Astaxanthin Regulates ROS-mediated Autophagy to Prolong Lifespan of Caenorhabditis elegans
-
摘要: 本文研究了虾青素(Astaxanthin,AST)延长秀丽隐杆线虫寿命及其相关分子机制。观察AST对野生型(WT)线虫的寿命的影响,qRT-PCR检测WT线虫抗氧化(sod-3、ctl-1)和自噬相关基因(bec-1、lgg-1)的相对表达量,DCFH-DA荧光探针检测AST对WT线虫体内ROS(Reactive oxygen species)水平的影响,Western Blot检测AST对DA2123线虫LGG-1::GFP荧光蛋白表达的影响,胡桃醌诱导氧化应激后,qRT-PCR检测WT线虫在氧化应激的条件下bec-1、lgg-1的mRNA表达水平,进一步检测氧化应激状态下AST对线虫寿命的作用。结果表明,AST可延长WT线虫的寿命,上调sod-3、ctl-1、bec-1、lgg-1基因的mRNA表达水平,清除线虫体内的过多ROS,氧化应激状态下上调自噬水平,并延长线虫寿命。因此本研究认为,AST可能通过调节线虫体内ROS水平进而调控自噬从而延长线虫寿命。Abstract: The present study was carried on assess the lifespan extension of Caenorhabditis elegans (C. elegans) by astaxanthin (AST) and its related molecular mechanisms. The effect of AST on the lifespan of wild-type (WT) nematodes was observed, the relative expression of antioxidant (sod-3, ctl-1) and autophagy-related genes (bec-1, lgg-1) in WT nematodes was detected by qRT-PCR, the effect of AST on ROS levels in WT nematodes was detected by DCFH-DA fluorescent probe, the effect of AST on LGG-1::GFP fluorescent protein expression in DA2123 nematodes was detected by Western blot, and after oxidative stress was induced by juglone, the mRNA expression levels of bec-1 and lgg-1 in WT nematodes under oxidative stress were detected by qRT-PCR, and the effect of AST on the lifespan of C. elegans under oxidative stress was further examined. The results showed that AST could prolong the lifespan of WT nematodes, up-regulate the mRNA expression levels of sod-3, ctl-1, bec-1, and lgg-1 genes, scavenge excessive ROS in nematodes, up-regulate autophagy levels and prolong nematode lifespan under oxidative stress. Therefore, AST might prolong nematode lifespan by regulating ROS levels in C. elegans and then regulating autophagy.
-
Keywords:
- astaxanthin (AST) /
- anti-aging /
- Caenorhabditis elegans /
- antioxidant activity /
- autophagy
-
衰老是一种自然的、不可避免的生命过程,以细胞衰老为基础,机体各组织器官、生理功能随年龄增长发生不可逆的退行性改变[1]。伴随衰老进程,自由基不断积累对细胞和组织造成氧化损伤[2],这也被许多研究证明是衰老的主要因素之一[3]。活性氧(ROS)属于自由基的一种,有研究发现ROS在信号转导,基因调节和氧化还原调节等生理方面至关重要,完全将其清除是有害的,保持一种适度的低剂量水平可促进自噬的形成[4]。自噬是一种分解代谢过程,通过吞噬细胞内受损的细胞器,改善细胞微循环,从而发挥其抗衰老作用[5]。自噬活性会随着年龄的增长而逐渐减弱[6],自噬缺乏会导致细胞中突变蛋白和错误折叠蛋白的积累,这是神经退行性疾病和其他衰老相关疾病出现和发展的基础[5]。
虾青素(astaxanthin,AST)属于类胡萝卜素,是一种超级抗氧化剂和自由基清除剂,AST具有共扼双键和α-羟基酮,使其容易捕获并中和自由基,淬灭单线态氧,清除自由基,在许多生物体中扮演强抗氧化剂的角色[7-8]。目前,有关AST延缓衰老的研究备受关注,Yazaki等[9]和Liu等[10]发现,AST可通过调节线虫IIS信号通路相关基因和氧化还原酶系统,维持细胞内ROS的最佳平衡,从而达到延缓衰老的作用。AST在心脏、肾脏、肝脏和肺中均能调控自噬从而调控细胞损伤[11]。本团队前期的研究也发现AST通过上调IIS通路的daf-16和TOR通路的hlh-30激活自噬从而延长线虫寿命[12]。而适宜水平的ROS能够调控自噬[13],但在AST延长寿命的效应中ROS和自噬是否存在相互作用还需进一步的研究。
秀丽隐杆线虫(Caenorhabditis elegans)简称线虫,是一种多细胞真核生物,个体结构简单、寿命较短、遗传背景清楚、繁殖速度快且易培养,在基因及信号通路上和人类比较保守,与人类有60%~80%的基因相似,是研究衰老的经典模型生物[14]。因此,本研究选取了线虫作为研究对象探讨AST延缓衰老的作用及其分子机制,以期为AST作为抗衰老药物或保健品开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
野生型线虫Bristol N2(wild type,WT)、线虫DA2123、GFP::LGG-1(adIs2122)、大肠杆菌Escherichia coli OP50(E.coli OP50) 美国明尼苏达大学的线虫中心(Caenorhabditis Genetics Center,CGC);谷草转苷酶(AST) 北京索莱宝科技有限公司;二甲基亚砜(DMSO)、胡桃醌 美国Sigma公司;五氟尿嘧啶(FUDR) 天津市风船化学试剂科技有限公司;兔抗GFP多克隆抗体 美国Abcam;山羊抗鼠二抗 中国博奥森生物技术有限公司。
生物培养箱 美国THERMO FISHER公司;SZX16体式显微镜 日本OLYMPUS公司;超净工作台(Esco Airstream) 新加坡ESCO公司;倒置荧光显微镜(IX81) 日本OLYMPUS公司;震荡培养箱 上海智诚分析仪器制造有限公司。
1.2 实验方法
1.2.1 秀丽隐杆线虫同期化
使用M9缓冲液将体内含有大量卵的成虫从NGM培养基上冲洗至离心管中。加入1 mL的M9缓冲液和1 mL的线虫裂解液(1 g NaOH,加入5 mL的NaClO2,95 mL超纯水),剧烈摇晃的同时在显微镜下实时观察,当看到虫体裂解而虫卵保存完好时停止振荡,1000 r/min离心2 min,除去上清,重复两次,即可得到虫卵。然后用M9缓冲液冲洗三次去除裂解液。虫卵在M9缓冲液中20 ℃恒温培养12 h。虫卵孵化以后,由于没有食物,幼虫发育将停滞在L1期。然后将幼虫加入NGM培养基中继续培养,待其长至L4期方可用于后续实验。
1.2.2 实验分组及干预方法
根据AST的浓度分为对照组(0 μmol/L)和AST干预组(120 μmol/L)。AST用DMSO溶液溶解配制成120 mmol/L的贮存液,细菌过滤器过滤除菌。将AST贮存液加入到含FuDR(终浓度为40 μmol/L,该浓度能够抑制线虫繁殖且不影响线虫生长发育和寿命[15])的NGM培养基中,使其终浓度为120 μmol/L。对照组只加入溶解相应浓度AST所需的等体积的DMSO,应确保所有NGM中DMSO的终浓度均要小于0.2%(v/v)[16]。为了防止E.coli OP50代谢AST改变其生物化学性质,本研究均使用高温灭活的E.coli OP50菌液涂至NGM表面,且E.coli OP50菌液中也需要使AST终浓度为0或120 μmol/L。
1.2.3 线虫寿命测定
转移50条同期化的L4期线虫到NGM培养基中,在20 °C恒温恒湿培养箱中培养,每2 d统计一次线虫的死亡、存活和剔除的数目(为了保证线虫食物充足,需要2 d更换一次NGM培养基)。线虫死亡判断标准:无移动及吞咽动作,轻触后仍无任何反应。剔除标准:逃离至平皿壁或盖上而干死;虫卵在体内孵化而成袋样虫;钻入琼脂中;生存期定义为:线虫从L4幼虫期(Age=0)至其被计数为死亡的时间,重复三次。
1.2.4 RNA提取和qRT-PCR
在AST干预WT线虫第6 d,用M9缓冲液收集约1000条线虫。采用Trizol法提取总RNA,UV吸光度(260/280比值)检查RNA纯度。随后采用SPARK script II RT Kit(思科捷,中国)将RNA逆转录为cDNA。qPCR检测相关基因的mRNA表达,用于qPCR的引物序列见表1。
表 1 自噬相关基因mRNA表达测定用引物Table 1. Primers for the determination of autophagy-related gene mRNA expression引物名称 引物序列 长度 act-1 5'-CCAGGAATTGCTGATCGTATGCAGAA-3'
5'- TGGAGAGGGAAGCGAGGATAGA -3'26
22sod-3 5′-CCAACCAGCGCTGAAATTCAATGG-3′
5′-GGAACCGAAGTCGCGCTTAATAGT-3′24
24ctl-1 5'-CGGATACCGTACTCGTGATGAT-3'
5'-CCAAACAGCCACCCAAATCA-3'22
20bec-1 5′- ACGAGCTTCATTCGCTGGAA -3′
5′- TTCGTGATGTTGTACGCCGA -3′20
20lgg-1 5′- GCCGAAGGAGACAAGATCCG -3′
5′- GGTCCTGGTAGAGTTGTCCC -3′20
20采用20 μL qPCR Master Mix(Promega)进行RT-PCR反应,每个样品3个重复。扩增反应在Roche公司的Lightcycler480 Ⅱ荧光定量PCR仪中完成。扩增条件为:95 ℃预变性5 min;95 ℃、10 s变性,60 ℃、30 s退火/延伸,共40个循环;溶解曲线:90 ℃ 5 s,60 ℃ 31 s。扩增结束后得到Ct值,采用Folds=2−∆∆Ct法计算相对基因表达量。
1.2.5 活性氧自由基ROS测定
ROS 测量根据 Schiavi等[17]方法进行。在AST干预WT线虫第6 d,将线虫转移至装有1 ml DCFH-DA荧光探针(100 μmol/L,溶于M9溶液中)的EP管中,20 ℃孵育30 min。随后将线虫转移至滴加NaN3溶液的琼脂糖垫上,用倒置荧光显微镜拍摄荧光图片(激发波长485 nm,发射波长530 nm),用Image J软件测量荧光强度值。每组随机挑选30条线虫,重复3次。
1.2.6 Western Blot
在AST干预DA2123线虫的第6 d用M9缓冲液收集虫体(每组约1000条线虫)。加入裂解液后使用超声仪匀浆提取蛋白,通过BCA蛋白检测试剂盒(Beyotime)测定蛋白浓度。通过SDS-PAGE分离等量蛋白,并转移到PVDF膜,5% BSA室温封闭1 h。再加入GFP抗体(1:1000;Abcam)和β-actin抗体(1:1000;CST)4℃封闭过夜。TBST清洗后加相应二抗室温孵育1 h,TBST清洗后加化学发光显色底物试剂显色,并使用ChemiDocTM XRS+成像系统(Bio-Rad,Hercules,CA)进行观察,Image J 2.0软件进行定量分析。
1.2.7 胡桃醌氧化应激实验
AST干预WT线虫至第6 d,将不同组别培养基上的线虫转移到含终浓度为240 μmol/L胡桃醌的NGM培养基中,每组3板,每板50条。每天记录线虫的死亡情况,死亡判定标准同寿命测定实验相同,直至线虫全部死亡。实验重复3次。
1.3 数据处理
采用Kaplan-Meier生存分析绘制生存曲线,采用Log-rank分析进行显著性差异检验。两组间采用t检验进行统计学分析,三组或多组之间的比较采用单因素方差分析(ANOVA),采用SNK-q检验进行各组间的两两比较。平均寿命表示为Mean±SEM,其他数据表示为Mean±SD,P<0.05为差异有统计学意义。数据录入使用Excel,所有统计分析均采用SPSS 20.0软件,使用Prism 7绘图。
2. 结果与分析
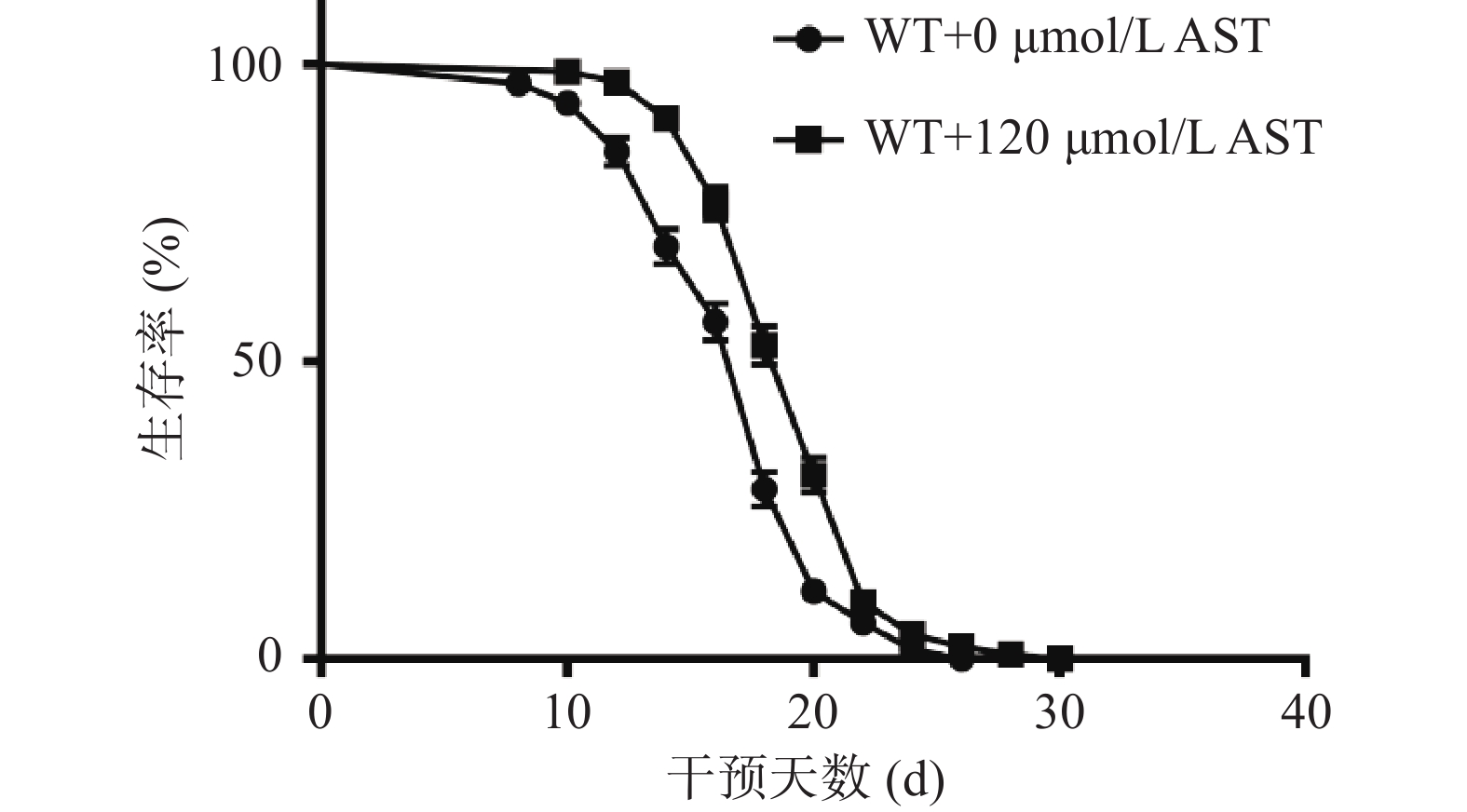
2.1 AST对WT线虫寿命的影响
AST干预后WT线虫的寿命变化结果见图1与表2。与对照组0 μmol/L AST相比,AST干预后线虫的生存曲线右移(图1),其平均寿命显著(P<0.05)延长(表2),表明AST干预能够延长WT线虫的寿命。
表 2 各组线虫寿命的统计分析Table 2. Statistical analysis of nematode longevity in each group品系/分组 数量 平均寿命(d) WT+0 μmol/L AST 225 16.99±0.24 WT+120 μmol/L AST 217 19.26±0.22* 注:*表示与WT+0 μmol/L AST相比,P<0.05。 2.2 AST对WT线虫抗氧化和自噬相关基因表达的影响
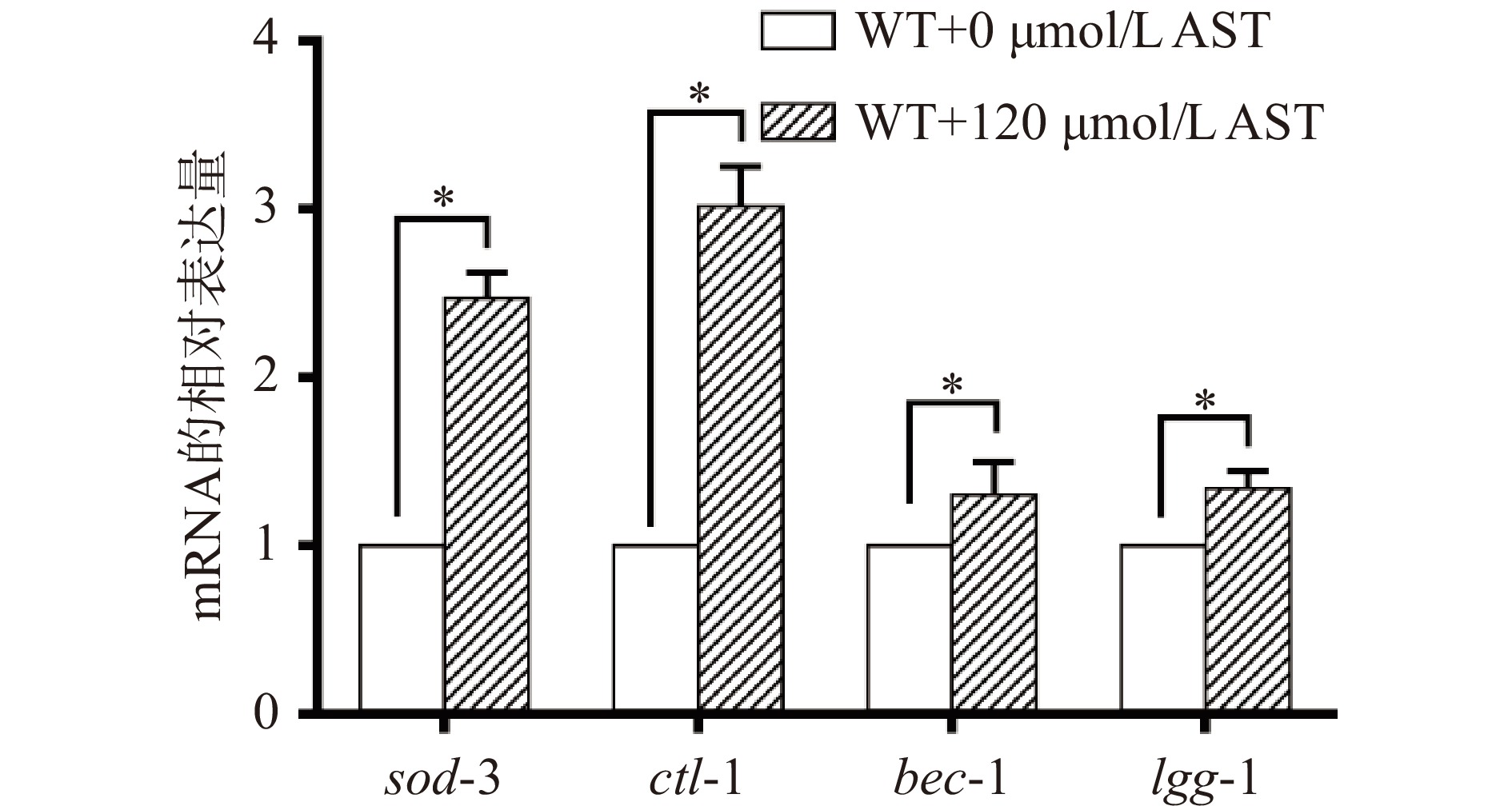
为了探讨AST延长线虫寿命的效应是否与抗氧化和上调自噬有关,在AST干预的第6 d采用qRT-PCR检测WT线虫抗氧化相关基因sod-3和ctl-1和自噬相关基因bec-1和lgg-1的mRNA表达水平。结果显示,与对照组相比,AST干预组sod-3 mRNA、ctl-1 mRNA、bec-1 mRNA和lgg-1 mRNA水平显著(P<0.05)升高(图2)。结果表明,AST可能通过上调sod-3和ctl-1的表达提高线虫的抗氧化能力,上调bec-1和lgg-1的表达提高线虫体内的自噬水平,从而达到延长寿命的作用。
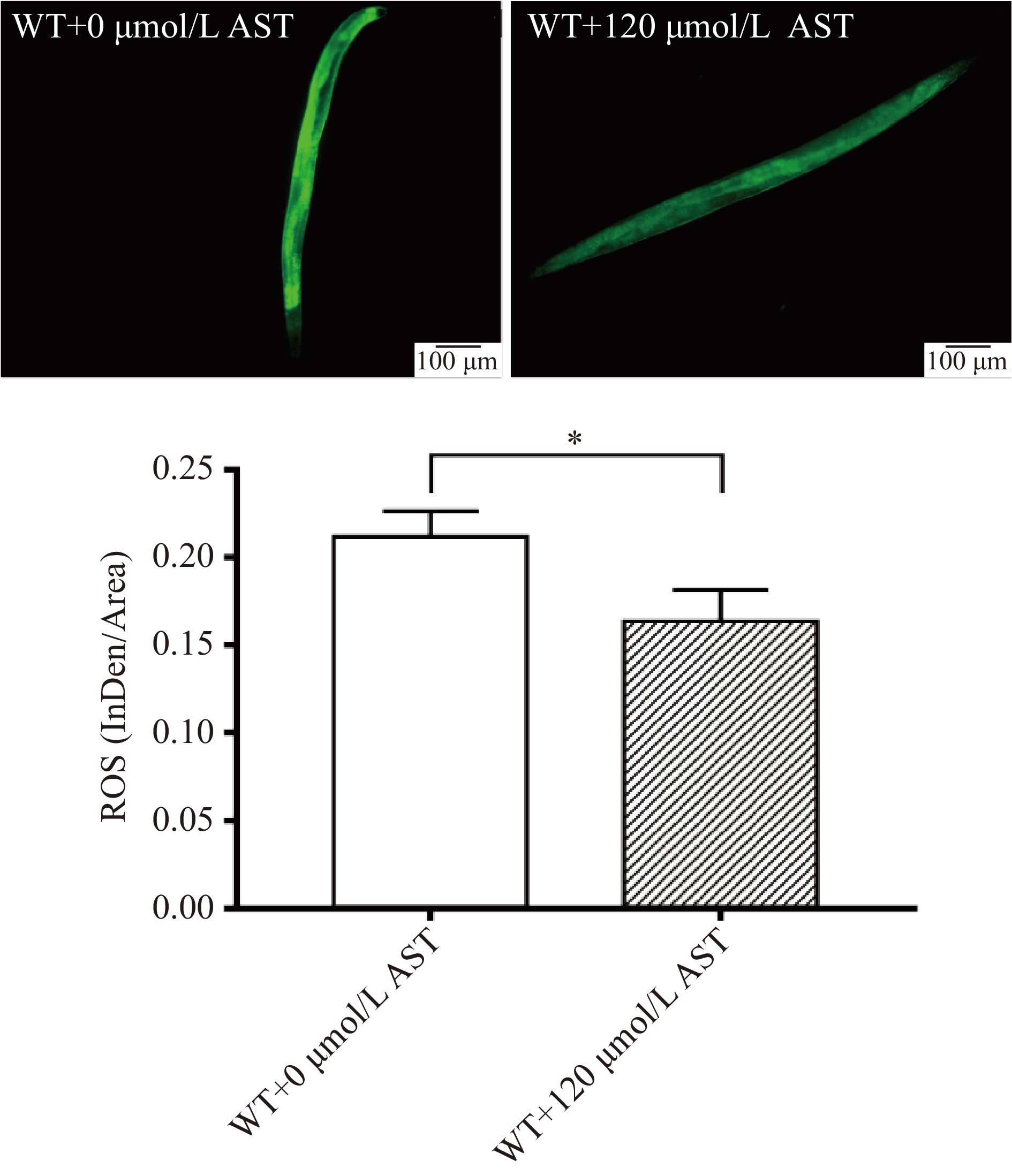
2.3 AST对WT线虫体内的ROS的影响
ROS具有强氧化性,过多的ROS堆积在细胞中会对DNA、脂质、蛋白质等造成损伤,是引起衰老的重要因素之一[18]。通过检测AST对ROS的影响从而进一步评估其抗衰老的效果。在AST干预的第6 d,荧光探针检测线虫体内的ROS水平。如图3所示,与对照组相比,AST干预组线虫体内的ROS荧光强度显著降低(P<0.05)。实验结果说明,AST通过清除线虫体内过多的ROS,改善氧化损伤状态,从而延长线虫寿命。
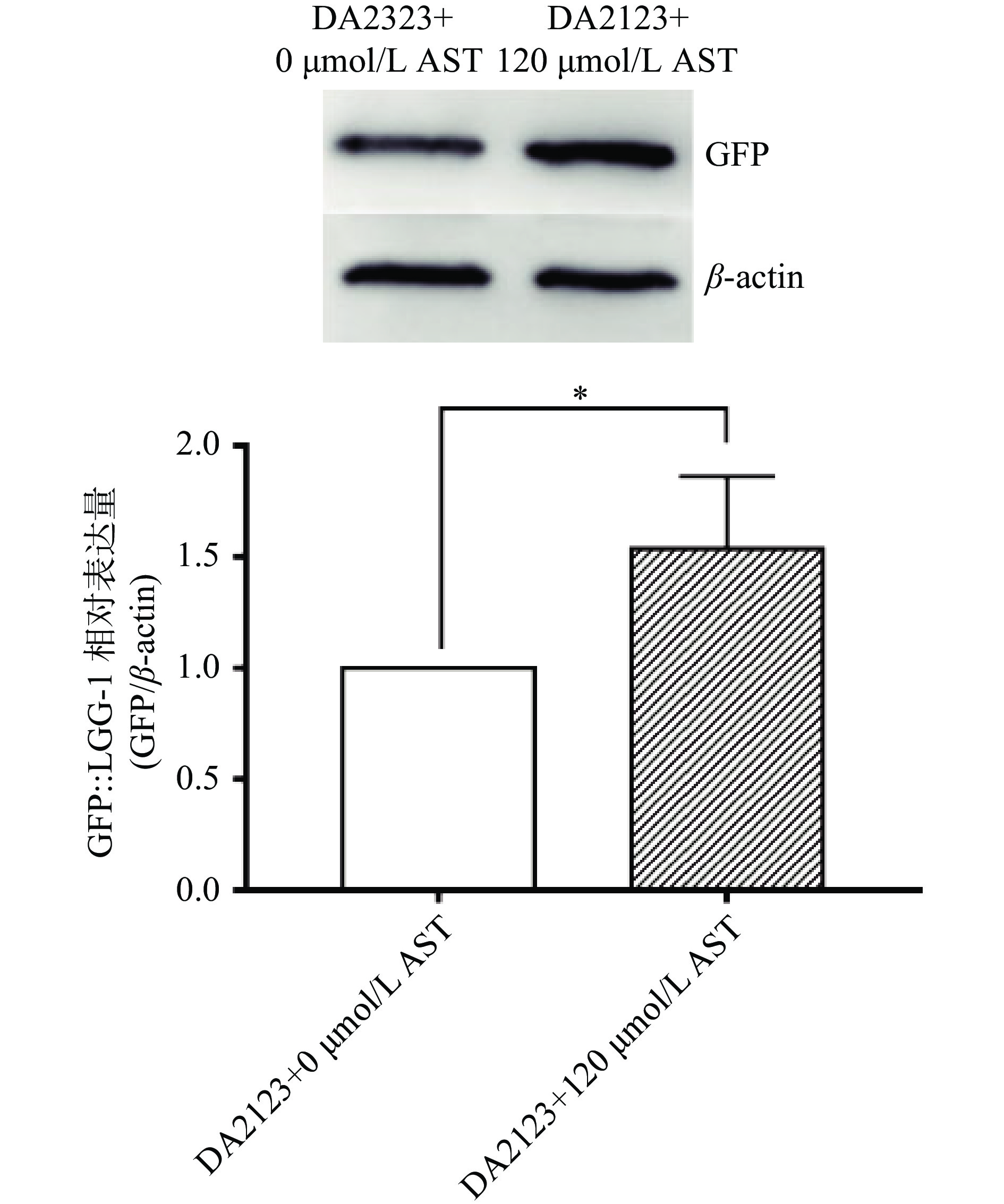
2.4 AST对DA2123线虫自噬基因lgg-1的影响
AST在心脏、肾脏、肝脏和肺中均能调控自噬从而调控细胞损伤[11]。DA2123线虫品系的自噬基因lgg-1标记有绿色荧光蛋白GFP,通过检测GFP的表达量即可反映线虫的自噬水平。在AST干预的第6 d,通过Western Blot检测DA2123线虫品系中GFP::LGG-1荧光蛋白的表达量。结果如图4,与对照组相比,AST干预组GFP::LGG-1表达显著上升(P<0.05),该结果与PCR结果一致,验证了AST干预能够上调线虫的自噬水平。
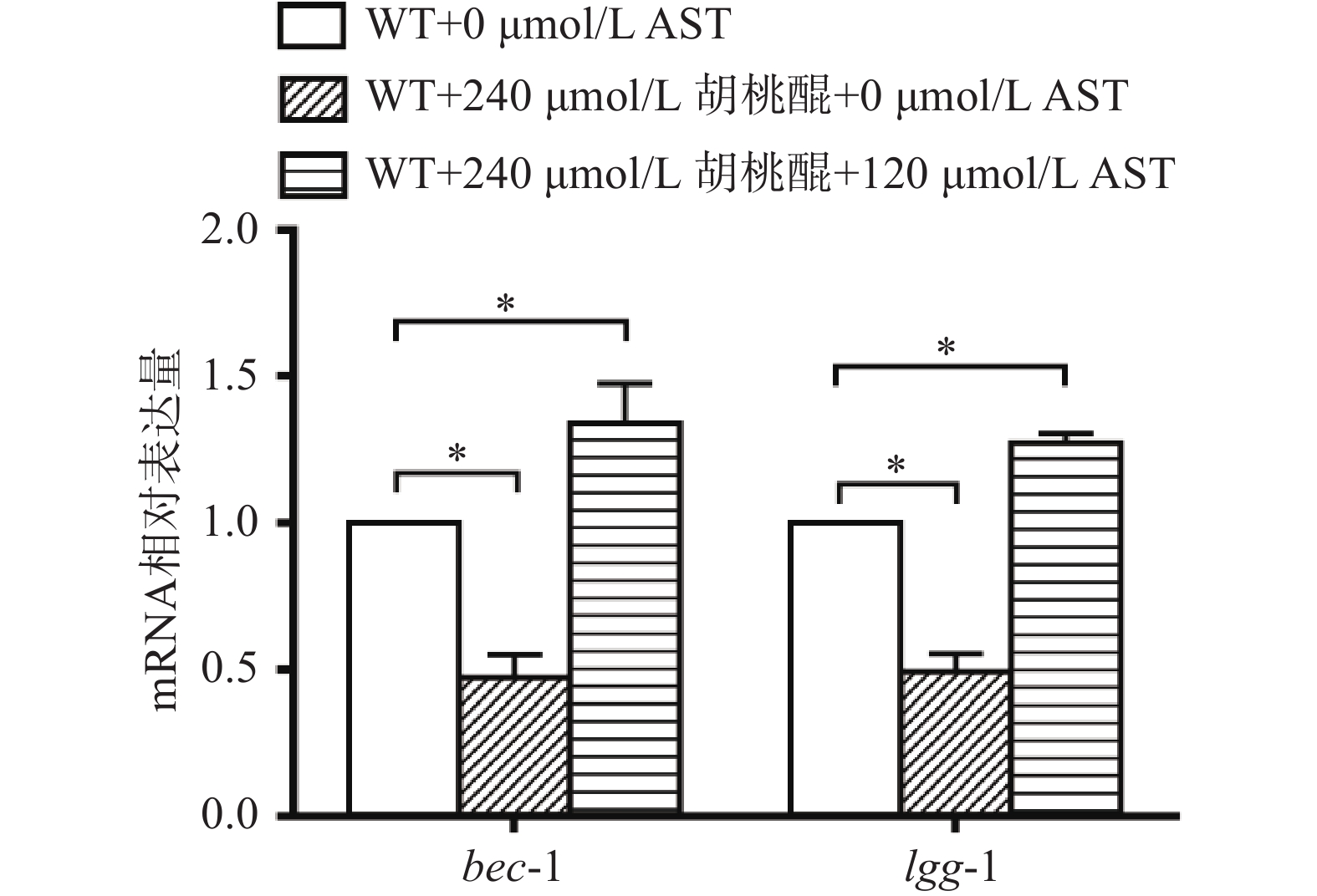
2.5 氧化应激条件下AST对WT线虫自噬水平的影响
研究表明,氧化应激产生的ROS在适宜的水平时可激活自噬[2]。胡桃醌可以在机体内氧化形成半醌自由基,半醌自由基拥有极强的氧化能力,可以迅速将氧分子氧化为超阴离子自由基,再生为胡桃醌,如此往复循环,形成体内氧化应激环境,导致线虫体内ROS增加[19]。本研究采用胡桃醌诱导线虫的氧化应激状态。在干预的第6 d采用qRT-PCR检测WT线虫自噬相关基因bec-1和lgg-1的mRNA表达量。结果如图5所示,与WT+0 μmol/L AST干预组相比,WT+240 μmol/L胡桃醌+0 μmol/L AST干预组bec-1和lgg-1的mRNA表达量均显著降低(P<0.05),WT+240 μmol/L胡桃醌+120 μmol/L AST组bec-1和lgg-1的mRNA表达量均显著升高(P<0.05)。由该结果可以推测,胡桃醌导致线虫体内大量的ROS堆积,大量的ROS抑制线虫自噬。而AST干预能够缓解线虫氧化应激状态(图5),降低ROS水平,适宜水平的ROS激活了线虫自噬。
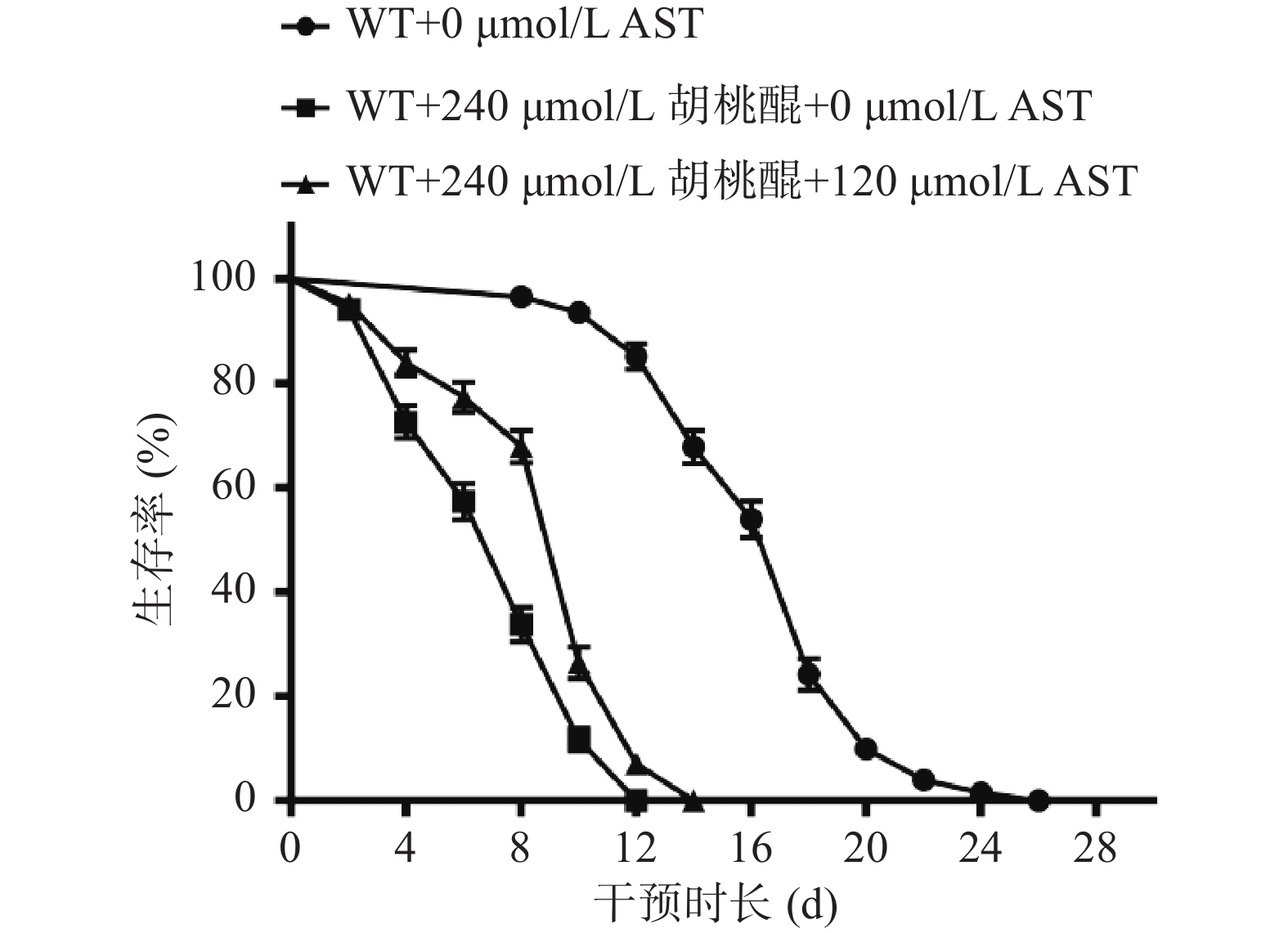
2.6 氧化应激条件下AST对WT线虫线虫寿命的影响
本研究进一步探讨了在氧化应激环境下AST对线虫寿命的影响,结果显示(图6和表3),与WT+0 μmol/L AST组相比,加入240 μmol/L胡桃醌后WT线虫的寿命缩短,差异具有统计学意义(P<0.05),在氧化应激的条件下加入120 μmol/L AST后,线虫的寿命有所延长,差异具有统计学意义(P<0.05)。表明AST对胡桃醌导致的氧化损伤具有保护作用。
表 3 各组线虫寿命的统计分析Table 3. Statistical analysis of nematode longevity in each group品系/分组 数量 平均寿命(d) WT+0 μmol/L AST 202 16.73±0.26 WT+240 μmol/L胡桃醌+0 μmol/L AST 204 7.39±0.21* WT+240 μmol/L胡桃醌+120 μmol/L AST 212 9.16±0.22# 注:*表示,与WT+0 μmol/L AST相比,P<0.05;#表示,与WT+240 μmol/L
胡桃醌+0 μmol/L AST相比,P<0.05。3. 讨论与结论
根据衰老的自由基理论,衰老的原因是由于细胞呼吸过程中产生过量的ROS堆积在细胞内,导致机体处于氧化应激状态[20]。目前关于AST的抗衰老作用多关注于其抗氧化作用[9-10,21-25],AST通过调节IIS信号通路相关基因维持细胞内ROS的最佳平衡,从而达到延缓衰老的作用。在本研究的结果也证实了表明AST通过上调抗氧化基因sod-3和ctl-1的表达水平,激活体内抗氧化酶,以抵御机体的氧化损伤。
本研究进一步探讨了ROS与自噬在AST抗衰老作用中的相互关系。ROS在信号转导、基因调节和氧化还原调节等生理方面至关重要,例如,氧化应激状态产生的ROS能够激活自噬[4,26]。反过来,自噬可能通过吞噬和降解氧化物质来减少氧化损伤响[26-27]。许多研究都表明了适当的增强自噬水平可以延缓衰老[28-30]。在线虫中与自噬相关的基因为lgg-1和bec-1。Lgg-1是酵母自噬相关基因8的同源基因(atg-8),在哺乳动物中的同源基因为LC3,位于自噬前体和自噬体的膜表面,参与自噬体的形成,是自噬的重要标志[31]。Bec-1是酵母自噬相关基因(atg-6)的同源基因,在哺乳动物中的同源基因为beclin-1,标志着自噬的开始[32]。结果2.5表明,采用240 μmol/L胡桃醌诱导线虫氧化应激时,自噬基因bec-1和lgg-1相对表达量显著减少(P<0.05),当加入具有强抗氧化作用的AST后,自噬基因bec-1和lgg-1相对表达量显著增加(P<0.05,图5)。因此,本研究推测强抗氧化剂AST能使线虫体内的ROS维持适宜的水平,进而诱导自噬水平上升,达到其延缓线虫衰老和延长寿命的作用。相反,上调的自噬通过吞噬和降解氧化物质来减少氧化损伤,清除细胞内堆积的ROS。但是本研究没有进一步探讨自噬水平的改变是否会影响ROS,后续有待进一步探讨AST抗衰老效应中ROS与自噬的相互作用。
本研究以秀丽隐杆线虫为模型,表明AST通过清除线虫体内过多的ROS堆积,上调其自噬水平,从而延长线虫的寿命,且AST可能通过调节线虫体内ROS水平进而调控自噬,研究为抗衰老保健品的开发奠定基础。
-
表 1 自噬相关基因mRNA表达测定用引物
Table 1 Primers for the determination of autophagy-related gene mRNA expression
引物名称 引物序列 长度 act-1 5'-CCAGGAATTGCTGATCGTATGCAGAA-3'
5'- TGGAGAGGGAAGCGAGGATAGA -3'26
22sod-3 5′-CCAACCAGCGCTGAAATTCAATGG-3′
5′-GGAACCGAAGTCGCGCTTAATAGT-3′24
24ctl-1 5'-CGGATACCGTACTCGTGATGAT-3'
5'-CCAAACAGCCACCCAAATCA-3'22
20bec-1 5′- ACGAGCTTCATTCGCTGGAA -3′
5′- TTCGTGATGTTGTACGCCGA -3′20
20lgg-1 5′- GCCGAAGGAGACAAGATCCG -3′
5′- GGTCCTGGTAGAGTTGTCCC -3′20
20表 2 各组线虫寿命的统计分析
Table 2 Statistical analysis of nematode longevity in each group
品系/分组 数量 平均寿命(d) WT+0 μmol/L AST 225 16.99±0.24 WT+120 μmol/L AST 217 19.26±0.22* 注:*表示与WT+0 μmol/L AST相比,P<0.05。 表 3 各组线虫寿命的统计分析
Table 3 Statistical analysis of nematode longevity in each group
品系/分组 数量 平均寿命(d) WT+0 μmol/L AST 202 16.73±0.26 WT+240 μmol/L胡桃醌+0 μmol/L AST 204 7.39±0.21* WT+240 μmol/L胡桃醌+120 μmol/L AST 212 9.16±0.22# 注:*表示,与WT+0 μmol/L AST相比,P<0.05;#表示,与WT+240 μmol/L
胡桃醌+0 μmol/L AST相比,P<0.05。 -
[1] KIM D K, KIM T H, Lee S J. Mechanisms of aging-related proteinopathies in Caenorhabditis elegans[J]. Experimental & Molecular medicine,2016,48(10):e263.
[2] SCHERZ-SHOUVAL R, ELAZAR Z. Regulation of autophagy by ROS: physiology and pathology[J]. Trends in Biochemical sciences,2011,36(1):30−38. doi: 10.1016/j.tibs.2010.07.007
[3] BETTIO L E B, RAJENDRAN L, GIL-MOHAPEL J. The effects of aging in the hippocampus and cognitive decline[J]. Neuroscience and Biobehavioral Reviews,2017,79:66−86. doi: 10.1016/j.neubiorev.2017.04.030
[4] LI L, TAN J, MIAO Y, et al. ROS and autophagy: Interactions and molecular regulatory mechanisms[J]. Cellular and Molecular Neurobiology,2015,35(5):615−621. doi: 10.1007/s10571-015-0166-x
[5] WONG S Q, KUMAR A V, MILLS J, et al. Autophagy in aging and longevity[J]. Human Genetics,2020,139(3):277−290. doi: 10.1007/s00439-019-02031-7
[6] LIPINSKI M M, ZHENG B, LU T, et al. Genome-wide analysis reveals mechanisms modulating autophagy in normal brain aging and in Alzheimer’s disease[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(32):14164−9. doi: 10.1073/pnas.1009485107
[7] NI Y, WU T, YANG L, et al. Protective effects of astaxanthin on a combination of D-galactose and jet lag-induced aging model in mice[J]. Endocrine Journal,2018,65(5):569−578. doi: 10.1507/endocrj.EJ17-0500
[8] SAINI R K, KEUM Y S. Progress in microbial carotenoids production[J]. Indian journal of Microbiology,2017,57(1):129−130. doi: 10.1007/s12088-016-0637-x
[9] YAZAKI K, YOSHIKOSHI C, OSHIRO S, et al. Supplemental cellular protection by a carotenoid extends lifespan via Ins/IGF-1 signaling in Caenorhabditis elegans[J]. Oxidative Medicine and Cellular longevity,2011,2011:596240.
[10] LIU X, LUO Q, CAO Y, et al. Mechanism of different stereoisomeric astaxanthin in resistance to oxidative stress in Caenorhabditis elegans[J]. Journal of Food Science,2016,81(9):H2280−H2287. doi: 10.1111/1750-3841.13417
[11] KIM S H, KIM H. Astaxanthin modulation of signaling pathways that regulate autophagy[J]. Marine drugs,2019,17(10):546. doi: 10.3390/md17100546
[12] FU M, ZHANG X, ZHANG X, et al. Autophagy plays a role in the prolongation of the life span of Caenorhabditis elegans by astaxanthin[J]. Rejuvenation Research,2021,24(3):198−205. doi: 10.1089/rej.2020.2355
[13] LUO Z, XU X, SHO T, et al. ROS-induced autophagy regulates porcine trophectoderm cell apoptosis, proliferation, and differentiation[J]. American Journal of Physiology Cell Physiology,2019,316(2):C198−c209. doi: 10.1152/ajpcell.00256.2018
[14] KOBET R A, PAN X, ZHANG B, et al. Caenorhabditis elegans: A model system for anti-cancer drug discovery and therapeutic target identification[J]. Biomolecules & Therapeutics,2014,22(5):371−383.
[15] GRUBER J, TANG S Y, HALLIWELL B. Evidence for a trade-off between survival and fitness caused by resveratrol treatment of Caenorhabditis elegans[J]. Annals of the New York Academy of Sciences,2007,1100(1):530−542. doi: 10.1196/annals.1395.059
[16] WANG Z W, SAIFEE O, NONET M L, et al. SLO-1 potassium channels control quantal content of neurotransmitter release at the C. elegans neuromuscular junction[J]. Neuron,2001,32(5):867−881. doi: 10.1016/S0896-6273(01)00522-0
[17] SCHIAVI A, TORGOVNICK A, KELL A, et al. Autophagy induction extends lifespan and reduces lipid content in response to frataxin silencing in C. elegans[J]. Experimental Gerontology,2013,48(2):191−201. doi: 10.1016/j.exger.2012.12.002
[18] LABUSCHAGNE C F, BRENKMAN A B. Current methods in quantifying ROS and oxidative damage in Caenorhabditis elegans and other model organism of aging[J]. Ageing Research Reviews,2013,12(4):918−930. doi: 10.1016/j.arr.2013.09.003
[19] DE CASTRO E, HEGI DE CASTRO S, JOHNSON T E. Isolation of long-lived mutants in Caenorhabditis elegans using selection for resistance to juglone[J]. Free radical Biology & Medicine,2004,37(2):139−145.
[20] 王慧, 赵江, 杨胜楠, 等. D-手性肌醇对高糖导致氧化损伤线虫延缓衰老的作用及机制[J]. 食品工业科技,2019,40(2):282−286. [WANG Hui, ZHAO Jiang, YANG Shengnan, et al. Effect and mechanism of D-chiral inositol on delaying aging of nematodes with oxidative damage induced by high glucose[J]. Food Industry Technology,2019,40(2):282−286. [21] 罗卿心, 刘晓娟, 曹庸, 等. 虾青素对秀丽隐杆线虫衰老的影响及其机制的初步研究[J]. 现代食品科技,2015,31(9):56−60. [LUO Qixin, LIU Xiaojuan, CAO Yong, et al. Effect of astaxanthin on senescence of caenorhabditis elegans and its mechanism[J]. Modern Food Technology,2015,31(9):56−60. [22] 罗婧, 沈紫龙, 任建武. 虾青素对秀丽隐杆线虫衰老的改善作用及机制研究[J]. 食品工业科技,2017,38(22):22−25, 30. [ LUO JING, SHEN ZILONG, REN JIANWU. Study on the effect and mechanism of astaxanthin on the aging of Caenorhabditis elegans[J]. Food Industry Science and Technology,2017,38(22):22−25, 30. [23] WU W, WANG X, XIANG Q, et al. Astaxanthin alleviates brain aging in rats by attenuating oxidative stress and increasing BDNF levels[J]. Food & Function,2014,5(1):158−166.
[24] SORRENTI V, DAVINELLI S, SCAPAGNINI G, et al. Astaxanthin as a putative geroprotector: molecular basis and focus on brain aging [J]. Marine Drugs, 2020, 18(7).
[25] EL-BAZ F K, HUSSEIN R A, ABDEL JALEEL G A R, et al. Astaxanthin-rich haematococcus pluvialis algal hepatic modulation in D-galactose-induced aging in rats: Role of Nrf2[J]. Advanced Pharmaceutical Bulletin,2018,8(3):523−528. doi: 10.15171/apb.2018.061
[26] 廖忻, 陈文莹, 李逸舟, 等. 齐墩果酸拮抗赭曲霉毒素A诱导的HEK293T细胞自噬性死亡[J]. 食品工业科技,2019,40(3):286−289, 295. [LIAO XIN, CHEN WENYING, LI YIZHOU, et al. Oleanolic acid antagonizes ochratoxin A-induced autophagic death of HEK293T cells[J]. Food Industry Technology,2019,40(3):286−289, 295. [27] LAPIERRE L R, DE MAGALHAES FILHO C D, MCQUARY P R, et al. The TFEB orthologue HLH-30 regulates autophagy and modulates longevity in Caenorhabditis elegans[J]. Nature Communications,2013,4:2267. doi: 10.1038/ncomms3267
[28] LAPIERRE L R, KUMSTA C, SANDRI M, et al. Transcriptional and epigenetic regulation of autophagy in aging[J]. Autophagy,2015,11(6):867−880. doi: 10.1080/15548627.2015.1034410
[29] REN J, ZHANG Y. Targeting autophagy in aging and aging-related cardiovascular diseases[J]. Trends in Pharmacological Sciences,2018,39(12):1064−1076. doi: 10.1016/j.tips.2018.10.005
[30] MIZUSHIMA N, LEVINE B. Autophagy in human diseases[J]. The New England Journal of Medicine,2020,383(16):1564−1576. doi: 10.1056/NEJMra2022774
[31] RAVIKUMAR B, SARKAR S, DAVIES J E, et al. Regulation of mammalian autophagy in physiology and pathophysiology[J]. Physiological Reviews,2010,90(4):1383−1435. doi: 10.1152/physrev.00030.2009
[32] CAO Y, KLIONSKY D J. Physiological functions of Atg6/Beclin 1: a unique autophagy-related protein[J]. Cell Research,2007,17(10):839−849. doi: 10.1038/cr.2007.78
-
期刊类型引用(3)
1. 庄燕苹,杨帆,肖曼,田小雨,陈怡,龙紫宇,陈柏岑,倪雅丽,宫爱民,谢毅强. 忧遁草乙醇提取物对秀丽隐杆线虫的抗衰老作用及机制. 食品工业科技. 2023(11): 411-417 .  本站查看
本站查看
2. 张慧康,马佳波,司奇,王珍珍,沙如意,戴静,毛建卫. 基于线虫模型的木姜叶柯抗氧化应激及抗衰老作用. 食品工业科技. 2023(12): 363-370 .  本站查看
本站查看
3. 黄少杰,陈宏著,钟淳菲,朱思阳,黎攀,杜冰. 铁皮石斛叶多糖对秀丽隐杆线虫体内抗衰老作用. 食品科学. 2022(21): 203-208 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



