Influence of Different Storage Conditions on Quality of Germinated Parboiled Rice
-
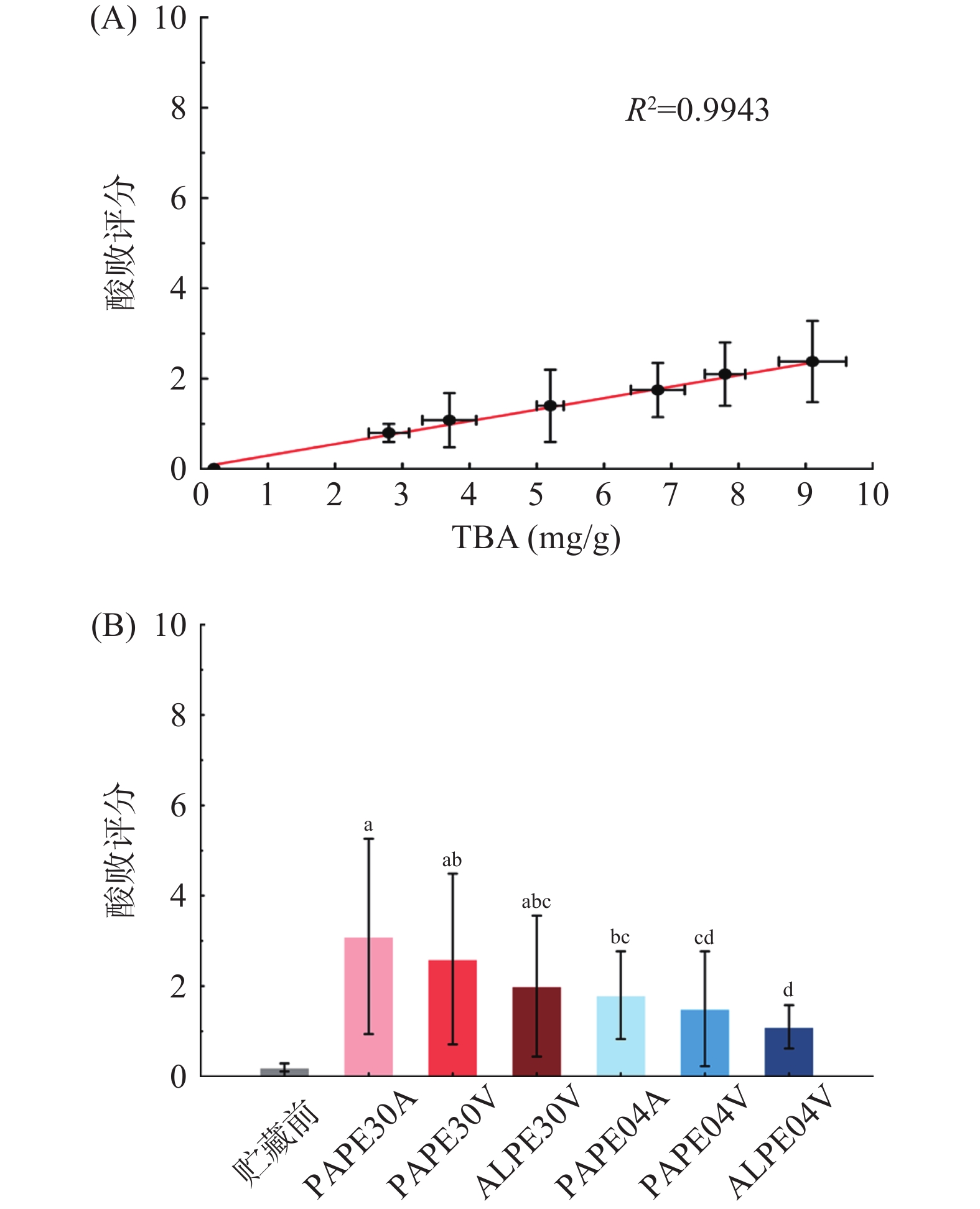
摘要: 为探究不同贮藏条件(包装材料、氧气含量和温度)对发芽蒸谷米的理化性质、生物活性物质、抗氧化活性、微生物学特性的影响,将发芽蒸谷米在真空和常压状态下分别包装在铝层压聚乙烯(aluminum-laminated-polyethylene, ALPE)和聚酰胺-聚乙烯(polyamide-polyethylene, PAPE)包装袋中,并分别在4 ℃和30 ℃下贮存6个月。结果表明,使用ALPE材料真空包装,在较低温度下可有效抑制生物活性物质的降解,延缓理化性质的变化,防止酸败,总酚含量和抗氧化活性也得到了充分保留。水分含量和水分活度在30 ℃下储存在PAPE中时会持续降低,而在30 ℃和4 ℃条件下储存在ALPE中时两者均保持不变。在30 ℃时γ-氨基丁酸和总花色苷含量会随着贮藏时间的增加而降低,但在4 ℃下其含量不随贮藏时间变化。在真空且低温的条件下,样品的总酚含量和抗氧化活性能够更有效地保留。基于硫代巴比妥酸法测定的发芽蒸谷米的酸败程度会随贮藏时间的延长而增加,此检测结果与感官评价结果呈高度相关(R2=0.9943)。在所有实验条件下,发芽蒸谷米的微生物含量均未超出国家相关标准的限量值,表明本研究过程中待测样品的微生物指标符合要求并可放心食用。Abstract: In order to explore the effects of different storage conditions (packaging materials, oxygen content and temperature) on the physical and chemical properties, biologically active substances, antioxidant activity, and microbiological properties of germinated parboiled rice, the germinated parboiled rice was put under vacuum and normal pressure, packed in aluminum-laminated-polyethylene (ALPE) and polyamide-polyethylene (PAPE) pouches and stored at 4 ℃ and 30 ℃ for 6 months. The results showed that packaging at lower temperatures under vacuum in ALPE was effective in retarding the degradation of bioactive compounds, changes in physicochemical quality, and rancidity. Moisture content and water activity continuously declined during the storage in PAPE pouches at 30 ℃ while they were unchanged when stored in ALPE at 30 ℃ and under all conditions at 4 ℃. γ-aminobutyrate and total colorosin content decreased at 30 ℃, but did not change with storage time at 4 ℃. Total phenolic content and antioxidant activities were also effectively retained under low temperature storage, especially in vacuum packaging. Rancidity of germinated parboiled rice determined using the thiobarbituric acid test, increased with storage time and showed a high correlation with sensory evaluation results (R2=0.9943). Under all test conditions, the microbial content of the germinated parboiled rice did not exceed the limit value of the relevant national standards, indicating that the microbiological indicators of the sample to be tested in the process of this research met the requirements and could be eaten with confidence.
-
Keywords:
- germinated parboiled rice /
- packaging materials /
- oxygen /
- temperature /
- quality characteristics
-
发芽蒸谷米(germinated parboiled rice,GPR)是稻米经发芽、蒸煮和干燥等处理后生产的大米制品。发芽蒸谷米由于其营养价值高于普通白米和糙米而广受欢迎[1]。发芽蒸谷米是集发芽糙米与蒸谷米的优点于一体的新型大米类制品,既提高了样品中总酚含量和抗氧化活性,还合成了大量的γ-氨基丁酸(gamma-aminobutyric acid,GABA)。GABA具有多种生理功能,如降低血压、抑制癌细胞、加速大脑的新陈代谢等[2-3]。发芽蒸谷米会使稻米的内源酶被激活、淀粉糊化和酶失活,使其营养组成和感官品质都得以改善,并可通过控制其含水量延长样品的保质期[4-5]。
黑稻米是一种富含花色苷、β-胡萝卜素和多酚类等生物活性物质的有色稻米,属于水稻中的特殊品种。大量研究表明,如花色苷等生物活性物质有助于改善血脂水平、抗炎、降低氧化应激和预防糖尿病等[6-7]。黑稻米中花色苷的含量和抗氧化活性普遍高于白色稻米。目前,以黑稻米为原料制备的发芽蒸谷米的研究并未有相关报道。而以普通稻米制备的商业化GPR保质期很短(一般在3个月左右),这主要是由于包装中的含氧量影响脂质水解和氧化反应,从而导致产品的酸败加剧。已报道的针对蒸谷米储藏温度的研究也只是基于(30±2)℃进行,并无低温贮藏的相关研究[8]。因此,本研究首次基于不同贮藏条件(包装材料、氧气和贮藏温度)对储藏6个月期间内GPR的品质和生物活性化合物的含量进行研究与分析。能够对未来发芽蒸谷黑米的商业化生产、贮藏条件的选择以及保质期的延长提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
供试黑稻米品种(绥098038;2019年产;黑龙江绥化) 黑龙江省农业科学院提供;γ-氨基丁酸、硼酸盐缓冲液、2-羟基-1-萘甲醛、2,2-二苯基-1-吡啶并肼基(≥98%) 西格玛奥德里奇(上海)贸易有限公司;实验所需化学试剂为色谱级(其中,酸类试剂为电子(MOS)级) 天津市科密欧化学试剂有限公司;R-Biopharm黄曲霉毒素总量酶联免疫检测试剂盒 德国拜发公司;铝层压聚乙烯(aluminum-laminated polyethylene,ALPE)、聚酰胺-聚乙烯(polyamide-polyethylene,PAPE) 诚德科技股份有限公司。
GL-21M高速冷冻离心机 上海市离心机机械研究厂;Daogrs S8xs型电蒸箱 意大利联合电器集团公司;DGG-9203A型电热恒温鼓风干燥箱 上海森信实验设备有限公司;WJ-HW-80L小型精密实验室烘箱恒温鼓风烘干机 杭州五佳机械设备有限公司;FC-2K小型砻谷机 日本YAMAMOTO有限公司;Multivac C-400真空包装机 莫迪维克(上海)贸易有限公司;STRIKE 300旋转蒸发仪 优莱博技术(北京)有限公司;A2-SET-HP通风湿度计 罗卓尼克(广州)有限公司;Millipore-Q密理博超纯水仪 美国密理博(中国)有限公司;Synergi 4μm Hydro-RP 80 A色谱柱(150 mm×4.6 mm) 美国Phenomenex有限公司;Evolution 350紫外可见分光光度计 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 发芽蒸谷米的制备
以黑稻米为原材料,其含水率(w.b.)约为11%。然后将其保持在(23±1)℃,相对湿度(RH)为(52%±2%)的条件下备用。制备发芽蒸谷米时,将黑稻米(500 g)放置于35 ℃的水(1.5 L)中浸泡24 h,洗涤、沥干后在35 ℃的气候室(RH为90%)中孵育16 h[9]。发芽后,可观察到一个小胚根,长约0.5~1 mm。将发芽的黑稻米在电蒸箱中蒸煮30 min,最后用烘干机在50 ℃,含湿量为25 g/kg干空气,风速为1.0 m/s的条件下烘干3 h,最终获得水分含量为12%~14%的GPR。
1.2.2 发芽蒸谷米的贮藏
将100 g GPR样品放置在由两种材料制成的15 cm×18 cm包装袋中:铝层压聚乙烯(ALPE):厚度为117 μm,水蒸气渗透性为6.45×10−8 kg/(m2·d·Pa),氧气透过率为0.0215 L/(m2·d);聚酰胺-聚乙烯(PAPE):厚度为90 μm,水蒸气渗透性为2.25×10−7 kg/(m2·d·Pa),氧气透过率为0.12 L/(m2·d)。将样品袋在大气压(≈ 900 mbar)和低压(下文统称真空(60 mbar))条件下用Multivac C-400真空包装机进行热封。然后,将包装样品分别放置在冰箱(温度(4±2)℃,RH为(55%±5%))和贮藏室(温度(30±2)℃,RH为(35%±5%))。贮藏室模拟目前的非冷藏储存,由于近些年全球气温普遍升高,多数情况下的常温贮存达不到理想状态的20~25 ℃,最终确定以30 ℃为本研究的贮藏温度[10]。表1中列出了基于现有文献资料[8-10]及相关预实验所确定的待测实验样品编码及其涉及到的多因素实验条件的组合情况,每月从不同贮藏条件分别随机抽取3份样品进行品质分析(n=3),贮藏期为6个月。
表 1 实验因素组合及样品编码Table 1. Combination of experimental factors and the sample code样品编码 包装材料 温湿度 气压(氧气含量) ALPE PAPE T=4 ℃; RH=55% T=30 ℃; RH=35% 大气压(A, 900 mbar) 真空(V, 60 mbar) PAPE 30A √ √ √ PAPE 30V √ √ √ ALPE 30V √ √ √ PAPE 04A √ √ √ PAPE 04V √ √ √ ALPE 04V √ √ √ 1.2.3 水分含量和活度的测定
水分含量(moisture content,MC)采用直接干燥法进行测定[11]。在密闭、恒温的水分活度仪测量舱内,试样中水分扩散平衡,此时水分活度仪测量舱内的传感器或数字化探头显示出的响应值(相对湿度对应的数值)即为样品的水分活度(water activity,Aw)[12]。
1.2.4 生物活性物质的测定
1.2.4.1 γ-氨基丁酸(GABA)含量的测定
基于KHUHAWAR等[13]的提取方法进行了改进,将20 mL的80%(体积比)甲醇加入到1.2 g的GPR中,随后匀浆3 min。将混合物在4 ℃下以5000 r/min离心10 min,随后通过滤纸进行过滤,重复上述步骤2次,使用旋转蒸发仪在50 ℃下蒸发合并萃取液。将提取物重新溶解在5 mL超纯水中,并放置在−22 ℃条件下备用。将1 mL待测样品添加到0.6 mL硼酸盐缓冲液(pH8)中并滴加1 mL的2-羟基-1-萘醛衍生试剂(质量体积比0.75%)。将混合物置于80 ℃水浴中加热10 min,最终用甲醇定容至5 mL。GABA检测是基于HAYAT等[14]的方法改进后通过HPLC进行测定。将20 μL样品注入色谱柱中。通过使用流动相A(甲醇100%)和流动相B(H2O)以1 mL/min的流速洗脱样品。梯度洗脱程序从0 min时使用50%流动相A开始,然后在1 min时增加到60%,在4 min时增加到70%,在7 min时增加到80%,在9 min时增加到90%,然后在11 min时减少到50%,直到18 min运行结束。检测波长为254 nm、柱温30 ℃。检测结果以mg GABA/100 g GPR(以干基计)表示。
1.2.4.2 总花色苷含量(Total anthocyanin content,TAC)的测定
将1 g的GPR样品加入到20 mL酸化的甲醇(40%甲醇:浓盐酸=98:2,体积比)中,均质化10 min后以180 r/min振荡1 h。将样品在4 ℃下以5000 r/min离心10 min,留取上清液部分利用酸化后的甲醇定容至25 mL,保存在−22 ℃备用。基于SUTHARUT等[15]所述改良的pH示差法来测定提取物中总花色苷的含量。使用分光光度计在pH为1.0和4.5的缓冲液中分别测定样品在510 nm和700 nm的吸光度。TAC以mg 矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside equivalents,CGE)/100 g GPR(干基)表示。
1.2.4.3 总酚含量(Total phenolic content,TPC)的测定
取1 g的GPR用3 mL的80%(体积比)甲醇进行两次萃取,每次萃取时将离心管中的混合物置于60 ℃水浴中,并在孵育过程中涡旋两次。随后,以10000 r/min离心10 min,合并上清液并用80%甲醇定容至10 mL,放置于−22 ℃留存备用。基于Folin-Ciocalteu比色法[16]进行TPC分析。避光孵育2 h后使用分光光度计在760 nm处测量吸光度,TPC 以mg 没食子酸当量(Gallic acid equivalents,GAE)/100 g GPR(干基)表示。
1.2.5 抗氧化活性的测定
清除2,2-二苯基-1-吡啶并肼基(DPPH)自由基活性[17],吸取上述TPC测定时的提取物200 μL,与新鲜制备的DPPH溶液(60 μmol/L的80%甲醇溶液,2.8 mL)混合。在避光环境中孵育30 min后,在517 nm下测得的吸光度,其抗氧化活性表示为:mg Trolox当量(Trolox equivalents,TE)/100 g GPR(干基)。采用铁离子还原/抗氧化能力法(Ferric reducing antioxidant potential,FRAP)进行总抗氧化性的测定[18]。将混合物避光孵育30 min后,在593 nm处测定吸光度,FRAP以mg TE/100 g GPR(干基)表示。
1.2.6 脂质过氧化的测定
丙二醛(Malondialdehyde,MDA)采用硫代巴比妥酸法(TBARS)进行测定,通过对MOKO等[19]方法稍作调整,将GPR(约50 mg)与正丁醇(25 mL)混合,取出5 mL混合溶液,并加入5 mL的TBA试剂。将该溶液在95 ℃下孵育2 h。使用分光光度计在528 nm处测量吸光度的增加,以mg TBA/g GPR(干基)表示。
1.2.7 酸败度的感官评价
GPR样品无需事先浸泡,按1:1.5(质量体积比)的饭水比煮熟。食用前将煮熟的GPR在室温下于密闭容器中放置30 min。称取约15 g煮熟的GPR装在盘子中,以随机顺序提供给小组成员。感官评价来自于经过培训后的20名工作人员(年龄在24~44岁,10名男性,10名女性)。酸败评价基于KLAYKRUAYAT等[10]的方法采用线性15 cm刻度(0 cm为不酸败,15 cm为强烈酸败气味)。要求小组成员比较在不同条件下储存6个月前后GPR的酸败情况。此外,小组成员可要求选择接受或拒绝样品。
1.2.8 微生物指标的测定
依据GB 4789.2-2016的相关标准内容进行GPR样品的菌落总数的测定[20];依据GB 4789.15-2016对GPR样品的霉菌和酵母菌进行测定[21];通过黄曲霉毒素总量(AFT)酶联免疫检测试剂盒对GPR的黄曲霉毒素总量进行测定。依据相关标准和试剂盒说明书所述进行具体操作步骤。
1.3 数据处理
本研究的检测结果表示为3次重复样品的平均值±标准偏差。方差分析(单向方差分析),在95%置信水平下,用Duncan多重范围检验确定均值之间的差异,检测结果分析时:显著性差异(P<0.05)用不同的小写字母表示,无显著性差异(P>0.05)用ns表示。感官评价是在完全随机区组设计(randomized complete blocks design,RCBD)中进行的。使用SPSS和Origin等软件进行相关数据的统计分析。
2. 结果与分析
2.1 贮藏条件对水分含量和水分活度的影响
如表2所示,与30 ℃的储存相比较,在4 ℃相对湿度为55% 的贮藏条件下,GPR样品的MC(11.51%~12.25%)和Aw(0.56~0.62)在6个月的贮藏期内变化较小。两种包装材料在常压和真空条件下无破损现象,均可正常使用。在30 ℃时,在常压和真空条件下PAPE 30A和PAPE 30V包装中GPR样品的MC和Aw值在6个月内有明显的下降,分别为8.19%和9.43%,0.27和0.33。但是,在ALPE包装中的GPR样品则基本保持不变。实验结果说明在30 ℃的储存条件下,ALPE可以有效阻止GPR的水分流失。
表 2 贮藏期内GPR的水分含量和水分活度的变化Table 2. Changes in moisture content and water activity of GPR during storage储藏时间(月) 30 ℃ 4 ℃ PAPE 30 A PAPE 30 V ALPE 30 V PAPE 04 A PAPE 04 V ALPE 04 V 水分
含量
(MC, %)0 12.12±0.09Aa 12.12±0.09 Aa 12.12±0.09 Aa 12.12±0.09 Aa 12.12±0.09 Ba 12.12±0.09 Aa 1 10.32±0.04 Bd 10.88±0.14 Bc 11.96±0.07 Ba 11.68±0.05 Cb 11.55±0.01 Db 11.67±0.06 Cb 2 9.61±0.02 Cc 10.70±0.24 Cb 11.75±0.09 Ca 11.68±0.03 Ca 11.63±0.12 Da 11.51±0.10 Da 3 9.22±0.10 Dd 10.02±0.05 Dc 11.63±0.04 Db 11.67±0.01 Dab 11.74±0.03 Ca 11.62±0.08 CDb 4 9.03±0.04 Ee 10.03±0.03 Dd 11.64±0.06 Cc 11.82±0.01 Bb 12.05±0.06 Ba 11.86±0.10 Bb 5 8.67±0.05 Fd 9.71±0.03 Ec 11.97±0.04 Ba 11.80±0.10 BCb 11.80±0.03 Cb 11.85±0.02 Bb 6 8.19±0.02 Ge 9.43±0.05 Fd 12.06±0.04 ABc 12.04±0.05 Ac 12.25±0.04 Aa 12.14±0.03 Ab 水分
活度(Aw, 23 ℃)0 0.61±0.01 Aa 0.61±0.01 Aa 0.61±0.01 Ba 0.61±0.01 Aa 0.61±0.01 Aa 0.61±0.01 Aa 1 0.46±0.00 Bd 0.54±0.00 Bc 0.61±0.01 Ba 0.60±0.00 Bb 0.59±0.00 Bb 0.59±0.00 Cb 2 0.39±0.00 Ce 0.49±0.00 Cd 0.61±0.00 Ba 0.58±0.00 Dc 0.60±0.01 ABb 0.58±0.00 Dc 3 0.38±0.00 Ce 0.44±0.01 Dd 0.62±0.00 ABa 0.59±0.01 Cc 0.59±0.00 Bc 0.60±0.00 Bb 4 0.37±0.01 Dd 0.43±0.00 Ec 0.62±0.00 ABa 0.60±0.00 Bb 0.59±0.00 Bb 0.59±0.00 Cb 5 0.33±0.00 Ee 0.38±0.00 Fd 0.63±0.00 Aa 0.59±0.00 Cc 0.60±0.00 ABb 0.61±0.01Ab 6 0.27±0.00 Fe 0.33±0.00 Gd 0.59±0.00 Cb 0.56±0.01 Ec 0.62±0.00 Aa 0.59±0.00 Cb 注:同列不同大写字母表示差异显著(P<0.05),同行不同小写字母表示差异显著(P<0.05);表2同。 2.2 贮藏条件对生物活性物质的影响
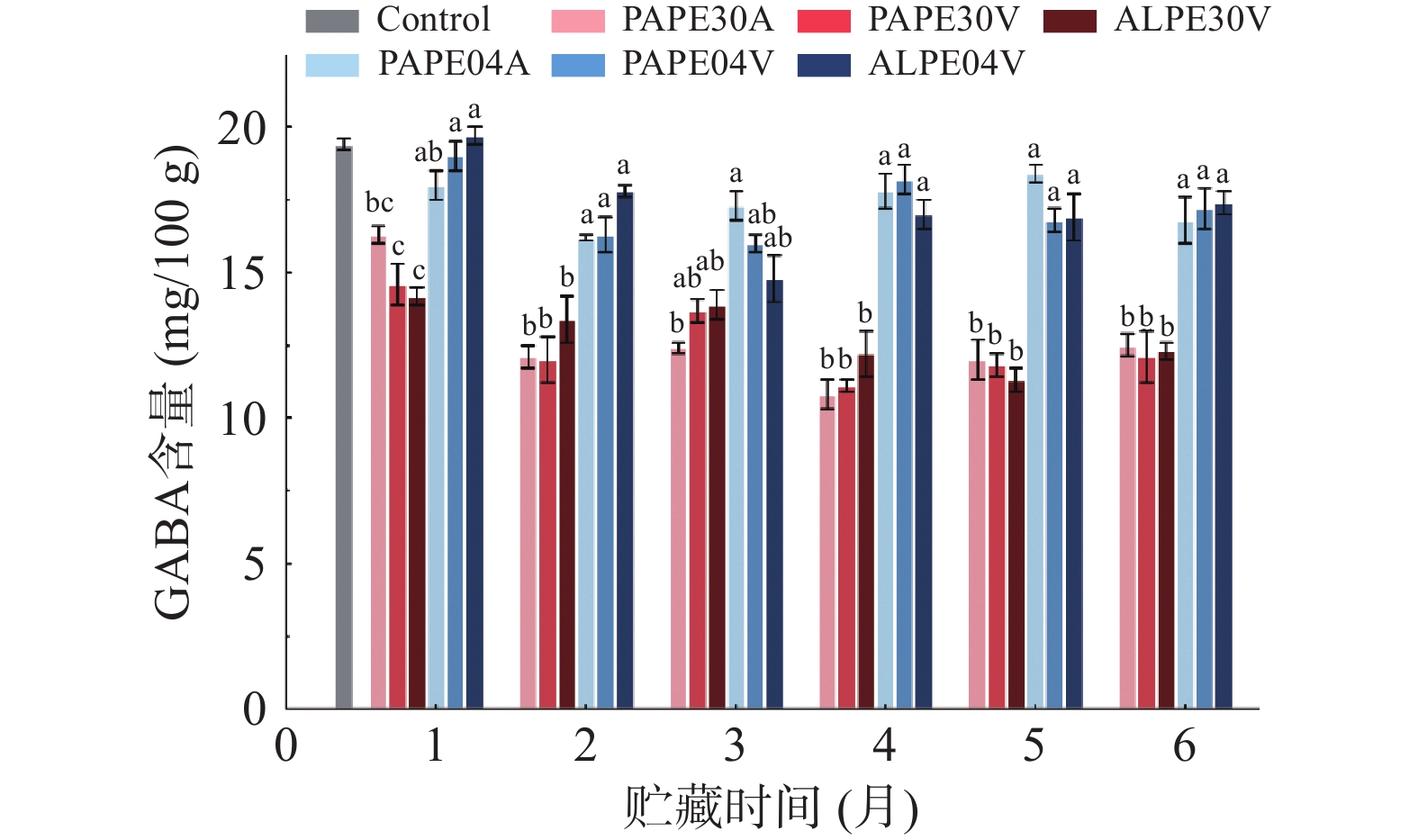
目前,对于GPR中γ-氨基丁酸(GABA)的研究发现其含量一般为(19.22±0.03)mg/100 g[14]。如图1所示,不同包装材料与氧气含量对GABA含量几乎无影响。GABA含量主要受贮藏时间与温度的影响,随贮藏时间及温度的增加而降低。在30 ℃的储存期内,GABA含量在1个月后显著下降至(14.25±0.29)~(16.32±0.38)mg/100 g(P<0.05),然而该值在2个月后基本保持不变。在储存6个月后,在4 ℃条件下GPR保留的GABA含量仍维持在(16.82±0.81)~(17.43±0.42)mg/100 g。此结果表明低温储存可以有效抑制GABA的减少。另一方面,在相同温度下储存在不同包装袋中的GPR的GABA含量差异不显著(P>0.05)。在储存过程中影响GABA含量的储存条件的相关研究较少。PARNSAKHORN等[22]已报道在4 ℃和37 ℃条件下贮存8个月后发芽糙米中GABA含量的下降幅度分别为30.90%和28.70%,两者均无显著性差异(P>0.05)。然而,本研究发现,在4 ℃储存后GABA含量仅下降了9.65%~11.58%,且在6个月贮藏期后高于30 ℃时的含量(30.52%~33.24%)。发芽蒸谷米GPR的胚乳在淀粉糊化过程中变硬,所以在贮藏过程中更耐破坏。在较高温度条件下GABA的降解机理可能是由于水分子的流失和γ-丁内酰胺的形成而引起的结构分解[23]。然而,GPR的低温储存导致GABA含量的增加,这可能是由于GABA作为一种防御机制在应对冷胁迫时的积累作用[10]。因此,在4 ℃下储存的GPR中GABA含量在储存过程中略有波动。因为GABA含量受储存温度的影响,GPR应在低温下储存以保存其GABA的含量。
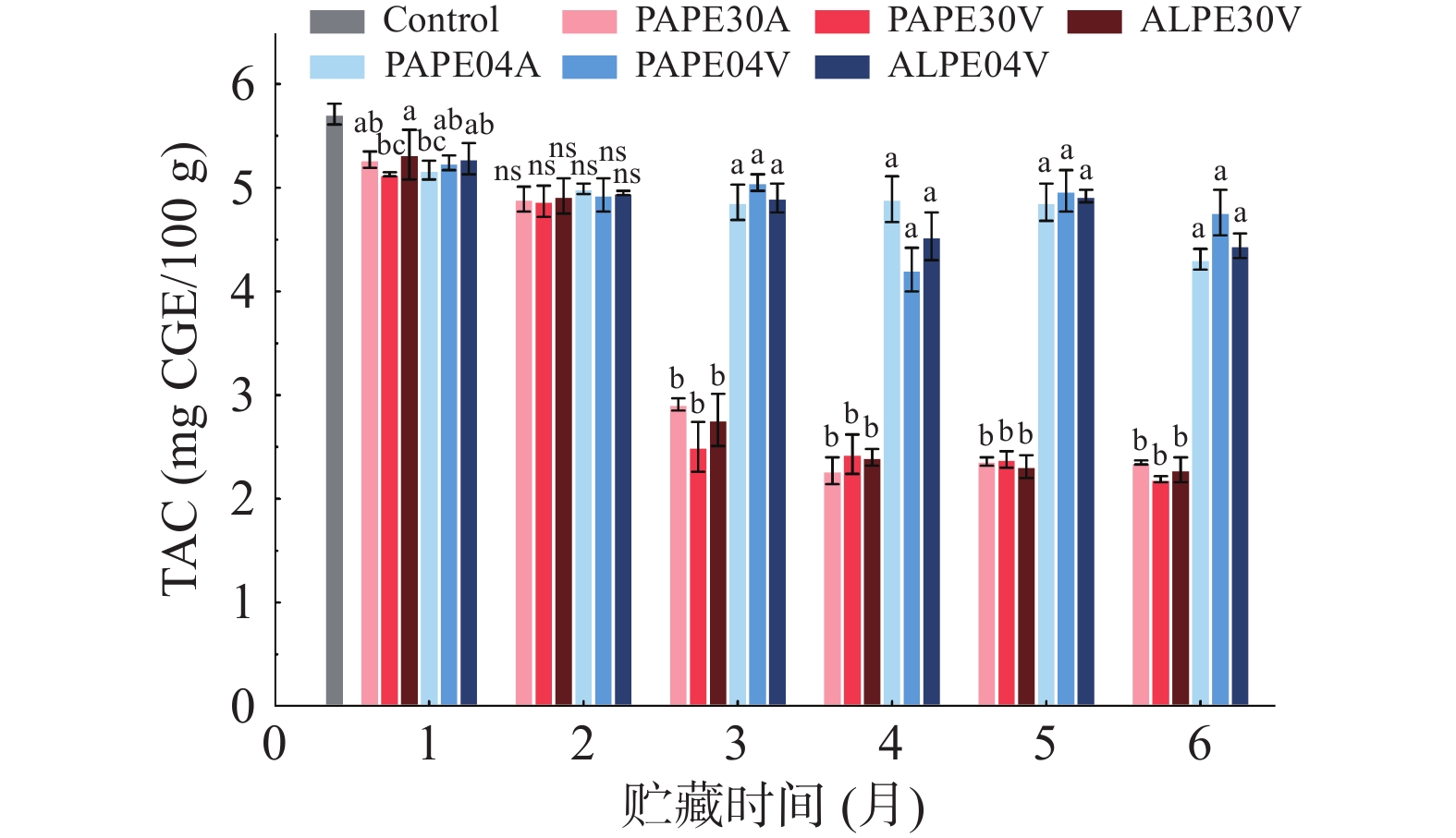
有色稻米中花色苷种类主要包括矢车菊素-3-葡萄糖苷和芍药素-3-葡萄糖苷。在本研究的黑稻米中GPR的总花色苷含量(TAC)约为5.68 mg CGE/100 g。TAC的变化情况如图2所示,在4 ℃条件下贮藏2个月后,GPR样品中的TAC含量无显著性变化(P>0.05),而在30 ℃条件下变化显著(P<0.05),TAC含量降低较快,这是由于花色苷在较高温度下易降解。将GPR储存在4 ℃时可有效减少总花色苷的损失。由于花色苷具有抗氧化特性,因此花色苷在30 ℃条件下贮藏3个月后发生降解可能是由于花色苷与脂质氧化自由基的反应[24]。这些现象都与氧化产物的形成有关,氧化产物在3个月后迅速增加,6个月后,贮藏在30 ℃处的GPR中TAC约为储存在4 ℃时TAC的一半。而不同包装材料和含氧量对TAC含量并无影响。
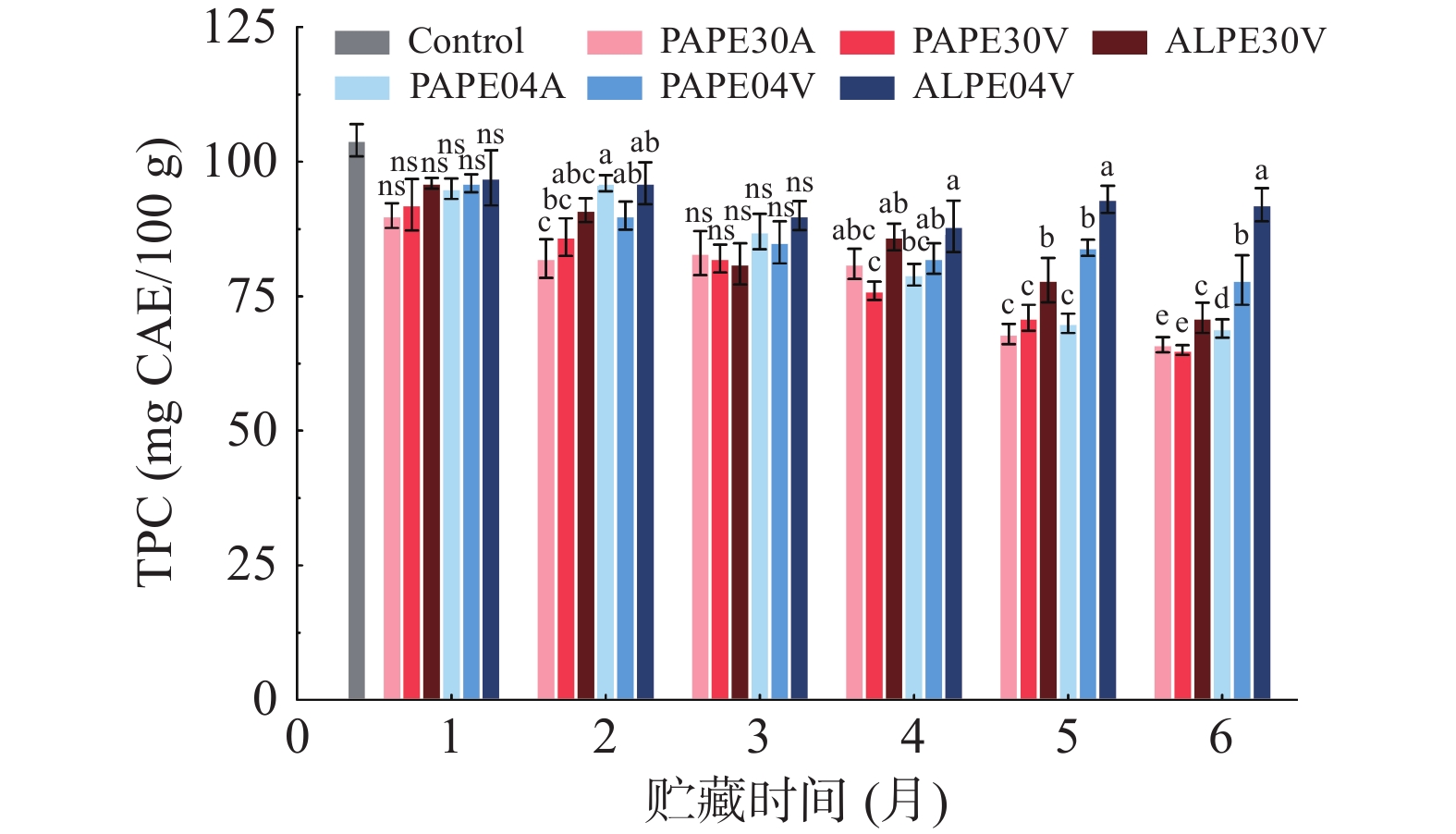
如图3所示,GPR的初始总酚含量(TPC)为(105.08±3.11)mg GAE/100 g。6个月后,在4 ℃贮藏条件下所有包装中的GPR的TPC为(69.03±1.68)~(97.85±1.64)mg GAE/100 g,均高于在30 ℃时相同变量贮藏条件下TPC的含量,4 ℃的真空ALPE包装中TPC含量最高。据SRIPUM等[5]相关研究证明有色稻米和发芽糙米中的TPC在6个月后均会下降。氧气和储存时间对黑稻米TPC的影响较大,光照、温度、氧含量、pH和贮藏时间等因素都会影响稻米中酚类化合物的稳定性[25-26]。如图3可知,在其它条件不变的情况下,贮藏6个月后,真空状态下TPC含量明显高于正常大气压下TPC含量。较低的氧气传输速率可以保护酚类化合物。
2.3 贮藏条件对抗氧化活性的影响
GPR的抗氧化能力可能来自多种成分,包括酚酸、类黄酮、花色苷、原花青素、生育酚、γ-异黄醇和植酸等物质。由DPPH自由基清除活性和铁还原/抗氧化电位(FRAP)确定GPR在贮藏过程中抗氧化能力的变化如图4(A)、(B)所示。抗氧化能力均随贮藏时间的延长而降低。在贮藏6个月后,4 ℃下GPR的DPPH和FRAP值明显高于在30 ℃下储存的值。DPPH自由基清除能力并未受到包装材料与含氧量的影响。而FRAP含量却受到含氧量的影响较大,由图4(B)可知,贮藏6个月后真空状态下的FRAP值比正常大气压下的含量高。而抗氧化能力的丧失程度可能与脂质氧化直接相关,这是在高温下暴露于氧气中储存的结果[5, 27]。在真空中储存比正常气压下更能保持GPR的抗氧化能力。
2.4 贮藏条件对脂质过氧化的影响
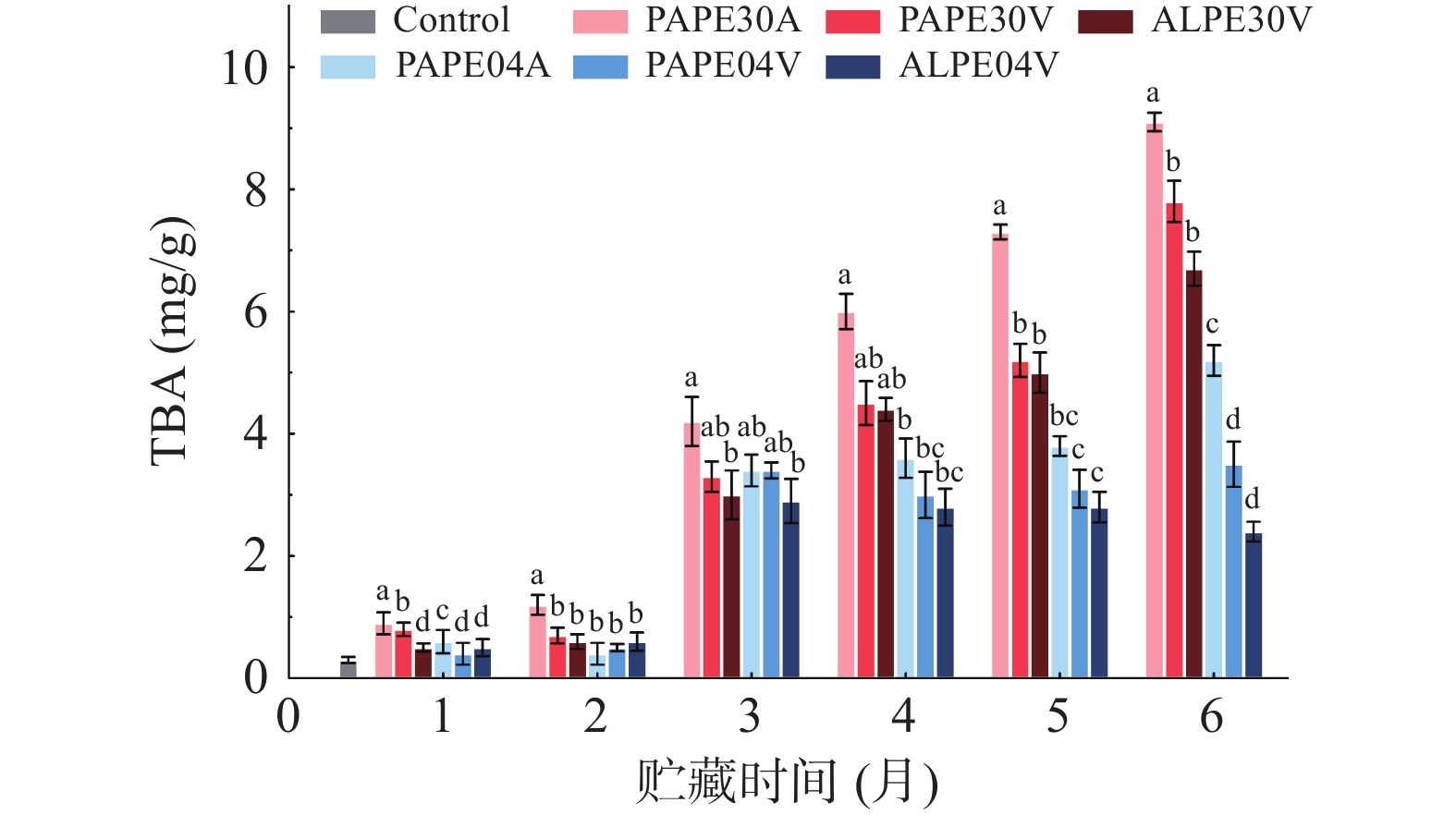
GPR含有大量的脂质,尤其是在麸皮外层,所以极易发生脂质自氧化反应。本研究采用硫代巴比妥酸(TBA)法监测脂质氧化的变化。在528 nm处吸光度的增加可用于表示脂质氧化的二次产物丙二醛(MDA)。由图5可知,TBA值在初始阶段缓慢升高,而在3个月贮藏期后迅速升高。一般情况下,发芽蒸煮糙米的TBA值在30 ℃下存储3个月后显著增加,而用ALPE包装的蒸煮米TBA值增速比其他包装材料低[28]。由于高温和富氧条件加速了脂质氧化的速率,在真空条件下贮藏时TBA值明显下降。吸光度随着贮藏时间而增加可能与包装材料的透氧性有关[8]。结果表明,使用ALPE包装的GPR具有较低的吸光度。此外,在4 ℃下储存的TBA值((2.41±0.16)~(5.23±0.25)mg/g)在6个月后低于30 ℃的TBA值((6.74±0.15)~(9.13±0.28)mg/g)。
2.5 酸败度的感官评价
由20名小组成员评估的酸败度分数与硫代巴比妥酸法测定结果高度相关(R2=0.9943),如图6(A)所示。由图6(B)可知所有条件下的酸败评分均较初始值显著提高(P<0.05),说明贮藏温度、氧气浓度和包装材质都会对酸败的评分产生影响。所有GPR样品在贮藏6个月后酸败评分依然较低,并且所有样品都在小组成员的可接受范围内。储存在真空ALPE中的GPR的酸败评分最低,可能是因为这种包装材料可以很好地保护GPR免受氧气的影响。
2.6 微生物特性
由表3可知,在贮藏期间,菌落总数呈逐渐增加的趋势,但均未超过104 CFU/g,而在整个储存期间内未检测到酵母菌和霉菌。目前,国内并没有现行有效的蒸谷米相关的微生物限量标准,而欧盟及其它国家标准规定蒸谷米的微生物限量为菌落总数不得高于106 CFU/g,酵母菌和霉菌计数不得高于500 CFU/g [29-30]。在30 ℃下贮藏的GRP样品菌落总数高于4 ℃,贮藏温度显著影响了微生物的生长(P<0.05)。此外,贮藏在真空包装中GPR的细菌数明显低于常压包装。随着贮藏时间的延长,黄曲霉毒素含量显著增加(P<0.05)。相同的贮藏期内,在30 ℃处的黄曲霉毒素含量高于4 ℃处的含量。贮藏6个月后,在30 ℃时储存在真空PAPE和真空ALPE包装中的GPR分别含有(2.83±0.07)μg/kg和(2.65±0.36)μg/kg的黄曲霉毒素,显著低于PAPE(4.52±0.36)μg/kg。所有GPR样品的黄曲霉毒素总量并未超过国家标准规定的限量值10 μg/kg[31]。表明本研究过程中待测样品的微生物指标符合相关要求,可放心食用。
表 3 不同条件下贮藏6个月的GPR的微生物指标Table 3. Microbiological indicators of GPR stored for 6 months under different conditions储藏时间(月) 30 ℃ 4 ℃ PAPE 30A PAPE 30V ALPE 30V PAPE 04A PAPE 04V ALPE 04V 菌落总数
(×103 CFU/g)0 未检出 未检出 未检出 未检出 未检出 未检出 1 0.05±0.01 Db 0.03±0.01 Dbc 0.04±0.01 Db 0.07±0.02 Da 0.03±0.01 Dbc 0.01±0.01 Dc 2 0.01±0.01 Db 0.02±0.01 Db 0.12±0.03 Da 0.01±0.01 Db 0.02±0.01 Db 0.02±0.01 Db 3 0.02±0.01 Dab 0.01±0.01 Db 0.02±0.01 Dab 0.02±0.01 Dab 0.02±0.01 Dab 0.05±0.02 Da 4 1.09±0.08 Ca 0.68±0.09 Cb 0.64±0.25 Cbc 0.36±0.05 Cc 0.56±0.10 Cbc 0.65±0.04 Cb 5 1.51±0.24 Ba 1.27±0.11 Bb 1.02±0.07 Bc 0.94±0.07 Bcd 0.98±0.07 Bc 0.73±0.06 Bd 6 2.23±0.15 Aa 1.45±0.06 Ab 1.41±0.13 Ab 1.20±0.09 Ac 1.24±0.11 Ac 0.99±0.07 Ad 酵母菌和霉菌(CFU/g) 0~6 未检出 未检出 未检出 未检出 未检出 未检出 黄曲霉毒素总量(μg/kg) 0 1.02±0.07 C 1.02±0.07 B 1.02±0.07 C 1.02±0.07 B 1.02±0.07 B 1.02±0.07 B 2 1.78±0.02 BCa 1.07±0.48 Bb 1.56±0.24 BCa 0.97±0.32 Bb 0.93±0.02 Bb 0.84±0.19 Bb 4 2.49±0.31 Ba 1.11±0.19 Bc 1.93±0.40 ABb 1.20±0.61 Bc 1.14±0.05 Bc 1.05±0.10 Bc 6 4.52±0.36 Aa 2.83±0.07 Ab 2.65±0.36 Ab 2.18±0.19 Ab 2.17±0.13 Ab 2.45±0.33 Ab 3. 结论
本研究分析了在6个月贮藏期间内,贮藏条件(温度、包装材料和氧气)对GPR的理化性质、生物活性化合物、抗氧化活性、感官评价和微生物特性的影响。结果表明:包装材料ALPE比PAPE的密闭性更好,更有助于发芽蒸谷米的贮藏,延缓酸败。GPR的水分含量和水分活度在4 ℃和真空ALPE下贮藏期间保持不变。生物活性化合物,包括总花色苷含量、总酚含量、抗氧化活性和GABA含量随贮藏温度和时间的增加而降低,将GPR储存在4 ℃的真空ALPE中是保存其生物活性化合物的最适贮藏条件。尽管随着贮藏时间的延长酸败程度略有增加(特别是在30 ℃时),但该产品的酸败仍然在可接受范围内。此外,在6个月贮藏期后,GPR中的微生物数量和黄曲霉毒素含量均小于国家相关标准的规定,说明实验过程中GPR样品的微生物指标符合标准要求并可放心食用。本研究能够对未来发芽蒸谷黑米的商业化生产,贮藏条件的选择以及保质期的延长提供一定的理论基础。
-
表 1 实验因素组合及样品编码
Table 1 Combination of experimental factors and the sample code
样品编码 包装材料 温湿度 气压(氧气含量) ALPE PAPE T=4 ℃; RH=55% T=30 ℃; RH=35% 大气压(A, 900 mbar) 真空(V, 60 mbar) PAPE 30A √ √ √ PAPE 30V √ √ √ ALPE 30V √ √ √ PAPE 04A √ √ √ PAPE 04V √ √ √ ALPE 04V √ √ √ 表 2 贮藏期内GPR的水分含量和水分活度的变化
Table 2 Changes in moisture content and water activity of GPR during storage
储藏时间(月) 30 ℃ 4 ℃ PAPE 30 A PAPE 30 V ALPE 30 V PAPE 04 A PAPE 04 V ALPE 04 V 水分
含量
(MC, %)0 12.12±0.09Aa 12.12±0.09 Aa 12.12±0.09 Aa 12.12±0.09 Aa 12.12±0.09 Ba 12.12±0.09 Aa 1 10.32±0.04 Bd 10.88±0.14 Bc 11.96±0.07 Ba 11.68±0.05 Cb 11.55±0.01 Db 11.67±0.06 Cb 2 9.61±0.02 Cc 10.70±0.24 Cb 11.75±0.09 Ca 11.68±0.03 Ca 11.63±0.12 Da 11.51±0.10 Da 3 9.22±0.10 Dd 10.02±0.05 Dc 11.63±0.04 Db 11.67±0.01 Dab 11.74±0.03 Ca 11.62±0.08 CDb 4 9.03±0.04 Ee 10.03±0.03 Dd 11.64±0.06 Cc 11.82±0.01 Bb 12.05±0.06 Ba 11.86±0.10 Bb 5 8.67±0.05 Fd 9.71±0.03 Ec 11.97±0.04 Ba 11.80±0.10 BCb 11.80±0.03 Cb 11.85±0.02 Bb 6 8.19±0.02 Ge 9.43±0.05 Fd 12.06±0.04 ABc 12.04±0.05 Ac 12.25±0.04 Aa 12.14±0.03 Ab 水分
活度(Aw, 23 ℃)0 0.61±0.01 Aa 0.61±0.01 Aa 0.61±0.01 Ba 0.61±0.01 Aa 0.61±0.01 Aa 0.61±0.01 Aa 1 0.46±0.00 Bd 0.54±0.00 Bc 0.61±0.01 Ba 0.60±0.00 Bb 0.59±0.00 Bb 0.59±0.00 Cb 2 0.39±0.00 Ce 0.49±0.00 Cd 0.61±0.00 Ba 0.58±0.00 Dc 0.60±0.01 ABb 0.58±0.00 Dc 3 0.38±0.00 Ce 0.44±0.01 Dd 0.62±0.00 ABa 0.59±0.01 Cc 0.59±0.00 Bc 0.60±0.00 Bb 4 0.37±0.01 Dd 0.43±0.00 Ec 0.62±0.00 ABa 0.60±0.00 Bb 0.59±0.00 Bb 0.59±0.00 Cb 5 0.33±0.00 Ee 0.38±0.00 Fd 0.63±0.00 Aa 0.59±0.00 Cc 0.60±0.00 ABb 0.61±0.01Ab 6 0.27±0.00 Fe 0.33±0.00 Gd 0.59±0.00 Cb 0.56±0.01 Ec 0.62±0.00 Aa 0.59±0.00 Cb 注:同列不同大写字母表示差异显著(P<0.05),同行不同小写字母表示差异显著(P<0.05);表2同。 表 3 不同条件下贮藏6个月的GPR的微生物指标
Table 3 Microbiological indicators of GPR stored for 6 months under different conditions
储藏时间(月) 30 ℃ 4 ℃ PAPE 30A PAPE 30V ALPE 30V PAPE 04A PAPE 04V ALPE 04V 菌落总数
(×103 CFU/g)0 未检出 未检出 未检出 未检出 未检出 未检出 1 0.05±0.01 Db 0.03±0.01 Dbc 0.04±0.01 Db 0.07±0.02 Da 0.03±0.01 Dbc 0.01±0.01 Dc 2 0.01±0.01 Db 0.02±0.01 Db 0.12±0.03 Da 0.01±0.01 Db 0.02±0.01 Db 0.02±0.01 Db 3 0.02±0.01 Dab 0.01±0.01 Db 0.02±0.01 Dab 0.02±0.01 Dab 0.02±0.01 Dab 0.05±0.02 Da 4 1.09±0.08 Ca 0.68±0.09 Cb 0.64±0.25 Cbc 0.36±0.05 Cc 0.56±0.10 Cbc 0.65±0.04 Cb 5 1.51±0.24 Ba 1.27±0.11 Bb 1.02±0.07 Bc 0.94±0.07 Bcd 0.98±0.07 Bc 0.73±0.06 Bd 6 2.23±0.15 Aa 1.45±0.06 Ab 1.41±0.13 Ab 1.20±0.09 Ac 1.24±0.11 Ac 0.99±0.07 Ad 酵母菌和霉菌(CFU/g) 0~6 未检出 未检出 未检出 未检出 未检出 未检出 黄曲霉毒素总量(μg/kg) 0 1.02±0.07 C 1.02±0.07 B 1.02±0.07 C 1.02±0.07 B 1.02±0.07 B 1.02±0.07 B 2 1.78±0.02 BCa 1.07±0.48 Bb 1.56±0.24 BCa 0.97±0.32 Bb 0.93±0.02 Bb 0.84±0.19 Bb 4 2.49±0.31 Ba 1.11±0.19 Bc 1.93±0.40 ABb 1.20±0.61 Bc 1.14±0.05 Bc 1.05±0.10 Bc 6 4.52±0.36 Aa 2.83±0.07 Ab 2.65±0.36 Ab 2.18±0.19 Ab 2.17±0.13 Ab 2.45±0.33 Ab -
[1] HU Z, TANG X, LIU J, et al. Effect of parboiling on phytochemical content, antioxidant activity and physicochemical properties of germinated red rice[J]. Food Chemistry,2017,214(1):285−292.
[2] HAN A, JINN J R, MAUROMOUSTAKOS A, et al. Effect of parboiling on milling, physicochemical, and textural properties of medium- and long-grain germinated brown rice[J]. Cereal Chemistry,2016,93(1):156−167.
[3] 雷月, 宫彦龙, 邓茹月, 等. 超声波辅助喷雾加湿法富集发芽黑糙米生物活性物质工艺的响应面优化[J]. 食品工业科技,2020,444(4):111−119. [LEI Y, GONG Y L, DENG R Y, et al. Response surface optimization of the process of enriching bioactive substances from germinated black brown rice by ultrasonic-assisted spray humidification[J]. Food Industrial Technology,2020,444(4):111−119. [4] KHAN W, BHATT P C, PANDA B P. Degradation kinetics of gamma amino butyric acid in monascus-fermented rice[J]. Journal of Food Quality,2015,38(2):123−129. doi: 10.1111/jfq.12135
[5] SRIPUM C, KUKREJA R K, CHAROENKIATKUL S, et al. The effect of extraction conditions on antioxidant activities and total phenolic contents of different processed Thai Jasmine rice[J]. International Food Research Journal,2017,24(4):1644−1650.
[6] 傅维, 吕晓玲, 孙勇民. 发芽黑米中γ-氨基丁酸及矿物元素含量变化的研究[J]. 食品工业科技,2011(9):178−180. [FU W, LU X L, SUN Y M. Study on the changes of γ-aminobutyric acid and mineral elements in germinated black rice[J]. Food Industrial Technology,2011(9):178−180. [7] 代国红, 周宝龙, 周佳, 等. 黑稻品种洋黑3号农艺性状及花青苷色素积累规律研究[J]. 中国稻米,2019,25(2):35−39. [DAI G H, ZHOU B L, ZHOU J, et al. Agronomic characteristics and anthocyanin pigment accumulation of black rice variety Yanghei 3[J]. China Rice,2019,25(2):35−39. doi: 10.3969/j.issn.1006-8082.2019.02.008 [8] RANMEECHAI N, PHOTCHANACHAI S. Effect of modified atmosphere packaging on the quality of germinated parboiled brown rice[J]. Food Science and Biotechnology,2017,26(2):303−310. doi: 10.1007/s10068-017-0041-2
[9] CHEEVITSOPON E, NOOMHORM A. Effects of superheated steam fluidized bed drying on the quality of parboiled germinated brown rice[J]. Journal of Food Processing and Preservation,2015,39(4):349−356. doi: 10.1111/jfpp.12239
[10] KLAYKRUAYAT S, MAHAYOTHEE B, KHUWIJITJARU P, et al. Influence of packaging materials, oxygen and storage temperature on quality of germinated parboiled rice[J]. LWT-Food Science and Technology,2019,121(3):108−126.
[11] GB 5009.3-2016 食品安全国家标准 食品中水分的测定[S]. 北京: 中国标准出版社, 2016. GB 5009.3-2016 National standard of food safety, determination of water in food[S]. Beijing: China Standard Press, 2016.
[12] GB 5009.238-2016食品安全国家标准 食品水分活度的测定[S]. 北京: 中国标准出版社, 2016. GB 5009.238-2016 National standard of food safety, determination of food water activity[S]. Beijing: Chinese Standard Press, 2016.
[13] KHUHAWAR M Y, RAJPER A D. Liquid chromatographic determination of γ-aminobutyric acid in cerebrospinal fluid using 2-hydroxynaphthaldehyde as derivatizing reagent[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences,2003,788(2):413−418.
[14] HAYAT A, JAHANGIR T M, KHUHAWAR M Y, et al. Simultaneous HPLC determination of gamma amino butyric acid(GABA) and lysine in selected Pakistani rice varieties by pre-column derivatization with 2-Hydroxynaphthaldehyde[J]. Journal of Cereal Science,2014,60(2):356−360. doi: 10.1016/j.jcs.2014.05.011
[15] SUTHARUT J, SUDARAT J. Total anthocyanin content and antioxidant activity of germinated colored rice[J]. International Food Research Journal,2012,19(1):215−221.
[16] IQBAL S, BHANGER M I, ANWAR F. Antioxidant properties and components of some commercially available varieties of rice bran in Pakistan[J]. Food Chemistry,2005,93(2):265−272. doi: 10.1016/j.foodchem.2004.09.024
[17] ZHANG H, SHAO Y, BAO J, et al. Phenolic compounds and antioxidant properties of breeding lines between the white and black rice[J]. Food Chemistry,2015,172(1):630−639.
[18] AGUILAR-GARCIA C, GAVINO G, BARAGANO-MOSQUEDA M, et al. Correlation of tocopherol, tocotrienol, γ-oryzanol and total polyphenol content in rice bran with different antioxidant capacity assays[J]. Food Chemistry,2007,102(4):1228−1232. doi: 10.1016/j.foodchem.2006.07.012
[19] MOKO E M, PURNOMO H, KUSNADI J, et al. Phytochemical content and antioxidant properties of colored and non colored varieties of rice bran from Minahasa, North Sulawesi, Indonesia[J]. International Food Research Journal,2014,21(3):1017−1023.
[20] GB 4789.2-2016食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 北京: 中国标准出版社, 2016. GB 4789.2-2016 National food safety standard, food microbiological examination, determination of the total number of colonies[S]. Beijing: China Standards Press, 2016.
[21] GB 4789.15-2016食品安全国家标准 食品微生物学检验 霉菌和酵母计数[S]. 北京: 中国标准出版社, 2016. GB 4789.15-2016 National food safety standard, food microbiological inspection, mold and yeast counting[S]. Beijing: China Standards Press, 2016.
[22] PARNSAKHORN S, LANGKAPIN J. Changes in physicochemical characteristics of germinated brown rice and brown rice during storage at various temperatures[J]. Agricultural Engineering International:The CIGR e-journal,2013,15(2):293−303.
[23] PU Y, SINCLAIR A J, ZHONG J, et al. Determination of γ-aminobutyric acid(GABA) in jujube fruit(Ziziphus jujuba Mill.)[J]. Cyta Journal of Food,2019,17(1):158−162. doi: 10.1080/19476337.2019.1566277
[24] NORKAEW O, BOONTAKHAM P, DUMRI K, et al. Effect of post-harvest treatment on bioactive phytochemicals of Thai black rice[J]. Food Chemistry,2017,217:98−105. doi: 10.1016/j.foodchem.2016.08.084
[25] KHOO H E, AZLAN A, TANG S T, et al. Anthocyanidins and anthocyanins: Colored pigments as food, pharmaceutical ingredients, and the potential health benefits[J]. Food & Nutrition Research,2017,61(1):90−21.
[26] HTWE N N, SRILAONG V, TANPRASERT K, et al. Effects of storage time and temperature on radical scavenging activities and bioactive compounds in colored rice varieties[J]. International Journal of Food Agriculture & Environment,2010,8(3):26−31.
[27] JUNKA N, CHALERMCHAI W A, RATTANAMECHAISKUL C. Optimal drying and storage conditions for purple rice based on expected high quality[J]. Journal of Food Processing and Preservation,2018,42(2):1−10.
[28] PORASUPHATANA S, CHAVASIT V, VASINRAPEE S, et al. Production and shelf stability of multiple-fortified quick cooking rice as a complementary food[J]. Journal of Food Science,2010,73(7):359−366.
[29] FAO. Worldwide regulations for mycotoxins in food and feed in 2003[J]. Fao Food & Nutrition Paper,2003:81.
[30] European Commission. Commission Regulation(EU) No 165/2010. Setting maximum levels for certain contaminants in foodstuffs as regards aflatoxins[S].
[31] GB 2761-2017食品安全国家标准 食品中真菌毒素限量[S]. 北京: 中国标准出版社, 2017. GB 2761-2017 National food safety standard, limits of mycotoxins in foods[S]. Beijing: China Standards Press, 2017.
-
期刊类型引用(9)
1. 向芳. 食品减盐策略研究进展. 食品与发酵工业. 2024(06): 350-358 .  百度学术
百度学术
2. 赵亚丽,张香美,卢涵,杨贝,文港. 传统腌腊肉制品质量安全管理研究. 食品与机械. 2023(01): 55-60+156 .  百度学术
百度学术
3. 刘东,夏金龙. 低钠酱鹿肉的配方优化及贮藏期特性研究. 中国调味品. 2023(03): 67-74 .  百度学术
百度学术
4. 李智,牛超杰,邹爱军,常超. 肉制品加工减盐技术及其应用. 武汉轻工大学学报. 2023(04): 31-38 .  百度学术
百度学术
5. 张彦慧,郑红霞,刘楠,高彦祥,毛立科. 胶体结构设计在减盐食品中的应用. 食品科学. 2022(01): 213-222 .  百度学术
百度学术
6. 吕广英,孔君,郑润愽. 一种低钠休闲香肠的加工技术研究. 肉类工业. 2022(05): 16-19 .  百度学术
百度学术
7. 芮李彤,李海静,张婷婷,郭琦,李子豪,夏秀芳. 食盐对肉制品品质形成的作用及减盐技术研究进展. 肉类研究. 2022(07): 61-67 .  百度学术
百度学术
8. 孙悦,李震,王鹏,徐幸莲. 响应面优化减盐鸡肉松热加工工艺及品质测定. 食品工业科技. 2022(20): 263-273 .  本站查看
本站查看
9. 周平萍. 咸味剂咸度分析研究方法进展. 现代食品. 2022(17): 23-26+37 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:

 下载:
下载:



