Establishment of an Indirect Competitive ELISA for Zearalenone
-
摘要: 本研究以玉米面为例,建立了玉米赤霉烯酮间接竞争ELISA(ic-ELISA)方法。采用棋盘滴定法确定抗原和单抗的最佳工作浓度,并确定了抗原37 ℃包被1 h、不封闭、酶催化底物作用时间15 min的反应条件进行检测。该方法的检测范围(IC20~IC80)为11~292 pg/mL,检测限(IC10)为6 pg/mL。玉米赤霉烯酮在玉米面中的加标回收率为81.29%~105.80%。本研究建立的ic-ELISA方法与赭曲霉素A、黄曲霉素B1、呕吐毒素、伏马毒素B1、T-2毒素无交叉反应,可用于玉米面中玉米赤霉烯酮的初筛检测。
-
关键词:
- 玉米赤霉烯酮 /
- 真菌毒素 /
- 检测 /
- 间接竞争酶联免疫分析(ic-ELISA)
Abstract: In this study, an indirect competitive ELISA (ic-ELISA) was developed for the detection of zearalenone in corn flour. The optimal working concentration of antigen and monoclonal antibody was determined by chessboard method. Antigen 37 ℃ coated for 1 h, unsealed and enzyme catalyzed substrate action time of 15 min were determined the optimal conditions. The results showed that the detection range (IC20~IC80) was 11~292 pg/mL, and the minimum detection limit (IC10) was 6 pg/mL. The recoveries of the zearalenone from corn flour were 81.29%~105.80%. There was no cross reaction with ochratoxin A, aflatoxin B1, deoxynivalenol, fumonisin B1, T-2 toxin. The ic-ELISA could be used for detection of zearalenon in corn flour. -
真菌毒素是一类由真菌产生的在自然界广泛存在的小分子代谢产物,世界上近1/4的粮食作物受到真菌毒素的污染,其中玉米赤霉烯酮(Zearalenone,ZEN)是玉米、小麦等粮食作物中污染最为广泛的真菌毒素之一[1]。朱风华等对2017~2019年我国山东省6000余份饲料样品进行真菌毒素污染状况调查,发现玉米中ZEN污染率接近50%,并有逐年增高的趋势[2-4]。ZEN具有很高的热稳定性,在粮食生产、加工和储存运输过程中很难被完全去除,通过食物进入人体后严重危害人类的健康[5-6]。而ZEN通过饲料进入动物体内会影响动物的生长和繁殖机能,导致流产[7-8];并抑制动物的免疫功能,诱发肿瘤[9]。
目前,全球100多个国家和地区都制定了ZEN的限量标准。如欧盟对原粮玉米中的ZEN限量为350 μg/kg,对粗加工玉米粉产品及人类食用需要再加工的其他玉米研磨制品的ZEN限量为200 μg/kg,对原粮谷物与可直接食用的玉米的ZEN限量为100 μg/kg,对婴幼儿加工食品中的ZEN限量为20 μg/kg[10];我国对玉米、玉米面、小麦和小麦粉中ZEN的限量为60 μg/kg[11]。除婴幼儿食品外,单纯从数值上看我国限量标准比欧盟更严格,但粮食的限量种类仅玉米和小麦两种,原粮与成品粮的品种限量标准还不够完善,且粮食在生产加工和贮存中会使毒素的含量增多,另外欧盟对婴幼儿这类特殊人群食品的限量标准远低于目前我国的限量标准。因此,建立一种ZEN的高灵敏度检测法对保障粮食安全十分必要。
基于仪器分析技术的高效液相色谱法、荧光光度计法、液相色谱-质谱法是食品中ZEN的国标检测方法[12],薄层色谱法和ELISA是国标饲料中的检测方法[13],这些仪器分析方法具有检测灵敏度高的优点,但检测所需时间长,同时需要大型的仪器设备和专业的操作人员,不便于基层或现场检测[14]。而间接竞争酶联免疫分析法(indirect competitive enzyme linked immunosorbent assay,ic-ELISA)在ZEN的检测中具有操作简单快捷、普通从业人员便可操作、能够满足基层或现场检测中大批样品的初筛鉴定等优势。为了增加ic-ELISA灵敏度,多使用各种生物传感元件或纳米材料在ELISA中起到信号放大的目的,在此基础上可以使传统ic-ELISA方法[15]的灵敏度由1900 ng/mL提高了一个数量级[16-17],但是这些改进的ELISA方法使ELISA的操作变得更加复杂。传统ic-ELISA在快速免疫检测中仍然是最简单实用、成本低廉、商业化产品最多的检测类型。提高ELISA检测灵敏度最核心的的问题还是提高目标抗体的特异性和灵敏度。本实验将优选一组高质量的商品化的抗原、抗体,以期建立高灵敏的ic- ELISA检测方法并用于后续相关免疫检测方法研究。
1. 材料与方法
1.1 材料与仪器
ZEN、赭曲霉毒素A(Ochratoxin A,OTA)、黄曲霉毒素B1(Aflatoxin B1,AFB1)、呕吐毒素(Deoxynivalenol, DON)、伏马毒素B1(Fumonisin B1,FB1)、T-2毒素(T-2)标准品 青岛普瑞邦生物工程有限公司;牛血清白蛋白偶联ZEN抗原(ZEN-BSA)、ZEN单抗 大连百奥思科生物有限公司;辣根过氧化物酶标二抗(HRP-IgG) 北京中杉金桥生物技术有限公司;ZEN试剂盒 北京华安麦科有限公司;玉米面 吉林省长春市某大型超市。
微孔板分光光度计 美国Biotek公司;高速离心机 美国Thermo公司。
1.2 实验方法
1.2.1 ic-ELISA检测基本程序
用碳酸盐缓冲液将ZEN-BSA包被于96孔板上,每孔100 μL,37 ℃恒温温育2 h。洗液(含0.05%吐温−20的磷酸盐缓冲液)清洗三次,每孔200 μL,将板内残余液体拍干。5%脱脂乳作为封闭剂,每孔200 μL,37 ℃恒温封闭1 h,洗液清洗三次,拍干。竞争孔加入ZEN待测样品和磷酸盐缓冲液稀释的单抗各50 μL,非竞争孔加入50 μL磷酸盐缓冲液和50 μL单抗,阴性孔中加100 μL磷酸盐缓冲液,37 ℃恒温温育1 h。洗液清洗三次,拍干。加入用5%脱脂乳稀释2000倍的HRP-IgG,每孔100 μL,37 ℃恒温温育1 h。洗液清洗三次,拍干。加入100 μL TMB底物溶液,37 ℃避光显色15 min。加入终止液(2 moL/L H2SO4),每孔50 μL,酶标仪读取450 nm处的OD值[13]。
1.2.2 ic-ELISA检测条件优化
1.2.2.1 包被抗原和单抗最佳工作浓度的确定
包被抗原BSA-ZEN用碳酸盐缓冲液梯度稀释至300、150、75、37.5、18.75、9.375、4.6875 ng/mL。ZEN单抗用磷酸盐缓冲液稀释至1000、500、250、125、62.5、31.25、0 ng/mL。棋盘滴定法确定抗原和单抗的最佳工作浓度。
1.2.2.2 包被条件、封闭条件和底物作用时间的确定
在“1.2.2.1”的基础上,进一步确定包被条件、封闭条件和底物作用时间。包被条件设置为4 ℃ 12 h、4 ℃ 24 h、37 ℃ 0.5 h 、37 ℃ 1 h、37 ℃ 2 h。封闭条件设置为1% BSA、0.5% BSA、5% 脱脂乳、3% 脱脂乳各1 h,同时做不封闭对照组。底物作用时间设置为5、10、15、20 min。最适条件确定以P/N比值最大进行判定。
PN(%)=阳性孔OD450阴性孔OD450×100 (1) 1.2.3 标准曲线的建立
将标准品的浓度稀释至500、250、125、62.5、31.25、15.63、7.81 pg/mL,用优化后的ic-ELISA进行测定。横坐标为ZEN标准品浓度的对数值,纵坐标为抑制率,绘制标准曲线。
抑制率(%)=(1−竞争孔OD450非竞争孔OD450)×100 (2) 1.2.4 特异性
为确定该检测方法的特异性,对500、250、125、62.5、31.25、15.63、7.81 pg/mL的ZEN以及10000、1000、100、10、1 ng/mL的OTA、AFB1、DON、FB1、T-2标准品进行ic-ELISA检测,分别绘制标准曲线,并计算各毒素的半数抑制浓度(IC50),通过以下公式计算交叉反应率(CR)。
CR(%)=IC50(ZEN)IC50(其他毒素)×100 (3) 1.2.5 加标回收
称取4份玉米面,每份1 g,将不同浓度ZEN标准品加入到玉米面中,使玉米面ZEN含量为20、15、5、2.5 μg/kg后,加入5 mL体积分数为70%的甲醇-水溶液中,充分振荡5 min,超声5 min,室温下4000×g离心10 min,取磷酸盐缓冲液稀释20倍的上清,进行ic-ELISA检测[18]。通过以下公式计算回收率。并用试剂盒进行验证分析,绘制拟合曲线。
回收率(%)=加标后检出的ZEN含量−未加标检出的含量实际上加入ZEN的含量×100 (4) 1.2.6 方法验证分析
用本方法和北京华安麦科ZEN商品化试剂盒同时检测3份ZEN加标量为120、80、60 μg/kg的玉米面样品,每份3个重复,试剂盒检测步骤参考说明书进行操作。
1.3 数据处理
本实验中的数据均为3次平行实验结果,并采用Microsoft Excel软件进行分析。
2. 结果与分析
2.1 包被抗原与单抗的最佳工作浓度
棋盘滴定法测定的OD450结果见表1,取OD450值接近1.0所对应的抗原、单抗质量浓度[19],本着节省单抗的原则,确定抗原质量浓度为75 ng/mL,单抗质量浓度为250 ng/mL。
表 1 包被抗原和单抗最佳浓度的确定Table 1. Optimal amount of coating antigen and monoclonal antibody抗原质量浓度
(ng/mL)单抗质量浓度(ng/mL) 1000 500 250 125 62.5 31.25 0 300 2.29 2.07 1.27 0.58 0.22 0.09 0.06 150 2.29 1.87 1.26 0.50 0.20 0.09 0.07 75 1.98 1.62 1.13 0.43 0.18 0.14 0.05 37.5 1.59 1.26 0.76 0.29 0.14 0.10 0.05 18.75 1.03 0.83 0.43 0.19 0.08 0.06 0.05 9.375 0.67 0.41 0.24 0.12 0.08 0.05 0.05 4.6875 0.30 0.22 0.15 0.07 0.06 0.05 0.05 2.2 包被条件、封闭条件和底物作用时间的确定
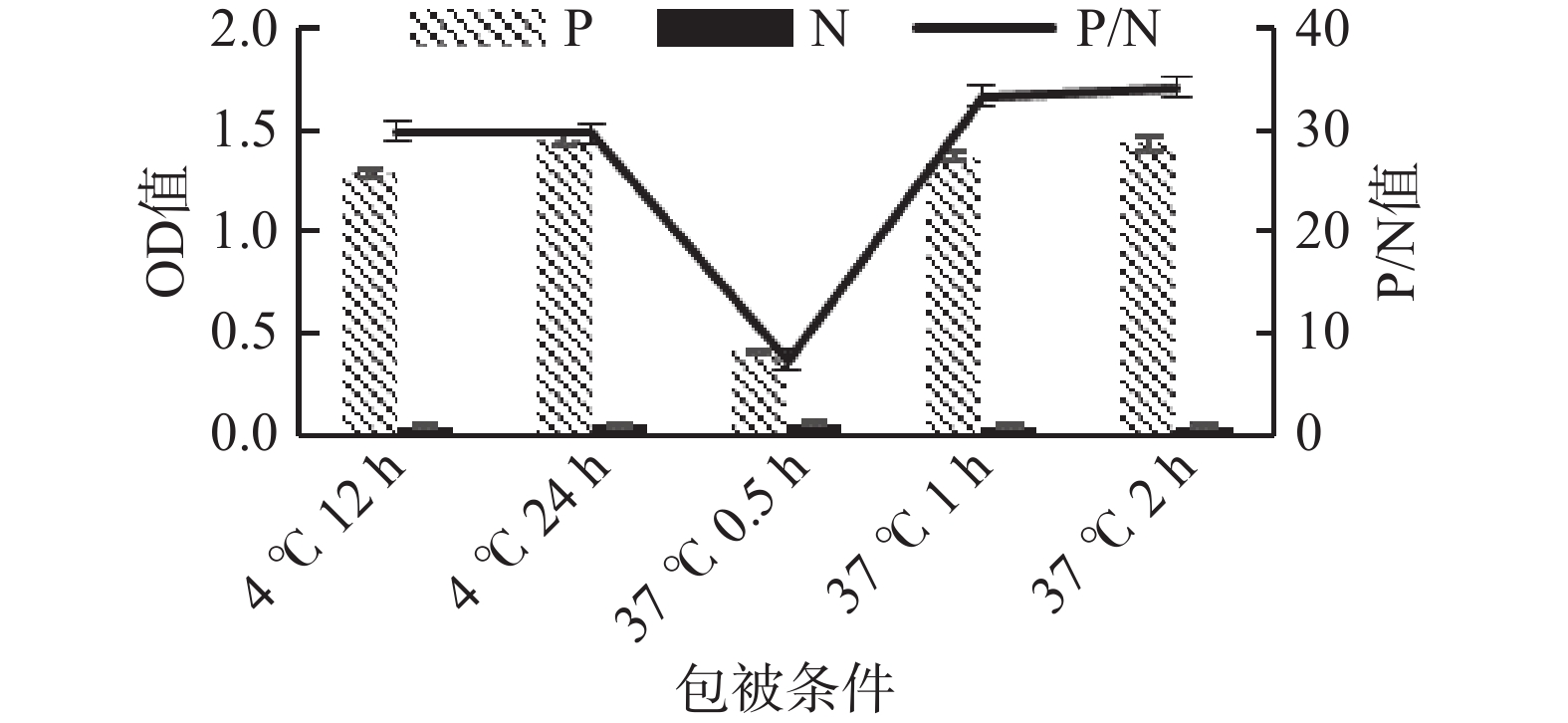
包被条件与P/N值结果见图1。从图1中可以看出,4 ℃包被12和24 h的P/N值一致,37 ℃包被0.5 h P/N值较低,1和2 h的P/N值较高并接近,综合37 ℃和4 ℃两种条件下的P/N值,同时为了缩短检测所需时间,选择了37 ℃ 1 h的最佳包被条件。
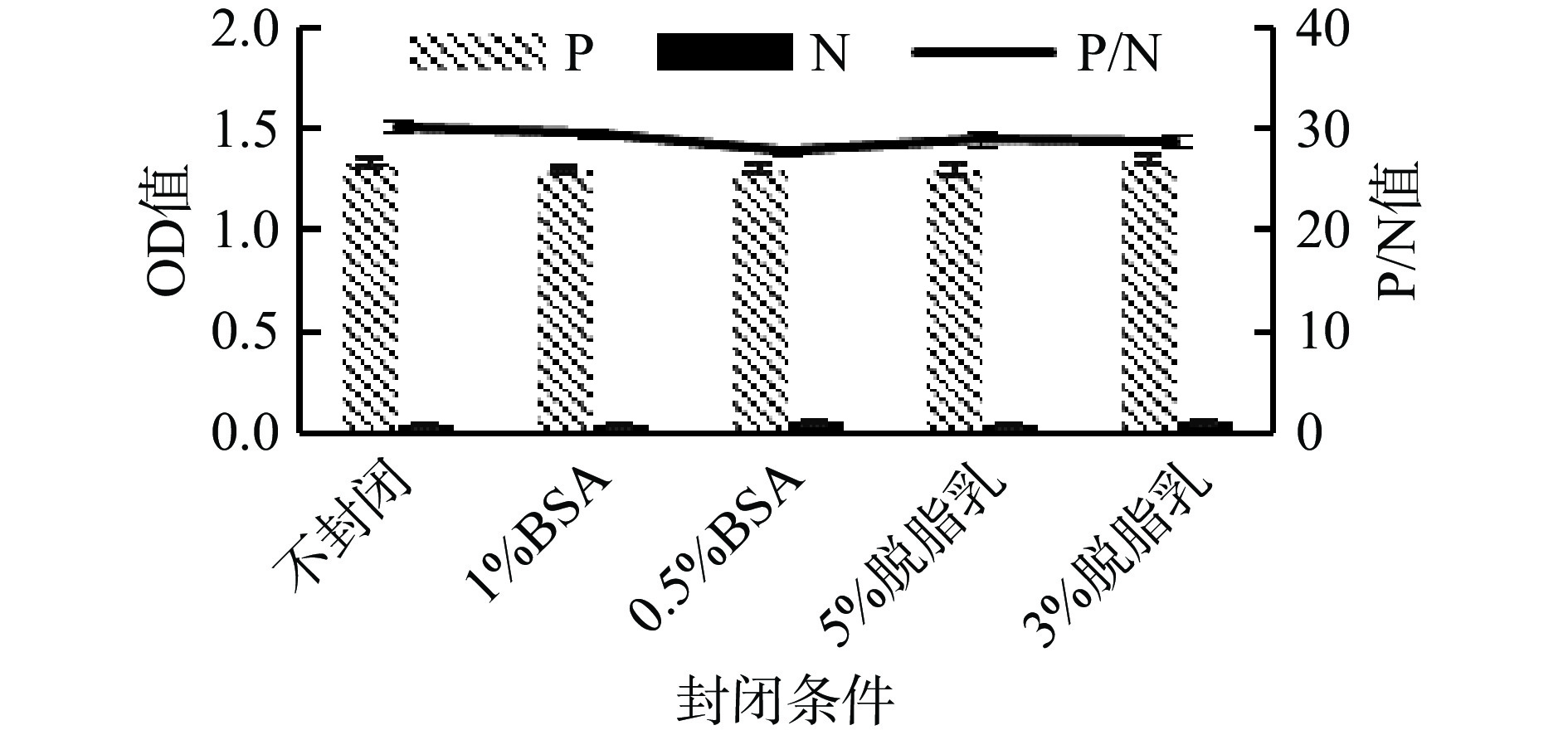
不同封闭条件与P/N值结果见图2。从图2中可以看出,不封闭和其他四种封闭P/N值之间不具有明显差异,为节省反应时间,故本方法不需要封闭。
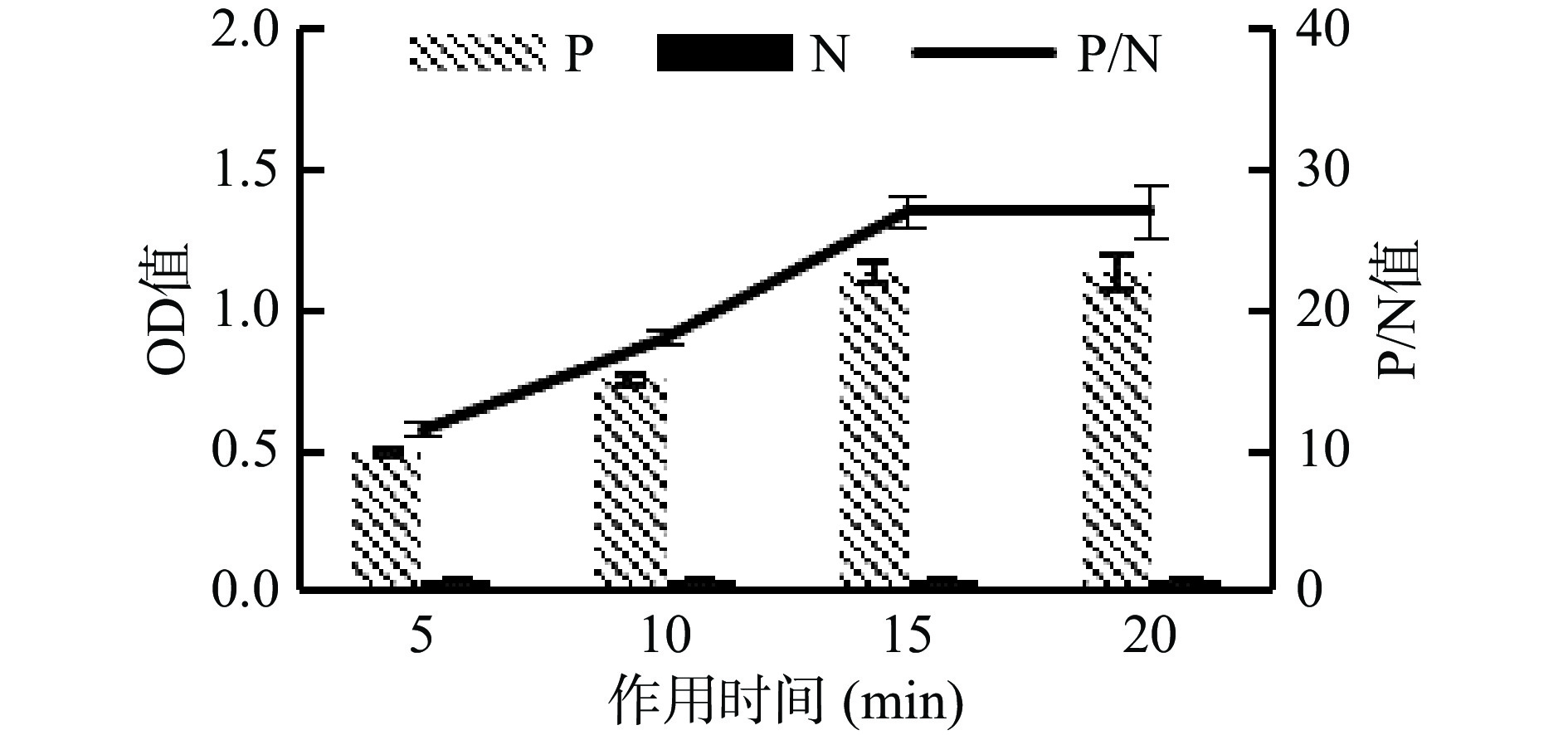
酶催化底物的反应时间与P/N值结果见图3。5~15 min,P/N值随着酶作用时间的延长而增大,在15~20 min时P/N趋于平衡。因此,选择酶催化底物的作用时间确定为15 min。
2.3 标准曲线
标准曲线如图4,以lg(ZEN的浓度)为自变量x,以抑制率的百分数为因变量y建立的曲线回归方程为:y=42.19x−23.994,R2=0.9919。线性检测范围(IC20~IC80)为11~292 pg/mL,检测限(IC10)为6 pg/mL,灵敏度(IC50)为57 pg/mL。
2.4 特异性
该方法与5种常见真菌毒素的交叉反应见表2。与OTA、AFB1、DON、FB1、T-2毒素均无交叉反应,表明本方法具有良好特异性。
表 2 单抗与其他5种真菌毒素的交叉反应率Table 2. Cross-reactivity of monoclonal antibody with 5 mycotoxins真菌毒素名称 IC50(pg/mL) CR(%) ZEN 57 100 OTA >106 <0.04 AFB1 >106 <0.04 DON >106 <0.04 FB1 >106 <0.04 T-2 >106 <0.04 2.5 回收率
玉米面ZEN加标回收实验结果见表3。从表中可以看出平均回收率为81.29%~105.80%,变异系数小于10%,建立的ic-ELISA方法可满足实际样品中ZEN的检测需要。
表 3 玉米面中添加ZEN回收率Table 3. ZEN recovery added in corn flour添加量(μg/kg) 回收率(%) 变异系数(%) 20 81.29±3.85 4.74 15 105.80±7.29 6.89 5 99.76±6.01 6.02 2.5 94.95±8.94 9.42 2.6 方法验证分析
采用ZEN商品化ELISA试剂盒和本文建立方法同时对ZEN加标样品进行验证分析,结果如图5所示:以本方法的检测值为自变量x,以商品化试剂盒的检测值为因变量y建立的曲线回归方程为y=1.0267x−1.8403,R2=0.972(相关性较好)。因此,本方法适用于在玉米面中快速筛查ZEN。
3. 结论与讨论
本实验建立的ZEN常规ic-ELISA方法灵敏度(IC50)达到了57 pg/mL,优于文献[15,20]报道的常规ELISA方法灵敏度1900 pg/mL和130 pg/mL。此外,为提高ELISA检测灵敏度,一些生物传感器被引入ELISA中[21]。Liu等[17]基于亲和素-生物素放大系统使IC50达到180 pg/mL;肖佳丽等[16]基于纳米磁珠偶联ZEN抗原和ZEN单抗双标探针使IC50达到220 pg/mL;Liu等[22]基于纳米磁珠-偶联噬菌体模拟物(替代抗原)和化学发光底物建立ZEN的磁性噬菌体化学发光酶免疫(P-MCLEIA)检测方法中IC50达到31.4 pg/mL,这些生物传感器的引入都相对于传统ELISA方法提高了灵敏度,但也增加了额外的探针制备过程和检测步骤。本实验建立的ic-ELISA方法,其灵敏度与国家标准中液相色谱-质谱法[12]相当,优于国家标准规定的荧光光度计法、高效液相法[12]、薄层色谱法和ELISA[13],能够满足玉米面中ZEN的痕量快速检测。
传统ELISA方法灵敏度主要受抗原、抗体性质决定,实验结果说明该ZEN抗体具有较好的特异性和灵敏度。后续将在前期完成ic-ELISA的基础上,开发其它快速免疫学检测方法。
-
表 1 包被抗原和单抗最佳浓度的确定
Table 1 Optimal amount of coating antigen and monoclonal antibody
抗原质量浓度
(ng/mL)单抗质量浓度(ng/mL) 1000 500 250 125 62.5 31.25 0 300 2.29 2.07 1.27 0.58 0.22 0.09 0.06 150 2.29 1.87 1.26 0.50 0.20 0.09 0.07 75 1.98 1.62 1.13 0.43 0.18 0.14 0.05 37.5 1.59 1.26 0.76 0.29 0.14 0.10 0.05 18.75 1.03 0.83 0.43 0.19 0.08 0.06 0.05 9.375 0.67 0.41 0.24 0.12 0.08 0.05 0.05 4.6875 0.30 0.22 0.15 0.07 0.06 0.05 0.05 表 2 单抗与其他5种真菌毒素的交叉反应率
Table 2 Cross-reactivity of monoclonal antibody with 5 mycotoxins
真菌毒素名称 IC50(pg/mL) CR(%) ZEN 57 100 OTA >106 <0.04 AFB1 >106 <0.04 DON >106 <0.04 FB1 >106 <0.04 T-2 >106 <0.04 表 3 玉米面中添加ZEN回收率
Table 3 ZEN recovery added in corn flour
添加量(μg/kg) 回收率(%) 变异系数(%) 20 81.29±3.85 4.74 15 105.80±7.29 6.89 5 99.76±6.01 6.02 2.5 94.95±8.94 9.42 -
[1] PLACINTA C M, D’MELLO J P F, MACDONALD A M C. A review of worldwide contamination of cereal grains and animal feed with Fusarium mycotoxins[J]. Animal Feed Science and Technology,1999,78(1):21−37.
[2] 朱风华, 陈甫, 刘文华, 等. 2017年山东省饲料原料及配合饲料霉菌毒素污染状况调查[J]. 中国畜牧杂志,2018,54(6):154−160. [ZHU F H, CHEN F, LIU W H, et al. Investigation on mycotoxin contamination of feed raw materials and compound feeds in Shandong Province in 2017[J]. Chinese Journal of Animal Husbandry,2018,54(6):154−160. [3] 朱风华, 陈甫, 徐进栋, 等. 2018年山东省饲料原料及配合饲料霉菌毒素污染状况调查[J]. 中国畜牧杂志,2019,55(8):151−156. [ZHU F H, CHEN F, XU J D, et al. Investigation on mycotoxin contamination of feed raw materials and compound feeds in Shandong Province in 2018[J]. Chinese Journal of Animal Husbandry,2019,55(8):151−156. [4] 朱风华, 朱连勤. 2019年山东省饲料原料及配合饲料主要霉菌毒素污染状况调查[J]. 中国畜牧杂志,2020,56(11):189−194. [ZHU F H, ZHU L Q. 2019 Investigation on mycotoxin contamination of feed raw materials and compound feeds in Shandong Province[J]. Chinese Journal of Animal Husbandry,2020,56(11):189−194. [5] BULLERMAN L B, BIANCHINI A. Stability of mycotoxins during food processing[J]. International Journal of Food Microbiology, 2007, 119(1–2): 140−146.
[6] HUSSEIN H S, BRASEL J M. Toxicity, metabolism, and impact of mycotoxins on humans and animals[J]. Toxicology,2001,167(2):101−134. doi: 10.1016/S0300-483X(01)00471-1
[7] CAO H, ZHI Y, XU H, et al. Zearalenone causes embryotoxicity and induces oxidative stress and apoptosis in differentiated human embryonic stem cells[J]. Toxicology in Vitro,2019,54:243−250. doi: 10.1016/j.tiv.2018.09.020
[8] WOZNY M, DOBOSZ S, HLIWA P, et al. Feed-borne exposure to zearalenone impairs reproduction of rainbow trout[J]. Aquaculture,2020,528:735522. doi: 10.1016/j.aquaculture.2020.735522
[9] WENTZEL J F, LOMBARD M J, DU PLESSIS L H, et al. Evaluation of the cytotoxic properties, gene expression profiles and secondary signalling responses of cultured cells exposed to fumonisin B1, deoxynivalenol and zearalenone mycotoxins[J]. Archives of Toxicology,2017,91(5):2265−2282. doi: 10.1007/s00204-016-1872-y
[10] 尚艳娥, 杨卫民. CAC、欧盟、美国与中国粮食中真菌毒素限量标准的差异分析[J]. 食品科学技术学报,2019,37(1):10−15. [SHANG Y E, YANG W M. Analysis of difference of limit standard of mycotoxin in grain of CAC, EU, USA and China[J]. Journal of Food Science and Technology,2019,37(1):10−15. doi: 10.3969/j.issn.2095-6002.2019.01.002 [11] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 2761-2017 食品安全国家标准 食品中真菌毒素限量[S]. 北京: 中国标准出版社, 2017 National Health and Family Planning Commission of the People's Republic of China, The State Food and Drug Administration. GB 2761-2017 National Standard for Food Safety. Limit of Mycotoxin in Food[S]. Beijing: China Standards Press, 2017.
[12] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.209-2016 食品安全国家标准 食品中玉米赤霉烯酮的测定[S]. 北京: 中国标准出版社, 2016 National Health and Family Planning Commission of the People's Republic of China, The State Food and Drug Administration. GB 5009.209-2016 National Standard for Food Safety. Determination of zearalenone in Food[S]. Beijing: China Standards Press, 2016.
[13] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 19540-2004 饲料中玉米赤霉烯酮的测定[S]. 北京: 中国标准出版社, 2004 General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China .GB/T 19540-2004 Determination of zearalenone in feed[S]. Beijing: China Standards Press, 2004.
[14] 宋卫得, 苏征, 惠希东, 等. 液质联用技术在食品真菌毒素检测中的研究进展[J]. 食品工业科技, 2016, 37(17): 395-399. SONG W D, SU Z, HUI X D, et al. Science and Technology of Food Industry, 2016, 37(17): 395-399.
[15] 王元凯, 王君, 王雨晨, 等. 玉米赤霉烯酮单克隆抗体的制备及间接竞争ELISA检测方法的建立[J]. 微生物学通报,2011,38(12):1793−1800. [WANG Y K, WANG J, WANG Y C, et al. Preparation of monoclonal antibody against zearalenone and development of indirect competitive ELISA assay[J]. Microbiology Bulletin,2011,38(12):1793−1800. [16] 肖佳丽, 叶青, 方云, 等. 基于纳米磁珠和双标记抗体的玉米赤霉烯酮快速、高灵敏检测方法的建立及应用[J]. 菌物学报,2019,38(3):440−450. [XIAO J L, YE Q, FANG Y, et al. Establishment and application of a rapid and highly sensitive detection method for zearalenone based on nanometer magnetic beads and double-labeled antibody[J]. Acta Mycology,2019,38(3):440−450. [17] LIU N, NIE D, ZHAO Z, et al. Ultrasensitive immunoassays based on biotin-streptavidin amplified system for quantitative determination of family zearalenones[J]. Food Control,2015,57:202−209. doi: 10.1016/j.foodcont.2015.03.049
[18] 甄玉萍, 裴世春, 王岩, 等. 玉米样品前处理方法和掩蔽剂对ELISA检测玉米赤霉烯酮的影响[J]. 食品科学,2015,36(16):255−260. [ZHEN Y P, PEI S C, WANG Y, et al. Effects of corn sample pretreatment and masking agent on detection of zearalenone by ELISA[J]. Food Science,2015,36(16):255−260. doi: 10.7506/spkx1002-6630-201516049 [19] WANG X, CHEN F, WAN P J, et al. Development of monoclonal antibody-based enzyme-linked immunosorbent assay for gossypol analysis in cottonseed meals[J]. Journal of Agricultural and Food Chemistry,2004,52(26):7793−7797. doi: 10.1021/jf049071y
[20] 刘琦, 生威, 李志, 等. 基于单克隆抗体的玉米赤霉烯酮检测方法研究[J]. 食品研究与开发, 2017, 38(21): 111−115 LIU Q, SHENG W, LI Z, et al. Food Research and Development, 2017, 38(21): 111−115.
[21] 冯林, 陈雪岚. 新型纳米材料与噬菌体展示技术在真菌毒素检测中的应用[J]. 食品与发酵工业: 1-8 FENG L, CHEN X L. Application of novel nanomaterials and phage display technology in mycotoxin detection[J]. Food and Fermentation Industries: 1-8.
[22] LIU R, SHI R, ZOU W, et al. Highly sensitive phage-magnetic-chemiluminescent enzyme immunoassay for determination of zearalenone[J]. Food Chemistry,2020,325:126905. doi: 10.1016/j.foodchem.2020.126905
-
期刊类型引用(5)
1. 陈晨,陶泽,王可,李晴晴,安红玉,卢增慧,李拖平,李苏红. 实时荧光环介导等温扩增快速检测黄曲霉毒素产生菌方法的建立. 食品与发酵工业. 2025(04): 335-344 .  百度学术
百度学术
2. 陈冠果,李可,陆金虎,金晨晨,王龑,帅江冰,鲍维琪,程昌勇,宋厚辉,张晓峰. 产黄曲霉毒素真菌双重荧光定量PCR检测技术的建立与应用. 中国粮油学报. 2024(02): 188-195 .  百度学术
百度学术
3. 金萍,丁洪流,金晓红,沈麒亮,范春燕. 纳米抗体在食品小分子污染物检测中的研究应用. 食品与机械. 2023(02): 236-240 .  百度学术
百度学术
4. 牛灿杰,叶素丹,胡玉霞,周晓红. 谷物及制品中真菌毒素前处理及检测技术研究进展. 食品与机械. 2023(05): 203-210+240 .  百度学术
百度学术
5. 邢广旭,邢云瑞,孙亚宁,范璐,张改平. 玉米赤霉烯酮荧光免疫层析快速检测方法的研究. 畜牧与兽医. 2022(08): 105-109 .  百度学术
百度学术
其他类型引用(4)









 下载:
下载:


 下载:
下载:



