Protective Effect and Its Mechanism Analysis of Baihe Wuyao Decoction on Treatment of Type 1 Diabetes Mellitus and Associated Hepatic Injury
-
摘要: 目的:考察百合乌药汤(Baihe Wuyao decoction,BWD)对小鼠1型糖尿病(Type 1 diabetes mellitus,T1DM)并发肝损伤的保护作用,并揭示其潜在机制。方法:小鼠70只,随机选取10只作为空白组,其余采用腹腔注射链脲佐菌素(Streptozotocin,STZ)诱导T1DM,成模后随机分为6组:模型组、阳性对照组、BWD各剂量组(15、5、2.5、1.25 g·kg−1·d−1)。各组小鼠连续给药6周。检测小鼠血清中谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)的含量,及肝组织匀浆超氧化物歧化酶(Superoxidedismutase,SOD)和丙二醛(Malonaldehyde,MDA)的含量;观察小鼠肝脏病理学变化;检测小鼠肝脏中蛋白激酶B(Protein kinase B,AKT)在蛋白水平的表达,检测锰超氧化物歧化酶(Manganese superoxide dismutase,Mn-SOD)和一氧化氮合酶(Inducible nitric oxide synthase,iNOS)、炎症因子包括肿瘤坏死因子(Tumor necrosis factor,TNF-α)、核因子-κB(Nuclear factor-κB,NF-κB)、白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素-6(Interleukin-6,IL-6)和白细胞介素-8(Interleukin-8,IL-8)、凋亡因子包括(B-cell lymphoma-2,Bcl2)、(Bcl2-associated X protein,Bax)和(Caspase 3,CASP3)在mRNA水平的表达。结果:BWD可改善T1DM小鼠肝组织病理损伤;与模型组相比,各剂量组ALT和AST水平均显著降低(P<0.01或P<0.05),低1剂量组效果更明显;BWD低1剂量可显著上调p-AKT/AKT(P<0.05);低1剂量显著下调MDA、iNOS,上调SOD、Mn-SOD含量(P<0.01或P<0.05);与模型组相比,低1剂量的Bcl2/Bax比值明显增加,Bax、CASP3被下调;低1剂量显著降低TNF-α、NF-κB、IL-1β、IL-6和IL-8在基因水平的表达(P<0.01或P<0.05)。结论:BWD可通过抗炎、抗氧化、抗凋亡、促进细胞增殖以及改善胰岛素信号通路发挥对T1DM并发肝损伤的保护作用。Abstract: Objective: To investigate the protective effect of Baihe Wuyao decoction (BWD) on mice with type 1 diabetes mellitus (T1DM) and liver damage, and to reveal its underlying mechanism. Methods: Ten of 70 mice were randomly selected as the blank group, and the rest were induced with intra-peritoneally (ip) streptozotocin (STZ) to induce T1DM. After successful modeling, the mice were randomly divided into 6 groups: Model group, positive control group and BWD groups (15, 5, 2.5, 1.25 g·kg−1·d−1). The mice in each group were given continuous administration for 6 weeks. The contents of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in the serum of mice were measured, and the contents of superoxidedismutase (SOD) and malonaldehyde (MDA) in liver tissue homogenate were detected. The pathological changes of mouse liver were observed. The expression of Protein kinase B (AKT) in mouse liver was detected, the mRNA level of manganese superoxide dismutase (Mn-SOD) and nitric oxide synthase (iNOS), inflammatory factors including tumor necrosis factor (TNF-α), nuclear factor-κB (NF-κB), interleukin-1β (IL-1β), interleukin-6 (IL-6), interleukin-8 (IL-8), apoptosis factors including B-cell lymphoma-2 (Bcl2), Bcl2-associated X protein (Bax), Caspase 3 (CASP3) were measured. Results: BWD exhibited a good hepatic protection with ameliorating hepatic pathological morphology in T1DM mice. Compared with the model group, the levels of ALT and AST in each dose group were significantly reduced (P<0.01, P<0.05), and the effect of the low 1 dose group was more obvious. The low 1 dose of BWD could significantly up-regulate p-AKT/AKT(P<0.05), low dose 1 could significantly down-regulate MDA, iNOS, and up-regulate SOD and Mn-SOD content(P<0.01, P<0.05). Comparing with the model group, the ratio of Bcl2/Bax at the low dose increased significantly, Bax and CASP3 were down-regulated, the low dose significantly reduced the expression of TNF-α, NF-κB, IL-1β, IL-6 and IL-8 at the gene level (P<0.01, P<0.05). Conclusion: The BWD would have a good hepatic protective effect during T1DM, which underlying mechanisms through improving insulin resistance and suppresses oxidative stress, apoptosis, inflammation and promotion of cell proliferation.
-
Keywords:
- liver injury /
- inflammation /
- mechanism /
- Baihe Wuyao decoction
-
糖尿病是一种以高血糖为主要临床特征的代谢性疾病,其发病机制与人口老龄化、肥胖、遗传因素及不当的生活方式等多种因素密切相关[1-2]。我国糖尿病患者已有1.14亿之多,已成为世界上的糖尿病大国[3-4]。糖尿病患者的血糖若长期控制不好,会出现血管、心、肝、肾及眼病等多器官并发症[5]。其中,糖尿病并发的肝脏损伤一般由于血糖、脂肪、蛋白质或水电解质紊乱引发炎症和氧化应激反应等,进而导致肝功能及肝脏糖脂代谢异常[6-8],临床上若糖尿病患者不能很好控制血糖,会诱发肝脏损伤甚至发展成肝硬化或肝癌。但目前还没有针对糖尿病并发肝损伤的特效药物[9-10],如何防治糖尿病及其肝脏并发症仍是医学难题。
百合乌药汤(Baihe Wuyao Decoction, BWD)由百合和乌药组成,配比10:3,始载于清代陈修园所著的《医学三字经》,主用于治疗浅表性胃炎[11]。百合是一种药食同源的中药,《中国药典》2020年版规定的百合为百合科植物卷丹Lilium lancifolium Thunb.、百合Lilium brownii F.E.Brown var. Viridulum Baker或细叶百合Lilium pumilum DC.的干燥肉质鳞叶,百合养阴润肺,清心安神。用于阴虚燥咳、劳嗽咳血、虚烦惊悸、失眠多梦、精神恍惚[12]。乌药始载于唐代《本草拾遗》,是一种传统的理气中药,《中国药典》2020年版规定乌药为樟科植物乌药Lindera aggregata(Sims)Kos-term.的干燥块根,功能与主治包括行气止痛,温肾散寒。用于寒凝气滞、胸腹胀痛、气逆喘急、膀胱虚冷、遗尿尿频、疝气疼痛、经寒腹痛[12]。为确定大剂量食用乌药是否存在安全隐患,根据《保健食品安全性毒理学评价程序和检验方法规范》的要求,有学者[13-14]对乌药进行了系列毒理试验,实验结果发现:乌药经口LD50>10.0 g/kg体重,微核试验、精子畸形试验、Ames试验均表现为阴性,因此得出实验结论:乌药属实际无毒,无致突变性。现代研究表明,百合及乌药具有保肝、降胆固醇和降血糖[9]、抗炎[9-10]、抗凋亡[11]和抗氧化[15-17]等作用。研究发现BWD对CCl4诱发的慢性肝损伤和肝纤维化具有很好疗效[18],但BWD对1型糖尿病(Type 1 diabetes mellitus, T1DM)及其并发的肝损伤是否具有保护作用尚无报道。
本研究采用STZ诱导小鼠T1DM并发肝损伤后,考察BWD对肝功能指标、肝组织中抗氧化指标、炎症因子和胰岛素信号通路的影响,旨在探究BWD对T1DM并发肝损伤的保护作用及其机制,以揭示T1DM并发肝损伤的病理机制,以期为进一步研发BWD的保健作用奠定基础。
1. 材料与方法
1.1 材料与仪器
百合、乌药 中国唐山唐人药业有限公司,由公司专人进行质检,确保中药饮片质量符合规范。采用传统水提法[19],按照10:3的质量比例称重百合与乌药,将药材置于容器内,加入药材质量8倍量的蒸馏水浸泡40 min,完成浸泡后煎煮1 h,滤过,药材残渣再加入原药材质量4倍量的蒸馏水煎煮1 h,再次滤过后,合并两次滤液。使用旋转蒸发仪将药液浓缩,制备浓度分别为2.7、0.9、0.45和0.23 g·mL−1的BWD;SPF级雄性昆明小鼠 6~8周龄,70只,体质量(20±2)g,购自北京华阜康生物科技有限公司,许可证号:SCXK(京)2014~0004;胰岛素注射液 江苏万邦生化医药股份有限公司;链脲佐菌素Streptozotocin(STZ) Cayman公司;0.1 mol·L−1柠檬酸钠缓冲溶液 Beijing Solarbbio Science & Technology Co.,Ltd.;天冬氨酸氨基转移酶测定试剂盒、丙氨酸氨基转移酶测定试剂盒 北京瑞正善达生物工程技术有限公司;胰岛素ELISA检测试剂盒 南京建成生物工程研究所;Trizol试剂 Invitrogen公司;Promega GoScript反转录试剂盒 Promega公司;PCR引物 Sangon Biotech(中国分公司)。
VORTE X-5多功能酶标仪 美国伯图腾仪器有限责任公司;G560E全自动生化分析仪 德国罗氏制药有限公司;Image Lab4.1 software q-PCR仪 Applied biosysterns英国;BX53F显微镜 日本OLYMPUS公司。
1.2 实验方法
1.2.1 动物实验分组
昆明小鼠70只随机分成空白组,模型组,阳性对照组,BWD高、中、低1和低2剂量组,剂量分别为15、5、2.5、1.25 g·kg−1·d−1,每组10只小鼠。
1.2.2 造模及处理
小鼠经适应性饲养1周后,禁食不禁水12 h。然后,除空白组外,其余各组小鼠按60 mg·kg−1 ip STZ溶液(STZ溶于0.1 mol·L−1柠檬酸缓冲液中,pH4.5,现配现用)[20],空白组小鼠同法注射柠檬酸缓冲液(10 mL·kg−1)。5 d后,禁食6 h,尾尖采血测血糖,血糖高于16.7 mmol·L−1的小鼠视为造模成功,用于后期实验。其中,阳性对照组小鼠皮下注射胰岛素(0.091 U·kg−1),每天两次;BWD的高、中、低1和低2剂量组分别灌胃15、5、2.5和1.25 g·kg−1·d-1的BWD;空白组和模型组每天同法灌胃蒸馏水。连续给药6周,每2周检测小鼠血糖和体质量,给药结束时,小鼠禁食12 h,然后被处死,同时收集血清和肝脏组织冻存于−80 ℃备用。
1.2.3 血清ALT和AST含量检测
血清ALT和AST水平采用全自动生化分析仪,根据试剂盒说明书检测。
1.2.4 肝组织中的SOD和MDA含量检测
取肝组织研磨,用生理盐水稀释后,按照试剂盒说明书检测小鼠肝组织中的SOD和MDA含量。
1.2.5 检测肝脏炎症因子、凋亡因子、抗氧化指标以及转录因子等基因mRNA表达
取肝组织利用trizol等试剂提取RNA后,采用Promega GoScript反转录试剂盒将RNA逆转录成cDNA,以β-actin为内参[18,21],通过Real-time PCR检测肝脏组织炎症相关因子(包括TNF-α、NF-κB 、IL-1β、IL-6和IL-8)、凋亡因子(包括Bcl2、Bax和CASP3)、氧化应激相关因子Mn-SOD和iNOS在mRNA水平的表达,PCR引物序列见表1。
表 1 引物序列Table 1. Primer sequences基因 上游引物 下游引物 IL-1β 5’-GTTCCCATTAGACAACTGC-3’ 5’-GATTCTTTCCTTTGAGGC-3’ IL-6 5’-GGCAATTCTGATTGTATG-3’ 5’-GACTCTGGCTTTGTCTTT-3’ IL-8 5’-GGGCTGCATCTAAAGTAAATGG-3’ 5’-CAGAACACTGCTGTAGAAGGTA-3’ NF-κB 5’-CAAAGACAAAGAGGAAGTGCAA-3’ 5’-GATGGAATGTAATCCCACCGTA-3’ Mn-SOD 5’-GTCAGACCTGACTATCTGAAAG-3’ 5’-CTGCAATGCTCTACACTACTAT-3’ iNOS 5’-CAGCTGGGCTGTACAAACCTT-3’ 5’-CATTGGAAGTGAAGCGTTTCG-3’ TNF-α 5’-CTCTTCTCATTCCTGCTTG-3’ 5’-CTCCACTTGGTGGTTTGCT-3’ Bcl2 5’-GATGACTTCTCTCGTCGATAC-3’ 5’-GAACTCAAAGAAGGCCACAATC-3’ Bax 5’-TTGCCCTCTTCTACTTTGCTAG-3’ 5’-CCATGATGGTTCTGATCAGCTC-3’ CASP3 5’-GAAACTCTTCATCATTCAGGCC-3’ 5’-GCGAGTGAGAATGTGCATAAAT-3’ β-actin 5’-CTAAGGCCAACCGTGAAAAG-3’ 5’-ACCAGAGGCATACAGGGACA-3’ 1.2.6 检测肝脏胰岛素信号通路AKT的表达
剪取100 mg肝组织,经研磨,提取蛋白,Bradford法测定蛋白浓度后进行Western-blot分别检测p-AKT和AKT在蛋白水平的表达,并以α-tubulin为内参[18,21],用Image J软件分析目的条带灰度值,并计算其相对表达量。
1.3 数据处理
应用SPSS 19.0统计学软件进行数据分析,所有数据均以均数±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用Dunet t检验,以P<0.05为具有统计学意义,P<0.01代表有极显著性统计学意义。
2. 结果与分析
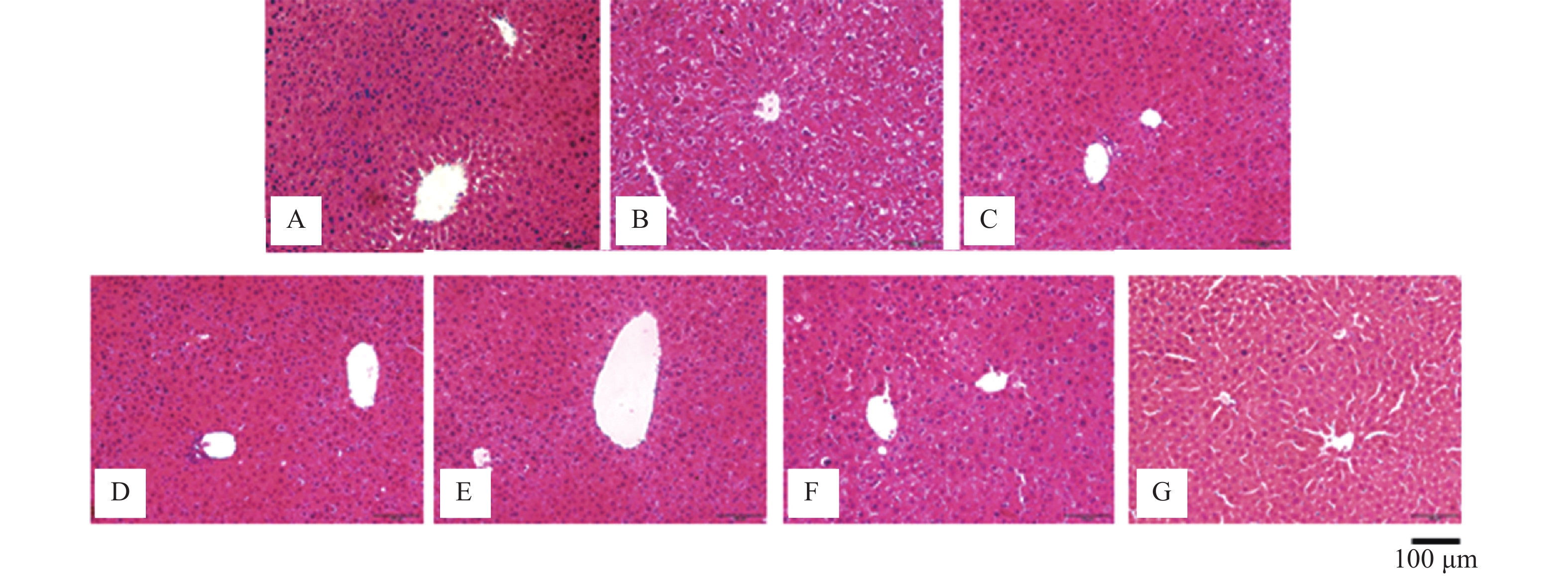
2.1 BWD对T1DM小鼠的肝脏组织形态的影响
在显微镜下观察HE染色状态下的小鼠肝脏组织形态,空白组小鼠的肝细胞排列紧实,结构完整;模型组小鼠的肝细胞排列疏松、肿胀,存在气球样变性。BWD干预后,小鼠肝脏有不同程度的恢复。BWD高剂量组小鼠肝脏的肝细胞排列较为紧密,结构较完整,有极少量空泡;BWD中剂量组小鼠肝脏的肝细胞排列更加紧密,结构更加完整;BWD低1剂量组小鼠肝脏的肝细胞排列和结构的恢复程度次于前两个给药剂量,BWD低2剂量组小鼠肝脏的病理状态也得到改善,程度次于前三个给药剂量组。由此可见,BWD对T1DM小鼠并发的肝损伤具有保护作用(见图1)。
2.2 BWD对T1DM小鼠肝功能的影响
BWD对T1DM小鼠肝功能的影响见图2,与空白组相比,模型组小鼠血清ALT和AST极显著升高(P<0.01),提示小鼠肝功能受损;与模型组相比,BWD各剂量组可不同程度的改善小鼠血清ALT和AST水平,BWD高剂量可降低小鼠血清ALT和AST水平(P<0.05),BWD中剂量也可降低小鼠血清ALT和AST水平(P<0.05)且作用效果优于BWD高剂量组,BWD低1剂量和低2剂量均可降低小鼠血清ALT和AST水平(P<0.01或P<0.05);与空白组相比,BWD低1剂量的ALT没有明显差异,BWD低2剂量AST和ALT均没有明显差异,说明其恢复至正常水平。结合HE染色结果,可以得出BWD对T1DM小鼠并发肝损伤具有改善作用,综合来看,BWD低1剂量组药效较好,因此,后续实验选用BWD低1剂量组进行探讨。
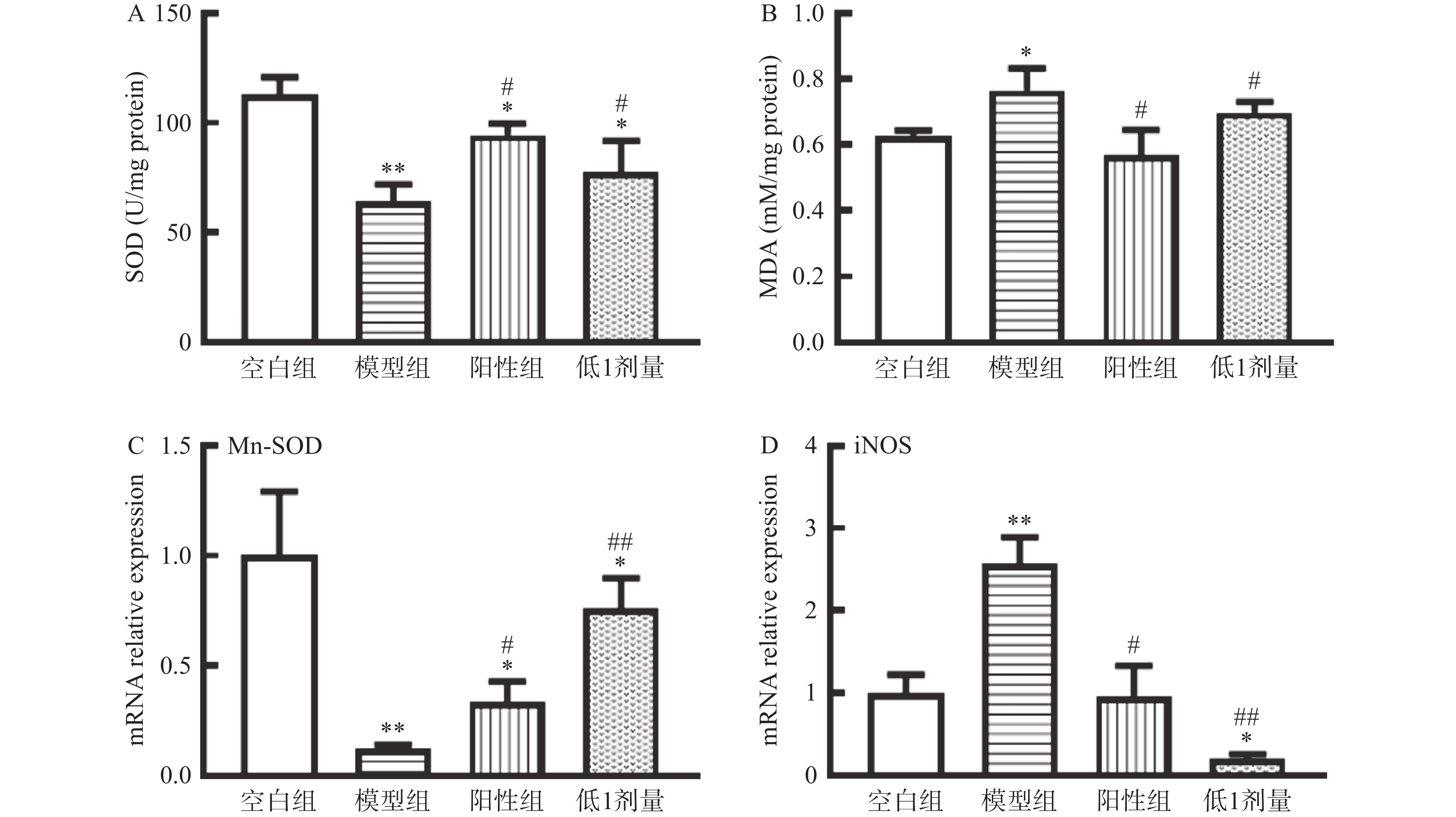
2.3 BWD对T1DM小鼠肝脏抗氧化能力的影响
与空白组相比,模型组小鼠肝脏匀浆中SOD水平明显降低,而MDA水平显著升高(P<0.05);表明小鼠受到STZ刺激后,抗氧化能力降低。与模型组相比,BWD低1剂量组小鼠肝脏中SOD水平升高(P<0.05),MDA水平下降(P<0.05)。与空白组相比,模型组小鼠肝脏中的Mn-SOD在mRNA水平的表达降低,iNOS在mRNA水平的表达升高,在RNA水平验证了小鼠抗氧化能力降低。BWD低1剂量可上调肝脏中Mn-SOD的表达,下调iNOS的表达(见图3)。表明BWD低1剂量可增强T1DM小鼠肝脏的抗氧化能力。
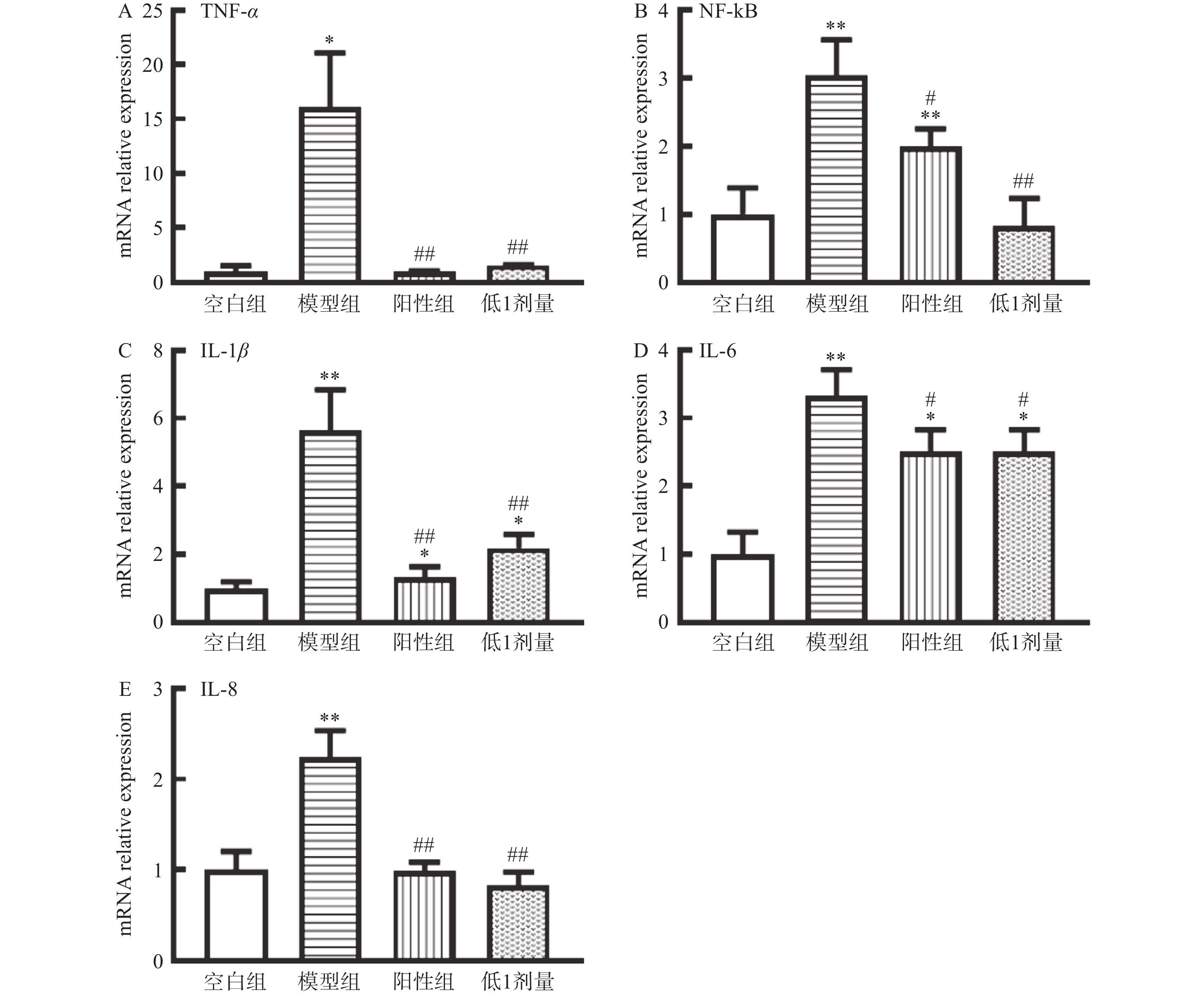
2.4 BWD对T1DM小鼠肝脏中多种炎症因子基因的影响
与空白组小鼠相比,模型组小鼠肝脏中的炎症因子TNF-α、NF-κB、IL-1β、IL-6和IL-8在mRNA水平的表达均被上调;与模型组相比,BWD低1剂量显著降低(P<0.01或P<0.05)以上各炎症因子mRNA水平的表达(图4)。揭示BWD低1剂量对T1DM小鼠肝脏具有良好的抗炎作用。
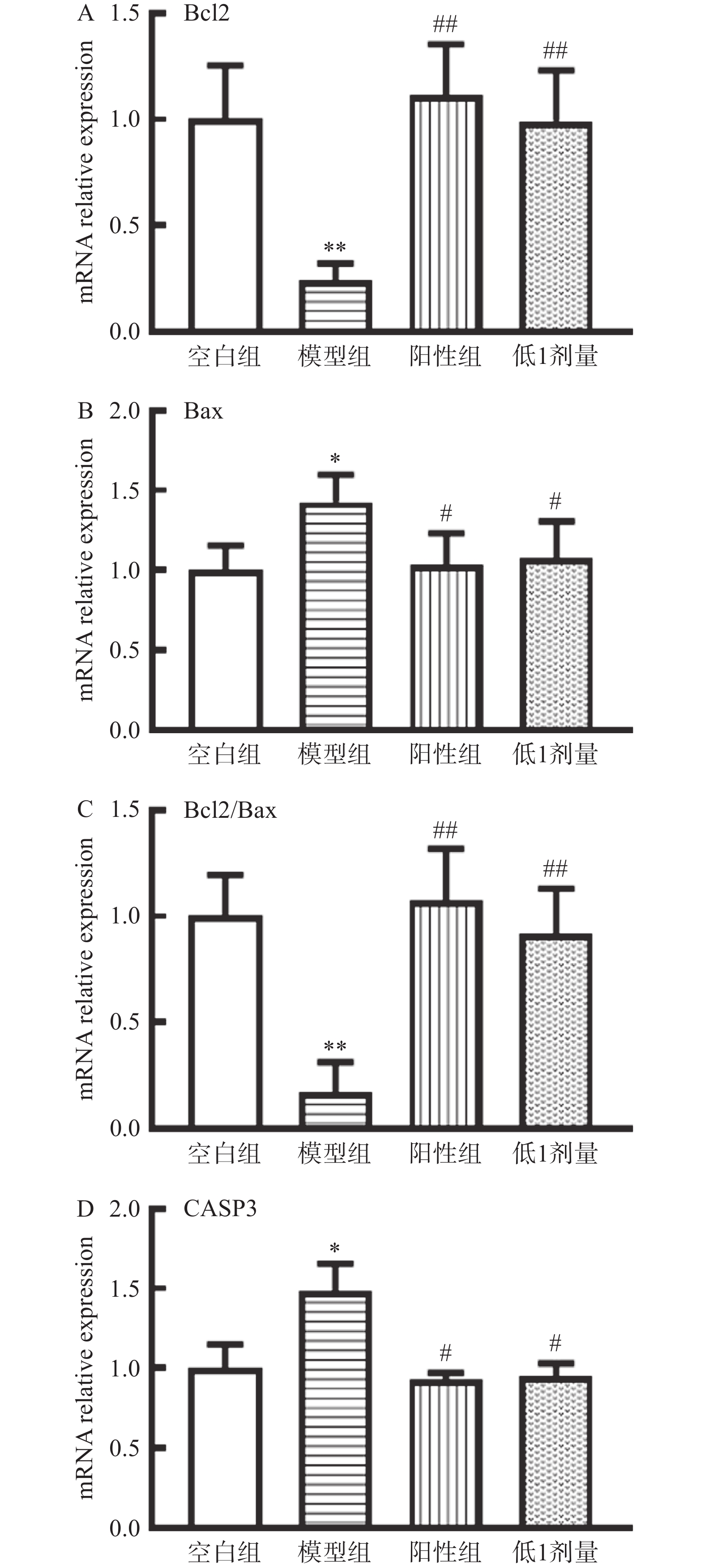
2.5 BWD对T1DM小鼠肝脏中凋亡因子的影响
当肝脏发生肝损伤时,也会存在细胞凋亡与细胞增殖异常活动,因此采用Q-PCR检测Bcl2、Bax、CASP3在mRNA水平的表达情况。如图5所示,与空白组相比,模型组小鼠肝脏Bcl2的基因表达升高,而Bax和CASP3的表达下降,Bcl2/Bax的比例降低,表明在模型小鼠肝脏中细胞凋亡受到抑制。与模型组相比,BWD低1剂量组小鼠肝脏的Bcl2/Bax的比例增加,而CASP3的表达被下调,表明BWD低1剂量可抑制T1DM小鼠肝脏的细胞凋亡。
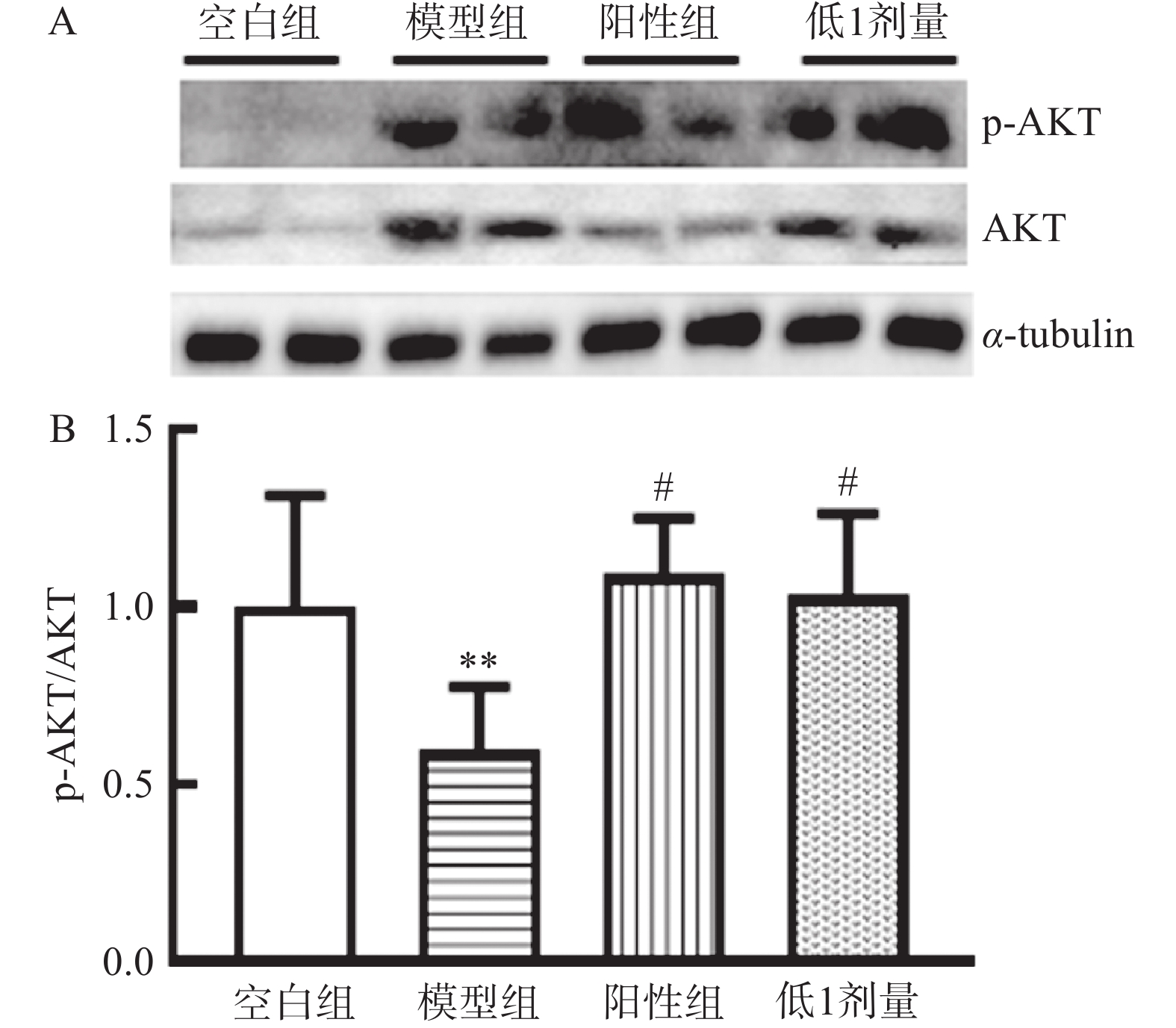
2.6 BWD对T1DM小鼠肝脏中AKT信号通路的影响
为探讨BWD对T1DM小鼠并发肝损伤的改善作用是否与胰岛素的AKT信号通路有关,进一步检测了p-AKT和AKT在蛋白水平的表达(图6)。与空白组相比,模型组小鼠肝脏中p-AKT/AKT的比值明显降低,表明胰岛素信号通路减弱。而与模型组相比,BWD低1剂量组小鼠肝脏中p-AKT/AKT的比值升高。表明BWD低1剂量可通过影响AKT改善胰岛素信号通路保护T1DM小鼠的肝脏。
3. 讨论
本研究发现BWD可缓解T1DM小鼠血清ALT和AST水平;改善肝脏病理形态结构,表明BWD对T1DM并发的肝损伤具有较好保护作用。在T1DM发生和发展过程中存在胰岛素抵抗,而胰岛素抵抗不仅会导致糖代谢异常,还会引发脂毒性和氧化应激[22]。当脂质过氧化产生MDA等物质时,SOD可清除机体内的超氧阴离子自由基,从而保护细胞膜免受损伤,因此,SOD对机体的氧化和抗氧平衡起着重要作用。BWD低1剂量可上调肝脏组织中SOD的含量,而下调MDA。此外,BWD低1剂量可增强抗氧化参数Mn-SOD在mRNA水平的表达,并降低iNOS的表达。表明BWD低1剂量对T1DM并发的肝损伤保护作用,与抗氧化作用有关。
当糖尿病并发肝损伤时,肝细胞中NF-κB通路被激活,从而炎症因子被大量释放,进而导致炎症和氧化应激反应,造成肝细胞功能受损甚至细胞死亡[23]。BWD低1剂量可下调炎症因子:TNF-α、NF-κB、IL-1β、IL-6和IL-8在mRNA水平的表达,表明BWD低1剂量可通过抗炎作用改善T1DM并发的肝损伤。
此外,胰岛素的PI3K-AKT信号通路可调控多种生物学进程,特别是细胞增殖、细胞凋亡和糖原代谢,在多种疾病如癌症、糖尿病、心血管疾病中均会发生该信号通路的失调[24]。PI3K受到刺激时可以诱导AKT磷酸化使其激活,而AKT的激活会进一步激活其下游信号通路如NF-κB和Foxo1等,影响氧化应激和炎症反应[25-26]。在血糖升高的早期,胞核内代偿性增加的Foxo1可使胰岛素基因启动子(IPF-1/PDX-1)与增强子区的转录因子的结合增强,促进β细胞的增殖与分化,进而胰岛素会代偿性升高[27]。BWD低1剂量可使T1DM小鼠肝脏中p-AKT/AKT的比值升高,改善胰岛素抵抗,从而改善T1DM相关的肝损伤。细胞凋亡的级联反应受到Bcl2家族蛋白质的严格调控,包括促凋亡的Bax和抗凋亡因子Bcl2[28]。Bcl2通常位于线粒体的外膜上,它抑制细胞色素C释放到细胞质中,而Bax位于细胞质的,并且与Bcl2的活性相反[29]。CASP3是半胱氨酸蛋白酶家族的成员,是细胞凋亡级联反应的关键执行者[30]。CASP3被前胱天蛋白酶3裂解激活,随后介导线粒体途径细胞凋亡[31]。BWD的低1剂量在基因水平上增加了Bcl2/Bax基因表达,下调CASP3
的表达,这表明BWD的低1剂量抑制了T1DM小鼠肝脏的细胞凋亡。 综上所述,BWD以药食同源的百合作为主要原料,搭配传统理气中药乌药,对T1DM并发的肝损伤具有良好保护作用,其机制与抗炎、抗氧化和改善胰岛素抵抗有关,为进一步研发BWD奠定了基础。
-
表 1 引物序列
Table 1 Primer sequences
基因 上游引物 下游引物 IL-1β 5’-GTTCCCATTAGACAACTGC-3’ 5’-GATTCTTTCCTTTGAGGC-3’ IL-6 5’-GGCAATTCTGATTGTATG-3’ 5’-GACTCTGGCTTTGTCTTT-3’ IL-8 5’-GGGCTGCATCTAAAGTAAATGG-3’ 5’-CAGAACACTGCTGTAGAAGGTA-3’ NF-κB 5’-CAAAGACAAAGAGGAAGTGCAA-3’ 5’-GATGGAATGTAATCCCACCGTA-3’ Mn-SOD 5’-GTCAGACCTGACTATCTGAAAG-3’ 5’-CTGCAATGCTCTACACTACTAT-3’ iNOS 5’-CAGCTGGGCTGTACAAACCTT-3’ 5’-CATTGGAAGTGAAGCGTTTCG-3’ TNF-α 5’-CTCTTCTCATTCCTGCTTG-3’ 5’-CTCCACTTGGTGGTTTGCT-3’ Bcl2 5’-GATGACTTCTCTCGTCGATAC-3’ 5’-GAACTCAAAGAAGGCCACAATC-3’ Bax 5’-TTGCCCTCTTCTACTTTGCTAG-3’ 5’-CCATGATGGTTCTGATCAGCTC-3’ CASP3 5’-GAAACTCTTCATCATTCAGGCC-3’ 5’-GCGAGTGAGAATGTGCATAAAT-3’ β-actin 5’-CTAAGGCCAACCGTGAAAAG-3’ 5’-ACCAGAGGCATACAGGGACA-3’ -
[1] LIANG T T, ZHANG Q, SUN W X, et al. Zinc treatment prevents type 1 diabetes-induced hepatic oxidative damage, endoplasmic reticulum stress, and cell death, and even prevents possible steatohepatitis in the OVE26 mouse model: Important role of metallothionein[J]. Toxicol Lett,2015,20(2):24−114.
[2] WANG W P, M JOHN, P KIMBERLY, et al. Hepatoprotective activity of easter lily(Lilium longiflorum Thunb.) bulb extracts[J]. Journal of Agricultural and Food Chemistry,2015,40(44):698−722.
[3] S VAROL, K SEDAT, S ERHAN, et al. Investigation of endoplasmic reticulum stress and sonic hedgehog pathway in diabetic liver injury in mice[J]. Life Science,2020,10(8):117−156.
[4] 罗良胜, 屈磊磊, 杨丽英, 等. 紫茉莉对高血糖模型小鼠降血糖作用研究[J]. 云南中医中药杂志,2009,30(4):51−53. [LUO L S, QU L L, YANG L Y, et al. Study on hypoglycemic effect of Mirabilis on hyperglycemia model mice[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Medica,2009,30(4):51−53. [5] 梁 燕, 王岳飞, 谢争珍, 等. 茶桑混合袋泡茶降血糖作用的实验研究[J]. 茶叶科学,2008,12(5):358−362. [LIANG Y, WANG Y F, XIE Z Z, et al. Experimental study on hypoglycemic effect of tea-mulberry mixed teabag[J]. Journal of Tea Science,2008,12(5):358−362. doi: 10.3969/j.issn.1000-369X.2008.05.008 [6] ZHANG H Y, WANG H L, ZHONG G Y, et al. Molecular mechanism and research progress on pharmacology of traditional Chinese medicine in liver injury[J]. Pharmaceutical Biology,2018,10(1):594−611.
[7] 田硕, 苗明三, 熊维政, 等. 2020年版《中国药典》(一部)药材和饮片的外用功能及应用分析[J]. 中国实验方剂学杂志,2021,27(8):161−167. [TIAN S, MIAO M S, XIONG W Z, et al. Analysis of the external function and application of medicinal materials and decoction pieces in the 2020 Chinese Pharmacopoeia (Part 1)[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27(8):161−167. [8] LUO L M, QIN L, ZHAN J H, et al. Study on effects of total saponins from Lilii Bulbus on proliferation, apoptosis, invasion and metastasis of lung cancer cells and its preliminary mechanism[J]. China Journal of Chinese Materia Medica,2018,18(22):4498−4505.
[9] 刘智衡. 百合乌药汤合平胃散加减治疗浅表性胃炎34例临床疗效观察[J]. 中医临床研究,2016,8(8):64−66. [LIU Z H. Clinical observation on 34 cases of superficial gastritis treated with Baihewuyao decoction and Pingwei powder[J]. Clinical Journal of Chinese Medicine,2016,8(8):64−66. doi: 10.3969/j.issn.1674-7860.2016.08.034 [10] QING L, A J HOON, K S BEOM, et al. Sesquiterpene lactones from the roots of Lindera strychnifolia[J]. Phytochemistry,2012,20(15):89−112.
[11] SUN X, GAO R L, XIONG Y K, et al. Antitumor and immunomodulatory effects of a water-soluble polysaccharide from Lilii Bulbus in mice[J]. Carbohydrate Polymers,2013,35(18):429−543.
[12] LUO Y B, LIU M, YAO X J, et al. Total alkaloids from Radix Linderae prevent the production of inflammatory mediators in lipopolysaccharide-stimulated RAW 264.7 cells by suppressing NF-kappaB and MAPKs activation[J]. Cytokine,2009,15(1):100−104.
[13] 邢梦雨, 田崇梅, 夏道宗. 乌药化学成分及药理作用研究进展[J]. 天然产物研究与开发,2017,29(12):2147−2151. [XING Y M, TIAN C M, XIA D Z, et al. Review on chemical constituents and pharmacological effects of Lindera aggregata Kosterm[J]. Nat Prod Res Dev,2017,29(12):2147−2151. [14] 来伟旗, 朱染枫, 陈建国, 等. 乌药的毒性研究[J]. 职业与健康,2003(12):78−80. [LAI Q W, ZHU R F, CHEN J G, et al. Study on the toxicity of Lindera aggregate (Sims) kosterm[J]. Occupation and Health,2003(12):78−80. doi: 10.3969/j.issn.1004-1257.2003.12.042 [15] EBTSAM M A, MARWA A A, DOAA H, et al. Assessment of the hepatoprotective effect of developed lipid-polymer hybrid nanoparticles(LPHNPs) encapsulating naturally extracted β-Sitosterol against CCl4 induced hepatotoxicity in rats[J]. Scientific Reports,2019,9(11):1083−1096.
[16] WANG J W, CHEN X Y, HU P Y, et al. Effects of Linderae radix extracts on a rat model of alcoholic liver injury[J]. Experimental and Therapeutic Medicine,2016,11(6):2185−2192. doi: 10.3892/etm.2016.3244
[17] GAN L S, ZHENG Y L, MO J X, et al. Sesquiterpene lactones from the root tubers of Lindera aggregata[J]. Journal of Natural Products,2009,8(8):501−1497.
[18] CHEN Y J, LI R F, HU N, et al. Baihe Wuyao decoction ameliorates CCl4-induced chronic liver injury and liver fibrosis in mice through blocking TGF-β1/Smad2/3 signaling, anti-inflammation and anti-oxidation effects[J]. Journal of Ethnopharmacology,2020,23(10):113−227.
[19] LIM D W, KIM H, LEE S J, et al. Jwa kum whan attenuates nonalcoholic fatty liver disease by modulating glucose metabolism and the insulin signaling pathway[J]. Evidence-Based Complementary and Alternative Medicine,2019:4589810.
[20] A MAHMOOD, R MOHAMMAD, M EBRAHIM, et al. Urtica dioica and Lamium album decrease glycogen synthase kinase-3 beta and increase K-Ras in diabetic rats[J]. Journal of Pharmacopuncture,2019,14(4):248−252.
[21] LIU F, ZHANG J, QIAN J, et al. Emodin alleviates CCl4-induced liver fibrosis by suppressing epithelial-mesenchymal transition and transforming growth factor-β1 in rats[J]. Molecular Medicine Reports,2018,18(3):3262−3270.
[22] B AURÈLE, E JENNIFER L. An intimate relationship between ROS and insulin signalling: Implications for antioxidant treatment of fatty liver disease[J]. International Journal of Cell Biology,2014,15(10):119−153.
[23] G RAJEEV, S MONIL, F ABUL FAIZ. Glutathione peroxidase activity in obese and nonobese diabetic patients and role of hyperglycemia in oxidative stress[J]. Journal of Mid-Life Health,2011,8(2):6−72.
[24] LIU W, JING Z T, XUE C R, et al. PI3K/AKT inhibitors aggravate death receptor-mediated hepatocyte apoptosis and liver injury[J]. Toxicology and Applied Pharmacology,2019,19(10):714−729.
[25] LIU Y E, TONG C C, TANG Y S, et al. Tanshinone IIA alleviates blast-induced inflammation, oxidative stress and apoptosis in mice partly by inhibiting the PI3K/AKT/FoxO1 signaling pathway[J]. Free Radical Biology & Medicine,2020,23(18):52−60.
[26] R FARZAD, A FERESHTEH, A AMIR, et al. Rigosertib potently protects against colitis-associated intestinal fibrosis and inflammation by regulating PI3K/AKT and NF-κB signaling pathways[J]. Life Science,2020,15(6):117−150.
[27] J Y KIM MULLER, Y J R KIM, J FAN, et al. FoxO1 deacetylation decreases fatty acid oxidation in β-cells and sustains insulin secretion in diabetes[J]. The Journal of Biological Chemistry,2016,21(19):72−101.
[28] T MOLDOVEANU, P E CZABOTAR. BAX, BAK, and BOK: A coming of age for the BCL-2 family effector proteins[J]. Cold Spring Harbor Perspectives in Biology,2020,12(4):56−60.
[29] E FRANK. BCL-2 proteins and apoptosis: Recent insights and unknowns[J]. Biochemical and Biophysical Research Communications,2018,500(1):26−34. doi: 10.1016/j.bbrc.2017.06.190
[30] AG PORTER, R U JÄNICKE. Emerging roles of caspase-3 in apoptosis[J]. Cell Death and Differentiation,1999,6(2):99−104. doi: 10.1038/sj.cdd.4400476
[31] M LÉVEILLÉ, ESTALL J L. Mitochondrial dysfunction in the transition from NASH to HCC[J]. Metabolites,2019,9(10):233. doi: 10.3390/metabo9100233
-
期刊类型引用(10)
1. 舒丽枝,时苗苗,张牧焓,卞欢,徐为民,王道营. 卟啉类化合物和游离铁对鸡胸肉肌原纤维蛋白理化特性的影响. 江苏农业学报. 2024(10): 1952-1961 .  百度学术
百度学术
2. 王晓芸,高霞,尤娟,尹涛,刘茹. 超声预处理对鲜湿鱼粉品质的影响及其作用机制. 食品科学. 2024(23): 213-220 .  百度学术
百度学术
3. 韩馨蕊,李颖,刘苗苗,范鑫,冯莉,曹云刚. 安石榴苷与焦磷酸钠对肌原纤维蛋白氧化稳定性及凝胶性能的影响. 食品科学. 2022(08): 15-21 .  百度学术
百度学术
4. 莫玲,香庆文,李晶晶,叶玉萍,赵超超. 孕哺期摄入氧化乳蛋白对子代小鼠机体氧化还原状态的影响. 食品科学技术学报. 2021(03): 122-128 .  百度学术
百度学术
5. 梁恽红,卢涵,张香美. 蛋白二、三级结构对鱼糜凝胶质构和持水力的影响及其测定方法研究进展. 东北农业大学学报. 2021(10): 87-96 .  百度学术
百度学术
6. 谢晨,熊泽语,李慧,金素莱曼,陈百科,包海蓉. 金针菇多糖对三文鱼片冻藏期间品质的影响. 食品与发酵工业. 2021(22): 178-183 .  百度学术
百度学术
7. 刘芳芳,林婉玲,李来好,吴燕燕,杨少玲,黄卉,杨贤庆,林织. 海鲈鱼糜加工及凝胶形成过程中蛋白质的变化机理. 食品科学. 2020(14): 15-22 .  百度学术
百度学术
8. 冯程,Manonose Tariro Upenyu,李志豪,王萍,余雄伟,付琴利,李述刚. 丙烯醛对籽瓜种仁蛋白质结构及凝胶特性影响研究. 食品科技. 2019(09): 66-71 .  百度学术
百度学术
9. 刁小琴,关海宁,李杨,刘丽美. 高压均质对肌原纤维蛋白乳化特性及结构的影响. 食品与发酵工业. 2019(18): 107-112 .  百度学术
百度学术
10. 郭兆斌,马纪兵,张丽,陈骋,陈立业,刘勇,韩玲,余群力. 传统风干牦牛肉加工过程中肌原纤维蛋白氧化对氨基酸的影响. 食品与发酵工业. 2019(22): 202-207+212 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:










 下载:
下载:
