Analysis on the Difference of Daohuaxiang Rice Metabolites in Different Producing Areas
-
摘要: 基于气相色谱与质谱联用(GC-MS)的代谢组学技术,对黑龙江省宁安市和五常市两个产地的水稻代谢产物与代谢差异进行研究。使用SIMCA软件和R软件对数据进行多元统计分析。结果表明,产地对稻花香水稻代谢物的数量、含量、种类及种类占比均具有影响,两产地水稻样本共定性到127个代谢物,筛选出22个差异代谢物,且发现产地对脂肪酸及其衍生物含量的影响最明显。代谢途径分析结果表明,不同产地间水稻代谢差异机制主要在于脂肪酸类物质的代谢,亚油酸、棕榈酸和富马酸是三种关键代谢物。本研究从代谢产物组成方面对不同产地的稻花香水稻代谢差异进行分析,可为水稻产地区分及农产品溯源提供理论支撑。
-
关键词:
- 产地 /
- 代谢组学 /
- 水稻 /
- 气相色谱与质谱联用(GC-MS) /
- 差异机制
Abstract: Based on the metabolomic technique of GC-MS, the metabolites and metabolic differential mechanism of rice from Ning'an and Wuchang city were studied. SIMCA and R software were used for multivariate statistical analysis of the data. The results showed that the place of production had an influence on the quantity, content, type and proportion of the metabolites of Daohuaxiang rice. A total of 127 metabolites were identified in rice samples from the two regions. A total of 22 different metabolites were screened out through the analysis of the differences between the samples from the two regions. And it was found that the origin had the most significant influence on the contents of fatty acids and their derivatives. The results of metabolic pathway analysis showed that the main mechanism of rice metabolism difference in different producing areas was the metabolism of fatty acids. Linoleic acid, palmitic acid and fumaric acid were the three key metabolites. And the difference of metabolites type and content was related to rice quality. The research analyzes the different mechanisms of rice metabolism in different producing areas from the aspect of metabolite composition, which can provide theoretical support for the regional differentiation of rice production and the traceability of agricultural products.-
Keywords:
- origin /
- metabonomics /
- rice /
- gas chromatography-mass spectrometry (GC-MS) /
- difference mechanism
-
水稻是我国主要的粮食作物,它含有丰富的营养成分和人体必需的微量元素,可满足机体健康需求[1-2]。不同的地理位置以及环境因素使得水稻品种多样、类型丰富,同时其质量品质也存在显著差异。生活水平的不断提高使得人们更加注重稻米风味及营养品质,地理标志稻米产品质优味美,虽价格较高,但供不应求。故稻米市场中频繁出现交易行为不规范的情况,违法者利用这些品牌严重损害市场秩序与原产地产品的价值,使消费者权益得不到保障,面对众多食品安全及市场问题,产地识别或溯源成为解决该问题的有效手段。
目前,应用于实际生活的溯源手段为数据编码记录技术,技术门槛不高,易于在产业中推行,但因其相关信息均可被人为更改或操纵,故仍需挖掘更真实、有效的溯源方法及手段。近年,国内外也开展了大量关于水稻产地溯源方面的研究,如采用稳定同位素技术[3-4]、近红外光谱技术[5]、矿物元素分析技术[6-7]、有机组分指纹图谱技术[8]、拉曼光谱技术[9-10]、顶空固相微萃取-气质联用技术[11-12]等进行溯源,这些方式与大米产地的气候、土壤、温度等相关的同位素组成、矿物元素含量、化学成分组成及风味特征物质等相关,而近年更关注水稻本身特性的代谢组学溯源方法逐渐成为研究热点[13-16]。产地环境对水稻的生长具有重要的影响,不同产地生长的水稻其代谢也会存在差异,最终代谢通路的终端物质则会将这些差异体现出来,水稻的代谢物就是代谢过程的终端物质。王玲[17]发现水稻种子在不同生长环境、不同传代以及转入外来基因的情况下,其代谢产物都会发生不同程度的改变,且与基因修饰的影响相比较,不同生长环境对水稻代谢物带来的影响更大。程建华等[18]对海南和武汉的转Bt基因大米进行了代谢组学研究,发现转Bt基因大米与其亲本大米中甘油和鼠李糖两种代谢物的含量存在显著性差异,产地对大米间代谢组学的差异影响要显著强于外源基因。
对水稻代谢物进行研究,可以从一个新的角度,直观地分析不同产地水稻的差异,从而为水稻及农产品的产地鉴别以及溯源提供新的研究方向。本研究基于GC-MS的代谢组学平台,以稻花香品种水稻为研究对象,通过两产地稻花香水稻在代谢物水平的差异分析, 对不同产地间水稻的品质以及代谢差异机制进行分析,为水稻产地区分及农产品溯源提供理论支撑。
1. 材料与方法
1.1 材料与仪器
稻花香水稻 采自黑龙江省宁安(NA)和五常(WC)两个地理标志稻米保护区,五常地区样品采集点分布于9个农场,宁安地区样品采集点分布于7个农场,每个保护区共采集20个糙米样品(后文图中的NA代表宁安地区样本,WC代表五常地区样本),两产地稻花香水稻施肥、浇灌水源以及耕作方式具有统一性。在大田收割前于保护范围内依据代表性采样原则,采用五点采样法进行随机采集,每个地块随机设置5个重复点,从每个位置收集1~2 kg的稻穗。将收集的稻谷样品清洗干净并风干至水分含量为14%~15%,在稻穗顶部相同的位置将稻谷脱粒,然后装入尼龙网眼袋中,实验前将样品混合均匀,水稻样品采集自2019年;吡啶(≥99.9%色谱纯)、甲醇(色谱纯) 阿拉丁试剂有限公司;2-氯苯丙氨酸(纯度98.5%)、甲氧基胺盐酸盐(纯度98%)、N,O-双(三甲基硅)三氟乙酰胺(含三甲基氯硅烷)99% BSTFA+1%TMCS 均购自麦克林试剂有限公司。
7890A/5975C GC-MS 美国Agilent公司;色谱柱HP-5ms(30 m×0.25 mm×0.25 μm) Agilent J & W Scientific公司。
1.2 实验方法
1.2.1 样品制备
样品处理方法和色谱方法参照程建华等[18]和ZHOU 等[19]的方法并略有修改。水稻种子液氮研磨后称取50 mg粉末于2 mL的EP管中,加入800 μL甲醇涡旋混匀30 s,而后置于4 ℃离心机中,12000 r/min 离心15 min,之后吸取200 μL上清液转入进样小瓶中氮气吹干。衍生化:取30 μL甲氧氨盐酸吡啶溶液至浓缩后的样品中,涡旋混匀至完全溶解,置于37 ℃恒温箱90 min,取出后加入30 μL BSTFA,置于70 ℃烘箱60 min,取出后待检测。衍生化处理后24 h内分析所有样品。
1.2.2 GC-MS检测
分析平台:Agilent 7890A/5975C GC-MS。用自动进样器进样1 µL。色谱柱为30 m的HP-5ms,色谱柱的内径为0.25 mm,膜厚为0.25 μm。采取不分流进样,进样温度为280 ℃,界面设置为250 ℃,离子源调节为230 ℃,四极杆温度调节至150 ℃。使用氦气(纯度 > 99.999%)作为载气,固定流速为2 mL/min。温度设定为:80 ℃下等温加热2 min,然后以10 ℃/min将温度升至320 ℃,最后维持320 ℃加热6 min。在注入下一个样品之前系统在80 ℃温度下平衡6 min。使用全扫描模式,扫描范围为50~550 m/z。
1.2.3 数据分析
GC-MS代谢组学数据分析由上海百趣生物医学科技有限公司进行。在R软件平台下使用XCMS软件包提取GC-MS数据并进行预处理,然后将已编辑的数据矩阵导入SIMCA软件(V14.1, Sartorius Stedim Data Analytics AB, Umea, Sweden),进行主成分分析( PCA) 和正交偏最小二乘-判别分析( OPLS-DA)等多元统计分析,之后根据学生t检验(student’s t-test)的P值(P-value)小于0.05,同时OPLS-DA模型第一主成分的变量投影重要度(variable importance in the projection, VIP)大于1,进行差异性代谢产物的筛选。
根据保留时间和质荷比(m/z),在Fiehn代谢组数据库中进行代谢物及差异代谢物的定性。对单个峰基于四分位数距对偏离值进行过滤以去除噪音,只保留单组空值不多于50%或所有组中空值不多于50%的峰面积数据,其次对原始数据中的缺失值进行模拟,数值模拟方法为最小值二分之一法进行填补,最后进行数据标准化处理,利用每个样本的总离子流进行归一化,可为代谢物进行定量。
对筛选出的差异代谢物进行KEGG[20]注释,检索出差异代谢物映射的所有通路,然后通过对差异代谢物所在通路的综合分析(包括富集分析和拓扑分析),对通路进行进一步的筛选,找到与代谢物差异相关性最高的关键通路。
2. 结果与分析
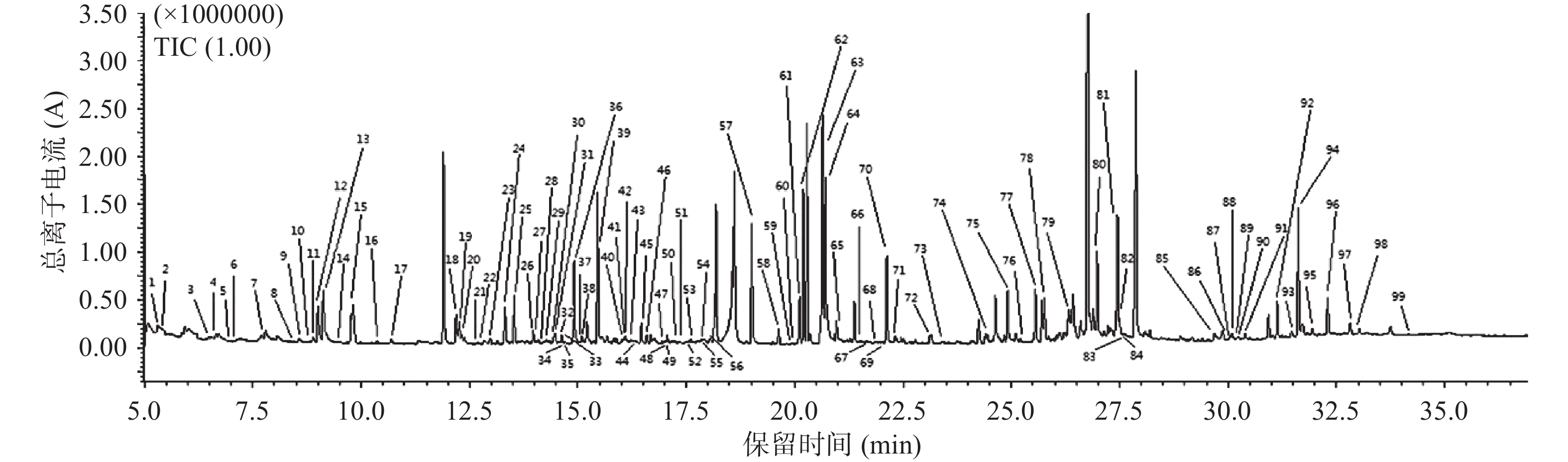
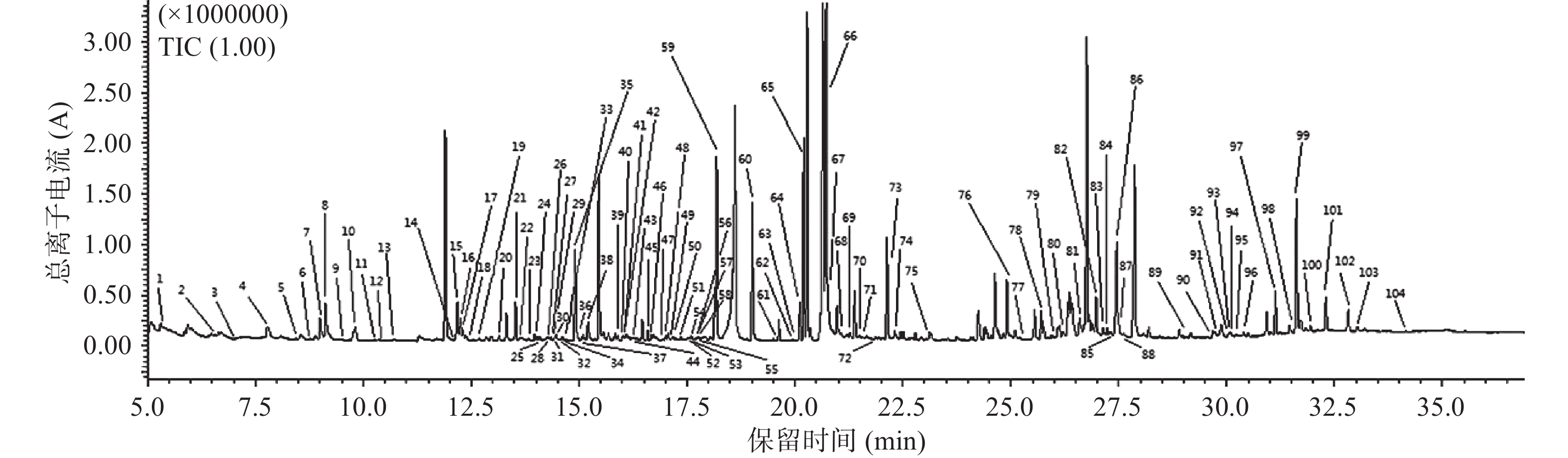
2.1 离子流色谱图
通过对GC-MS原始数据的处理,五常地区稻花香样本共检测出291个峰,宁安地区稻花香样本共检测出318个峰,两产地稻花香的离子流色谱图如图1和图2所示,两个产地间的稻花香样本的总离子流色谱图大体相近,但存在一定的差异性,色谱峰基线平稳。
2.2 代谢物定性结果分析
代谢物通过Fiehn数据库进行定性,相似度越接近1000越准确,但是组学中代谢产物多数为中间代谢产物,并不是所有物质均有标准品可依据,故存在部分代谢产物相似度不是特别高的情况。两产地共鉴定到127个代谢物,五常地区鉴定出99个代谢物,宁安地区鉴定出104个代谢物(标注见图1和图2),两产地稻花香水稻同时拥有的代谢物有76个,两产地相比较,五常地区独有的代谢物有23个,宁安地区独有的代谢物有28个。代谢物定性结果如表1所示,序号1~76为共有代谢物,序号77~99为五常地区稻花香水稻独有的代谢物,序号100~127为宁安地区稻花香水稻独有代谢物。
表 1 代谢产物定性结果Table 1. Qualitative results of metabolites序号 保留时间(min) 质核比 相似度 英文名称 中文名称 WC NA 1 5.36 119 780 hydroxylamine 羟胺 + + 2 6.53 119 769 o-toluic acid 邻甲苯甲酸 + + 3 7.17 128 818 cyclohexylamine 环己胺 + + 4 7.70 120 653 phenylalanine minor 苯丙氨酸小体 + + 5 8.53 147 880 glycerol 甘油 + + 6 8.89 141 863 cyanoalanine 氰丙氨酸 + + 7 9.10 142 410 proline 脯氨酸 + + 8 9.50 117 726 digitoxose 洋地黄糖 + + 9 9.77 148 777 benzylalcohol 苄醇 + + 10 10.40 158 721 trans-4-hydroxy-L-proline 反式-4-羟基-L-脯氨酸 + + 11 10.73 85 481 tetracosane 二十四烷 + + 12 12.32 103 763 2-monoolein 2-单油酸甘油酯 + + 13 12.55 143 599 phytol 植醇 + + 14 12.69 131 644 capric acid 癸酸 + + 15 12.96 184 535 citrulline minor 瓜氨酸微量 + + 16 13.61 145 628 diglycerol 二甘醇 + + 17 13.84 170 663 1-methyladenosine minor 1-甲基腺苷小体 + + 18 13.97 217 759 deoxypentitol 去氧戊醇 + + 19 14.24 355 731 epicatechin 1 表儿茶素1(黄烷衍生物) + + 20 14.35 129 715 2-monopalmitin 2-单软脂酸甘油酯 + + 21 14.45 129 822 cholesterol 胆固醇 + + 22 14.47 143 679 dehydroascorbic acid 2 脱氢抗坏血酸2(烯醇) + + 23 14.59 245 564 fumaric acid 富马酸 + + 24 14.60 147 882 pentonic acid 戊酸 + + 25 14.62 217 916 UDP-glucuronic acid 尿苷二磷酸葡萄糖醛酸 + + 26 14.91 97 950 myristyl myristate 肉豆蔻醇肉豆蔻酸酯 + + 27 15.21 204 940 levoglucosan 左旋葡聚糖 + + 28 15.23 365 713 1-monoolein 1-单油酸甘油酯 + + 29 16.01 217 705 xylonolactone 木内酯 + + 30 16.09 217 891 glucose-1-phosphate 葡糖-1-磷酸 + + 31 16.23 145 575 fructose 果糖 + + 32 16.29 217 588 UDP-N-acetylglucosamine 糖胺 + + 33 16.59 116 680 gluconic acid lactone 葡糖酸内酯 + + 34 16.60 85 805 1,5-anhydroglucitol 1,5-脱水葡萄糖醇 + + 35 16.94 204 817 methylhexose nist 甲基己糖NIST + + 36 17.00 217 873 ribose 核糖 + + 37 17.25 117 743 myristic acid 肉豆蔻酸 + + 38 17.42 161 593 aspartate minor 天门冬氨酸盐 + + 39 17.54 103 914 tagatose 塔格糖 + + 40 17.60 117 647 glucose overload 葡萄糖超量 + + 41 17.76 319 967 glucose 葡萄糖 + + 42 18.18 217 868 galactitol 半乳糖醇 + + 43 18.89 217 765 Unknown 未知物 + + 44 19.63 117 965 palmitic acid 棕榈酸 + + 45 19.93 355 684 epigallocatechin 表没食子儿茶素 + + 46 19.95 204 875 N-acetylgalactosamine N-乙酰半乳糖胺 + + 47 20.11 305 897 conduritol-beta-expoxide 连翘酯β-环氧丙烷 + + 48 20.29 97 596 hypoxanthine 次黄嘌呤 + + 49 20.71 97 770 d6 cholesterol D6胆固醇 + + 50 20.75 237 664 alpha-tocopherol α-生育酚 + + 51 21.51 138 857 linoleic acid 亚油酸 + + 52 21.58 117 891 oleic acid 油酸 + + 53 21.86 117 835 stearic acid 硬脂酸 + + 54 22.36 89 714 linolenic acid 亚麻酸 + + 55 24.91 89 478 2-ketoisovaleric acid 2-酮异戊酸 + + 56 25.34 371 786 1-monopalmitin 1-单罂粟碱 + + 57 25.75 361 942 sucrose 蔗糖 + + 58 26.32 361 878 1-kestose 1-蓖麻糖 + + 59 27.11 399 775 1-monostearin 1-单硬脂酸甘油酯 + + 60 27.45 95 904 squalene 角鲨烯 + + 61 27.51 204 698 cellobiose minor 纤维二糖微量 + + 62 27.62 117 492 lignoceric acid 二十四烷酸 + + 63 29.73 89 775 N-acetylmannosamine 乙酰甘露糖胺 + + 64 30.09 165 784 tocopherol acetate 醋酸生育酚 + + 65 30.11 237 720 alpha-tocopherol α-生育酚 + + 66 30.17 204 867 maltotriose 麦芽三糖 + + 67 30.22 117 366 1-deoxyerythritol 1-脱氧赤藓糖醇 + + 68 30.40 151 317 phenol 苯酚 + + 69 31.24 129 853 stigmasterol 豆甾醇 + + 70 31.65 495 489 triacontanol 三十烷醇 + + 71 31.70 129 807 beta-sitosterol β-谷甾醇 + + 72 31.96 361 900 inulotriose 菊粉三糖 + + 73 32.30 95 691 lanosterol 羊毛甾醇 + + 74 32.82 95 653 lithocholic acid 胆石酸 + + 75 33.03 136 606 chenodeoxycholic acid 去氧胆酸 + + 76 34.23 217 819 melezitose 松三糖 + + 77 5.25 126 974 N-acetylglutamate N-乙酰谷氨酸 + − 78 6.48 117 800 pentadecanoic acid 十五烷酸 + − 79 6.89 241 930 methanolphosphate 甲醇磷酸酯 + − 80 8.46 299 874 phosphate 磷酸盐 + − 81 8.57 136 727 catechol 邻苯二酚 + − 82 8.83 116 652 adrenaline 肾上腺素 + − 83 12.20 129 713 elaidic acid 反油酸 + − 84 12.38 205 577 cinnamic acid 肉桂酸 + − 85 13.32 243 769 dodecanol 十二醇 + − 86 14.70 129 516 2-monostearin 2-单硬脂酸甘油酯 + − 87 15.54 145 466 2-hydroxypentanoic acid 2-羟基戊酸 + − 88 16.09 271 649 2,4-hexadienedioic acid 1,4-己二烯二酸 + − 89 17.06 119 439 glycerol-3-galactoside 甘油-3-半乳糖苷 + − 90 17.77 117 767 galactose 半乳糖 + − 91 21.22 105 585 hippuric acid 马尿酸 + − 92 22.03 93 639 linoleic acid methyl ester 亚油酸甲酯 + − 93 22.33 204 729 piceatannol 苦味酸 + − 94 23.16 116 759 n-acetyl-5-hydroxytryptamine N-乙酰-5-羟色胺 + − 95 23.42 129 575 monomyristin 单孢菌素 + − 96 24.46 299 544 ethanolamine 乙醇胺 + − 97 25.56 217 583 4',5-dihydroxy-7-glucosyloxyflavanone 4’,5-二羟基-7-葡萄糖苷黄烷酮 + − 98 27.43 89 634 3,6-anhydro-d-hexose 3,6-脱水-D-己糖 + − 99 29.97 204 931 galactinol 5 半乳糖醇5 + − 100 8.84 116 511 alanine 丙氨酸 − + 101 10.26 355 435 succinic acid 琥珀酸 − + 102 12.18 129 653 palmitoleic acid 棕榈油酸 − + 103 12.25 129 742 zymosterol major 酵母甾醇 − + 104 12.37 185 531 2-piperidinobenzonitrile 2-哌啶苯甲腈 − + 105 12.49 103 652 xylose 木糖 − + 106 14.03 145 515 butyraldehyde 丁醛 − + 107 14.28 173 718 dehydroascorbic acid 脱氢抗坏血酸 − + 108 14.47 143 629 N-acetylaspartic acid N-乙酰天冬氨酸 − + 109 14.95 143 723 inosine 肌苷 − + 110 15.84 157 638 3-deoxyhexitol 3-脱氧己醇 − + 111 16.09 271 711 sucrose-6-phosphate 蔗糖-6-磷酸 − + 112 17.23 147 599 isohexonic acid 异己酸 − + 113 17.60 117 673 6-deoxyglucose 6-脱氧葡萄糖 − + 114 17.62 263 732 arabinose 阿拉伯糖 − + 115 17.73 318 667 conduritol-beta-epoxide minor 环戊二酸β-环氧丙烷 − + 116 17.77 204 709 beta-gentiobiose β-龙胆二糖 − + 117 21.07 204 638 digalacturonic acid 二乙酰醛酸 − + 118 21.22 105 588 arachidonic acid 花生四烯酸 − + 119 22.31 221 564 dihydrocholesterol 二氢胆固醇 − + 120 23.16 116 669 2-deoxyerythritol 2-脱氧赤藓糖醇 − + 121 25.96 131 564 glucosamine 氨基葡萄糖 − + 122 26.65 169 749 sophorose 槐甲素 − + 123 27.23 217 739 glucose 4 葡萄糖4 − + 124 27.26 217 644 6-deoxygalactofuranose 6-脱氧半乳糖呋喃糖 − + 125 27.33 85 426 cis-gondoic acid 顺式顺丁烯二酸 − + 126 29.07 204 625 lactobionic acid 乳糖酸 − + 127 29.69 117 576 cerotinic aci 角化剂ACI − + 注:“+”代表定性到该物质,“−”代表未定性到该物质。 由表1可知,从宁安和五常产地的大米中鉴定出的代谢物包括脂肪酸及其衍生物,氨基酸及其衍生物,糖类及其衍生物,固醇类和其他物质,其他类包括胺、醛、烷烃、腺苷、有机酸、无机盐、酮、烯烃、嘌呤等。从数量上看,五常产地的稻花香样品中,各种物质的比例为脂肪酸及其衍生物占22.22%,糖及其衍生物占27.27%,氨基酸及其衍生物占7.07%,醇及其衍生物占10.10%,酚类占7.07%,类固醇及其衍生物占2.02%,其他类占24.24%。宁安产地的稻花香样品中,各种物质的比例为脂肪酸及其衍生物占19.23%,糖及其衍生物占31.73%,氨基酸及其衍生物占7.69%,醇及其衍生物占10.58%。酚类占4.81%,类固醇及其衍生物占2.88%,其他类占23.08%。对比可知,五常产地的稻花香水稻中脂肪酸及其衍生物、酚类物质以及其他类物质在数量上所占的比例要高于宁安地区。宁安产地的稻花香水稻中糖类及其衍生物、氨基酸及其衍生物和固醇类物质在数量上所占的比例要高于五常地区。研究表明,氨基酸除了用于蛋白质的合成外,还是次生代谢产物(如激素和植物防御相关物质)的前体,氨基酸的合成直接或间接影响植物生长发育的各个方面[21]。糖的代谢和运输分布影响糖类进入储库细胞以及糖在储库细胞中的储存,从而影响植物材料的质量。稻米中的脂类物质(甘油脂类、游离脂肪酸、固醇类等)含量很少, 但在水稻生长发育期间的代谢变化对其生长适应性有重要影响,对植物细胞骨架重塑、生长发育、逆境胁迫、激素响应、衰老过程等具有显著的生理效应[22-24]。脂类作为稻米的重要组分,不仅具有丰富且独特的营养价值[25],而且对稻米品质尤其是蒸煮食味品质也具有较大影响[26-27],优质水稻品种中脂类物质含量通常要高于非优质的水稻品种。根据两个产地的稻花香样品中代谢产物的情况,发现同一品种的稻米在不同产地生长其代谢物数量和比例是不同的,说明产地对稻米代谢产物的种类具有较大影响,不同产地的稻米具有不同的代谢物组成。
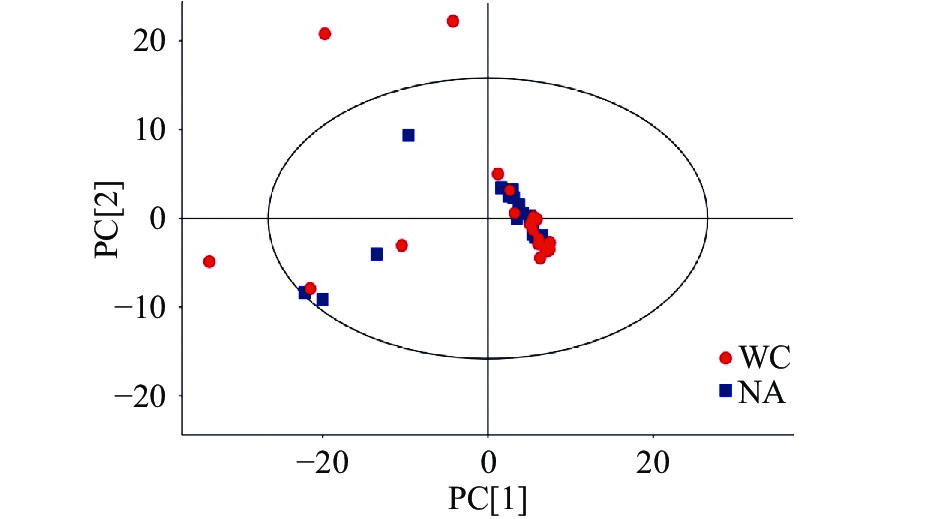
2.3 主成分分析(PCA)
主成分分析(principal component analysis, PCA) 是将一组观测的可能相关变量,通过正交变换转换为线性不相关变量(即主成分)的统计方法,可以揭示数据的内部结构,有效地利用少量的主成分使得数据的维度降低。图3为两产地稻花香样品的PCA得分图,本次分析中R2X=0.515,Q2=0.182,第一主成分贡献度为36.4%,第二主成分贡献度为29.7%。由图3可以看出,除个别异常样本外,基本处于95%置信区间(Hotelling’s T-squared ellipse)内,两产地的稻花香样本并没有区分开,存在重叠的现象,可能是由于相同品种,代谢物种类相近的原因造成的,PCA是从整体上反映样本的情况,所以区分不明显,但同样可以看出两产地的样本均存在明显的聚集区。
2.4 正交偏最小二乘法判别分析(OPLS-DA)及置换检验
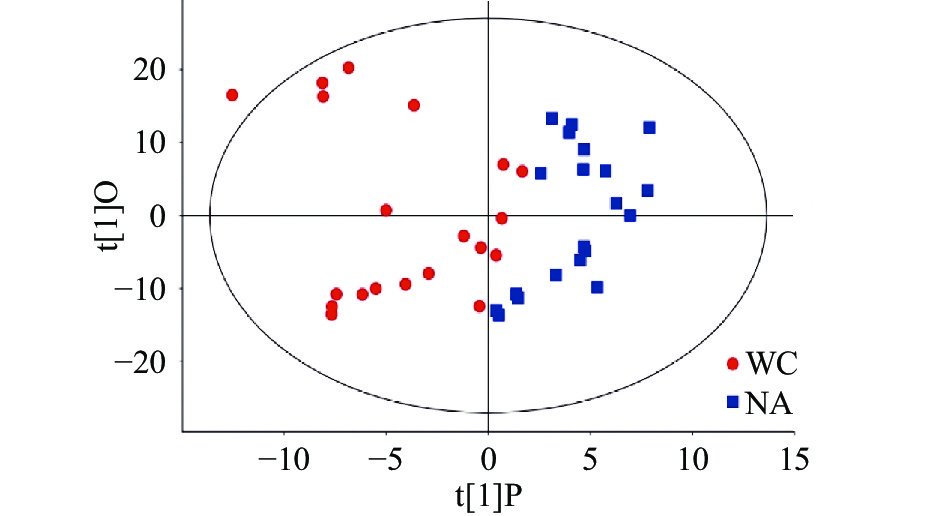
使用PCA模型进行分析,因相关变量的影响,差异变量会分散到更多的主成分上,无法进行更好的可视化和后续分析。所以下面采用正交偏最小二乘法-判别分析(orthogonal projections to latent structures-discriminant analysis, OPLS-DA)的统计方法对结果进行分析。通过OPLS-DA分析,可以过滤掉代谢物中与分类变量不相关的正交变量,并对非正交变量和正交变量分别进行分析,从而获取更加可靠的代谢物组间差异与实验组的相关程度信息。图4为两产地稻花香OPLS-DA得分图。
从OPLS-DA得分图的结果可以看出,两组样本区分比较明显,样本基本处于95%置信区间内。本次分析共得到两个主成分,第一主成分贡献度为29.8%,第二主成分贡献度为21.3%。R2X=0.449,R2Y=0.649,Q2=0.531,R2X与R2Y数值相差不多,且Q2值大于0.5,说明OPLS-DA模型的预测性较好,不存在过拟合现象。由图4可知,五常地区稻花香样本主要分布在左侧的置信区间内,而宁安地区稻花香样本分布在右侧的置信区间内,样本点间没有重叠,区分效果较好。同时可以发现每个产地的20个样本点之间存在较大的距离,相对较分散。这可能与采样地点不同有关,为了体现产地的区别,所以水稻样本的采集覆盖整个地理保护区域,而不局限于一个采样点,使研究结果具有普遍性。由OPLS-DA结果可以看出,产地对水稻的代谢具有显著的影响。
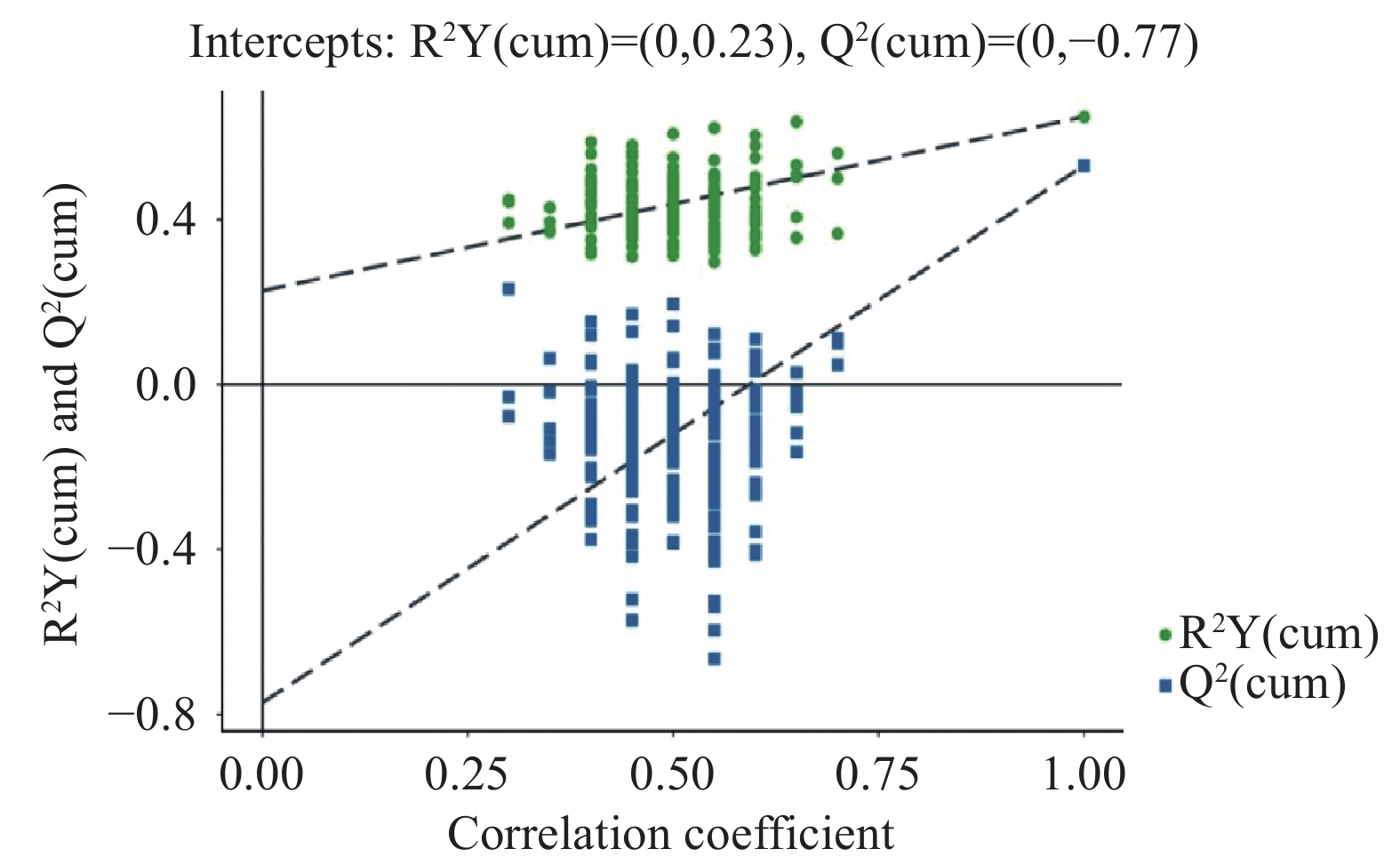
置换检验通过随机改变分类变量Y的排列顺序,多次(次数n=200)建立对应的OPLS-DA模型以获取随机模型的R2Y和Q2值,在避免检验模型的过拟合以及评估模型的统计显著性上有重要作用。OPLS-DA模型的置换检验结果如图5所示。图中横坐标表示置换检验的置换保留度(与原模型Y变量顺序一致的比例,置换保留度等于1处的点即为原模型的R2Y和Q2值),纵坐标表示R2Y或Q2的取值,绿色圆点表示置换检验得到的R2Y值,蓝色方点表示置换检验得到的Q2值,两条虚线分别表示R2Y和Q2的回归线。原模型R2Y比较接近1,说明建立的模型比较符合样本数据的真实情况;原模型Q2大于0.5,说明如果有新样本加入模型,会得到较为近似的分布情况,总的来说原模型可以较好地解释两组样本之间的差异。置换检验随机模型的Q2值均小于原模型的Q2值;Q2的回归线与纵轴的截距小于零;同时随着置换保留度逐渐降低,置换的Y变量比例增大,随机模型的Q2逐渐下降。说明原模型具有良好的稳健性,不存在过拟合现象,即OPLS-DA得分图结果准确。
2.5 差异代谢物的筛选
采用OPLS-DA模型的VIP(variable importance in the projection)值(阈值≥1),并结合学生氏t检验(student’s t-test)的P值(阈值<0.05)来筛选差异代谢物。在Fiehn数据库中通过保留时间等条件与库中物质进行匹配,从而进行物质差异性代谢物的定性,宁安地区对五常地区筛选的差异代谢物定性结果如表2所示。
表 2 差异代谢物定性结果Table 2. Differential metabolite qualitative results序号 英文名称 中文名称 相似度 保留时间(min) 质核比 P值 VIP 倍数变化 log2倍数变化 1 salicylaldehyde 水杨醛 793 6.52 119 0.030139 1.556 0.6787 −0.5591 2 2-aminophenol 2-氨基苯酚 719 9.28 150 0.036889 1.026 0.6022 −0.7317 3 digitoxose 洋地黄糖 774 9.50 117 3.23E-07 2.912 1.3760 0.4605 4 benzylalcohol 苯甲醇 778 9.77 148 0.00012 2.353 0.3068 −1.7044 5 2-monoolein 2-单油精 789 12.32 103 0.000632 2.590 1.4640 0.5499 6 2-piperidinobenzonitrile 2-哌啶子基苄腈 531 12.37 185 3.36E-06 2.027 1.4551 0.5411 7 capric acid 癸酸 644 12.68 131 0.035737 1.514 1.3851 0.4700 8 1,5-anhydroglucitol 1,5-脱水葡萄糖醇 741 13.15 129 0.031234 1.723 1.5358 0.6190 9 1-monoolein 1-单油酸甘油酯 719 13.31 129 0.00043 2.163 1.7684 0.8225 10 2-monopalmitin 2-单软脂酸甘油酯 711 14.35 129 0.005343 1.793 1.3399 0.4221 11 fumaric acid 富马酸 628 14.59 245 0.005112 1.695 1.5117 0.5962 12 2-monostearin 2-单硬脂酸甘油酯 516 14.7 129 1.23E-06 2.752 1.7978 0.8463 13 glucose 葡萄糖 664 15.26 145 9.54E-06 2.891 1.8075 0.8540 14 gluconic acid lactone 葡萄糖酸内酯 680 16.58 116 0.001695 1.671 1.5022 0.5871 15 Unknown217 未知物217 765 18.89 217 0.03449 1.509 0.8068 −0.3097 16 palmitic acid 棕榈酸 969 19.63 117 0.045499 1.380 1.2690 0.3437 17 conduritol-beta-expoxide 连翘酯β-环氧丙烷 901 20.11 305 0.004145 2.098 0.7493 −0.4165 18 linoleic acid 亚油酸 852 21.52 138 0.000632 1.453 0.2910 −1.7810 19 oleic acid 油酸 889 21.58 117 0.012901 1.417 1.3369 0.4189 20 2-deoxyerythritol 2-脱氧赤藓糖醇 617 28.07 117 0.013363 1.630 0.7535 −0.4083 21 piceatannol 苦味酚 679 29.69 117 0.016967 1.453 0.7055 −0.5033 22 phenol 苯酚 317 30.39 151 0.036358 1.143 0.5944 −0.7506 注:倍数变化为两组样本定量的比值;log2倍数变化为倍数变化取以2为底的对数,“+”代表含量升高,“−”代表含量下降。 宁安产地和五常产地的稻花香样品中共筛选出22个差异代谢物。差异代谢物为两产地水稻共同拥有的代谢物,但是含量上存在显著差异。大部分差异代谢物是脂肪酸和脂肪酸衍生物,以及少量糖、有机酸、多元醇和其他物质。在含量上,由表2可知,宁安产地稻花香样品中有9个差异代谢物的含量均低于五常地区,这些物质多为酚、醛、醇类物质。宁安地区稻花香水稻中有13个代谢物的含量高于五常地区,这些物质多数为脂肪酸及脂肪酸的衍生物,倍性变化在1.34~1.81倍之间。研究表明,温度对水稻中脂肪酸的含量有较大的影响[28]。宁安地区属于温带大陆性季风气候,五常属于中温带大陆性季风气候,宁安独特的玄武岩“石板地”使地温、水温都要略高于五常地区,水稻成熟度更高,所以导致宁安稻花香中脂肪酸的含量要高于五常地区。与2.2中得到的结果综合分析,可以发现数量上,宁安地区的水稻其脂肪酸等脂类物质在全部代谢物中所占的比例要少于五常地区。但是在含量上,宁安地区脂类物质要显著高于五常地区,酚类物质在数量和含量上均是宁安地区低于五常地区,醇类物质在数量上两产地占比相近,含量上宁安地区要低于五常地区。综上所述,产地对稻米代谢物中影响最大的物质为脂肪酸及其衍生物。
2.6 差异代谢物的层次聚类分析
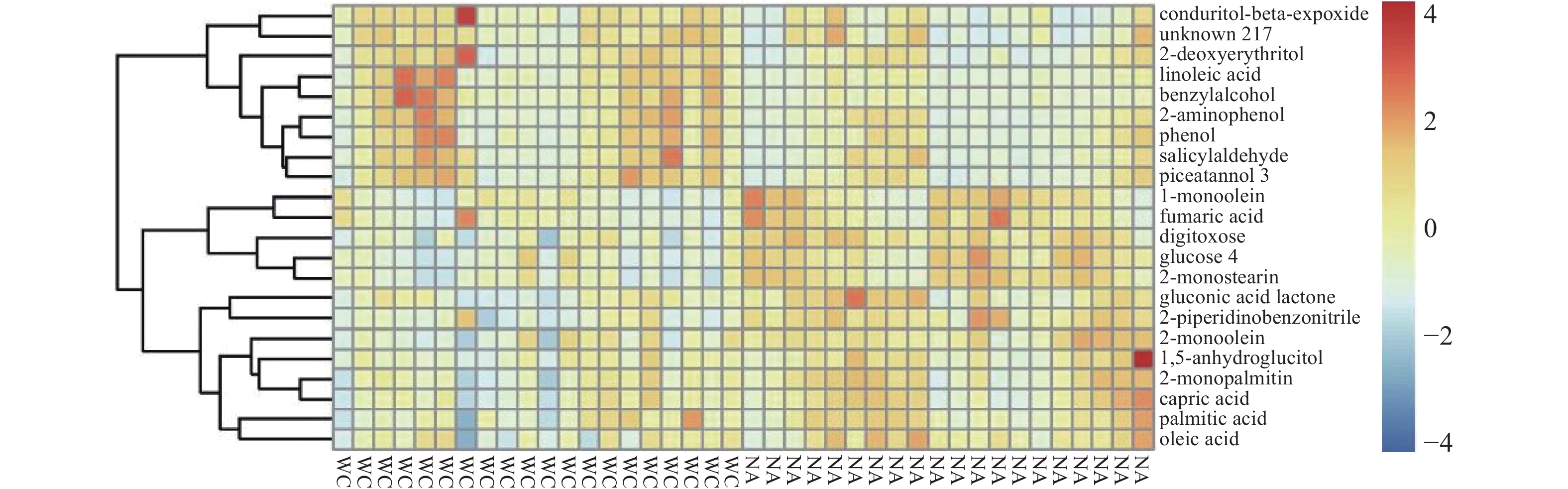
对差异代谢物的定量值计算欧式距离矩阵(Euclidean distance matrix),以完全连锁方法对差异代谢物进行聚类分析,并以热力图进行展示,结果如图6所示。
图6中横坐标代表不同实验分组,左侧为五常地区稻花香样本,右侧为宁安地区样本;纵坐标代表该组对比的差异代谢物,不同位置的色块代表对应位置代谢物的相对表达量,红色代表高表达量,蓝色代表低表达量。图6可以分成上下两个区域,图右侧的前9个代谢物为上半部分,下方13个差异代谢物为下半部分。在上半部分中可以看出五常地区的样本中9个代谢物的表达量明显高于宁安地区样本代谢物的表达量,这9个代谢物分别为甜菜碱β-环氧丙烷、未知物217、2-脱氧赤藓糖醇、亚油酸、苄醇、2-氨基苯酚、苯酚、水杨醛、皮糖醇3,多数为酚类、醛类以及多元醇类物质。在下半部分中由颜色区域可知,宁安地区的除上述9个代谢物外的13个差异代谢物的表达量要明显高于五常地区,这13个差异代谢物多数为脂肪酸以及脂肪酸的衍生物。从聚类分析的颜色变异程度上可以看出,产地不同,脂肪酸类物质含量差异更显著。
2.7 差异代谢物的代谢通路分析
生物体中的复杂代谢反应及其调控并不单独进行,往往由不同基因和蛋白质形成复杂的通路和网络,它们的相互影响和相互调控最终导致代谢组发生系统性的改变。通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG) Pathway数据库http://www.kegg.jp/kegg/pathway.html,共检索到差异代谢物参与的19个水稻的代谢通路,分别为不饱和脂肪酸的生物合成(ReFSEQ),水稻的代谢途径(ReFSEQ),脂肪酸生物合成,水稻角质、丝氨酸和蜡生物合成(ReFSEQ),枸橼酸循环(TCA循环),水稻脂肪酸延伸,脂肪酸降解,水稻氧化磷酸化,精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,酪氨酸代谢,苯丙氨酸代谢,亚油酸代谢,丙酮酸代谢,丁酸代谢,烟酰胺和烟酰胺代谢,次生代谢物的生物合成,碳代谢,脂肪酸代谢。KEGG注释分析仅找到所有差异代谢物参与的通路,为了找到与产地影响密切相关的通路,需要对差异代谢物进行进一步的代谢通路分析。通过对差异代谢物所在通路的综合分析(包括富集分析和拓扑分析),可以对通路进行进一步的筛选,找到与代谢物差异相关性最高的关键通路。首先,通过差异代谢物对KEGG、PubChem等权威代谢物数据库进行映射,映射出3个物质,亚油酸、棕榈酸以及富马酸,且均为精确匹配。在取得差异代谢物的匹配信息后,对对应物种Oryza sativa japonica (Japanese rice) 的通路数据库进行搜索和代谢通路分析,代谢通路分析如表3所示。
表 3 差异代谢物的代谢途径Table 3. Metabolic pathways of the differential metabolitesPathway Total Hits Raw p −ln(p) Holm adjust FDR Impact Hits Cpd 亚油酸代谢 5 1 0.013146 4.3316 1 0.9037 1 Linoleic acid cpd:C01595 线粒体脂肪酸的延长 13 1 0.03394 3.3832 1 0.9037 0 Palmitic acid cpd:C00249 酪氨酸代谢 18 1 0.046786 3.0622 1 0.9037 0 Fumaric acid cpd:C00122 柠檬酸循环(TCA循环) 20 1 0.051893 2.9586 1 0.9037 0.034 Fumaric acid cpd:C00122 丙氨酸、天冬氨酸和谷氨酸代谢 21 1 0.054439 2.9107 1 0.9037 0.007 Fumaric acid cpd:C00122 脂肪酸代谢 37 1 0.094563 2.3585 1 1 0 Palmitic acid cpd:C00249 精氨酸和脯氨酸代谢 37 1 0.094563 2.3585 1 1 0 Fumaric acid cpd:C00122 脂肪酸生物合成 47 1 0.11906 2.1282 1 1 0 Palmitic acid cpd:C00249 注:Pathway为代谢通路名称;Total为该代谢通路中代谢物的数量;Hits为差异代谢物命中该通路的个数;Raw p代表通路富集分析的P值;−ln(p)为P值取以e为底的负对数(负自然底对数);Holm adjust 为经Holm-Bonferroni方法进行多重假设检验校正后的P值;FDR为经错误发现率(false discovery rate,FDR)方法进行多重假设检验校正后的P值;Impact为代谢通路拓扑分析的Impact值;Hits Cpd为命中该通路的差异代谢物名称及KEGG ID。 由表3可知,共找到8条与代谢物差异相关性最高的关键通路,包含两大类代谢即脂肪酸代谢和氨基酸代谢,而这8条通路中的差异代谢物分别为亚油酸、棕榈酸以及富马酸,其中富马酸参与的代谢通路有4条,棕榈酸参与的有3条,可见这两种差异代谢物是处于多条通路的交集处,对通路影响较大。
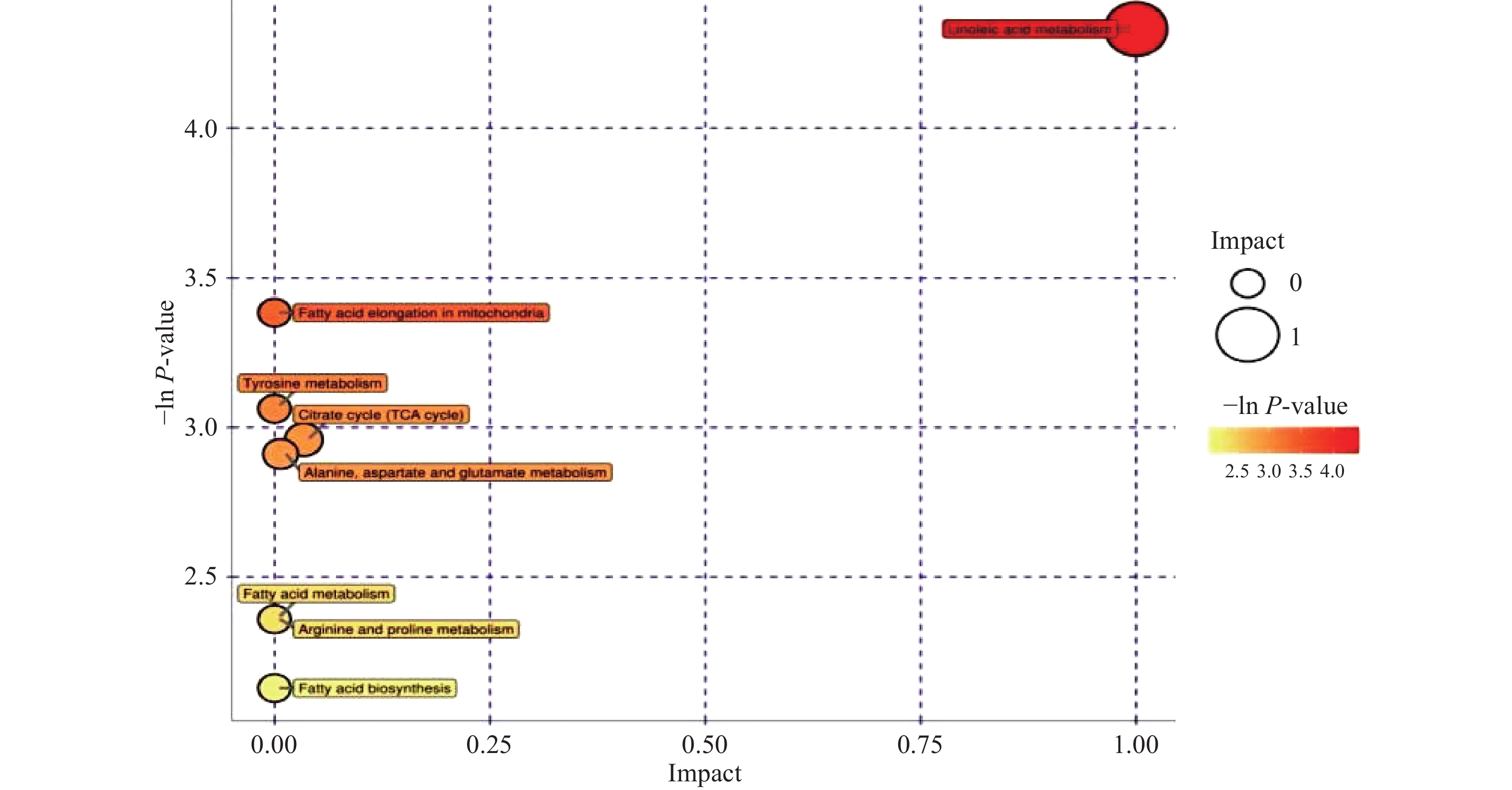
代谢通路分析的结果以气泡图进行展示,如图7所示。气泡图中每一个气泡代表一个代谢通路,气泡所在横坐标和气泡大小表示该通路在拓扑分析中的影响因子大小,越大影响因子越大;气泡所在纵坐标和气泡颜色表示富集分析的P值(取负自然对数,即−lnP-value),颜色越深P值越小,富集程度越明显。由图7可知,亚油酸代谢处的气泡颜色最深,而且最大,可见亚油酸对两产地稻花香水稻之间差异的影响最大,其次是棕榈酸和富马酸。亚油酸、棕榈酸和富马酸是稻米脂肪酸的主要组成成分,亚油酸和富马酸属于不饱和脂肪酸,而棕榈酸属于饱和脂肪酸。脂肪酸是水稻品质的关键决定因子[29],稻米中脂类含量与稻米品质呈显著正相关[30],亚油酸在水稻脂肪中含量较高,可提高蒸煮时的食味品质,富马酸不仅可以提升蒸煮时的水稻香味,还起到酸度调节剂的作用,也可以提高水稻的食味品质,而棕榈酸是一种高级的饱和脂肪酸,对稻米的色泽、口感等也具有显著地影响,尤其是色泽,但棕榈酸含量与稻米色泽以及食味品质呈负相关。
由结果可知,产地对影响稻米品质的代谢物含量具有明显影响,说明产地对稻米品质具有一定的影响。还有研究表明,棕榈酸、亚油酸的含量与生长环境的温度有关,宁安和五常两个地区中环境温度也不相同,由代谢通路结果可知,五常与宁安两个产地的稻花香水稻在代谢中最大的差异体现在脂肪酸代谢过程,则说明不同产地间水稻代谢差异机制可能主要在于脂肪酸类物质的代谢。
3. 结论
基于GC-MS代谢组学技术对不同产地水稻代谢产物与代谢差异机制进行研究具有可行性。研究结果表明产地对稻花香水稻代谢物的数量和含量均具有影响,且代谢物种类与含量的差异可能与稻米品质相关。产地不同,对水稻中脂类物质的影响最为显著,且不同产地间水稻代谢差异机制主要在于脂肪酸类物质的代谢。亚油酸,棕榈酸和富马酸是产地影响的脂肪酸代谢中的三种关键代谢物。产地对稻米的代谢具有明显的影响。
-
表 1 代谢产物定性结果
Table 1 Qualitative results of metabolites
序号 保留时间(min) 质核比 相似度 英文名称 中文名称 WC NA 1 5.36 119 780 hydroxylamine 羟胺 + + 2 6.53 119 769 o-toluic acid 邻甲苯甲酸 + + 3 7.17 128 818 cyclohexylamine 环己胺 + + 4 7.70 120 653 phenylalanine minor 苯丙氨酸小体 + + 5 8.53 147 880 glycerol 甘油 + + 6 8.89 141 863 cyanoalanine 氰丙氨酸 + + 7 9.10 142 410 proline 脯氨酸 + + 8 9.50 117 726 digitoxose 洋地黄糖 + + 9 9.77 148 777 benzylalcohol 苄醇 + + 10 10.40 158 721 trans-4-hydroxy-L-proline 反式-4-羟基-L-脯氨酸 + + 11 10.73 85 481 tetracosane 二十四烷 + + 12 12.32 103 763 2-monoolein 2-单油酸甘油酯 + + 13 12.55 143 599 phytol 植醇 + + 14 12.69 131 644 capric acid 癸酸 + + 15 12.96 184 535 citrulline minor 瓜氨酸微量 + + 16 13.61 145 628 diglycerol 二甘醇 + + 17 13.84 170 663 1-methyladenosine minor 1-甲基腺苷小体 + + 18 13.97 217 759 deoxypentitol 去氧戊醇 + + 19 14.24 355 731 epicatechin 1 表儿茶素1(黄烷衍生物) + + 20 14.35 129 715 2-monopalmitin 2-单软脂酸甘油酯 + + 21 14.45 129 822 cholesterol 胆固醇 + + 22 14.47 143 679 dehydroascorbic acid 2 脱氢抗坏血酸2(烯醇) + + 23 14.59 245 564 fumaric acid 富马酸 + + 24 14.60 147 882 pentonic acid 戊酸 + + 25 14.62 217 916 UDP-glucuronic acid 尿苷二磷酸葡萄糖醛酸 + + 26 14.91 97 950 myristyl myristate 肉豆蔻醇肉豆蔻酸酯 + + 27 15.21 204 940 levoglucosan 左旋葡聚糖 + + 28 15.23 365 713 1-monoolein 1-单油酸甘油酯 + + 29 16.01 217 705 xylonolactone 木内酯 + + 30 16.09 217 891 glucose-1-phosphate 葡糖-1-磷酸 + + 31 16.23 145 575 fructose 果糖 + + 32 16.29 217 588 UDP-N-acetylglucosamine 糖胺 + + 33 16.59 116 680 gluconic acid lactone 葡糖酸内酯 + + 34 16.60 85 805 1,5-anhydroglucitol 1,5-脱水葡萄糖醇 + + 35 16.94 204 817 methylhexose nist 甲基己糖NIST + + 36 17.00 217 873 ribose 核糖 + + 37 17.25 117 743 myristic acid 肉豆蔻酸 + + 38 17.42 161 593 aspartate minor 天门冬氨酸盐 + + 39 17.54 103 914 tagatose 塔格糖 + + 40 17.60 117 647 glucose overload 葡萄糖超量 + + 41 17.76 319 967 glucose 葡萄糖 + + 42 18.18 217 868 galactitol 半乳糖醇 + + 43 18.89 217 765 Unknown 未知物 + + 44 19.63 117 965 palmitic acid 棕榈酸 + + 45 19.93 355 684 epigallocatechin 表没食子儿茶素 + + 46 19.95 204 875 N-acetylgalactosamine N-乙酰半乳糖胺 + + 47 20.11 305 897 conduritol-beta-expoxide 连翘酯β-环氧丙烷 + + 48 20.29 97 596 hypoxanthine 次黄嘌呤 + + 49 20.71 97 770 d6 cholesterol D6胆固醇 + + 50 20.75 237 664 alpha-tocopherol α-生育酚 + + 51 21.51 138 857 linoleic acid 亚油酸 + + 52 21.58 117 891 oleic acid 油酸 + + 53 21.86 117 835 stearic acid 硬脂酸 + + 54 22.36 89 714 linolenic acid 亚麻酸 + + 55 24.91 89 478 2-ketoisovaleric acid 2-酮异戊酸 + + 56 25.34 371 786 1-monopalmitin 1-单罂粟碱 + + 57 25.75 361 942 sucrose 蔗糖 + + 58 26.32 361 878 1-kestose 1-蓖麻糖 + + 59 27.11 399 775 1-monostearin 1-单硬脂酸甘油酯 + + 60 27.45 95 904 squalene 角鲨烯 + + 61 27.51 204 698 cellobiose minor 纤维二糖微量 + + 62 27.62 117 492 lignoceric acid 二十四烷酸 + + 63 29.73 89 775 N-acetylmannosamine 乙酰甘露糖胺 + + 64 30.09 165 784 tocopherol acetate 醋酸生育酚 + + 65 30.11 237 720 alpha-tocopherol α-生育酚 + + 66 30.17 204 867 maltotriose 麦芽三糖 + + 67 30.22 117 366 1-deoxyerythritol 1-脱氧赤藓糖醇 + + 68 30.40 151 317 phenol 苯酚 + + 69 31.24 129 853 stigmasterol 豆甾醇 + + 70 31.65 495 489 triacontanol 三十烷醇 + + 71 31.70 129 807 beta-sitosterol β-谷甾醇 + + 72 31.96 361 900 inulotriose 菊粉三糖 + + 73 32.30 95 691 lanosterol 羊毛甾醇 + + 74 32.82 95 653 lithocholic acid 胆石酸 + + 75 33.03 136 606 chenodeoxycholic acid 去氧胆酸 + + 76 34.23 217 819 melezitose 松三糖 + + 77 5.25 126 974 N-acetylglutamate N-乙酰谷氨酸 + − 78 6.48 117 800 pentadecanoic acid 十五烷酸 + − 79 6.89 241 930 methanolphosphate 甲醇磷酸酯 + − 80 8.46 299 874 phosphate 磷酸盐 + − 81 8.57 136 727 catechol 邻苯二酚 + − 82 8.83 116 652 adrenaline 肾上腺素 + − 83 12.20 129 713 elaidic acid 反油酸 + − 84 12.38 205 577 cinnamic acid 肉桂酸 + − 85 13.32 243 769 dodecanol 十二醇 + − 86 14.70 129 516 2-monostearin 2-单硬脂酸甘油酯 + − 87 15.54 145 466 2-hydroxypentanoic acid 2-羟基戊酸 + − 88 16.09 271 649 2,4-hexadienedioic acid 1,4-己二烯二酸 + − 89 17.06 119 439 glycerol-3-galactoside 甘油-3-半乳糖苷 + − 90 17.77 117 767 galactose 半乳糖 + − 91 21.22 105 585 hippuric acid 马尿酸 + − 92 22.03 93 639 linoleic acid methyl ester 亚油酸甲酯 + − 93 22.33 204 729 piceatannol 苦味酸 + − 94 23.16 116 759 n-acetyl-5-hydroxytryptamine N-乙酰-5-羟色胺 + − 95 23.42 129 575 monomyristin 单孢菌素 + − 96 24.46 299 544 ethanolamine 乙醇胺 + − 97 25.56 217 583 4',5-dihydroxy-7-glucosyloxyflavanone 4’,5-二羟基-7-葡萄糖苷黄烷酮 + − 98 27.43 89 634 3,6-anhydro-d-hexose 3,6-脱水-D-己糖 + − 99 29.97 204 931 galactinol 5 半乳糖醇5 + − 100 8.84 116 511 alanine 丙氨酸 − + 101 10.26 355 435 succinic acid 琥珀酸 − + 102 12.18 129 653 palmitoleic acid 棕榈油酸 − + 103 12.25 129 742 zymosterol major 酵母甾醇 − + 104 12.37 185 531 2-piperidinobenzonitrile 2-哌啶苯甲腈 − + 105 12.49 103 652 xylose 木糖 − + 106 14.03 145 515 butyraldehyde 丁醛 − + 107 14.28 173 718 dehydroascorbic acid 脱氢抗坏血酸 − + 108 14.47 143 629 N-acetylaspartic acid N-乙酰天冬氨酸 − + 109 14.95 143 723 inosine 肌苷 − + 110 15.84 157 638 3-deoxyhexitol 3-脱氧己醇 − + 111 16.09 271 711 sucrose-6-phosphate 蔗糖-6-磷酸 − + 112 17.23 147 599 isohexonic acid 异己酸 − + 113 17.60 117 673 6-deoxyglucose 6-脱氧葡萄糖 − + 114 17.62 263 732 arabinose 阿拉伯糖 − + 115 17.73 318 667 conduritol-beta-epoxide minor 环戊二酸β-环氧丙烷 − + 116 17.77 204 709 beta-gentiobiose β-龙胆二糖 − + 117 21.07 204 638 digalacturonic acid 二乙酰醛酸 − + 118 21.22 105 588 arachidonic acid 花生四烯酸 − + 119 22.31 221 564 dihydrocholesterol 二氢胆固醇 − + 120 23.16 116 669 2-deoxyerythritol 2-脱氧赤藓糖醇 − + 121 25.96 131 564 glucosamine 氨基葡萄糖 − + 122 26.65 169 749 sophorose 槐甲素 − + 123 27.23 217 739 glucose 4 葡萄糖4 − + 124 27.26 217 644 6-deoxygalactofuranose 6-脱氧半乳糖呋喃糖 − + 125 27.33 85 426 cis-gondoic acid 顺式顺丁烯二酸 − + 126 29.07 204 625 lactobionic acid 乳糖酸 − + 127 29.69 117 576 cerotinic aci 角化剂ACI − + 注:“+”代表定性到该物质,“−”代表未定性到该物质。 表 2 差异代谢物定性结果
Table 2 Differential metabolite qualitative results
序号 英文名称 中文名称 相似度 保留时间(min) 质核比 P值 VIP 倍数变化 log2倍数变化 1 salicylaldehyde 水杨醛 793 6.52 119 0.030139 1.556 0.6787 −0.5591 2 2-aminophenol 2-氨基苯酚 719 9.28 150 0.036889 1.026 0.6022 −0.7317 3 digitoxose 洋地黄糖 774 9.50 117 3.23E-07 2.912 1.3760 0.4605 4 benzylalcohol 苯甲醇 778 9.77 148 0.00012 2.353 0.3068 −1.7044 5 2-monoolein 2-单油精 789 12.32 103 0.000632 2.590 1.4640 0.5499 6 2-piperidinobenzonitrile 2-哌啶子基苄腈 531 12.37 185 3.36E-06 2.027 1.4551 0.5411 7 capric acid 癸酸 644 12.68 131 0.035737 1.514 1.3851 0.4700 8 1,5-anhydroglucitol 1,5-脱水葡萄糖醇 741 13.15 129 0.031234 1.723 1.5358 0.6190 9 1-monoolein 1-单油酸甘油酯 719 13.31 129 0.00043 2.163 1.7684 0.8225 10 2-monopalmitin 2-单软脂酸甘油酯 711 14.35 129 0.005343 1.793 1.3399 0.4221 11 fumaric acid 富马酸 628 14.59 245 0.005112 1.695 1.5117 0.5962 12 2-monostearin 2-单硬脂酸甘油酯 516 14.7 129 1.23E-06 2.752 1.7978 0.8463 13 glucose 葡萄糖 664 15.26 145 9.54E-06 2.891 1.8075 0.8540 14 gluconic acid lactone 葡萄糖酸内酯 680 16.58 116 0.001695 1.671 1.5022 0.5871 15 Unknown217 未知物217 765 18.89 217 0.03449 1.509 0.8068 −0.3097 16 palmitic acid 棕榈酸 969 19.63 117 0.045499 1.380 1.2690 0.3437 17 conduritol-beta-expoxide 连翘酯β-环氧丙烷 901 20.11 305 0.004145 2.098 0.7493 −0.4165 18 linoleic acid 亚油酸 852 21.52 138 0.000632 1.453 0.2910 −1.7810 19 oleic acid 油酸 889 21.58 117 0.012901 1.417 1.3369 0.4189 20 2-deoxyerythritol 2-脱氧赤藓糖醇 617 28.07 117 0.013363 1.630 0.7535 −0.4083 21 piceatannol 苦味酚 679 29.69 117 0.016967 1.453 0.7055 −0.5033 22 phenol 苯酚 317 30.39 151 0.036358 1.143 0.5944 −0.7506 注:倍数变化为两组样本定量的比值;log2倍数变化为倍数变化取以2为底的对数,“+”代表含量升高,“−”代表含量下降。 表 3 差异代谢物的代谢途径
Table 3 Metabolic pathways of the differential metabolites
Pathway Total Hits Raw p −ln(p) Holm adjust FDR Impact Hits Cpd 亚油酸代谢 5 1 0.013146 4.3316 1 0.9037 1 Linoleic acid cpd:C01595 线粒体脂肪酸的延长 13 1 0.03394 3.3832 1 0.9037 0 Palmitic acid cpd:C00249 酪氨酸代谢 18 1 0.046786 3.0622 1 0.9037 0 Fumaric acid cpd:C00122 柠檬酸循环(TCA循环) 20 1 0.051893 2.9586 1 0.9037 0.034 Fumaric acid cpd:C00122 丙氨酸、天冬氨酸和谷氨酸代谢 21 1 0.054439 2.9107 1 0.9037 0.007 Fumaric acid cpd:C00122 脂肪酸代谢 37 1 0.094563 2.3585 1 1 0 Palmitic acid cpd:C00249 精氨酸和脯氨酸代谢 37 1 0.094563 2.3585 1 1 0 Fumaric acid cpd:C00122 脂肪酸生物合成 47 1 0.11906 2.1282 1 1 0 Palmitic acid cpd:C00249 注:Pathway为代谢通路名称;Total为该代谢通路中代谢物的数量;Hits为差异代谢物命中该通路的个数;Raw p代表通路富集分析的P值;−ln(p)为P值取以e为底的负对数(负自然底对数);Holm adjust 为经Holm-Bonferroni方法进行多重假设检验校正后的P值;FDR为经错误发现率(false discovery rate,FDR)方法进行多重假设检验校正后的P值;Impact为代谢通路拓扑分析的Impact值;Hits Cpd为命中该通路的差异代谢物名称及KEGG ID。 -
[1] WANG N N, FENG X, SUNG Y P, et al. Gas chromatography combined with stoichiometry to distinguish rice storage time and origin[J]. Analysis and Testing Journal,2013,32:1227−1231.
[2] LIU C J, XIE Y H, LI J, et al. The eating quality of rice has different regions and the comparative study of chemical composition[J]. J Food Sci,2013,34:165−169.
[3] CHEN T, ZHAO Y, ZHANG W, et al. Variation of the light stable isotopes in the superior and inferior grains of rice(Oryza sativa L.) with different geographical origins[J]. Food Chemistry,2016,209:95−98. doi: 10.1016/j.foodchem.2016.04.029
[4] CHUNG I M, KIM J K, LEE K J, et al. Geographic authentication of Asian rice (Oryza sativa L.) using multi-elemental and stable isotopic data combined with multivariate analysis[J]. Food Chemistry,2018,240:840−849. doi: 10.1016/j.foodchem.2017.08.023
[5] PASQUINI, CELIO. Near infrared spectroscopy: A mature analytical technique with new perspectives-a review[J]. Analytica Chimica Acta,2018,1026:8−36. doi: 10.1016/j.aca.2018.04.004
[6] ARIYAMA K, SHINOZAKI M, KAWASAKI A. Determination of the geographic origin of rice by chemometrics with strontium and lead isotope ratios and multielement concentrations[J]. Journal of Agricultural & Food Chemistry,2012,60(7):1628−1634.
[7] KUKUSAMUDE C, KONGSRI S. Elemental and isotopic profiling of Thai jasmine rice(Khao Dawk Mali 105) for discrimination of geographical origins in Thung Kula Rong Hai area, Thailand[J]. Food Control,2018,91:357−364. doi: 10.1016/j.foodcont.2018.04.018
[8] 李红, 田福林, 刘成雁, 等. 气相色谱-串联质谱法测定不同产地大米中的角鲨烯[J]. 分析测试学报,2011,30(10):1179−1182. [LI H, TIAN F L, LIU C Y, et al. Determination of squalene in rices from different areas by gas chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis,2011,30(10):1179−1182. doi: 10.3969/j.issn.1004-4957.2011.10.020 [9] PANKIN D, KOLESNIKOV I, VASILEVA A, et al. Raman fingerprints for unambiguous identification of organotin compounds[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy,2018,204:158.
[10] ZHU L, SUN J, WU G, et al. Identification of rice varieties and determination of their geographical origin in China using Raman spectroscopy[J]. Journal of Cereal Science,2018,82:175−182. doi: 10.1016/j.jcs.2018.06.010
[11] BRYANT R J, MCCLUNG A M. Volatile profiles of aromatic and non-aromatic rice cultivars using SPME/GC-MS[J]. Food Chemistry,2010,124(2):501−513.
[12] KYU D, PHUOC N, WON S. Non-destructive profiling of volatile organic compounds using HS-SPME/GC-MS and its application for the geographical discrimination of white rice[J]. Journal of Food & Drug Analysis,2018,26(1):260.
[13] CALINGACION M N, BOUALAPHANH C, DAYGON V D, et al. A genomics and multi-platform metabolomics approach to identify new traits of rice quality in traditional and improved varieties[J]. Metabolomics,2012,8(5):771−783. doi: 10.1007/s11306-011-0374-4
[14] CHEN W, GONG L, GUO Z, et al. A novel integrated method for large-scale detection, identification, and quantification of widely-targeted metabolites: Application in the study of rice metabolomics[J]. Molecular plant,2013,6(6):1769−1780. doi: 10.1093/mp/sst080
[15] JUNG ES, LEE S, LIM SH, et al. Metabolite profiling of the short-term responses of rice leaves(Oryza sativa cv. Ilmi) cultivated under different LED lights and its correlations with antioxidant activities[J]. Plant Science,2013,210:61−69. doi: 10.1016/j.plantsci.2013.05.004
[16] FENG Y C, FU T X, ZHANG L Y, et al. Research on differential metabolites in distinction of rice(Oryza sativa L.) origin based on GC-MS[J]. Journal of Chemistry,2019,7:1−7.
[17] 王玲. 转基因水稻的代谢组学研究[D]. 北京: 北京化工大学, 2013. WANG L. Metabonomics research of genetically modifed rice[D]. Beijing: Beijing University of Chemical Technology, 2013.
[18] 程建华, 桑志红, 李海静, 等. 基于GC-TOF/MS技术的转Bt基因大米代谢组学研究[J]. 分析测试学报,2016,35(10):1217−1224. [CHENG J H, SANG Z H, LI H J, et al. Metabolomics analysis of Bt-transgenic and parental rice based on gas chormatography-mass spectrometry[J]. Journal of Istrumental Analysis,2016,35(10):1217−1224. doi: 10.3969/j.issn.1004-4957.2016.10.001 [19] ZHOU J, WANG S Y, CHANG Y W, et al. Development of a gas chromatography-mass spectrometry method for the metabolomic study of rice(Oryza sativa L.) grain[J]. Chinese Journal of Chromatography,2012,30(10):1037−1042.
[20] KANEHISA M. KEGG for representation and analysis of molecular networks involving diseases and drugs[J]. Nucleic Acids Research,2010,38(1):355−360.
[21] CHENG J, SUN Y Y, SHI Y H, et al. Branched-chain amino acids regulate plant growth by affecting the homeostasis of mineral elements in rice[J]. Science China Life Sciences,2019,62:1107−1110. doi: 10.1007/s11427-019-9552-8
[22] LI Y L, LI D D, GUO Z L, et al. Os ACOS12, an orthologue of Arabidopsis acyl-CoA synthetase5, plays an important role in pollen exine formation and anther development in rice[J]. BMC Plant Biology,2016,16(1):256. doi: 10.1186/s12870-016-0943-9
[23] YANG X J, LIANG W Q, CHEN M J, et al. Rice fatty acyl- CoA synthetase Os ACOS12 is required for tapetum programmed cell death and male fertility[J]. Planta,2017,246(1):1−18. doi: 10.1007/s00425-017-2706-8
[24] ZHANG D S, LIANG W Q, YUAN Z, et al. Tapetum degeneration retardation is critical for aliphatic metabolism and gene regulation during rice pollen development[J]. Molecular Plant,2008,1(4):599−610. doi: 10.1093/mp/ssn028
[25] KIM N H, KWAK J, JI Y B, et al. Changes in lipid substances in rice during grain development[J]. Phytochemistry,2015,116:170−179. doi: 10.1016/j.phytochem.2015.05.004
[26] TUFVESSON F, WAHLGREN M, ELIASSON A C. Formation of amylose-lipid complexes and effects of temperature treatment: Part 2: Fatty acids[J]. Starch Starke,2003,55(3/4):138−149.
[27] 刘海, 赵欢, 何佳芳, 等. 稻米营养品质影响因素研究进展[J]. 贵州农业科学,2013,41(6):85−89. [LIU H, ZHAO H, HE J F, et al. Advances in the influencing factors of rice nutritional quality[J]. Guizhou Agricultural Sciences,2013,41(6):85−89. doi: 10.3969/j.issn.1001-3601.2013.06.025 [28] 王海涛. 影响稻谷脂肪酸值测定的因素分析[J]. 现代食品,2017(13):74. [WANG H T. Analysis of the factors affecting the determination of fatty acids in rice[J]. Modern Food,2017(13):74. [29] 钟一平. 稻谷脂肪酸值测定的影响因素分析[J]. 粮食科技与经济,2017,42(4):52−53. [ZHONG Y P. Analysis of factors the determination of fatty acid in rice[J]. Grain Science and Technology and Economy,2017,42(4):52−53. [30] 许光利. 稻米脂类对品质的影响及脂类代谢对高温弱光的响应[D]. 雅安: 四川农业大学, 2017. XU G L. Studies on effect of lipid on rice quality and lipid metabolism in response to high temperature and weak light stresses[D]. Yaan: Sichuan Agricultural University, 2017.
-
期刊类型引用(5)
1. 范琦琦,赵香香,吴鸣,李祥,张帅,喻江,刘晓飞,张娜. 代谢组学在谷物食品中的应用研究进展. 食品工业科技. 2024(07): 35-43 .  本站查看
本站查看
2. WANG Xiang,HUANG Jianping,WANG Yupeng,WANG Qilong,JING Yajiang,ZHANG Gang,PENG Liang,GAO Jing,WANG Hongyan,YAN Yonggang. Differential metabolite analysis of the pharmacodynamic differences between different ratios of Dahuang(Radix Et Rhizoma Rhei Palmati)-Taoren(Semen Persicae) herb pair. Journal of Traditional Chinese Medicine. 2024(03): 515-523 .  必应学术
必应学术
3. 李雪,罗芳,刘光宪,王丽,程文龙,张耀. 基于代谢组学的酱卤鸭翅变质前后代谢物差异比较. 食品研究与开发. 2023(04): 15-21 .  百度学术
百度学术
4. 张晓宁,李彩朝,金威恒,叶正,张雨,李林,舒黄英,郝园园,汪志伟. 中国辣椒(Capsicum chinense)果色转变的比较代谢组分析. 分子植物育种. 2023(05): 1701-1708 .  百度学术
百度学术
5. 孙传恒,袁晟,罗娜,徐大明,杨信廷. 基于区块链和边缘计算的水稻原产地溯源方法研究. 农业机械学报. 2023(05): 359-368 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:



