Effect of Heating Method and Heating Time on Physicochemical Properties of Fish Gelatin
-
摘要: 为探究加热方式和加热时间对鱼类明胶理化性质的影响,对加热明胶溶液的蛋白组成、粘度、流变性质和热稳定性,以及明胶凝胶的强度、质构(texture profile analysis,TPA)参数和微观结构进行分析和比较。结果显示,鱼类明胶溶液的粘度、流变性质及热稳定性随加热时间的增加而明显降低,但间歇加热明胶中这些性质的变化幅度均低于连续加热明胶。连续加热明胶至48 h时电泳图谱中β条带消失,96 h时α1和α2亚基明显降解,而当间歇加热明胶至96 h时β条带才消失。鱼类明胶形成的凝胶其强度和TPA参数随热处理时间的延长逐渐减小,但间歇加热明胶的凝胶形成能力优于连续加热明胶。扫描电子显微镜结果显示,连续加热的凝胶表面光滑平整,而间歇加热凝胶的结构更加粗糙且多孔隙。研究结果表明,间歇加热及加热时间小于12 h有利于减少明胶热降解。Abstract: In order to explore the effect of heating method and heating time on physicochemical properties of fish gelatin, the protein composition, viscosity, rheological properties and thermal stability of heated gelatin solutions, and the gel strength, texture profile analysis (TPA) parameters and microstructure of gelatin gels were analyzed and compared. The results showed that the viscosity, rheological properties and thermal stability of fish gelatin solutions decreased significantly with the increase of heating time, while the change extents of these properties in the intermittent heated gelatin were less than those in the continuous heated gelatin. When gelatin was heated for 48 h continuously, the β band disappeared in the electrophoresis pattern, and the α1 and α2 subunits degraded obviously after being heated for 96 h. When gelatin was heated for 96 h intermittently, the β band disappeared. The gel strength and TPA parameters of the gel prepared by fish gelatin gradually decreased with the increase of heating time, whereas the gel properties of the intermittent heated gelatin were superior to those of the continuous heated gelatin. Scanning electron microscope results showed that the surfaces of continuous heated gels were smooth and flat, while the structure of gel prepared by intermittent heated gelatin was rougher and more porous. The results suggested that intermittent heating and the heating less than 12 h could reduce the heat degradation of gelatin.
-
Keywords:
- fish gelatin /
- heating method /
- heating time /
- intermittent heating /
- thermal stability /
- gelatin gel
-
明胶是胶原的部分变性产物,可以从动物的皮、骨、肌腱和膜等结缔组织中通过稀酸或稀碱处理后利用热水浸提制备获得[1]。明胶具有良好的成膜性、发泡性和乳化性等特征,作为一种高分子生物材料可以广泛应用于食品、医药等领域[2]。在食品工业中,明胶可以作为稳定剂、乳化剂及增稠剂等[3]。在医药领域,明胶可以应用于组织工程、抗菌包装及胶囊制作等[4]。明胶凝胶是一种热可逆凝胶,在升温和降温过程中会发生溶胶-凝胶转变,因此明胶制品具有独特的感官性质和风味控释作用[5-6]。
明胶粉末一般拥有半结晶结构,在使用前需要先经过冷水浸泡溶胀,再加热至40 ℃以上使明胶大分子溶解[7]。热处理的温度和时间对明胶的凝胶特性和成膜性能有一定的影响。鱼鳞明胶在60 ℃下伴随加热时间的延长,其制备的凝胶强度会发生下降[8]。猪皮明胶在加热温度从30 ℃提升到70 ℃时分子量会发生下降,而牛骨明胶在40 ℃下随加热时间的延长降解程度增加[9]。Hoque等[10]发现热处理温度超过70 ℃时乌贼皮明胶会发生降解,进而使明胶的成膜性能下降。这些结果表明了在热处理过程中不同种类明胶都会发生降解,从而导致明胶的凝胶特性和成膜性能发生下降。而且,为了降低能源成本,在实际应用中还有可能采用间歇加热替代连续加热的方式。然而,有关连续加热和间歇加热对鱼类明胶性能影响的比较研究却未见报道。
随着经济发展和生活水平的提高,世界各国鱼类加工产品逐渐增多,同时产生了大量胶原蛋白含量丰富的鱼皮和鱼鳞等下脚料[11]。传统明胶一般是从哺乳动物的皮和骨中制备得到,但这些来源的明胶由于具有疾病传播可能和一些地区宗教文化限制而受到影响,促使人们想从鱼类下脚料中寻找替代来源[3,12]。因此,本研究考察了加热方式和加热时间对鱼类明胶的粘度、分子量分布、流变性质、热稳定性、明胶凝胶性能和微观结构的影响,以期为鱼类明胶的工业化应用提供参考。
1. 材料与方法
1.1 材料与仪器
鱼类明胶(冻力约为280 Bloom) 由集美大学水产品加工研究室提供,是由鱼鳞经过碱处理去除杂蛋白和酸处理脱钙后,利用热水浸提获得;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺等试剂(化学纯) 美国Bio-Rad公司。
BHS-4数显恒温水浴锅 中国福州泰美实验仪器有限公司;DV-C数显粘度计 美国Brookfield公司;Mini-PIII垂直电泳槽 美国Bio-Rad公司;G:Box凝胶成像仪 英国Syngene公司;DHR-2流变仪、Q2000差示扫描量热仪 美国TA仪器有限公司;TA-XT Plus质构仪 英国Stable Micro System 公司;S-4800电子扫描显微镜 日本东京日立制造所。
1.2 实验方法
1.2.1 鱼类明胶溶液的制备
向鱼类明胶颗粒(30 g)中加入70 mL蒸馏水于室温下溶胀30 min,置于60 ℃水浴锅中连续加热1 h(对照组)、12、24、48、96 h制备成连续加热的样品。实际应用中,当天未使用完的明胶通常冷藏后在第2 d重新加热使用。因此在本实验中,溶胀的明胶在60 ℃每次加热12 h,间歇12 h(4 °C),再加热12 h,直到加热时间达到24、48和96 h,以加热1 h的明胶溶液作为对照组,制备成间歇加热的样品。根据明胶质地评价方法中使用的标准浓度[13],用蒸馏水调配明胶质量浓度为6.67%。明胶溶液放在30 ℃水浴锅中保温1 h,供以下实验使用。
1.2.2 鱼类明胶SDS-PAGE分析
参考Weng等[14]的方法将样品溶于8 mol/L尿素、2% SDS和20 mmol/L Tris-HCl(pH8.8)中,利用6%分离胶和4%浓缩胶在8 mA恒定电流下进行电泳。电泳结束后利用染色液染色2 h,再用脱色液(甲醇:乙酸:水=3:1:6,v/v/v)脱色至背景色透明,最后用凝胶成像仪拍照并保存。
1.2.3 鱼类明胶溶液粘度的测定
参考Hu等[15]的方法,利用数显旋转粘度计对明胶溶液的粘度进行测定。选择s61型转子,转速为100 r/min,旋转30 s后记录数据。粘度单位以厘泊(cp)表示,每个样品均重复测定3次。
1.2.4 明胶溶液流变性质的测定
参考Ma等[16]报道的方法并稍作修改,利用流变仪对明胶溶液的流变性质进行测定。取适量样品置于间隙为1 mm的平行板(直径为40 mm)之间,于45 ℃下平衡5 min后,在线性粘弹性区域内设定应变为2%,振荡频率为1 Hz,于45~5 ℃(冷却扫描)和5~45 ℃(加热扫描)范围内以1 ℃/min的速率进行温度斜坡扫描。记录明胶溶液的弹性模量(G')和粘性模量(G'')随温度的变化,G'和G''的交点视为明胶的凝胶点和熔化点。
1.2.5 热稳定性分析
利用差示扫描量热仪(differential scanning calorimeter,DSC)对明胶溶液的热转变温度进行扫描测定。准确称取10 μL明胶溶液置于Tzero铝盘并密封,在5 ℃下保温30 min后,以2 ℃/min的速率升温至50 ℃,扫描后获得DSC图谱。以空铝盘作为对照,用DSC分析软件对数据进行分析。
1.2.6 鱼类明胶凝胶的制备
取质量浓度为6.67%的明胶溶液30 mL倒入不锈钢圈(高3.0 cm,直径3.5 cm)内,将两端密封好后置于4 ℃冰箱平衡凝固制成凝胶,供以下实验使用。
1.2.6.1 明胶凝胶强度的测定
利用质构仪对凝胶强度进行测定。测定时使用5 kg传感器,直径为12.7 mm的P-0.5 s探头,测试速率为0.5 mm/s。穿透距离为4 mm时所施加的力表示凝胶强度,以“g”为单位。实验于室温下进行并重复测定3次。
1.2.6.2 明胶凝胶的质构(texture profile analysis,TPA)参数测定
利用质构仪P-50探头对明胶凝胶连续两次挤压形变30%,间隔时间5 s,测试速度为0.5 mm/s,对凝胶样品进行TPA分析。实验于室温下进行并重复测定3次。
1.2.6.3 明胶凝胶的微观结构
参考Fang等[17]报道的方法,从凝胶样品中切下长度为3 mm、厚度为2 mm的薄块,随后浸泡在含有2.5%(v/v)戊二醛的0.1 mol/L磷酸盐缓冲液(PBS,pH7.2)中固定24 h。随后用0.1 mol/L PBS(pH7.2)漂洗,再用乙醇梯度脱水。经CO2临界干燥后固定在导电胶带上并利用离子溅射仪镀金,最后利用电子显微镜进行观察并拍照。
1.3 数据处理
实验数据结果用平均值±标准差表示。采用SPSS17.0软件对数据进行方差分析(ANOVA),并通过Duncan多重比较对数据进行显著性检验分析,显著水平为0.05。
2. 结果与分析
2.1 加热对鱼类明胶分子量的影响
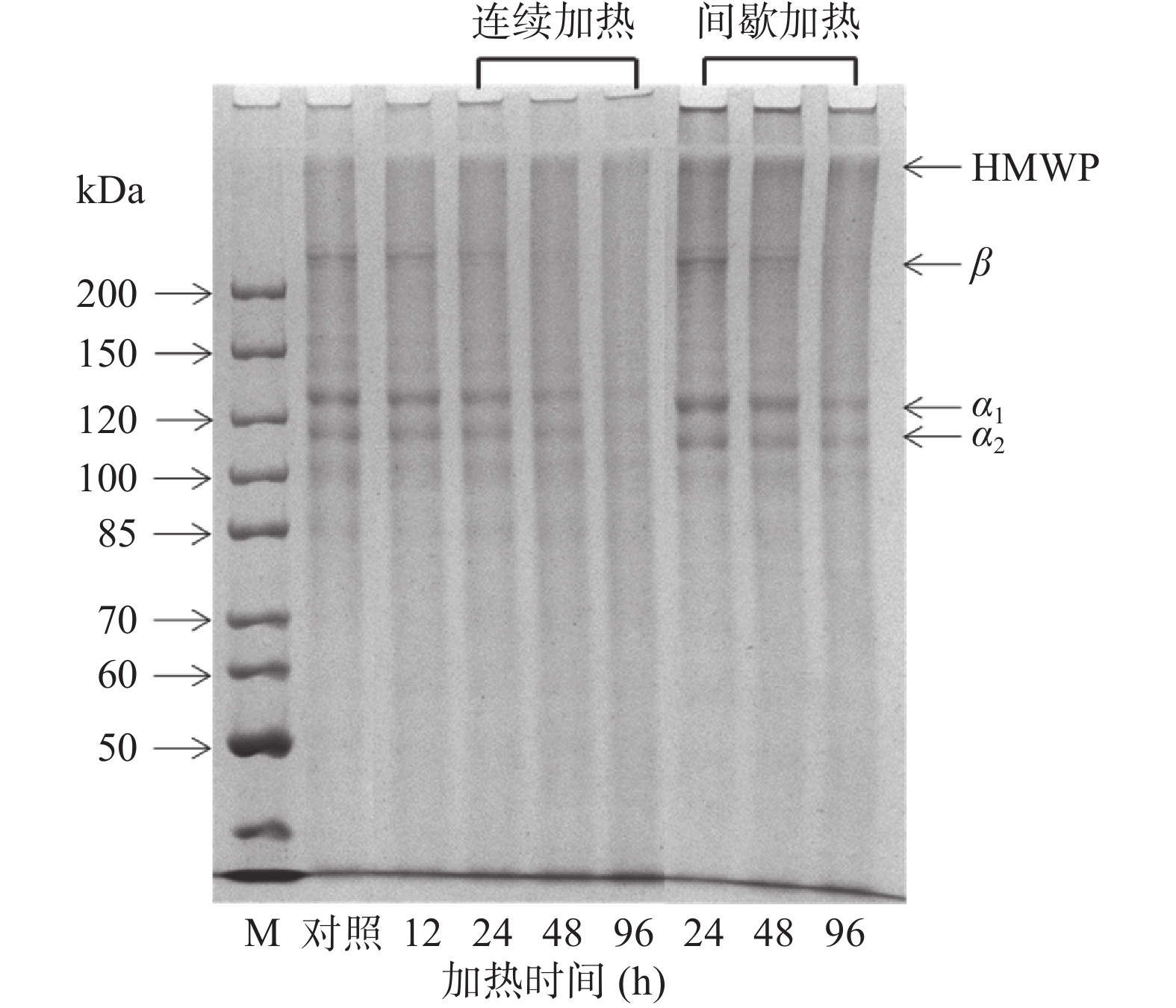
明胶的分子量分布与其物理性能等息息相关,尤其是高分子量组分的变化会对工业应用产生一些影响[11]。从图1中可以观察到,鱼类明胶(对照)主要含有分子量约为130、110 kDa的α1和α2肽链,以及高于200 kDa的β肽链,还有少量高分子量组分和110 kDa以下的低分子量组分。在连续加热过程中,随着加热时间的延长,明胶分子α1、α2和β条带逐渐变浅。当加热到48 h以上时β条带消失,加热到96 h以上时α1和α2条带明显降解,高分子量组分减少,而低分子量组分增多。这是由于明胶分子在加热过程中氢键及肽键受热断裂,使得明胶分子发生降解,从而分子量不断下降。有学者也证实了猪皮明胶经40 ℃加热72 h明胶分子中的肽键被破坏[11]。在间歇加热的过程中明胶分子也出现了类似的条带降解的现象,与连续加热过程不同的是间歇加热到96 h以上时β条带消失,而α1和α2条带明显变浅但未消失。这可能是因为间歇加热明胶在低温复性过程中,α链通过链内和链间的相互作用形成了三螺旋结构[18]。
2.2 加热对鱼类明胶溶液粘度的影响
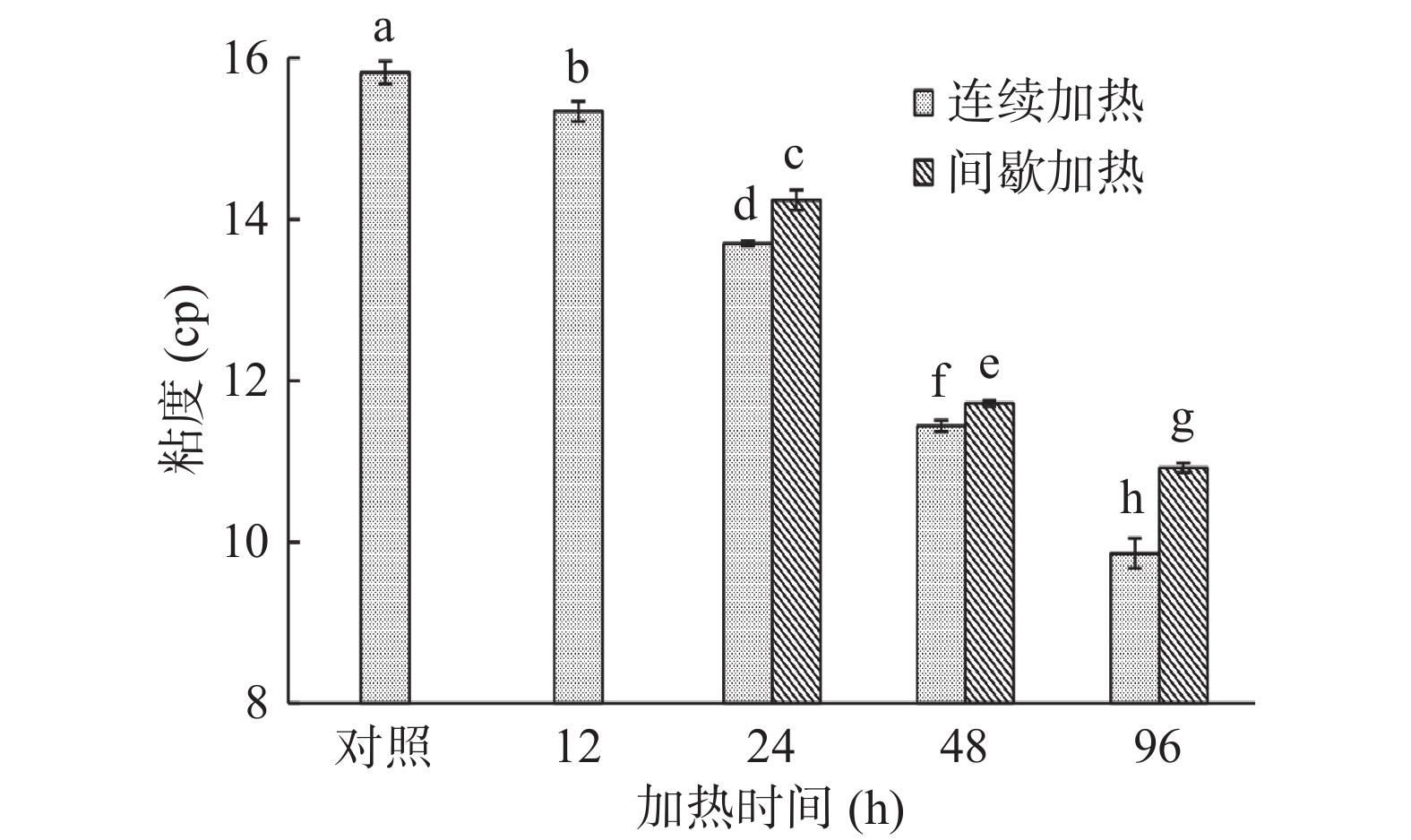
粘度可以反映蛋白质分子间力的变化,是明胶第二重要的商业物理性质[11]。由图2可知,对照组中的明胶溶液的粘度为15.82 cp。这与Shakila等[19]报道的从红鲷鱼骨中提取的明胶粘度(15.30 cp)相近,但高于哺乳动物明胶(13.80 cp)。在连续加热过程中,明胶的粘度随着加热时间的延长呈明显下降的趋势。这是由于明胶分子经加热后蛋白质聚合物的尺寸会减小,明胶分子中相互作用的氢键也会受到较高动能的破坏[20]。随着加热时间的延长,这种影响的程度会逐渐增大,使得明胶溶液的粘度不断减小。在间歇加热的过程中明胶溶液粘度也出现类似的下降现象,但间歇加热的明胶样品粘度下降的幅度比连续加热低。这可能与间歇加热明胶在冷藏期间发生的复性有关。根据报道,明胶链在复性过程中会通过形成三螺旋而自缔合,使明胶的粘度增加[21]。
![]() 图 2 加热方式及加热时间对鱼类明胶溶液粘度的影响注:不同字母表示差异显著(P<0.05);图5同。Figure 2. Effects of heating method and heating time on the viscosity of fish gelatin solution
图 2 加热方式及加热时间对鱼类明胶溶液粘度的影响注:不同字母表示差异显著(P<0.05);图5同。Figure 2. Effects of heating method and heating time on the viscosity of fish gelatin solution2.3 加热对鱼类明胶流变性质的影响
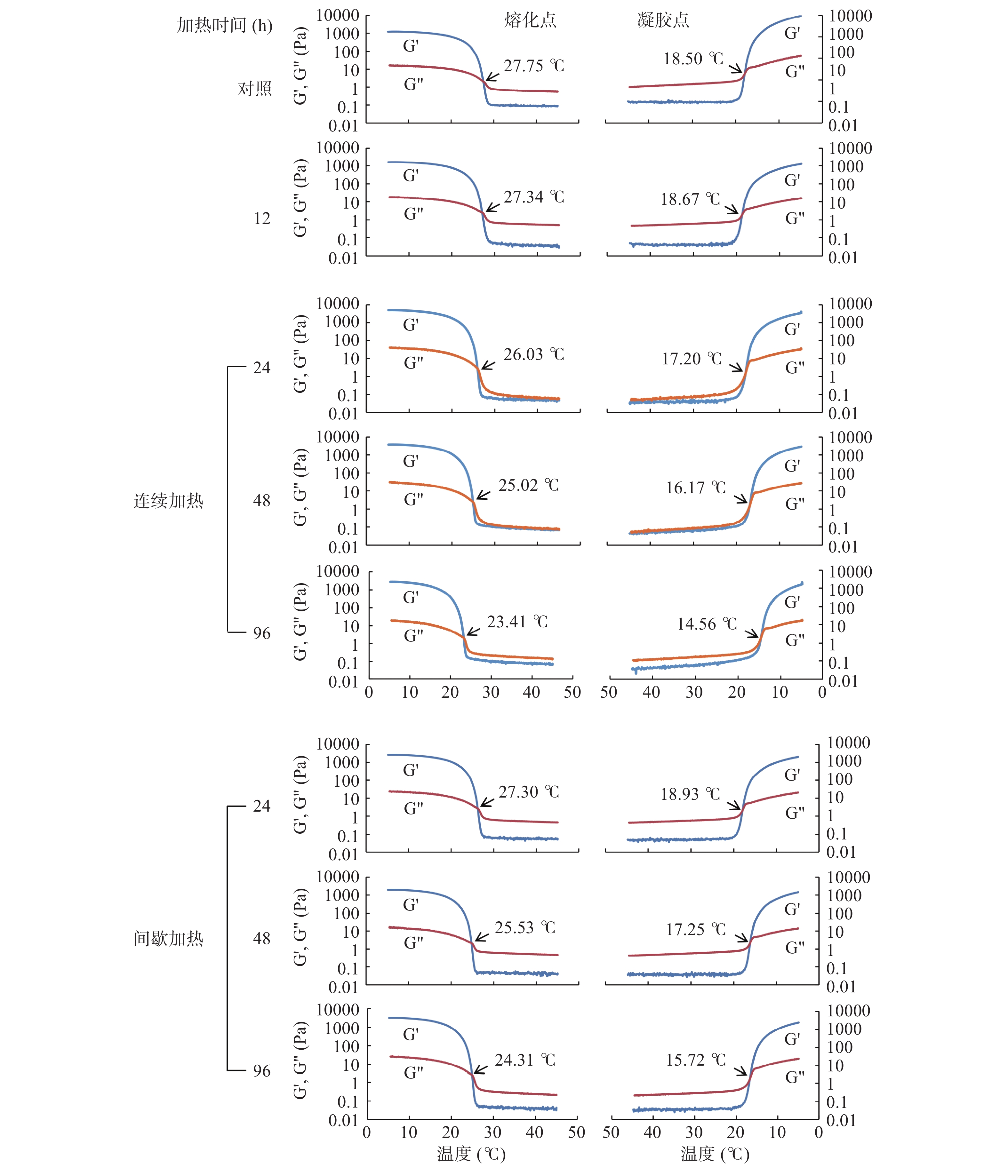
鱼类明胶样品在5~45 ℃内的升温和降温过程中出现的动态粘弹性曲线如图3所示。弹性模量(G')是指凝胶变形时因弹性变形而储存能量的量,而粘性模量(G'')代表样品因粘滞变形而造成的能量损耗[22]。在升温和降温过程中,G'和G''的交点分别对应明胶的熔化温度和凝胶温度[16]。从图3中可以看出鱼类明胶(对照组)熔化点和凝胶点分别为27.75 ℃和18.50 ℃。这与Kasankala 等[23]报道的草鱼皮明胶的熔化点(26.8 ℃)和凝胶点(19.5 ℃)温度相近,但低于Kosaraju等[24]报道的牛皮明胶的熔化点(31.2 ℃)和凝胶点(23.8 ℃)温度。这主要是与鱼类和哺乳动物明胶中亚氨酸含量的差异有关[23]。在连续加热的鱼类明胶样品(图3)中,随加热时间的延长,鱼类明胶熔化点和凝胶点的温度均呈下降趋势。这与明胶因受热导致较高分子量的组分发生降解(图1),形成较多不规则的短肽链甚至氨基酸有关。另外,从图3也可以看出间歇加热过程中也有类似的随加热时间的延长熔化点和凝胶点温度下降的现象,但是在相同的加热时间下间歇加热的明胶熔化点和凝胶点温度均高于连续加热的样品。这可能是由于明胶属于热可逆胶体,在降温过程中发生复性重新形成类胶原三股螺旋结构[25],从而提高了明胶的熔化点和凝胶点。
2.4 加热对鱼类明胶热转变温度的影响
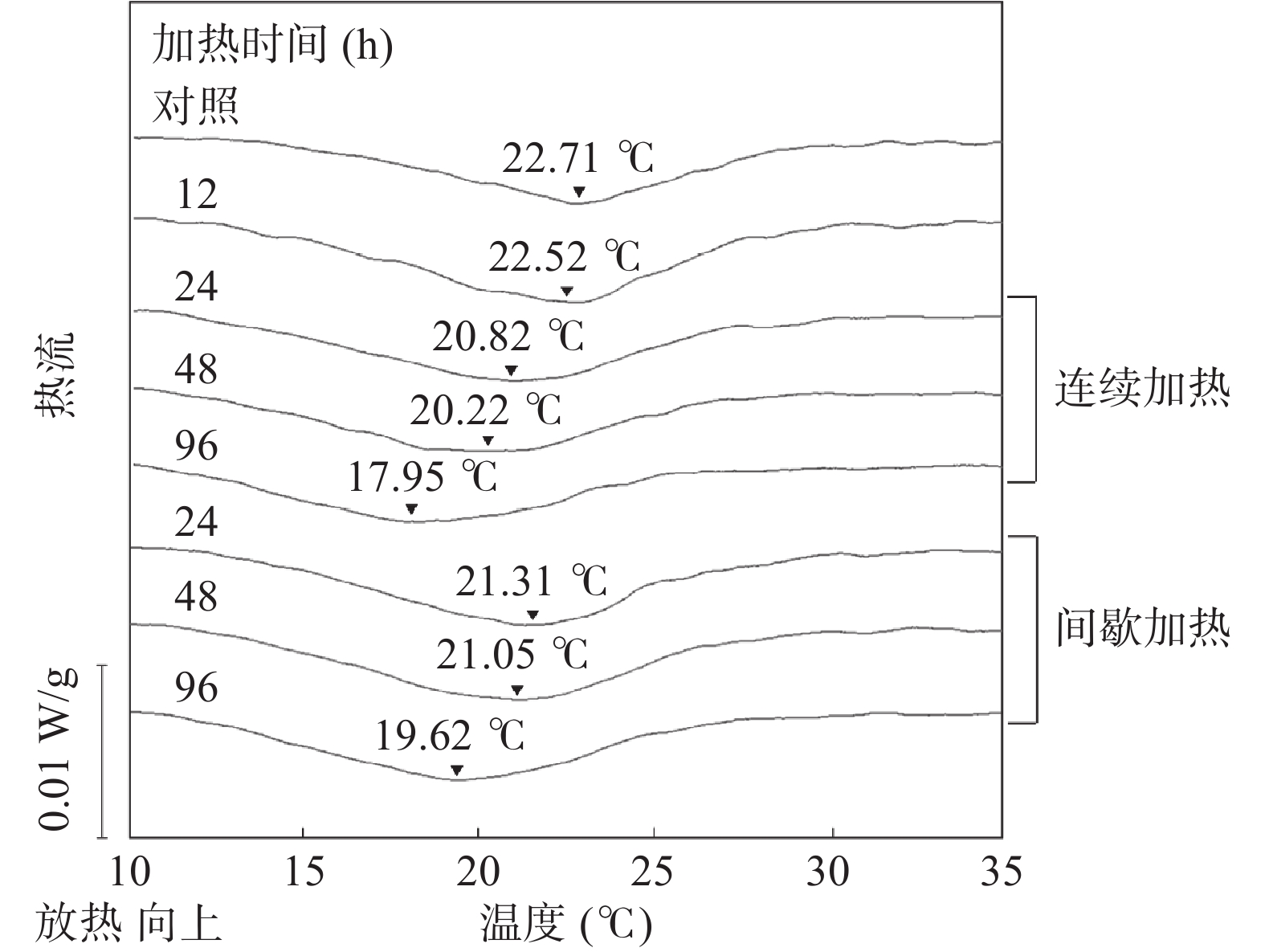
从图4中可以观察到鱼类明胶在5~50 ℃范围内的DSC扫描均显示单一的吸热峰,峰值对应的温度指的是一半明胶发生变性所达到的温度,即螺旋-线圈转变温度(Tm)[26]。在连续加热过程中,鱼类明胶(对照)的转变温度为22.71 ℃,这与Norziah等[27]报道的商业鱼胶的转变温度(23.74 ℃)接近。随着连续加热时间的延长,鱼类明胶的Tm呈明显下降的趋势。经过96 h连续加热,Tm从22.71 ℃降低到17.95 ℃。胶原材料的吸热过程伴随着氢键的断裂和三螺旋结构向无规卷曲结构的重排[26],因此加热会使明胶的Tm发生下降。在间歇加热的过程中也观察到类似的变化趋势,但在相同时间下间歇加热明胶的Tm比连续加热明胶的Tm下降幅度小。这是因为间歇加热明胶在降温过程中发生了复性,恢复部分螺旋结构[28]。Yoshimura等[29]在比较鲨鱼皮明胶与猪皮明胶时报道了明胶的结构稳定性与Tm呈正相关。因此,图4的结果也表明了在相同加热时间下间歇加热的明胶结构比连续加热的明胶稳定。
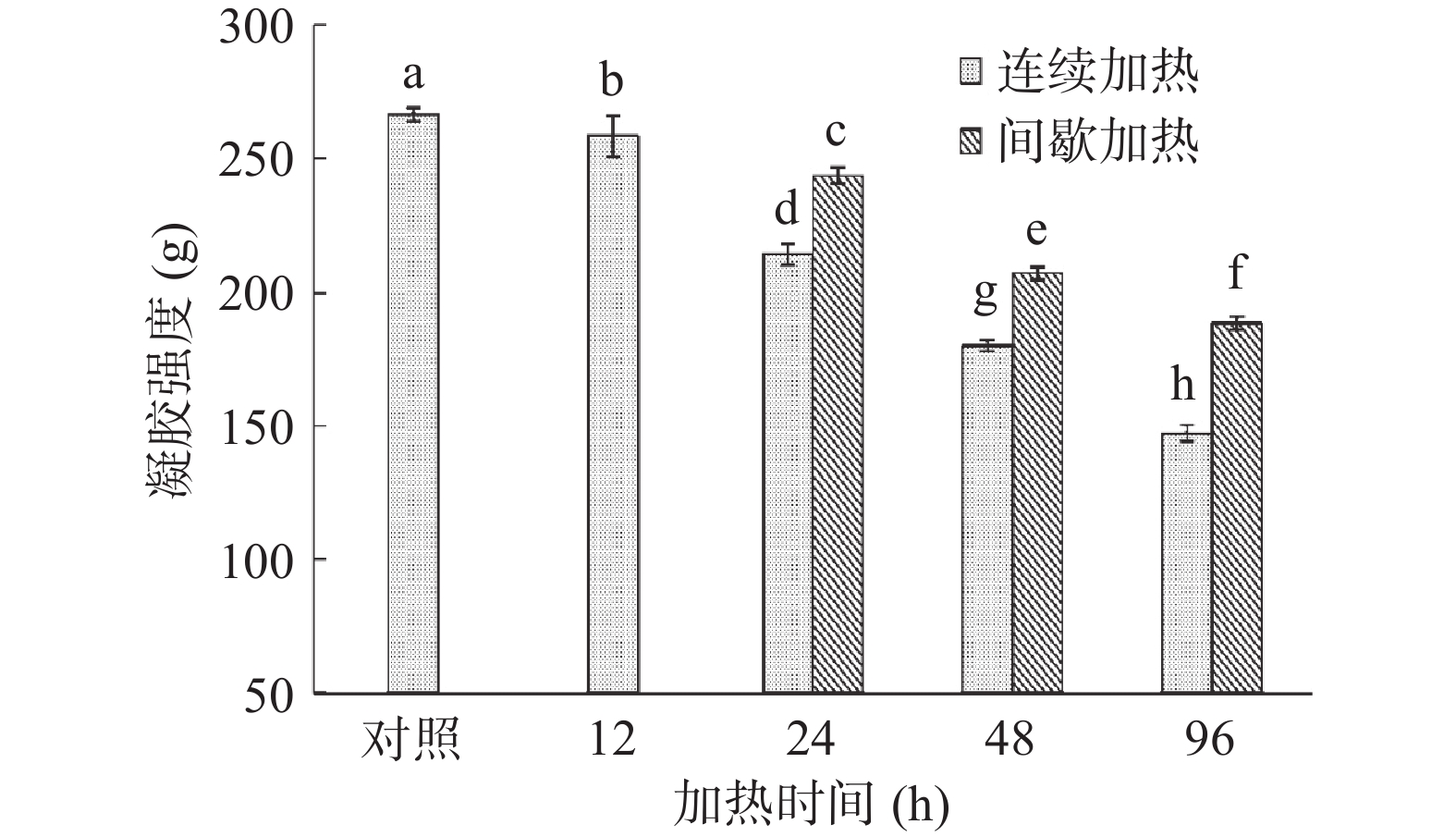
2.5 加热对鱼类明胶凝胶强度的影响
鱼类明胶具有形成热可逆凝胶的独特性质,在低温状态下明胶分子会相互缠绕通过交联形成具有三维网络结构的凝胶[30]。因此,凝胶强度也作为明胶凝胶性能的重要衡量指标之一[10]。由图5可知,鱼类明胶(对照)的凝胶强度为266.53 g,类似于Kasankala等[23]报道的草鱼皮明胶凝胶(267 g)。也有文献报道,利用黄鳍金枪鱼皮制备的明胶其凝胶强度可以高达426 g[30],而利用尼罗河鲈鱼幼鱼皮制备的明胶其凝胶强度只有217 g[31]。这些凝胶强度的差异可能与鱼的种类,以及明胶的提取方法有关[27]。从图5中还可以观察到,在连续加热过程中鱼类明胶的凝胶强度随加热时间的延长逐渐减小。明胶的凝胶强度主要取决于α、β肽链和游离羟基氨基酸的含量[19,32]。因此,明胶凝胶强度的减小可能是由于明胶分子中的α和β肽链在加热过程中逐渐降解(图1)。在间歇加热过程中,鱼类明胶的凝胶强度也出现随加热时间的延长逐渐减小的趋势,但减小的程度低于连续加热(图5)。明胶由于具有溶胶-凝胶热可逆转变特性,在低温条件下能够发生三螺旋结构的复性[33]。有研究表明,明胶羟脯氨酸羟基可以与游离水分子之间形成氢键和稳定三股螺旋结构[27]。因此,间歇加热的明胶分子在降温过程中发生复性形成氢键,一定程度上抑制热降解,保持较好的凝胶形成能力。明胶质量根据冻力凝冻强度可分为低凝胶强度(<150 g)、中凝胶强度(150~200 g)和高凝胶强度(220~300 g)三个水平[26]。为了保证明胶的质量,建议加热时间应小于12 h以保持明胶的高凝胶强度。
2.6 加热对鱼类明胶凝胶TPA的影响
鱼类明胶凝胶的TPA测定结果能够客观反映其力学性质[34]。由表1可以看出,鱼类明胶经加热12 h制备的明胶凝胶的硬度、胶着性和弹性均无明显变化。当加热时间超过12 h,随着加热时间的延长,硬度等TPA参数均呈下降趋势。硬度反映的是明胶的凝胶特性,而胶着性是硬度的补充参数[34]。伴随加热时间的延长,明胶α、β肽链逐渐发生热降解(图1),结果导致明胶凝胶的硬度等TPA参数发生下降。另一方面,由表1可以观察到,在相同加热时间下,间歇加热的明胶其凝胶的硬度、胶着性和弹性均比连续加热明胶样品高。这种变化趋势类似于明胶α、β肽链热降解的变化趋势(图1),再次表明了间歇加热可以抑制明胶的热降解,有利于形成高硬度的凝胶。
表 1 加热方式及加热时间对鱼类明胶凝胶TPA参数的影响Table 1. Effect of heating method and heating time on TPA parameters of gelatin gel加热方式 加热时间(h) 硬度(g) 胶着性(g) 弹性 对照 1102.74±131.30a 1006.71±143.04a 0.88±0.05a 连续加热 12 1104.13±86.48a 1000.14±106.11a 0.90±0.04a 24 843.17±90.04bc 763.60±86.86bc 0.79±0.04b 48 701.45±108.77cd 625.81±121.15cd 0.76±0.07b 96 533.56±48.52e 476.10±48.16e 0.76±0.02b 间歇加热 24 945.05±38.02b 838.12±41.31b 0.89±0.05a 48 848.51±27.38bc 769.52±32.20bc 0.89±0.01a 96 628.31±22.61de 560.16±30.54de 0.80±0.01b 注:同列肩标不同字母表示差异显著(P <0.05)。 2.7 加热方式及加热时间对鱼类明胶凝胶微观结构的影响
图6展示了明胶凝胶样品的微观结构。从对照样品中观察到明胶凝胶含有松散的网络结构并且网络中孔隙较大。Huang等[35]也从鳙鱼鱼鳞明胶制备的凝胶中观察到类似的结果。这是由于在凝胶化过程中无规卷曲明胶链发生复性缠绕成螺旋结构,进而形成三维网络状,并将水分子通过相互作用包裹于其中[7],脱水和干燥处理使水分子消失留下大量孔隙。然而加热时间为12 h时,明胶凝胶中孔隙明显减少,表面呈皱缩块状。在连续加热过程中,加热时间12~96 h,明胶凝胶样品表面越来越光滑平整。这可能是随着加热时间的延长,明胶不断受热降解,分子量逐渐下降(图1),小分子量肽段更容易填充于凝胶网络的孔隙中的缘故。经间歇加热明胶制备的凝胶样品中也能发现类似的趋势,但在相同时间下经间歇加热处理的样品其形态比连续加热的样品更粗糙且具有更多的孔隙。这可能与间歇加热明胶的分子量以及制备的凝胶强度高于连续加热的样品(图1和图5)有关。这些结果证实了间歇加热在一定程度上抑制了明胶的热降解。
3. 结论
本研究主要考察了加热方式和加热时间对鱼类明胶性质的影响。鱼类明胶的粘度、流变性质及热稳定性均随加热时间的延长明显下降。鱼类明胶制备的凝胶其凝胶强度和TPA参数也随热处理时间的延长不断减小,而由间歇加热制备的凝胶其凝胶性能和TPA参数均优于连续加热样品。这主要是由于间歇式加热的冷却过程有助于明胶蛋白复性,一定程度上抑制了明胶蛋白的热降解,因而形成的凝胶表面形态比连续加热样品具有更多的孔隙。本研究的结果表明,为了保证鱼类明胶的质量以及降低能源成本,建议连续加热时间不超过12 h,本文结果可以为鱼类明胶在工业上的应用提供参考。
-
图 2 加热方式及加热时间对鱼类明胶溶液粘度的影响
注:不同字母表示差异显著(P<0.05);图5同。
Figure 2. Effects of heating method and heating time on the viscosity of fish gelatin solution
表 1 加热方式及加热时间对鱼类明胶凝胶TPA参数的影响
Table 1 Effect of heating method and heating time on TPA parameters of gelatin gel
加热方式 加热时间(h) 硬度(g) 胶着性(g) 弹性 对照 1102.74±131.30a 1006.71±143.04a 0.88±0.05a 连续加热 12 1104.13±86.48a 1000.14±106.11a 0.90±0.04a 24 843.17±90.04bc 763.60±86.86bc 0.79±0.04b 48 701.45±108.77cd 625.81±121.15cd 0.76±0.07b 96 533.56±48.52e 476.10±48.16e 0.76±0.02b 间歇加热 24 945.05±38.02b 838.12±41.31b 0.89±0.05a 48 848.51±27.38bc 769.52±32.20bc 0.89±0.01a 96 628.31±22.61de 560.16±30.54de 0.80±0.01b 注:同列肩标不同字母表示差异显著(P <0.05)。 -
[1] KARIM A A, BHAT R. Fish gelatin: Properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids,2009,23(3):563−576. doi: 10.1016/j.foodhyd.2008.07.002
[2] CASANOVA F, MOHAMMADIFAR M A, JAHROMI M, et al. Physico-chemical, structural and techno-functional properties of gelatin from saithe (Pollachius virens) skin[J]. International Journal of Biological Macromolecules,2020,156:918−927. doi: 10.1016/j.ijbiomac.2020.04.047
[3] LIN L, REGENSTEIN J M, LV S, et al. An overview of gelatin derived from aquatic animals: Properties and modification[J]. Trends in Food Science & Technology,2017,68:102−112.
[4] LV L, HUANG Q, DING W, et al. Fish gelatin: The novel potential applications[J]. Journal of Functional Foods,2019,63:103581. doi: 10.1016/j.jff.2019.103581
[5] KARIM A A, BHAT R. Gelatin alternatives for the food industry: Recent developments, challenges and prospects[J]. Trends in Food Science & Technology,2008,19(12):644−656.
[6] LIU Y, WENG R, WANG W, et al. Tunable physical and mechanical properties of gelatin hydrogel after transglutaminase crosslinking on two gelatin types[J]. International Journal of Biological Macromolecules,2020,162:405−413. doi: 10.1016/j.ijbiomac.2020.06.185
[7] FARAHNAKY A, ZENDEBOODI F, AZIZI R, et al. Solubilization of bovine gelatin using power ultrasound: Gelation without heating[J]. Journal of Texture Studies,2017,48(2):87−94. doi: 10.1111/jtxs.12213
[8] 满泽洲, 涂宗财, 王辉, 等. 加工条件对鱼鳞明胶凝胶性能和微观结构的影响[J]. 食品科学,2013,34(23):67−71. [MAN Z Z, TU Z C, WANG H, et al. Effects of processing conditions on gel performance and microstructure of fish scale gelatin[J]. Food Science,2013,34(23):67−71. [9] VAN DEN BOSCH E, GIELENS C. Gelatin degradation at elevated temperature[J]. International Journal of Biological Macromolecules,2003,32(3-5):129−138. doi: 10.1016/S0141-8130(03)00046-1
[10] HOQUE M S, BENJAKUL S, PRODPRAN T. Effect of heat treatment of film-forming solution on the properties of film from cuttlefish (Sepia pharaonis) skin gelatin[J]. Journal of Food Engineering,2010,96(1):66−73. doi: 10.1016/j.jfoodeng.2009.06.046
[11] KARAYANNAKIDIS P D, ZOTOS A. Fish processing by-products as a potential source of gelatin: A review[J]. Journal of Aquatic Food Product Technology,2016,25(1):65−92. doi: 10.1080/10498850.2013.827767
[12] HUANG T, TU Z, SHANGGUAN X, et al. Fish gelatin modifications: A comprehensive review[J]. Trends in Food Science & Technology,2019,86:260−269.
[13] SOW L C, CHONG J M N, LIAO Q X, et al. Effects of κ-carrageenan on the structure and rheological properties of fish gelatin[J]. Journal of Food Engineering,2018,239:92−103. doi: 10.1016/j.jfoodeng.2018.05.035
[14] WENG W, WANG Y. Partial characterization and primary structure of collagen subunits from golden pompano skins[J]. Process Biochemistry,2018,70:98−103. doi: 10.1016/j.procbio.2018.03.030
[15] HU Y, SHI L, REN Z, et al. Characterization of emulsion films prepared from soy protein isolate at different preheating temperatures[J]. Journal of Food Engineering,2021,309:110697. doi: 10.1016/j.jfoodeng.2021.110697
[16] MA Y, ZENG X, MA X, et al. A simple and eco-friendly method of gelatin production from bone: One-step biocatalysis[J]. Journal of Cleaner Production,2019,209:916−926. doi: 10.1016/j.jclepro.2018.10.313
[17] FANG Q, SHI L, REN Z, et al. Effects of emulsified lard and TGase on gel properties of threadfin bream (Nemipterus virgatus) surimi[J]. LWT-Food Science and Technology,2021,146:111513. doi: 10.1016/j.lwt.2021.111513
[18] ENRIONE J, CHAR C, PEPCZYNSKA M, et al. Rheological and structural study of salmon gelatin with controlled molecular weight[J]. Polymers,2020,12(7):1587. doi: 10.3390/polym12071587
[19] SHAKILA R J, JEEVITHAN E, VARATHARAJAKUMAR A, et al. Functional characterization of gelatin extracted from bones of red snapper and grouper in comparison with mammalian gelatin[J]. LWT-Food Science and Technology,2012,48(1):30−36. doi: 10.1016/j.lwt.2012.03.007
[20] EISSA A S. Newtonian viscosity behavior of dilute solutions of polymerized whey proteins. Would viscosity measurements reveal more detailed molecular properties?[J]. Food Hydrocolloids,2013,30(1):200−205. doi: 10.1016/j.foodhyd.2012.05.018
[21] RBII K, SUREL O, BRAMBATI N, et al. Study of gelatin renaturation in aqueous solution by AFlFFF–MALS: Influence of a thermal pre-treatment applied on gelatin[J]. Food Hydrocolloids,2011,25(3):511−514. doi: 10.1016/j.foodhyd.2010.08.001
[22] CHEN H, SHI P, FAN F, et al. Hofmeister effect-assisted one step fabrication of fish gelatin hydrogels[J]. LWT,2020,121:108973. doi: 10.1016/j.lwt.2019.108973
[23] KASANKALA L M, Xue Y, YAO W, et al. Optimization of gelatine extraction from grass carp (Catenopharyngodon idella) fish skin by response surface methodology[J]. Bioresource Technology,2007,98(17):3338−3343. doi: 10.1016/j.biortech.2006.03.019
[24] KOSARAJU S L, PUVANENTHIRAN A, LILLFORD P. Naturally crosslinked gelatin gels with modified material properties[J]. Food Research International,2010,43(10):2385−2389. doi: 10.1016/j.foodres.2010.09.008
[25] CHEN T, EMBREE H D, BROWN E M, et al. Enzyme-catalyzed gel formation of gelatin and chitosan: Potential for in situ applications[J]. Biomaterials,2003,24(17):2831−2841. doi: 10.1016/S0142-9612(03)00096-6
[26] SARBON N M, BADII F, HOWELL N K. Preparation and characterisation of chicken skin gelatin as an alternative to mammalian gelatin[J]. Food Hydrocolloids,2013,30(1):143−151. doi: 10.1016/j.foodhyd.2012.05.009
[27] NORZIAH M H, AL-HASSAN A, KHAIRULNIZAM A B, et al. Characterization of fish gelatin from surimi processing wastes: Thermal analysis and effect of transglutaminase on gel properties[J]. Food Hydrocolloids,2009,23(6):1610−1616. doi: 10.1016/j.foodhyd.2008.12.004
[28] CHEN S, TANG L, HAO G, et al. Effects of α1/α2 ratios and drying temperatures on the properties of gelatin films prepared from tilapia (Tilapia zillii) skins[J]. Food Hydrocolloids,2016,52:573−580. doi: 10.1016/j.foodhyd.2015.07.026
[29] YOSHIMURA K, TERASHIMA M, HOZAN D, et al. Physical properties of shark gelatin compared with pig gelatin[J]. Journal of Agricultural and Food Chemistry,2000,48(6):2023−2027. doi: 10.1021/jf990887m
[30] CHO S M, GU Y S, KIM S B. Extracting optimization and physical properties of yellowfin tuna (Thunnus albacares) skin gelatin compared to mammalian gelatins[J]. Food Hydrocolloids,2005,19(2):221−229. doi: 10.1016/j.foodhyd.2004.05.005
[31] MUYONGA J H, COLE C G B, DUODU K G. Extraction and physico-chemical characterisation of Nile perch (Lates niloticus) skin and bone gelatin[J]. Food Hydrocolloids,2004,18(4):581−592. doi: 10.1016/j.foodhyd.2003.08.009
[32] ALI A M M, KISHIMURA H, BENJAKUL S. Physicochemical and molecular properties of gelatin from skin of golden carp (Probarbus Jullieni) as influenced by acid pretreatment and prior-ultrasonication[J]. Food Hydrocolloids,2018,82:164−172. doi: 10.1016/j.foodhyd.2018.03.052
[33] SOW L C, YANG H. Effects of salt and sugar addition on the physicochemical properties and nanostructure of fish gelatin[J]. Food Hydrocolloids,2015,45:72−82. doi: 10.1016/j.foodhyd.2014.10.021
[34] 杨晖, 马良, 于玮, 等. 兔皮明胶功能特性及其影响因素[J]. 食品科学,2016,37(23):7−12. [YANG H, MA L, YU W, et al. Functional characteristics and influencing factors of rabbit skin gelatin[J]. Food Science,2016,37(23):7−12. doi: 10.7506/spkx1002-6630-201623002 [35] HUANG T, TU Z, WANG H, et al. Pectin and enzyme complex modified fish scales gelatin: Rheological behavior, gel properties and nanostructure[J]. Carbohydrate Polymers,2017,156:294−302. doi: 10.1016/j.carbpol.2016.09.040
-
期刊类型引用(3)
1. 高涵,贾金辉,徐凌,朱丽婷,徐铭,程贵兰,蔡智军. 杏仁油凝胶软糖的配方及贮藏温度优化. 安徽农学通报. 2024(09): 94-102 .  百度学术
百度学术
2. 刘博文,孙洋,康宇,程凯旋,邓伶俐,程超,张驰,商龙臣. 食品凝胶递送体系的应用及研究进展. 食品与发酵工业. 2024(13): 377-387 .  百度学术
百度学术
3. 尹朝阳,石文琪,李卫东,朱明坤,董晶晶,孙纪录. 水产品源明胶的制备工艺、理化性质及结构的研究进展. 食品研究与开发. 2023(07): 193-203 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:

 下载:
下载:



