Interaction between Astaxanthin and Whey Protein Based on Fluorescence and Ultraviolet Spectroscopy
-
摘要: 本研究采用分子自组装技术制备虾青素/乳清蛋白纳米复合物,并探究虾青素(Astaxanthin,AST)与乳清蛋白(Whey Protein)之间的分子相互作用机制。选用乳清蛋白(α-乳白蛋白、β-乳球蛋白、浓缩乳清蛋白、牛血清蛋白)与虾青素自组装,通过控制水相蛋白质溶液与有机相虾青素溶液的比例,分别可控形成H聚集体或J聚集体虾青素/乳清蛋白纳米复合物(H/J Aggregates Astaxanthin/Whey Protein Nanocomplexes)。通过动态光散射仪(Dynamic Light Scattering,DLS)测定虾青素/乳清蛋白纳米复合物的粒径均在150~430 nm之间,多分散性指数(Polydispersity Index,PDI)表明分散性良好,电位在−12~−1 mV之间;采用透射电子显微镜(Transmission Electron Microscope,TEM)观察成功制备出的H聚集体或J聚集体虾青素/乳清蛋白纳米复合物呈边缘清晰光滑的近球形结构;紫外可见光谱表明4种蛋白质构建的H聚集体或J聚集体虾青素/乳清蛋白纳米复合物中虾青素H聚集体最大吸收波长λmax由虾青素单体的λmax480 nm蓝移至388 nm,虾青素J聚集体最大吸收波长λmax光谱红移,并显示出519和556 nm左右的并肩峰;通过荧光光谱分析表明由于虾青素聚集体特定的结构使形成的虾青素/乳清蛋白纳米复合物的荧光强度都明显增强,乳清蛋白中疏水性氨基酸及疏水性区域暴露。本研究从虾青素及其聚集体的水分散性和乳清蛋白载体特性两方面探究,为其后续在食品药品领域的开发及应用提供理论依据。Abstract: The molecule self-assembly technology was used to prepare astaxanthin/whey protein nanocomplex, and the interaction mechanism between astaxanthin (AST) and whey protein was studied. By controlling the proportion of astaxanthin organic solution and whey protein aqueous phase, whey protein (α-lactalbumin, β-lactoglobulin, whey protein concentrate and bovine serum albumin) and astaxanthin were used for preparing well formed H aggregates or J aggregates astaxanthin/bovine serum albumin nanocomplexes, the resultant H/J AWC-NPs were spherical with 150~430 nm diameter, polydispersity index (PDI) showed good dispersity and −12~−1 mV Zeta potential measured by dynamic light scattering (DLS). Both H aggregates and J aggregates astaxanthin/whey protein nanocomplexes were near spherical with clear and smooth edges by transmission electron microscopy (TEM). The analysis by ultraviolet-visible absorption spectra revealed that the absorption maximum λmax of astaxanthin H aggregates was shifted from 480 nm of astaxanthin monomer blue to 388 nm, and the absorption maximum λmax of astaxanthin J aggregates was shifted red, showing a parallel peak at about 519 and 556 nm. The fluorescence spectrum analysis showed that the fluorescence intensity of astaxanthin/whey protein nanocomplex was significantly enhanced due to the specific structure of astaxanthin aggregates, and hydrophobic amino acids and hydrophobic regions in whey protein were exposed. In this study, the water dispersion of astaxanthin and its aggregates and the characteristics of whey protein carrier were investigated to provide theoretical basis for its subsequent development and application in the field of food and medicine.
-
Keywords:
- astaxanthin(AST) /
- whey protein /
- nanocarriers /
- UV-Vis spectra /
- fluorescence spectra /
- interaction
-
虾青素是一种酮式类胡萝卜素[1],广泛存在于虾、蟹、鱼、藻类、酵母等生物中。虾青素分子式为C40H52O4,其分子结构为共轭多烯不饱和链,常见虾青素为紫红色粉末。Lu等[2]的研究发现,虾青素单体分子在水合溶剂中可以发生分子聚集,产生头与头面对面平行堆积卡包(Card-packed)构型的H聚集体(如图1A)和头与尾错位平行堆积头包尾(Head-to-tail)构型的J聚集体(如图1B)。
虾青素抗氧化性极强,并且具有抗肿瘤[3]、防癌症[4]、抗炎症[5]、光保护[6]、视力保护[7]、中枢神经的保护[8]及预防心血管疾病[9]等多种对人类有益的生理功能。这些生理功能使其在医药、食品等行业有着广泛的应用。但是虾青素水分散性较差,并且在光、热、氧气等条件下容易发生分解不稳定,导致其生物利用度较低,使虾青素的应用受到限制[10]。乳清蛋白主要生物活性成分包括α-乳白蛋白(α-lactalbumin Solution,α-La)、β-乳球蛋白(β-lactoglobulin,β-Lg)、牛血清蛋白(Bovine Serum Albumin,BSA)、免疫球蛋白(Immunoglobulins,Ig)、乳铁蛋白(Lactoferrin,LF)、乳过氧化物酶(Lactoperoxidase,LP)等[11]。乳清蛋白在提高免疫力[12]、抗氧化[13]、抗癌[14]、缓解疲劳[15]等方面有多种应用。并且乳清蛋白可以与多种小分子或生物大分子发生作用,具有配体结合性和可以结合多种金属离子的功能特性。乳清蛋白的组成和结构决定了它可作为载体运用,这些功能主要是由α-乳白蛋白、β-乳球蛋白以及牛血清蛋白所提供,所以研究选用了这三种蛋白以及浓缩乳清蛋白(Whey Protein Concentrate,WPC)进行研究。江萍[16]利用乳清蛋白包埋姜黄素形成载药纳米粒,提高了姜黄素在小肠上皮的吸收效率;Shafaei等[17]阐明β-乳球蛋白作为高效多样载体蛋白的潜力,以及其形成靶向性良好的纳米载体体系的能力;贾前生等[18]运用乳铁蛋白对姜黄素进行包载,发现构建的乳铁蛋白姜黄素纳米载药递送系统能够有效提升姜黄素的生物可利用率。本研究依据乳清蛋白良好的载体特性,拟构建虾青素/乳清蛋白纳米复合物解决虾青素水分散性差问题,并通过紫外光谱法和荧光光谱法分析虾青素聚集体与乳清蛋白(α-乳白蛋白、β-乳球蛋白、浓缩乳清蛋白、牛血清蛋白)的相互作用,探究虾青素聚集体与乳清蛋白的结合机制,以期提高虾青素及其聚集体的水分散性和生物利用度,并为乳清蛋白作为载体特性的应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
虾青素 纯度99%,分子量596.84 kDa,上海阿拉丁生化科技股份有限公司;α-乳白蛋白 纯度85%,分子量14.2 kDa,上海源叶生物科技有限公司;β-乳球蛋白(纯度90%,分子量18.3 kDa)、牛血清蛋白(纯度97%,分子量66.430 kDa) 北京索莱宝科技有限公司;浓缩乳清蛋白粉 蛋白含量80%,美国Glanbia营养有限公司;无水乙醇等 国药化学试剂有限公司。
FA1004精密电子天平 上海舜宇恒平科学仪器有限公司;AMM-6T多点磁力搅拌器 天津奥特赛恩斯仪器有限公司;Nano-S90马尔文粒度仪、Nano-Z Zeta电位仪 英国马尔文仪器有限公司;UPT-II-10T优普系列超纯水器 四川优普超纯科技有限公司;DHG-9140A 电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;MJ-78A高压灭菌锅 施都凯仪器设备(上海)有限公司;DF-101S集热式恒温磁力搅拌器 巩义市予华仪器有限责任公司;RF-6000荧光分光光度计 日本株式会社岛津制作所;UV-3100紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 溶液的制备
1.2.1.1 虾青素溶液的制备
参考Lu等[2]的方法,略有修改,配制虾青素母液。准确称取0.00250 g虾青素置于100 mL烧瓶中,加入100 mL无水乙醇溶解虾青素,在室温避光的条件下200 r/min磁力搅拌1 h,配制浓度为0.0250 mg/mL的虾青素溶液,使用时现配现用。
1.2.1.2 乳清蛋白的制备
参考江萍[16]的方法,略有修改,配制乳清蛋白母液。
α-乳白蛋白溶液(α-La)的制备:称取10 mg α-乳白蛋白白色固体粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的α-乳白蛋白溶液为母液,4 ℃冷藏。取1 mL α-La母液,加入到39 mL无菌水中得到0.025 mg/mL α-La溶液;取1 mL α-La母液加入到31.5 mL无菌水中得到溶液0.03 mg/mL α-La溶液。
β-乳球蛋白(β-Lg)溶液的制备:称取10 mg β-乳球蛋白白色固体粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的β-乳球蛋白溶液为母液,4 ℃冷藏。取1 mL β-Lg母液,加入到39 mL无菌水中得到0.025 mg/mL β-Lg溶液;取1 mL β-Lg母液加入到31.5 mL无菌水中得到0.03 mg/mL β-Lg溶液。
浓缩乳清蛋白(Whey Protein Concentrate,WPC)溶液的制备:称取10 mg浓缩乳清蛋白白色固体粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的浓缩乳清蛋白溶液为母液,4 ℃冷藏。取1 mL 浓缩乳清蛋白母液,加入到39 mL无菌水中得到0.025 mg/mL WPC溶液;取1 mL浓缩乳清蛋白母液加入到31.5 mL无菌水中得到0.03 mg/mL WPC溶液。
牛血清蛋白(Bovine Serum Albumin,BSA)溶液的制备:称取10 mg牛血清蛋白粉末,加入到10 mL无菌水中,制备浓度为1 mg/mL的牛血清蛋白溶液为母液,4 ℃冷藏。取1 mL BSA母液,加入到39 mL无菌水中得到0.025 mg/mL BSA溶液;取1 mL BSA母液加入到31.5 mL无菌水中得到0.03 mg/mL BSA溶液。
1.2.1.3 H型/J型聚集体虾青素与乳清蛋白纳米复合物的可控制备
本实验分别对α-乳白蛋白、β-乳球蛋白、乳清蛋白粉、牛血清蛋白包载的虾青素进行相关探究。运用分子层层自组装法进行制备[19]。以下八种纳米复合物溶液所用四种蛋白终浓度均为0.02 mg/mL,所用虾青素(AST)终浓度均为0.005 mg/mL。
H型/J型虾青素/α-乳白蛋白纳米复合物(H/J Aggregates Astaxanthin/α-La Nanocomplexes,H/J-ALaNs)的制备如下。H-ALaNs:吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mL α-La溶液,200 r/min避光磁力搅拌10 min;J-ALaNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mL α-La溶液中,200 r/min避光磁力搅拌10 min。
H型/J型虾青素/β-乳球蛋白纳米复合物(H/J Aggregates Astaxanthin/β-Lg Nanocomplexes,H/J-ALgNs)的制备:H-ALgNs的制备如下。吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mL β-Lg溶液,200 r/min避光磁力搅拌10 min;J-ALgNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mL β-Lg液中,200 r/min避光磁力搅拌10 min。
H型/J型虾青素/浓缩乳清蛋白纳米复合物(H/J Aggregates Astaxanthin/Whey protein concentrate Nanocomplexes,H/J-AWNs)的制备如下。H-AWNs的制备:吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mL WPC溶液,200 r/min避光磁力搅拌10 min;J-AWNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mL WPC溶液中,200 r/min避光磁力搅拌10 min。
H型/J型虾青素/牛血清蛋白纳米复合物(H/J Aggregates Astaxanthin/Bovine Serum Albumin Nanocomplexes,H/J-ABNs)的制备如下。H-ABNs的制备:吸取2 mL 0.025 mg/mL AST溶液,逐渐滴加到8 mL 0.025 mg/mL BSA溶液,200 r/min避光磁力搅拌10 min;J-ABNs的制备:吸取10 mL 0.025 mg/mL AST溶液,向其中加入7.5 mL无水乙醇,磁力搅拌10 min后吸取3.5 mL逐滴加入到6.5 mL 0.03 mg/mL BSA溶液中,200 r/min避光磁力搅拌10 min。
1.2.2 虾青素/乳清蛋白纳米复合物的外观分析
通过1.2.1的方法对虾青素/乳清蛋白纳米复合物进行制备,将新鲜制备的虾青素纳米复合物悬液装入适合的玻璃样品瓶中,密封、室温25 ℃、避光条件下储存,观察其溶液状态,对其进行外观分析。
1.2.3 虾青素/乳清蛋白纳米复合物的粒径及电位测量
粒径、多分散性指数(PDI)的测定[20]:打开马尔文粒度仪预热30 min。清洗比色皿,并用待测液润洗两次,取新鲜制备的纳米复合物1 mL加入粒径样品皿中,放入卡槽中,测量角度为90o,测试温度为25 ℃,平衡时间为120 s,循环次数为90次,分散介质为水。每个样品测量四次,取平均值,进行数据分析。
Zeta电位的测定:根据亨利方程(Henry)公式。虾青素/乳清蛋白纳米复合物的电位采用动态光散射的方法,测试时首先测得复合物的电泳速率UE,然后根据亨利方程(Henry)求得虾青素/乳清蛋白纳米复合物的电位,测试温度为25 ℃,样品平衡时间120 s。样品比色皿为1 cm聚苯乙烯池,采用一对0.45 cm2铂电极,间距为0.4 cm。每个样品测量四次,取平均值,进行数据分析。
1.2.4 虾青素/乳清蛋白纳米复合物的透射电镜观察
按照Preethi等[21]的方法略有调整。取一滴样品滴于洁净的石蜡板上,将铜网轻轻放在液滴表面使液滴浸入铜网格中。大约10 min后取下铜网,用滤纸将铜网表面液体擦干,沾有液体表面的铜网为正面朝上放置。将铜网正面与磷钨酸液滴接触染色10 min,取下铜网,室温下干燥后,放入透射电子显微镜中观察。
1.2.5 虾青素/乳清蛋白纳米复合物的紫外吸收光谱测量
按照Qiao等[22]的方法略有调整,打开紫外可见分光光度计,预热15 min,用待测溶液润3次石英比色皿。参数设置扫描范围为200~800 nm;间距为1.0 nm;精度为10。测定样品的紫外光谱,用灭菌超纯水做基线校准。
1.2.6 虾青素/乳清蛋白纳米复合物的荧光检测
按照Liu等[23]的方法略有调整,将制备的虾青素/乳清蛋白纳米复合物以及α-乳白蛋白溶液、β-乳球蛋白溶液、浓缩乳清蛋白溶液、牛血清蛋白溶液分别进行荧光光谱扫描。发射光谱扫描的参数设置如下,设置激发波长固定为280 nm,发射光谱范围设置为290~450 nm,激发和发射的狭缝宽度固定在10 nm,扫描速度为6000 nm/min。在上述参数设置下得到其相应的荧光光谱。
1.3 数据处理
本文运用Microsoft Excel 2020等软件处理试验数据,获得虾青素与乳清蛋白相互作用的紫外可见光吸收光谱、荧光光谱,并且由谱图分析两者相互作用机制。
2. 结果与分析
2.1 虾青素/乳清蛋白纳米复合物的外观分析
研究选用了α-乳白蛋白(α-La)、β-乳球蛋白(β-Lg)、牛血清蛋白(BSA)三种单一蛋白及浓缩乳清蛋白(WPC),由1.2.1所示的分子自组装方法,制备出H/J-ALaNs、H/J-ALgNs、H/J-AWNs、H/J-ABNs溶液。如图2所示四种蛋白所构建的纳米复合物当中,其中H型-虾青素/乳清蛋白纳米复合物均为浅黄色均一透明溶液、无沉淀、无絮凝;J型-虾青素/乳清蛋白纳米复合物均为粉紫均一透明溶液、无沉淀、无絮凝。四种复合物在颜色深浅上存在差异。Lu等[2]的研究发现,虾青素单体分子以“面对面”平行的共轭链堆叠而成H聚集体,相对于虾青素游离单体的最大吸收波长发生蓝移,H聚集体颜色为黄色。以松散的虾青素单体分子错位平行堆叠组成的J聚集体,相对于虾青素游离单体的最大吸收波长发生红移,显现粉紫色[24]。根据实验室前期的研究[25]可知,虾青素H聚集体和J聚集体可被包裹在DNA-壳聚糖构建的疏水微区中,使形成的纳米悬液呈现出相应的颜色。参考李敬等[26]的研究,推测虾青素以H聚集体或J聚集体嵌入蛋白的疏水微区中,后期可以通过紫外光谱或荧光光谱等方法进行进一步的分析。
2.2 虾青素/乳清蛋白纳米复合物的粒径及电位
利用动态光散射仪测量虾青素/乳清蛋白纳米复合物的粒径及电位,得到结果如表1。
表 1 虾青素/乳清蛋白纳米复合物的粒径及电位Table 1. Particle size and potential of astaxanthin/whey protein nanocomplex样品名称 粒径(nm) PDI 电位(mV) H-ALaNs 159±39 0.41±0.03 -10.7±2.0 J-ALaNs 390±9 0.24±0.05 -5.8±1.7 H-ALgNs 257±5 0.31±0.05 -8.5±1.4 J-ALgNs 298±8 0.20±0.01 -1.4±0.3 H-AWNs 340±12 0.43±0.06 -5.2±1.3 J-AWNs 427±5 0.28±0.03 -4.7±0.4 H-ABNs 251±15 0.33±0.88 -6.1±1.0 J-ABNs 357±14 0.21±0.05 -2.7±0.3 表1为乳清蛋白与虾青素制备的纳米复合物所对应的粒径、多分散性指数(PDI)、电位。因蛋白空间结构不同,其中α-乳白蛋白相较于其他三种蛋白与J聚集体虾青素所形成的纳米复合物的粒径相较较小,β-乳球蛋白相较于其他三种蛋白与H聚集体虾青素形成的纳米复合物的粒径小,导致不同蛋白与虾青素相互作用程度不同,多分散指数有所差异。由表1可知H聚集体的粒径普遍小于J聚集体,且前者的PDI和电位大于后者,猜测是因为H聚集体虾青素与J聚集体虾青素的结构不同所造成的。Zhao等[27]分析了首尾相连结构的J-AST和层层堆叠结构的H-AST。其中首尾相连的结构相对于层层堆叠,形成的复合物的粒径较大。体系粒径减少会导致乳液中分散粒子的相互作用增大,从而提高乳液的稳定性[24]。乳液的稳定是由液滴间的静电排斥维持的,因此体系电位值可侧面反映体系稳定性[26]。由表1可知四种蛋白与虾青素形成复合物的电位也有较为明显的差异,其中H型/J型虾青素/α-乳白蛋白纳米复合物有较高电位,一定程度上表明其稳定性较高。由表1数据可知,虾青素/乳清蛋白纳米复合物粒径均在150~430 nm之间,PDI分散性良好,电位在−12~−1 mV之间。参考刘俊丽等[28]的研究,说明实验成功制备出虾青素/乳清蛋白纳米复合物。
2.3 虾青素/乳清蛋白纳米复合物的透射电镜观察
由前期实验探究发现,β-乳球蛋白、浓缩乳清蛋白不能形成稳定的纳米粒,α-乳白蛋白市价较贵,所以选用牛血清蛋白进行接下来的实验。采用1.2.1.3中的方法成功制备H-ABNs和J-ABNs纳米复合物,通过TEM观察制备的样品的样貌,其结果如图3所示。
由图3可以看出H/J-ABNs溶液近似为球形,这与Wu等[29]制备的纳米复合物形状相似。如图3,形成的纳米复合物中间为黑色的,结合紧密的实心球状物,球状物外部呈灰色且结合较为疏松,推测是牛血清白蛋白形成了核-壳结构排列在外部,中间黑色球状物为虾青素,被包裹在牛血清蛋白的核-壳纳米结构中。由图3中对比可以看出J-ABNs溶液的纳米粒径要大于H-ABNs溶液的纳米粒径,通过2.2中对于H/J-ABNs溶液的粒径的测量可知,H-ABNs溶液的水合粒径为251 nm,J-ABNs溶液的水合粒径为357 nm,J-ABNs溶液的水合粒径大于H-ABNs溶液的水合粒径。DLS测得的水合粒径大于透射电镜所测得的纳米粒径,这可能是由于电镜测量时需要脱水造成的[30]。该透射电镜图表明,虾青素/乳清蛋白纳米复合物(H/J-ABNs)的纳米粒子分布均匀,虾青素被包裹在乳清蛋白形成的核-壳纳米结构中,说明虾青素/乳清蛋白纳米复合物(H/J-ABNs)成功制备。
2.4 虾青素/乳清蛋白纳米复合物的紫外可见光谱分析
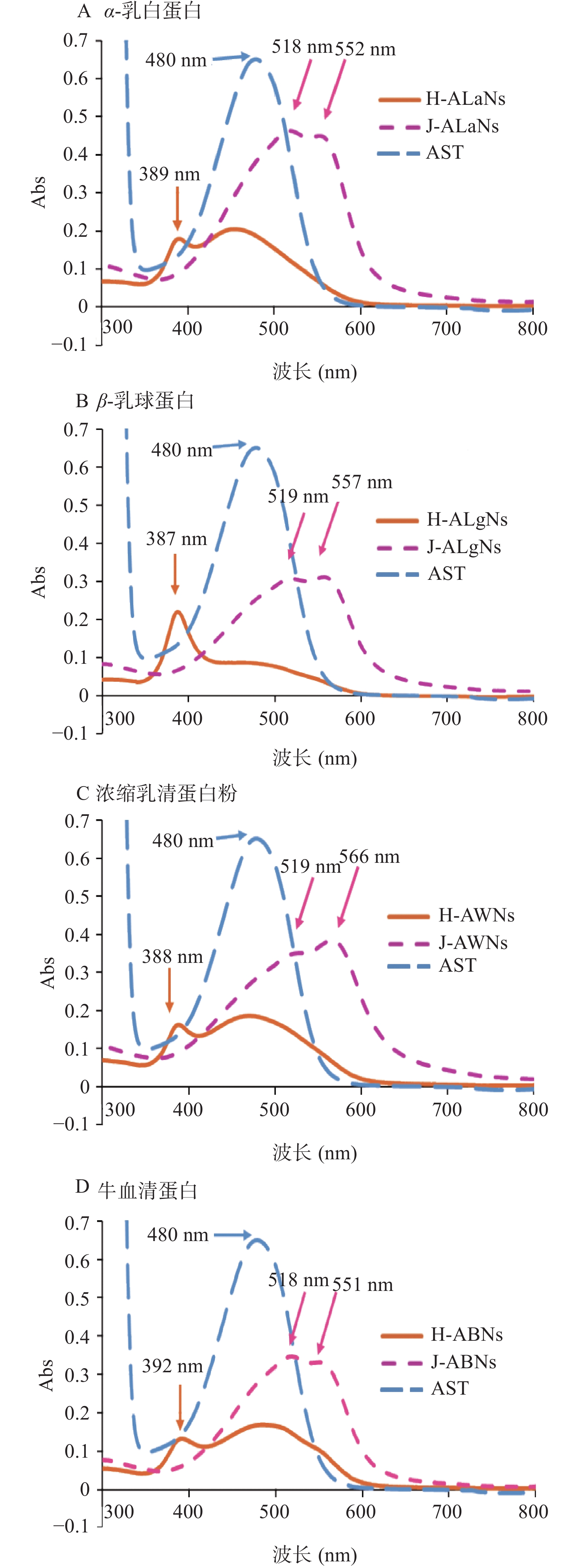
对虾青素/乳清蛋白纳米复合物进行紫外光谱扫描,在300~800 nm得到光谱如图4。
由图4可知H型-虾青素/乳清蛋白纳米复合物普遍在388 nm左右存在一个吸收峰,因H聚集体不稳定,向J聚集体进行转换,导致A、C、D的H聚集体在480 nm处存在另外一个吸收峰,而J-ALaNs在519和556 nm左右有两处显示并肩峰。乳清蛋白中的酪氨酸(Tyr)、苯丙氨酸(Phe)、色氨酸(Trp)在300~800 nm没有吸收峰[31],而本研究中虾青素/乳清蛋白纳米复合物的吸收峰明显,这一变化与Zhao等[32]研究的H型/J型虾青素/DNA/壳聚糖纳米复合物的紫外可见吸收光谱基本相似,这是虾青素所造成的。虾青素/乳清蛋白纳米复合物中虾青素H聚集体光谱由单体480 nm蓝移至388 nm,虾青素J聚集体光谱红移,并显示出519和556 nm左右的并肩峰,表明虾青素对乳清蛋白产生了影响,两者结合形成了纳米复合物。
2.5 虾青素/乳清蛋白纳米复合物的荧光光谱分析
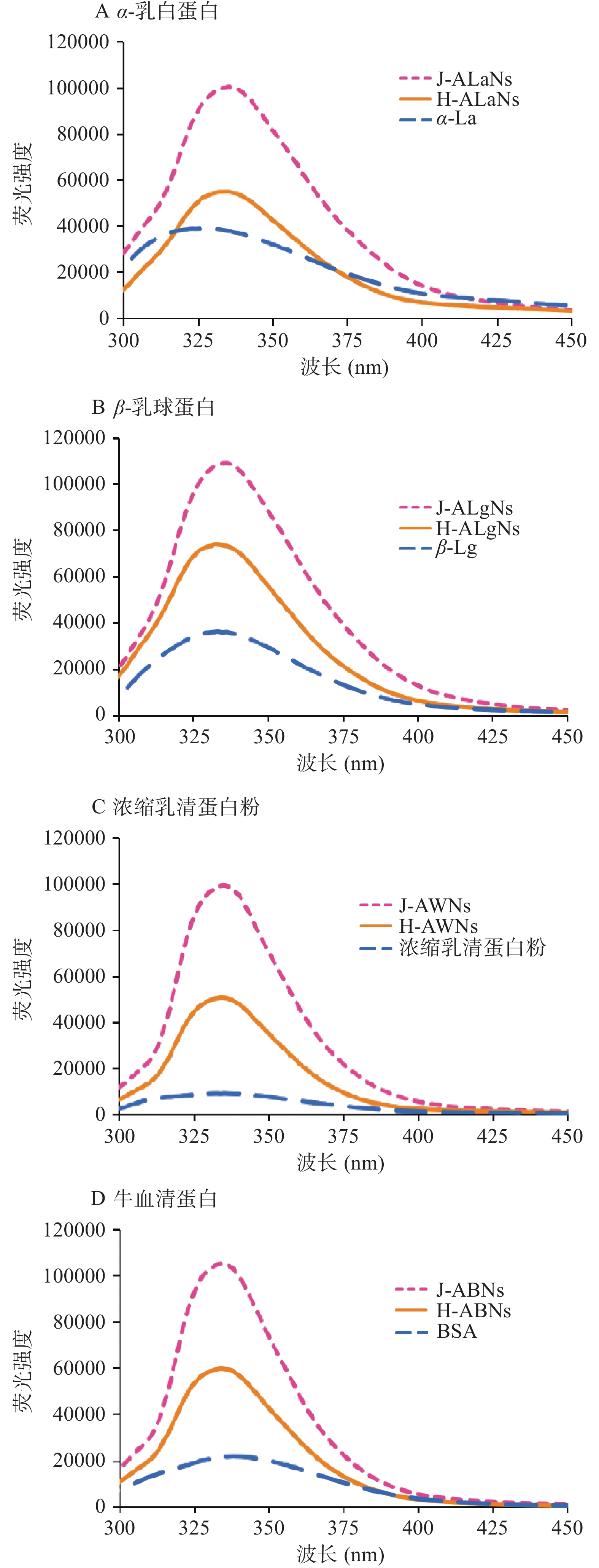
在270~300 nm激发光下可发出内源荧光的蛋白质分别为酪氨酸、色氨酸、苯丙酸这三种氨基酸的残基,其中色氨酸的荧光强度最大[33]。三种发光基团的荧光峰特征见表2。氨基酸残基的荧光发射波长与其所处的微环境有关,环境极性增加则发生峰红移,疏水性增加则发生峰蓝移[34]。对α-乳白蛋白、β-乳球蛋白、浓缩乳清蛋白、牛血清蛋白形成的虾青素/乳清蛋白纳米复合物以及α-乳白蛋白溶液、β-乳球蛋白溶液、浓缩乳清蛋白溶液、牛血清蛋白溶液分别进行荧光扫描,得到的荧光强度如图5所示。
表 2 三种发光基团的荧光峰特征Table 2. Fluorescence peak characteristics of three luminescent clusters生色团 激发峰(nm) 发射峰(nm) 苯丙氨酸 260 282 酪氨酸 275 303 色氨酸 287 348 由图5看出,四种蛋白形成虾青素/乳清蛋白纳米复合物后的荧光强度与对应的蛋白相比均增强。虾青素作为一种含共轭双键的短链多烯类生物分子,和其他类胡萝卜素分子一样有宽带荧光[35]。虾青素有两个β-紫罗兰酮环和11个共轭双键,这种结构导致了虾青素/乳清蛋白纳米复合物荧光强度的增加。同时虾青素本身可发生分子自聚集形成具有内源荧光的虾青素H聚集体和虾青素J聚集体,使虾青素/乳清蛋白纳米复合物的荧光强度增强。这与鲁瑞梅等[36]发现共轭聚合物会使荧光增强的实验结果一致,并且与通过改变温度和加入聚合乳清蛋白导致的蛋白质荧光强度增加[33]结果相似。
α-乳白蛋白形成的两种纳米复合物H/J-ALaNs的最大发射波长发生红移,表明形成的纳米复合物使色氨酸等残基的光强猝灭,且所处的微环境极性更强[37]。虾青素与α-乳白蛋白结合后形成的纳米复合物与张明等[38]发现的乳白蛋白结合油酸或亚油酸后的荧光光谱的变化相似,乳白蛋白中的色氨酸所处微环境的极性增强。同时β-乳球蛋白形成的两种纳米复合物,J-ALgNs的最大发射波长相对于β-Lg发生红移;H-ALgNs相对于β-Lg发生蓝移。其中J-ALgNs的红移说明β-Lg疏水性下降,结合位点的氨基酸残基部分可能暴露在溶剂中,H-ALgNs发生较少蓝移,推测是虾青素H聚集体的特殊结构导致β-Lg疏水性增强。由图5可知,浓缩乳清蛋白的最大发射波长为335 nm。H/J-AWNs纳米复合物的最大发射峰仍在335 nm左右,与浓缩乳清蛋白的最大发射峰为335 nm相比,几乎未发生移动。参考Burstezin等[39]的研究,色氨酸残基的最大发射峰在335 nm,部分色氨酸残基处于蛋白质内部非极性区域,另一部分可能处于蛋白质表面区域,并与水溶液的相互接触受到限制或整体处于水溶液中。由图5得牛血清蛋白的荧光峰位于342 nm处,符合表2中色氨酸发射波长范围,可以确定牛血清蛋白中的主要发光基团为色氨酸残基。且牛血清蛋白与虾青素H/J聚集体形成纳米复合物后峰值出现蓝移,溶液疏水性增加[40]。根据发射波长的移动判断,虾青素与牛血清蛋白结合,导致色氨酸所处微环境发生改变。
3. 结论
本文选用乳清蛋白与虾青素构建纳米复合物,并实现乳清蛋白对虾青素H聚集体和J聚集体的可控载运。本实验主要采用紫外可见分光光谱法和荧光光谱法对乳清蛋白与虾青素聚集体的相互作用机制进行探究。研究表明虾青素/乳清蛋白纳米复合物的水合粒径均在150~430 nm范围内,且J-ABNs纳米复合物的粒径要大于H-ABNs纳米复合物的粒径。在虾青素/乳清蛋白纳米复合物中,虾青素H聚集体紫外可见吸收波长λmax由虾青素单体480蓝移至388 nm,虾青素J聚集体紫外可见光谱发生红移,并显示出519和556 nm左右的并肩峰。虾青素聚集体与乳清蛋白的相互作用能改变芳香族氨基酸残基在空间结构中所处的微环境的极性变化,引起乳清蛋白的构象变化。本研究为提高虾青素及其聚集体的水分散性和拓展乳清蛋白载体特性的应用提供理论基础。
-
表 1 虾青素/乳清蛋白纳米复合物的粒径及电位
Table 1 Particle size and potential of astaxanthin/whey protein nanocomplex
样品名称 粒径(nm) PDI 电位(mV) H-ALaNs 159±39 0.41±0.03 -10.7±2.0 J-ALaNs 390±9 0.24±0.05 -5.8±1.7 H-ALgNs 257±5 0.31±0.05 -8.5±1.4 J-ALgNs 298±8 0.20±0.01 -1.4±0.3 H-AWNs 340±12 0.43±0.06 -5.2±1.3 J-AWNs 427±5 0.28±0.03 -4.7±0.4 H-ABNs 251±15 0.33±0.88 -6.1±1.0 J-ABNs 357±14 0.21±0.05 -2.7±0.3 表 2 三种发光基团的荧光峰特征
Table 2 Fluorescence peak characteristics of three luminescent clusters
生色团 激发峰(nm) 发射峰(nm) 苯丙氨酸 260 282 酪氨酸 275 303 色氨酸 287 348 -
[1] 张丽敏, 华艳艳, 孙玉梅, 等. 红发夫酵母生物合成虾青素天然促进剂的研究[J]. 河南工业大学学报(自然科学版),2011,32(1):66−69. [ZHANG L M, HUA Y Y, SUN Y M, et al. Study on natural promoter of astaxanthin biosynthesis by Phaffia rhodozyma[J]. Journal of Henan University of Technology (Natural Science),2011,32(1):66−69. [2] LU L P, HU T P, XU Z G. Structural characterization of astaxanthin aggregates as revealed by analysis and simulation of optical spectra[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2017,185(3):85−92.
[3] HORMOZI M, GHOREISHI S, BAHARVAND P. Astaxanthin induces apoptosis and increases activity of antioxidant enzymes in LS-180 cells[J]. Artificial Cells, Nanomedicine, and Biotechnology,2019,47(1):891−895. doi: 10.1080/21691401.2019.1580286
[4] LI J J, GUO C Y, WU J Y. Astaxanthin in liver health and disease: A potential therapeutic agent[J]. Drug Design, Development and Therapy,2020,14:2275−2285. doi: 10.2147/DDDT.S230749
[5] 赵英源, 刘俊霞, 陈姝彤, 等. 虾青素生理活性的研究进展[J]. 中国海洋药物,2020,39(3):80−88. [ZHAO Y Y, LIU J X, CHEN S T, et al. Advances in studies on the physiological activity of astaxanthin[J]. Chinese Marine Pharmacology,2020,39(3):80−88. [6] 王宝贝. 雨生红球藻的光保护机制及脂肪酸与虾青素合成的相互关系[D]. 厦门: 厦门大学, 2014. WANG B B. Photoprotective mechanism and the relationship between fatty acids and astaxanthin synthesis in Rhodococcus pluvii[D]. Xiamen: Xiamen University, 2014.
[7] 董学卫, 孙敏, 颜世超, 等. 虾青素药理学作用及其在眼科疾病治疗中的应用[J]. 山东化工,2020,49(22):133−135. [DONG X W, SUN M, YAN S C, et al. Pharmacological effects of astaxanthin and its application in the treatment of ophthalmic diseases[J]. Shandong Chemical Industry,2020,49(22):133−135. doi: 10.3969/j.issn.1008-021X.2020.22.054 [8] 张涛, 邓思, 陈艳红, 等. 虾青素和β-胡萝卜素的抗氧化活性及其协同作用研究[J]. 食品与发酵工业,2021,47(9):8−15. [ZHANG T, DENG S, CHEN Y H, et al. Study on antioxidant activity and synergistic effect of astaxanthin and β-carotene[J]. Food and Fermentation Industries,2021,47(9):8−15. [9] ALIDADI M, JAMIALAHMADI T, CICERO A, et al. The potential role of plant-derived natural products in improving arterial stiffness: A review of dietary intervention studies[J]. Trends in Food Science & Technology,2020,99(4):426−440.
[10] 潘丽, 常振刚, 陈娟, 等. 虾青素的生理功能及其制剂技术的研究进展[J]. 河南工业大学学报(自然科学版),2019,40(6):123−129. [PAN L, CHANG Z G, CHEN J, et al. Research progress on physiological function and preparation technology of astaxanthin[J]. Journal of Henan University of Technology (Natural Science),2019,40(6):123−129. [11] 刘永峰, 张薇, 刘婷婷, 等. 乳蛋白中乳清蛋白与酪蛋白组成、特性及应用的研究进展[J]. 食品工业科技,2020,41(23):354−358. [LIU Y F, ZHANG W, LIU T T, et al. Research progress on the composition, properties and application of whey protein and casein in milk protein[J]. Science and Technology of Food Industry,2020,41(23):354−358. [12] BRIX S, BOVETTO L, FRITSCHÉ R, et al. Immunostimulatory potential of β-lactoglobulin preparations: Effects caused by endotoxin contamination[J]. Journal of Allergy and Clinical Immunology,2003,112(6):1216−1222. doi: 10.1016/j.jaci.2003.08.047
[13] 杨若愚. 乳清蛋白与运动营养[J]. 中国科技信息,2008(23):272−274. [YANG R Y. Whey protein and sports nutrition[J]. China Science and Technology Information,2008(23):272−274. doi: 10.3969/j.issn.1001-8972.2008.23.185 [14] 周衍香, 刘中洋. 乳清蛋白在慢性消耗性疾病营养支持中的应用[J]. 中国食物与营养,2019,25(9):83−86. [ZHOU Y X, LIU Z Y. Application of whey protein in nutritional support of chronic wasting disease[J]. Food and Nutrition in China,2019,25(9):83−86. doi: 10.3969/j.issn.1006-9577.2019.09.019 [15] 马彬. 食物中乳清蛋白对高强度运动能力的促进作用分析[J]. 食品安全质量检测学报,2019,10(24):8424−8431. [MA B. Analysis of promoting effect of whey protein in food on high intensity exercise ability[J]. Journal of Food Safety and Quality Inspection,2019,10(24):8424−8431. [16] 江萍. 基于Caco-2细胞模型的乳清蛋白纳米载体提高姜黄素吸收率的研究[D]. 北京: 北京化工大学, 2018. JIANG P. The study of improving the absorption rate of curcumin by using whey protein nanocarrier based on Caco-2 cell model[D]. Beijing: Beijing University of Chemical Technology, 2018.
[17] SHAFAEI Z, GHALANDARI B, VASEGHI A, et al. β-lactoglobulin: An efficient nanocarrier for advanced delivery systems[J]. Nanomedicine: Nanotechnology, Biology, and Medicine,2017,13(5):1685−1692. doi: 10.1016/j.nano.2017.03.007
[18] 贾前生, 刘远洋. 乳铁蛋白基姜黄素纳米载体颗粒的制备及其对大鼠抗疲劳能力的影响[J]. 食品工业科技,2021,42(13):26−32. [JIA Q S, LIU Y Y. Preparation of lactoferrin-based curcumin nanocarrier particles and its effect on fatigue resistance in rats[J]. Science and Technology of Food Industry,2021,42(13):26−32. [19] 张晓燕. 南极磷虾壳中虾青素提取纯化与纳米包载[D]. 青岛: 中国海洋大学, 2013. ZHANG X Y. Extraction, purification and nanoencapsulation of astaxanthin from krill shell[D]. Qingdao: Ocean University of China, 2013.
[20] 吴婉仪, 李璐, 解新安, 等. 基于响应面法构建虾青素纳米乳液[J]. 食品工业科技,2018,39(10):204−210. [WU W Y, LI L, XIE X A, et al. Preparation of astaxanthin nanoemulsion based on response surface methodology[J]. Science and Technology of Food Industry,2018,39(10):204−210. [21] PREETHI S, ABARNA K, NITHYASRI M, et al. Synthesis and characterization of chitosan/zinc oxide nanocomposite for antibacterial activity onto cotton fabrics and dye degradation applications[J]. International Journal of Biological Macromolecules,2020,164(5):2779−2787.
[22] QIAO X, YANG L, HU X X, et al. Characterization and evaluation of inclusion complexes between astaxanthin esters with different molecular structures and hydroxypropyl-β-cyclodextrin[J]. Food Hydrocolloids,2021,110(5):106208.
[23] LIU Y X, HUANG L, LI D H, et al. Re-assembled oleic acid-protein complexes as nano-vehicles for astaxanthin: Multispectral analysis and molecular docking[J]. Food Hydrocolloids,2020,103(5):105689.
[24] GRZEGORZ Z, EWA M, AGNIESZKA K, et al. Structure of supramolecular astaxanthin aggregates revealed by molecular dynamics and electronic circular dichroism spectroscopy[J]. Physical Chemistry Chemical Physics,2018,20(26):18038−18046. doi: 10.1039/C8CP01742E
[25] 赵英源. 虾青素/DNA/壳聚糖纳米复合物的制备及其稳定性研究[D]. 青岛: 中国海洋大学, 2015. ZHAO Y Y. Preparation and stability of astaxanthin/DNA/chitosan nanocomposite[D]. Qingdao: Ocean University of China, 2015.
[26] 李敬, 关磊, 刘俊丽, 等. 一种易溶于冷水的雨生红球藻色素纳米冻干粉及其制备与应用: 中国, 109419819A[P]. 2019-03-05. LI J, GUAN L, LIU J L, et al. The invention relates to a nanometer lyophilized pigment of Chlorella pluvii soluble in cold water and its preparation and application: China, 109419819A[P]. 2019-03-05.
[27] ZHAO Y, LI J, DAI M, et al. Discriminative preparation of stable H- or J-aggregates of astaxanthin in waterborne chitosan/DNA nanoparticles[J]. Chemistry Letters,2019,48(4):345−348. doi: 10.1246/cl.180940
[28] 刘俊丽, 代明琴, 杨昭, 等. 虾青素/天然DNA/壳聚糖纳米粒对紫外诱导的小鼠皮肤光老化的改善作用[J]. 中国海洋药物,2019,38(4):32−38. [LIU J L, DAI M Q, YANG Z, et al. Effects of astaxanthin/natural DNA/chitosan nanoparticles on uv induced skin photoaging in mice[J]. China Marine Pharmaceutics,2019,38(4):32−38. [29] WU YI JHEN, WU YU CHIUAN, CHEN I FEN, et al. Reparative effects of astaxanthin-hyaluronan nanoaggregates against retrorsine-CCl₄-induced liver fibrosis and necrosis[J]. Molecules (Basel, Switzerland),2018,23(4):726. doi: 10.3390/molecules23040726
[30] LIU C Z, ZHANG S Z, DAVID J M, et al. Design of astaxanthin-loaded core-shell nanoparticles consisting of chitosan oligosaccharides and poly(lactic-co-glycolic acid): enhancement of water solubility, stability, and bioavailability[J]. Journal of Agricultural and Food Chemistry,2019,67(18):5113−5121. doi: 10.1021/acs.jafc.8b06963
[31] 董欣, 王丽燕. 氨基酸紫外光谱的再测定[J]. 德州学院学报,2015,31(2):44−46. [DONG X, WANG L Y. Determination of amino acids by ultraviolet spectroscopy[J]. Journal of Dezhou University,2015,31(2):44−46. doi: 10.3969/j.issn.1004-9444.2015.02.011 [32] ZHAO Y Y, LIU J L, GUAN L, et al. Fabrication of aqueous nanodispersion from natural DNA and chitosan as eminent carriers for water-insoluble bioactives[J]. International Journal of Biological Macromolecules,2018,118(5):263−270.
[33] 孙亚婷. 发酵乳饮料的调配与聚合乳清蛋白对发酵乳饮料稳定性的影响[D]. 哈尔滨: 东北农业大学, 2016. SUN Y T. The preparation of fermented milk beverage and the influence of polymerized whey protein on the stability of fermented milk beverage[D]. Harbin: Northeast Agricultural University, 2016.
[34] QIU B, GUO L, CHEN M, et a1. Study on interaction between a new fluorescent probe2-methylbenzo[b] [1, 10] phenanthrolin-7(12H)-one and BSA[J]. The Analyst,2011,136(5):973−978. doi: 10.1039/C0AN00595A
[35] 房文汇, 里佐威, 李占龙, 等. 类胡萝卜素的分子光谱研究[J]. 物理学报,2012,61(15):170−176. [FANG W H, LI Z W, LI Z L, et al. Molecular spectral study of carotenoids[J]. Journal of Physics,2012,61(15):170−176. [36] 鲁瑞梅, 肖毅, 李佳慧, 等. 基于水溶性共轭聚合物荧光增强测定精氨酸[J]. 分析科学学报,2017,33(3):323−326. [LU R M, XIAO Y, LI J H, et al. Determination of arginine by fluorescence enhancement of water-soluble conjugated polymer[J]. Journal of Analytical Science,2017,33(3):323−326. [37] 张静, 陈薇晓, 朱亚先, 等. 一羟基芘对血清白蛋白构象变化的光谱学研究[A]. 中国毒理学会分析毒理专业委员会. 第八届全国分析毒理学大会暨中国毒理学会分析毒理专业委员会第五届会员代表大会论文摘要集[C]// 中国毒理学会分析毒理专业委员会: 中国毒理学会, 2014: 4. ZHANG J, CHEN W X, ZHU Y X, et al. Spectroscopic study of conformational changes of serum albumin by a hydroxypyrene[A]. Toxicology Committee of the Chinese Society of Toxicology. The Eighth National Conference of Analytical Toxicology and the Fifth Conference of the Analytical Toxicology Committee of the Chinese Society of Toxicology[C]// Analytical Toxicology Committee of Chinese Society of Toxicology: Chinese Society of Toxicology, 2014: 4.
[38] 张明, 方冰, 张录达, 等. 牛α-乳白蛋白-亚油酸复合物的结构及抗肿瘤活性[J]. 光谱学与光谱分析,2015,35(9):2609−2612. [ZHANG M, FANG B, ZHANG L D, et al. Structure and anti-tumor activity of bovine α-lactalbumin after binding linoleic acid[J]. Spectroscopy and Spectral Analysis,2015,35(9):2609−2612. [39] BURSTEZIN E A, VEDENKINA N S, LYKOVA M N. Fluorescence and the location of tryptophan residues in protein molec ules[J]. Phorothemisrry and Phofobioloay,1973,18(4):263−279.
[40] 李翠侠, 刘绍璞, 刘忠芳, 等. 荧光光谱法研究托拉塞米与牛血清白蛋白的相互作用及其分析应用[J]. 化学学报,2011,69(12):1408−1414. [LI C X, LIU S P, LIU Z F, et al. Study on the interaction between tolasemide and bovine serum albumin by fluorescence spectrometry and its application[J]. Journal of Chemical,2011,69(12):1408−1414. -
期刊类型引用(5)
1. 谭永曌,张迪,吉宏武,刘书成. 凡纳滨对虾热处理过程中虾青素酯与肌原纤维蛋白的结合作用. 广东海洋大学学报. 2024(06): 73-79 .  百度学术
百度学术
2. 付娌丽,饶璐,王智俊,刘东亮,陈黄琴,李月生. 荧光光谱法与分子模拟研究氨苄西林钠与牛血清蛋白相互作用及构象变化. 湖北科技学院学报(医学版). 2023(01): 21-25 .  百度学术
百度学术
3. 任祥瑞,赵晓燕,刘红开,张晓伟,王萌,朱运平. 不同热改性乳清蛋白-虾青素复合物对色素稳定性的影响. 食品科技. 2023(08): 243-250 .  百度学术
百度学术
4. 谢世英,赵英源,于靖薇,刘淑贤,张强,陈迪,王雪琴. H/J-聚集体虾青素/牛血清白蛋白纳米复合物的制备与表征. 河南工业大学学报(自然科学版). 2023(06): 26-35 .  百度学术
百度学术
5. 曾婧,白雪媛,王悦,赵大庆,王思明. 铁皮石斛蛋白提取工艺优化、活性成分筛选及结构研究. 食品工业科技. 2022(19): 228-237 .  本站查看
本站查看
其他类型引用(7)





 下载:
下载:


 下载:
下载:
