Temporal-Spatial Property of Small Molecular Sugars and Its Applications in the Processing and Storage of Sugar-Rich Foods: A Review
-
摘要: 单糖和寡糖等小分子糖不同时-空层面的物性转变是决定高糖食品加工保藏性能、安全性和营养价值体现的重要因素。时-空特征,作为描述不同相态下小分子糖分子或基团运动状态的全新参量,已被证实与高糖食品加工保藏过程中的品质劣变及受扩散限制反应的速率间存在明显因果关系。因此针对小分子糖时-空特征规律的深入认识,是保障小分子糖精深加工及研发和构筑功能性高糖食品结构的一种全新思路和技术手段。本文综述了小分子糖时-空特征理论的发展进程,重点介绍了基于热力学方法的时-空特征表征量—Strength值。同时,针对该参量在高糖食品防潮、抗结晶及受扩散限制反应速率调控方面的应用潜力展开了论述。旨在为推动时-空特征规律调控这一全新方法在高糖食品加工保藏性能改善中的应用提供理论储备和技术参考。Abstract: The physical properties of small molecular sugars, such as monosaccharides and oligosaccharides, are important to determine the processibility, storage stability, safety and nutritional value of sugar-rich foods. Temporal-spatial property, as a new parameter to describe the mobility of molecules or groups included in sugars when experiencing phase transition, has been proved to be related with the quality deterioration and the diffuse-limited reaction of sugar-rich foods. Therefore, a comprehensive understanding of the temporal-spatial property can provide a novel idea and technical means to guarantee the deep processing of small molecular sugars as well as to develop and construct the functional structure of sugar-rich foods. In this review, the origins of temporal-spatial property and its latest practical studies are reviewed. This review aims to provide a theoretical reserve for the development of temporal-spatial property and emphasised on the characterization quantity of such property based on thermodynamic approach—Strength value. Meanwhile, the potential applications of the above parameter in moisture-proof, anti-crystallization, and the controlling of diffusive-limited reactions on sugar-rich foods are discussed. The main conclusions we summarized are of guiding significance for the improvement of the processability and storage stability on sugar-rich food.
-
单糖、寡糖这类小分子糖(Small Molecular Sugars)作为一类重要营养素,具有为人体提供热能、存储养分、构成组织等多重营养和生理功能,一直是食品科学与工程领域的研究热点。近年来,国内外科学家基于各类小分子糖研发和制备出多种创新性食品结构,广泛应用于品质改善、配方订制、载体构建等食品精深加工领域[1-2]。小分子糖作为关键组分,在高糖食品中常处于玻璃态,其拓扑结构在加工、保藏过程中的相态转变问题普遍存在,宏观上表现为产品结块、坍缩、潮解、霉变等一系列加工保藏性能劣变,大大降低了高糖食品的品质及安全性和营养价值[3-4]。
小分子糖及相关高糖食品在不同加工、保藏条件下会发生各种各样的物性变化并触发一系列与受扩散限制的化学反应,而这些变化过程及反应速率很大程度上是由体系所含小分子糖的运动状态变化所决定的。例如,小分子糖在玻璃化转变温度(Glass Transition Temperature, Tg)附近的运动变化主要是产生了除原位振动和转动外的分子或基团的平动(Translation Movement)。根据自由体积理论可知,由于体系伴随温度上升时的自由体积分数增加,产生了更多“空穴”,进而导致小分子糖拓扑结构在空间上的结构松弛进而引发平动,这个过程被称为分子流动(Molecular Mobility, Mm)[5]。作为描述小分子糖分子或基团在不同相态下运动状态的全新参量,时-空特征(Spatio-Temporal Parameter)通常与小分子糖在Tg附近由于平动产生的 Mm对温度变化的动态依赖程度直接相关,并已被证实与高糖食品加工保藏过程中的品质劣变和受扩散限制反应速率之间存在明显的因果关系[6]。因此,针对小分子糖时-空特征规律的深入认识是改善高糖食品加工保藏性能及安全和营养价值的一种全新思路和技术手段。
目前市场对精深加工高糖食品的需求量巨大,针对小分子糖在加工保藏过程中的变化及调控机制的研究迫在眉睫。本文综述了小分子糖时-空特征理论及相关应用的最新研究进展,旨在为推动时-空特征规律调控这一全新方法在高糖食品加工保藏性能改善的应用提供前期理论储备和技术参考。此外,文章的主要结论对于各类功能性高糖食品结构平台的研发与构筑也极具有指导意义。
1. 小分子糖的玻璃化转变与游离水塑化效应
1.1 小分子糖玻璃化转变
玻璃化转变(Glassy Transition)是指物质由非晶固态向非晶液态自发转变的热力学可逆过程[5]。在Tg范围内,体系的热容(Cp)、膨胀/压缩系数(α)、Mm等特性均会发生变化。例如,当外界温度(T)低于Tg时物质处于玻璃态(即非晶固态),具有极高粘度(η>1012 Pa∙s),分子热运动能量低且不足以克服平移所需能垒,分子或基团只能在原位震动和转动;当温度超过Tg时粘度骤降(≤108 Pa∙s)形成非晶液态,此时平动出现导致分子形成粘性流动,宏观上引发一系列食品的结构劣变和受扩散限制反应的发生[6]。对高糖食品产品而言,处于玻璃态的小分子糖分子运动非常缓慢,导致体系中许多受扩散限制的反应不会发生或反应速度极慢,故产品品质能够长期保持稳定,货架寿命得到有效延长[7]。
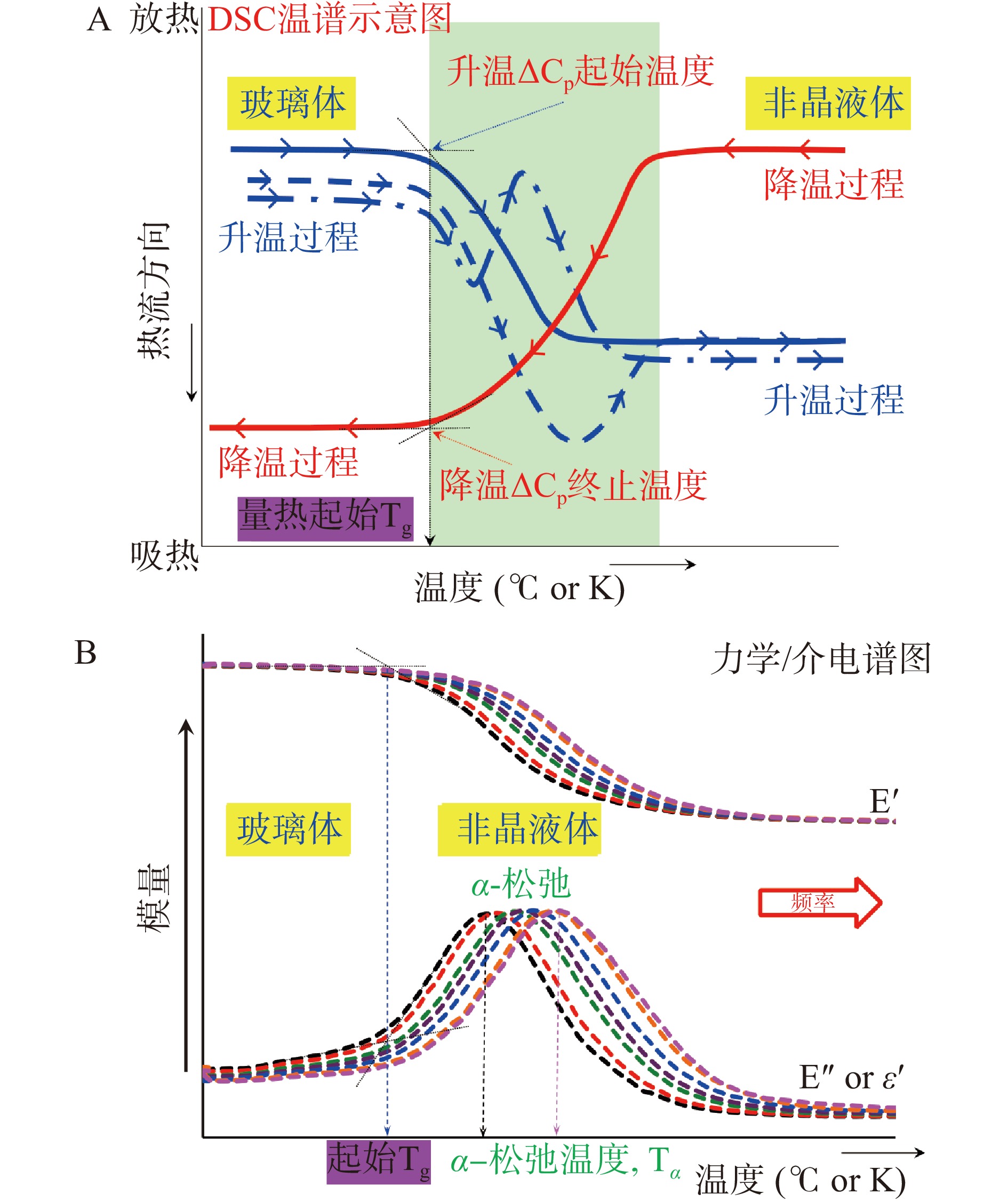
从热学角度分析,玻璃化转变通常体现在小分子糖的热容变化(ΔCp)并可由差示扫描量热仪(Differential Scanning Calorimeter, DSC)测定。如图1(A)所示,由于DSC升温扫描中ΔCp变化起始值与降温扫描的终止温度相同,故该起始温度(Onset-Tg)即为小分子糖玻璃化转变的量热参考温度值。此外,伴随玻璃化转变发生的潜热变化同样出现在图1(A)中,这种潜热变化主要是由样品前期不同热历史造成,代表了样品的焓松弛(Enthalpy Relaxation)过程[8]。例如,CHEN等[9]发现土豆淀粉的焓松弛通常与其老化过程密切相关。从力/电学角度来看,玻璃化转变出现常常伴随时间依赖的α-松弛(α-Relaxation)过程,其Tg值还可由力学或电学模量(储能模量,E′;损耗模量,E″;介电损耗模量,ε″及tanδ)随温度的变化进行表征[10]。动态力学(Dynamic-Mechanical Analyzer, DMA)及介电分析仪(Dielectric Analyzer, DEA)常用于测量小分子糖玻璃化转变及相关松弛过程。这些测量既可以等温进行,以确定频率函数的粘弹模量,也可通过保持频率不变来确定作为温度函数的特定频率响应[11]。其中,损耗模量的变化反映了糖分子对简谐频率(f)的响应过程,这主要取决于分子重排所需的松弛时间(Relaxation Time,τ;τ = 1/2πf)。图1(B)展示了玻璃态小分子糖不同频率下E′和E″(或ε″)伴随温度的变化趋势,其中α-松弛温度(Tα)可由损耗模量的峰值温度确定且应高于体系量热Tg值。这种温度差(Tα−Tg)反映了糖分子为适应简谐频率变化的流动重排过程[10,12]。应该注意的是结构松弛过程本质上是玻璃态物质趋向热力学平衡的过程,故这种趋势也会发生在玻璃化转变前,表现为β-或γ-松弛等,但这类松弛所需时间远久于α-松弛[13]。
目前,有关玻璃化转变的形成机理众说纷纭(表1),其中以FOX等[15]提出的自由体积理论(Free-Volume Theory)最为盛行。该理论假设玻璃体中存在一定比例的自由体积(fg,fg=1%~13%),发生玻璃化转变后自由体积(fg)会增加,且该增量可由热膨胀系数(αf)与温度差(T−Tg)的乘积表示(公式1)。对小分子糖而言,研究发现其玻璃化转变前后其自由体积的增量与数均分子量(Number-Average Molecular Weight)呈正相关,这表明伴随温度变化的自由体积增量与糖分子的拓扑结构运动直接相关[15,25]。然而,自由体积理论仅能解释由温度变化引发的体积增加,对于体系受组分影响导致结构松弛而产生的相态转变无法有效描述,同时,该理论忽略了时间积累对体系相态转变的影响。除自由体积理论外,基于玻璃化转变前后分子松弛时间依赖特性的动力学理论、基于预设平衡态下高熵玻璃体熵值变化的热力学理论等都可用于解释玻璃化转变的形成机制(表1)。由于对玻璃化转变形成实质缺乏深入的认识,目前有关其形成实质仍有待深入研究,深入解析玻璃化转变前后小分子糖拓扑结构的泛时-空运动规律,或许是解释上述问题的一种全新思路。
f=fg+af(T−Tg) (1) 表 1 玻璃化转变形成理论及主要文献来源Table 1. Theories and their relevance reference source for explaining the glass transition1.2 游离水塑化效应
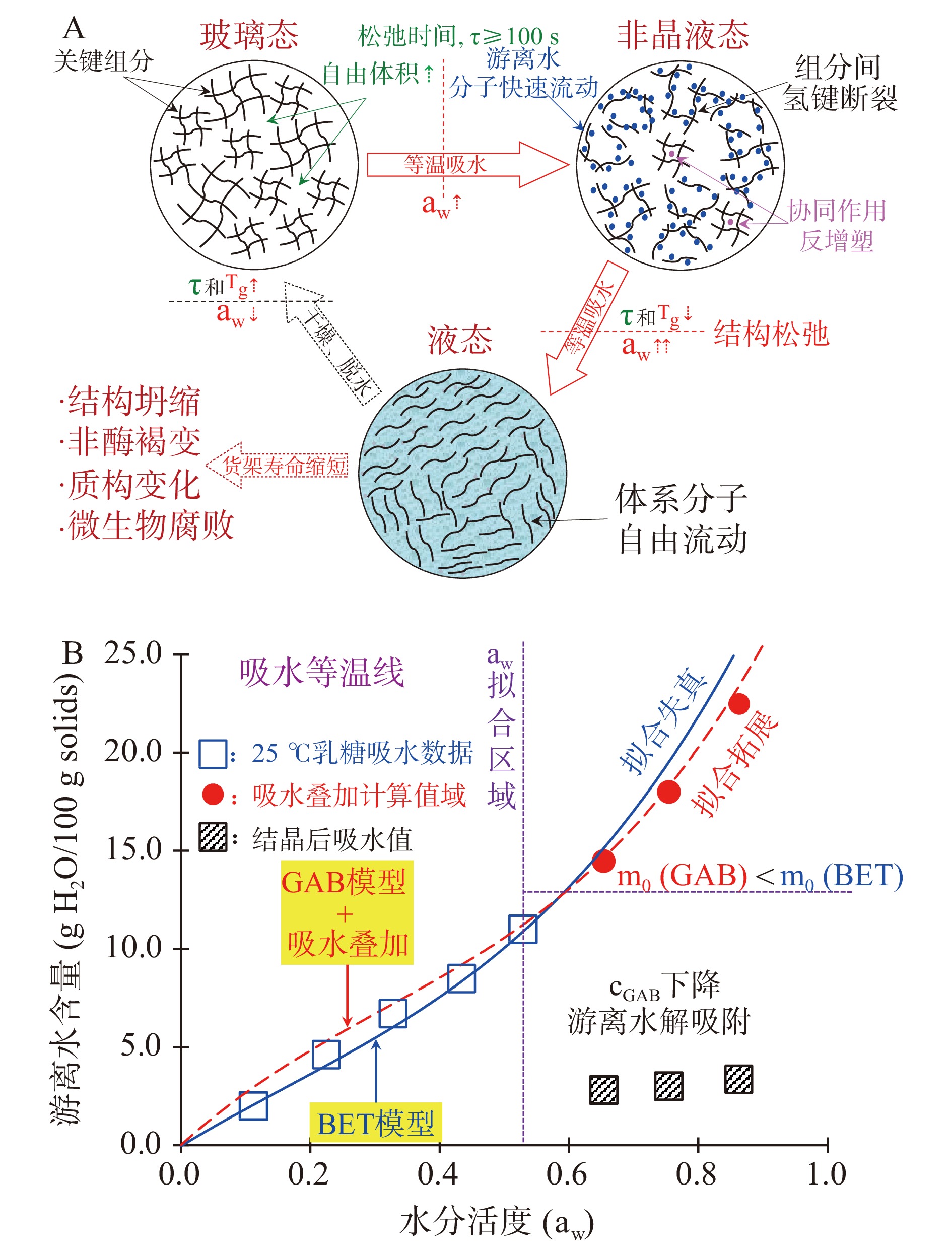
玻璃态小分子糖在加工保藏过程中由温湿度、压力等环境变化而产生的塑化(Plasticization)效应能显著影响其玻璃化转变过程及Tg值[26]。通常,塑化效应对高糖食品体系Tg的影响可由Gordon-Taylor经验方程描述(公式2;其中:w1和w2代表各组分的质量分数,即:w1+w2=1,kGT为公式常数),其中常数kGT可通过玻璃化转变前后不同组分的热容变化反映出体系被塑化的程度[27-28]。一些较易与食品体系混溶的小分子物质被称为塑化剂,而食品中的游离水(Mobilized Water)是最常见的塑化剂。这是由于纯水自身的Tg值极低(−137 ºC),室温下纯水内部存在大量自由体积,与小分子糖混溶后能大大增强体系分子流动性,从而降低体系的Tg值。研究发现游离水产生塑化效应的强弱主要受其与组分结合程度的影响,通常可由水分活度(aw)表征[29]。例如,在干燥状态下高糖食品组分分子间会形成氢键聚集体,随着体系aw的增加,水分子的快速迁移会破坏体系氢键网络,并干扰分子间氢键的形成,形成增塑效应(图2A)。此外,游离水还会产生反增塑(Anti-Plasticization)作用,具体表现在其松弛温度下降的同时粘度与力学模量的异常增加[26]。CARÇABAL等[30]的研究发现这种反增塑过程是由游离水在破坏关键组分间氢键网络的同时与小分子糖分子内氢键产生的协同作用所导致的。除游离水外,环境温度或压力变化也会影响小分子糖的玻璃化转变过程[31]。这些影响的本质是环境因素改变了体系对游离水的利用程度,干扰了游离水的塑化效应。
UBBINK等[32]提出了食品体系游离水利用度(Usability)这一概念,并指出其主要取决于游离水与组分的结合能力。由于组分间氢键、毛细管作用力广泛存在,加之游离水饱和蒸气压与纯水接近,加工保藏过程中aw往往呈动态变化难以准确测量,仅通过aw不足以全面描述这种利用度。吸水等温线(Water Sorption Isotherm, WSI)主要表征了恒温下食品吸水行为的动态变化规律,其在分子层面上调控体系游离水含量的同时,可通过模型建构从热力学角度对游离水与组分结合所需能量作出合理判断,WSI是指导aw调控游离水利用度延长产品货架寿命的通用方法[33]。BRUNAUER等[34]通过研究固体材料在不同压力下等温吸附气体过程归纳出5种等温吸附线并首次提出基于单分子层吸附理论的Brunauer-Emmett-Teller(BET)吸附模型。BET模型同时提供了吸水过程中体系单层游离水饱和吸附量(m0)和化学势差(cBET)这两种重要的物理信息,利用m0结合Clausius–Clapeyron方程(公式3;其中:aw1和aw2分别代表体系在温度T1和T2时的水分活度,qst为吸附热,R为理想气体常数8.314 J·mol−1·K−1)还可从热力学角度量化结合游离水所需能量[35]。大量实验证明:高糖食品吸水行为多归属于II(反S型)、III(J型)类吸水线且可由BET模型模拟[11,32,34]。此外,IGLESIA等[36]提出了将基于多分子层吸附理论的Guggenheim-Anderson-de Boer(GAB)模型应用于高糖食品当中(公式4;其中m为体系吸水量,C和K为常数),并指出GAB模型在cBET基础上通过引入多个自由度(k, cBET = kcGAB)能够提高对体系m0估算的准确度。由于GAB模型在拓展BET模型aw应用范围的同时丰富了吸水等温模型的物理含义,目前已被广泛应用于描述高糖食品吸水行为。然而,研究发现利用BET或GAB模型描述中高aw环境下(>0.44)固态食品吸水行为时拟合曲线会异常上扬[37]。以乳糖为例,本文结合已发表数据[5]分别计算比较aw≤0.44及0.44<aw≤0.76时的m0和cGAB后,发现后者明显小于前者(图2B),这表明中高aw环境下体系中游离水更易转移到环境中发生解吸附从而影响模型拟合结果。导致小分子糖中高aw近属区域内吸水行为改变的主要原因是游离水塑化效应引发的相态转变,这种变化导致游离水与纯水化学势差增加、等量吸附热下降,从而引发解吸现象改变体系吸水行为。POTES等[38]在研究玻璃态乳糖/麦芽糊精体系吸水行为时报道了样品在aw≤0.44下的水分叠加规律(Water Additive Principle),即体系总吸附水量等于各个非晶组分吸附量按比例分配之和。LIU等[25]通过系统研究冻干乳糖/乳清分离蛋白体系吸水行为证实了吸水叠加效应对m0同样适用并将GAB模型的适用范围拓展至0.76 aw。这种由体系相分离引发的吸水叠加效应能够有效扩展吸水等温模型对aw的适用性,因此在调控游离水利用度方面极具潜力。
Tg=w1Tg1+kGTw2Tg2w1+kGTw2 (2) ln(aw1aw2)=−qstR(1T1−1T2) (3) mm0=CKaw(1−Kaw)(1−Kaw+CKaw) (4) 2. 小分子糖时-空特征表述理论及变化规律
2.1 时-空特征表述理论
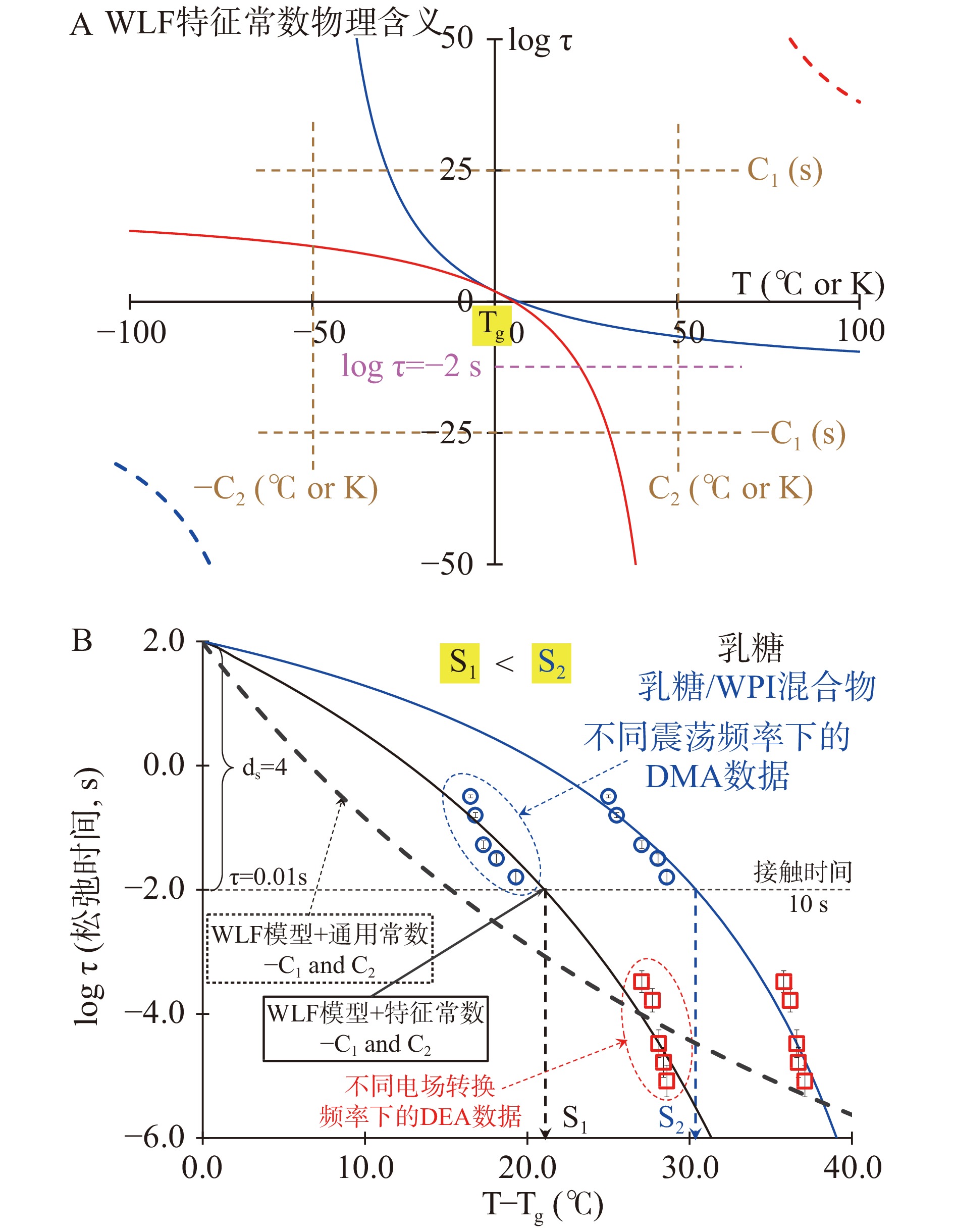
围绕小分子糖时-空特征的有效表述问题,大量研究指出Tg附近分子流动(Mm)状态对温度变化的动态依赖程度是时-空特征的直观体现,松弛时间则反映了其拓扑结构变化对时间的响应[5,39]。SLADE等[6]是小分子糖时-空特征表述的先驱,他们首先发现Tg附近受水塑化作用导致的分子流动具备一定时-空属性且与松弛时间对温度差(T−Tg)的依赖程度直接相关,并提出借助William-Landel-Ferry(WLF)动力学来表述小分子糖时-空特征的初步构想(公式5;其中:τ和τg分别表示体系在温度T和Tg时的松弛时间,C1和C2为常数)。由WLF模型图(图3A)可知,其中常数C1作为时间参量(s)表示小分子糖Tg附近松弛时间的理论最大下降值,C2(ºC)则用于表征任意松弛时间下的温度变化。由自由体积理论可知,C2代表的温度参数与热膨胀后的自由体积增量密切相关,因此C2为空间参量。然而,研究发现WLF动力学方程中通用常数(C1=17.44 s和C2=51.60 ºC)仅适用于表征高聚物的时-空特征松弛过程,对小分子糖并不适用,需另做针对性计算[37]。此外,ANGELL[40]提出了基于Vogel–Tammann–Fulcher(VTF)动力学的“强-脆”分类法(公式6;其中:η和ηs分别代表体系在温度T及Ts时的粘度,D代表体系的脆性),并对葡萄糖的时-空特征首先进行了描述,研究指出二氧化硅弛豫时间随温度比(T/Tg)的变化最小,表明其在Tg附近的分子流动状态对时-空依赖的程度最弱;相反水在其Tg附近的分子流动状态对时-空依赖的程度最高,因为其松弛时间对温度比变化的依赖程度最高。然而VTF动力学模型中的温度比并不适用于小分子糖及高糖食品的时-空特征描述。例如,蔗糖松弛时间对温度比的依赖性明显强于水[5,31,39],这与上述“强-脆”理论的结论相悖。
log(ττg)=−C1(T−Tg)C2+(T−Tg) (5) η=ηseDTs/(T−Ts) (6) S=dsC2−C1−ds (7) 最新研究发现小分子糖松弛时间这一狄波拉数对温度差(T−Tg)的极强依赖性,能够描述小分子糖分子流动特征并实现针对其时-空特征的量化[37,41]。在明确WLF方程常数物理意义的基础上,利用其组分针对性改良WLF动力学方程能够有效拟合低频率下(0.1~103 Hz)松弛时间与T−Tg的相关性。为此,ROOS[42], FAN等[39]和MAIDANNYK等[43]共同提出了一种利用WLF方程中2/logτ与1/(T−Tg)线性关系计算时-空特征常数C1和C2,并提出在规定接触时间(10 s)内松弛时间下降四个数量级时(ds= 4; 此为玻璃态小分子糖发生相态转变所需临界时间),分子流动状态的变化量—Strength(S)值(公式7)。作为一个用于描述相态转变过程中分子运动状态的全新参量,S值包含了其拓扑结构所在时间和空间尺度的全部信息,能够直观地表述出小分子糖拓扑结构运动状态变化对时-空的响应能力,即分子流动状态对时-空依赖的程度与S值呈正相关。上述理论自提出以来已在各类高糖食品玻璃化加工领域中得到验证和广泛应用。例如,BHANDARI等[7]回顾了过去半个世纪食品玻璃化转变的研究和应用,其中多次介绍了小分子糖时-空特征理论的研究成果,并指出S值是用于食品加工保藏性能改善的全新思路和重要手段。此外,RENZETTI等[44]在指出基于材料特异性的WLF动力学方程能够很好表述蔗糖/乳清蛋白体系不同时-空层面的物性变化,这有力地支持了有关小分子糖时-空特征表述的理论。UBBINK等[32]通过对比“强-脆”分类在蔗糖时-空特征的表述后发现,S值对高糖食品时-空特征的表述更为有效,并将该理论拓展应用到糖溶液体系。
2.2 时-空特征趋势
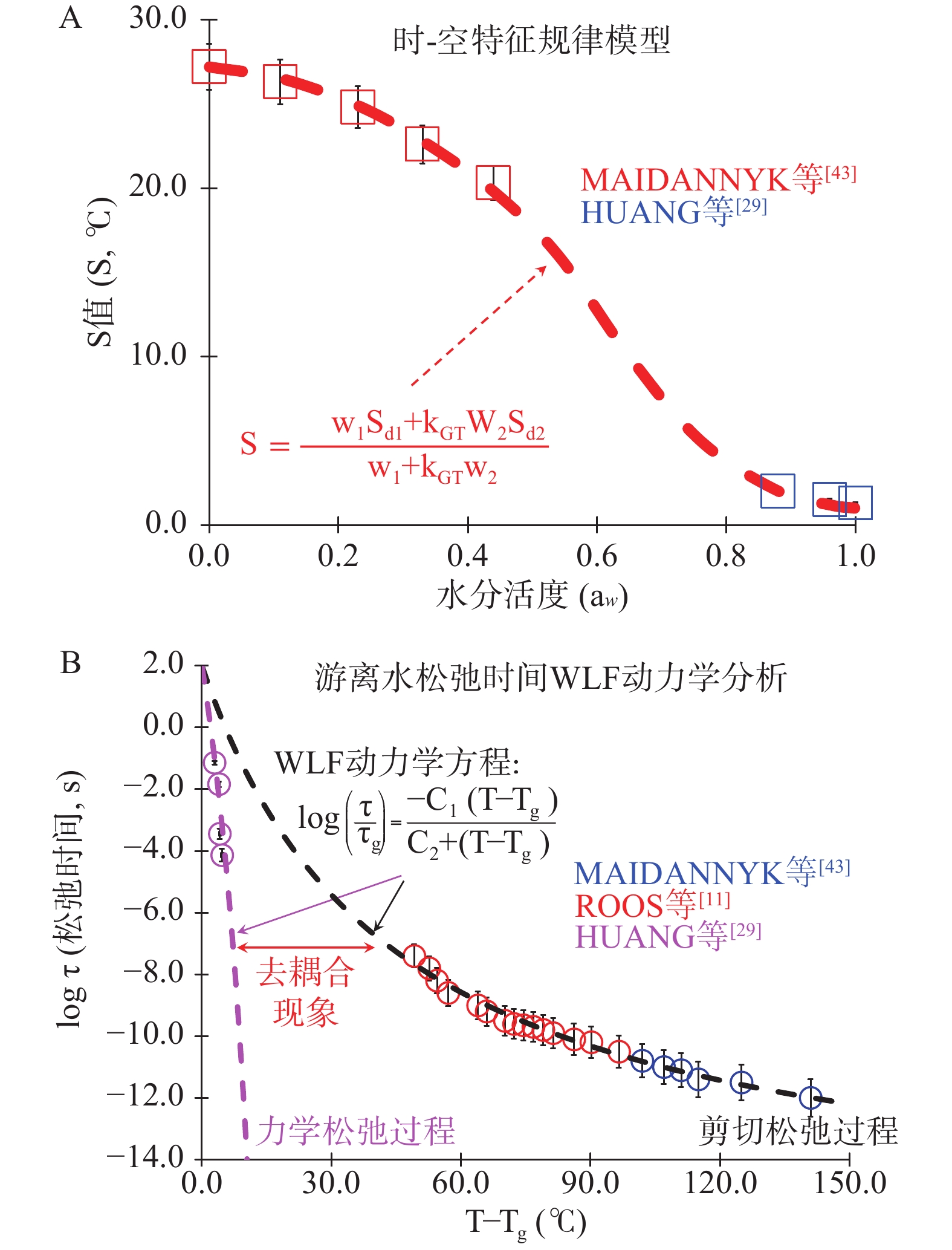
食品必然会经历加工保藏的过程,不同种类小分子糖的时-空特征会随温度、压力、含水量的变化而规律变化,具体体现在S值的规律变化。与Tg值相似,小分子糖的分子流动状态能被游离水改变,这归结于游离水的增塑作用能够有效增加体系自由体积。例如,MAIDANNYK等[43]有关海藻糖S值的研究发现,其S值随体系含水量的增加而下降。FAN等[45]通过系统研究乳糖S值发现,其时空特征的变化受到水塑化作用的影响明显,且这种变化与Tg对水的依赖性极其相似,进而利用这种变化趋势提出了不同含水量下小分子糖时-空特征的经验公式(公式8)。
S=w1Sd1+kGTw2Sd2w1+kGTw2 (8) 目前,有关时-空特征经验公式的预测精度还有待提高。难点主要集中在针对纯水S值的计算。通常,纯水分子在超低温(T<Tg)下能够保持高粘(≥1012 Pa∙s)的“冻结”状态,当温度超过Tg时粘度骤降内能改变,引发体系分子扩散速率上升、流动性增加。ANGELL[40]报道了有关纯水玻璃化转变过程中与焓值变化相关分子松弛的研究,指出水分子以秒为单位的松弛时间在玻璃化转变狭窄温度区间(~10 ºC)内由102 s骤降至10−6 s(下降速率~108 s/10 ºC)。这种相态转变过程中松弛时间的剧烈动态变化表明水自身分子流动能力极强,这是驱动游离水快速流动的关键[46]。本文结合文献数据研究后,发现利用麦克斯韦关系(公式9;G∞为剪切频率,τs为剪切松弛时间)研究冰晶在−40~20 ºC内不同剪切力对应松弛时间动态变化,显示水在每10 ºC温度变化范围内剪切松弛时间最大下降约102 s,远低于玻璃化转变过程中的松弛时间变化量。这表明结晶过程会干扰水自身分子流动,从而导致力学与剪切松弛时间在以Tg为参考温度时发生去耦合现象(图4B)。此外,利用WLF动力学方程结合纯水相关力学和剪切松弛时间文献数据计算特征常数的结果表明,WLF动力学分析法不同振荡和剪切频率下松弛时间对(T−Tg)的依赖性都能有效拟合,其中力学松弛时间计算所得特征常数值C1(23.47 s)高于剪切松弛时间对应C1(18.00 s),这表明冰晶形成能够阻碍“玻璃态-液态”过程中水分子流动变化。结合现有文献资料通过S值计算发现,基于小幅低频振荡力学松弛研究能够有效避免结晶过程带来的干扰,其分子流动性结果(S=3.8 ºC)较之前剪切松弛时间所得结果(S=6 ºC)对游离水分子流动性的描述更合理(图4B)。由于缺乏对纯水“玻璃态-液态”转变中结晶过程的综合考量,目前有关水分子流动的系统研究还未见报道。
η=G∞τs (9) 3. 时-空特征调控在高糖食品加工保藏中的应用
3.1 防潮、抗结晶中的应用
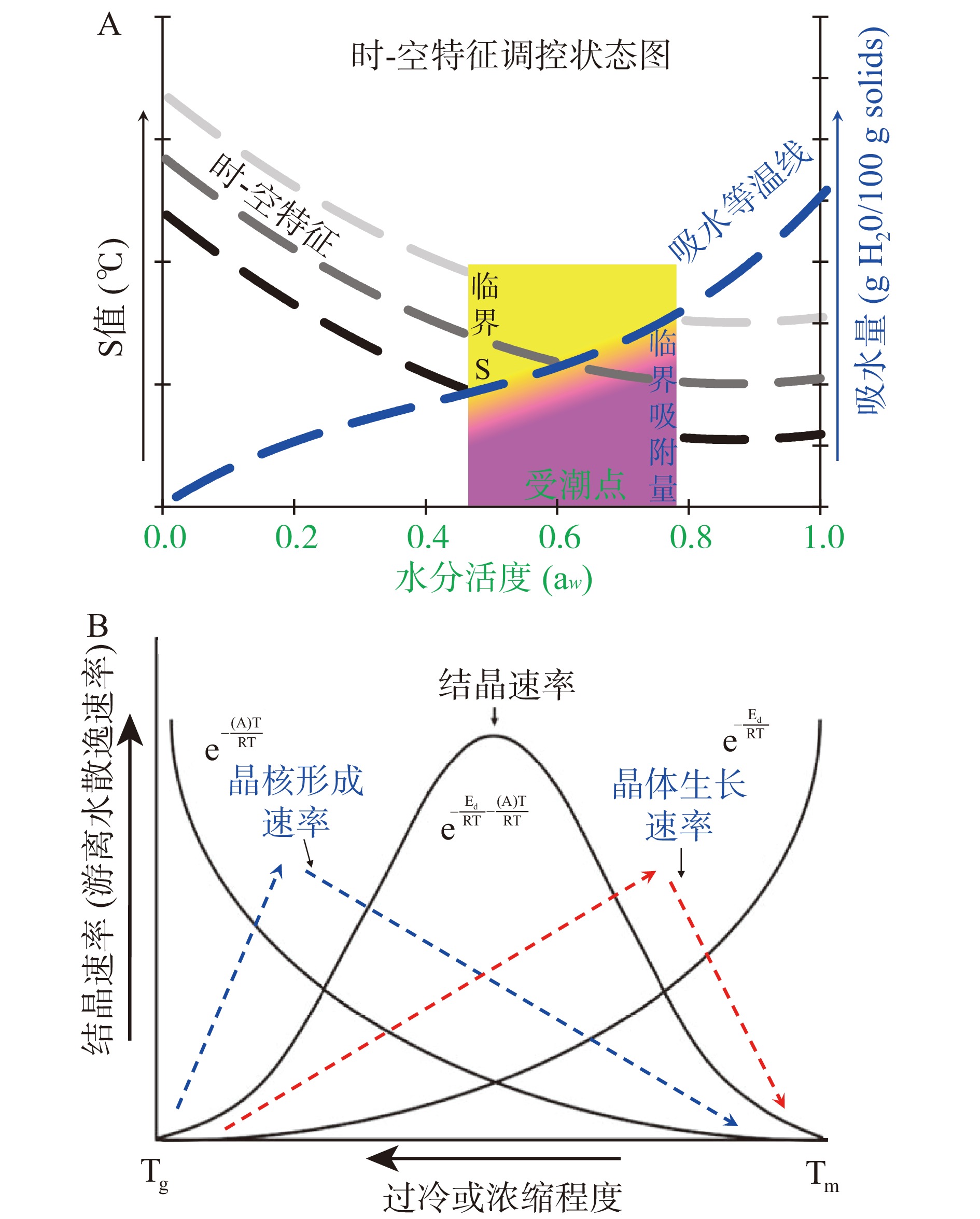
高糖食品中的玻璃态小分子糖在加工保藏过程中极易吸潮(Hygroscope),引发一系列品质劣变,如结构坍缩、结块等[47-51]。FAN等[37]研究玻璃态乳糖/乳清分离蛋白体系的动态吸水行为后发现,体系吸潮过程与其时-空特征密切相关。该研究表明,乳糖/乳清分离蛋白体系的S值越大,体系发生品质劣变所需环境湿度越高,即体系的防潮能力越强。YUAN等[52]提出通过将吸水等温线与动力学时-空特征相结合构建状态图,从而提出综合改善高糖食品品质的方法。例如,宋慧慧等[53]成功利用上述状态图改善枸杞粉稳定性。从时-空特征出发,高糖食品吸潮现象可利用时-空特征经验式结合吸水叠加原理构建时-空特征规律状态图(State Diagram)(图5A),利用该状态图可实现任意含水量(或aw)或温度下有关S值的计算,从而确定引发体系品质变化的吸潮点及临界吸水量。上述吸潮临界值的确定,为综合改善加工保藏过程中高糖食品的防潮性能提供了重要参考。
此外,高糖食品体系吸潮后是否会出现结晶(Crystallization)现象以及形成晶体大小和形状都将对其品质产生重要影响[54-56]。小分子糖吸潮结晶主要发生在Tg以上但低于熔融温度(Tm),通常是一个三步过程,包括:成核(形成晶核)、增殖(晶体生长)和成熟(晶体每隔段和/或持续生长)[11,54]。其中,成核形成和晶核生长过程与小分子糖分子不同时-空层面的运动状态密切相关,并共同决定了结晶速率及结晶度。例如,当温度越接近熔点温度(Tm),成核速率越低,但由于黏度降低使晶核生长速率增大;温度越接近Tg,成核速率越快,但是由于黏度大使晶核生长较慢,所以结晶速率在温度为Tg和Tm之间的某个值时达到最大值(图5B)。长期保藏实验指出,体系中游离水吸附/排出的过程可以用来表征结晶过程,当体系中游离水吸附/排出量相等时,达到最大的结晶度。而游离水由于结晶过程中分子重排导致被排出,该排出量随时间的变化即为体系的结晶速率[37-38]。前期有关高糖粉体保藏性能的研究结果显示,体系结构劣变过程与玻璃态小分子糖时-空时间的变化密切相关。可食用大分子如蛋白质的添加能够有效提升体系S值延缓体系吸水结晶过程,这证明通过改变时-空特征能够大幅提高高糖食品的抗结晶性能[52]。LI等[57]的研究指出,乳清分离蛋白能够有效阻止乳粉的晶化、结块、联粘等品质劣变和非酶褐变,这也直接源于蛋白质对乳糖分子流动的干扰作用。最新研究表明,时-空特征能够用于调控蜂蜜干粉在保藏过程中的结晶度,这是时-空特征在高糖食品防潮、抗结晶性能提升中的首次尝试[58]。除蛋白质外,多糖被发现同样具有干扰小分子糖Tg附近分子流动性的能力。NURHADI等[59]在研究红姜粉防潮性能的过程中发现,利用麦芽糊精针对体系时-空特征实施调控能够有效提高红姜粉保藏过程中的防潮、抗结晶性能。此外,异构化也是影响结晶过程的重要因素,且往往决定最终的结晶产物。例如,乳糖存在两种异头物,异头物之间存在理化性质的差异,异头物的质量比受温度等多种条件的影响,影响乳糖的结构变化,并可能产生一些不良问题,如溶解度下降等[60]。由于结晶与高糖食品的品质及加工保藏稳定性密切相关,对于时-空特征的深入研究对具备防潮、抗结晶性能的功能性高糖食品研发具有极其重要的意义。
3.2 扩散限制反应调控中的应用
扩散限制反应(Diffusion Limited Reaction),如,降解、非酶褐变等,对食品品质的影响性巨大[61-62]。在恒温恒压下,三个主要因素控制了扩散限制反应的速率:扩散因子—表征反应相遇的几率;碰撞因子—表征反应物相遇后单位时间内发生碰撞的数量;活化能—表征定向反应中反应物碰撞反应需要克服的能垒。因此,与时-空特征相关的扩散因子决定了反应速率。目前人们已普遍接受分子流动是扩散限制反应发生的必要条件,因此对扩散限制反应调控的核心在于对其分子时-空特征的综合调控。例如,MIAO等[62]研究了高糖食品模型中非酶褐变过程与体系分子流动的关联特性。LIM等[63]研究了包含β-胡萝卜素的层层包埋冻干粉末后发现,β-胡萝卜素的降解动力学与体系中海藻糖的时-空特征密切相关,即S值越大,降解速率越慢。LU等[64]最新的研究表明S值对受扩散限制的营养素降解反应直接相关,通过对体系时-空特征规律的深入研究,有利于设计出具备营养素保护机能的功能性高糖食品载体。由于缺乏对扩散限制反应过程与时-空特征关联机制的认识,目前将相关研究结果应用到高糖食品体系防潮、抗结晶性能改善中的报道还很少。
4. 前景与展望
尽管有关小分子糖时-空特征及应用的研究已取得不少进展,但该领域仍处于起步阶段。目前主要存在的科学问题在于动力学作为表述时-空特征的现行方法存在理论缺陷,无法有效兼顾Tg附近的塑化-流动效应,所建模型的普适性较差。这直接导致工程应用方面的技术难点,即:时-空特征规律模型与吸水结晶过程无法有效耦合,利用该特征改善高糖食品加工保藏性能的可靠性一般。此外,小分子糖时-空特征调控,是否可应用于高糖食品吸水缔和强度及结晶度控制等方面?能否探索出新的防潮、抗结晶等物性调控途径?这些已成为高糖食品精深加工中的“卡脖子”问题。针对上述问题,未来通过深入解析小分子糖时-空特征规律可实现吸水结晶过程的有效调控,从而探索和研发出具备防潮、抗结晶性能的功能性高糖结构平台,综合改善小分子糖加工保藏性能及安全性和营养价值。针对小分子糖时-空特征的科学准确解析手段的研究,对于实现吸水结晶过程有效调控同样至关重要。目前常用的方法是从松弛过程的热力学角度来表征与解析小分子糖的S值,往往具有一定的局限性。未来可以考虑从小分子糖的光学特性、电磁特性等方面借助介电扫描仪、正电子湮灭寿命谱、闪速DSC等先进仪器对小分子糖的时-空特征进行更加深入的解析。该方面的深入认识不仅对理解加工保藏过程营养素(糖)变化及其机制有重要的理论参考价值,对于推进高糖食品精深加工也极具实际意义。
-
表 1 玻璃化转变形成理论及主要文献来源
Table 1 Theories and their relevance reference source for explaining the glass transition
-
[1] DIAZ A B, BLANDINO A, CARO I. Value added products from fermentation of sugars derived from agro-food residues[J]. Trends in Food Science & Technology,2018,71:52−64.
[2] 徐晓梅, 温家颖, 王庆华. 小分子糖及其类似物与α-葡萄糖苷酶的分子对接[J]. 食品科学,2020,41(8):139−143. [XU X M, WEN J Y, WANG Q H. Molecular docking of small-molecule monosaccharides and their analogues[J]. Food Science,2020,41(8):139−143. doi: 10.7506/spkx1002-6630-20181201-001 [3] 胡庆兰, 阙婷婷, 任西营, 等. 玻璃化转变在食品贮藏中的应用研究进展[J]. 中国酿造,2013,32(8):1−4. [HU Q L, QUE T T, REN X Y, et al. Application and research progress of glass transition in food preservation[J]. China Brewing,2013,32(8):1−4. [4] 赵学伟, 毛多斌. 玻璃化转变对食品稳定性的影响[J]. 食品科学,2007(12):539−546. [ZHAO X W, MAO D B. Effects of glass transition on food stability[J]. Food Science,2007(12):539−546. doi: 10.3321/j.issn:1002-6630.2007.12.129 [5] FAN F, ROOS Y H. Glass transition-associated structural relaxations and applications of relaxation times in amorphous food solids: A review[J]. Food Engineering Reviews,2017,9(4):257−270. doi: 10.1007/s12393-017-9166-6
[6] SLADE L, LEVINE H, REID D S. Beyond water activity: Recent advances based on an alternative approach to the assessment of food quality and safety[J]. Critical Reviews in Food Science & Nutrition,1991,30(2-3):115−360.
[7] BHANDARI B R, ROOS Y H. Non-equilibrium states and glass transitions in foods: Processing effects and product-specific implications[M]. Woodhead Publishing, 2016, 153−168.
[8] LIU Y, BHANDARI B, ZHOU W. Glass transition and enthalpy relaxation of amorphous food saccharides: A review[J]. Journal of Agricultural and Food Chemistry,2006,54(16):5701−5717. doi: 10.1021/jf060188r
[9] CHEN Y F, SINGH J, ARCHER R. Potato starch retrogradation in tuber: Structural changes and gastro-small intestinal digestionin vitro[J]. Food hydrocolloids,2018,84:552−560. doi: 10.1016/j.foodhyd.2018.05.044
[10] SILALAI N, ROOS Y H. Coupling of dielectric and mechanical relaxations with glass transition and stickiness of milk solids[J]. Journal of Food Engineering,2011,104(3):445−454. doi: 10.1016/j.jfoodeng.2011.01.009
[11] ROOS Y H, DRUSCH S. Phase transitions in foods[M]. Second Edition, Academic Press, 2015.
[12] LI R, LIN D, ROOS Y H, et al. Glass transition, structural relaxation and stability of spray-dried amorphous food solids: A review[J]. Drying Technology,2019,37(3):287−300. doi: 10.1080/07373937.2018.1459680
[13] KISSI E O, GROHGANZ H, LÖBMANN K, et al. Glass-transition temperature of the β-relaxation as the major predictive parameter for recrystallization of neat amorphous drugs[J]. The Journal of Physical Chemistry B,2018,122(10):2803−2808. doi: 10.1021/acs.jpcb.7b10105
[14] EYRING H. Viscosity, plasticity, and diffusion as examples of absolute reaction rates[J]. J Chem Phys,1936,4(4):283−291. doi: 10.1063/1.1749836
[15] FOX T G JR, FLORY P J. Second-order transition temperatures and related properties of polystyrene. I. Influence of molecular weight[J]. J Appl Phys,1950,21(6):581−591. doi: 10.1063/1.1699711
[16] COHEN M H, TURNBULL D. Molecular transport in liquids and glasses[J]. J Chem Phys,1959,31(5):1164−1169. doi: 10.1063/1.1730566
[17] SPERLING L H. Introduction to physical polymer science[M]. John Wiley & Sons, 2005.
[18] PEREZ J. Theories of liquid-glass transition[J]. J Food Eng,1994,22:89−114. doi: 10.1016/0260-8774(94)90027-2
[19] SJÖGREN L, GÖTZE W. α-Relaxation spectra in supercooled liquids[J]. J Non-Cryst Solids,1994,172:7−15.
[20] DEBENEDETTI P G, STILLINGER F H. Supercooled liquids and the glass transition[J]. Nature,2001,410(6825):259−267. doi: 10.1038/35065704
[21] TARJUS G, KIVELSON D. Breakdown of the stokes–Einstein relation in supercooled liquids[J]. J Chem Phys,1995,103(8):3071−3073. doi: 10.1063/1.470495
[22] ADAM G, GIBBS J H. On the temperature dependence of cooperative relaxation properties in glass-forming liquids[J]. J Chem Phys,1965,43(1):139−146. doi: 10.1063/1.1696442
[23] GIBBS J H, DIMARZIO E A. Nature of the glass transition and the glassy state[J]. J Chem Phys,1958,28(3):373−383. doi: 10.1063/1.1744141
[24] GIBBS J H, DIMARZIO E A. Statistical mechanics of helix-coil transitions in biological macromolecules[J]. J Chem Phys,1959,30(1):271−282. doi: 10.1063/1.1729886
[25] LIU W, ROOS Y H, FAN F. Physicochemical properties and relaxation time in strength analysis of amorphous poly (vinyl-pyrrolidone) and maltodextrin: Effects of water, molecular weight, and lactose addition[J]. Journal of Food Engineering,2018,226:82−95. doi: 10.1016/j.jfoodeng.2018.01.020
[26] UBBINK J. Plasticization and antiplasticization in amorphous food systems[J]. Curr Opin Food Sci,2018,21:72−78. doi: 10.1016/j.cofs.2018.05.007
[27] CHAUDHARY D S, ADHIKARI B P, KASAPIS S. Glass-transition behaviour of plasticized starch biopolymer system-A modified Gordon-Taylor approach[J]. Food Hydrocolloid,2011,25(1):114−121. doi: 10.1016/j.foodhyd.2010.06.002
[28] 周国辉, 刘成梅, 万婕, 等. 分子动力学模拟水分对小分子糖玻璃态转变温度及扩散性质的影响[J]. 现代食品科技,2014,30(9):154−160, 165. [ZHOU G H, LIU C M, WAN J, et al. Effect of moisture content on glass transition temperature and diffusion properties of low-molecular[J]. Modern Food Science and Technology,2014,30(9):154−160, 165. [29] HUANG W L, FAN F. Strength analysis of amorphous water and lactose containing water solutions[R]. IFT20 International Conference, Chicago, 2020.
[30] CARÇABAL P, JOCKUSCH R A, HÜNIG I. Hydrogen bonding and cooperativity in isolated and hydrated sugars: Mannose, galactose, glucose, and lactose[J]. J Am Chem Soc,2005,127(32):11414−11425. doi: 10.1021/ja0518575
[31] 詹世平, 陈淑花, 刘华伟, 等. 玻璃化转变与食品的加工、储存和品质[J]. 食品工业,2006(2):51−52. [ZHAN S P, CHEN S H, LIU H W, et al. Effect of glass transition on the processing storage and quality of food products[J]. The Food Industry,2006(2):51−52. [32] UBBINK J, DUPAS-LANGLET M. Rheology of carbohydrate blends close to the glass transition: Temperature and water content dependence of the viscosity in relation to fragility and strength[J]. Food Research International,2020,138:109801. doi: 10.1016/j.foodres.2020.109801
[33] FONTANAA J, CARTER B P. Measurement of water activity, moisture sorption isotherm, and moisture content of foods[M]. 2020: 207−226.
[34] BRUNAUER S, EMMETT P H, TELLER E. Adsorption of gases in multimolecular layers[J]. J Am Chem Soc,1938,60(2):309−319. doi: 10.1021/ja01269a023
[35] TIMMERMANN E O, CHIRIFE J, IGLESIAS HA. Water sorption isotherms of foods and foodstuffs: BET or GAB parameters?[J]. Journal of Food Engineering,2001,48:19−31.
[36] IGLESIAS H A, CHIRIFE J. An alternative to the GAB model for the mathematical description of moisture sorption isotherms of foods[J]. Food Res Int,1995,28:317−321. doi: 10.1016/0963-9969(94)00002-P
[37] FAN F, MOU T, NURHADI B, et al. Water sorption-induced crystallization, structural relaxations and strength analysis of relaxation times in amorphous lactose/whey protein systems[J]. Journal of Food Engineering,2017,196:150−158. doi: 10.1016/j.jfoodeng.2016.10.022
[38] POTES N, KERRY J P, ROOS Y H. Additivity of water sorption, alpha-relaxations and crystallization inhibition in lactose-maltodextrin systems[J]. Carbohydrate polymers,2012,89(4):1050−1059. doi: 10.1016/j.carbpol.2012.03.061
[39] FAN F, ROOS Y H. Structural relaxations of amorphous lactose and lactose-whey protein mixtures[J]. Journal of Food Engineering,2016,173:106−115. doi: 10.1016/j.jfoodeng.2015.10.047
[40] ANGELL C A. Formation of glasses from liquids and biopolymers[J]. Science,1995,267(5206):1924−1935. doi: 10.1126/science.267.5206.1924
[41] ROOS Y H, FRYER P J, KNORR D, et al. Food engineering at multiple scales: Case studies, challenges and the future-a European perspective[J]. Food Engineering Reviews,2016,8(2):91−115. doi: 10.1007/s12393-015-9125-z
[42] ROOS Y H. Relaxations, glass transition and engineering properties of food solids[M]. In: Advances in Food Process Engineering Research and Applications, Springer New York, 2013: 79−90.
[43] MAIDANNYK V A, ROOS Y H. Water sorption, glass transition and “strength” of lactose–Whey protein systems[J]. Food Hydrocolloids,2017,70:76−87. doi: 10.1016/j.foodhyd.2017.03.025
[44] RENZETTI S, JURGENS A. Rheological and thermal behavior of food matrices during processing and storage: Relevance for textural and nutritional quality of food[J]. Current Opinion in Food Science,2016,9:117−125. doi: 10.1016/j.cofs.2016.10.003
[45] WU Y, HUANG W, CUI T, et al. Crystallization and strength analysis of amorphous maltose and maltose/whey protein isolate mixtures[J]. Journal of the Science of Food and Agriculture,2020,101(6):2542−2551.
[46] MAIDANNYK V A, NURHADI B, ROOS Y H. Structural strength analysis of amorphous trehalose-maltodextrin systems[J]. Food Research International,2017,96:121−131. doi: 10.1016/j.foodres.2017.03.029
[47] FAN F, ROOS Y H. Crystallization and structural relaxation times in structural strength analysis of amorphous sugar/whey protein systems[J]. Food Hydrocolloids,2016,60:85−97. doi: 10.1016/j.foodhyd.2016.03.019
[48] 张晋鲁, 袁颖憨, 周恒为, 等. 水的玻璃化转变的研究[J]. 物理学进展,2006(Z1):449−451. [ZHANG J L, YUAN Y H, ZHOU H W, et al. Investigation of water glass transition[J]. Progress in Physics,2006(Z1):449−451. [49] 苏安祥, 浦浩亮, 胡秋辉, 等. 脱水香菇不同贮藏水分活度下细菌菌落演替规律及关键菌控制[J/OL]. 食品科学, 2021. http://www.cnki.com.cn/Article/CJFDTotal-SPKX2021031200K.htm SU A X, PU H L, HU Q H, et al. Bacterial diversity and control method of dried lentinus edodes stored at different water activity[J/OL]. Food Science 2021. http://www.cnki.com.cn/Article/CJFDTotal-SPKX2021031200K.htm
[50] 凌逍, 马世广, 汪学荣. 不同水分活度降低剂对半干猪肉干水分活度的影响[J]. 肉类工业,2019(12):14−19. [LING X, MA S G, WANG X R. Effect of different water activity lowering agent on the water activity of semi-dried pork[J]. Meat Industry,2019(12):14−19. doi: 10.3969/j.issn.1008-5467.2019.12.004 [51] 周国辉, 刘成梅, 万婕, 等. 分子动力学模拟水分对小分子糖玻璃态转变温度及扩散性质的影响[J]. 现代食品科技,2014,9:154−160. [ZHOU G H, LIU C M, WAN J, et al. Effect of moisture content on glass transition temperature and diffusion properties of low-molecular[J]. Modern Food Science and Technology,2014,9:154−160. [52] YUAN X, CARTER B P, SCHMIDT S J. Determining the critical relative humidity at which the glassy to rubbery transition occurs in polydextrose using an automatic water vapor sorption instrument[J]. Journal of Food Science,2011,76(1):E78−E89. doi: 10.1111/j.1750-3841.2010.01884.x
[53] 宋慧慧, 陈芹芹, 毕金峰, 等. 基于玻璃化转变及流动特性的枸杞粉贮藏稳定性研究[J]. 中国食品学报,2020,20(6):209−218. [SONG H H, CHEN Q Q, BI J F, et al. Studies on the storage stability of goji powders based on the glass transition and flow characterist[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(6):209−218. [54] MULLIN J W. Crystallization[M]. Elsevier, 2001, 181−284.
[55] 张珊, 倪春蕾, 张高鹏, 等. 小分子糖对马铃薯淀粉晶体结构、糊化特性和冻融稳定性的影响[J]. 中国食品学报,2019,19(8):49−59. [ZHANG S, NI C L, ZHANG G P, et al. Effect of low molecular weight saccharides on crystal structure, gelatinization and freeze-thaw stab[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(8):49−59. [56] HARTEL R W, SHASTRY A V. Sugar crystallization in food products[J]. Critical Reviews in Food Science & Nutrition,1991,30(1):49−112.
[57] LI R, ROOS Y H, MIAO S. Influence of pre-crystallisation and water plasticization on flow properties of lactose/WPI solids systems[J]. Powder Technology,2016,294:365−372.
[58] FAN F, ROOS Y H. Physicochemical properties, structural transformation, and relaxation time in strength analysis for honey powder models[J]. Food Research International,2019,122:137−148. doi: 10.1016/j.foodres.2019.04.003
[59] NURHADI B, SAPUTRA R A, SUKRI, N. The role of encapsulant materials on the stability of bioactive compounds of red ginger (Zingiber officinale Roscoe. var. Rubrum) extract powder during storage[J]. Food Chemistry,2020,333:127490. doi: 10.1016/j.foodchem.2020.127490
[60] FAN F, XIANG P, ZHAO L. Vibrational spectra analysis of amorphous lactose in structural transformation: Water/temperature plasticization, crystal formation, and molecular mobility[J]. Food Chemistry,2021,341:128215. doi: 10.1016/j.foodchem.2020.128215
[61] DAMODARAN S, PARKIN K L, FENNEMA O R. Fennema's food chemistry[M]. CRC press, 2007: 17.
[62] MIAO S, ROOS Y H. Nonenzymatic browning kinetics of a carbohydrate-based low-moisture food system at temperatures applicable to spray drying[J]. Journal of Agricultural and Food Chemistry,2004,52(16):5250−5257. doi: 10.1021/jf049706t
[63] LIM A S L, ROOS Y H. Amorphous wall materials properties and degradation of carotenoids in spray dried formulations[J]. Journal of Food Engineering,2018,223:62−69. doi: 10.1016/j.jfoodeng.2017.12.001
[64] LU W, MAIDANNYK V A, LIM A S. Carotenoids: Degradation and precautions during processing. Incarotenoids: Properties, processing and applications[M]. Academic Press, 2020, 23−258.
-
期刊类型引用(2)
1. 曾少雯,李汴生,阮征,李丹丹,洪泳鸿,吴洁. 不同粒度充气硬糖的品质特性分析. 现代食品科技. 2024(04): 196-205 .  百度学术
百度学术
2. 李卓豪,毕金峰,易建勇,冯舒涵,郭玉霞. 真空冷冻干燥果胶-纤维素-小分子糖气凝胶质构研究. 核农学报. 2022(09): 1805-1814 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:









 下载:
下载:



