Water Activity at Isothermal Temperature and Its Effect on Microbial Heat Resistance in Low-moisture Foods
-
摘要: 水分活度(Water activity,aw)是定义低水分食品(aw,25 ℃<0.85)的关键指标,对低水分食品(LMFs)中微生物的抗热性起着决定性的作用。食品的水分活度受到食品组分、质构等的影响,并且与温度密切相关,在温度改变时呈现不同的变化趋势,是典型的温度依赖型指标。等温水分活度(aw,T)反映了食品在高温灭菌过程中的实时水分活度,其准确测定或推算有助于学者量化低水分食品中微生物抗热性指标,进而设计、验证、完善相关热灭菌工艺。但商业化的水分活度仪只能测量低温区间(20~50 ℃),人们对高温区间(>55 ℃)的水分活度还了解甚少。本文首先介绍了低水分食品微生物安全及其抗热性指标,然后对等温水分活度的定义、检测方法、模型预测、影响因素及其对微生物抗热性的影响研究进行综述。等温水分活度的认知与测定有利于食品企业降低低水分食品的微生物污染程度,保障消费者食品安全。Abstract: Water activity (aw) is the key factor defining low-moisture foods (LMFs, aw,25 ℃<0.85), and also determines the heat resistance of microorganisms in LMFs. However, aw of food is a temperature-dependent factor, and is highly influenced by food components and texture. When temperature rises, aw has shown different trends of changes. Water activity at isothermal temperature (aw,T) reflects the real-time aw of foods during high-temperature pasteurization. Accurate measurement and calculation of aw,T enable scholars to quantify the heat resistance parameters of microorganisms in LMFs, and to design, verify, and improve associated thermal pasteurization processes. However, commercial aw meters can only conduct the measurement at low temperature range (20~50 ℃). Little is known on the aw in the high temperature range (>55 ℃). The microbial safety of LMFs and its microbial heat resistance parameters are first introduced in this article. Then the definition, detection methods, model predictions, influencing factors of aw,T and the effects of aw,T on microbial heat resistance of LMFs are summarized. Recognition and measurement of aw,T are beneficial for food industries to reduce the degree of LMFs microbial contamination and ensure consumers food safety.
-
食品水分活度(aw)是区分低水分与高水分食品的关键指标,它是“某特定温度下食品产生的蒸汽压与同温度下纯水蒸汽压的比值”[1]。因此,水分活度是温度依赖型指标,它随着温度的升高而变化。25 ℃条件下测定的水分活度(aw,25 ℃)并不能反映食品热加工过程中(>50 ℃)的实时水分活度,故此在研究中添加下标T来表示某特定温度下的食品水分活度,并称之为等温水分活度(aw,T)[2]。等温水分活度能直观地反映温度和水分对微生物细胞热致死过程的影响,对低水分食品中微生物的热致死动力学研究具有重要的意义[3]。深入了解等温水分活度,有助于进一步研究等温水分活度影响微生物抗热性的客观规律和生物学机理,丰富低水分食品微生物高抗热性理论,提高低水分食品微生物的安全性。
1. 低水分食品微生物安全现状
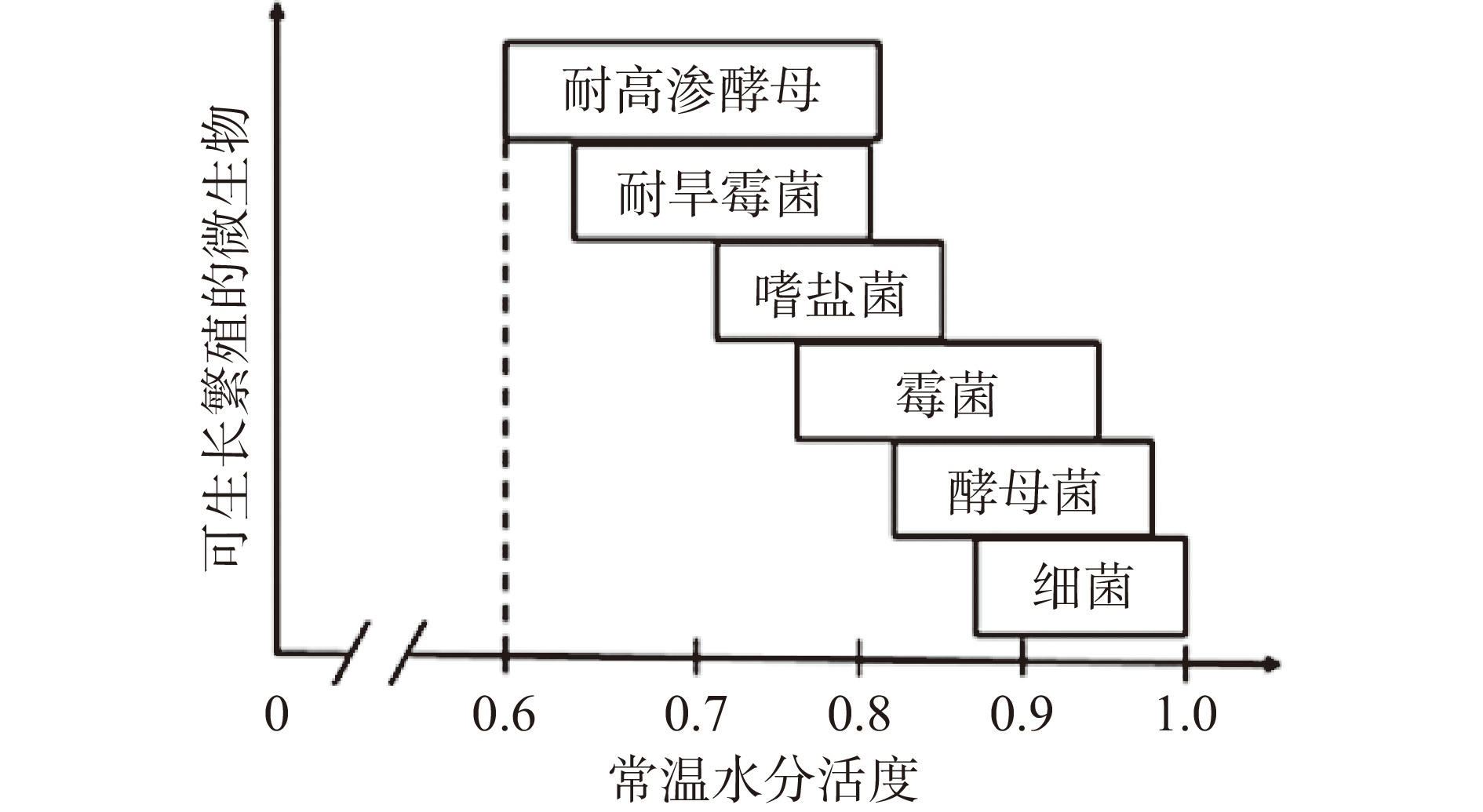
低水分食品(Low-moisture foods)是指25 ℃条件下水分活度值(aw,25 ℃)低于0.85的一类食品[4],一般由高水分食品经过加热、腌渍、低压冰晶气化等方式脱水而成,包括干制蛋白质(如奶粉)、干制水果和蔬菜(如葡萄干、洋葱粉)、干制肉品(如牛肉干)、谷物基产品(如早餐麦片、面粉、饼干)、坚果及坚果制品(如大杏仁、花生酱)、糖果(如巧克力)和混合类产品(如能量棒)等。低水分食品种类繁多,具有轻便耐贮等优点,在日常食品消费和工业食品原料中均占比可观。
由于低水分食品的水分含量(Moisture content, %)与aw,25 ℃均很低,几乎没有微生物能在其中生长繁殖(图1)[5],故而普遍认为低水分食品是一类“安全”的加工食品,但缺乏有效的微生物风险评估和适度的杀菌要求。
长久以来,低水分食品在加工、包装、运输、销售及贮藏等过程中难以做到完全无菌,可能会被极耐低水分环境的微生物所污染,如致病菌、霉菌和真菌孢子等[6]。这些微生物能够在低水分环境中存活数日甚至数月[7],而且经过干旱胁迫(Desiccation stress)等影响,还能表现出较强的耐高温能力和对其他不良环境的耐受性[8-9]。近几年发生了多起低水分食品微生物安全事件,表明了低水分食品可能也存在着较大的微生物安全隐患[10-12]。其中,致病菌及产毒微生物污染已经在国际范围内引发了多起食品安全事件[12–14],如2007年的美国花生酱感染沙门氏菌事件,沙门氏菌直接诱发消费者食源性疾病,导致了8人死亡;2018年中国杭州发生了“木耳中毒事件”,干制木耳中存在休眠的椰毒假单胞菌,在木耳长时间泡发的过程中繁殖,并产生了毒性代谢产物—米酵菌酸。低水分食品中的致病菌严重危及人类健康,应对低水分食品微生物安全高度重视。
2. 低水分食品微生物抗热性研究进展
2.1 低水分食品的热巴氏杀菌
食品中的水分与营养成分可以使未灭活微生物生长繁殖,通常需要冷链运输、低温销售、气调控制等其他措施,抑制微生物生长[15]。低水分食品因其水分活度低、几乎没有微生物生长繁殖的特点,没有完全灭菌(Sterilization)的条件也不会发生腐败变质。热加工是一种传统的加工方式,具有无化学残留、环境友好等特点。热巴氏杀菌是一种温和的热灭菌工艺,温度范围为70~90 ℃,仅去除致病菌,能够最大限度的保留产品品质。故热巴氏杀菌是在保障低水分食品微生物安全的前提下,加工程度最低、对食品品质保护程度最佳的热杀菌工艺。
热巴氏杀菌的工艺要求与相关目标致病菌(Pertinent pathogen)、目标致病菌污染程度(Potential contamination)及其抗热性(Heat resistance)息息相关。通过前期的风险分析与致病菌筛查,美国食品药品监督管理局、美国大杏仁学会、美国食品杂货制造商协会、美国香料贸易协会、世界粮农组织等官方机构均认定肠炎沙门氏菌(Salmonella enterica)为低水分食品巴氏杀菌的目标致病菌[16–19],而抗热性最强的一株——肠炎沙门氏菌PT30[20],于2004年在美国大杏仁召回事件中被筛选出来,成为目标致病菌株。由于肠炎沙门氏菌在低水分食品中污染的浓度通常低于4 lg CFU/g,因此低水分食品中肠炎沙门氏菌的目标杀菌度为4~5 lg CFU/g[16]。迄今,针对特定低水分食品的特定加工工艺已经有了高效可信的权威指南:如美国大杏仁学会颁布的大杏仁烘培工艺巴氏杀菌验证指南[18]、美国食品药品监督管理局颁布的关于花生[21]和开心果[22]的致病菌控制指南和The OpxE组颁布的食品焙烤指南[23]。指南涉及到热烫漂、油炙(Oil roasting)、焙烤等热灭菌工艺,但工艺的具体温度、时间等参数实际取决于肠炎沙门氏菌在特定食品中的抗热性指标。
2.2 低水分食品中微生物抗热性
细菌的抗热性指标一般通过绘制等温热致死动力学曲线(Iso-thermal inactivation kinetics)来获得。其中常用的两个指标为DT值(Decimal reduction time)和温度敏感性zT(Temperature sensitivity)。前者表述了在特定温度T下杀灭90%目标致病菌所需的时间,是温度相关的指标;后者描述了使DT值变化10倍所需要改变的温度[24],用数学公式[24]表示如下:
DT=−tlog(NN0) (1) zT=T2−T1log(DT1DT2) (2) 其中,N0与N表示的是等温热致死动力学曲线里升温时间(Come-up time)时t0和曲线内任意时间t时的细菌总数(CFU/g)。值得注意的是,以上公式仅适用于在高温下有稳定水分含量、物理特性与化学组分的食品样品(如面粉、坚果粒)。然而,在低水分食品的实际加工中,还有除温度以外的其他因素影响着细菌细胞的抗热性。
在低水分食品中,食品的成分组成、质构、水分和微生物污染方式等因素均对细菌的抗热性起着非常重要的作用[25]。单从水分而言,水分活性(Water mobility)、水分含量(Moisture content)和aw,25 ℃均被认为或是除温度因素之外的关键因素[26]。近百篇学术论文发表了水分相关的指标对某特定低水分食品中细菌抗热性的影响[20,27-28],通过现有数据可以得出以下结论:水分活性对沙门氏菌抗热性没有影响;低水分含量和低水分活度会显著增加沙门氏菌抗热性,其抗热性增加程度又取决于食品的理化特性[25]。
此外,学者们也提出低水分食品中微环境影响(Micro-environment impact)[29]、油脂保护(Oil pro-tection)[30]等假说以解释细菌在低水分环境下抗热性增强的现象,这些解释或假说对低水分食品热巴氏杀菌工艺的设计和验证起到了促进作用。但是,这些假说只顺应了低水分食品种类与组成的复杂性,使得现有的官方指南中的数据均基于单一食品样品(如大杏仁),指南中也特别强调了“可能不适用于其他低水分食品”,因而缺乏普遍适用性[18]。若针对每一种配方和质构的低水分食品都测定其中肠炎沙门氏菌的抗热性指标,这个过程显然是费时费力的,并且处理致病菌也需要高安全标准的实验室和专业人士的操作。因此,为了探究低水分食品中沙门氏菌抗热性的客观规律,从食品水分含量、水分活度、组分、物性、灭菌处理温度等一系列影响微生物抗热性的因素中确定1~2个关键因素显得尤为重要。其中,水分活度就是关键因素之一[31]。
3. 等温水分活度及其测定方式
3.1 等温活度与相对湿度
水分活度是指在一定温度下,食品在封闭空间产生的蒸汽压与等温等压条件下纯水产生的蒸汽压之比,数值由0(完全没有水)到1(纯水)[1]。由于食物中的水有一定的逸出度(Fugacity)或逸出倾向(Escaping tendency)[32],温度的改变会影响水分子的热动能,从而改变逸出度与等温水分活度。因此,食品中的水蒸汽压等于封闭系统中与食品处于热力学平衡的空气中的蒸汽压,水分活度也等于空气中的相对湿度值(RH)除以100:
aw,测定温度=RH100 (3) 其中,相对湿度主要描述空气中的自由水分子含量,但水分活度主要描述固体和液体物质中自由水分子的逸出度。由于食品中水分含量不同,且食品组分对水分子的吸附能力各异,因此食品水分活度主要受到水分含量和食品组分的影响。温度升高普遍会加速食品中水分子的运动,从而提升食品产生的蒸汽压与等温水分活度。等温吸附线能够直观地表示食物中水分含量和水分活度之间的关系,可以用于水分活度和水分含量之间互相推算,也可以用于了解食物组分对水分的吸附能力[33]。
3.2 测定方式及设备校准
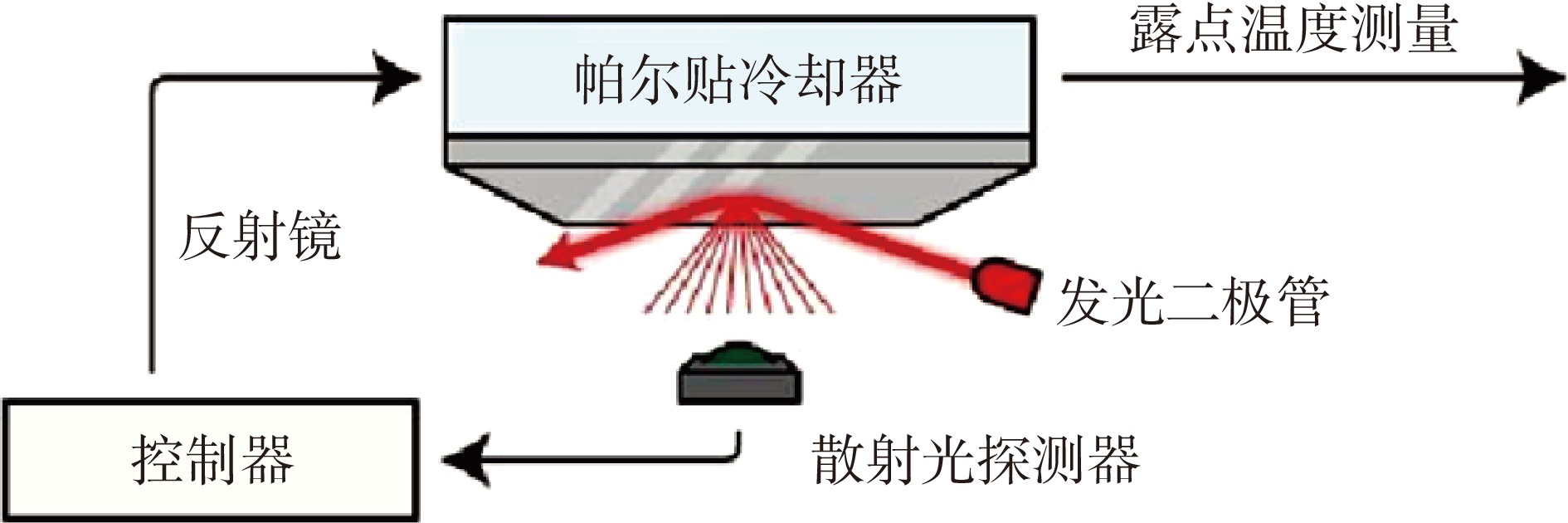
根据水分活度的定义,测定水分活度应当通过测定密闭空间内食品产生的蒸汽压来计算。因此,常用的水分活度测定方法有冷冻镜露点法(Chilled-mirror dew point method)和电容法(Capacitance method)(图2、图3)。冷冻镜露点法是测定水分活度的经典方法[34],即冷冻镜在降温的过程中会改变靠近该表面的相对湿度,当相对湿度达到100%时冷冻镜表面出现露珠、影响光的折射,光折射的改变被检测器捕获,与之对应的降温温度即为露点。如果空气中温度是Tair,露点生成温度为Tdew,则该密闭空间的相对湿度(等于该空气温度Tair下空间内的水分活度)可以通过以下公式算出:
相对湿度=aw,Tair×100=Tdew时的饱和蒸汽压Tair时的饱和蒸汽压×100 (4) 露点法测量水分活度遵循了Regnault原理:当一定体积的湿空气在恒定的总压力下被均匀降温,空气中水汽会在一定温度时达到饱和状态,该温度叫做露点,对应的相对湿度可用作换算水分活度。露点法的测量方式基于水分活度的原理定义,是最准确(±0.003 aw)、快速(5 min内)的测定方法[34]。但是露点法也涉及到镜面污染、温度控制等问题。例如,如果被测食品产生小分子水溶性物质(如可溶性盐类)造成镜面提前结露,会使得测量结果产生偏差。此外,露点仪通常放置于室温下,因此其测量的水分活度受室温变化的影响,或者需要人为控温于25 ℃(aw,25 ℃)。
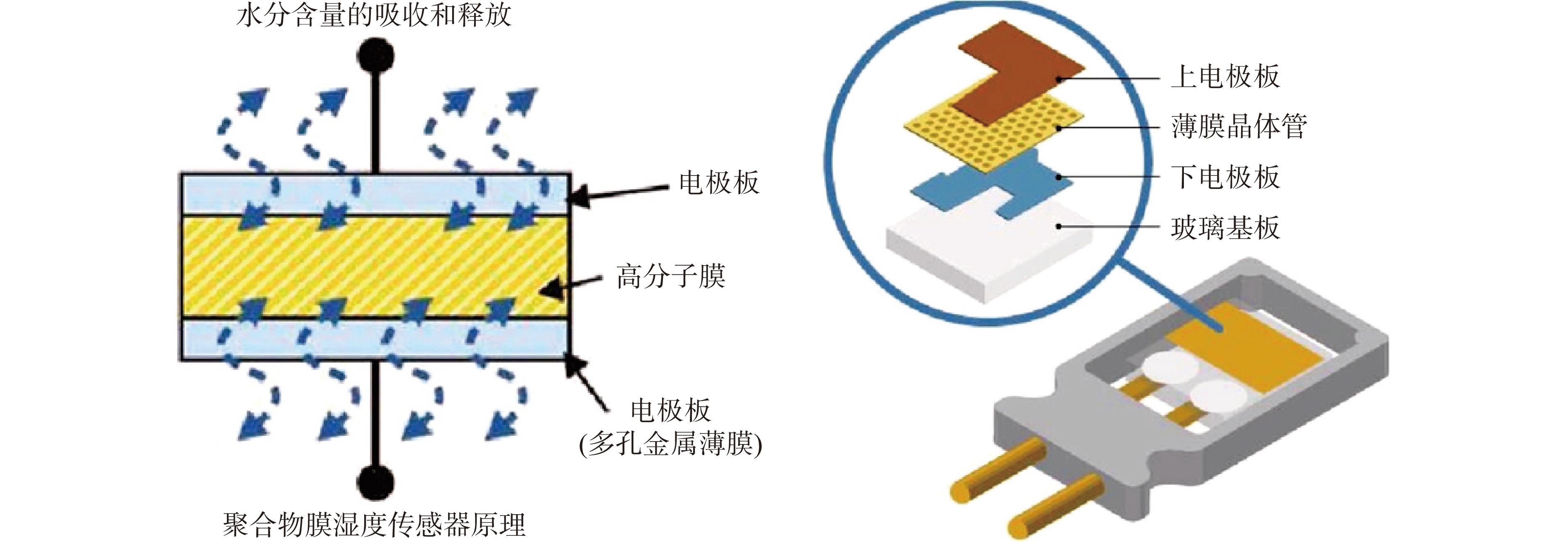
电容法同露点法相比其准确度略有降低(±0.02 aw),由于在测量过程中不易受到挥发性物质和温度的影响,也是目前应用于开发等温水分活度测定仪的主要测量方法[31]。基于电容法的水分活度仪由耐腐蚀聚合物薄膜和带电极板组成,当样品与空气顶空的蒸汽压处于热力学平衡时,传感器测量出聚合物膜的电容、换算出水分活度。电容法的组件可以耐受较高的温度,因此基于电容法的水分活度测定仪可以测量温度在20~60 ℃(如The Meter Group的Vapor Sorption Absorber)[35],甚至更高(>60 ℃)[36]温度下的水分活度。但是,聚合物薄膜在高温、高湿、使用时间过久等情况下会衰老、产生微量形变,从而影响水分活度值的测量,因此基于电容法的设备需要定期校准。
校准水分活度仪需要使用到不同种类的饱和盐溶液或盐,因为盐溶液分子在饱和状态会产生稳定的蒸汽压,且该蒸汽压伴随盐分子的不同而差异显著,不同盐溶液及其在室温下的饱和相对湿度如表1[37]。
表 1 盐溶液及其在饱和状态下产生的相对湿度Table 1. Saturated salt solutions and the corresponding relative humidity盐溶液种类 饱和相对湿度(%) LiCl 11.3 CH3COOK 22.5 MgCl2 32.8 K2CO3 43.2 MgNO3 52.9 NaCl 65.8 KCl 84.3 以上两种测量方法均是对密闭空间内的食品产生的蒸汽压进行相对湿度的测量,再换算为水分活度,因此其测量温度与密闭空间内的原空气会对测量结果产生影响。例如,在高温测量时,高温状态下(>60 ℃)需要一定的平衡时间(~30 min)使得空气与食物温度一致。在测量过程中,为避免空气中的湿度影响食物产生的蒸汽压,水分活度仪的样品槽内应当尽量干燥、样品量不得过多或过少,样品测量后应尽量敞开样品槽一定时间,以去除样品对样品槽中空气相对湿度的影响。
3.3 水分活度对微生物抗热性的影响
水分活度的提出增加了人们量化水分子在食品中能够被微生物生长繁殖利用和一些生物化学反应所需要的可利用量的认知,为微生物的研究提出了新的探索指标。食品的aw,25 ° C越低,表明食品保持水分的能力越强,能提供给微生物利用的可利用水分越少,越不利于微生物的繁殖,进而有利于食品的保存。此外,低aw,25 ℃也会显著增加热灭活微生物的难度[38]。比如,随着环境中aw,25 ℃值从0.98降低到0.83,鼠伤寒沙门氏菌的D68.3 ℃值由0.12 min增加到了40.2 min[39]。
目前,已有很多文献报道了不同微生物(沙门氏菌、李斯特菌、大肠杆菌、乳酸菌、酵母等)在不同低水分食品内(蛋白质粉、坚果、香辛料、面粉、蛋白脂肪混合物)受到aw,25 ℃影响的抗热性指标的变化(DT或ZT值)[38,40–42]。随着aw,25 ℃的降低,不同食品内的微生物抗热性均显著增加,但增加的程度不同。微生物抗热性指标受aw,25 ℃调控下的变化趋势因其 “食品样品不同”的壁垒而无法联立分析:即使在相同aw,25 ℃条件下,微生物在不同低水分食品中呈现出完全不同的抗热性。
4. 等温水分活度的概念及其研究进展
4.1 概念
商业化的水分活度测定仪仅能测定食品在25 ℃条件下的蒸汽压,且只能计算得出aw,25 ℃,不能直接反映食品在热巴氏杀菌温度(70~90 ℃)下的等温水分活度(aw,T)。因此,开发高温条件下aw,T的测定方法及设备是研究等温水分活度(高温范围)的重要支撑。2016年,美国华盛顿州立大学Juming Tang教授团队首次提出等温水分活度(Water activity at iso-thermal treatment)的概念[2],表示某特定温度的水分活度,并以温度T为下标来表示(aw,T)。该团队开发设计了基于电容法的高温水分活度测定仪,并且正在与The METER group联合推出商业化设备[2]。此外,该团队对小麦面粉、脱脂奶粉、花生酱、蜂蜜粉、鸡蛋粉等多类低水分食品的等温水分活度(20~80 ℃)进行了测定分析,并揭露了等温水分活度的变化趋势受到低水分食品组分的决定性影响,例如,具有相同aw,25 ℃=0.50±0.02的花生酱与小麦面粉在80 ℃条件下产生了aw,80 ℃=0.10±0.02和0.80±0.02的显著差异。同时,该团队也发现低水分食品中细菌细胞会随着环境的变化在数秒内平衡并达到环境的等温水分活度[43],花生酱和小麦面粉产生的不同等温水分活度或对其中沙门氏菌的抗热性指标产生重要影响[2]。
4.2 测量方式
目前,测量温度在50 ℃以下的水分活度可以选择Vapor Sorption Analyzer,在50 ℃以上的等温水分活度的测量还没有商业化的设备。在高温条件下,等温水分活度的准确测量最重要的是保持食品样品与其密闭空间顶空的等温等湿(Iso-thermal iso-moisture)。为达到这种水分子和温度均平衡的状态,常温状态下的样品所需的测量时间通常需要3~30 min(25~80 ℃,取决于测定的温度)。此外,加热会使得顶空空气升温、水分活度降低、带走食品中的水分,引起等温水分活度测定值偏低。只有将食品样品与其顶空一同封闭加热,并将样品与顶空的体积比控制在一定范围才能完成正确的水分活度测量(如花生油中样品:顶空体积比≥10.6[44])。
SYAMALADEVI等[2]将相对湿度探头附着于金属容器的顶端,把食品样品密闭于金属容器内后一并放入高温烘箱中进行平衡与测定,设备的校准选取了已知不同温度下等温水分活度的13.4 mol的LiCl溶液与6 mol的NaCl溶液[45-46]。这类高温水分活度测定仪设计简单,通过将设备与样品一同进行加热处理,即可获得等温等湿的测量条件。它能较为准确的测定大部分食品的高温水分活度,但是也有加热速度慢(>15 min)、测量温度低(<100 ℃)、食品水分活度受顶空空气影响大、无法测量含挥发性物质的样品等缺点。YANG等[44]对该容器进行了改进:在底部加入磁力搅拌柱—并完成了对花生油的等温水分活度测定,结果发现花生油的等温水分活度随着温度的升高而呈指数型下降,认为油脂升温后水分活度的降低或能够解释油脂保护假说[39]。
4.3 模型预测
高温水分活度可以使用基于电容法的水分活度仪进行直接测量,但在没有高温水分活度仪的情况下,基于食品等温吸附线(Sorption isotherm)的数学建模也可以推算得到较为准确的等温水分活度。等温吸附线是指在恒温条件下,食品系统中水分活度与水分含量(g水/g干物质)之间的关系曲线[33],反映了该食品系统水分子的转移难易程度,也能用于判断食品中非水组分与水结合能力的强弱。描述等温吸附线的数学模型有助于预测食品系统的等温水分活度(尤其是在难以检测的高温状态),但是相关的模型均易受到食品组分及质构的影响。
Guggenheim, Anderson与De Boer(GAB)模型可以描述大部分食品(水果、蔬菜、肉、奶制品、淀粉类食物、坚果、咖啡、茶和香料)在理论状态下的等温吸湿线[47-48],其具体相关模型参数及假说可参见QUIRIJINS等[49]的文章。GAB模型在小麦面粉和花生酱的等温吸湿线中拟合良好(如小麦面粉中吸附线R2=0.80,解吸线R2=0.87),并能够用于不同aw,80 ℃值的计算。但是,该GAB模型的建立是基于已测定的20~80 ℃的等温吸湿线,工作量巨大,而且拟合关系并不够高(R2≤0.87)[6]。
Clausuis Clapeyron equation(CCE)可以用于描述食品样品在固定水分含量状态下不同温度时的水分活度变化情况[50-51]。它通过计算样品吸收的静等容热(qst, J·mol−1)以估算温度对食品系统中水分含量的影响。TADAPANENI等[52]自制了电容型高温水分活度测定仪,完成了温度在20~80 ℃的小麦面粉、大杏仁粉和脱脂奶粉中的等温吸湿线,并计算得到样品的qst(受水分含量与样品组分的影响,qst在0~90 J/mol不等)。基于此qst值建立的CCE在三种样品中匹配度高(R2=0.96~0.98),而且仅通过测定低温等温吸湿线(<50 ℃,现有商业设备能够涵盖该温度区间)就能预测某特定水分含量下该样品的高温水分活度(>50 ℃),极大地节约了测试时间与成本。
吉布斯自由能(Gibbs free energy,kJ/mol)是在化学热力学中为判断过程进行的方向而引入的热力学函数,又称自由焓或自由能。在纯食物油中,由于油脂活度趋近于1,因此超额吉布斯自由能(Excess Gibbs free energy)可以用于估算纯油脂中水分活度随着温度升高的变化方向。YANG等[44]测量了花生油的高温水分活度,计算出其超额吉布斯自由能(14.25 kJ/mol)和每摩尔溶解在油中的水的熵(0.023 kJ/mol/K),运用该指标建立起来的方程拟合度高(R2=0.996,RSME=0.01(aw)),有效地预测了花生油在高温下的等温水分活度。
5. 等温水分活度对低水分食品中微生物抗热性的影响
等温水分活度作为一个实时的指标,会随着温度升高而变化,而且不同食品组分的等温水分活度在温度升高时变化差异明显。该现象首先在花生酱和小麦面粉的对比中被发现[2]:若两个样品都从aw,25 ℃=0.45±0.02开始,当温度升高到80 ℃时,花生酱与小麦面粉的aw,80 ℃出现了0.04与0.80的巨大反差。此反差也被认为或与肠炎沙门氏菌在其中的D80 ℃值有关(花生酱中(17.0±0.9)min,小麦面粉中(6.9±0.7)min)[2]。由于低水分食品中细菌细胞会随着环境的变化在数秒内平衡到环境的等温水分活度[43],花生酱和小麦面粉产生的不同等温水分活度或对其中沙门氏菌的抗热性指标产生重要影响。
为继续探究等温水分活度与肠炎沙门氏菌抗热性之间的关系,LIU等[53]用二氧化硅颗粒代表低水分环境,发现了等温水分活度与肠炎沙门氏菌D80 ℃值具有明显的对数线性关系[54](Log-linear relationship, R2=0.97):
logD80℃=−3.2314×aw,80℃+2.7481 (5) 此线性关系也与文献已公开的小麦面粉中肠炎沙门氏菌的D80 °C值高度拟合。该研究首次采用非食品组分的低水分环境,排除了食品理化性质对微生物抗热性的影响,揭示了等温水分活度具有预测不同低水分食品中沙门氏菌DT值的潜力。但是,该研究也有以下限制:其一,肠炎沙门氏菌在二氧化硅颗粒中可能受到饥饿胁迫,这与食品系统中的污染情况不符;其二,文章运用少量的二氧化硅颗粒(1.0 g),使得附着在表面的微生物细胞均暴露于相同的aw,80 ℃,但实际食品系统中更复杂、aw,80 ℃更难均匀、灭菌的程度受到微环境影响更大。
XU等[55]运用了更大比表面积的水分活度控制器(将不同组分的食品粉末轻薄地铺在样品槽内),绘制了三种不同食品中的微生物细胞在相同aw,80 ℃条件下的等温热致死曲线,建立了类似的对数线性关系:
logD80℃=−7.214×aw,80℃+2.8145(R2=0.89) (6) XIE等[56]也在等温水分活度的基础上,建立了肠炎沙门氏菌的纯菌及其在五种食品和与二氧化硅颗粒中的水分含量(7.7%~15.7%,干重)与D80 °C值的对数线性关系。
至此,等温水分活度与水分含量对肠炎沙门氏菌在纯菌和不同低水分食品、环境下的抗热性指标D80 °C的对数线性关系在不同角度得到了证实。此对数线性关系对低水分食品微生物安全可能产生以下影响:a. 对不同水分含量或等温水分活度的食品在灭菌处理时,能够进行灭菌程度的预测及验证;b. 在判断实验室培育的微生物是否进入干旱胁迫状态时,可以采用控制等温水分活度的方式进行抗热性校准;c. 对进一步探究水分子在脱水微生物细胞热灭活过程中的影响起到了促进作用。
但是,在高温区间的水分活度被准确测量之前(2016年[2]),所有已发布的水分活度对低水分食品微生物安全的相关文章(>100篇)均使用的是aw,25 ℃。而且由于实验样品组分差异巨大,相关的等温水分活度模型未能全部得到建立,因此大部分的微生物数据无法联立到该食品样品的高温水分活度。在有限数据的情况下,已发布的微生物抗热性数据及可预测/已测定的高温水分活度见表2。
表 2 等温水分活度、低水分食品/环境及相关微生物的热抗性指标Table 2. Water activity at isothermal temperature(aw,T), low-moisture foods/environment and heat resistance parameters of associated microorganisms菌株 低水分样品 食品组分(%,干重) aw,25 ℃±0.2 aw,80 ℃±0.2 D80 ℃(min) zT(℃) zaw(80 ℃) 参考文献 肠炎沙门氏菌PT30 二氧化硅颗粒 无食品组分 0.11~0.70 0.18~0.72 159±5.77~1.80±0.12 NA 0.31(R2=0.97) [53] 纯菌 NA 0.45 0.65 5.9±0.80 NA [56] 葡萄糖粉 C6H12O6纯净物 0.13 0.18 63.0±5.40 [35] 0.24 0.31 37.9±1.50 0.34 0.40 21.3±1.00 0.45 0.50 9.7±0.70 果糖粉 0.13 0.18 47.4±2.30 0.24 0.31 37.6±1.70 0.34 0.40 26.6±2.00 0.45 0.50 21.6±1.40 蜂蜜粉 NA 0.13 0.18 35.5±2.30 0.24 0.31 27.0±1.60 0.34 0.40 19.3±1.80 0.45 0.50 14.4±1.10 小麦面粉 碳水化合物78.92±0.16
脂肪3.28±0.09
蛋白质5.70±0.000.31 0.52* 10.27±0.65 16.7±0.73
(aw,ref=0.62)[57] 0.43 0.68* 5.51±0.22 0.58 0.81* 1.27±0.06 0.70 0.85* 1.17±0.06 0.30 0.52 10.27±0.65 21.8 [58] 0.45 0.68 5.51±0.22 14.8 0.60 0.81 1.27±0.06 15.9 0.25 0.47 12.2±0.70 0.32
(R2=0.89)[55] 0.45 0.68 4.9±0.50 0.60 0.78 1.2±0.20 0.80 0.89 NA 杏仁粉 碳水化合物23.3±0.88
脂肪48.8±0.33
蛋白质21.1±0.300.25 0.47 27.3±0.30 0.45 0.68 21.2±0.90 0.60 0.78 11.1±0.80 0.80 0.89 0.8±0.10 乳清蛋白 碳水化合物8.60±0.68
脂肪6.36±0.41
蛋白质77.1±0.280.25 0.47 17.5±1.30 0.45 0.68 10.6±0.20 0.60 0.78 5.1±0.40 0.80 0.89 1.5±0.10 蛋清粉 碳水化合物2.9±0.8
脂肪5.3±0.1
蛋白质84.3±0.70.30 0.48 25.81±0.33 0.39
(R2=0.85)[59] 0.45 0.56 13.3±0.33 0.60 0.66 6.07±0.06 蛋黄粉 碳水化合物4.5±0.5
脂肪55.1±0.3
蛋白质34.7±0.70.30 0.53 25.9±0.20 0.45 0.60 13.6±0.20 0.60 0.72 6.08±0.04 全蛋粉 碳水化合物0.9±0.2
脂肪43.2±0.1
蛋白质46.4±0.10.30 0.45 20.5±0.20 0.45 0.62 7.0±0.10 0.60 0.74 5.3±0.10 屎肠球菌NRRL B-2354 二氧化硅颗粒 无食品组分影响 0.11~0.70 0.18~0.72 281.78±5.78~
3.81±0.11NA 0.28
(R2=0.98)[53] 小麦面粉 碳水化合物78.92±0.16
脂肪3.28±0.09
蛋白质5.70±0.000.30 0.52 20.4±0.85 14.3 NA [58] 0.45 0.68 5.56±0.49 11.9 0.60 0.81 2.27±0.25 8.5 蛋清粉 碳水化合物2.9±0.8
脂肪5.3±0.1
蛋白质84.3±0.70.30 0.48 43.8±0.40 NA 0.47
(R2=0.85)[59] 0.45 0.56 21.53±0.10 0.60 0.66 13.2±0.10 蛋黄粉 碳水化合物4.5±0.5
脂肪55.1±0.3
蛋白质34.7±0.70.30 0.53 42.4±0.40 0.45 0.60 21.6±0.20 0.60 0.72 12.5±0.30 全蛋粉 碳水化合物0.9±0.2
脂肪43.2±0.1
蛋白质46.4±0.10.30 0.45 32.2±0.50 0.45 0.62 15.5±0.30 0.60 0.74 10.4±0.40 单增李斯特菌 小麦面粉 碳水化合物78.92±0.16
脂肪3.28±0.09
蛋白质5.70±0.000.30 0.52* 7.10 12.9 NA [60] 0.45 0.68* 3.10 14.2 0.60 0.81* 1.60 9.9 注:NA表示无数据;*表示数据来源于其他文献(相同原材料的数学模型)。 6. 结论
本文综述了等温水分活度的定义、测量及对微生物热抗性的影响,强调了水分活度在食品热加工过程中的温度依赖特性,对常温下食品的水分活度与灭菌过程中的实时水分活度进行了明确的区分。相关研究数据表明:食品水分活度会随着温度升高而发生显著的变化,其变化趋势及程度受到食品组分、质构等多因素影响;等温条件下的水分活度(aw,T)是决定该温度下致病菌抗热性(DT)的关键指标;监测与提升食品高温灭菌过程中的实时水分活度或能提升灭菌效率。
但是,等温水分活度研究还有以下方面的局限:a. 研究依赖于特制的高温水分活度测定仪等未商业化的设备,研究的硬件可行性不高;b. 常规热加工过程中更能接受相对湿度的概念,等温水分活度的概念推广任重道远;c. 水分活度是一个平衡状态下的指标,而食品生产加工却是动态变化的过程,运用等温水分活度的理论指导实际灭菌工艺需要提高其测量精度与开发智能监测系统;d. 在高温状态下,提升等温水分活度虽然有利于提升微生物灭活效率,但也可能对低水分食品产生严重的品质影响(如吸潮),而此方面的研究还未见报道。
水分活度是低水分食品微生物安全控制研究的重要指标。但低水分食品是复杂的体系,不同的食品内部也会存在许多不均匀的微环境,造成相同处理条件下出现不同位点的灭菌结果存在差异。等温水分活度在多种类、复合型低水分食品(如能量棒、混合谷物、复合糖果)中的微生物安全中起着怎样的作用,还需要学者们进行更加深入的探索。
-
表 1 盐溶液及其在饱和状态下产生的相对湿度
Table 1 Saturated salt solutions and the corresponding relative humidity
盐溶液种类 饱和相对湿度(%) LiCl 11.3 CH3COOK 22.5 MgCl2 32.8 K2CO3 43.2 MgNO3 52.9 NaCl 65.8 KCl 84.3 表 2 等温水分活度、低水分食品/环境及相关微生物的热抗性指标
Table 2 Water activity at isothermal temperature(aw,T), low-moisture foods/environment and heat resistance parameters of associated microorganisms
菌株 低水分样品 食品组分(%,干重) aw,25 ℃±0.2 aw,80 ℃±0.2 D80 ℃(min) zT(℃) zaw(80 ℃) 参考文献 肠炎沙门氏菌PT30 二氧化硅颗粒 无食品组分 0.11~0.70 0.18~0.72 159±5.77~1.80±0.12 NA 0.31(R2=0.97) [53] 纯菌 NA 0.45 0.65 5.9±0.80 NA [56] 葡萄糖粉 C6H12O6纯净物 0.13 0.18 63.0±5.40 [35] 0.24 0.31 37.9±1.50 0.34 0.40 21.3±1.00 0.45 0.50 9.7±0.70 果糖粉 0.13 0.18 47.4±2.30 0.24 0.31 37.6±1.70 0.34 0.40 26.6±2.00 0.45 0.50 21.6±1.40 蜂蜜粉 NA 0.13 0.18 35.5±2.30 0.24 0.31 27.0±1.60 0.34 0.40 19.3±1.80 0.45 0.50 14.4±1.10 小麦面粉 碳水化合物78.92±0.16
脂肪3.28±0.09
蛋白质5.70±0.000.31 0.52* 10.27±0.65 16.7±0.73
(aw,ref=0.62)[57] 0.43 0.68* 5.51±0.22 0.58 0.81* 1.27±0.06 0.70 0.85* 1.17±0.06 0.30 0.52 10.27±0.65 21.8 [58] 0.45 0.68 5.51±0.22 14.8 0.60 0.81 1.27±0.06 15.9 0.25 0.47 12.2±0.70 0.32
(R2=0.89)[55] 0.45 0.68 4.9±0.50 0.60 0.78 1.2±0.20 0.80 0.89 NA 杏仁粉 碳水化合物23.3±0.88
脂肪48.8±0.33
蛋白质21.1±0.300.25 0.47 27.3±0.30 0.45 0.68 21.2±0.90 0.60 0.78 11.1±0.80 0.80 0.89 0.8±0.10 乳清蛋白 碳水化合物8.60±0.68
脂肪6.36±0.41
蛋白质77.1±0.280.25 0.47 17.5±1.30 0.45 0.68 10.6±0.20 0.60 0.78 5.1±0.40 0.80 0.89 1.5±0.10 蛋清粉 碳水化合物2.9±0.8
脂肪5.3±0.1
蛋白质84.3±0.70.30 0.48 25.81±0.33 0.39
(R2=0.85)[59] 0.45 0.56 13.3±0.33 0.60 0.66 6.07±0.06 蛋黄粉 碳水化合物4.5±0.5
脂肪55.1±0.3
蛋白质34.7±0.70.30 0.53 25.9±0.20 0.45 0.60 13.6±0.20 0.60 0.72 6.08±0.04 全蛋粉 碳水化合物0.9±0.2
脂肪43.2±0.1
蛋白质46.4±0.10.30 0.45 20.5±0.20 0.45 0.62 7.0±0.10 0.60 0.74 5.3±0.10 屎肠球菌NRRL B-2354 二氧化硅颗粒 无食品组分影响 0.11~0.70 0.18~0.72 281.78±5.78~
3.81±0.11NA 0.28
(R2=0.98)[53] 小麦面粉 碳水化合物78.92±0.16
脂肪3.28±0.09
蛋白质5.70±0.000.30 0.52 20.4±0.85 14.3 NA [58] 0.45 0.68 5.56±0.49 11.9 0.60 0.81 2.27±0.25 8.5 蛋清粉 碳水化合物2.9±0.8
脂肪5.3±0.1
蛋白质84.3±0.70.30 0.48 43.8±0.40 NA 0.47
(R2=0.85)[59] 0.45 0.56 21.53±0.10 0.60 0.66 13.2±0.10 蛋黄粉 碳水化合物4.5±0.5
脂肪55.1±0.3
蛋白质34.7±0.70.30 0.53 42.4±0.40 0.45 0.60 21.6±0.20 0.60 0.72 12.5±0.30 全蛋粉 碳水化合物0.9±0.2
脂肪43.2±0.1
蛋白质46.4±0.10.30 0.45 32.2±0.50 0.45 0.62 15.5±0.30 0.60 0.74 10.4±0.40 单增李斯特菌 小麦面粉 碳水化合物78.92±0.16
脂肪3.28±0.09
蛋白质5.70±0.000.30 0.52* 7.10 12.9 NA [60] 0.45 0.68* 3.10 14.2 0.60 0.81* 1.60 9.9 注:NA表示无数据;*表示数据来源于其他文献(相同原材料的数学模型)。 -
[1] LABUZA T P. Sorption phenomena in foods: Theoretical and practical aspects[M]. Springer Netherlands, 1975: 197–219.
[2] SYAMALADEVI R M, TADAPANENI R K, XU J, et al. Water activity change at elevated temperatures and thermal resistance of Salmonella in all purpose wheat flour and peanut butter[J]. Food Research International,2016,81:163−170. doi: 10.1016/j.foodres.2016.01.008
[3] LIU S, TANG J, TADAPANENI R K. Ponentially increased thermal resistance of Salmonella and Enterococcus faecium at reduced water activity[J]. Environmental Microbiology, 2018, 84(8):e02742-17.
[4] FDA. Risk profile: Pathogen and filt in spices. CFSAN Risk & Safety Assessments[S/OL]. 2019. https://www.fda.gov/food/cfsan-risk-safety-assessments/risk-profile-pathogen-and-filth-spices.
[5] National Advisory Committee on Microbiological Criteria for Foods. Parameters for determining inoculated pack/challenge study protocols[J]. Journal of Food Protection, 2010: 73: 140–202.
[6] 连风, 赵伟, 杨瑞金. 低水分活度食品的微生物安全研究进展[J]. 食品科学,2014,35(19):333−337. [LIAN F, ZHAO W, YANG R J. Microbiological safety of low-water activity foods[J]. Food Science,2014,35(19):333−337. doi: 10.7506/spkx1002-6630-201419066 [7] 张宏梅, 尹小慧, 林育成, 等. 沙门氏菌在不同环境下辣椒中的存活情况[J]. 现代食品科技,2017,33(4):236−240. [ZHANG H M, YIN X H, LIN Y C. et al. Survival of Salmonella in red pepper under different environmental conditions[J]. Modern Food Science & Technology,2017,33(4):236−240. [8] 石品. 低水分活度食品携带病菌情况加重[J]. 农产品加工,2013(2):74−75. [SHI P. Low water activity foods carry more pathogens[J]. Farm Products Processing,2013(2):74−75. [9] FINN S, CONDELL O, MCCLURE P, et al. Mechanisms of survival, responses, and sources of Salmonella in low-moisture environments[J]. Frontiersin Microbiology,2013,4(1):331.
[10] Administration, U S F and D. Outbreak investigation of Salmonella Stanley: Wood ear mushrooms-dried fungus[EB/OL]. (2020-11-4). https://www.fda.gov/food/outbreaks-foodborne-illness/outbreak-investigation-Salmonella-stanley-wood-ear-mushrooms-dried-fungus-september-2020.
[11] CDC. Multistate outbreak of shiga toxin-producing Escherichia coli O121 infections associated with Flour-Canada, 2016-2017[EB/OL]. (2016-9-29). https://www.cdc.gov/ecoli/2016/o121-06-16/index.html
[12] FDA. Urgent food recall of Jungle Jim's roast no salt sunflower seeds, Windy Acres fruity trail mix and Windy Acres no salt sunflower seeds due to potential presence of Listeria monocytogenes[EB/OL]. (2016-6-2). https://www.fda.gov/Safety/Recalls/ucm504811.htm.
[13] CDC. Multistate outbreak of Salmonella Montevideo and Salmonella Senftenberg infections linked to wonderful pistachios(final update)[EB/OL]. (2016-5-20).https://www.cdc.gov/Salmonella/montevideo-03-16/index.html.
[14] MCCALLUM L, PAINE S, SEXTON K, et al. An outbreak of Salmonella typhimurium phage type 42 associated with the consumption of raw flour[J]. Foodborne Pathogens and Disease,2013,10(2):159−164. doi: 10.1089/fpd.2012.1282
[15] HOLDSWORTH S D, SIMPSON R. Thermal processing of packaged foods[M]. Blackie Academic and Professional, 1997.
[16] The Association of Food Beverage and Consumer Products Companies. Control of Salmonella in low-moisture foods[S]. 2009.
[17] Almond Board of California. Guidelines for process validation using Enterococcus faecium NRRL B-2354[S]. 2007.
[18] Almond Board of California. Guidelines for validation of dry roasting processes[S]. 2007.
[19] WHO. Code ofhygienic practice for low-moisture foods CAC/RCP 75-2015[S]. 2016.
[20] VILLA-ROJAS R, TANG J, WANG S, et al. Thermal inactivation of Salmonella enteritidis PT 30 in almond kernels as influenced by water activity[J]. Journal of Food Protection,2013,76(1):26−32. doi: 10.4315/0362-028X.JFP-11-509
[21] Food, U S. Guidance for industry: Measures to address the risk for contamination by Salmonella species in food containing a peanut-derived product as an ingredient[S]. United States: Center for Food Safety and Applied Nutrition, 2012(99): 4–7.
[22] FDA. Guidance for industry: Measures to address the risk for contamination by Salmonella species in food containing a pistachio-derived product as an ingredient[S/OL]. United States: Center for Food Safety and Applied Nutrition, 2009: 3. https://www.fda.gov/RegulatoryInformation/Guidances/ucm115386.htm.
[23] OpX Leadership Network. Spotlight on baking [S/OL]. 2016. https://www.opxleadershipnetwork.org/quality/download/spotlight-baking.
[24] GAILLARD S, LEGUERINEL I, MAFART P. Model for combined effects of temperature, pH and water activity on thermal inactivation of Bacillus cereus spores[J]. Journal of Food Science,2010,63(5):887−889.
[25] PODOLAK R, ENACHE E, STONE W, et al. Sources and risk factors for contamination, survival, persistence, and heat resistance of Salmonella in low-moisture foods[J]. Journal of Food Protection,2010,73(10):1919−1936. doi: 10.4315/0362-028X-73.10.1919
[26] LIMCHAROENCHAT P, MARKS B P, JEONG S. The effect of changing almond water activity on thermal inactivation of Salmonella enteritidis PT 30 during dry heating[C]//in American Society of Agricultural and Biological Engineers Annual International Meeting, 2014.
[27] SANTILLANA FARAKOS S M, FRANK J F, SCHAFFNER D W. Modeling the influence of temperature, water activity and water mobility on the persistence of Salmonella in low-moisture foods[J]. International Journal of Food Microbiology,2013,166(2):280−293. doi: 10.1016/j.ijfoodmicro.2013.07.007
[28] GARCES-VEGA F J, RYSER E T, MARKS B P. Relationships of water activity and moisture content to the thermal inactivation kinetics of Salmonella in low-moisture foods[J]. Journal of Food Protection,2019,82(6):963−970. doi: 10.4315/0362-028X.JFP-18-549
[29] HAIPING L I, XIAOWEN F U, BIMA Y, et al. Effect of the local microenvironment on survival and thermal inactivation of Salmonella in low- and intermediate-moisture multi-ingredient foods[J]. Journal of Food Protection,2014,77(1):67−74. doi: 10.4315/0362-028X.JFP-13-277
[30] SHIGEMOTO M, NAKAGAWA K, SAKAMOTO J J, et al. Thermal death of Bacillus subtilis spores in oil water systems[J]. Biocontrol Science,2010,15(1):27−31. doi: 10.4265/bio.15.27
[31] SYAMALADEVI R M, TANG J, VILLA-ROJAS R, et al. Influence of water activity on thermal resistance of microorganisms in low-moisture foods: A review[J]. Comprehensive Reviews in Food ence and Food Safety,2016,15(2):353−370. doi: 10.1111/1541-4337.12190
[32] LONCIN M. Activity of water and its importance in preconcentration and drying of foods[C]//Preconcentration and Drying of Food Materials, Elsevier, 1988, 15–34.
[33] BERG E V D, BRUIN S. Water activity and its estimation in food systems: Theoretical aspects[C]//Water Activity: Influences on Food Quality, Academic Press, 1981, 1–62.
[34] FONTANA A J. Measurement of water activity, moisture sorption isotherms, and moisture content of foods[M]. Water Activity in Foods: Fundamentals and Applications. Blackwell Publishing Ltd, 2008.
[35] ALSHAMMARI J, XU J, TANG J, et al. Thermal resistance of Salmonella in low-moisture high-sugar products[J]. Food Control,2020,114:107255. doi: 10.1016/j.foodcont.2020.107255
[36] LIU S, ROJAS R V, GRAY P,et al. Enterococcus faecium as a Salmonella surrogate in the thermal processing of wheat flour: Influence of water activity at high temperatures[J]. Food Microbiology,2018,74:92−99. doi: 10.1016/j.fm.2018.03.001
[37] GREENSPAN L. Humidity fixed points of binary saturated aqueous solutions[J]. J Res Natl Bur Stand,1977,81(1):81−89.
[38] LAROCHE C, FINE F, GERVAIS P. Water activity affects heat resistance of microorganisms in food powders[J]. International Journal of Food Microbiology,2005,97(3):307−315. doi: 10.1016/j.ijfoodmicro.2004.04.023
[39] SUMNER S S, SANDROS T M, HARMON M C, et al. Heat resistance of Salmonella typhimurium and Listeria monocytogenes in sucrose solutions of various water activities[J]. Journal of Food Science,1991,56:1741−1743. doi: 10.1111/j.1365-2621.1991.tb08684.x
[40] LIU S, XU J, XIE L, et al. Dry inoculation methods for nonfat milk powder[J]. Journal of Dairy Science,2018,102(1):77−86.
[41] BIANCHINI A, STRATTON J, WEIER S, et al. Use of Enterococcus faecium as a surrogate for Salmonella enterica during extrusion of a balanced carbohydrate-protein meal[J]. Journal of Food Protection,2014,77:75−82. doi: 10.4315/0362-028X.JFP-13-220
[42] CHEN L, WEI X, IRMAK S, et al. Inactivation of Salmonella enterica and Enterococcus faecium NRRL B-2354 in cumin seeds by radiofrequency heating[J]. Food Control,2019,103:59−69. doi: 10.1016/j.foodcont.2019.04.004
[43] SYAMALADEVI R M, TANG J, ZHONG Q P. Water diffusion from a bacterial cell in low-moisture foods[J]. Journal of Food Science,2016,81(9):R2129−R34.
[44] YANG R, GUAN J, SUN S, et al. Understanding water activity change in oil with temperature[J]. Current Research in Food Science,2020,3:158−165. doi: 10.1016/j.crfs.2020.04.001
[45] GIBBARD H F, ROUSSEAU R A, CREEK J L, et al. Liquid-vapor equilibrium of aqueous sodium chloride, from 298 to 373 K and from 1 to 6 mol kg-1, and related properties[J]. Journal of Chemical and Engineering Data,1974,19(3):281−288. doi: 10.1021/je60062a023
[46] GIBBARD H F, CATCHARD G. Liquid-vapor equilibrium of aqueous lithium chloride, from 25 ℃ to 100 ℃ and from 1.0 to 18.5 molal, and related properties[J]. Journal of Chemical and Engineering Data, 1973, 18(3): 293–298 .
[47] LOMAURO C J, BAKSHI A S, LABUZA T P. Evaluation of food moisture sorption isotherm equations part I: Fruit, vegetable and meatproducts[J]. LWT-Food Science and Technology,1985,18(2):111−117.
[48] LOMAURO C J, BAKSHI A S, LABUZA T P. Evaluation of food moisture sorption isotherm equations part II: Milk, coffee, tea, nuts, oilseeds, spices and starchy foods[J]. LWT-Food Science and Technology,1985,18(2):118−124.
[49] QUIRIJNS E J, BOXTEL A J V, LOON W K V, et al. Sorption isotherms GAB parameters and isosteric heat of sorption[J]. Journal of the Science of Food and Agriculture,2005,85(11):1805−1814.
[50] HOSSAIN M D, BALA B K, HOSSAIN M A, et al. Sorption isotherms and heat of sorption of pineapple[J]. Journal of Food Engineering,2001,48(2):103−107. doi: 10.1016/S0260-8774(00)00132-1
[51] JAMALI A, KOUHIL A M, MOHAMED L A, et al. Sorption isotherms of Chenopodium ambrosioides leaves at three temperatures[J]. Journal of Food Engineering,2006,72(1):77−84. doi: 10.1016/j.jfoodeng.2004.11.021
[52] TADAPANENI R K, YANG R, CARTER B, et al. A new method to determine the water activity and the net isosteric heats of sorption for low moisture foods at elevated temperatures[J]. Food Research International,2017,102:203−212. doi: 10.1016/j.foodres.2017.09.070
[53] LIU S, TANG J, TADAPANENI R K, et al. Exponentially increased thermal resistance of Salmonella and Enterococcus faecium at reduced water activity[J]. Applied and Environmental Microbiology,2018,84(8):AEM.02742−17.
[54] LIU S X, TANG J M, TADAPANENI R K, et al. Exponentially increased thermal resistance of Salmonella spp. and Enterococcus faecium at reduced water activity[J]. Applied and Environmental Microbiology,2018,84:1−12.
[55] XU J, TANG J M, JIN Y Q, et al. High temperature water activity as a key factor influencing survival of Salmonella enteritidis PT 30 in thermal processing[J]. Food Control,2019,98:520−528. doi: 10.1016/j.foodcont.2018.11.054
[56] XIE Y, XU J, YANG R, et al. Moisture content of bacterial cells determines thermal resistance of Salmonella enteritidis PT 30[J]. Applied and Environmental Microbiology, 2021, 87(3):e02194-20.
[57] SMITH D F, HILDEBRANDT I M, CASULLI K E, et al. Modeling the effect of temperature and water activity on the thermal resistance of Salmonella enteritidis PT 30 in wheat flour[J]. Journal of Food Protection,2016,79:2058−2065. doi: 10.4315/0362-028X.JFP-16-155
[58] LIU S, ZHONG Q, SMITH D, et al. Validation of Enterococcus faecium NRRL B2354 as a surrogate for Salmonella in thermal treatment of wheat flour at different water activities[C]//Int Assoc Food Prot Ann Meet. Portland, OR, 2015.
[59] REYES M E P. Thermal inactivation of Salmonella enteritidis PT 30 and Enterococcus faecium in egg powders at different water activities[D]. Pullman: Washington State University, 2019.
[60] TAYLOR B J, QUINN A R, KATAOKA A. Listeria monocytogenes in low-moisture foods and ingredients[J]. Food Control,2019,103:153−160. doi: 10.1016/j.foodcont.2019.04.011





 下载:
下载:






 下载:
下载:
