Effects of Fish Oil Combined with Cisplatin on HEK293 Cells and A549 Cells
-
摘要: 目的:探讨鱼油对顺铂(cis-dichlorodiamineplatinum (Ⅱ),CDDP)抗A549人肺腺癌细胞活性的影响及对CDDP损伤HEK293细胞的保护作用。方法:体外培养A549和HEK293细胞,将细胞分为对照组、CDDP组、鱼油组、鱼油+CDDP组;分别用不同浓度的鱼油对细胞进行预处理,同时建立CDDP组、鱼油+CDDP组CDDP 损伤模型,CCK-8法检测细胞活力,试剂盒测定HEK293细胞中丙二醛(MDA)含量,二还原型谷胱甘肽(GSH)含量,超氧化物歧化酶(SOD)的活力等指标。结果:4~16 mg/L浓度的鱼油能够显著抑制CDDP造成的人胚肾HEK293细胞毒性(P<0.05),其中4 mg/L浓度的鱼油保护效果最佳,且此浓度的鱼油能够显著抑制CDDP(20 mg/L)引起的GSH含量降低以及MDA含量升高(P<0.05)。当鱼油浓度≥32 mg/L时显著增强了CDDP对A549细胞的抑制效果(P<0.05)。结论:一定浓度范围内,鱼油对CDDP致人胚肾细胞HEK293损伤具有一定的保护作用。低浓度鱼油对CDDP 所致A549细胞的抑制作用没有明显的影响,高浓度的鱼油增强了CDDP 的抗癌效果。Abstract: Objective: To explore the effect of fish oil on the activity of cis-dichlorodiamineplatinum (Ⅱ) (CDDP) against A549 human lung adenocarcinoma cells and its protective effect on HEK293 cells damaged by CDDP. Methods: A549 and HEK293 cells were cultured in vitro, and the cells were divided into control group, CDDP group, fish oil group, fish oil+CDDP group; the cells were pretreated with different concentrations of fish oil, and CDDP injury models of CDDP group and fish oil+CDDP group were established at the same time. Cell viability was detected by CCK-8 method, and the kits were used to measure malondialdehyde (MDA) content, direduced glutathione (GSH) content, and superoxide dismutase (SOD) activity in HEK293 cells. Results: Fish oil at a concentration of 4~16 mg/L could significantly inhibit the cytotoxicity of HEK293 cells caused by CDDP (P<0.05). Fish oil at a concentration of 4 mg/L had the best protective effect, and fish oil at this concentration could significantly inhibit CDDP (20 mg/L) decreased GSH content and increased MDA content (P<0.05). When the fish oil concentration was ≥32 mg/L, the inhibitory effect of CDDP on A549 cells was significantly enhanced (P<0.05). Conclusion: Within a certain concentration range, fish oil has a certain protective effect on CDDP-induced damage to HEK293 of human embryonic kidney cells. Low-concentration fish oil has no obvious effect on the inhibitory effect of CDDP-induced A549 cells, and high-concentration fish oil enhances the anti-cancer effect of CDDP.
-
Keywords:
- fish oil /
- cisplatin /
- nephrotoxicity /
- anti-oxidant /
- antitumor
-
顺铂(cis-dichlorodiamineplatinum (Ⅱ),CDDP)在1978 年被美国食品药品监督管理局批准用于临床,是目前临床上常用的强效抗癌药,常作为治疗头颈部癌、睾丸癌、卵巢癌、乳腺癌、甲状腺癌、肺癌、胃癌、食道癌和骨肉瘤的首选药[1-6],具有极其显著的抗癌效果。CDDP 进入细胞后,细胞中的低氯离子可促进顺铂水解,形成水合顺铂[7],该物质活性很高,容易与DNA发生加成反应,引发交叉联结,进而破坏DNA的结构功能,同时导致细胞凋亡[8]。此外,CDDP中的Pt2+离子,易与细胞中酶、蛋白质中的巯基(-SH)相结合,从而使酶和蛋白质失活,进而导致细胞或人体组织损伤[9]。有报道称,每24 h就有65%~98%的CDDP与血液中蛋白结合,造成了许多毒副作用,其中为剂量限制性的肾毒性是最常见及最严重的毒副反应[10]。CDDP进入细胞后需经肾脏排出体外,长时间的蓄积在肾脏中,最终对肾小管以及肾脏造成不可逆的损伤[11]。众多的研究也证明CDDP对肾小管上皮细胞具有显著的毒性作用[12-13],连燕娜等[5]的研究也证明CDDP对人胚肾细胞HEK293细胞有明显的毒性作用。本课题组之前的研究结果显示,线粒体损伤和氧化应激是CDDP导致肾毒性的原因之一[14],而CDDP可直接损伤线粒体并且其中所含有的亲核氨基也能与水分子结合,形成大量自由基,从而造成线粒体损伤,最终导致细胞凋亡[15]。CDDP肾毒性包括可逆的急性肾功能损伤和不可逆慢性肾功能衰竭[16],许多患者为此痛苦不堪。因此,减轻CDDP肾毒性迫在眉睫。
鱼油是鱼体内全部油脂类物质的总称,富含二十二碳六烯酸(docosahexaenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA)等长链多不饱和脂肪酸。大量研究证明,DHA和EPA具有预防心脑血管疾病、调节血脂、促进大脑神经系统发育,预防老年痴呆、保护视力、抗抑郁、降血脂、抗衰老[17-23]等一系列功效。也有资料显示,EPA和DHA还有增加化疗疗效,减低耐药作用。除此之外,鱼油中的ω-3多不饱和脂肪酸可调控机体的免疫功能及炎症反应,并在体内氧化供能[24]。Barbosa等[25]研究表明,溃疡性结肠炎病人在每天补充4.5 g鱼油后,可使血浆氧化应激状态有所好转;白冬[26]发现持续摄入鲣鱼鱼油42 d后,D-半乳糖小鼠体内MDA含量明显降低、GSH、SOD等抗氧化酶的活性升高;Cazzola等[27]认为老年男性每天补充高剂量EPA (1.35、2.7 g或4.05 g)有发生脂质过氧化的危险;此外,也有研究学者[28-29]提出补充鱼油对机体抗氧化能力无任何影响。
目前,鱼油对CDDP所致的肾毒性及对CDDP的抗癌作用的影响均未见报道,且鱼油在抗肿瘤方面鲜少有人研究。因此,本研究采取体外培养细胞的方法研究探讨了鱼油对CDDP 所致人胚肾细胞HEK293细胞损伤的保护作用及机制,并对CDDP杀伤人肺腺癌细胞A549 的影响进行了研究,为其提高CDDP的化疗效果及临床应用提供实验依据,并为化疗过程中鱼油类辅助品的研发提供参考。
1. 材料与方法
1.1 材料与仪器
人肺腺癌细胞(A549)和人胚肾细胞(HEK293) 均购自中国医学科学院基础医学研究所北京协和医学院基础学院细胞中心;无菌生理盐水溶解的CDDP注射用粉剂 购自齐鲁制药公司;鱼油软胶囊,规格:每粒1500 mg(提供900 mg总ω-3脂肪酸;540 mg EPA、360 mg DHA和其他不饱和脂肪酸) 美国GNC公司生产;胎牛血清 购自美国Hyclone 公司;DMEM-H和DMEM/F12(1:1)培养基、0.25%胰酶、含有100 μg/mL链霉素和100 U/mL青霉素的双抗 均购自北京鼎国昌盛生物技术有限公司;CCK-8(cell counting kit-8,CCK-8)毒性检测试剂盒 购自美国Sigma 公司;BCA蛋白浓度测定试剂盒 北京鼎国昌盛生物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)测定试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
TE2000-M倒置显微镜 日本Nikon公司;MQX-200微孔板分光光度计 美国Bio-Tek公司;WFZ UV-4802H紫外-可见分光光度计 上海尤尼柯仪器有限公司;3K15台式高速冷冻离心机 德国Sigma公司。
1.2 实验方法
1.2.1 细胞培养
在37 ℃,CO2体积分数为5%,饱和湿度的孵育培养箱中,HEK293细胞和A549细胞分别用含15%和10%胎牛血清的DMEM-H和DMEM/F12(1:1)培养基(均含1%的双抗)培养,待细胞汇合度至80%~90%时,用胰酶消化,按1:3比例进行传代,每隔1 d换1次培养基,每2~3 d传代1次,取对数生长期细胞进行下一步实验[4-6,13,16]。
1.2.2 CCK-8法检测细胞活力
1.2.2.1 CCK-8法检测CDDP对HEK293细胞和A549细胞的毒性
将100 μL浓度为1×105个/mL的细胞接种到96 孔板中,待细胞生长到汇合状态,弃去原培养基,加入100 μL含不同终浓度CDDP的培养基。处理A549 细胞时,CDDP终浓度分别为0、5、10、15、20、25和30 mg/L;处理HEK293细胞时,CDDP终浓度分别为0、1、2、4、8、16、32、64和128 mg/L,每组设6个平行孔,置于培养箱中孵育24 h,之后每孔加入100 μL含10% CCK-8的培养基,继续孵育4 h,并在450 nm处检测吸光度(OD450)值,按下式计算细胞存活率[4-6,13,16]:
细胞存活率(%)=OD450实验组OD450对照组×100 细胞抑制率(%)=1−细胞存活率 CDDP诱导两种细胞损伤模型的最佳使用浓度由CDDP对HEK293细胞及A549细胞的半数抑制浓度(IC50)确定。
1.2.2.2 CCK-8法检测鱼油对HEK293细胞和A549细胞存活率的影响
处理计算方法同1.2.2.1,A549细胞中鱼油终浓度为0、0.5、1、2、4、8、16、32 mg/L,HEK293细胞中鱼油终浓度分别为0、0.5、1、2、3、4、8、16、32、64、128 mg/L[4-6,13,16]。
1.2.2.3 CCK-8法检测鱼油对CDDP 致HEK293细胞和A549细胞损伤的影响
将处于对数生长期的细胞按1×105个/mL 接种到96 孔板中,待细胞生长至汇合状态时,进行加药处理。试验分3组:a.对照组,未加入CDDP和鱼油;b.CDDP组(CDDP终浓度为20 mg/L);c.鱼油+CDDP组,提前4 h加入不同浓度鱼油(HEK293细胞鱼油浓度分别为1、2、4、8、16、32、64 mg/L;A549 细胞鱼油浓度分别为2、4、8、16、24、32、40、48 mg/L)。孵育细胞之后加入CDDP(HKE293细胞为20 mg/L;A549细胞为10 mg/L)。每组设6个复孔,在37 ℃,含5%的CO2培养箱中培养24 h,并按照1.2.2.1所述方法检测细胞存活率[4-6,13,16]。
1.2.3 鱼油对HEK293细胞蛋白浓度及细胞内MDA、SOD、GSH含量的影响
将细胞分为4组:a.正常对照组(不对细胞做任何其他处理);b.鱼油组(加入4 mg/L鱼油);c.CDDP模型组(加入20 mg/L CDDP);d.鱼油+CDDP联合处理组(加入4 mg/L鱼油和20 mg/L CDDP)。将1×105个/mL细胞接种到96孔板中,待细胞生长至融合状态时,分别加药处理。继续培养24 h后弃培养液,用PBS洗1遍后每孔再加入300 μL PBS,细胞刮收集细胞于离心管中并放入冰水浴,之后用细胞破碎仪破碎细胞30 s(30 Hz);12000 r/min离心10 min,收集上清液,并按照试剂盒说明书进行细胞蛋白浓度和SOD活力以及GSH、MDA的含量测定[4-6,13,16]。
1.3 数据处理
使用SPSS22.0进行数据统计分析,结果以平均值±标准差(
ˉx ±s)表示,多组间数据比较采用独立样本t检验进行分析,以α=0.05为检验水准。用Origin9.1软件作图。2. 结果与分析
2.1 鱼油对CDDP所致HEK293细胞损伤的保护作用
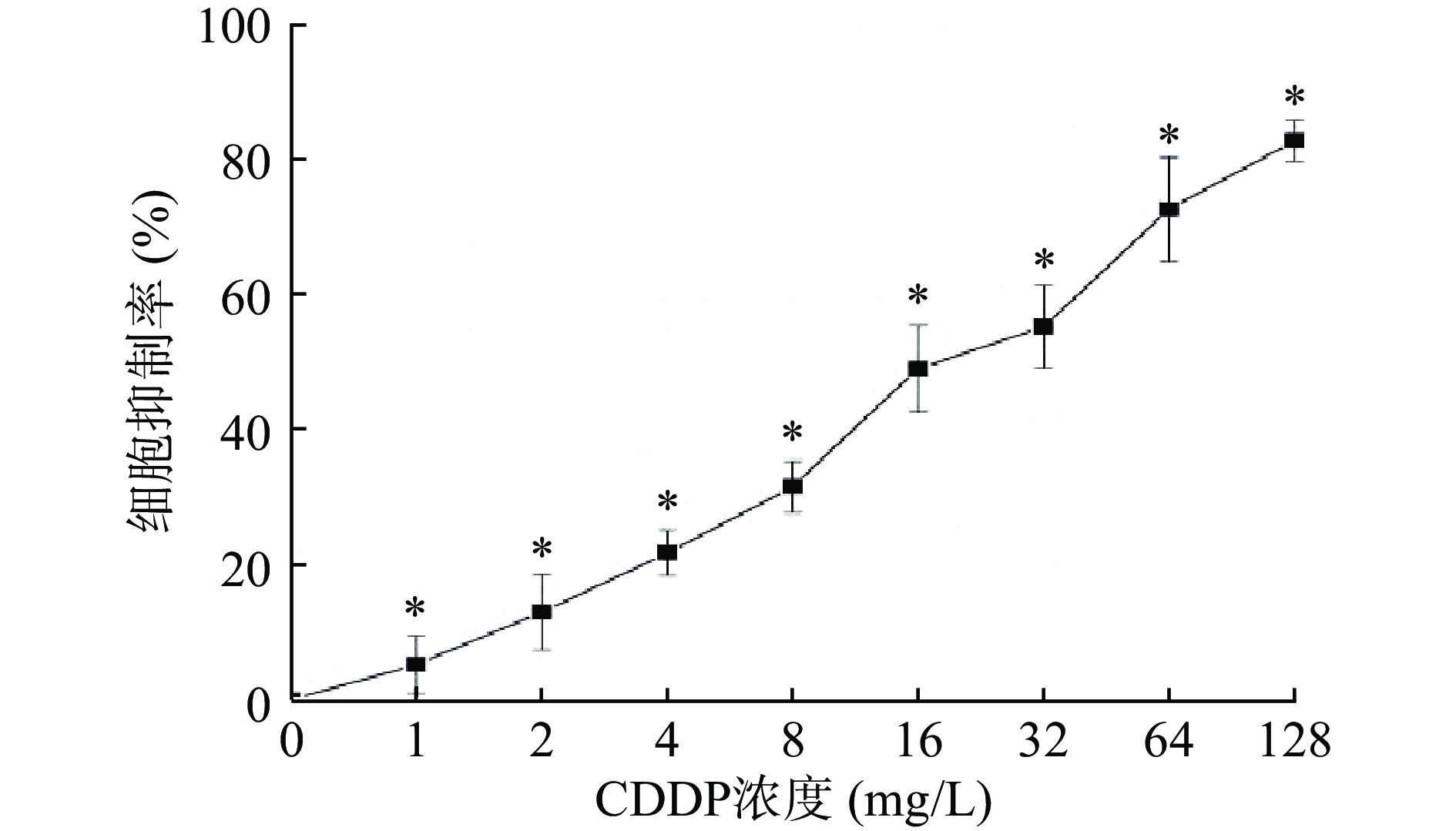
2.1.1 CDDP对HEK293细胞的毒性作用
如图1所示,不同浓度的CDDP作用于HEK293细胞24 h后,对细胞生长有不同程度地抑制作用。随着浓度的升高,CDDP对HEK293细胞存活率的抑制作用逐渐增强,且呈剂量依赖效应。当浓度为128 mg/L时,CDDP对HEK293细胞的抑制率达到最高,为82.0%±4.0%。CDDP对HEK293细胞的IC50为20.058 mg/L,故选用20 mg/L的CDDP建立CDDP损伤HEK293细胞模型。
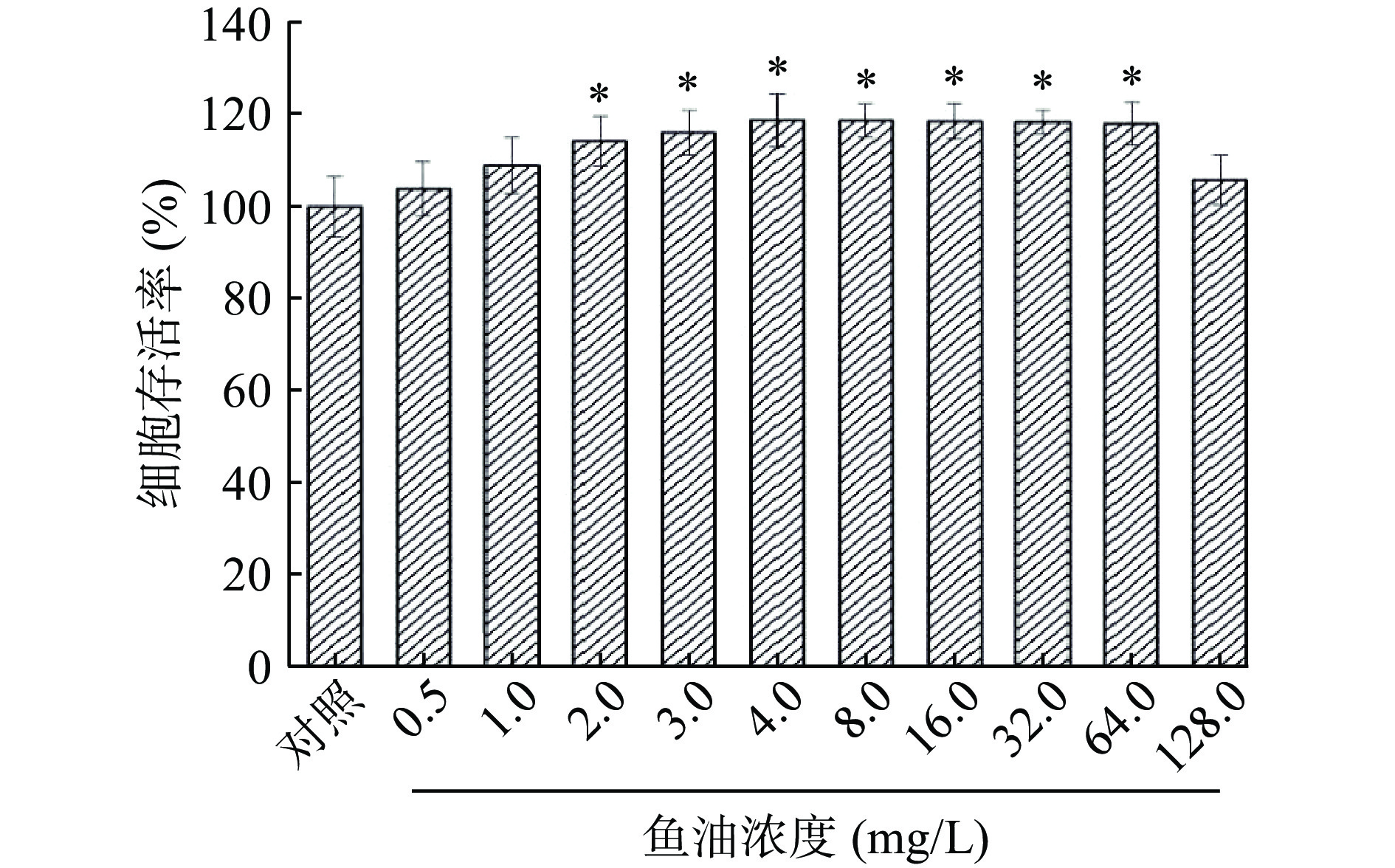
2.1.2 鱼油对HEK293细胞存活率的影响
由图2可知,不同浓度的鱼油作用于HEK293细胞24 h后,随着鱼油浓度的升高,细胞相对活力不断上升。当鱼油浓度为4 mg/L时,HEK293细胞的存活率达到最高,与对照组(0.0 mg/L)相比具有统计学意义(P<0.05)。随着鱼油浓度的升高,HEK293细胞存活率逐渐降低,当鱼油浓度达到128 mg/L时,HEK293细胞存活率与对照组相比无显著性差异。即一定浓度范围内的鱼油可使HEK293细胞增殖。
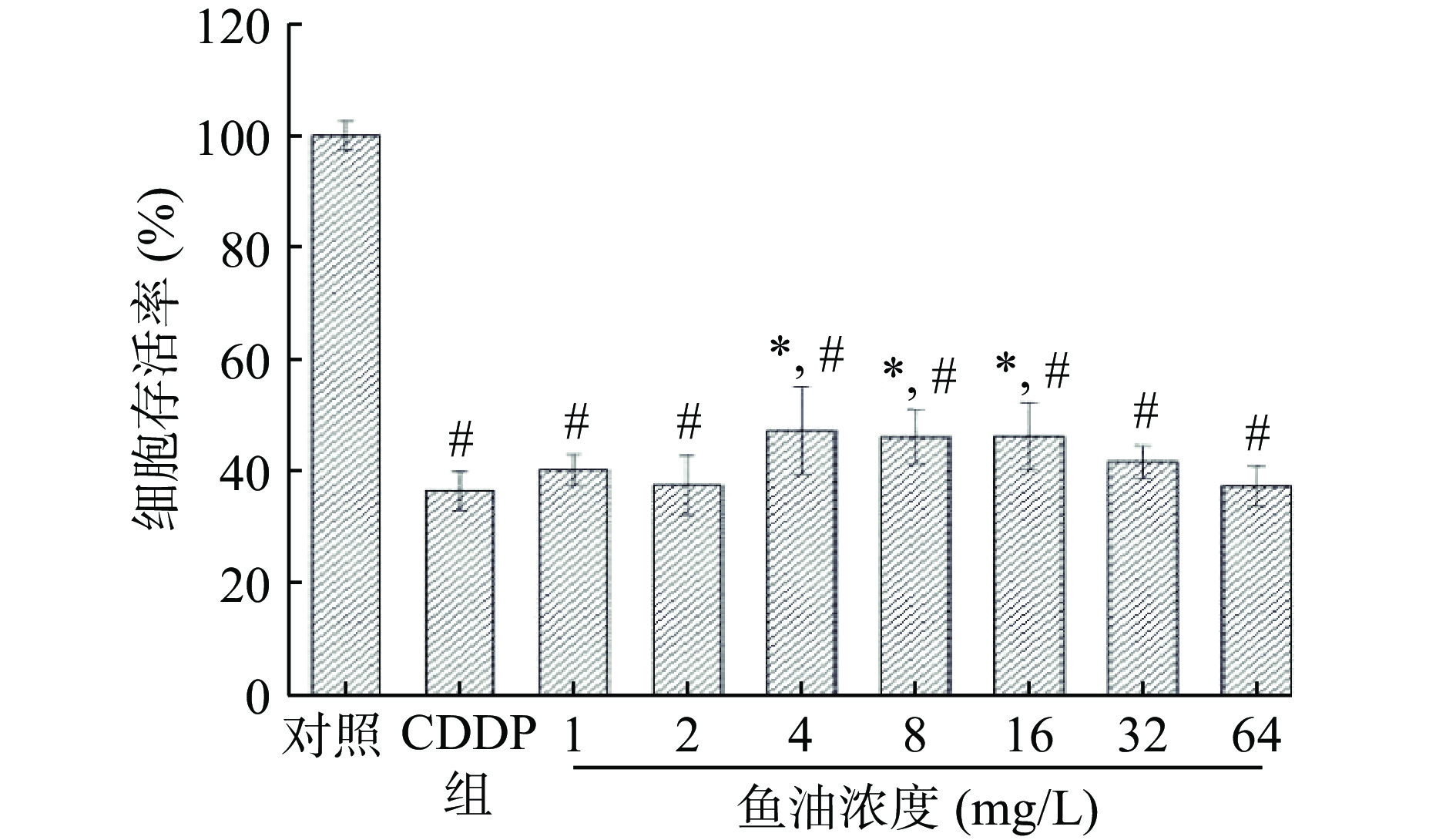
2.1.3 鱼油对CDDP所致HEK293 细胞损伤的保护作用
不同浓度鱼油对CDDP 致HEK293 细胞损伤的影响见图3。与对照组相比,CDDP模型组细胞存活率显著降低。当鱼油浓度小于4 mg/L时,鱼油对CDDP所致HEK293细胞的损伤无显著影响;当鱼油浓度在4~16 mg/L时,HEK293细胞活力显著高于CDDP组(P<0.05),提示在一定浓度范围内,鱼油对CDDP损伤的HEK293细胞具有保护作用。当鱼油浓度为4 mg/L时,HEK293细胞的存活率达到最高,因此,选用此浓度的鱼油对CDDP致HEK293细胞损伤影响进行下一步试验。
![]() 图 3 不同浓度鱼油对CDDP诱导HEK293细胞损伤的影响(n=6)注:与对照组相比,#表示P<0.05;与CDDP 模型组相比,*表示P<0.05;图6同。Figure 3. The effect of different concentrations of fish oil on the damage of HEK293 cells induced by CDDP (n=6)
图 3 不同浓度鱼油对CDDP诱导HEK293细胞损伤的影响(n=6)注:与对照组相比,#表示P<0.05;与CDDP 模型组相比,*表示P<0.05;图6同。Figure 3. The effect of different concentrations of fish oil on the damage of HEK293 cells induced by CDDP (n=6)2.1.4 鱼油对CDDP损伤HEK293细胞内SOD活力、GSH和MDA含量的影响
由表1可知,与对照组相比,鱼油组SOD活力显著增加(P<0.05),GSH、MDA含量与对照组无显著性差异;CDDP单独作用HEK293细胞时,SOD活力和GSH含量显著降低(P<0.05),MDA含量显著增高(P<0.05),提示CDDP可使HEK293细胞内脂质过氧化程度增加,抗氧化水平降低;鱼油+CDDP组与CDDP组相比GSH含量显著增加(P<0.05),MDA含量显著降低(P<0.05),提示一定浓度的鱼油可以拮抗CDDP所致HEK293 细胞内抗氧化指标的改变。
表 1 鱼油和顺铂联合用药对HEK293 细胞内抗氧化指标的影响Table 1. The effect of the combination of fish oil and cisplatin on the anti-oxidation indexes in HEK293 cells组别 SOD活力
(U/mg pro)GSH含量
(μmol/g pro)MDA含量
(μmol/g pro)对照组 45.94±1.21b 72.89±2.39a 1.03±0.02c CDDP组 36.38±2.44c 45.98±1.11c 1.54±0.04a 鱼油组 52.20±4.53a 76.11±4.52a 0.90±0.01c 鱼油+CDDP组 37.05±0.98c 56.43±3.24b 1.26±0.01b 注:同列上标小写字母不同表示有统计学差异(P<0.05)。 2.2 鱼油和CDDP对A549细胞的影响
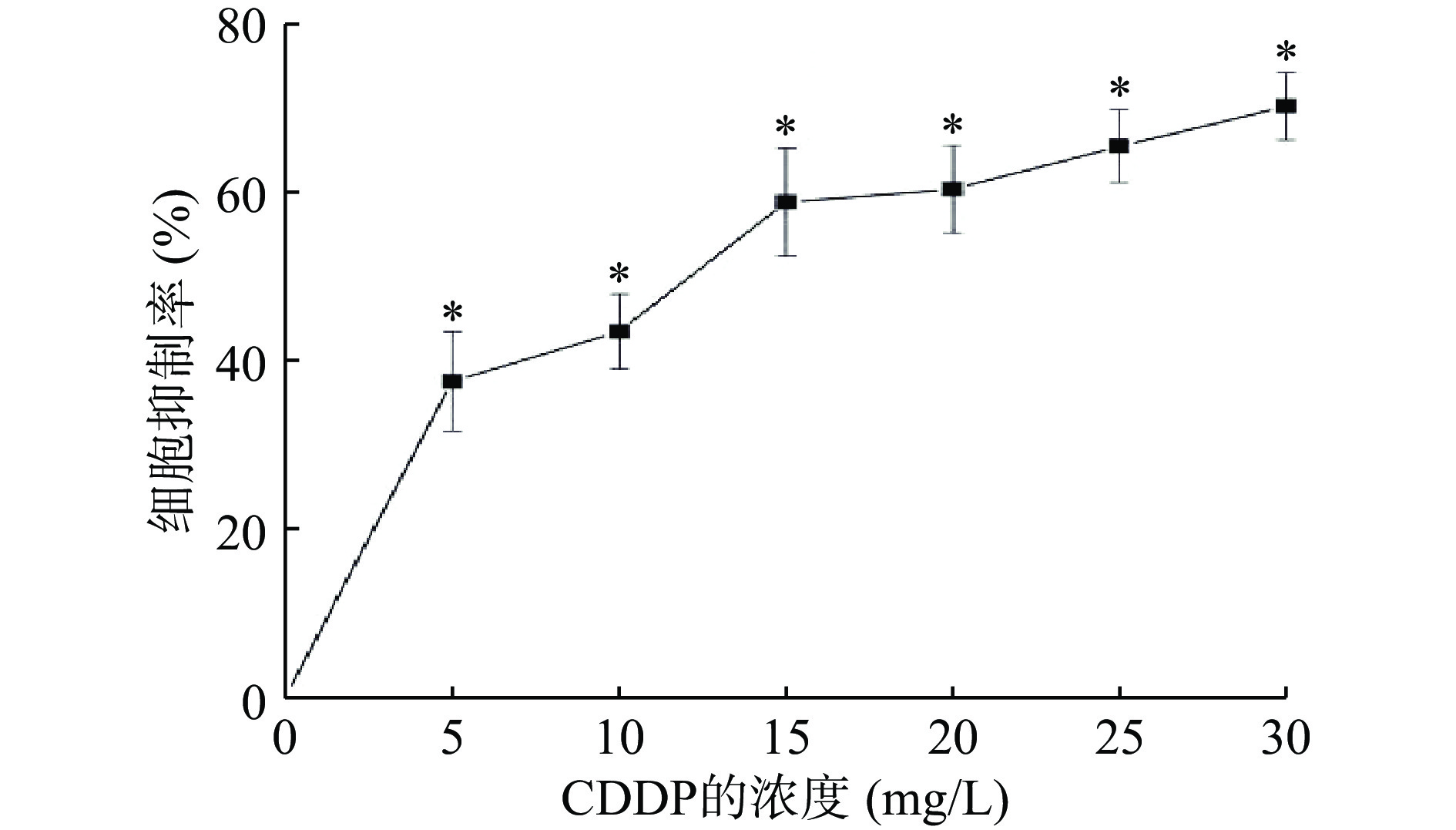
2.2.1 CDDP对A549细胞的抑制作用
如图4 所示,随着浓度的升高,CDDP对A549细胞生存抑制率逐渐增高。当CDDP浓度为30 mg/L时,抑制率达到最高为70.0%±4.0%。CDDP对A549的IC50为10.685 mg/L,因此选择10 mg/L浓度的CDDP作为建立细胞损伤模型的浓度。
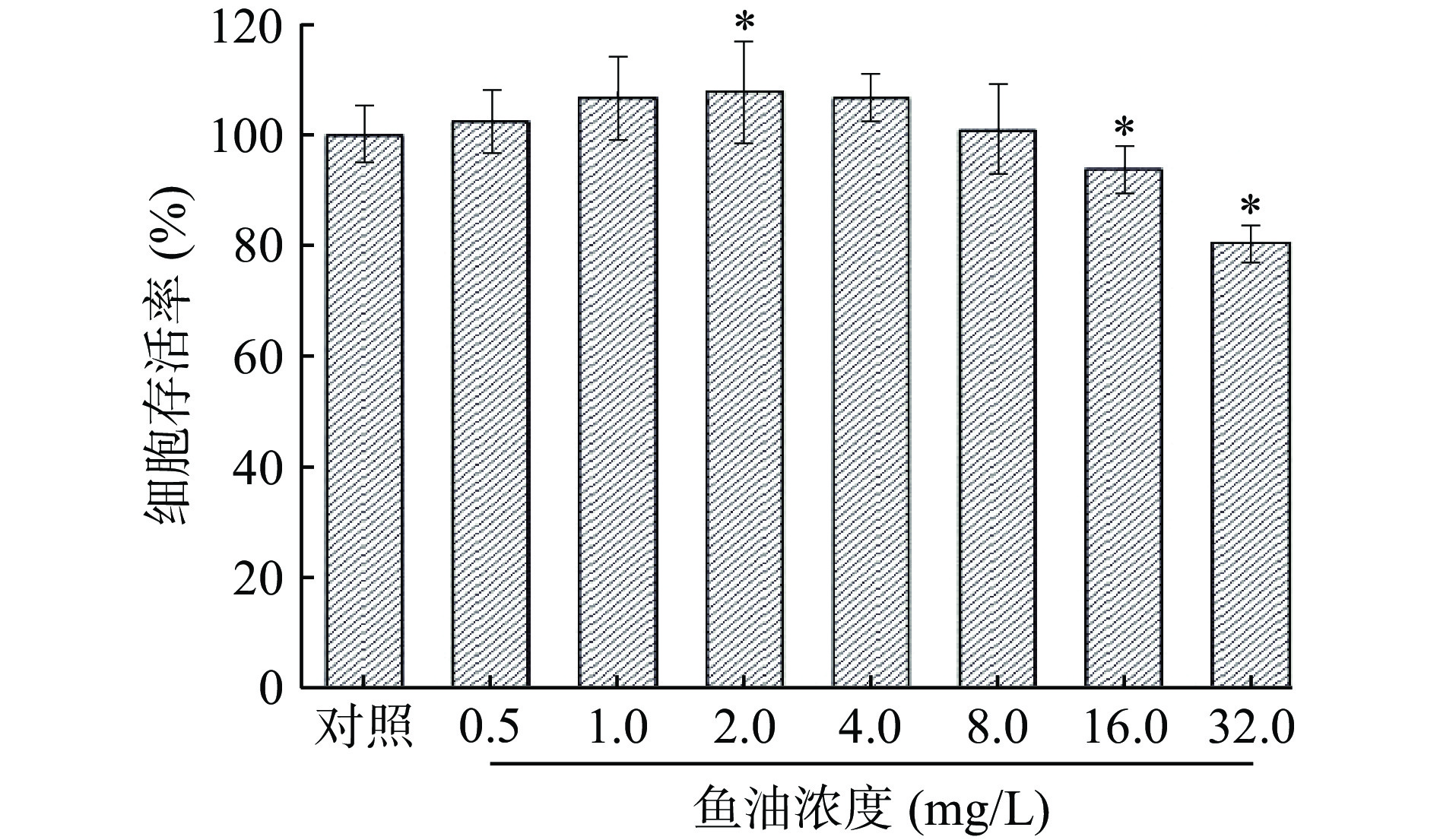
2.2.2 鱼油对A549细胞的抑制作用
由图5可知,当鱼油浓度为2 mg/L时,细胞存活率显著增加,但此时无浓度效应关系。当浓度小于8 mg/L时,鱼油对A549细胞存活率的影响与对照组性比无显著性差异,随着鱼油浓度的增大,细胞存活率逐渐降低,且当鱼油浓度大于16 mg/L时,鱼油对A549细胞有显著的抑制作用(P<0.05),说明鱼油对A549细胞的抑制作用与鱼油浓度存在浓度效应关系。
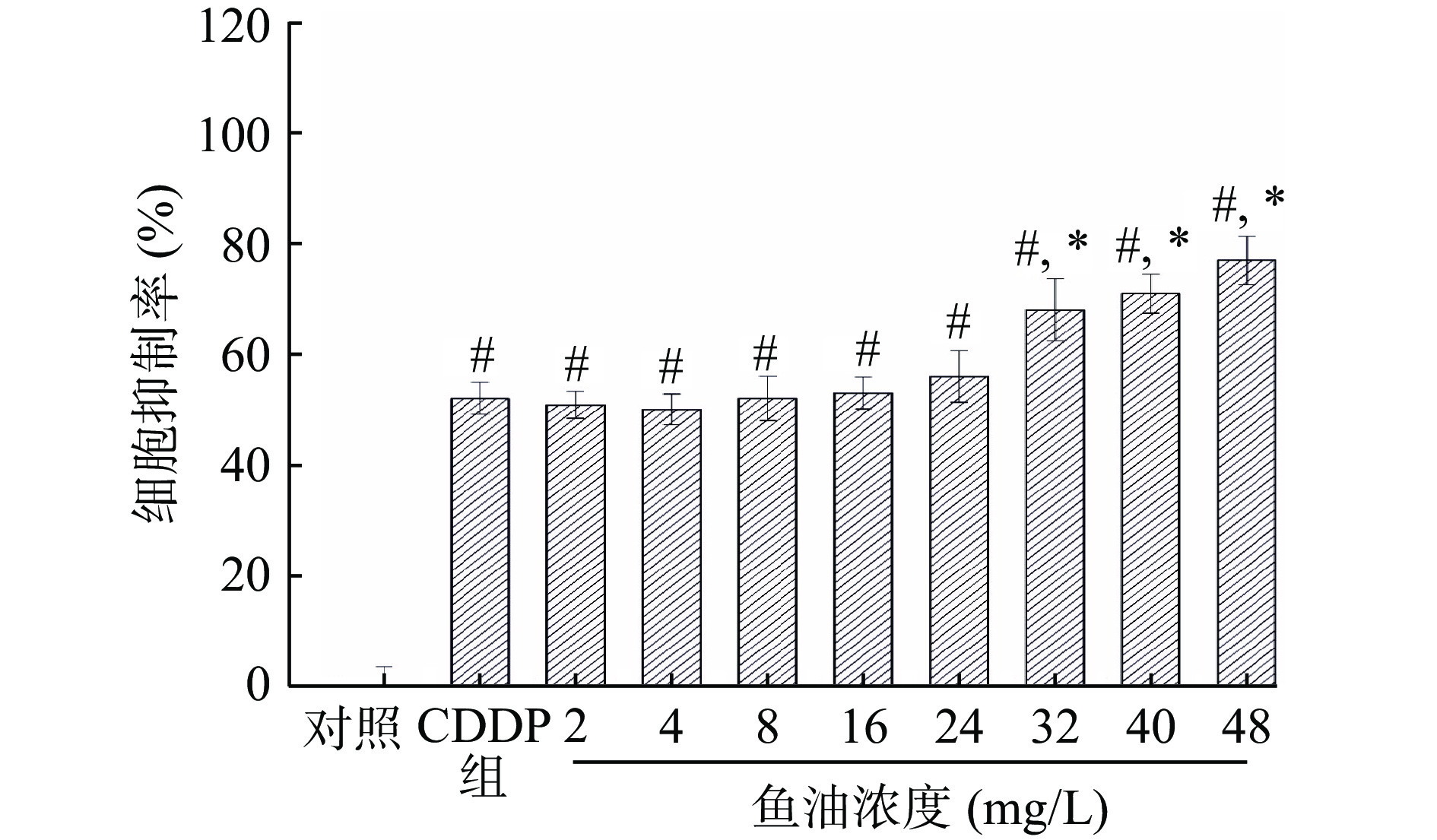
2.2.3 鱼油联合CDDP对A549细胞的影响
如图6所示,与对照组相比,模型组的细胞抑制率显著增加(P<0.05)。与CDDP模型组比,当鱼油浓度小于32 mg/L时无统计学意义(P>0.05);当鱼油浓度为32 mg/L时,A549细胞的抑制率显著高于CDDP模型组(P<0.05),且随着鱼油浓度的增大,A549 细胞的抑制率逐渐增高。提示高浓度的鱼油可增强CDDP 杀伤A549细胞的效果。本实验结果显示当CDDP浓度为20 mg/L时,会导致50%的HEK293死亡,同时可显著抑制A549细胞增殖。
3. 讨论与结论
有报道称,鱼油可抑制激活型Caspase-3活性,减少活性氧(reactiveoxygen species,ROS)的生成,同时合成大量抗氧化酶参与氧自由基的清除,使氧化应激导致的细胞凋亡明显减少[29-30],修复局部受损伤的组织。赵艳凤[31]发现鱼油能够明显改善恶病质小鼠的一般状态,增加体重,改善其营养指标并降低血脂,从而达到抗癌性恶病质效果。但鱼油对CDDP抗肿瘤活性的影响尚未见报道,本实验研究结果表明,当鱼油大于32 mg/L时可增强CDDP杀伤人肺腺癌细胞A549细胞的效果,且随着鱼油浓度的增加,抑制效果逐渐增强。
CDDP肾毒性主要原因是氧化应激[6]。使用CDDP化疗时,其肾脏中线粒体和细胞膜功能失调是由于CDDP产生大量脂质过氧化产物和氧自由基,从而造成肾毒性[25]。本课题组前期的研究也表明HEK293细胞的自身清除自由基的能力明显不及CDDP诱发产生自由基的能力,会造成生物体肾脏的氧化损伤[32]。脂质过氧化反应会产生一种重要代谢产物—MDA,其含量增加会破坏细胞膜的结构。细胞中GSH合成量增加提示机体内存在着抵抗化学损伤的保护机制,其含量的减少或合成能力降低都会使细胞对某些特定的药物变得异常敏感[33-34]。GSH活力的高低可体现机体清除氧自由基的能力,MDA的高低可反映细胞内脂质过氧化程度和细胞受自由基攻击的严重程度。Aziroglu等[35]研究表明CDDP对肾脏中GSH-Px、SOD和CAT等抗氧化酶系统具有抑制作用。本研究结果表明,CDDP模型组GSH含量和SOD活力明显低于对照组,MDA的含量明显高于对照组,提示HEK293细胞抗氧化系统的自由基清除能力显著低于CDDP诱发产生的自由基,最终导致细胞氧化损伤;CDDP+鱼油组细胞内MDA含量明显低于CDDP组,GSH含量明显高于CDDP组,提示鱼油能够清除超氧化物阴离子等自由基,抑制了CDDP引起的GSH耗竭,减少脂质过氧化反应,拮抗CDDP诱发的HEK293细胞氧化损伤。
综上所述,鱼油能够在一定质量浓度范围提高HEK293细胞存活率,拮抗CDDP所致GSH含量降低、MDA含量升高,提示适当剂量的鱼油对CDDP损伤HEK293细胞具有保护作用,其机制可能是鱼油抑制了CDDP引起的GSH耗竭,从而抑制了CDDP引起的HEK293细胞损伤,提高了细胞的生存率。低浓度鱼油对CDDP所致A549细胞的抑制作用没有明显的影响,高浓度的鱼油增强了CDDP的抗癌效果。由于本研究主要的实验方法和手段为细胞活性检测和氧化应激相关指标检测,因此有关鱼油确切的作用机制还有待进一步研究,比如后期进行细胞周期及周期蛋白检测,细胞凋亡及凋亡蛋白等其他相关指标的检测等。
-
图 3 不同浓度鱼油对CDDP诱导HEK293细胞损伤的影响(n=6)
注:与对照组相比,#表示P<0.05;与CDDP 模型组相比,*表示P<0.05;图6同。
Figure 3. The effect of different concentrations of fish oil on the damage of HEK293 cells induced by CDDP (n=6)
表 1 鱼油和顺铂联合用药对HEK293 细胞内抗氧化指标的影响
Table 1 The effect of the combination of fish oil and cisplatin on the anti-oxidation indexes in HEK293 cells
组别 SOD活力
(U/mg pro)GSH含量
(μmol/g pro)MDA含量
(μmol/g pro)对照组 45.94±1.21b 72.89±2.39a 1.03±0.02c CDDP组 36.38±2.44c 45.98±1.11c 1.54±0.04a 鱼油组 52.20±4.53a 76.11±4.52a 0.90±0.01c 鱼油+CDDP组 37.05±0.98c 56.43±3.24b 1.26±0.01b 注:同列上标小写字母不同表示有统计学差异(P<0.05)。 -
[1] VICTORIA C, MIGUEL A F, JOSEFINA C, et al. Biochemical mechanisms of cisplatin cytotoxicity[J]. Anti-Cancer Agents in Medicinal Chemistry,2007,7(1):3−18. doi: 10.2174/187152007779314044
[2] SZTURZ P, CRISTINA V, RGH G, et al. Cisplatin eligibility issues and alternative regimens in locoregionally advanced head and neck cancer: Recommendations for clinical practice[J]. Frontiers in Oncology,2019,9(4):464−78.
[3] SERŠA G, ŠTABUC B, ČEMAŽAR M, et al. Electrochemotherapy with cisplatin: Clinical experience in malignant melanoma patients[J]. Clinical Cancer Research,2000,6(3):863−867.
[4] 韩何丹, 杜月梅, 高丽萍, 等. 枸杞多糖联合顺铂对人肺腺癌细胞A549氧化损伤及凋亡的影响[J]. 食品科学,2020,41(15):194−200. [HAN H D, DU Y M, GAO L P, et al. Effects of Lycium barbarum polysaccharide combined with cisplatin on oxidative damage and apoptosis of human lung adenocarcinoma cell A549[J]. Food Science,2020,41(15):194−200. [5] 连燕娜, 高丽萍, 郭豫, 等. 低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响[J]. 食品科学,2016,37(7):182−186. [LIAN Y N, GAO L P, GUO Y, et al. Effects of low-poly grape seed anthocyanins on cisplatin damage HEK293 cells and anti-cancer activity[J]. Food Science,2016,37(7):182−186. doi: 10.7506/spkx1002-6630-201607033 [6] 王海, 连燕娜, 高丽萍, 等. 低聚葡萄籽原花青素联合顺铂对人肺腺癌细胞A549凋亡的影响[J]. 食品科学,2017,38(19):177−181. [WANG H, LIAN Y N, GAO L P, et al. Low-poly grape seed anthocyanins combined with cisplatin on the apoptosis of human lung adenoplasty cancer cells A549[J]. Food Science,2017,38(19):177−181. doi: 10.7506/spkx1002-6630-201719028 [7] BAGCHI D, BAGCHI M, STOHS S, et al. Cellular protection with proanthocyanidins derived from grape seeds[J]. Annals of the New York Academy of Sciences,2002,957:260−270. doi: 10.1111/j.1749-6632.2002.tb02922.x
[8] SUGANUMA M, SAHA A, FUJIKI H. New cancer treatment strategy using combination of green tea catechins and anticancer drugs[J]. Cancer Science,2011,102(2):317−323. doi: 10.1111/j.1349-7006.2010.01805.x
[9] WELKOBORSKY H J, BLEIER R, SIEGER W I. Antineoplastic effectiveness and unwanted side effects of polychemotherapy of extensive oro-and hypopharyngeal cancers-results of a prospective therapy study with 5-FU/cisplatin versus 5-FU/carboplatin[J]. Laryngorhinootologie,1992,71(5):261−266. doi: 10.1055/s-2007-997292
[10] 曲永亮. 杜鹃素对顺铂诱导小鼠肾小管上皮细胞损伤的保护作用的研究[D]. 长春: 吉林大学, 2020. QU Y L. Study on the protective effect of azaleas on epithyroid cell damage in the renal tube in mice induced by cisplatin[D]. Changchun: Jilin University, 2020.
[11] LIEBERTHAL W, TRIACA V, LERINE J, et al. Mechanism of death induced by cisplatin in proximal tubular epithelial cells: Apoptosis vs necrosis[J]. Am J Physiol Renal Physiol,1996,270:700−708. doi: 10.1152/ajprenal.1996.270.4.F700
[12] 闫长会. 铂类抗肿瘤药体外肾毒性的比较研究[D]. 北京: 中国人民解放军军事医学科学院, 2004 YAN C H. Acomparative study of in-body nephrotoxicity of platinum anti-tumor drugs[D]. Beijing: Chinese Platmin Platary School of Military Medicine, 2004.
[13] 赵艳萌, 赵江燕, 高丽萍. 葡萄籽原花青素对顺铂所致大鼠肾脏氧化损伤和线粒体损伤的防护作用[J]. 现代食品科技,2015,31(1):6−10. [ZHAO Y M, ZHAO J Y, GAO L P. The protective effect of grape seed anthophylactin on renal oxidation damage and mitochondrial damage in rats caused by cisplatin[J]. Modern Food Technology,2015,31(1):6−10. doi: 10.13982/j.mfst.1673-9078.2015.1.002 [14] TOHAMY A A, EL-GHOR A A, EL-NAHAS S M, et al. β-Glucan inhibits the genotoxicity of cyclophosphamide, adriamycin and cisplatin[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2003,541(1-2):45−53.
[15] GERMAN O L, INSUA M F, GENTILI C, et al. Docosahexaenoic acid prevents apoptosis of retina photoreceptors by activating the ERK/MAPK pathway[J]. Journal of Neurochemistry,2010,98(5):1507−1520.
[16] 韩何丹, 王海, 高丽萍. 大蒜素对顺铂肾毒性的保护作用[J]. 癌变•畸变•突变,2018,30(1):20−24. [HAN H D, WANG H, GAO L P. The protective effect of allicin on the nephrotoxicity of cisplatin[J]. Cancer, Distortion, Mutation,2018,30(1):20−24. [17] 孔海军, 黄玲, 王凤华, 等. ω-3多不饱和脂肪酸对运动疲劳大鼠心肌细胞代谢、抗氧化能力及血清IL-4、IL-6、INF-γ的影响[J]. 中国油脂,2017,2(8):63−67. [KONG H J, HUANG L, WANG F H, et al. Omega-3 polyunsaturated fatty acids on the metabolism, antioxidant ability and effects of serum IL-4, IL-6, INF-γ in sports fatigue rats[J]. Chinese Grease,2017,2(8):63−67. doi: 10.3969/j.issn.1003-7969.2017.08.014 [18] QURESHI A W, ALTAMIMY R, FAROOQ M A, et al. Ageing enhances the shedding of splenocyte microvesicles with endothelial pro-senescent effect that is prevented by a short-term intake of omega-3 PUFA EPA: DHA 6: 1[J]. Biochemical Pharmacology,2019:113734.
[19] GUO X F, LI K L, LI J M, et al. Effects of EPA and DHA on blood pressure and inflammatory factors: A meta-analysis of randomized controlled trials[J]. Critical Reviews in Food Science and Nutrition,2019,59(20):3380−3393. doi: 10.1080/10408398.2018.1492901
[20] 滕向龙, 郭景泉, 邹武军. ω-3多不饱和脂肪酸对结直肠癌根治术患者的炎症、营养、免疫功能及预后的影响机制研究[J]. 中国现代医生,2016,54(29):13−16. [TENG X L, GUO J Q, ZOU W J. Study on the mechanisms of inflammation, nutrition, immune function and prognostic effects of polyunsaturated fatty acids on patients with colorectal cancer[J]. Chinese Modern Doctor,2016,54(29):13−16. [21] JANSSEN C I, KILIAAN A J. Long chain polyunsaturated fatty acids (LCPUFA) from genesis to senescence: The influence of LCPUFA on neural development, aging, and neurodegeneration[J]. Progress in Lipid Research,2014,53:1−17. doi: 10.1016/j.plipres.2013.10.002
[22] 张德平, 宋彦泽, 谢祥军, 等. DHA对糖尿病认知障碍大鼠海马神经元SDF-1/CXCR4通路的影响[J]. 神经解剖学杂志,2018,34(2):230−236. [ZHANG D P, SONG Y Z, XIE X J, et al. DHA's effect on the SDF-1/CXCR4 pathfly in diabetic cognitively impaired rats[J]. Journal of Neuroanatomy,2018,34(2):230−236. doi: 10.16557/j.cnki.1000-7547.2018.02.016 [23] 王萍, 张银波, 江木兰. 多不饱和脂肪酸的研究进展[J]. 中国油脂,2008,33(12):42−46. [WANG P, ZHANG Y B, JIANG M L. Advances in the study of polyunsaturated fatty acids[J]. Chinese Grease,2008,33(12):42−46. doi: 10.3321/j.issn:1003-7969.2008.12.011 [24] 郑伟龙. 南极磷虾反式EPA及DHA抗肿瘤作用的研究[D]. 大连: 大连理工大学, 2018 ZHENG W L. Study on the anti-tumor effects of Antarctic krill trans-EPA and DHA[D]. Dalian: Dalian University of Technology, 2018.
[25] BARBOSA D S, CECCHINI R, KADRI M Z E, et al. Decreased oxidative stress in patients with ulcerative colitis supplemented with fish oil w-3 fatty acids[J]. Nutrition,2003,19:837−842. doi: 10.1016/S0899-9007(03)00162-X
[26] 白冬. 深海鲣鱼鱼油提取、精制与抗氧化活性研究[D]. 舟山: 浙江海洋大学, 2018 BAI D. Study on the extraction, refining and antioxidant activity of deep-sea mackerel oil[D]. Zhoushan: Zhejiang Ocean University, 2018.
[27] CAZZOLA R, RUSSO-VOLPE S, MILES E A, et al. Age-and dose-dependent effects of an eicosapentaenoic acid-rich oil on cardiovascular risk factors in healthy male subjects[J]. Atherosclerosis,2007,193:159−167. doi: 10.1016/j.atherosclerosis.2006.06.008
[28] KOOSHKI A, TALEBAN FA, TABIBI H, et al. Effects of marine omega-3 fatty acids on serum systemic and vascular inflammation markers and oxidative stress in hemodialysis patients[J]. Annals of Nutrition and Metabolism,2011,58:197−202. doi: 10.1159/000329727
[29] HAYATI F, HOSSAINZADEH M, SHAYANPOUR S, et al. Prevention of cisplatin nephrotoxicity[J]. JNephropharmacol,2016,5(1):57−60.
[30] 王艳, 郑国荣, 高金华, 等. 鱼油对老年Ⅰ期压疮模型大鼠免疫功能、炎症反应及细胞凋亡的影响[J]. 中国医药导报,2013,10(17):10−12. [WANG Y, ZHENG G R, GAO J H, et al. The effects of fish oil on the immune function, inflammatory response and apoptosis of older I period pressure sore model rats[J]. China Medical Guide,2013,10(17):10−12. doi: 10.3969/j.issn.1673-7210.2013.17.004 [31] 赵艳凤. 鱼油治疗癌性恶病质的实验研究[D]. 石家庄: 河北医科大学, 2007 ZHAO Y F. Experimental study of fish oil in the treatment of cancerous and vicious diseases[D]. Shijiazhuang: Hebei Medical University, 2007.
[32] 韩何丹, 王海, 高丽萍, 等. 红景天提取物对顺铂致肾细胞毒性的保护作用[J]. 癌变•畸变•突变,2018,30(3):204−208. [HAN H D, WANG H, GAO L P, et al. Red King's Day extract on the protection of renal cytotoxicity called cisplatin[J]. Cancer, Distortion, Mutation,2018,30(3):204−208. [33] 邓茂先, 吴德生, 陈祥贵, 等. 双酚A雄性生殖毒性的体内外实验研究[J]. 中华预防医学杂志,2004,38(6):383−387. [DENG M X, WU D S, CHEN X G, et al. In vitro experimental study of reproductive toxicity of BPA males[J]. Chinese Journal of Preventive Medicine,2004,38(6):383−387. doi: 10.3760/j:issn:0253-9624.2004.06.006 [34] 逄兵, 吴向东, 任道风, 等. 双酚A对大鼠睾丸Leydin细胞的毒性作用[J]. 卫生毒理学杂志,2000,14(3):173−174. [PANG B, WU X D, REN D F, et al. BPA's toxic effect on testicular Leydin cells in rats[J]. Journal of Health Toxicology,2000,14(3):173−174. [35] ATESSAHIN A, KARAHAN I, TURK G, et al. Protective role of lycopene on cisplatin-induced changes in sperm characteristics, testicular damage and oxidative stress in rats[J]. Reproductive Toxicology,2006,21(1):42−47. doi: 10.1016/j.reprotox.2005.05.003








 下载:
下载:
 下载:
下载:



