Optimization of Fermentation Technology and Evaluation of Regulating Immune Function of Ginseng and Wolfberry Fermentation Liquid
-
摘要: 目的:优化参杞酵素的发酵工艺,并研究参杞酵素对小鼠免疫功能的调节作用。方法:以总酸含量为响应值,以发酵时间、发酵温度、菌种比例、接种量为自变量,通过单因素实验和Box-Behnken试验优化发酵工艺。以80 mg/(kg·d)环磷酰胺诱导小鼠构建免疫低下小鼠模型,分别用低(5.0 mL/kg)、中(10.0 mL/kg)、高(15.0 mL/kg)剂量的试验酵素液免疫调节干预,模型组和正常组灌胃等体积的蒸馏水,测定血清中免疫球蛋白G(Immunoglobulin G,IgG)含量和白细胞介素-4(Interleukin-4,IL-4)、白细胞介素-10(Interleukin-10,IL-10)、干扰素-γ(Interferon-γ,IFN-γ)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)的相对表达量,利用碳廓清法检测小鼠吞噬细胞的吞噬能力及对脏器指数的影响。结果:优化得到发酵工艺为发酵时间72 h,发酵温度37 ℃,接种量5%,菌种比例5:4.5:0.5,总酸含量为1.23 g/100 g。试验酵素可显著(P<0.05)上调免疫抑制小鼠的血清中IFA-γ、TNF-α、IL-4及IgG水平,下调IL-10水平,高剂量的小鼠血清IL-10质量浓度可恢复至72.26 pg/mL,小鼠血清IFN-γ质量浓度达到213.47 pg/mL,TNF-α质量浓度可达246.13 pg/mL,IgG的质量浓度可达119.89 ng/mL,接近或高于正常组,明显增强吞噬细胞的吞噬能力。结论:参杞酵素对小鼠免疫功能具有正向调节作用。Abstract: Objective: To optimize the fermentation process of ginseng and wolfberry fermentation liquid and study its regulating effect on the immune function of mice. Methods: The fermentation process was optimized by single factor test and Box-Behnken test with total acid content as response value and fermentation time, fermentation temperature, strain proportion and inoculum amount as independent variables. The mice were induced with 80 mg/(kg·d) cyclophosphamide to establish an immunocompromised mouse model. The mice were treated with low (5.0 mL/kg), medium (10.0 mL/kg) and high (15.0 mL/kg) doses of experimental fermentation liquid solution, respectively. The contents of immunoglobulin G (IgG), interleukin-4 (IL-4), interleukin-10 (IL-10) and interferon-γ (interferon-γ) in serum were determined. The relative expression levels of IFN-γ and tumor necrosis factor-α (TNF-α) were measured. The phagocytosis ability of mouse phagocytes and its effect on organ index were detected by carbon clearance method. Results: The fermentation process was optimized as follows: Fermentation time 72 h, fermentation temperature 37 ℃, inoculation amount 5%, strain ratio 5:4.5:0.5, total acid content 1.23 g/100 g. The levels of IFA-γ, TNF-α, IL-4 and IgG in the serum of immunosuppressed mice were significantly up-regulated by the fermentation liquid, and the levels of IL-10 were down-regulated. The mass concentration of IL-10 and IFN-γ in the serum of mice with high dose could be restored to 72.26 and 213.47 pg/mL, respectively. The mass concentration of TNF-α and IgG reached 246.13 pg/mL and 119.89 ng/mL, which were close to or higher than those of solvent control group, and significantly enhanced the phagocytic ability of phagocytic cells. Conclusion: The ginseng and wolfberry fermented liquid had a positive regulatory effect on the immune function of mice.
-
人参是五加科人参属植物生长于地下的根及根茎,是全世界最著名的药材之一,在传统医学中已有数千年的应用历史[1],其中5年及5年以下人工种植的人参已于2012年被批准为新资源食品。人参中主要含有人参皂苷、人参多糖、人参蛋白质、人参肽、聚炔醇、生物碱等活性物质,具有增强免疫力、促进智力发育、抗氧化、保护心脑血管及抑制癌细胞增长等功能,对人体健康具有重要的促进作用[2-6]。枸杞子为茄科植物枸杞的成熟果实,作为中药材已有千年的食用历史,已被卫生部批准为药食同源物品。枸杞富含多种营养和生物活性物质,包括多糖类、类胡萝卜素、氨基酸、多酚、脂肪酸、有机酸等[7-9]。具有多种日常保健功能,如缓解视疲劳、腹痛、头晕头痛和干咳等[10]。相关研究表明枸杞多糖具有免疫调节、降血糖和保护神经等作用[11-12]。
食用酵素是以动植物等为原料,经微生物发酵而得的具有特定生物活性成分的可食用的产品,包括固态和液态[13]。酵素产品中含有丰富的多糖类、有机酸、多酚及低聚糖等生物活性物质[14-16]。有关植物酵素的研究表明,植物经微生物发酵后具有调节胃肠道、抗氧化、抗肿瘤、保护胃黏膜等功能,还能促进小鼠淋巴细胞增殖分化提高细胞免疫能力[17-20]。目前酵素的制备过程中发酵时间普遍较长,因此,本研究以人参、枸杞子为原料,优化参杞酵素的发酵工艺并对其免疫调节作用进行了评价,为其合理应用提供理论参考。
1. 材料与方法
1.1 材料与仪器
人参(人工种植)、大枣 樟树市仁德中药饮片有限公司;枸杞子 中宁县杞福源商贸有限公司;燕麦麸皮 张家口新素燕麦食品科技有限公司;低聚异麦芽糖(IMO-90型) 保龄宝生物股份有限公司;植物乳杆菌(Lactobacillus plantarum)HCS03-001、罗伊氏乳杆菌(Lactobacillus reuteri)HCS02-001、鼠李糖乳杆菌(Lactobacillus rhamnosus)HCS01-013 江西仁仁健康微生态科技有限公司;SPF级雄性ICR小鼠(18~22 g) 生产许可SCXK(辽)2020-0001,辽宁长生生物技术有限公司;白细胞介素-4(IL-4)、白细胞介素-10(IL-10)、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、免疫球蛋白G(IgG)检测试剂盒 北京方程生物科技有限公司;环磷酰胺试剂盒 上海科艾博生物技术有限公司。
LDZX-50KBS高压蒸汽灭菌锅 上海申安医疗器械厂;DNP-420培养箱 北京市永久光明医疗器械有限公司;UPTB-10超纯水机 上海申分分析仪器有限公司;101A-3电热恒温干燥箱 北京市永久光明医疗器械有限公司;JA2003N精密电子天平 上海佑科仪器仪表有限公司;PHS-25B酸度计 上海大普仪器有限公司;SW-CJ-2D超净工作台 沈阳鑫科之杰仪器化玻有限公司;TG1650-WS台式高速离心机 上海卢湘仪离心机仪器有限公司;CS-2000高速多功能粉碎机 永康市天祺盛世工贸有限公司;UV-2000型可见紫外分光光度计 尤尼柯(上海)仪器有限公司;Multiskan FC酶标仪 美国Thermo公司。
1.2 实验方法
1.2.1 参杞酵素的制备工艺
1.2.1.1 工艺流程
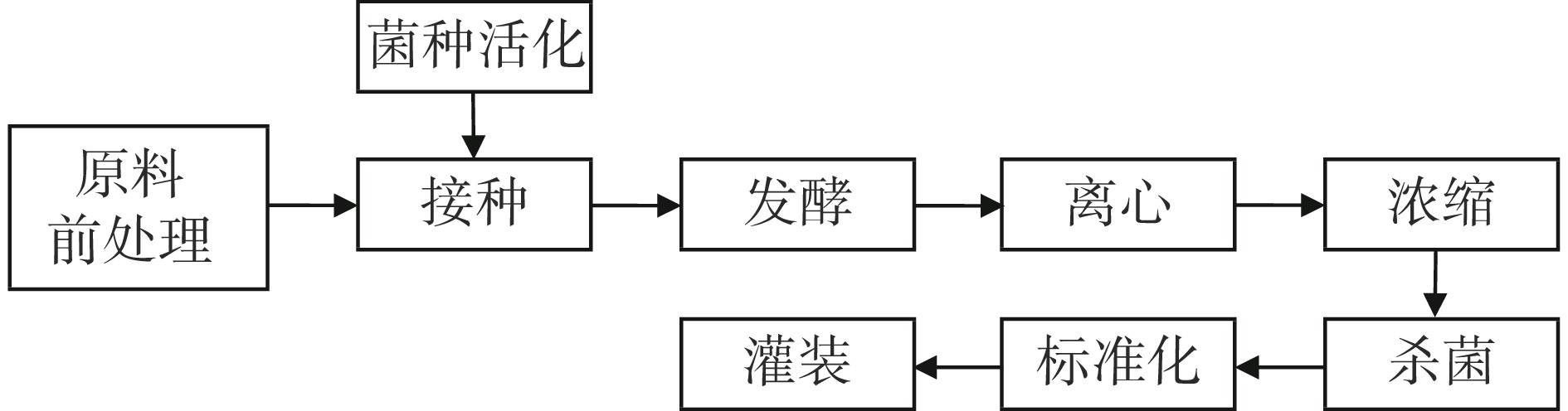
参杞酵素制备的工艺流程见图1。
1.2.1.2 操作要点
原料预处理:将枸杞子浸透处理后与人参、大枣及燕麦麸皮投入多功能提取罐中浸泡处理后煮沸。
菌种活化:将植物乳杆菌HCS03-001、罗伊氏乳杆菌HCS02-001、鼠李糖乳杆菌HCS01-013按比例混合后接种至活化培养基中37 ℃培养17 h至培养液活菌数达1.0×109 CFU/mL以上。
活化培养基的配制:无水葡萄糖4.0%,酵母浸出物1.5%,酵母蛋白胨1.0%,L-苹果酸0.3%,一水柠檬酸0.2%,磷酸二氢钾0.2%,无水氯化钙0.05%,硫酸镁0.006%,硫酸锰0.001%,调pH至5.0~7.0;115 ℃,灭菌30 min。
发酵、离心:将活化后的菌种接种至原料处理液,37 ℃搅动培养,13000 r/min离心至液体溶液均匀澄清,无杂质。
杀菌、灌装:超高温(温度131 ℃,时间15 s)瞬时灭菌后进行无菌灌装。
1.2.2 发酵菌种的选择
以5%的接种量分别接种植物乳杆菌HCS03-001:罗伊氏乳杆菌HCS02-001:鼠李糖乳杆菌HCS01-013,根据多次试验选取7组活菌数较高的菌种比例(10:0:0、0:10:0、0:0:10、5:5:0、5:0:5、5:4:1、5:1:4),发酵温度设置37 ℃,发酵48 h,取发酵液采用平板计数法检测活菌数,筛选发酵菌种。
1.2.3 发酵工艺单因素实验
实验以总酸含量为考察指标,优化发酵时间、发酵温度、接种量、菌种比例(HCS03-001:HCS02-001:HCS01-013)工艺参数。固定发酵温度37 ℃、接种量5%、菌种比例为5:4:1,优化发酵时间水平分别为48、60、72、84、96 h;固定发酵时间60 h、接种量5%、菌种比例为5:4:1,优化发酵温度水平分别为33、35、37、39、41 ℃;固定发酵时间60 h、发酵温度37 ℃、接种量5%,根据多次实验优选7组菌株比例活菌数较高,进而优化菌种比例水平分别为5:5:0、5:4.5:0.5、5:4:1、5:3.5:1.5、5:3:2;固定发酵时间60 h、发酵温度37 ℃、菌种比例为5:4:1,优化接种量水平分别为1%、3%、5%、7%、9%。
1.2.4 响应面试验优化
根据单因素实验结果,发酵时间、发酵温度、接种量、菌种比例是影响发酵程度的主要因素。根据Box-Benhnken试验设计原理,以此四因素为自变量进行组合优化,以总酸含量为响应值,进行响应面试验分析。确定参杞酵素的最佳工艺条件。试验设计方案如表1,采用Design Expert 8.0.6软件进行数据处理和回归分析。
表 1 Box-Benhnken试验设计因素水平Table 1. Factors and levels of the Box-Behnken experiment因素 水平 −1 0 1 A发酵时间(h) 60 72 84 B发酵温度(℃) 35 37 39 C菌种比例(鼠李糖乳杆菌HCS01-013) 0 0.5 1 D接种量(%) 3 5 7 1.2.5 指标测定方法
总酸测定参照GB 12456《食品安全国家标准 食品中总酸的测定》;pH测定参照GB/T 10468《水果和蔬菜产品pH值的测定方法》;乙醇含量测定参照GB/T 12143《饮料通用分析方法》;菌落总数测定参照GB 4789.2《食品安全国家标准 食品微生物学检验 菌落总数测定》;大肠菌群测定参照GB 4789.3《食品安全国家标准 食品微生物学检验 大肠菌群计数》;霉菌测定参照GB 4789.15《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》。
1.2.6 小鼠免疫抑制模型建立及分组
试验动物福利伦理审查批文号为HZYX2207153750。选择试验小鼠50只,于湿度50%±10%,温度22±1.5 ℃,噪音<60 dB,工作照度160~280 lx条件下自由进食进水以适应性喂养1周。将供试小鼠随机分为5组,每组10只,分别为模型组、正常组,根据人体每日摄入参杞酵素剂量30、60、90 mL/60 kg,换算设计实验组:5.0 mL/kg酵素样品低剂量组、10.0 mL/kg酵素样品中剂量组、15.0 mL/kg酵素样品高剂量组。
除正常组外,其余各组试验小鼠于试验开始时1~3 d腹腔注射环磷酰胺80 mg/(kg·d),建立免疫抑制模型。于试验4~30 d开始分别将酵素样品灌胃各剂量组,正常组和模型组灌胃等体积的蒸馏水。
1.2.7 小鼠脏器指数的测定
末次给予受试物24 h后称量脏器质量,取眼球血后立即处死小鼠,解剖分离胸腺、脾脏、肝脏、肾脏及心脏,用滤纸吸干脏器表面血污,分别称重,计算脏器指数[21],脏器指数计算公式如下:
脏器指数(%)=脏器质量(g)体重(g)×100 1.2.8 吞噬细胞吞噬指数的测定
末次给予受试物24 h后,按体重从小鼠尾静脉注射印度墨汁(用生理盐水1:4稀释,100 mg/kg),待墨汁注射后立即计时,分别于2和10 min时在眼静脉丛取血20 μL,并立即将其加到2 mL 0.1% Na2CO3溶液中,紫外分光光度计在600 nm波长处测定光密度值(OD),以Na2CO3溶液作空白对照[21]。
以吞噬指数表示小鼠碳廓清的能力,吞噬指数(a)计算公式如下:
K=lgOD1−lgOD2t2−t1 a=G1G2+G3×3√K 式中:K为吞噬速率;OD1为2 min时测定的光密度值;OD2为10 min时测定的光密度值;t1为2 min;t2为10 min;a为每单位组织吞噬细胞指数;G1为体重;G2为肝重;G3为脾重。
1.2.9 生化指标的测定
取小鼠眼球血于离心管内37 ℃放置1 h,再于4 ℃放置1 h,4 ℃ 2800 r/min离心10 min,收集血清,−20 ℃保存备用。用酶联免疫吸附(ELISA)检测试剂盒测定血清中IL-4、IL-10、IFN-γ、TNF-α、IgG的活性[22]。
1.3 数据处理
所有数据均为3次平行实验的平均值±标准偏差。通过Design-Expert 8.0.6软件对回归模型进行方差分析和可靠性分析。
2. 结果与分析
2.1 发酵菌种的确定
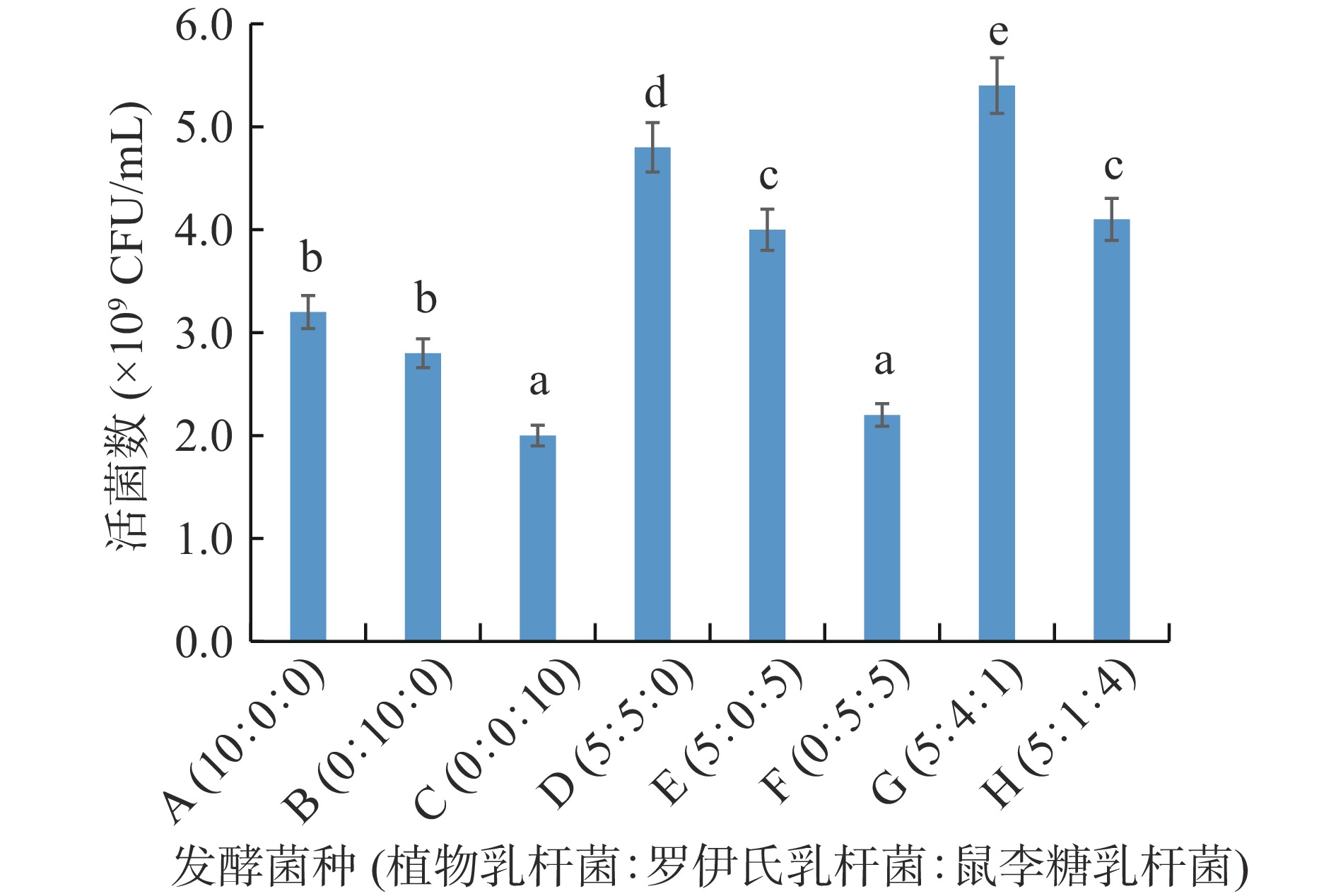
酵素原料发酵过程中活菌数浓度影响着发酵程度,因此以活菌数为考察指标,确定发酵菌种。以5%的接种量分别接种不同比例的植物乳杆菌、罗伊氏乳杆菌和鼠李糖乳杆菌,发酵温度设置37 ℃,发酵48 h后发酵液活菌数见图2。A、B、C组为使用单一菌种发酵,活菌数结果为植物乳杆菌>罗伊氏乳杆菌>鼠李糖乳杆菌;使用两两菌种组合发酵活菌数结果见D、E、F组,植物乳杆菌+罗伊氏乳杆菌>植物乳杆菌+鼠李糖乳杆菌>罗伊氏乳杆菌+鼠李糖乳杆菌,且D组和E组显著(P<0.05)高于单一菌种发酵组,而F组即无植物乳杆菌发酵的活菌数显著(P<0.05)低于A组(植物乳杆菌组),故发酵菌种固定有植物乳杆菌。根据D、E组结果,设计考察三种菌种组合发酵,结果G组活菌数显著(P<0.05)高于其他组,H组(4.1×109 CFU/mL)与E组(4.0×109 CFU/mL)无显著(P>0.05)差异。因此发酵菌种选择三菌种组合,以G组为基础进行单因素比例优化。
![]() 图 2 不同发酵菌种的发酵液活菌数注:不同字母之间表示差异显著(P<0.05);图3同。Figure 2. Number of viable bacteria in the fermentation liquid of different fermentation strains
图 2 不同发酵菌种的发酵液活菌数注:不同字母之间表示差异显著(P<0.05);图3同。Figure 2. Number of viable bacteria in the fermentation liquid of different fermentation strains2.2 发酵条件优化的单因素实验结果
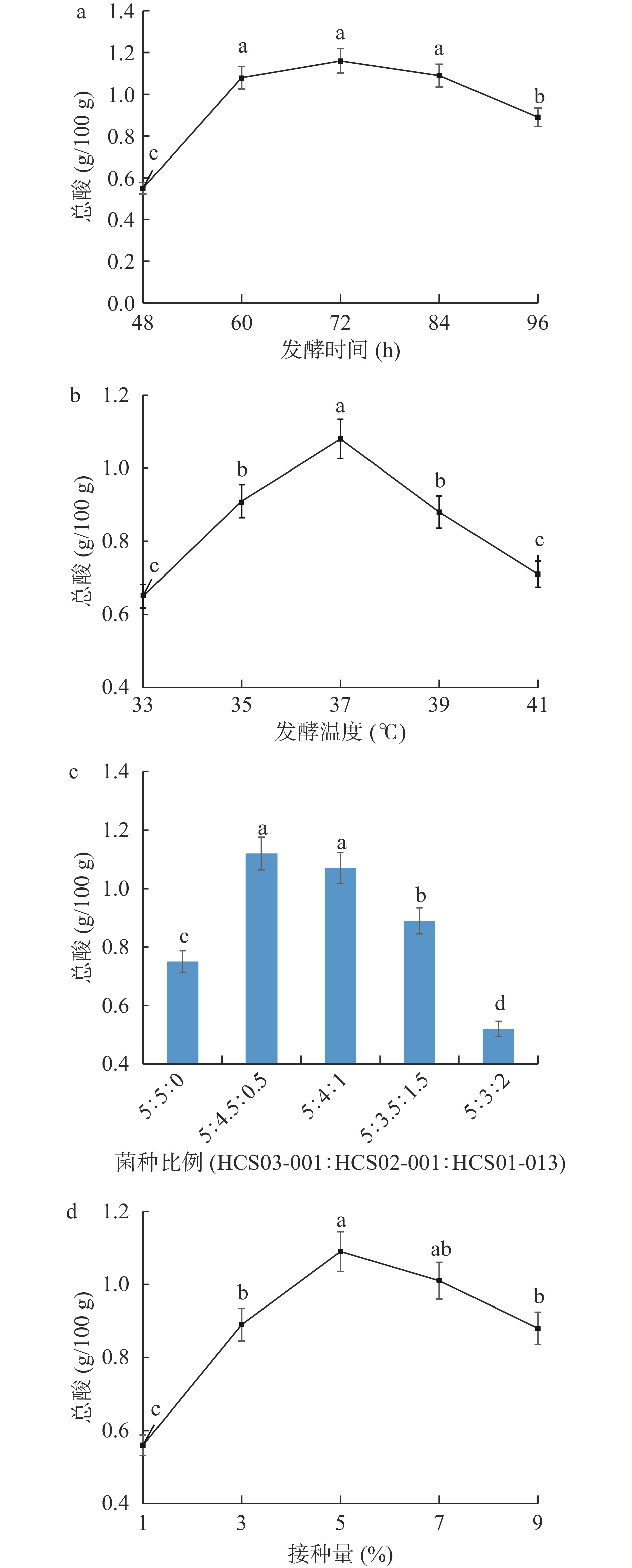
总酸是衡量发酵程度的主要指标,同时也是反映产品质量品质的重要理化指标。以总酸含量为考察指标,考察发酵时间、发酵温度、发酵菌种比例和菌种接种量对酵素液发酵程度的影响,结果如图3所示。
根据图3可以看出,总酸的量均随变量的变化呈先上升,达到最高值后下降的趋势。发酵时间的影响见图3a,随发酵时间的延长,总酸的含量逐渐增加,在60 h总酸含量显著(P<0.05)升高,在72 h时达1.16 g/100 g,原料已全部被菌体利用发酵,随后总酸含量呈下降趋势,可能与能利用有机酸的微生物繁殖有关[23],因此发酵时间72 h为最佳。从图3b可以看出,总酸含量随发酵温度的升高而增加,当发酵温度为37 ℃时总酸的含量达到最高,为1.08 g/100 g,发酵温度过高或过低均影响菌体的生长,且适宜的发酵温度原料利用率高,发酵更彻底。根据图3c,HCS01-013菌株由0增加到0.5时,总酸含量显著(P<0.05)增加并达到最高为1.12 g/100 g,随着HCS01-013继续增加,HCS02-001逐渐降低,总酸的含量又缓慢下降,因此最佳菌种比例(HCS03-001:HCS02-001:HCS01-013)为5:4.5:0.5。由图3d可知,接种量为3%时,总酸含量开始显著(P<0.05)增加。当接种量<5%时,总酸含量随接种量的增加而升高,接种量低菌体发酵较慢,代谢少,当接种量为5%时总酸含量最高为1.09 g/100 g,当接种量>5%时,总酸含量逐渐下降,可能与原料的利用程度有关,因此最佳接种量为5%。
2.3 响应面试验
以单因素实验结果为基础,依据Design Expert 8.0.6中的Box-Benhnken试验设计原理,选择发酵时间(A)、发酵温度(B)、菌种比例(C)、接种量(D)为考察因素,以总酸含量(Y)为响应值,进行4因素3水平的试验设计,Box-Benhnken试验设计及结果见表2,方差分析见表3。
表 2 发酵工艺优化Box-Benhnken试验设计与结果Table 2. Box-Benhnken experimental design and results of fermentation process optimization序号 因素 总酸含量
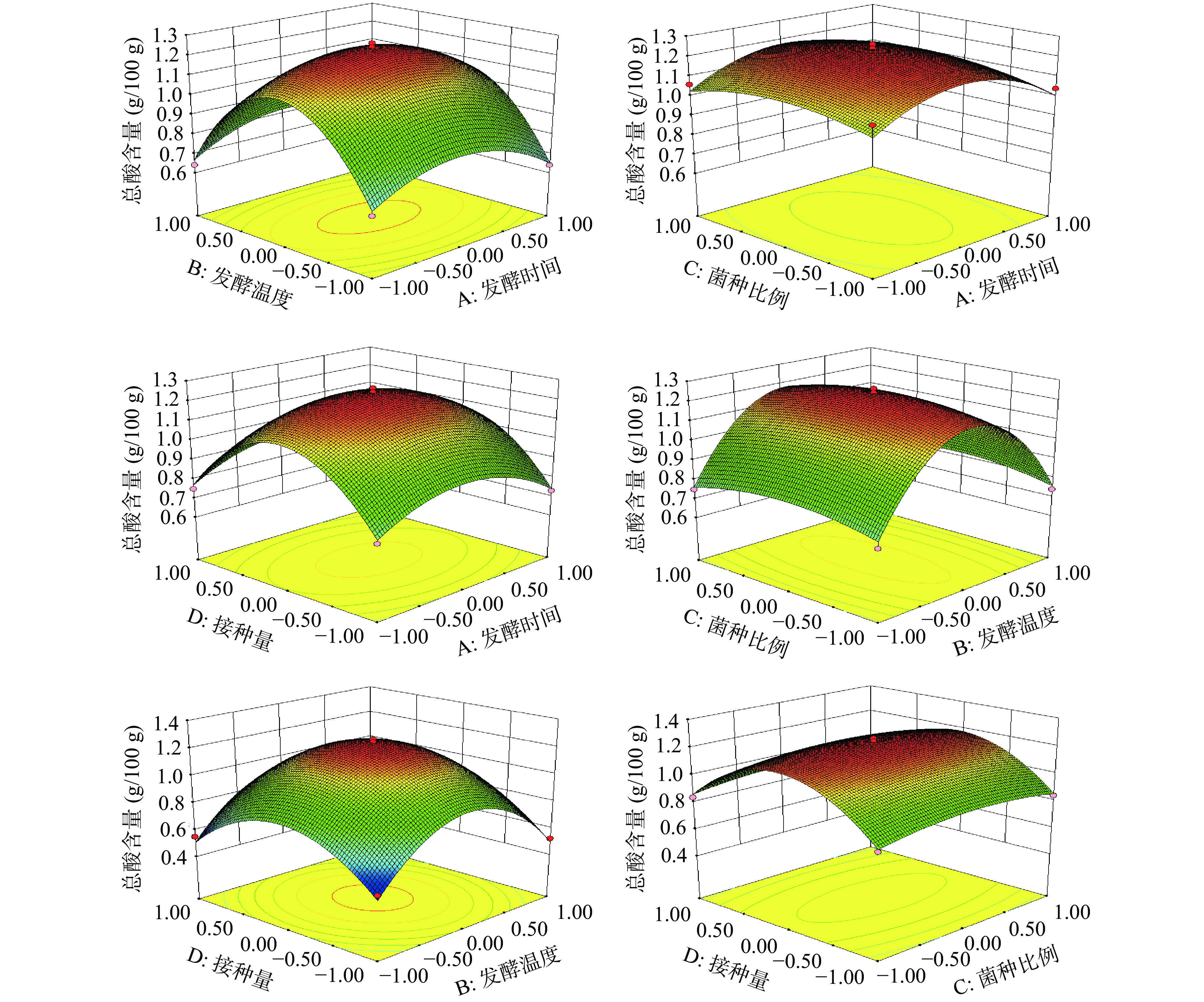
(g/100 g)A发酵时间 B发酵温度 C菌种比例 D接种量 1 1 0 −1 0 1.04±0.01 2 −1 0 0 1 0.75±0.13 3 0 0 −1 −1 0.82±0.02 4 0 −1 0 1 0.55±0.21 5 0 0 0 0 1.24±0.03 6 −1 1 0 0 0.64±0.02 7 1 1 0 0 0.66±0.12 8 −1 −1 0 0 0.67±0.08 9 0 −1 1 0 0.75±0.09 10 −1 0 1 0 1.06±0.15 11 1 −1 0 0 0.64±0.04 12 0 1 −1 −1 0.52±0.07 13 0 0 0 0 1.23±0.06 14 0 −1 −1 −1 0.53±0.18 15 0 0 −1 −1 0.84±0.15 16 1 1 0 0 0.74±0.03 17 0 0 0 0 1.26±0.11 18 1 1 0 0 0.77±0.08 19 0 0 1 1 0.83±0.04 20 0 0 1 1 0.75±0.05 21 0 0 0 0 1.21±0.13 22 −1 0 0 0 1.09±0.06 23 0 0 0 0 1.26±0.02 24 0 0 1 1 0.84±0.03 25 0 1 1 1 0.54±0.09 26 0 −1 0 0 0.73±0.12 27 −1 0 −1 −1 0.75±0.04 28 1 0 −1 −1 0.73±0.06 29 1 0 0 0 1.03±0.11 表 3 回归模型方差分析Table 3. ANOVA of regression model项目 平方和 自由度 均方 F值 P 模型 1.56 14 0.11 87.82 <0.0001 A 1.008E-3 1 1.008E-3 0.80 0.387 B 0.000 1 0.000 0.000 1.0000 C 3.333E-5 1 3.333E-5 0.026 0.8734 D 4.083E-4 1 4.083E-4 0.32 0.5791 AB 6.250E-4 1 6.250E-4 0.49 0.4938 AC 1.000E-4 1 1.000E-4 0.079 0.7828 AD 1.000E-4 1 1.000E-4 0.079 0.7828 BC 2.500E-5 1 2.500E-5 0.020 0.8903 BD 2.220E-16 1 2.220E-16 1.754E-13 1.0000 CD 2.250E-4 1 2.250E-4 0.18 0.6797 A2 0.16 1 0.16 123.09 <0.0001 B2 1.11 1 1.11 877.06 <0.0001 C2 0.026 1 0.026 20.82 0.0004 D2 0.69 1 0.69 541.15 <0.0001 残差 0.018 14 1.266E-3 失拟项 0.016 10 1.593E-3 3.54 0.1173 纯误差 1.800E-3 4 4.500E-4 总离差 1.57 28 注:P<0.01表示极显著;0.01<P<0.05表示显著。 应用Design-Expert 8.0.6软件对表2试验结果进行分析,得到二次多项回归方程Y=1.24−(9.176E-3)A+0.000B+(1.667E-3)C+(5.833E-3)D+0.012AB+(5.000E-3)AC+(5.000E-3)AD+(2.500E-3)BC+0.000BD−(7.500E-3)CD-0.16A2−0.41B2−0.064C2−0.032D2。由表3可知,回归模型极显著(P<0.01),说明该模型对参杞酵素液发酵总酸含量的分析和预测较精准,失拟项(P=0.1173>0.05),无显著性(P>0.05)差异。模型决定系数R2=0.9887,校正决定系数R2Adj=0.9775,说明该模型方程拟合度良好,可以较好的反应各因素之间的关系[24]。各因素的F值可评价该因素对响应值的影响,F值越大,表明该因素的影响越显著[25-26]。绘制响应面三维立体图见图4,发酵温度、发酵时间、菌种比例和接种量四种因素两两交互作用不显著(P>0.05),但趋势明显。因此,对总酸的影响顺序依次是发酵时间>接种量>菌种比例>发酵温度。
模型预测最佳发酵工艺条件为:发酵时间72.36 h,发酵温度37.00 ℃,菌种比例5:4.5:0.5,接种量5.02%,在此条件下,总酸含量理论值为1.24 g/100 g。为了方便实际操作,将最佳发酵工艺修正为:发酵时间72 h,发酵温度37 ℃,菌种比例5:4.5:0.5,接种量5%。在此条件下进行5次平行验证试验,总酸含量实际值为1.23 g/100 g,与理论值接近,说明该模型能准确反映各因素条件的变化与发酵程度之间的关系,该模型具有可靠性。
2.4 质量指标检测结果
根据产品质量要求,检测了参杞酵素液的pH符合《GB/T 10468 水果和蔬菜产品pH值的测定方法》、乙醇含量符合《GB/T 12143 饮料通用分析方法》、菌落总数符合《GB 4789.2 食品安全国家标准 食品微生物学检验 菌落总数测定》、大肠菌群符合《GB 4789.3 食品安全国家标准 食品微生物学检验 大肠菌群计数》及霉菌符合《GB 4789.15 食品安全国家标准 食品微生物学检验 霉菌和酵母计数》,结果见表4,均符合相应标准要求。
2.5 对免疫抑制小鼠脏器指数的影响
胸腺及脾脏是重要的免疫器官,脏器指数可以直观地反映机体免疫功能的强弱[32]。酵素样品对免疫抑制小鼠脏器指数的影响见表5,模型组中胸腺、心脏和肾脏相比正常组具有显著(P<0.05)变化,说明建模成功。模型组小鼠各脏器指数较溶剂正常组均有所降低。各剂量组胸腺指数均增加,且高剂量组较模型组显著(P<0.05)增加;不同剂量组小鼠与模型组相比脾脏指数及肝脏指数均有所增加。高剂量组小鼠心脏指数及中、高剂量组小鼠肾脏指数显著(P<0.05)增加。表明酵素试验样品可明显改善环磷酰胺诱导的免疫抑制小鼠的免疫器官指数。
表 5 酵素样品对免疫抑制小鼠脏器指数的影响(n=30)Table 5. Effects of enzyme samples on organ index of immunosuppressed mice (n=30)组别 脏器指数(%) 胸腺 脾脏 肝脏 心脏 肾脏 正常组 0.14±0.02 0.38±0.05 5.20±0.21 0.59±0.03 1.11±0.09 模型组 0.08±0.01a 0.32±0.06a 5.05±0.13a 0.45±0.09a 0.79±0.08a 低剂量组 0.09±0.03 0.35±0.10 5.08±0.19 0.51±0.05 0.91±0.11 中剂量组 0.10±0.02 0.37±0.08 5.11±0.15 0.56±0.05 0.95±0.16* 高剂量组 0.13±0.01* 0.38±0.07 5.13±0.22 0.56±0.04* 1.08±0.13* 注:*与模型组比较,P<0.05;a与正常组比较,P<0.05。 2.6 对免疫抑制小鼠巨噬细胞吞噬指数的影响
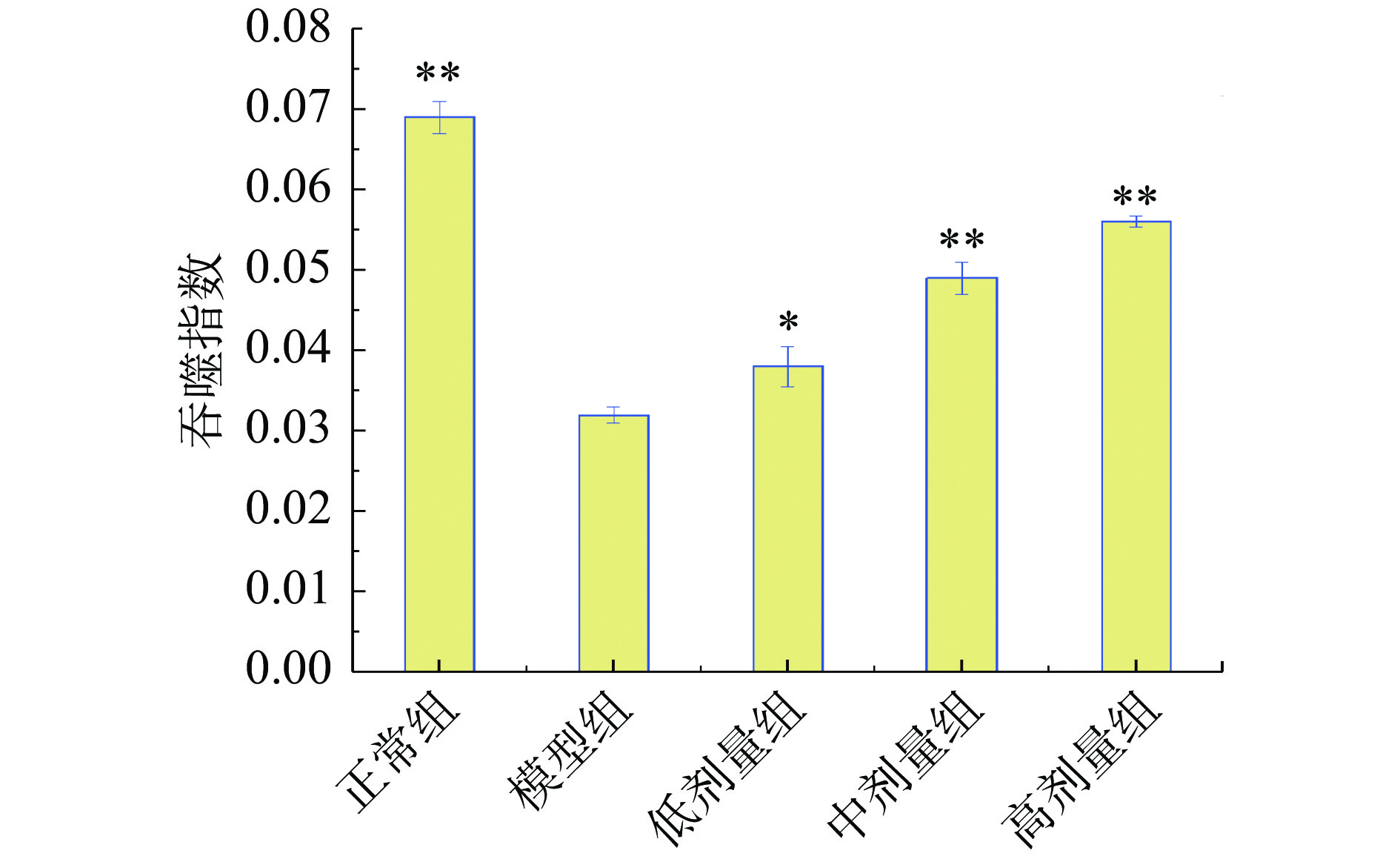
单核巨噬细胞系统对异物具有很强的吞噬功能,是机体非特异性免疫功能的指标之一[33]。利用碳廓清实验检测不同剂量组酵素样品对免疫抑制小鼠巨噬细胞吞噬活性的影响,结果见图5,模型组小鼠吞噬指数较正常组显著(P<0.01)降低,表明免疫抑制小鼠造模成功。中剂量组与模型组相比,吞噬指数极显著(P<0.01)高于模型组,高剂量组吞噬指数较模型组具有极显著(P<0.01)差异。表明试验酵素可增强免疫抑制小鼠吞噬细胞的系统功能,且具有剂量依赖性。
2.7 对免疫抑制小鼠血清免疫指标的影响
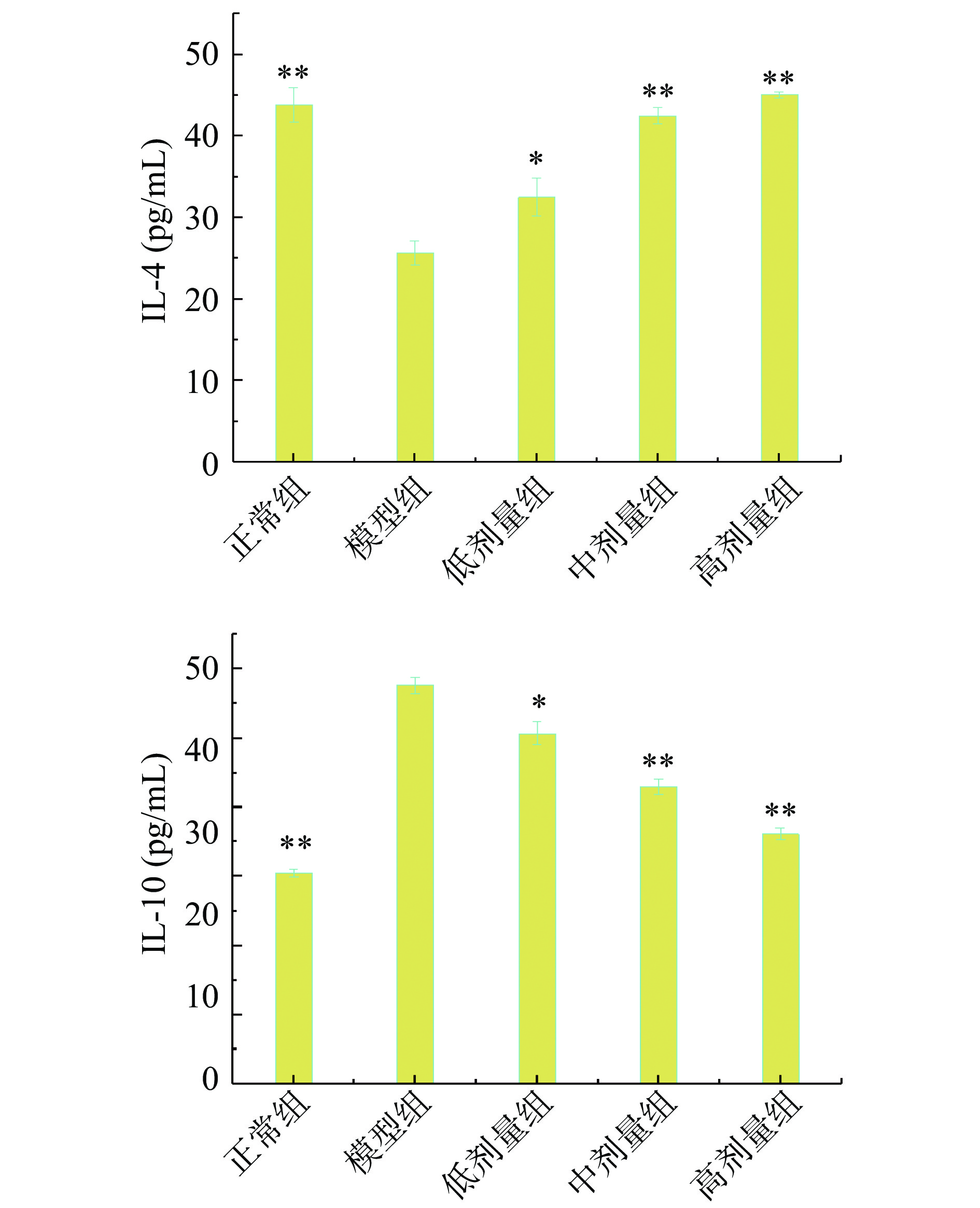
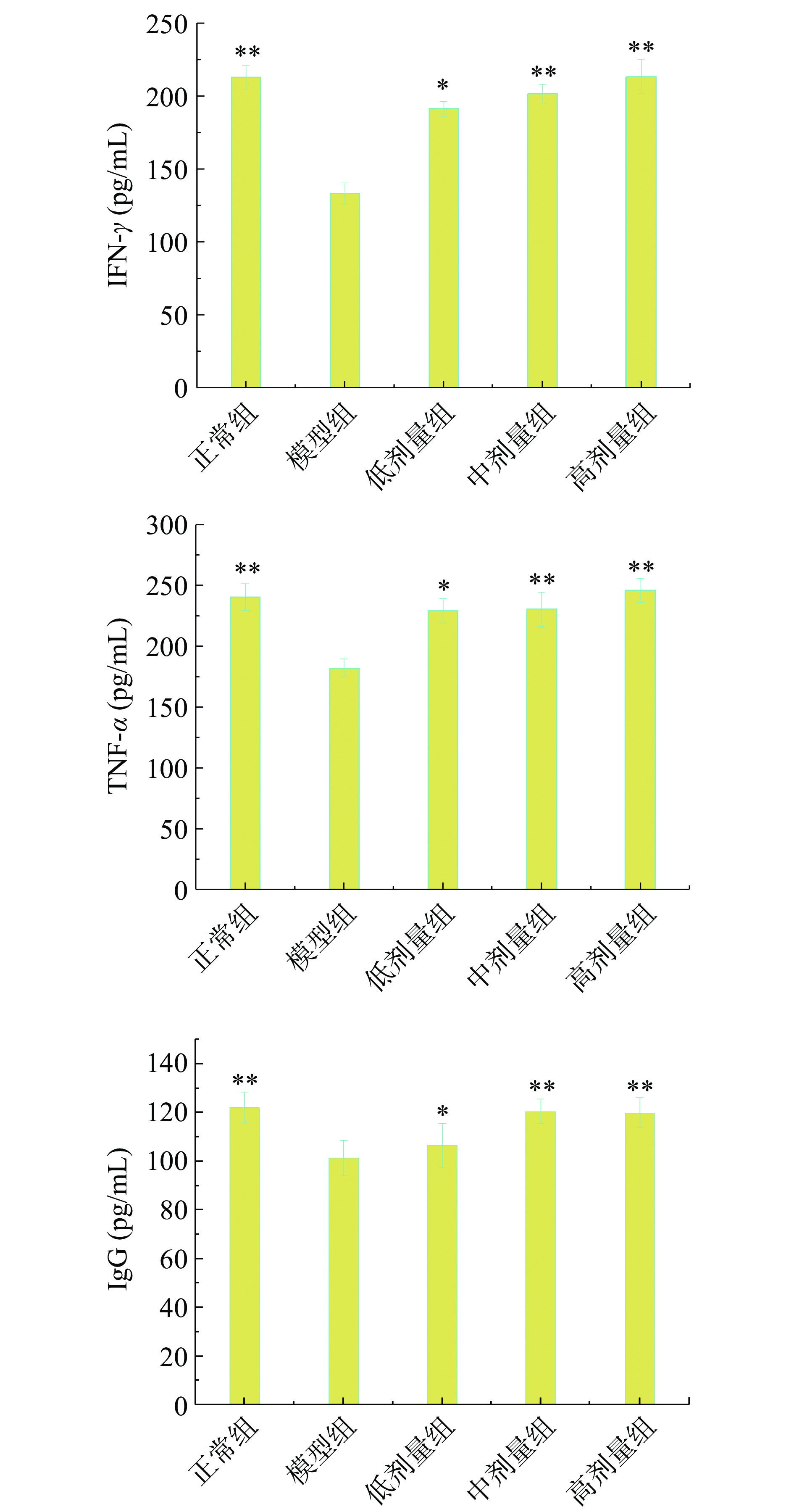
参杞酵素液对小鼠血清免疫因子的影响见图6及图7。模型组小鼠血清与正常组相比IL-4显著下降(P<0.01),IL-10明显增加,IFN-γ、TNF-α及IgG质量浓度均明显下降,说明环磷酰胺诱导的免疫抑制模型造模成功。
IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞和造细胞都有免疫调节作用,能够诱导IgG和IgE的产生[34]。根据图6所示,与模型组比较,剂量组免疫抑制小鼠血清IL-4含量随酵素液剂量的增加而增加,且中、高剂量组具有极显著性(P<0.01),分别可达42.47、45.04 pg/mL。白细胞介素-10(IL-10)又称为细胞因子合成抑制因子,能抑制NK细胞活性,干扰NK细胞和巨噬细胞产生细胞因子。中、高剂量免疫抑制小鼠血清IL-10含量与模型组小鼠相比含量明显降低,且差异极显著(P<0.01),高剂量的小鼠血清IL-10质量浓度可恢复至72.26 pg/mL。试验酵素液对免疫抑制小鼠血清IFN-γ、TNF-α及IgG质量浓度的影响见图7,中、高剂量组IFN-γ、TNF-α的质量浓度与模型组相比均极显著(P<0.01)增加,IFN-γ可激活淋巴细胞,促进细胞分化,通过增强炎症应答的方式提高机体免疫作用,属于促炎细胞因子[35],说明剂量组能够极大程度地促进促炎细胞因子分泌,增强炎症应答水平。试验酵素液可刺激TNF-α分泌,TNF-α分泌后诱导巨噬细胞活性和杀伤功能增强,使得巨噬细胞促进机体免疫应答。中、高剂量组小鼠血清IgG质量浓度较模型组极显著(P<0.01)增加,且试验酵素液对小鼠血清IFN-γ的影响具有剂量依赖性。高剂量组可使小鼠血清IFN-γ质量浓度达到213.47 pg/mL,TNF-α质量浓度可达246.13 pg/mL,IgG的质量浓度可达119.89 ng/mL,接近或高于正常组。以上表明参杞酵素液对环磷酰胺所致免疫功能的抑制有一定的恢复作用[36-38]。
3. 结论
提升免疫力是改变当代人们身体普遍处于亚健康状态的重要途径,为满足人们需要,充分发挥人参和枸杞子的保健优势,研究开发参杞本草酵素。本研究首先对参杞酵素的发酵工艺进行优化,以总酸为响应值,通过单因素实验和Box-Behnken试验对发酵时间、发酵温度、菌种比例、接种量四个因素进行优化,优化后的工艺参数为发酵时间72 h,发酵温度37 ℃,菌种比例5:4.5:0.5,接种量5%。以环磷酰胺诱导小鼠构建免疫低下小鼠模型,探究优化后的参杞酵素液对小鼠免疫调节作用。经参杞酵素液对免疫抑制小鼠进行调节干预后,各剂量组小鼠脏器指数及巨噬细胞吞噬指数较模型组均有所增加,且具有剂量依赖,说明能够增强免疫抑制小鼠的免疫器官和免疫细胞功能;显著(P<0.05)上调了免疫抑制小鼠的血清中IFA-γ、TNF-α、IL-4及IgG水平,下调IL-10水平,促进机体免疫应答。参杞酵素液对免疫低下小鼠模型小组具有一定的免疫调节作用,为该产品的开发应用提供理论基础,后续将开展人体临床试验,进一步探究其增强免疫能力及机理。
-
图 2 不同发酵菌种的发酵液活菌数
注:不同字母之间表示差异显著(P<0.05);图3同。
Figure 2. Number of viable bacteria in the fermentation liquid of different fermentation strains
表 1 Box-Benhnken试验设计因素水平
Table 1 Factors and levels of the Box-Behnken experiment
因素 水平 −1 0 1 A发酵时间(h) 60 72 84 B发酵温度(℃) 35 37 39 C菌种比例(鼠李糖乳杆菌HCS01-013) 0 0.5 1 D接种量(%) 3 5 7 表 2 发酵工艺优化Box-Benhnken试验设计与结果
Table 2 Box-Benhnken experimental design and results of fermentation process optimization
序号 因素 总酸含量
(g/100 g)A发酵时间 B发酵温度 C菌种比例 D接种量 1 1 0 −1 0 1.04±0.01 2 −1 0 0 1 0.75±0.13 3 0 0 −1 −1 0.82±0.02 4 0 −1 0 1 0.55±0.21 5 0 0 0 0 1.24±0.03 6 −1 1 0 0 0.64±0.02 7 1 1 0 0 0.66±0.12 8 −1 −1 0 0 0.67±0.08 9 0 −1 1 0 0.75±0.09 10 −1 0 1 0 1.06±0.15 11 1 −1 0 0 0.64±0.04 12 0 1 −1 −1 0.52±0.07 13 0 0 0 0 1.23±0.06 14 0 −1 −1 −1 0.53±0.18 15 0 0 −1 −1 0.84±0.15 16 1 1 0 0 0.74±0.03 17 0 0 0 0 1.26±0.11 18 1 1 0 0 0.77±0.08 19 0 0 1 1 0.83±0.04 20 0 0 1 1 0.75±0.05 21 0 0 0 0 1.21±0.13 22 −1 0 0 0 1.09±0.06 23 0 0 0 0 1.26±0.02 24 0 0 1 1 0.84±0.03 25 0 1 1 1 0.54±0.09 26 0 −1 0 0 0.73±0.12 27 −1 0 −1 −1 0.75±0.04 28 1 0 −1 −1 0.73±0.06 29 1 0 0 0 1.03±0.11 表 3 回归模型方差分析
Table 3 ANOVA of regression model
项目 平方和 自由度 均方 F值 P 模型 1.56 14 0.11 87.82 <0.0001 A 1.008E-3 1 1.008E-3 0.80 0.387 B 0.000 1 0.000 0.000 1.0000 C 3.333E-5 1 3.333E-5 0.026 0.8734 D 4.083E-4 1 4.083E-4 0.32 0.5791 AB 6.250E-4 1 6.250E-4 0.49 0.4938 AC 1.000E-4 1 1.000E-4 0.079 0.7828 AD 1.000E-4 1 1.000E-4 0.079 0.7828 BC 2.500E-5 1 2.500E-5 0.020 0.8903 BD 2.220E-16 1 2.220E-16 1.754E-13 1.0000 CD 2.250E-4 1 2.250E-4 0.18 0.6797 A2 0.16 1 0.16 123.09 <0.0001 B2 1.11 1 1.11 877.06 <0.0001 C2 0.026 1 0.026 20.82 0.0004 D2 0.69 1 0.69 541.15 <0.0001 残差 0.018 14 1.266E-3 失拟项 0.016 10 1.593E-3 3.54 0.1173 纯误差 1.800E-3 4 4.500E-4 总离差 1.57 28 注:P<0.01表示极显著;0.01<P<0.05表示显著。 表 4 质量指标检测结果
Table 4 Quality index test results
表 5 酵素样品对免疫抑制小鼠脏器指数的影响(n=30)
Table 5 Effects of enzyme samples on organ index of immunosuppressed mice (n=30)
组别 脏器指数(%) 胸腺 脾脏 肝脏 心脏 肾脏 正常组 0.14±0.02 0.38±0.05 5.20±0.21 0.59±0.03 1.11±0.09 模型组 0.08±0.01a 0.32±0.06a 5.05±0.13a 0.45±0.09a 0.79±0.08a 低剂量组 0.09±0.03 0.35±0.10 5.08±0.19 0.51±0.05 0.91±0.11 中剂量组 0.10±0.02 0.37±0.08 5.11±0.15 0.56±0.05 0.95±0.16* 高剂量组 0.13±0.01* 0.38±0.07 5.13±0.22 0.56±0.04* 1.08±0.13* 注:*与模型组比较,P<0.05;a与正常组比较,P<0.05。 -
[1] WANG L, HUANG Y, YIN G, et al. Antimicrobial activities of Asian ginseng, American ginseng, and notoginseng[J]. Phytother Res,2020,34(6):1226−1236. doi: 10.1002/ptr.6605
[2] 高健, 吕邵娃. 人参化学成分及药理作用研究进展[J]. 中医药导报,2021,27(1):127−130,137. [GAO J, LÜ S W. Research progress in chemical constituents and pharmacological action of renshen (ginseng)[J]. Guiding Journal of Traditional Chinese Me-dicine,2021,27(1):127−130,137. [3] 于学涛, 王淑萍. 人参皂苷Rg3联合化疗治疗对胃癌术后患者的临床观察[J]. 中华肿瘤防治杂志,2010,17(1):779−781. [YU X T, WANG S P. Clinical observation on treatment for postoperative gastric cancer by ginsenoside Rg3 combined with chemotherapy[J]. Chinese Journal of Cancer Prevention and Treatment,2010,17(1):779−781. doi: 10.16073/j.cnki.cjcpt.2010.10.003 [4] ZHANG G, LIU A, ZHOU Y, et al. Panax ginseng ginsenoside Rg2 protects memory impairment via anti-a poptosis in a rat model with vascular dementia[J]. Journal of Ethnopharmacology,2008,115(3):441−448. doi: 10.1016/j.jep.2007.10.026
[5] 王勖. 浅谈人参的药理作用与临床应用[J]. 双足与保健,2018,27(4):190−194. [WANG X. Discussion on pharmacological action and clinical application of ginseng[J]. Biped and Health,2018,27(4):190−194. [6] 李倩, 柴艺汇, 高洁, 等. 人参现代药理作用研究进展[J]. 贵阳中医学院学报,2019,41(191):93. [LI Q, CHAI Y H, GAO J, et al. Research progress of modern pharmacological action of ginseng[J]. Journal of Guizhou University of Traditional,2019,41(191):93. [7] BLASI F, MONTESANO D, SIMONETTI M S, et al. A simple and rapid extraction method to evaluate the fatty acid composition and nutritional value of goji berry lipid[J]. Food Analytical Methods,2017,10:970−979. doi: 10.1007/s12161-016-0652-x
[8] MONTESANO D, COSSIGNANI L, GIUA L, et al. A simple HPLC-ELSD method for sugar analysis in goji berry[J]. Journal of Chemistry, 2016. DOI:org/10.1155/2016/ 6271808.
[9] FORINO M, TARTAGLIONE L, DELL AVERSANO C, et al. NMR-based identification of the phenolic profile of fruits of Lycium barbarum (goji berries). Isolation and structural determination of a novel N-feruloyl tyramine dimer as the most abundant antioxidant polyphenol of goji berries[J]. Food Chemistry,2016,194:1254−1259. doi: 10.1016/j.foodchem.2015.08.129
[10] CHENG J, ZHOU Z W, SHENG H P, et al. An evidence-based update on the pharmacological activities and possible molecular targets of Lycium barbarum polysaccharides[J]. Drug Des Devel Ther,2015,9:33−78.
[11] GAO L L, MA J M, FAN Y N, et al. Lycium barbarum polysaccharide combined with aerobic exercise ameliorated nonalcoholic fatty liver disease through restoring gut microbiota, intestinal barrier and inhibiting hepatic inflammation[J]. International Journal of Biological Macromolecules,2021,183:1379−1392. doi: 10.1016/j.ijbiomac.2021.05.066
[12] LE B, PHAM T N A, YANG S H. Prebiotic potential and anti-inflammatory activity of soluble polysaccharides obtained from soybean residue[J]. Foods,2020(12):1808.
[13] T/CBFIA08001-2016. 酵素产品分类导则[S]. 北京: 中国标准出版社, 2016. T/CBFIA08001-2016. Guidelines for the classification of enzyme products[S]. Beijing: China Standard Press, 2016.
[14] KUWAKI S, NAKAJINMA N, TANAKA H, et al. Plant based paste fermented by lactic acid bacteria and yeast: Functional analysis and possibility of application to functional food[J]. Biochemistry Insights,2012,5:21−29.
[15] 李晓青, 刘俊江, 陈宏运, 等. 植物发酵液的发展及其功效[J]. 农产品加工,2014(1):70−72. [LI X Q, LIU J J, CHEN H Y, et al. The development and function of plant fermentation[J]. Academic Periodical of Farm Products,2014(1):70−72. [16] OKADA H, FUKUSHI E, YAMAMORI A, et al. Structural analysis of three novel trisaccharides isolated from the fermented beverage of plant extracts[J]. Chemistry Central Journal,2009,3(1):8. doi: 10.1186/1752-153X-3-8
[17] OKADA H, KUDOH K, FUKUSHI E, et al. Antioxidative activity and protective effect of fermented plant extract on ethanol induced damage to rat gastric mucosa[J]. Journal of Japanese Society of Nutrition and Food Science (Japan),2005,58:209−215. doi: 10.4327/jsnfs.58.209
[18] 赵金凤, 曲佳乐, 皮子凤, 等. 植物酵素润肠通便保健功能研究[J]. 食品与发酵科技,2012,48(3):54−56. [ZHAO J F, QU J L, PI Z F, et al. Study on the health care function of relieving constipation of plant enzyme[J]. Food and Fermentation Science & Technology,2012,48(3):54−56. doi: 10.3969/j.issn.1674-506X.2012.02-014 [19] 赵金凤, 宿秀芹, 曲佳乐, 等. 敖东酵素对脾淋巴细胞增殖作用的影响[J]. 食品与发酵科技,2014,50(3):50−52. [ZHAO J F, SU X Q, QU J L, et al. Effect on the splenic lymphocyte proliferation functionary of Aodong enzyme[J]. Food and Fermentation Science & Technology,2014,50(3):50−52. [20] LU M, TOSHIMA Y, WU X, et al. Inhibitory effects of vegetable and fruit ferment liquid on tumor growth in Hepatoma-22 inoculation model[J]. Asia Pacific Journal of Clinical Nutrition,2007,16(S1):443−446.
[21] 刘春红, 王晓慧, 高磊, 等. 植物乳杆菌C88联合人参多糖的免疫调节作用[J]. 食品科学,2016,37(11):202−207. [LIU C H, WANG X H, GAO L, et al. Immunomodulatory effects of ginseng polysaccharides combined with Lactobacillus plantarum C88[J]. Food Science,2016,37(11):202−207. doi: 10.7506/spkx1002-6630-201611035 [22] 高光武, 李玲. 黄岑提取物的抗炎作用及其作用机制研究[J]. 中国临床药理学杂志,2014,30(6):550−552. [GAO G W, LI L. Study on the anti-inflammatory effect and mechanism of the extract of Scutellaria baicalensis Georgi[J]. The Chinese Journal of Clinical Pharmacology,2014,30(6):550−552. [23] 郭俊花, 许先猛, 马欣, 等. 利用苹果皮渣发酵制备天然酵素工艺优化及其对苹果品质的影响[J]. 江苏农业科学,2018,46(1):97−101. [GUO J H, XU X M, MA X, et al. The optimization of natural enzyme process and its effect on apple quality by fermentation of apple peel slag[J]. Jiangsu Agric Sci,2018,46(1):97−101. [24] 陈铭中, 刘志芳, 吴海珍, 等. 响应面法优化发酵青梅酒澄清工艺[J]. 中国酿造,2019,38(3):84−87. [CHEN M Z, LIU Z F, WU H Z, et al. Optimization of clarification process for fermented plum wine by response surface method[J]. China Brewing,2019,38(3):84−87. [25] 洪晶, 陈涛涛, 唐梦茹, 等. 响应面法优化韭菜籽蛋白质提取工艺[J]. 中国食品学报,2013,13(12):89−95. [HONG J, CHEN T T, TANG M R, et al. Optimization of protein extraction process of leek seed by response surface methodology[J]. Journal of Chinese Institute of Food Science and Technology,2013,13(12):89−95. [26] 徐璐, 汪涛, 郭巧生, 等. 响应面法优化超声辅助法提取昆仑雪菊色素的工艺研究[J]. 中国中药杂志,2014,39(24):4792−4797. [XU L, WANG T, GUO Q S, et al. Optimization of ultrasonic-assisted extraction of pigment from Chamaejasme kunlun by response surface methodology[J]. China Journal of Chinese Materia Medica,2014,39(24):4792−4797. [27] 中华人民共和国商业部. GB/T 10468-1989 水果和蔬菜产品pH值的测定方法[S]. 北京: 北京市食品研究所, 1989. Ministry of Commerce of the people's Republic of China. GB/T 10468-1989 Fruit and vegetable products-Determination of pH[S]. Beijing: Beijing Food Research Institute, 1989.
[28] 中华人民共和国国家质量监督检验检疫总局. GB/T 12143-2008 饮料通用分析方法[S]. 北京: 中国国家标准化管理委员会, 2008. State Administration for Market Regulation of China. GB/T 12143-2008 General analytical methods for beverage[S]. Beijing: Standardization Administration of China, 2008.
[29] 国家食品药品监督管理总局. GB 4789.2-2016 食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 北京: 中华人民共和国国家卫生和计划生育委员会, 2016. State Administration for Market Regulation of China. GB 4789.2-2016 National Standards for Food Safety. Microbiology detection. Determination of total number of colonies[S]. Beijing: National Health Commission of the People's Republic of China, 2016.
[30] 国家食品药品监督管理总局. GB 4789.3-2016 食品安全国家标准 食品微生物学检验 大肠菌群计数[S]. 北京: 中华人民共和国国家卫生和计划生育委员会, 2016. State Administration for Market Regulation of China. GB 4789.2-2016 National Standards for Food Safety. Microbiology detection. Coliform bacteria count[S]. Beijing: National Health Commission of the People's Republic of China, 2016.
[31] 中华人民共和国国家卫生和计划生育委员会. GB 4789.15-2016 食品安全国家标准 食品微生物学检验 霉菌和酵母计数[S]. 北京: 中华人民共和国国家卫生和计划生育委员会, 2016. National Health Commission of the People's Republic of China. GB 4789.15-2016 National Standards for Food Safety. Microbiology detection. Mold and yeast counts[S]. Beijing: National Health Commission of the People's Republic of China, 2016.
[32] 成黎. 传统发酵食品营养保健功能与质量安全评价[J]. 食品科学,2012,33(1):280−284. [CHEN L. Assessment of health benefits, quality and safety of traditional fermented foods: A review[J]. Food Science,2012,33(1):280−284. [33] 管晓冉, 张德纯, 李金玲, 等. 双歧杆菌发酵果蔬汁对小鼠免疫功能的影响[J]. 中国微生态学杂志,2010,22(2):110−113. [GUAN X R, ZHANG D C, LI J L, et al. Effect of bifidobacterium fermented mixed fruit and vegetable juice on immunological function of mice[J]. Chinese Journal of Microecology,2010,22(2):110−113. doi: 10.13381/j.cnki.cjm.2010.02.004 [34] SNAPPER C M, FINKELMAN F D, PAUL W E. Differential regulation of IgG1 and IgE synthesis by interleukin 4[J]. J Exp Med,1988,167:183−196. doi: 10.1084/jem.167.1.183
[35] EISSA M A, HASHIM Z H Y, ABDUL A S S S, et al. Phytochemical constituents of Aquilaria malaccensis leaf extract and their anti-inflammatory activity against LPS/IFN-γ-stimulated RAW 264.7 cell line[J]. ACS Omega,2022,7(18):15637−15646. doi: 10.1021/acsomega.2c00439
[36] ZHANG L F, MA H M, GE Q P, et al. The accuracy of mycobacterium tuberculosis specific IFN-γ/IL-2/TNF-α- FluoroSpot in differential diagnosis of active tuberculosis and latent tuberculosis infection: A case-control study[J]. Open Forum Infectious Diseases,2021:8. doi: 10.1093/OFID/OFAB466.1597
[37] DI N A, GRECO D, SCAFETTA G, et al. IL-10, IL-13, eotaxin and IL-10/IL-6 ratio distinguish breast implant-associated anaplastic large-cell lymphoma from all types of benign late seromas[J]. Cancer Immunology, Immunotherapy: CII,2021,70(5):1379−1392. doi: 10.1007/s00262-020-02778-3
[38] HAN J, PAN Y Q, GU Y X, et al. Profiling of IgG N-glycome during mouse aging: Fucosylated diantennary glycans containing one Neu5Gc-linked LacNAc are associated with age[J]. Journal of Proteomics,2020,229:103966. doi: 10.1016/j.jprot.2020.103966
-
期刊类型引用(1)
1. 周美,廖秀,李立郎,王瑜,安巧,罗鸣,王道平. 铁皮石斛酵素制备工艺及其免疫活性研究. 食品科技. 2024(01): 94-102 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:



 下载:
下载:



