Quantitative Determination of Phosphate in Meat Products by 31P-Nuclear Magnetic Resonance
-
摘要: 建立了核磁共振磷谱(31P-qNMR)技术快速定量测定肉制品中磷酸盐含量的方法。样品采用碱性缓冲盐振荡提取2次,离心过膜后,以六甲基磷酰三胺为内标进行定量分析。结果表明:该方法加标回收率为97.0%~112.0%,相对标准偏差0.87%~3.15%。日内精密度为0.68%~3.55%,日间精密度为1.12%~4.51%,对市售肉制品中磷酸盐含量进行检测,核磁共振法测定结果准确,与离子色谱法无显著性差异(P>0.05)。该方法无需复杂的前处理操作,节约时间,定量准确,为肉制品中磷酸盐的定量测定提供了一种快速的新颖的方法。Abstract: A 31P-quantitative nuclear magnetic resonance (31P-qNMR) technique was established for determination of content of various phosphates in meat products. The samples were extracted twice with alkaline buffer salts, after shaking and centrifugation through the membrane, the target compounds quantified analysis by NMR using hexamethyl phosphoramide as internal standard. The results showed that: The recovery rates of phosphates were 97.0%~112.0%, and the RSDs were 0.87%~3.15%, the intra-day and inter-day precisions were 0.68%~3.55%, 1.12%~4.51%, respectively. The phosphates in commercial meat products were detected, and the qNMR measurement results were accurate. This method simplified sample pretreatment, saved time, quantified accurately, and had wider applicability for quantitative detection of phosphates in foods. It provides a new method for the quantitative determination of phosphates in meat products.
-
多聚磷酸盐是肉制品加工中常用的品质改良剂,有助于提高肉制品的保水性及嫩度,具有杀菌及抗氧化作用[1]。然而过量摄入磷酸盐可能会危害人体健康,有研究表明动物(大鼠)摄入过量磷酸盐会增加其患肺癌的风险[2]。目前我国批准使用的磷酸盐食品添加剂共有18种[3],在肉制品中广泛使用的有三聚磷酸盐、三偏磷酸盐、焦磷酸盐,三者通常按照不同比例混合使用[4]。《食品添加剂使用标准》规定在预制肉制品、熟肉制品、冷冻鱼糜制品(包括鱼丸等)中磷酸盐最大使用量为5.0 g/kg(单独或混合使用,以PO43−计) [3]。
目前有关磷酸盐的国家及行业检测标准有薄层层析法、钼蓝分光光度法、钒钼黄分光光度法及离子色谱法[5-8]。文献报道的检测方法还有流动注射分析(FIA)结合分光光度法[9]、毛细管电泳法[10]、快检试剂盒法[11]。然而,使用分光光度法时,需要通过消解将磷酸盐全部转换成正磷酸盐再进行测定,无论通过湿法消解、干法灰化还是亚硫酸钠还原,都无法测定除正磷酸盐离子之外的其它种类离子。离子色谱法易受基质干扰影响,且需要经过多个步骤提取及净化,耗费大量时间和试剂耗材,分析方法步骤繁琐、耗时长,易受其它阴离子影响。毛细管电泳方法易受到缓冲液溶度、pH、分离电压、温度等各方面因素影响,迁移时间重现性较差。快检试剂盒法虽不需要大型仪器,但其耗时长,准确度低。
近年来, 随着核磁共振技术(nuclear magnetic resonance,NMR)的发展,越来越多的科研工作者使用NMR来进行目标化合物的定性及定量[12-13]。在NMR定性定量研究中,1H-NMR谱应用最为广泛,其次是13C- NMR,31P-NMR应用较少,但是由于一般食品基质中含有31P原子的比例远小于1H,对于不含P原子的物质,基本不存在基质效应,因此31P -NMR在定性和定量方面,相比于1H-NMR和13C-NMR具有很大的优势[14]。
31P-NMR在食品分析中的应用广泛,包括橄榄油等级鉴定、畜禽肉新鲜度鉴别、牛奶中甘油磷酰胆碱定量测定、酪蛋白中磷脂酰丝氨酸定量测定、淀粉来源辨别、果蔬中有机磷农药定量测定等[15-18]。Stanley等 [19]对市售的三聚磷酸钠进行31P-NMR分析,鉴别出市售三聚磷酸钠中含有焦磷酸钠、三偏磷酸钠、磷酸氢二钠3种杂质,并定量测定其含量。Stanislawski等[20]使用31P-NMR定量测定三偏磷酸钠、四偏磷酸钠、磷酸氢二钠、焦磷酸钠,采集时间2 h,检出限为200 mg/kg;说明31P-NMR可用于磷酸盐的定量研究。
本研究详细讨论使用31P-NMR定量检测肉制品中磷酸盐的影响因素,选取六甲基磷酰三胺(hexamethylphosphoramide, HMPA)为内标的方法定量测定肉制品中磷酸盐。本方法旨在提供一种简便且不需要消耗有机试剂,不需复杂的提取及净化等前处理过程,可在没有标准品情况下快速定性定量测定肉制品中焦磷酸盐、磷酸盐、三偏磷酸盐、三聚磷酸盐含量的检测方法。
1. 材料和方法
1.1 材料与仪器
重水 美国Cambridge Isotope Laboratories公司;HMPA 美国Sigma-Aldrich公司;三偏磷酸根、三聚磷酸根、磷酸根、焦磷酸根 浓度均为1000 mg/L,美国O2si公司;三偏磷酸钠、三聚磷酸钠、磷酸钾、焦磷酸钠 纯度≥98.0%,上海阿拉丁生化科技股份有限公司;硼酸、乙二胺四乙酸二钠、氯化钾、氢氧化钠 均为分析纯,国药集团化学试剂有限公司。
Bruker Avance III HD 600 MHz波谱仪配备PABBO 600S3 BBF-H-D-05 Z SP探头 德国布鲁克公司;核磁管 5 mm,美国Norell公司;ICS-5000+型离子色谱仪 美国赛默飞世尔公司;230Volt型涡旋振荡器 美国Talboys公司;S210型酸度计 美国梅特勒-托利多公司;S 180H超声波清洗仪(功率为1000 W) 德国艾尔玛公司;Milli-Q型超纯水机 法国密理博公司;GM200型刀式研磨仪 德国莱驰公司。
1.2 实验方法
1.2.1 核磁共振方法
1.2.1.1 碱性缓冲盐配制
试剂1:硼酸-氯化钾缓冲液(pH=9.0)。取硼酸3.09 g,用0.1 mol/L氯化钾溶液500 mL溶解,加0.1 mol/L氢氧化钠溶液210 mL。
试剂2:0.1 mol/L乙二胺四乙酸二钠。取29.224 g EDTA,加超纯水900 mL,用10 mol/L的NaOH溶液调节pH到9.0,使其完全溶解,再定容到1 L。
碱性缓冲盐:试剂1/试剂2(2/1,V/V)。
1.2.1.2 样品前处理
参照文献方法[21-22]并加以修改,取肉制品约100 g,切成约1 cm3的肉丁,用刀式研磨仪绞碎。称取约5.00 g绞碎的样品,加入碱性缓冲盐10 mL,涡旋振荡2 min,4 ℃下12000 r/min离心5 min,倒出上清液;用10 mL提取液重复提取并离心一次,合并两次上清液,转移到25 mL具塞比色管中,加入200 μL浓度为100 mg/mL的HMPA内标溶液,用碱性缓冲盐定容到25 mL,取2~3 mL上清液过0.45 μm滤膜,为待测液。用移液枪精密移取450 μL待测液至核磁管中,精密移取50 μL重水于核磁管中,将二者混匀,上机检测。
1.2.1.3 31P-NMR采样参数
31P-NMR采集条件:反转门控去耦脉冲序列zgig,采样点数TD:65536,扫描次数NS=64,延迟时间D1=12 s,采集时间AQ=1.9268 s,谱宽SW=70 ppm,O1P=5 ppm,O2P=4.7 ppm,P1=12 μs,增益RG=203,测定温度298 K。采用线宽因子为0.3 Hz的窗函数对原始的自由感应衰减信号(FID)进行傅里叶变换得到频域谱,然后用apk进行自动相位校正, abs进行自动基线平滑。
1.2.1.4 磷酸盐含量的测定
采用式(1)计算待测样品磷酸盐的含量:
mx=mstd⋅Mx⋅(Ax/nx)Mstd⋅(Astd/nstd) (1) 式中,mx为待测物含量;mstd为内标含量;Mx为待测物分子量;Mstd为内标分子量;Ax为待测物定量峰信号面积;Astd为内标物定量峰信号面积;nx为待测样品定量峰包含的磷原子数;nstd为内标物包含的磷原子数。
1.2.2 方法学考察
1.2.2.1 精密度实验
以火腿肠为基质,按照1.2.1的处理方法,同一样品1 d内连续测定6次,计算平均值,分析方法的日内精密度;连续测定5 d,每天测定6次并取平均值,分析方法的日间精密度。
1.2.2.2 回收率实验
平行称取火腿肠样品,用1.2.1的方法进行前处理。加入高中低三水平(0.50、2.0、5.0 g/kg)的磷酸盐,每个水平平行测定6次,计算回收率和相对标准偏差。
1.2.3 离子色谱法对比
1.2.3.1 前处理
参照GB 5009.256-2016的方法[8]。称取2.5 g火腿肠样品,用50 mmol/L氢氧化钠溶液洗入100 mL 比色管中混匀定容至刻度,80 ℃超声提取30 min,每隔 5 min 振摇一次, 保持固定相完全分散。冷却至室温后, 溶液经滤纸过滤; 取滤液于4 ℃下,8000 r/min 离心10 min,取上清液备用。取滤液15 mL,通过0.45 μm水性滤膜针头过滤器、Ag 柱和Na 柱,弃去前7 mL,收集后面洗脱液待测。
1.2.3.2 色谱分析条件
使用DionexIonPac AS19 型离子色谱柱(4 mm×250 mm) ,检测条件为:柱温30 ℃;流速1. 0 mL /min;进样量25 μL;氢氧化钾溶液梯度淋洗,0~10 min,25~60 mmol/L,10~28 min,保持60 mmol/L,28~30 min,60~25 mmol/L,30~35 min,保持25 mmol/L。
1.3 数据处理
数据处理使用TopSpin、MestReNova、Office及Origin软件。
2. 结果与分析
2.1 前处理条件优化
2.1.1 提取试剂的选择
比较了不同pH的缓冲盐及超纯水对肉制品中磷酸盐的提取效果。以1.0 mg/mL的焦磷酸钠为例,比较了其在pH=4.5醋酸缓冲盐、pH=7.0的超纯水、pH=9.0的硼酸缓冲盐下的化学位移(δ,ppm),分别为δ=−9.40 ppm、δ=−7.4 ppm、δ=−6.50 ppm,实验结果显示pH越大,其化学位移越大。在实际样品中,相同磷酸盐的化学位移会因为pH不同而导致化学位移变化,从而造成峰归属分类错误,因此不适合使用水去提取磷酸盐,而需采用缓冲盐提取。由于磷酸盐在酸性条件下容易发生水解,因此本实验最后选择pH=9.0的硼酸缓冲盐保持样品提取溶液pH稳定,进行磷酸盐提取。本实验还以焦磷酸钠和焦磷酸钾为例,比较了钠盐和钾盐的化学位移,在相同pH下,其化学位移相同。
2.1.2 净化方式
比较了C18固相萃取、Ag/H固相萃取小柱、CHCl3有机试剂沉淀、直接离心过膜上机共4种方法对磷酸盐测定含量的影响,结果表明4种方法测得的结果无显著性差异,说明31P-NMR在测定磷酸盐时,抗干扰能力强,无需复杂前处理即可进行测定。
2.2 NMR实验参数的选择
2.2.1 内标物的选择
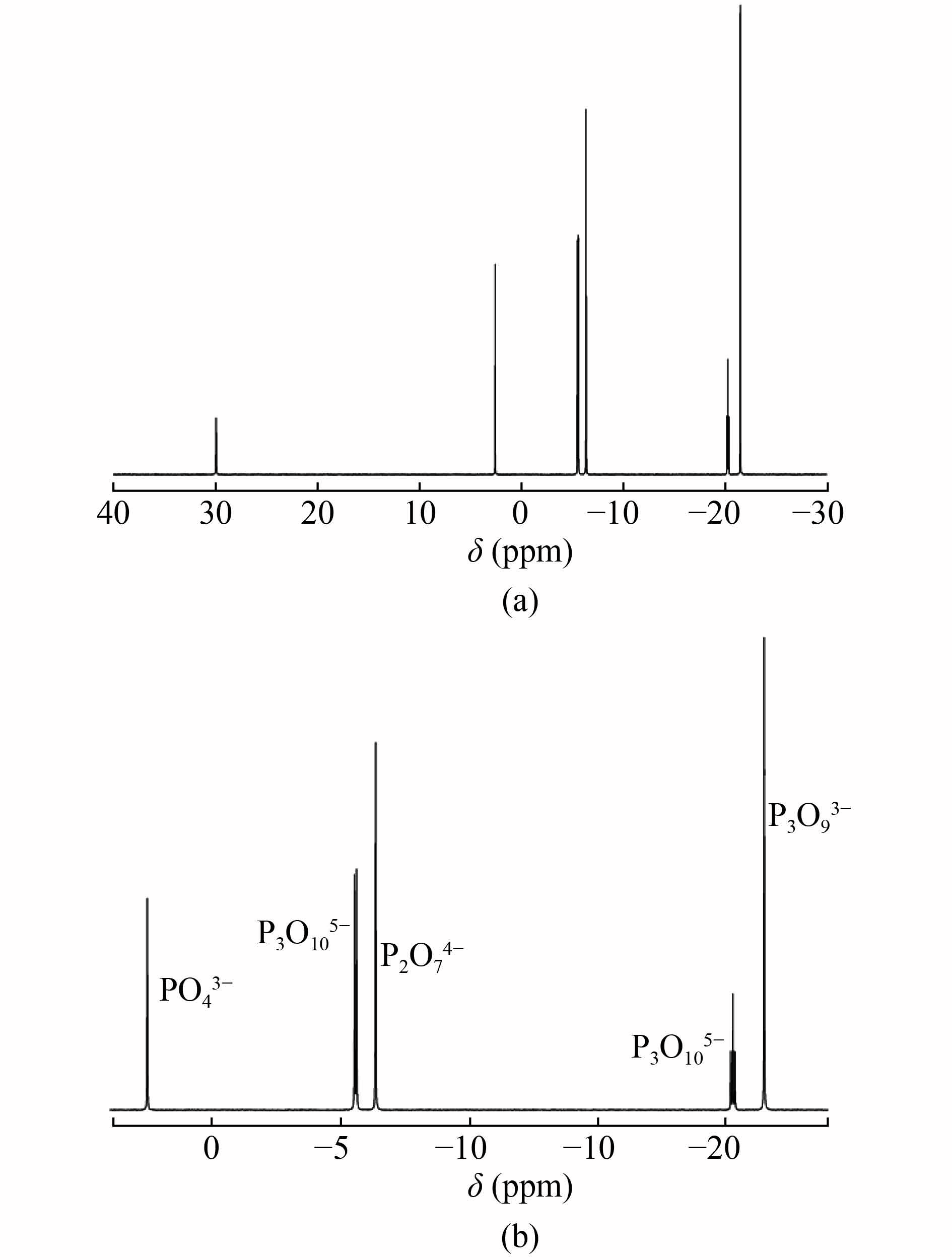
用于qNMR理想的内标应满足以下条件:内标的定量峰与待测样品的定量峰分离良好,易溶于测试溶剂,不与待测样品相互作用。常见的定量内标物有磷酸氢二钾、六甲基磷酰三胺、亚甲基二磷酸、磷酸三苯酯、三苯基膦等。不同磷酸盐的化学位移δ分布在5.0~−25.0 ppm,故宜选取内标物的化学位移δ大于10 ppm。综合考虑,本实验选取六甲基磷酰三胺(HMPA)为内标,其化学位移为29.91 ppm(使用H3PO3校准),与各目标化合物分离度好。4种磷酸盐和内标的图谱如图1所示。
2.2.2 延迟时间D1
使用标准序列t1irpg测定各化合物的弛豫时间T1,各化合物的T1如表1所示。一般认为当延迟时间D1≥5T1时,目标化合物的响应达到最大,此时定量准确。按照一般性要求,本实验D1的值需要设定为55 s。但过大的D1会导致单次扫描时间增加,分析时间显著加长。为了缩短单次扫描耗时间,本实验研究了在相同扫描次数下,D1分别为0.1、0.5、1.0、2.0、5.0、10、12、14、16、18、20、25、30、50、60 s时各化合物的的响应强度,实验结果表明当D1在0.1~12 s时,信号逐渐增强,但在12 s后信号无显著性差异(P>0.05),因此本实验将D1设为12 s。
表 1 各化合物的弛豫时间(T1)Table 1. Relaxation time (T1) of each compound化合物名称 化学位移δ(ppm) T1(s) PO43− 2.59 10.63 P3O93− −21.51 2.43 P2O74− −6.51 3.72 P3O105− −5.66~−5.58 2.35 −20.43~−20.27 1.59 HMPA 29.91 8.59 2.3 方法学考察
2.3.1 方法准确度分析
核磁定量分为外标法和内标法,本实验使用3种不同方法验证方法的准确性。配制4种磷酸盐(以阴离子根计)的混合标准曲线为40、100、300、500、800、1000、1500、2000 μg/mL,内标加入浓度为800 μg/mL。方法①:以4种磷酸盐定量峰信号强度为纵坐标y,以浓度为横坐标x,进行线性回归绘制曲线。方法②:以4种磷酸盐与内标物定量峰的信号强度比为纵坐标y,以4种磷酸盐与内标物浓度比为横坐标x轴,进行线性回归绘制曲线。方法③:使用内标绝对测定法(即本文的1.2.1.4公式),利用HMPA的峰面积和质量计算出其它4种磷酸盐的含量。
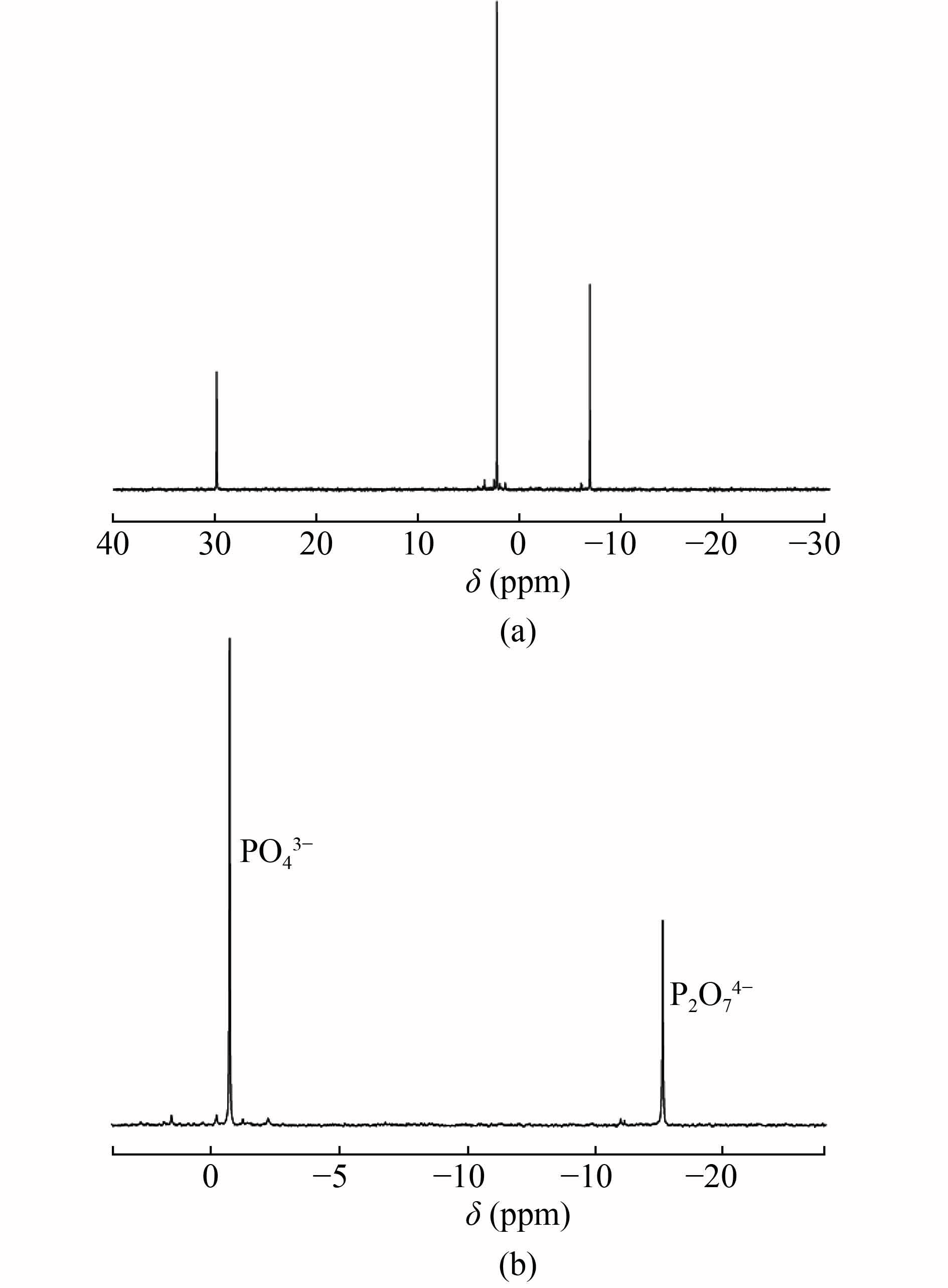
实验结果表明使用①和②时,y与x均成线性,且决定系数R2>0.999,线性方程及决定系数见表2。由表2看出31P-qNMR信号响应稳定,浓度与定量峰面积成正比。使用方法③内标定量,HMPA峰面积计算PO43−、P3O93−、P2O74−、P3O105−的含量分别为实际含量的112.0%、102.5%、103.2%、101.8%,表明该方法使用外标法和内标法计算结果均准确。使用内标绝对测定法不需要4种磷酸盐的标准品,且一次采集就可定量4种不同磷酸盐,因此文章选择第3种方法进行精密度、回收率等方法学实验。标准图谱及化学位移见图1标注,实际样品图谱见图2。
表 2 各化合物的线性方程及决定系数Table 2. Linear equations and coefficients of determination of compounds化合物名称 方法① 方法② PO43−(δ=2.59 ppm) y=44277x–11656, R²=0.9998 y=1.0117x+0.0788,R²=0.9994 P2O74−(δ=−6.51 ppm) y=109899x–57344, R²=0.9999 y=0.5622x−0.0848, R²=0.9996 P3O93−(δ=−21.51 ppm) y=199705x+8955, R²=0.9999 y=0.4288x−0.0776, R²=0.9993 P3O105−(δ=−5.66~−5.58 ppm) y=94549x+57623, R²=0.9999 y=0.4744x+0.0626, R²=0.9999 P3O105−(δ=−20.43~20.27 ppm) y=64874x+1633, R²=0.9999 y=0.7524x+0.1292, R²=0.9997 2.3.2 精密度分析
参照吉鑫等[23]定量测定食品中水苏糖的精密度分析方法并加以改动。按照本文1.2.2.1的方法进行测试,采用HMPA内标法测定肉制品中磷酸盐的日内精密度为0.68%~3.55%,日间精密度为1.12%~4.51%,且日内与日间两者磷酸盐测定结果无显著性差异,方法精密度高。
2.3.3 回收率实验
采用本文1.2.2.2的方法进行测定。往基质中添加高中低三水平的磷酸盐,每个水平平行测定6次,计算回收率和相对标准偏差。结果如表3所示,采用HMPA内标法测定肉制品中磷酸盐的回收率为97.0%~112.0%,RSD为0.87%~3.15%。
表 3 加标回收率及相对标准偏差Table 3. standard addition recoveries and relative standard deviations of the methods化合物名称 基质含量(g/kg) 添加水平(g/kg) 实测含量(g/kg) 回收率(%) RSD(%) PO43− 2.68 0.50 3.21 106.0 2.13 2.00 4.62 97.0 1.15 5.00 7.58 98.0 1.56 P3O93− 0 0.50 0.55 110.0 3.11 2.00 1.98 99.0 2.18 5.00 5.28 105.6 0.96 P3O105− 0 0.50 0.56 112.0 3.15 2.00 2.08 104.0 2.65 5.00 4.92 98.4 2.14 P2O74− 0.48 0.50 0.52 104.0 1.68 2.00 2.21 110.5 0.98 5.00 5.11 102.2 0.87 2.3.4 检出限
肖坤等[24]在使用1H-NMR测定食用油中的脂肪酸时指出qNMR方法的定量限很难达到英国药典要求的S/N≥150,并认为依据中国药典四部通则(2015版)规定,以信噪比为 3 或 2 时的相应浓度确定检出限。本研究使用31P-NMR也难以达到S/N≥150的要求,因此本研究未明确评价定量限,以信噪比 S /N≥2确定检出限。依照1.2.1.3的方法测试,扫描时间为14 min 53 s,PO43−、P3O93−、P2O74−、P3O105−的检出限分别为0.15、0.15、0.15、0.30 g/kg。
2.3.5 方法比对
使用1.2.1的核磁共振方法和1.2.3离子色谱法分别对10份市售火腿肠进行含量测试,结果如表4所示,两种检测方法的含量无显著性差异,进一步验证31P-NMR方法准确、可靠。结果也表明在肉制品中磷酸盐含量普遍较高,这与文献的报告结果一致[4]。
表 4 不同检测方法的含量对比Table 4. Content comparison of different detection methods样品编号 样品中各离子的含量(g/kg) PO43− P2O74− P3O93− P3O105− 1 4.55a4.83b 0.80a0.87b 0a0b 0a0b 2 4.91a4.53b 0.16a0.15b 0a0b 0a0b 3 0.62a0.59b 0a0b 0a0b 0a0b 4 3.90a3.54b 0.84a0.78b 0a0b 0a0b 5 4.95a4.67b 1.66a1.56b 0a0b 0a0b 6 2.68a2.93b 0.49a0.52b 0a0b 0a0b 7 3.34a3.02b 0.88a0.80b 0a0b 0a0b 8 3.54a3.96b 0.62a0.69b 0a0b 0a0b 9 4.72a4.65b 1.38a1.42b 0a0b 0a0b 10 3.50a3.34b 0.61a0.59b 0a0b 0a0b 注:a为核磁共振法结果,b为离子色谱法结果。 3. 结论
本研究以HMPA为内标,利用31P-NMR方法,加标回收率为97.0%~112.0%,相对标准偏差0.87%~3.15%。日内精密度为0.68%~ 3.55%,日间精密度为1.12%~4.51%。该方法与离子色谱法[8]相比不需消耗有机试剂,不需复杂的提取及净化等前处理过程,在没有标准品情况下,可快速定性定量测定肉制品中焦磷酸盐、磷酸盐、三偏磷酸盐、三聚磷酸盐,单个样品的检测时间为14 min 53 s,与离子色谱法[8]单个样品检测时间60 min相比,极大缩短了检测时间,检测效率显著提高,是一种新颖的检测方法,对肉制品中磷酸盐的定量测定具有很好的准确性和广泛的适用性。然而31P-qNMR也存在一定的缺陷,比如灵敏度不高,对微量成分进行准确定量仍存在难度,需进一步开发适合31P检测的高灵敏度的探头;并且核磁共振设备的普及率远不及其它色谱仪器,限制了这项技术的广泛应用。但是,随着核磁技术的不断进步、灵敏度不断的提高,定量核磁共振技术必然会迎来广阔的应用前景。
-
表 1 各化合物的弛豫时间(T1)
Table 1 Relaxation time (T1) of each compound
化合物名称 化学位移δ(ppm) T1(s) PO43− 2.59 10.63 P3O93− −21.51 2.43 P2O74− −6.51 3.72 P3O105− −5.66~−5.58 2.35 −20.43~−20.27 1.59 HMPA 29.91 8.59 表 2 各化合物的线性方程及决定系数
Table 2 Linear equations and coefficients of determination of compounds
化合物名称 方法① 方法② PO43−(δ=2.59 ppm) y=44277x–11656, R²=0.9998 y=1.0117x+0.0788,R²=0.9994 P2O74−(δ=−6.51 ppm) y=109899x–57344, R²=0.9999 y=0.5622x−0.0848, R²=0.9996 P3O93−(δ=−21.51 ppm) y=199705x+8955, R²=0.9999 y=0.4288x−0.0776, R²=0.9993 P3O105−(δ=−5.66~−5.58 ppm) y=94549x+57623, R²=0.9999 y=0.4744x+0.0626, R²=0.9999 P3O105−(δ=−20.43~20.27 ppm) y=64874x+1633, R²=0.9999 y=0.7524x+0.1292, R²=0.9997 表 3 加标回收率及相对标准偏差
Table 3 standard addition recoveries and relative standard deviations of the methods
化合物名称 基质含量(g/kg) 添加水平(g/kg) 实测含量(g/kg) 回收率(%) RSD(%) PO43− 2.68 0.50 3.21 106.0 2.13 2.00 4.62 97.0 1.15 5.00 7.58 98.0 1.56 P3O93− 0 0.50 0.55 110.0 3.11 2.00 1.98 99.0 2.18 5.00 5.28 105.6 0.96 P3O105− 0 0.50 0.56 112.0 3.15 2.00 2.08 104.0 2.65 5.00 4.92 98.4 2.14 P2O74− 0.48 0.50 0.52 104.0 1.68 2.00 2.21 110.5 0.98 5.00 5.11 102.2 0.87 表 4 不同检测方法的含量对比
Table 4 Content comparison of different detection methods
样品编号 样品中各离子的含量(g/kg) PO43− P2O74− P3O93− P3O105− 1 4.55a4.83b 0.80a0.87b 0a0b 0a0b 2 4.91a4.53b 0.16a0.15b 0a0b 0a0b 3 0.62a0.59b 0a0b 0a0b 0a0b 4 3.90a3.54b 0.84a0.78b 0a0b 0a0b 5 4.95a4.67b 1.66a1.56b 0a0b 0a0b 6 2.68a2.93b 0.49a0.52b 0a0b 0a0b 7 3.34a3.02b 0.88a0.80b 0a0b 0a0b 8 3.54a3.96b 0.62a0.69b 0a0b 0a0b 9 4.72a4.65b 1.38a1.42b 0a0b 0a0b 10 3.50a3.34b 0.61a0.59b 0a0b 0a0b 注:a为核磁共振法结果,b为离子色谱法结果。 -
[1] 闫家荫, 刘瑞英, 康明丽. 复合磷酸盐在肉制品中的应用及研究进展[J]. 农产品加工,2020(2):82−84. [2] Jin H, Xu C X, Lim H T, et al. High dietary inorganic phosphate increases lung tumorigenesis and alters Akt signaling[J]. American journal of respiratory and critical care medicine,2009,179(1):59−68. doi: 10.1164/rccm.200802-306OC
[3] 国家卫生和计划生育委员会. GB 2760-2014食品安全国家标准食品添加剂使用标准[S]. 北京: 中国标准出版社, 2014. [4] 刘佳, 沈娟, 詹玮, 等. 采用离子色谱检测肉及肉制品中多聚磷酸盐[J]. 食品与发酵工业,2017,43(9):215−218. [5] 国家标准化管理委员会, 国家质量监督检验检疫总局. GB/T 9695.9-2009 肉与肉制品聚磷酸盐测定[S]. 中国标准出版社, 2009. [6] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.87-2016 食品安全国家标准食品中磷的测定[S]. 中国标准出版社, 2016. [7] 国家质量监督检验检疫总局. SN/T 4590-2016出口水产品中焦磷酸盐、三聚磷酸盐、三偏磷酸盐含量的测定离子色谱法[S]. 中国标准出版社, 2017. [8] 国家卫生和计划生育委员会. GB 5009.256-2016食品安全国家标准食品中多种磷酸盐的测定[S]. 中国标准出版社, 2016. [9] Gimbert L J, Haygarth P M, Worsfold P J. Determination of nanomolar concentrations of phosphate in natural waters using flow injection with a long path length liquid waveguide capillary cell and solid-state spectrophotometric detection[J]. Talanta,2007,71(4):1624−1628. doi: 10.1016/j.talanta.2006.07.044
[10] Jastrzębska A, Hol A, Szłyk E. Simultaneous and rapid determination of added phosphorus (V) compounds in meat samples by capillary isotachophoresis[J]. LWT-Food Science and Technology,2008,41(10):2097−2103. doi: 10.1016/j.lwt.2007.11.015
[11] Wijnker J J, Tjeerdsma-van Bokhoven J L M, Veldhuizen E J A. Phosphate analysis of natural sausage casings preserved in brines with phosphate additives as inactivating agent-Method validation[J]. Meat Science,2009,81(1):245−248. doi: 10.1016/j.meatsci.2008.07.027
[12] 周霞云. 分散液相微萃取-定量核磁共振 31P谱测定农田土壤中有机磷农药残留[D]. 南京: 南京农业大学, 2017. [13] 罗敬. 利用核磁共振法分析几种含磷物质中磷的形态与含量[D]. 长沙: 湖南师范大学, 2015. [14] 严伟. 果蔬中多农残19F和31P NMR定量检测方法的研究[D]. 北京: 北京化工大学, 2013. [15] Spyros A, Dais P. 31P NMR spectroscopy in food analysis[J]. Progress in Nuclear Magnetic Resonance Spectroscopy,2009,54(3-4):195−207. doi: 10.1016/j.pnmrs.2008.09.002
[16] Rigger R, Rück A, Hellriegel C, et al. Certified reference material for use in 1H, 31P, and 19F quantitative NMR, ensuring traceability to the International System of Units[J]. Journal of AOAC International,2017,100(5):1365−1375. doi: 10.5740/jaoacint.17-0093
[17] Stücker A, Podschun J, Saake B, et al. A novel quantitative 31P NMR spectroscopic analysis of hydroxyl groups in lignosulfonic acids[J]. Analytical Methods,2018,10(28):3481−3488. doi: 10.1039/C8AY01272E
[18] 周凝, 刘宝林, 王欣. 核磁共振技术在食品分析检测中的应用[J]. 食品工业科技,2011,32(1):325−329. [19] Sojka S A, Wolfe R A. Analysis of commercial sodium tripolyphosphates by phosphorus-31 Fourier transform nuclear magnetic resonance spectrometry[J]. Analytical Chemistry,1978,50(4):585−587. doi: 10.1021/ac50026a011
[20] Stanislawski D A, Van Wazer J R. Determination of phosphorus compounds by phosphorus-31 Fourier transform nuclear magnetic resonance spectrometry[J]. Analytical Chemistry,1980,52(1):96−101. doi: 10.1021/ac50051a023
[21] Hrynczyszyn P, Jastrzębska A, Szłyk E. Determination of phosphate compounds in meat products by 31-phosphorus nuclear magnetic resonance spectroscopy with methylenediphosphonic acid after alkaline extraction[J]. Analytica Chimica Acta,2010,673(1):73−78.
[22] Szłyk E, Hrynczyszyn P. Phosphate additives determination in meat products by 31-phosphorus nuclear magnetic resonance using new internal reference standard: Hexamethylphosphoroamide[J]. Talanta,2011,84(1):199−203. doi: 10.1016/j.talanta.2010.12.046
[23] 吉鑫, 樊双喜, 杨彤晖, 等. 核磁共振法测定食品中水苏糖的含量[J]. 食品与发酵工业,2019,45(19):251−257. [24] 肖坤, 龚灿, 郭强胜, 等. 定量核磁共振碳谱同时测定食用油中甘油三酯的sn-1, 3和sn-2脂肪酸含量[J]. 分析化学,2020,48(6):802−812. -
期刊类型引用(7)
1. 屠相土,李俊,雷虹,徐玲萍,曾茂法. 定量核磁共振磷谱同时测定浓维磷糖浆中甘油磷酸钠和磷酸的含量. 分析化学. 2024(07): 1020-1027 .  百度学术
百度学术
2. 周晓力,李增鑫,刘万卉,尹利辉. 核磁共振技术的定量方法综述. 药物分析杂志. 2024(10): 1655-1664 .  百度学术
百度学术
3. 卢丽娟,赵静,毕静莹. 微波消解-连续流动分析法测定肉类食品中的磷. 中国无机分析化学. 2023(02): 177-182 .  百度学术
百度学术
4. 朱松松,李贝贝,吴婉琴,夏金涛,江丰,王会霞. ASSURE-NMR-HSQC实验检测保健食品中西地那非类物质. 化学研究与应用. 2023(06): 1487-1492 .  百度学术
百度学术
5. 黄挺,吴华鑫. 氟磷谱定量核磁共振法进展综述. 计量科学与技术. 2023(05): 9-15 .  百度学术
百度学术
6. 夏金涛,黄秀秀,朱松松,朱芊,李贝贝,江丰. 基于~1H-qNMR的水溶性镧系位移试剂识别法测定功能性食品中谷氨酰胺对映体. 中国食品卫生杂志. 2023(11): 1579-1586 .  百度学术
百度学术
7. 朱松松,夏金涛,朱芊,程银棋,江丰,王会霞. 定量核磁共振技术检测食品中硼的含量. 中国食品卫生杂志. 2022(04): 687-692 .  百度学术
百度学术
其他类型引用(2)






 下载:
下载:
 下载:
下载:



