Screening of Protective Agent and Bioactivity Analysis of Bread Yeast Freeze-dried Powder
-
摘要: 目的:优化真空冷冻干燥过程中保护剂配方,得到发酵性能较好的面包酵母3G-28冻干粉。方法:在对脱脂奶粉、蔗糖、吐温−80、阿拉伯胶、β-环状糊精、甘油单因素实验基础上,采用响应面实验对复合冻干保护剂的配方进行了优化,并对酵母冻干粉的发酵力、海藻糖含量、蔗糖酶活力以及发酵液中的风味物质进行了研究。结果:各因素对面包酵母冻干粉活菌数量影响顺序为:甘油浓度 > 蔗糖浓度 > 脱脂奶粉浓度 > β-环状糊精浓度;最佳复合冻干保护剂的配方为:甘油4.7%,脱脂奶粉20%,β-环状糊精15%,蔗糖5%;面包酵母冻干粉活菌数量为36.89×109 个/mL。面包酵母3G-28冻干粉的发酵能力为214 mg/h/g干酵母,海藻糖含量为44.22 mg/g干酵母,蔗糖酶活力20.27 U/g干酵母,与市售酵母菌冻干粉和初始菌株酵母冻干粉相比表现出较高的生物活性。在风味物质方面,面包酵母3G-28冻干粉与其它两者相比醇类的含量最高,表现出了良好的实用性。结论:本文探讨了面包酵母3G-28冻干粉的最佳冻干保护剂配方,得到了生物活性较优的面包酵母冻干粉,在改善面包产品品质及微生物工业化应用中具有很好的前景。Abstract: Objective:The formulation of protective agent added in vacuum freeze-drying process was optimized to obtain bread yeast 3G-28 freeze-drying powder with good fermentation performance.Methods:On the basis of single factor experiments of skim milk powder, sucrose, Tween-80, Arabic gum, cyclodextrin and glycerin, the formula of compound freeze-drying protectant was optimized by response surface experiment, and the ferment power, trehalose content, sucrase activity and flavor in fermentation liquid of yeast freeze-drying powder were studied.Results:The order of influence of each factor on the number of viable bacteria in bread yeast freeze-dried powder was as follows: The concentration of glycerol > the concentration of sucrose > the concentration of skim milk powder > the concentration of β-cyclodextrin. The formula of the best compound freeze-drying protective agent was as follows: Glycerin 4.7%, skimmed milk powder 20%, β-cyclodextrin 15%, sucrose 5%. The viable quantity of bread yeast freeze-dried powder was 36.89×109 PCS / mL. The fermentation capacity of baker's yeast 3G-28 freeze-dried powder was 214 mg/h/g, the content of trehalose was 44.22 mg/g, and the activity of sucrase was 20.27 U/g. Compared with the freeze-dried powder of commercially available yeast and the freeze-dried powder of the initial strain of yeast, the yeast showed higher biological activity. In terms of flavor, the content of alcohol in bread yeast 3G-28 freeze-dried powder was the highest compared with the other two, showing good practicability.ConclusionThe optimum formulation of the baker's yeast 3G-28 freeze-drying powder was studied, and the baker's yeast freeze-drying powder with better biological activity was obtained, which had a good prospect in improving the quality of bread products and in the application of microbial industrialization.
-
Keywords:
- bread yeast /
- freeze-dried powder /
- protectant /
- fermentability /
- bioactivity /
- GC-MS /
- flavor
-
面包酵母(S.cerevisiae)是重要的工业微生物,广泛地应用于人类主食的制作,如作为优良的发酵剂和营养剂用于包子、糕点、面包等面食产品[1-2]。在面包烘培工业中,面包酵母可以在较短的发酵时间内产生二氧化碳使面团膨胀,形成内相柔软的面包,并且在发酵过程中,代谢产生醇类、羟基化合物和乙酸乙酯等风味物质。这些风味物质在焙烤过程中,通过氨基酸和糖的反应得到吡嗪类化合物,赋予了面包制品的独特风味[3-4]。在现代食品工业领域,将新鲜的酵母菌通过干燥技术制备成活性酵母粉是一种可行的制剂化方法。有研究表明,与其它干燥方法相比,真空冷冻干燥具有保持微生物较高的存活率,避免杂菌污染而且携带方便等特点[5-8]。
然而,在冷冻干燥过程中酵母菌会受到预冷、冰晶、高渗透压、细胞脱水等因素的影响,导致其存活率降低或者生物活性丧失。因此,在冷冻干燥过程中,选择恰当保护剂十分重要[9-12]。常见的保护剂有糖、醇、脱脂乳等[13-15]。龙艳珍等[16]研究了棘孢木霉的真空冷冻方法,通过实验发现,加入保护剂后,经冷冻干燥得到的菌株的存活率达到81.25%,并保持较高的活性水平。陈胜杰等[17]以脂乳粉、低聚木糖、可溶性淀粉和VC钠盐为基础,采用正交实验研究复合冻干保护剂,发现复合保护剂能够有效提高三株实验菌株的冻干存活率,且活菌数均高于1.0×108 CFU/g。叶鹏等[12]通过SDS-PAGE凝胶电泳发现,抗冻剂对细胞超微结构均有不同程度的冷冻修复作用,修复后的细胞壁变厚。张雅硕等[18]在副干酪乳杆菌冷冻干燥工艺中加入由脱脂奶粉、蔗糖、聚乙烯吡咯烷酮、谷胱甘肽组成的复合保护剂,实验发现副干酪乳杆菌经真空冷冻干燥后存活因子达(0.998±0.001),活菌数为(2.35 ± 0.02)×1011 CFU/g。经电镜观察发现菌体形态饱满,结构完整,菌体活性保持良好。于红等[19]以植物乳杆菌发酵枸杞浆为研究对象,通过优化得到最佳复配保护剂组合为:20%麦芽糊精、14%乳糖、6%海藻糖。在此条件下,益生菌发酵枸杞冻干粉后活菌数达9.6 lg CFU/g,含水量低于3%,色泽完好,复水性强,产品质量佳。目前,关于面包酵母菌冷冻干燥保护剂的研究少有报道。
以实验室筛选改良的面包酵母菌种3G-28为对象,以脱脂奶粉、蔗糖、甘油和β-环状糊精为复合保护剂,进行面包酵母冻干粉制作,对面冻干菌粉的发酵力、海藻糖含量、蔗糖酶活力以及发酵液中的风味物质进行了研究,旨在得到性能优良的酵母冻干粉,为微生物工业化应用以及酵母冷冻干燥保护剂的作用机理研究提供一定的科学参考。
1. 材料与方法
1.1 材料与仪器
面包酵母BY-3、3G-28 均为实验室保存;市售酵母Ⅰ、Ⅱ、Ⅲ号 安琪酵母有限股份公司;脱脂奶粉 BD医疗器械(上海)有限公司;蔗糖(分析纯) 北京奥博星生物技术有限责任公司;阿拉伯胶(分析纯) 北京Bio-topped科技有限公司;吐温-80(分析纯) 北京益利精细化学品有限公司;β-环状糊精(食品级) 孟州市华兴生物化工有限责任公司。
YOD-203真空冷冻干燥机 美国Thermo公司;3K15高速冷冻离心机 美国Sigma公司;6890N-5975i气相色谱-质谱(GC-MS)联用仪 美国Agilent公司;SPME(CAR/PDMS, 75 μm) 美国Supelco公司。
1.2 实验方法
1.2.1 酵母菌的培养
菌种增殖培养:取面包酵母3G-28的斜面菌种,用接种环挑取一环,无菌条件下接种于YPD培养基[20]中,恒温30 ℃,摇床转速150 r/min,培养36 h。
1.2.2 酵母冻干粉的制备
取培养好的酵母菌液,于6000 r/min离心10 min,收集菌体沉淀,用无菌水清洗并稀释到0.1 g/mL。按菌液与保护剂比例(v/v) 为1:5加入保护剂,用透气膜封口后进行预冻,先置于−20 ℃,8 h,再置于−40 ℃,12 h,样品冻结完全后放入冷冻温度为−50 ℃,真空度100 mBar的真空冷冻干燥机内冻干24 h,然后真空封装,于4 ℃冰箱中储存。
1.2.3 离心条件的确定
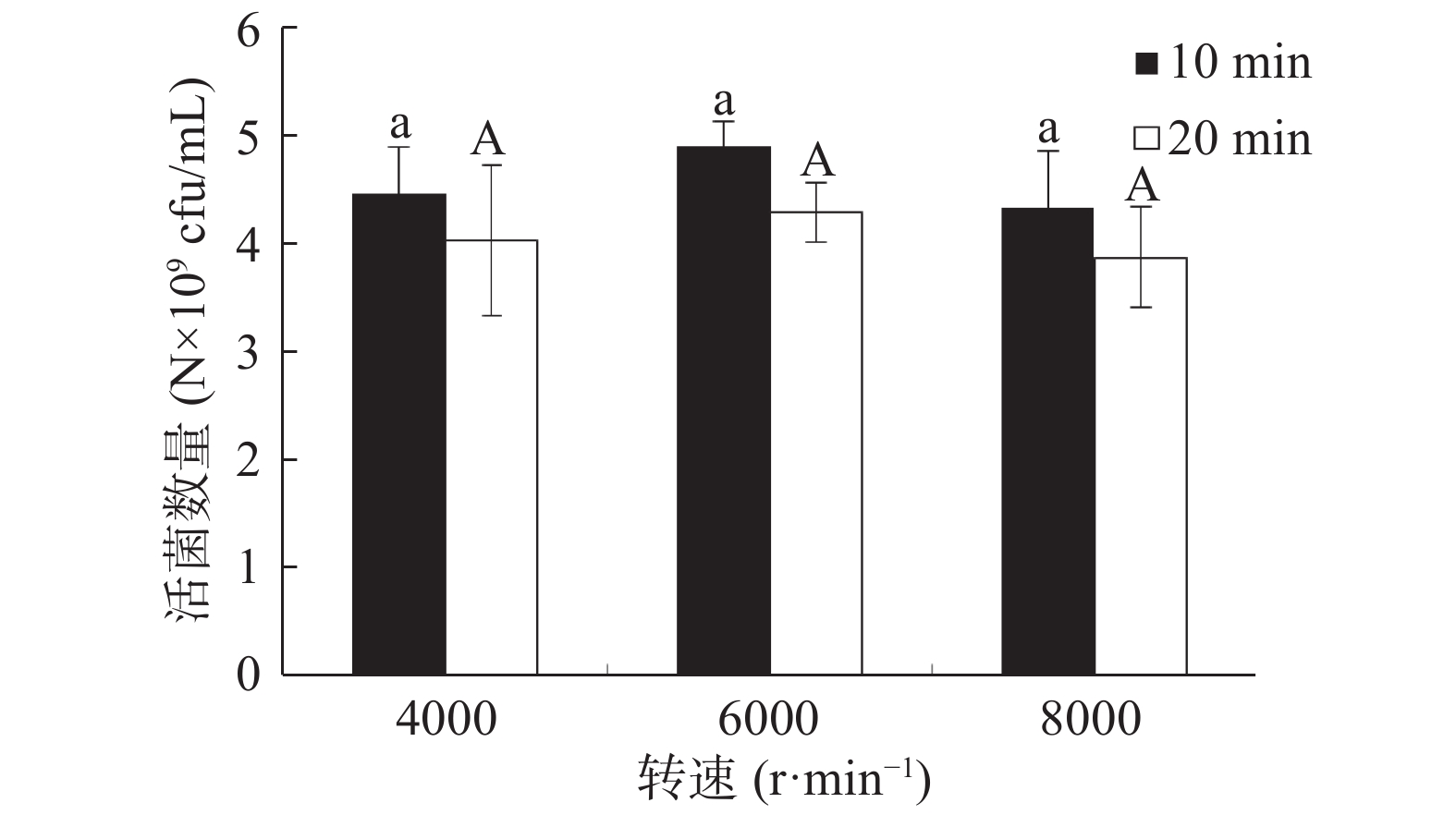
将酵母菌液分别在转速为4000、6000、8000 r/min条件下离心10、20 min,得到的酵母泥用无菌水水洗两次,均匀涂布在YPD固体培养基上,30 ℃下静置培养24 h后,测定酵母活菌数量。
1.2.4 保护剂配比的确定
1.2.4.1 单一保护剂的筛选
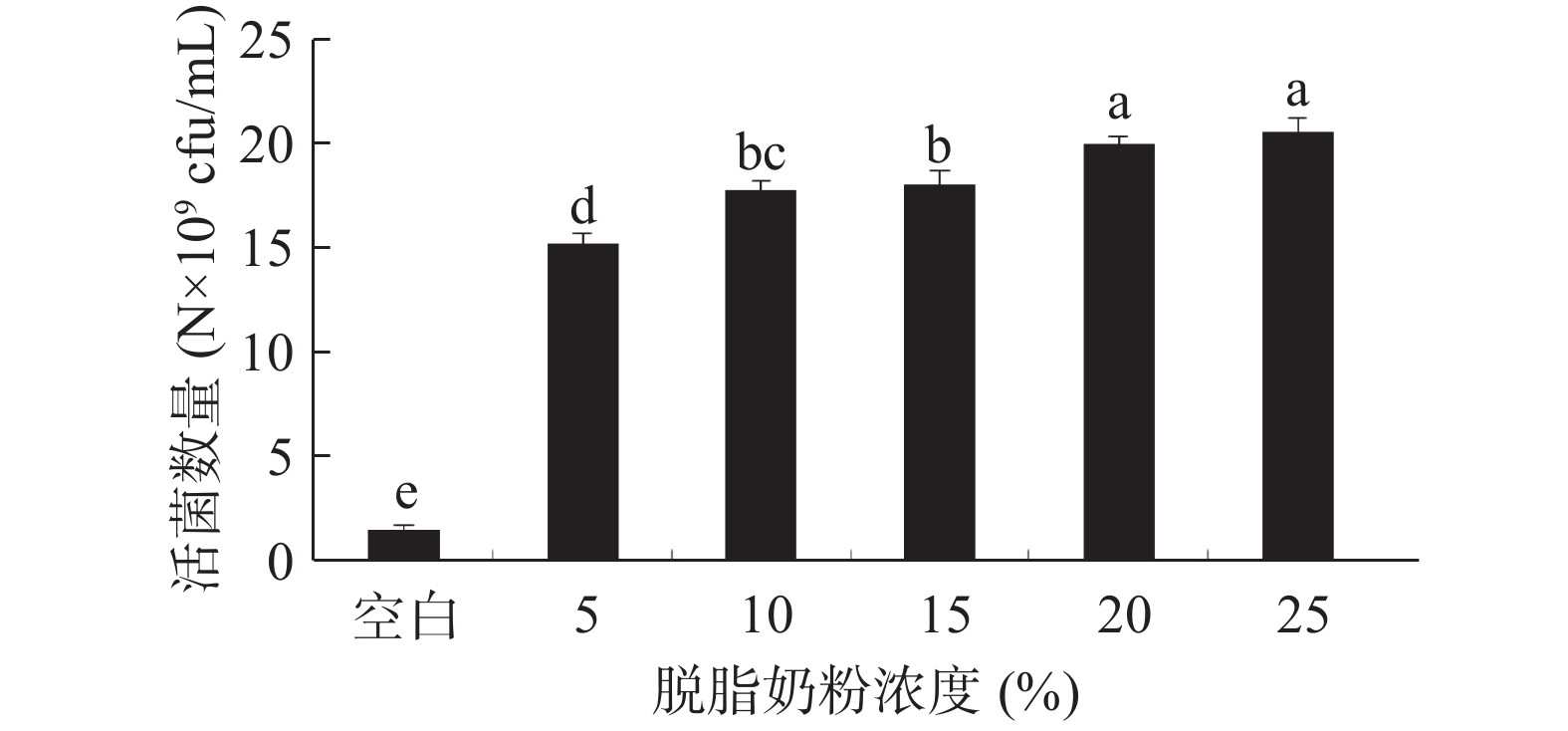
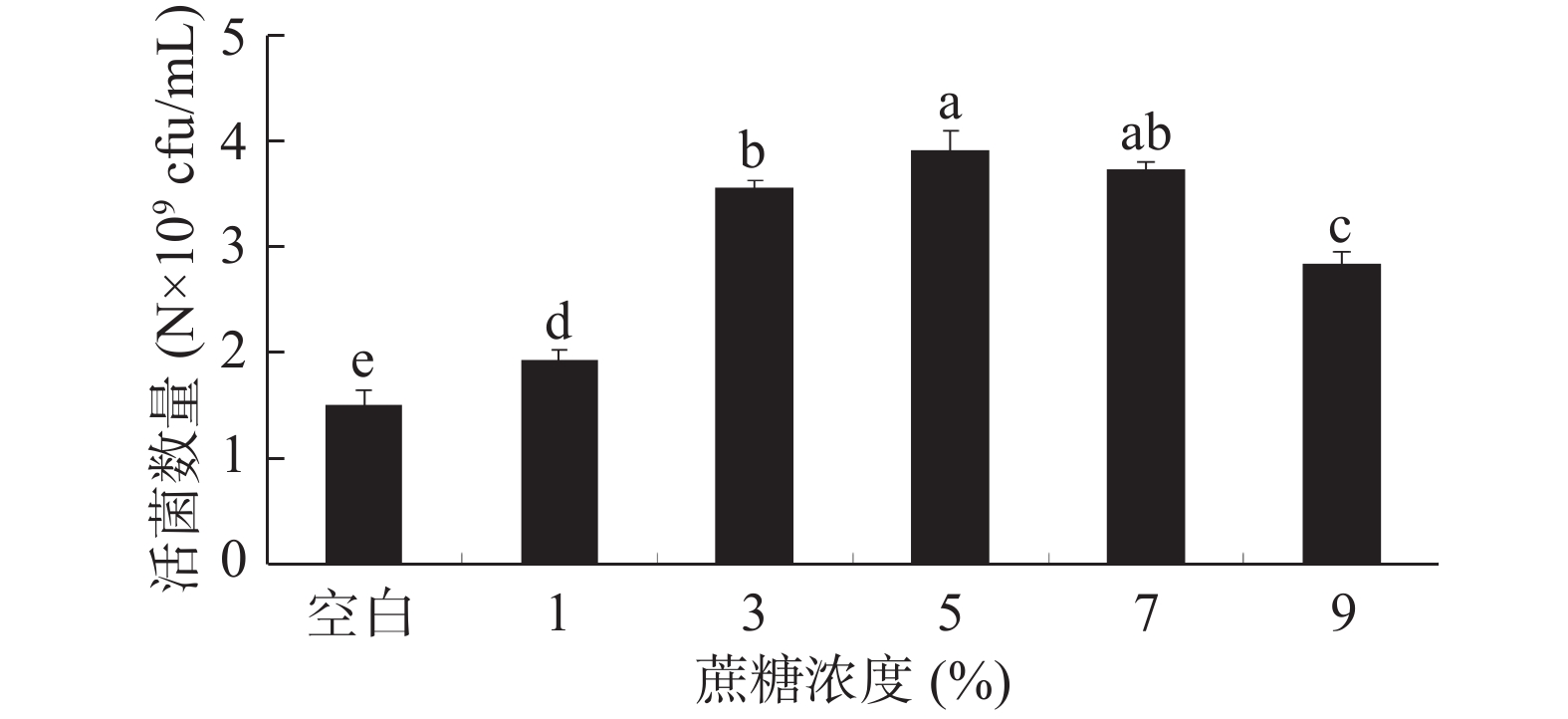
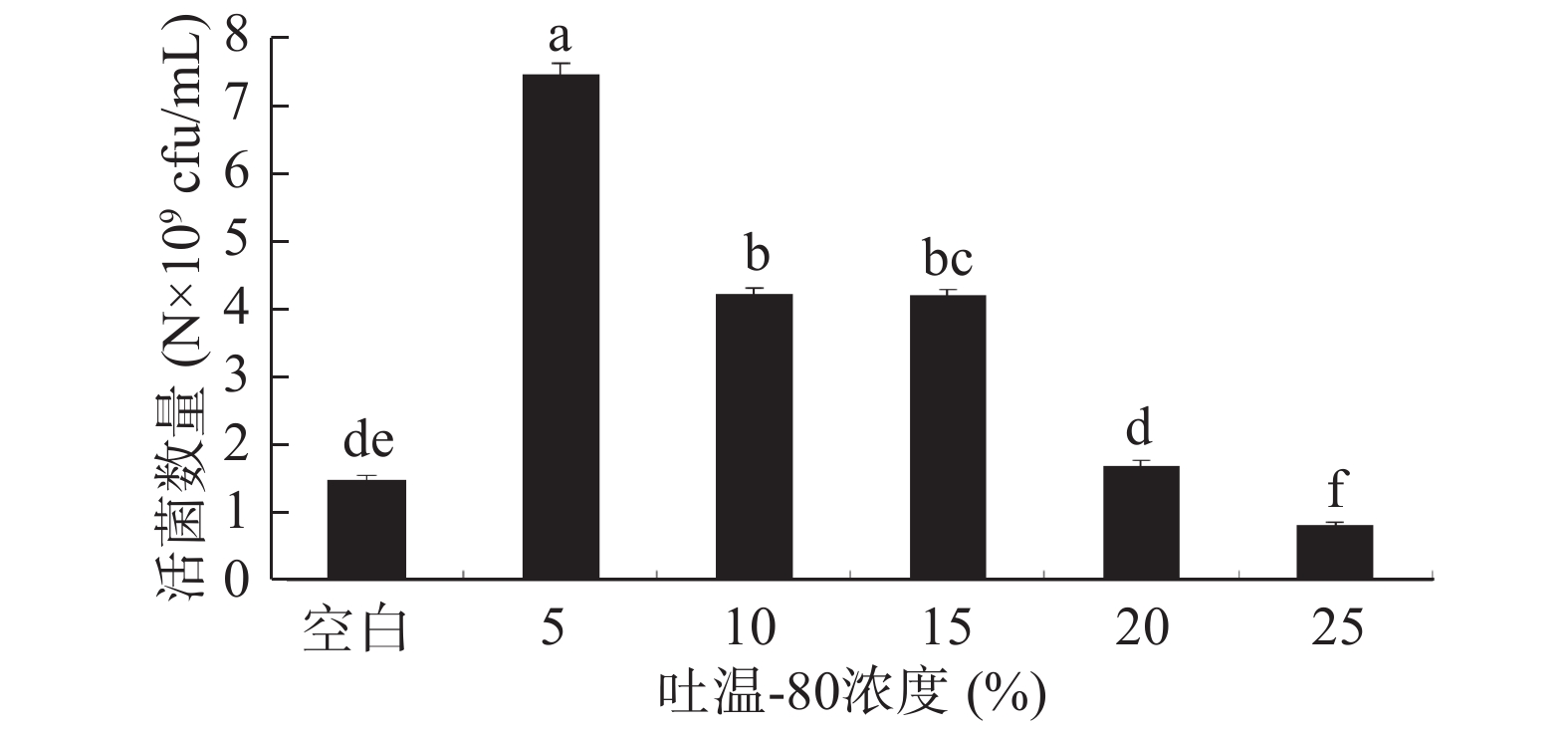
本实验选择低分子和高分子共6种不同的保护剂,通过活菌计数法考察单个保护剂在不同浓度下的保护效果。活菌数量多者说明此保护剂在该浓度下的保护效果优于活菌数量较低者。将6种保护剂加入无菌水配制到所需浓度(w/v),具体为:脱脂奶粉浓度(5%、10%、15%、20%、25%),蔗糖浓度(1%、3%、5%、7%、9%),吐温−80浓度(5%、10%、15%、20%、25%),阿拉伯胶浓度(5%、10%、15%、20%、25%),β-环状糊精浓度(5%、10%、15%、20%、25%),甘油浓度(1%、3%、5%、7%、9%),于121 ℃灭菌20 min,其中脱脂奶粉灭菌温度为115 ℃,10 min。按照1.2.2的方法制备酵母冻干粉,并测定活菌数量。
1.2.4.2 响应面试验优化
根据响应面分析软件提供的模型,选取:A(甘油浓度)、B(脱脂奶粉浓度)、C(β-环状糊精浓度)、D(蔗糖浓度)四个因素为变量,酵母菌的活菌数量为响应值,设计四因素三水平的实验,实验因素与水平的取值表见表1。
表 1 响应面试验因素水平表Table 1. Factors and levels table of response surface experiment因素 水平 −1 0 1 A甘油浓度(%) 4 5 6 B脱脂奶粉浓度(%) 15 20 25 C β-环状糊精浓度(%) 13 15 17 D蔗糖浓度(%) 4 5 6 1.2.5 酵母活菌数量的测定
选用平板计数法作为实验过程中酵母活菌数量的测定方法,采用十倍稀释法适当稀释发酵液,取1 mL发酵液加入9 mL无菌水混匀,再取1 mL稀释的发酵液加入9 mL无菌水,重复稀释6~7次。将稀释液均匀涂布在YPD固体培养基上,恒温30 ℃,培养24 h后,进行平板计数(30~ 300 CFU/mL范围内),求得单位酵母活菌数量。
1.2.6 发酵力的测定
本研究采用失重法[21]对制得的BY-3、3G-28、市售Ⅰ,市售Ⅱ,市售Ⅲ五种酵母冻干粉进行发酵力(F)的测定。
用量筒量取50 mL LF培养基,加入1.0 g活化后的酵母,将锥形瓶置于30 ℃恒温摇床上,150 r/min培养3 h,每30 min记录质量,用重量的变化来表示酵母发酵力大小,见式(1):
F=(x1−x2)/(t×m) (式(1)) 式中:F为菌种的发酵力,mg/(h•g);x1为发酵前锥形瓶的重量,mg;x2为发酵后锥形瓶的重量,mg;t为发酵时间,h;m为添加酵母的重量,g。
1.2.7 海藻糖含量的测定
称取1.0 g酵母粉放入干燥离心管中,加入三氯乙酸(0.5%)15 mL,混合均匀,置于冰水浴中提取海藻糖,每隔15 min振荡一次,提取1 h后离心(3000 r/min;10 min),取上清液放入25 mL容量瓶中,加蒸馏水至刻度,混匀待测。以15 mL三氯乙酸溶液(0.5%)加蒸馏水至25 mL为空白对照,选择蒽酮-硫酸法[22]测定海藻糖含量。海藻糖含量与吸光值线性关系良好,标准曲线方程为y=3.8829 x+0.0143,R2=0.9993。
1.2.8 蔗糖酶活力的测定
取洁净试管加入蔗糖溶液(0.1 mol/L)1.0 mL,NaAc-HAc缓冲液(0.2 mol/L, pH=5.2)2.0 mL,蒸馏水6.5 mL,于30 ℃水浴5 min,加入0.5 mL酵母液(已知浓度)迅速混匀,继续水浴5 min,然后吸取1 mL反应液加入到2 mL DNS溶液中,沸水中保持5 min,取出冷却至室温,于540 nm测定葡萄糖标准曲线,标准方程为y=0.1023x+0.0409,R2=0.9992,线性关系良好[23]。
DNS(3,5-二硝基水杨酸)显色液的制备方法:称取酒石酸钾钠182.0 g放入500 mL热的蒸馏水中溶解(水温不能超过50 ℃),加热过程中依次向溶液中加入3,5-二硝基水杨酸、NaOH、苯酚、无水亚硫酸钠质量分别为6.3、21.0、5.0、5.0 g,搅拌直至全部溶解,冷却后用纯水定容至1000 mL,室温下在棕色瓶中保存,放置一周后方能使用。
蔗糖酶活力的定义:30 ℃,pH为5.2时,单位酵母(每g酵母干物质)每分钟分解蔗糖生成1 mg葡萄糖为一个活力单位(U)。
蔗糖酶活力(U/g酵母干物质)=(A×0.180)(5×0.5×C) (式(2)) 式中:A为根据标准曲线方程求得的葡萄糖含量(μmol);C为酵母液浓度(g/mL);0.180为1 μmol葡萄糖的摩尔质量(mg);5为显色反应时间(min);0.5为加入的酵母液的体积(mL)。
1.2.9 发酵液风味物质成分的测定
将等量BY-3、3G-28和市售Ⅲ菌种分别置于LF培养基[21]中发酵,3 h后测定风味物质。发酵液中挥发性物质的萃取:取发酵液于样品瓶中,放入恒温水浴中50 ℃下平衡20 min,插入SPME萃取头,继续在50 ℃下保持吸附40 min,GC解吸5 min,进行GC-MS分析[24]。
气相色谱(GC)的条件设定:DB-WAX毛细管柱(30 m×0.32 mm×0.25 mm;Agilent),氦气(He)为载气,恒定流速为1.2 mL/min,不分流进样,进样口温度为250 ℃;程序升温:初始温度为40 ℃,保持3 min,以5 ℃ /min升温到200 ℃,再以10 ℃/min升温到250 ℃,保持3 min。
质谱(MS)的条件设定:电子轰击(EI)离子源,电子能量为70 eV,离子源温度为230 ℃,传输线温度为280 ℃,四级杆温度为150 ℃,质量扫描范围m/z 55 ~ 500。
1.3 数据处理
实验数据每组3个平行样,每个平行实验测定3次取其平均值,结果用“平均值±标准差表示”。采用SPSS 18.0软件进行差异显著性分析,采用Origin 8.0进行相关图形绘制。
2. 结果与分析
2.1 离心条件对酵母活菌数量的影响
从图1看出,离心转速相同时,活菌数随着离心时间的增加反而变少,说明菌体可能受到了过强的机械作用导致死亡;离心时间相同时,活菌数随转速增加先增大后减少,说明离心转速在一定范围内(4000~ 6000 r/min)时,转速增加能减少菌体随上清液的流失使得活菌数增加,但在6000~8000 r/min范围内时,离心强度过大引起的机械作用造成了菌体的死亡。离心时间和转速对酵母菌体的存活率具有一定影响,这一结论与其他研究报道相符[25-27]。根据实验结果,选择离心条件为6000 r/min,时间10 min。
2.2 单因素实验结果
2.2.1 不同浓度脱脂奶粉的保护效果
结果如图2所示,与空白组相比,脱脂奶粉对菌体的保护效果非常显著。这是因为脱脂奶粉是一种常见的大分子胞外保护剂,能在菌体表面形成一层保护层,而且奶粉中含有的蛋白、糖类等物质可以对细胞加以保护,减少细胞与介质的接触面积[23],并可以固定冻干的酶类,防止由于细胞壁的损伤而引起的胞内物质渗漏[28];陈胜杰等[17]研究发现随着脱脂乳粉浓度的增加,植物乳杆菌、凝结芽孢杆菌和酿酒酵母菌三种菌的存活率均逐渐增加,但是当增加到一定浓度后菌体的存活率保持稳定或些许下降。由实验结果可知,当脱脂奶粉浓度达到20%时,浓度的继续增加并不会使保护效果变化更加明显,结合生产实际经济效益方面的考虑,脱脂奶粉浓度选择20%。
2.2.2 不同浓度蔗糖的保护效果
结果如图3所示,蔗糖作为低温保护剂在冷冻干燥过程中能够显著提高酵母菌的存活率。在冷冻干燥过程中,蔗糖可形成具有高粘度、低流动性的玻璃态基质,将蛋白质分子支撑起来,使之不易变性。而且蔗糖分子中的羟基可以与菌体细胞膜蛋白质及膜磷脂上的极性基团结合形成氢键,从而对细菌的细胞膜和蛋白质的完整性起到保护作用[29-30]。蔗糖还可以渗透进入细胞,在细胞壁和膜间发挥作用,和溶液中的水分子结合,减缓晶核的形成,降低在冷冻干燥时晶核对细胞的伤害[31]。随蔗糖浓度增大,酵母活菌数量先增多后减小。综合考虑到酵母的活菌数量、实验的可操作性以及生产成本,蔗糖浓度选择5%。
2.2.3 不同浓度吐温−80的保护效果
从图4可以看出,与空白对照相比,吐温−80浓度在5% ~ 20%之间对酵母菌的存活均具有保护作用,这是因为吐温−80是一种非离子型表面活性剂,具有较好的乳化能力、润湿能力,在冷冻过程中减少菌体因脱水造成的蛋白变性,降低冻结损失;又能在冻干粉复水时,对菌体起到一定水分润湿作用[32]。但是随着吐温−80浓度的增加,其保护作用逐渐减弱,根据实验结果,选择吐温−80浓度为5%,但其酵母菌活菌数量仍明显低于其他单体保护剂。
2.2.4 不同浓度阿拉伯胶的保护效果
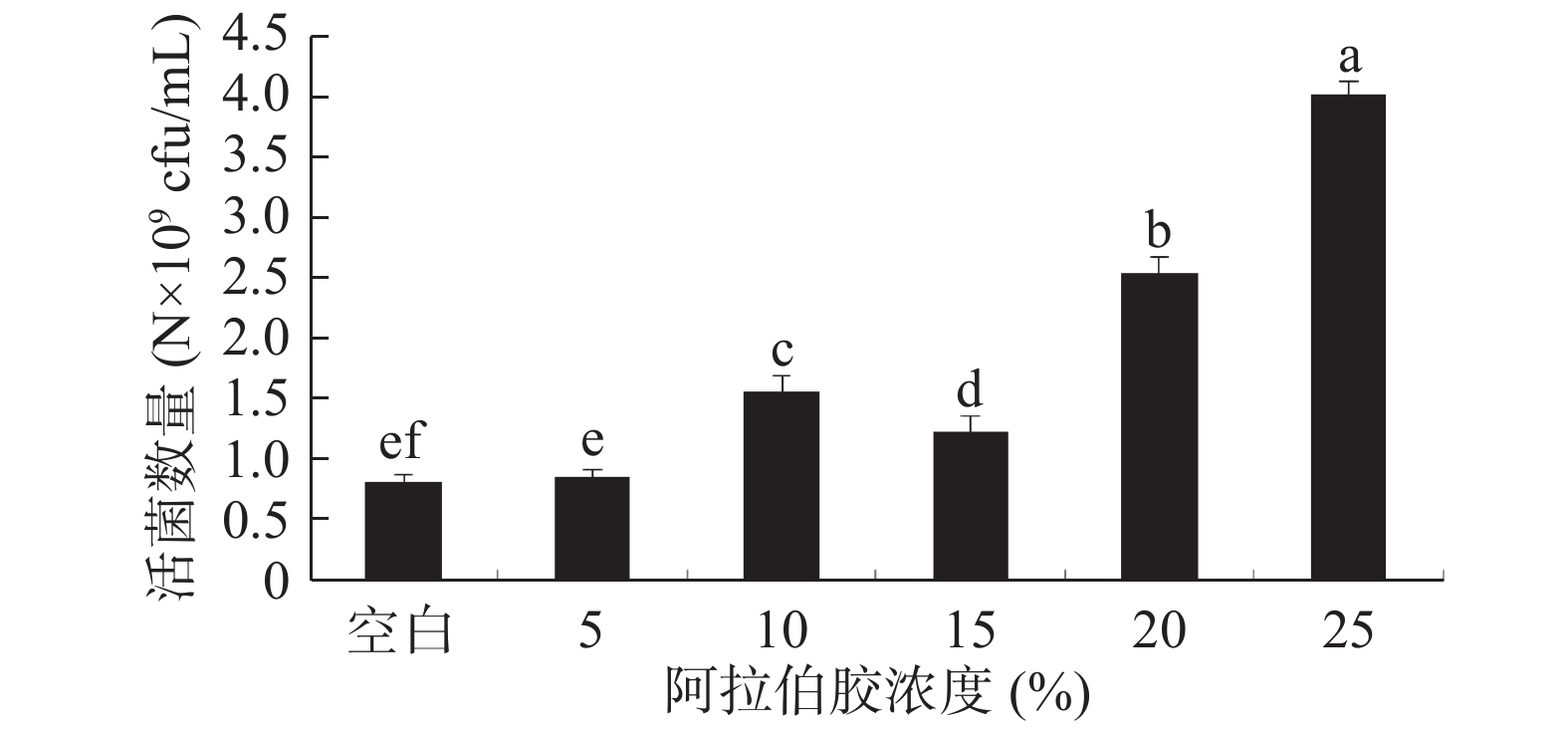
阿拉伯胶是一种聚合类保护剂,广泛用作乳化剂、稳定剂、悬浮剂、黏合剂、成膜剂等。邹小波等[33]将低温贮藏的蓝莓果实进行阿拉伯胶复合涂膜处理,实验发现可以显著减缓蓝莓果实质量损失、降低腐烂率和延缓硬度降低(P < 0.05),并能维持果实较高的总酚、花色苷含量和较好的感官品质。其原因是具有较高憎水性的阿拉伯胶能够在菌体表面形成水蒸气屏障。在酵母菌体的冷冻干燥过程中阿拉伯胶作为保护剂可以减少水分蒸发,能够保护细胞在受到低温和脱水时不被伤害。由图5可以看出,添加阿拉伯胶对酵母菌具有一定的保护作用,阿拉伯胶浓度为25%时,保护作用最好,但其酵母菌活菌数量仍明显低于其他单体保护剂。
2.2.5 不同浓度β-环状糊精的保护效果
β-环状糊精是一种大分子多糖,它可以增加菌体的黏度增加,提高冻干物料的玻璃化温度,使其不易结晶。同时,以β-环状糊精作为保护剂,得到的冻干菌粉呈蓬松状态,阻止细胞收缩变硬,使酵母冻干粉具有良好的复水性,并提高其生物活性[34]。从图6可知,与空白对照相比,β-环状糊精对酵母菌具有很好地保护作用,当β-环状糊精的浓度达到15%时,酵母菌活菌数目最大,因此,选择β-环状糊精浓度为15%。
2.2.6 不同浓度甘油的保护效果
结果如图7所示,保护效果呈现先增加后降低的趋势,在5%时,活菌数量达到峰值。其原因是甘油属于小分子类保护剂,具有良好的渗透性能,能够进入细胞内部,分子中羟基和细胞中的大分子形成氢键,可以部分替代由水形成的氢键,使得在失水过程中细胞内的大分子物质,如蛋白质、脂肪、碳水化合物和其他大分子物质保持原有结构和生物体的活性。由于在甘油添加量1%~5%范围内时,氢键的形成有效的维持了细胞的活性,此外甘油具有较好的持水性使得在失水过程中不至于过快的失去水分,而当甘油的添加量超过5%时,对一些大分子诸如蛋白质的稳定能力达到了极限,在冷冻干燥的过程中过高的浓度使得蛋白质发生了变性影响了细胞的活性。因此甘油的浓度选择5%。
2.3 响应面实验结果与分析
2.3.1 响应面实验结果
根据单因素实验结果,发现脱脂奶粉、蔗糖、甘油和β-环状糊精保护效果较好,故分别设定为变量A、B、C、D,酵母菌的活菌数量为响应值(Y),采用Design-Expert 8.0.6软件设计了27组试验,24组为析因点试验,3组为重复零点试验,结果见表2。
表 2 响应面试验设计及结果Table 2. Design and results of response surface experiment试验号 A甘油浓度(%) B脱脂奶粉浓度(%) C蔗糖浓度(%) D β-环状糊精浓度(%) Y活菌数量
(N × 109个/mL)1 0 0 −1 −1 32.16 2 0 0 −1 1 34.26 3 −1 0 1 0 36.19 4 1 0 1 0 32.85 5 0 1 1 0 31.24 6 1 0 0 −1 33.65 7 0 −1 0 1 32.65 8 −1 −1 0 0 30.45 9 1 1 0 0 31.85 10 0 0 1 1 33.67 11 −1 0 0 −1 35.37 12 1 −1 0 0 30.65 13 0 −1 1 0 30.12 14 0 0 0 0 36.97 15 −1 0 0 1 35.44 16 0 0 0 0 36.53 17 −1 0 −1 0 34.78 18 0 1 0 −1 32.14 19 1 0 0 1 34.62 20 0 0 1 −1 32.64 21 1 0 −1 0 34.12 22 0 −1 0 −1 30.12 23 −1 1 0 0 31.47 24 0 0 0 0 36.89 25 0 1 0 1 31.02 26 0 −1 −1 0 30.45 27 0 1 −1 0 31.62 根据实验数据,用Design-Expert软件对实验进行二元多项式回归模拟,得到回归方程如下:
Y=36.80−0.50A+0.41B−0.057C+0.47D+0.045AB−0.67AC+0.22AD−0.013BC−0.91BD−0.27CD−0.87A2−4.322 −1.78C2−1.33D2
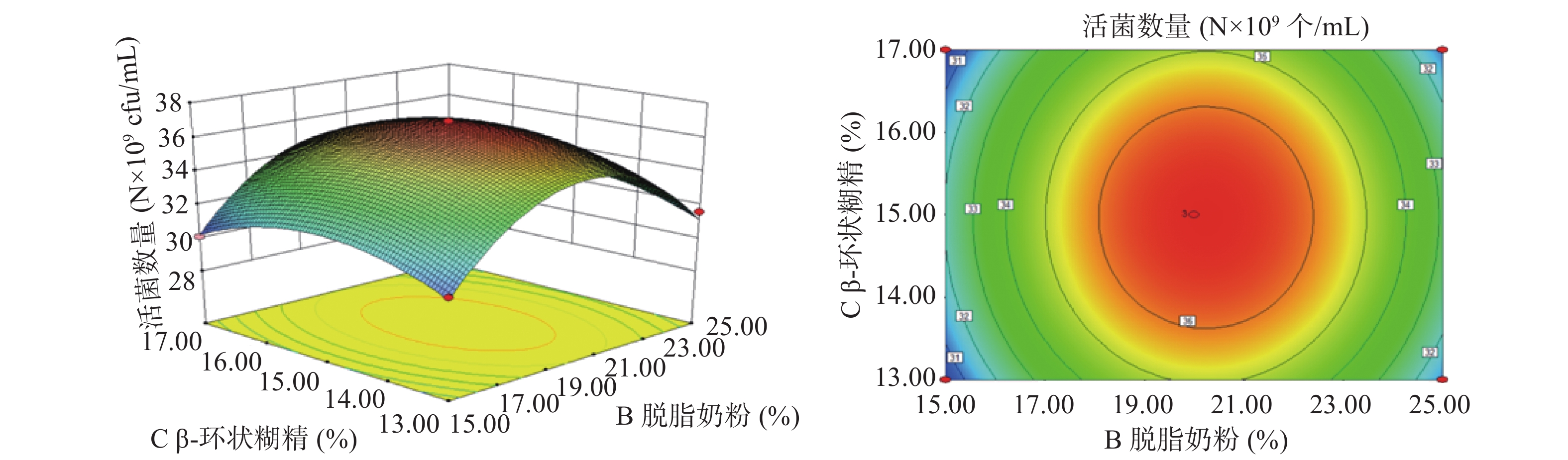
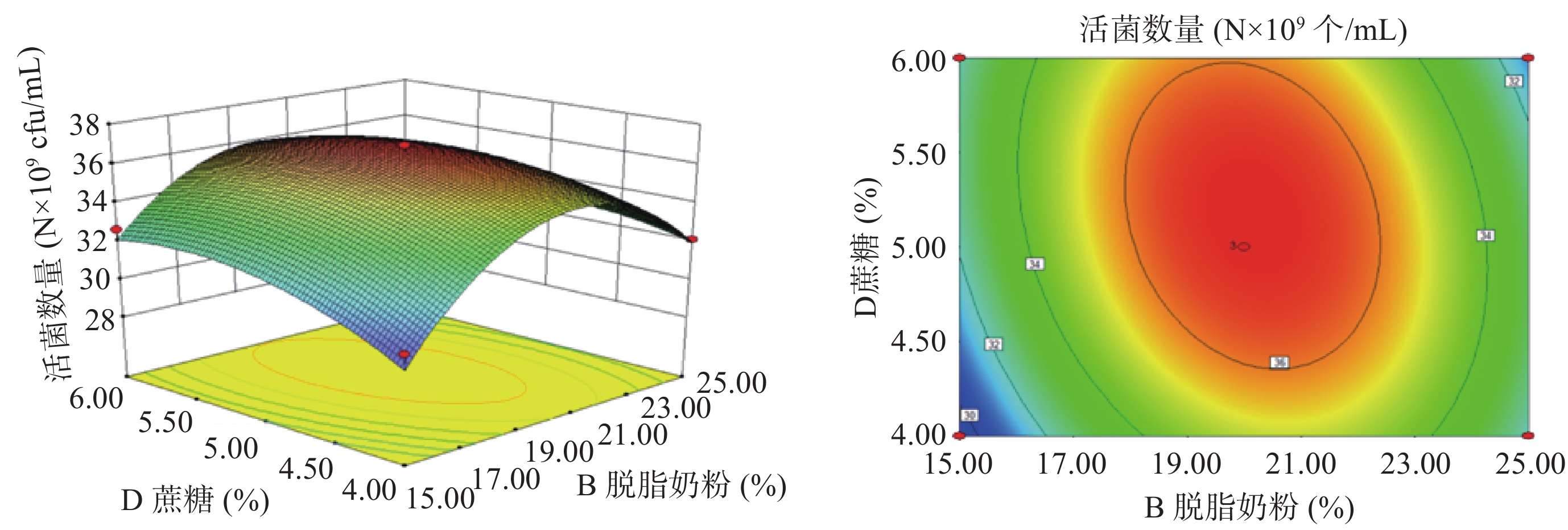
由表3可知,本实验所得到的回归模型F值为13.67,P值 < 0.0001说明此实验模型的达到极显著水平,失拟项P=0.0730,呈不显著,表明该模型真实可靠。四种变量中甘油浓度对响应值(活菌数量)的影响最为显著(P小于0.05),且四个因素对响应值的影响效果依次为:A甘油浓度 > D蔗糖浓度 > B脱脂奶粉浓度 > C β-环状糊精浓度。模型的总决定系数为R2 =0.9410,校正决定系数为R2Adj =0.8721,说明试验误差较小,模型与实际预测值拟合效果好,本模型可以解释87.21%响应值的变化。本实验的变异系数(C.V.)为2.36% < 5%,这表明实验具有较高的重复度和准确性。因此回归方程可以很好地描述各因素与响应值之间的关系。
表 3 响应面试验方差分析Table 3. Variance analysis of regression model方差来源 平方和 自由度 均方 F P 模型 116.41 14 8.32 13.67 < 0.0001** A 2.96 1 2.96 4.87 0.0476* B 2.00 1 2.00 3.29 0.0948 C 0.039 1 0.039 0.063 0.8055 D 2.59 1 2.59 4.27 0.0612 AB 0.0081 1 0.0081 0.013 0.9100 AC 1.80 1 1.80 2.95 0.1115 AD 0.20 1 0.20 0.33 0.5746 BC 0.000652 1 0.000625 0.001027 0.9750 BD 3.33 1 3.33 5.47 0.0374* CD 0.29 1 0.29 0.47 0.5058 A2 3.99 1 3.99 6.57 0.0249* B2 99.67 1 99.67 163.83 < 0.0001** C2 16.95 1 16.95 27.87 0.0002** D2 9.40 1 9.40 15.46 0.0020** 残差 7.30 12 0.61 失拟项 7.19 10 0.72 13.09 0.0730 纯误差 0.11 2 0.055 总差 123.71 26 注:C.V. %=2.36;R2=0.9410;R2Adj=0.8721;**表示差异极显著(P < 0.01);*表示差异显著(P < 0.05)。 2.3.2 响应面交互作用分析与优化
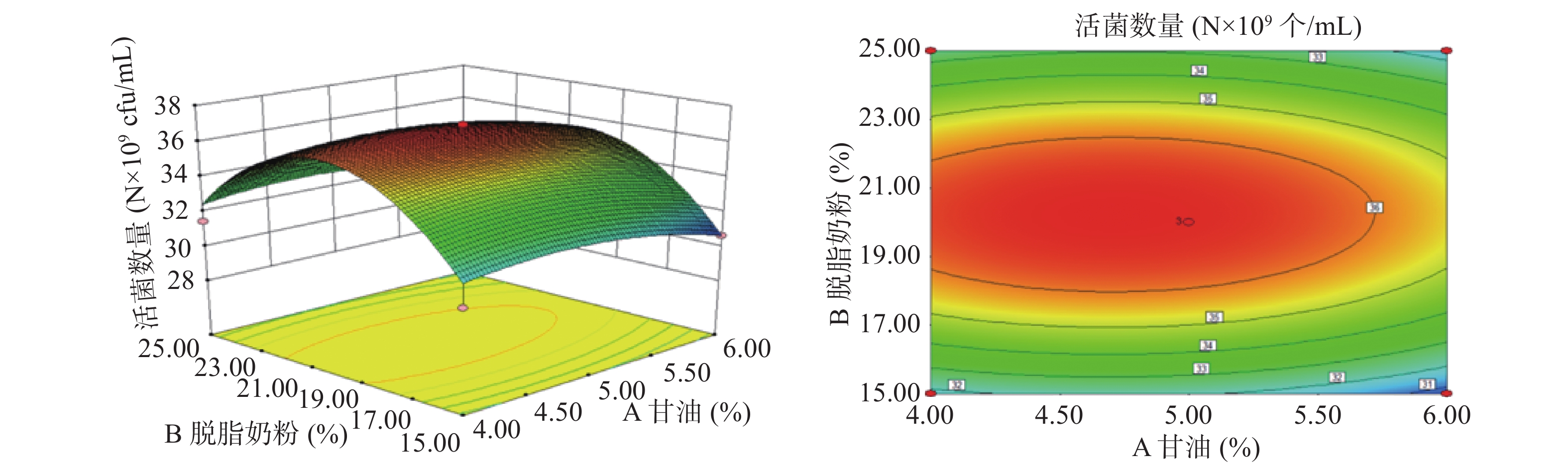
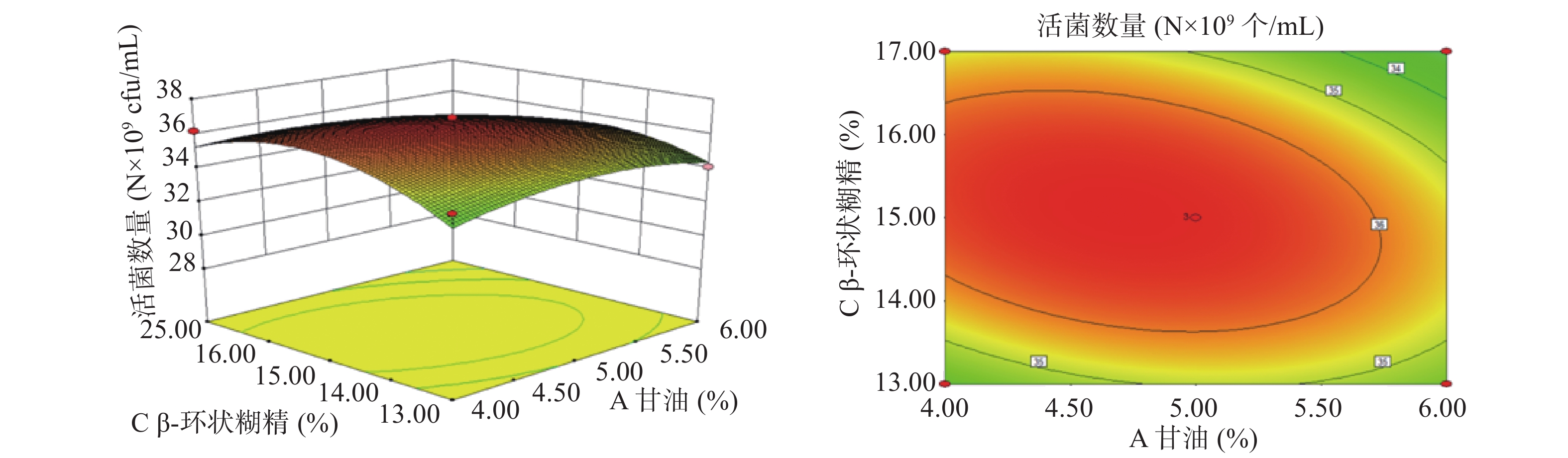
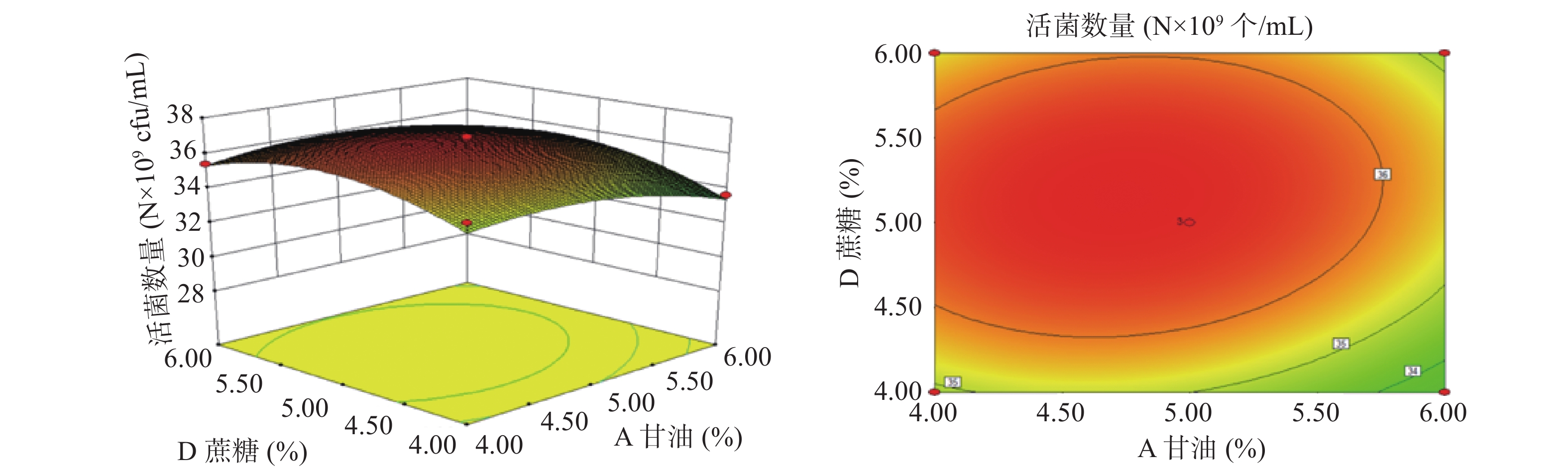
以A(甘油浓度)、B(脱脂奶粉浓度)、C(β-环状糊精浓度)、D(蔗糖浓度)为影响因子,以酵母菌活菌数量为响应值,根据上述回归方程做出响应面分析图及等高线图,如图8~图13所示。通过图组可以直观的观察各个因素的交互作用对响应值的影响。图中各因素的边线坡度越小则该因素对酵母菌活菌数量的影响越小,因素的边线的坡度越陡则该因素对酵母菌活菌数量的影响越大[35]。由组图分析得到的各因素对响应值的影响效果与方差分析结果一致。响应曲面的坡度反映了两因素的交互作用效果,曲面坡度越陡峭,表明两因素交互作用对响应值的影响越显著,反之,代表二者交互作用不显著[36]。由图12可知,脱脂奶粉浓度和蔗糖浓度之间的交互影响显著,表现为响应面曲线坡度最为陡峭。但各因素的交互作用下酵母细胞存活数量的变化均呈现正抛物线形状,表明各因素在波动水平内均存在峰值任意两个因素的交互作用都存在一个最高点,说明通过改变这四个因素,可以使酵母菌活菌数量达到最高[37]。
2.3.3 最佳保护剂配比的确定与验证
通过Design-Expert 8.0.6软件对二次多项式回归方程进行分析,得出最优设计为:A(甘油浓度)4.72%,B(脱脂奶粉浓度)20.15%,C(β-环状糊精浓度)15.06%,D(蔗糖浓度)5.14%,预测值为36.9035×109个/mL。为了便于具体实验操作,将各因素条件优化为:甘油浓度4.7%,脱脂奶粉浓度20%,β-环状糊精浓度15%,蔗糖浓度5%。在此条件下重复实验3次,实际测得的酵母活菌数量为36.89×109 个/mL,表明模型与实际操作拟合度良好。
2.4 发酵力的测定结果
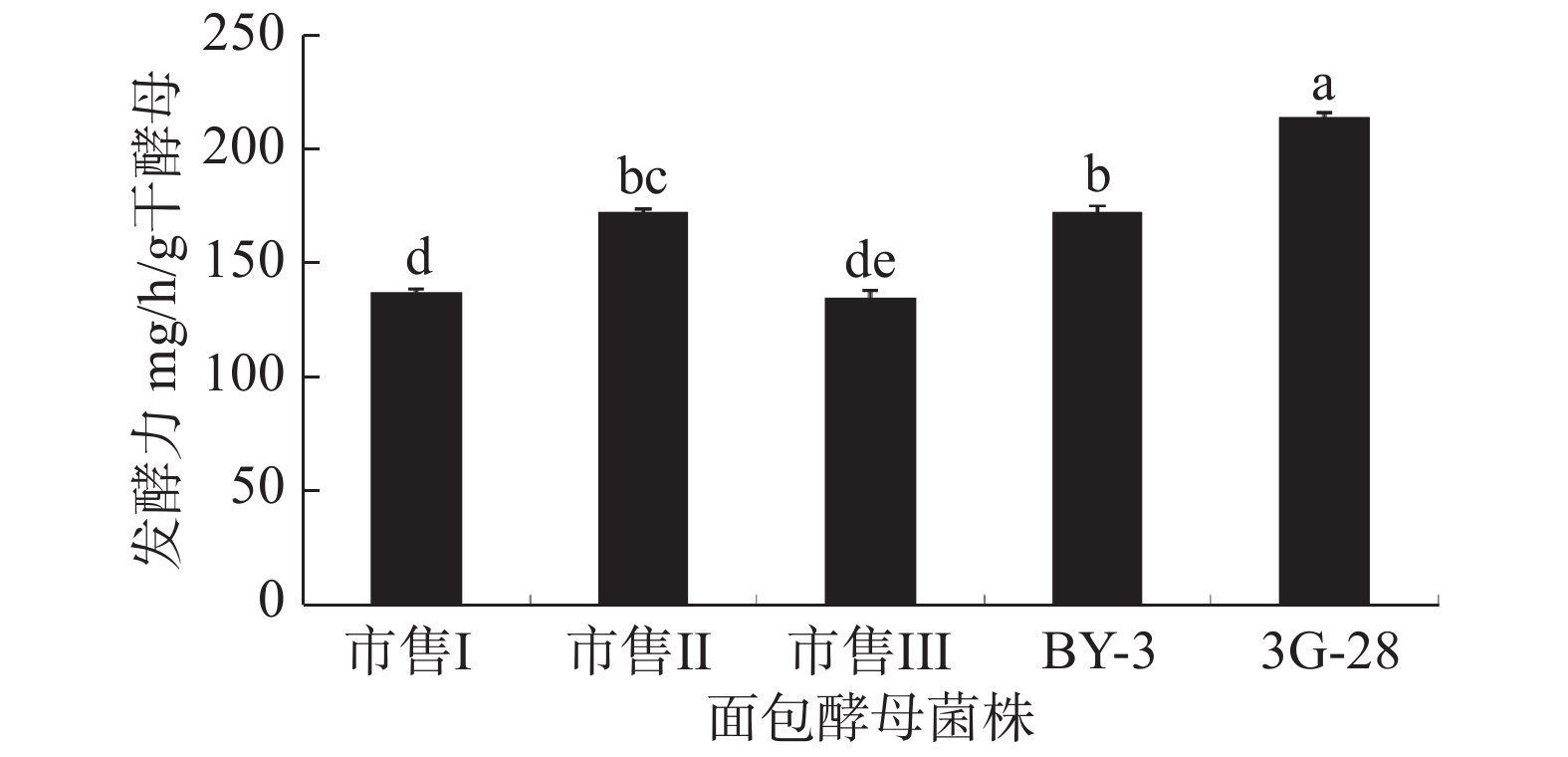
分别将酵母菌株BY-3、3G-28、市售Ⅰ、Ⅱ、Ⅲ号,按照1.2.5的方法制成酵母粉,进行发酵能力测定实验。结果如图14所示,与其它菌株相比,菌株3G-28的发酵能力最好,为214 mg/h/g干酵母。这是因为3G-28为改良菌株,以BY-3菌株为初始菌株,通过空气等离子体技术诱变得到。该菌株在改良后较初始菌株发酵力提高了48.57%,在高糖面团和无糖面团中均能保持较高的酵母活力,特别是在低温耐受性方面明显优于初始菌株,因此,3G-28酵母菌冻干粉表现出良好的发酵力[21]。
2.5 海藻糖含量的分析
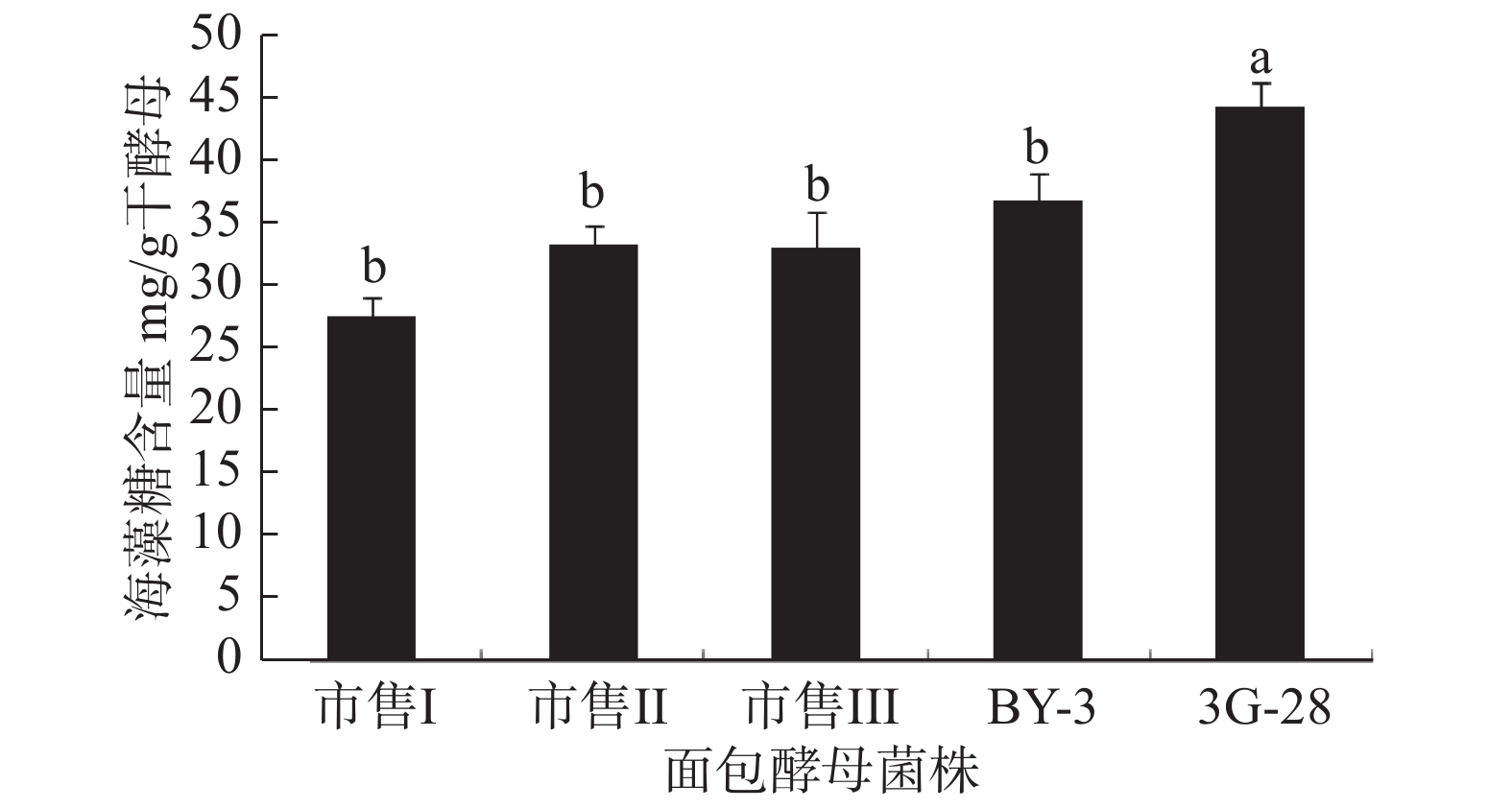
前期研究表明,菌株3G-28在−20 ℃低温下进行保藏,两周后,其菌株的相对发酵力可达到76.10%,酵母泥的相对发酵力为83.91%[21]。有文献表明,酵母细胞的耐冷冻性与发酵开始前细胞内的海藻糖含量有关,并且高含量海藻糖的酵母比低含量海藻糖的酵母的保存期限长,这是因为海藻糖的结构稳定,在冷冻干燥过程中可以保护膜和蛋白质不被破坏[38-39]。因此,海藻糖含量的测定也是衡量酵母性能的一个指标。分别对五种酵母冻干制粉进行海藻糖含量的测定,结果如图15所示,菌株3G-28的海藻糖含量为44.220 mg/g干酵母,处于一个较高的水平,相较于其它四种酵母冻干粉,性能较优,耐冷冻性和耐储存能力较好。
2.6 蔗糖酶活力的分析
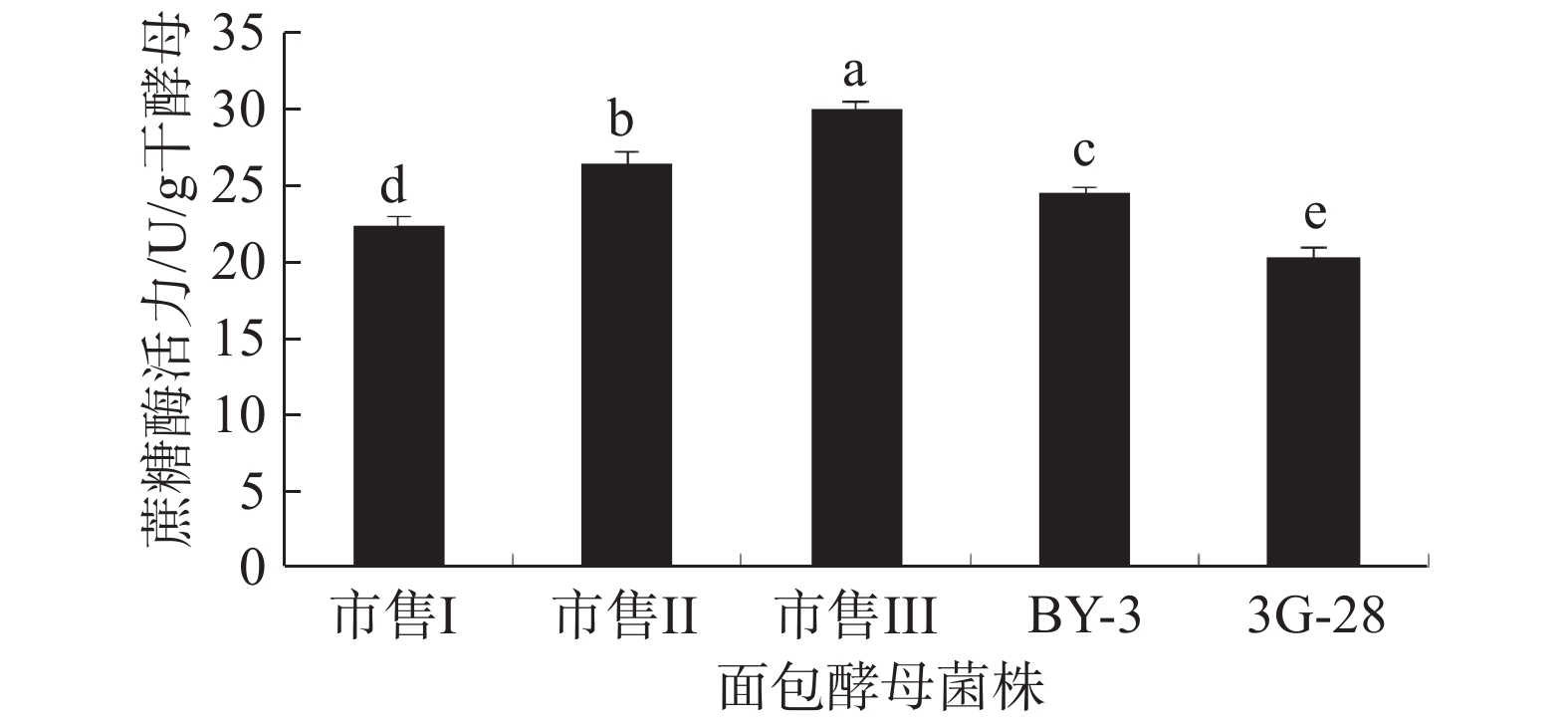
对于酵母菌来说,在利用蔗糖作为碳源时,蔗糖在细胞外的分解速度远高于细胞内己糖的代谢速度,从而导致环境渗透压快速升高,生长受到抑制。因此,降低酵母菌蔗糖酶活力,维持适宜的渗透压水平,不仅可以保持其细胞的活性,在面团含糖较高时也能保持酵母的发酵活性[40]。在前期的研究中发现,酵母菌3G-28蔗糖酶活力较初始菌株BY-3降低了71.89%,在高糖面团和无糖面团中均能保持较高的酵母活力[21]。分别对五份酵母冻干制粉进行蔗糖酶活力的测定,结果如图16所示,菌株3G-28的蔗糖酶活力为20.27 U/g干酵母,低于其它菌株,即在面团含糖较高时,其发酵活性高于其他4种酵母冻干粉。
2.7 发酵液风味物质成分的测定及比较
选取BY-3、3G-28和综合表现较好的市售Ⅲ号,三种酵母冻干粉进行发酵实验,采用固相微萃取结合GC-MS的方法分别对发酵液体培养基所含的风味物质成分进行测定,检测结果见表4。
表 4 发酵液风味物质成分Table 4. The flavor composition of before and after fermentation风味物质 保留时间(min) 相对含量(%) 空白 市售Ⅲ BY-3 3G-28 空白 市售Ⅲ BY-3 3G-28 异戊醛 5.07 5.61 乙醇 6.00 5.98 6.03 41.21 31.21 45.75 乙酸乙烯酯 6.97 2.34 三氯甲烷 7.99 8.01 8.04 4.80 5.46 3.31 甲苯 8.57 8.55 8.53 8.56 1.03 6.40 4.07 5.37 乙酸丁酯 9.42 9.43 3.18 2.23 3-甲基-1-丁醇乙酸酯 10.67 11.68 乙酸异戊酯 10.69 7.49 乙酸-3-甲基丁酯 10.71 9.97 3-甲基-1-丁醇 13.36 12.65 2-甲基-1-丁醇 13.54 10.28 异戊醇 13.54 13.750 正己酸乙酯 13.93 13.76 13.78 0.71 0.39 0.36 苯乙烯 14.60 14.46 14.48 0.96 0.75 0.99 丁酸戊酯 14.81 14.65 14.67 0.62 0.26 0.84 正辛醛 15.97 61.80 壬醛 18.22 18.29 18.21 0.60 0.30 0.51 辛酸乙酯 19.26 二十七烷 19.32 0.56 四甲基十七烷 19.34 0.59 异戊酸香叶酯 19.71 0.36 5-丁基-4壬烯 19.89 0.36 环己二甲醇 20.09 0.370 2-乙基己醇 20.74 20.72 20.72 1.21 0.90 1.14 2-十六烷醇 20.85 0.43 苯甲醛 21.631 21.614 0.980 0.800 7-十六烯醛 21.948 0.180 小茴香醇 23.054 0.340 2-十六烷醇 23.319 23.313 0.260 0.750 2,6,10-三甲基十四烷 23.334 0.920 9-十四烯醛 23.471 0.650 3-羟基十四烷酸甲酯 23.593 0.750 2-甲基十六醇 25.600 0.790 异戊酸香叶酯 25.642 0.490 月桂酸甲酯 27.876 27.841 27.843 5.470 11.400 4.460 2-甲基丙酸 29.424 3.380 抗氧剂BHT 30.103 30.103 6.000 0.750 苯乙醇 30.178 30.178 30.177 1.870 1.250 1.390 2-十五烷酮 32.270 32.262 0.580 0.530 2,4-二叔丁基苯酚 37.168 37.164 37.163 37.163 31.510 3.000 5.310 3.720 邻苯二甲酸二丁酯 40.405 40.404 40.405 3.630 2.570 3.450 三个样品检测到的挥发性物质主要包括醇类、酯类、醛类和烃类。其中市售Ⅲ发酵液样品检测到的风味物质共18种,分别为醇类5种,酯类7种,烃类5种,醛类1种,各组分占例为57.73%,24.32%,13.38%,1.28%;BY-3发酵液样品检测到的风味物质共19种,分别为醇类5种,酯类6种,醛类3种,烃类5种,各组分占例为44.38%,26.66%,6.45%和11.20%;3G-28发酵液样品检测到的风味物质共18种,分别为醇类6种,酯类7种,醛类2种,烃类3种,各组分占例为62.85%,21.17%,1.31%,9.68%。表明在保护剂的作用下,酵母冻干粉的发酵力和性能得到了很好的保留。根据检测结果显示,样品中的主要风味物质为醇类,其次为酯类。三个样品中共同检测出的醇类主要有:乙醇、2-乙基己醇和苯乙醇,醇类是风味物质的重要组成部分,在焙烤过程中,通过一系列化学反应带给面包制品的独特风味,其中,经菌株3G-28发酵的样品中醇类含量最高,表现出较好的发酵性能及较高的实用性。
3. 结论
本文在前期研究的基础上,对改良酵母菌株3G-28的冻干粉的生产及其生物活性进行了研究。通过响应面实验得到了面包酵母3G-28的最佳冻干保护剂配方为:甘油浓度4.7%,脱脂奶粉浓度20%,β-环状糊精浓度15%,蔗糖浓度5%,添加该保护剂制得的面包酵母冻干粉活菌数量为36.89×109 个/mL。该面包酵母冻干粉性能较优,其发酵能力为214 mg/h/g干酵母,海藻糖含量为44.22 mg/g干酵母,蔗糖酶活力20.27 U/g干酵母。通过GC-MS对3G-28酵母菌冻干粉、市售酵母菌冻干粉和初始菌株酵母冻干粉的发酵液风味物质进行分析比较,发现3G-28酵母菌冻干粉具有较好的风味特质,由其发酵的样品中风味物质醇类含量最高。本研究具有很强的实用价值,为改善面包产品品质、推进微生物工业化应用提供理论基础。
-
表 1 响应面试验因素水平表
Table 1 Factors and levels table of response surface experiment
因素 水平 −1 0 1 A甘油浓度(%) 4 5 6 B脱脂奶粉浓度(%) 15 20 25 C β-环状糊精浓度(%) 13 15 17 D蔗糖浓度(%) 4 5 6 表 2 响应面试验设计及结果
Table 2 Design and results of response surface experiment
试验号 A甘油浓度(%) B脱脂奶粉浓度(%) C蔗糖浓度(%) D β-环状糊精浓度(%) Y活菌数量
(N × 109个/mL)1 0 0 −1 −1 32.16 2 0 0 −1 1 34.26 3 −1 0 1 0 36.19 4 1 0 1 0 32.85 5 0 1 1 0 31.24 6 1 0 0 −1 33.65 7 0 −1 0 1 32.65 8 −1 −1 0 0 30.45 9 1 1 0 0 31.85 10 0 0 1 1 33.67 11 −1 0 0 −1 35.37 12 1 −1 0 0 30.65 13 0 −1 1 0 30.12 14 0 0 0 0 36.97 15 −1 0 0 1 35.44 16 0 0 0 0 36.53 17 −1 0 −1 0 34.78 18 0 1 0 −1 32.14 19 1 0 0 1 34.62 20 0 0 1 −1 32.64 21 1 0 −1 0 34.12 22 0 −1 0 −1 30.12 23 −1 1 0 0 31.47 24 0 0 0 0 36.89 25 0 1 0 1 31.02 26 0 −1 −1 0 30.45 27 0 1 −1 0 31.62 表 3 响应面试验方差分析
Table 3 Variance analysis of regression model
方差来源 平方和 自由度 均方 F P 模型 116.41 14 8.32 13.67 < 0.0001** A 2.96 1 2.96 4.87 0.0476* B 2.00 1 2.00 3.29 0.0948 C 0.039 1 0.039 0.063 0.8055 D 2.59 1 2.59 4.27 0.0612 AB 0.0081 1 0.0081 0.013 0.9100 AC 1.80 1 1.80 2.95 0.1115 AD 0.20 1 0.20 0.33 0.5746 BC 0.000652 1 0.000625 0.001027 0.9750 BD 3.33 1 3.33 5.47 0.0374* CD 0.29 1 0.29 0.47 0.5058 A2 3.99 1 3.99 6.57 0.0249* B2 99.67 1 99.67 163.83 < 0.0001** C2 16.95 1 16.95 27.87 0.0002** D2 9.40 1 9.40 15.46 0.0020** 残差 7.30 12 0.61 失拟项 7.19 10 0.72 13.09 0.0730 纯误差 0.11 2 0.055 总差 123.71 26 注:C.V. %=2.36;R2=0.9410;R2Adj=0.8721;**表示差异极显著(P < 0.01);*表示差异显著(P < 0.05)。 表 4 发酵液风味物质成分
Table 4 The flavor composition of before and after fermentation
风味物质 保留时间(min) 相对含量(%) 空白 市售Ⅲ BY-3 3G-28 空白 市售Ⅲ BY-3 3G-28 异戊醛 5.07 5.61 乙醇 6.00 5.98 6.03 41.21 31.21 45.75 乙酸乙烯酯 6.97 2.34 三氯甲烷 7.99 8.01 8.04 4.80 5.46 3.31 甲苯 8.57 8.55 8.53 8.56 1.03 6.40 4.07 5.37 乙酸丁酯 9.42 9.43 3.18 2.23 3-甲基-1-丁醇乙酸酯 10.67 11.68 乙酸异戊酯 10.69 7.49 乙酸-3-甲基丁酯 10.71 9.97 3-甲基-1-丁醇 13.36 12.65 2-甲基-1-丁醇 13.54 10.28 异戊醇 13.54 13.750 正己酸乙酯 13.93 13.76 13.78 0.71 0.39 0.36 苯乙烯 14.60 14.46 14.48 0.96 0.75 0.99 丁酸戊酯 14.81 14.65 14.67 0.62 0.26 0.84 正辛醛 15.97 61.80 壬醛 18.22 18.29 18.21 0.60 0.30 0.51 辛酸乙酯 19.26 二十七烷 19.32 0.56 四甲基十七烷 19.34 0.59 异戊酸香叶酯 19.71 0.36 5-丁基-4壬烯 19.89 0.36 环己二甲醇 20.09 0.370 2-乙基己醇 20.74 20.72 20.72 1.21 0.90 1.14 2-十六烷醇 20.85 0.43 苯甲醛 21.631 21.614 0.980 0.800 7-十六烯醛 21.948 0.180 小茴香醇 23.054 0.340 2-十六烷醇 23.319 23.313 0.260 0.750 2,6,10-三甲基十四烷 23.334 0.920 9-十四烯醛 23.471 0.650 3-羟基十四烷酸甲酯 23.593 0.750 2-甲基十六醇 25.600 0.790 异戊酸香叶酯 25.642 0.490 月桂酸甲酯 27.876 27.841 27.843 5.470 11.400 4.460 2-甲基丙酸 29.424 3.380 抗氧剂BHT 30.103 30.103 6.000 0.750 苯乙醇 30.178 30.178 30.177 1.870 1.250 1.390 2-十五烷酮 32.270 32.262 0.580 0.530 2,4-二叔丁基苯酚 37.168 37.164 37.163 37.163 31.510 3.000 5.310 3.720 邻苯二甲酸二丁酯 40.405 40.404 40.405 3.630 2.570 3.450 -
[1] 孙溪, 张翠英, 董建, 等. mal62基因高表达对工业面包酵母发酵力的影响[J]. 微生物学报,2012,52(9):1094−1102. [2] 窦冰然, 郭会明, 骆海燕, 等. 耐高糖面包酵母发酵工艺优化[J]. 食品工业科技,2016,37(18):208−212. [3] 苏从毅, 王辛, 王四维, 等. 提高面包酵母耐冷冻性的研究进展[J]. 粮食与食品工业,2012,19(6):77−79. doi: 10.3969/j.issn.1672-5026.2012.06.030 [4] 张守文, 张智武. 不同酵母、不同发酵工艺对面包质量影响的比较研究[J]. 食品与发酵工业,1997,23(6):24−30, 35. doi: 10.3321/j.issn:0253-990X.1997.06.006 [5] Berny J F, Hennebert G L. Viability and stability of yeast cells and filamentous fungus spores during freeze-drying: Effects of protectants and cooling rates[J]. Mycologia,1991,83(6):805−815. doi: 10.1080/00275514.1991.12026086
[6] Morgan C A, Herman N, White P A, et al. Preservation of microorganisms by drying: A review[J]. Journal of Microbiological Methods,2006,66(2):183−193. doi: 10.1016/j.mimet.2006.02.017
[7] Fonseca F, Passot S, Cunin O, et al. Collapse temperature of freeze-dried Lactobacillus bulgaricus suspensions and protective media[J]. Biotechnology Progress,2004,20(1):229−238.
[8] Miyamoto Shinohara Y, Imaizumi T, Nakahara T, et al. Survival curves for microbial species stored by freeze-drying[J]. Cryobiology,2006,52(1):27−32. doi: 10.1016/j.cryobiol.2005.09.002
[9] Huang L J, Lu Z X, Yuan Y J, et al. Optimization of a protective medium for enhancing the viability of freeze-dried Lactobacillus delbrueckii subsp. bulgaricus based on response surface methodology[J]. Journal of Industrial Microbiology & Biotechnology,2006,33(1):55−61.
[10] Sinha R N, Shukla A K. Rehydration of freeze-dried cultures of lactic streptococci[J]. Journal of Food Science,1982,47(2):668−669. doi: 10.1111/j.1365-2621.1982.tb10148.x
[11] Graciela Font de Valdez, Graciela Savoy de Glori, Aida Pesce de Ruiz Holgado, et al. Comparative study of the efficiency of some additives in protecting lactic acid bacteria against freeze-drying[J]. Cryobiology,1983,20(5):560−566. doi: 10.1016/0011-2240(83)90044-5
[12] 叶鹏, 王学东, 陈聪莉, 等. 抗冻剂对冷冻面团中酵母冷冻保护机理研究[J]. 中国粮油学报,2017,32(7):7−13. doi: 10.3969/j.issn.1003-0174.2017.07.002 [13] Merico A, Ragni E, Galafassi S, et al. Generation of an evolved Saccharomyces cerevisiae strain with a high freeze tolerance and an improved ability to grow on glycerol[J]. Journal of Industrial Microbiology & Biotechnology,2011,38(8):1037−1344.
[14] 叶鹏, 王学东, 宋劲松, 等. 冷冻面团中酵母抗冻保护剂的优选[J]. 中国酿造,2015,34(8):72−76. doi: 10.11882/j.issn.0254-5071.2015.08.015 [15] Siaterlis A, Deepika G, Charalampopoulos D. Effect of culture medium and cryoprotectants on the growth and survival of probiotic lactobacilli during freeze drying[J]. Letters in Applied Microbiology,2010,48(3):295−301.
[16] 龙艳珍, 吴菲菲, 李化强, 等. 真空冷冻干燥棘孢木霉菌株工艺优化研究[J]. 食品研究与开发,2019,40(2):144−148. doi: 10.3969/j.issn.1005-6521.2019.02.027 [17] 陈胜杰, 高翔, 袁戎宇. 真空冷冻干燥法制备益生菌粉的冻干保护剂配方优化[J/OL]. 食品工业科技: 1-15[2020-10-13]. http://kns.cnki.net/kcms/detail/11.1759.TS.20200615.1458.032.html. [18] 张雅硕, 侯一超, 张紫薇, 等. 高活性副干酪乳杆菌冻干菌粉的制备及工艺优化[J]. 食品工业科技,2019,40(16):90−96. [19] 于红, 彭珍, 黄涛, 等. 高活性益生菌发酵枸杞粉的真空冷冻干燥工艺优化[J]. 食品科学,2019,40(20):255−260. doi: 10.7506/spkx1002-6630-20181022-243 [20] 时桂芹, 任菲, 谢冰宗, 等. 高糖胁迫对酿酒酵母抗氧化活性及代谢的影响[J]. 食品工业科技,2019,40(20):94−100. [21] 韩芸娇, 张媛媛, 张彬, 等. 空气等离子体技术对面包酵母的诱变选育研究[J]. 食品工业科技,2019,40(24):94−98. [22] 张媛媛, 张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学,2016,37(4):158−163. doi: 10.7506/spkx1002-6630-201604028 [23] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社 1999. [24] 崔震昆, 毕继才, 朱琳, 等. 不同酵母对无糖面包品质及风味成分的影响[J]. 食品工业科技,2017,38(21):90−99. [25] 王旭增. 鲜食葡萄酿酒酵母的筛选及其活性干酵母制备工艺的研究[D]. 上海: 上海应用技术大学, 2018. [26] 陈伟康, 罗雪梅, 王进, 等. 利用酿酒酵母ZM1-5制备活性干酵母的工艺条件优化试验[J]. 广西农学报,2017,32(5):4−10, 25. doi: 10.3969/j.issn.1003-4374.2017.05.002 [27] 高恩燕. 乳源马克思克鲁维酵母菌的筛选、增殖培养及其冻干菌粉制备的优化研究[D]. 镇江: 江苏大学, 2019. [28] 徐丽萍. 嗜酸乳杆菌冻干菌粉保护剂选择的研究[J]. 食品工业科技,2007(5):119−122. doi: 10.3969/j.issn.1002-0306.2007.05.031 [29] Saez A, Guzmán M, Molpeceres J, et al. Freeze-drying of polycaprolactone and poly (D, L-lactic-glycolic) nanoparticles induce minor particle size changes affecting the oral pharmacokinetics of loaded drugs[J]. European Journal of Pharmaceutics and Biopharmaceutics,2000,50(3):379−387. doi: 10.1016/S0939-6411(00)00125-9
[30] Li H P, Lu M J, Guo H, et al. Protective effect of sucrose on the membrane properties of Lactobacillus casei Zhang subjected to freeze-drying[J]. Journal of Food Protection,2010,73(4):715−719. doi: 10.4315/0362-028X-73.4.715
[31] Arakawa T, Prestrelski S J, Kenney W C, et al. Factors affecting short-term and long-term stabilities of proteins[J]. Advanced Drug Delivery Reviews,1993,10(1):1−28. doi: 10.1016/0169-409X(93)90003-M
[32] 牛春华, 苗欣宇, 牛红红, 等. 复合真空冷冻干燥益生菌发酵保护剂的研制[J]. 轻工科技,2019,35(12):20−23, 63. [33] 邹小波, 杨志坤, 石吉勇, 等. 阿拉伯胶/白色玫瑰茄提取物复合涂膜对低温贮藏蓝莓保鲜效果的影响[J]. 食品科学,2019,40(7):204−211. doi: 10.7506/spkx1002-6630-20180305-032 [34] 张涛, 闫有利. 草鱼肠道拮抗性芽孢杆菌的冻干保护剂优化研究[J]. 水产科学,2018,37(2):244−248. [35] 邓霞, 喻随, 陈思颖, 等. 响应面法优化超声波辅助提取英山云雾茶多糖的研究[J]. 中国食品添加剂,2020,31(8):102−107. [36] 曹颖堃, 刘祖望, 仇凤梅, 等. 野木瓜总皂苷提取工艺优化及其美白活性组分筛选[J/OL]. 食品工业科技: 1-18[2020-10-13]. http://kns.cnki.net/kcms/detail/11.1759.ts.20200825.1356.016.html. [37] 张爱爱, 黄文, 王益, 等. 超声辅助酶法提取香菇柄滋味物质工艺优化[J]. 食品工业科技,2020,41(12):133−138, 149. [38] 谭海刚, 梅英杰, 关凤梅. 蒽酮-硫酸法测定酵母中海藻糖的含量[J]. 现代食品科技,2006,22(1):125−128. [39] Jagdale G B, Grewal P S, Salminen S O. Both heat-shock and cold-shock influence trehalose metabolism in an entomopathogenic nematode[J]. Journal of Parasitology,2005,91(5):988−994. doi: 10.1645/GE-504R.1
[40] 刘湄, 肖冬光, 代丽昕. 耐高糖面包酵母的研究[J]. 食品与发酵工业,2001(5):12−16. doi: 10.3321/j.issn:0253-990X.2001.05.004





 下载:
下载:





 下载:
下载:



