Research Progress on Non-enzymatic Browning Mediated by Polyphenols in Fruit and Vegetable Juice
-
摘要: 褐变存在于果蔬汁加工和贮藏的整个过程,其中酚类物质引起的非酶褐变尤为重要。在此过程中,酚类物质被氧化后进一步反应聚合形成大分子的棕色物质,从而引起颜色的改变。本文依次介绍了多酚的分类、多酚的非酶氧化以及影响该非酶褐变的主要因素,以期为解决多酚氧化引起的非酶褐变难题提供有效的理论依据。这对提升果蔬汁的品质、延长产品货架期具有重要的现实意义。Abstract: Browning occurs throughout the whole processing and storage of fruit and vegetable juices, among which non-enzymatic browning caused by phenols being particularly important. In this process, phenols are oxidized and further polymerized to form macromolecular brown compounds, which cause color changes. This article introduces the classification of polyphenols, the non-enzymatic oxidation of polyphenols and the main factors affecting the non-enzymatic browning in order to provide an effective theoretical basis for solving the problem of non-enzymatic browning caused by polyphenol oxidation. This has important practical significance for improving the quality of fruit and vegetable juices and extending the shelf life of products.
-
Keywords:
- phenols /
- non-enzymatic browning /
- oxidation mechanism /
- influencing factors
-
我国果蔬汁产业起步较晚,20世纪80年代果蔬种植面积开始增大,果蔬汁产业有了充足的原材料。20世纪90年代我国果蔬汁产业迅速发展,浓缩苹果蔬汁、梨汁出口量均排在世界第一位。但我国果蔬汁产业与发达国家仍有一定距离,因此提升果蔬汁的品质迫在眉睫[1]。果蔬汁的加工过程当中,影响果蔬汁产品品质的三大主要技术问题:果蔬汁的褐变、果蔬汁的后浑浊、果蔬汁的二次浑浊。对果蔬汁品质的研究最重要的就是解决果汁三大技术难题。针对果汁的浑浊问题,20世纪末时就发现采用一些先进的超滤技术,减少果蔬汁中的大分子物质,可以显著防止果蔬汁贮藏和流通中引起果汁后混浊;对果浆进行酶解,提高出汁率的同时可以分解可溶性果胶,进而消除果胶引起的沉淀。果汁在储存过程中面临的另一个重大难题就是褐变问题,多酚类物质通过氧化聚合反应而引发褐变[2]。褐变会引起产品品质下降,产品货架期缩短,如果没有良好的解决办法会极大程度冲击果汁产业的发展。
目前国内外一致把多酚的氧化褐变分为酶促褐变和非酶褐变。酶促褐变是在氧气的作用下,果蔬汁中的酚类物质经多酚氧化酶催化形成醌类物质,醌类物质自身聚合或者与蛋白质、氨基酸等大分子物质聚合生成高分子聚合物的一个过程。现阶段对于酶促褐变的研究较多,已经有较完善的解决方案,可以通过控制多酚氧化酶的活性来有效地抑制酶促褐变。常见的方法有热处理、低pH、辐照法等[3]。此外Giner等[4]发现高压脉冲电场可以抑制果蔬当中多酚氧化酶的活力,Gacche等[5]发现肉桂酸和谷胱甘肽同样有抑制多酚氧化酶活性的作用。果蔬汁经过热加工处理后,多酚氧化酶因钝化而失去催化作用,但酚类物质受加工条件的影响相对较小且依然保持较高的化学反应活性,容易引起非酶褐变[6-7]。由于难以严格阻断酚类物质与氧化物的接触,该非酶褐变较难被控制并广泛存在于果蔬汁加工和储藏过程中[8-11]。
由此可知,多酚引起的非酶褐变是影响果蔬汁品质的一个重要难题,也是我国果蔬汁出口行业面临的一个主要障碍,解决多酚引起的非酶褐变问题会对我国果蔬汁出口产业提供一些支持。因此,本文整理和综述了近些年国内外的研究中常见多酚类物质结构、多酚非酶褐变的途径与生成产物和影响非酶褐变的主要因素。
1. 多酚的结构分类
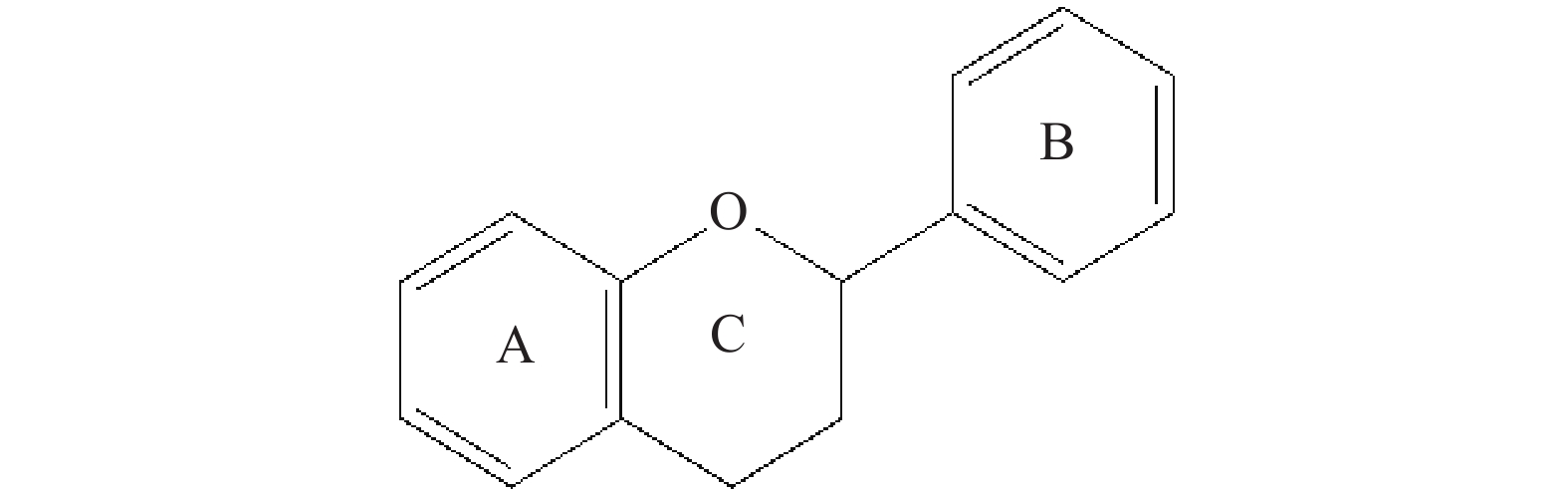
多酚在化学上可以分为两大类,一类是由分子骨架C6-C3-C6衍生的黄酮类物质,另一类是无C6-C3-C6骨架的非黄酮类物质[12]。黄酮类物质的C6-C3-C6骨架由一个中心的含氧吡喃环(C环)沿一个键与芳香环(A环)链接,并通过另一个单键与另一个芳香环(B环)连接(图1)[13]。果蔬中常见的黄酮类物质有黄酮、黄酮醇类、黄烷醇类、花色苷等[14]。
1.1 黄酮类物质
黄酮是果蔬中含量较多的酚类物质,在C6-C3-C6骨架中的C环上多了一个酮基,是最基本的黄酮类物质。黄酮醇类和黄酮结构十分相似,C环上比黄酮多了一个羟基取代基。主要的黄酮醇类物质有杨梅酮、槲皮素、山奈酚、异鼠李亭等,同时C环多出的羟基(如图R位置)可以发生糖苷化,糖苷化的形式主要包括葡萄糖、半乳糖、葡萄糖醛酸、鼠李糖苷化等,其结构如图2所示[15]。
黄烷醇类主要分为单体和聚合体,单体是指黄烷-3-醇单体,它是黄烷醇类物质构成的基本骨架,与黄酮类物质骨架区别为B环上的取代基。主要的黄烷-3-醇单体有阿福豆素、儿茶素、没食子儿茶素,其结构图如图3所示[16-17]。聚合体是指由黄烷醇类物质构成的缩合单宁,缩合单宁中不含有糖键,非常难水解。
花色苷是糖与花色素以糖苷键连接而成的物质,广泛存在于植物的组织与器官当中,根据结构中B环上取代基的不同花色苷可以分为花葵素、花青素、花翠素、甲基花葵素、甲基花青素、甲基花翠素,结构图如图4所示[13,18]。花色苷在C环上的糖苷键能够被酰基(如乙酰基、香豆酰基、咖啡酰基等)催化成更稳定的酰化花色苷分子[19]。
1.2 非黄酮类物质
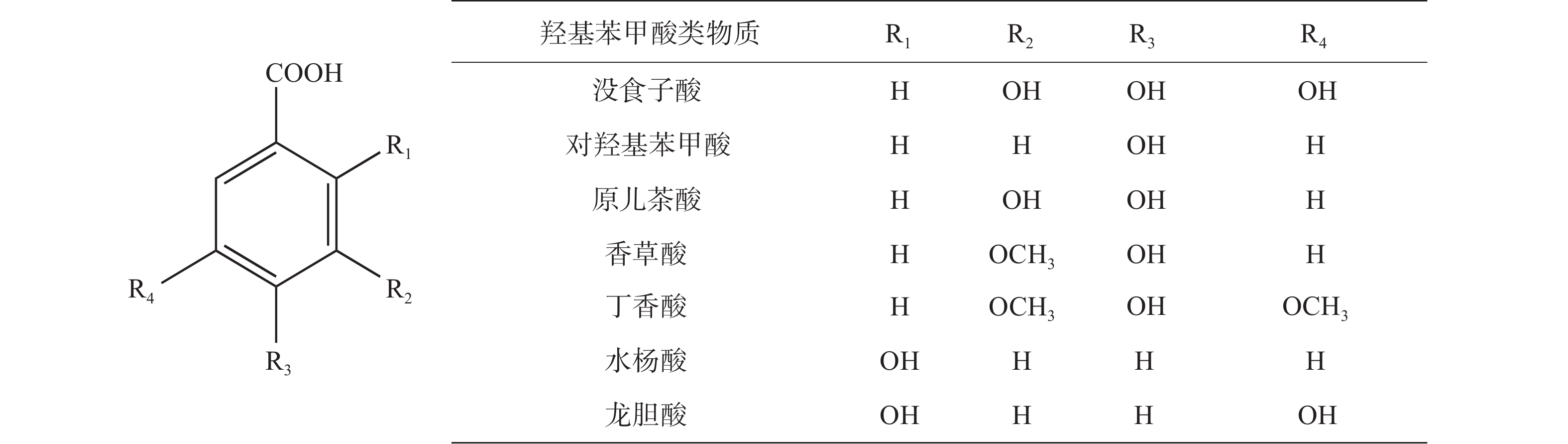
非黄酮类物质虽然未含有C6-C3-C6的结构骨架,但它在果蔬生理生化方面起着不可或缺的作用。果蔬中常见的非黄酮类物质按结构分为羟基苯甲酸、羟基肉桂酸、水解单宁。羟基苯甲酸类物质的骨架为C6-C1,在结构中因为苯环上的取代基不同所以有很多不同的物质,果蔬中常见的羟基苯甲酸类物质有没食子酸、对羟基苯甲酸、原儿茶酸、香草酸、丁香酸、水杨酸等,结构如图5所示[20-23]。
羟基肉桂酸的结构骨架为C6-C3。果蔬中羟基肉桂酸的含量比羟基苯甲酸的含量多,尤其是蔬菜中羟基肉桂酸含量是羟基苯甲酸的十倍,比如咖啡酸、p-香豆酸几乎存在于所有蔬菜中。果蔬中常见的羟基肉桂酸为绿原酸、咖啡酸、p-香豆酸、阿魏酸、芥子酸、2-羟基肉桂酸、3-羟基肉桂酸、异阿魏酸等,其结构如图6所示[24-26]。水解单宁由酚酸及其衍生物与多元醇或葡萄糖通过酯键形成,属C6-C1型酚类。根据分解产生的酚酸种类,可分为没食子单宁、鞣酸单宁等,主要存在于核桃、石榴、牡丹等中,结构复杂多变[27]。
2. 果蔬中常见的多酚
日常水果和蔬菜中都含有一定量的多酚类物质,水果和蔬菜是人类摄入多酚的主要来源,多酚对果蔬的色泽、风味产生影响的同时也会为人体健康带来益处。果蔬中的多酚种类繁多,像苹果、梨、猕猴桃、马铃薯等果蔬都含有一定量的多酚类物质。表1为常见果蔬的主要酚类化合物种类与含量,其中绿原酸、咖啡酸、儿茶素、没食子酸、槲皮素等酚类物质广泛存在于各种果蔬当中,起到了重要的作用[28-33]。
表 1 常见果蔬中多酚Table 1. Polyphenols in common fruits and vegetables3. 多酚介导的非酶褐变
3.1 易氧化的多酚物质
多酚氧化引起的褐变严重影响果蔬汁的货架期及品质,因此如何抑制褐变是果蔬汁生产的重要难题。前期研究发现多酚能否氧化取决于其结构中的B环。果蔬中常见的多酚按氧化难易程度进行分类如表2、表3所示,Ma等[34]近期研究发现含有邻苯二酚、邻苯三酚、对苯二酚基团的多酚容易发生氧化,因为这些基团氧化后能够形成稳定的自由基阴离子[35],其中邻苯三酚比邻苯二酚更容易发生自氧化[36]。具有这些官能团的酚类物质主要包括咖啡酸及其酯类、儿茶素、表儿茶素、花青素及其衍生物、没食子酸和槲皮素等[37]。单酚、间苯二酚和取代酚(特别是甲氧基衍生物)不容易被氧化,因为它们不能产生稳定的半醌自由基[35,38]。此外,异构体反应活性的不同导致氧化电位的差异,也会影响多酚的氧化速率。因为邻位和对位的电子密度最高,当苯环上的羟基位于邻位或对位时,芳香环被羟基活化导致反应活性增强,因此,对苯二酚和邻苯二酚的芳香环易被激活,而间苯二酚的芳香环由于电子密度低不易被激活,所以间苯二酚相对于对苯二酚或邻苯二酚不易被氧化。对苯二酚和邻苯二酚可以通过两个电子和两个质子的转移发生可逆反应形成醌,而间苯二酚在失去两个电子时不能产生邻或对醌类产物[39]。
表 2 易氧化的酚类结构Table 2. Easily oxidized phenolic structure名称 结构 代表性多酚
邻苯二酚
儿茶素,表儿茶素
花青素,甲基花青素
3,4-二羟基苯甲酸
咖啡酸邻苯三酚 
没食子儿茶素
表没食子儿茶素
花翠素
没食子酸对苯二酚 
龙胆酸 表 3 不易氧化的酚类结构Table 3. Not easily oxidized phenolic structure名称 结构 代表性多酚 间苯二酚 
类黄酮物质的A环 单酚 
p-香豆酸
对羟基苯甲酸
水杨酸
花葵素
山奈酚3.2 多酚氧化聚合引起的褐变
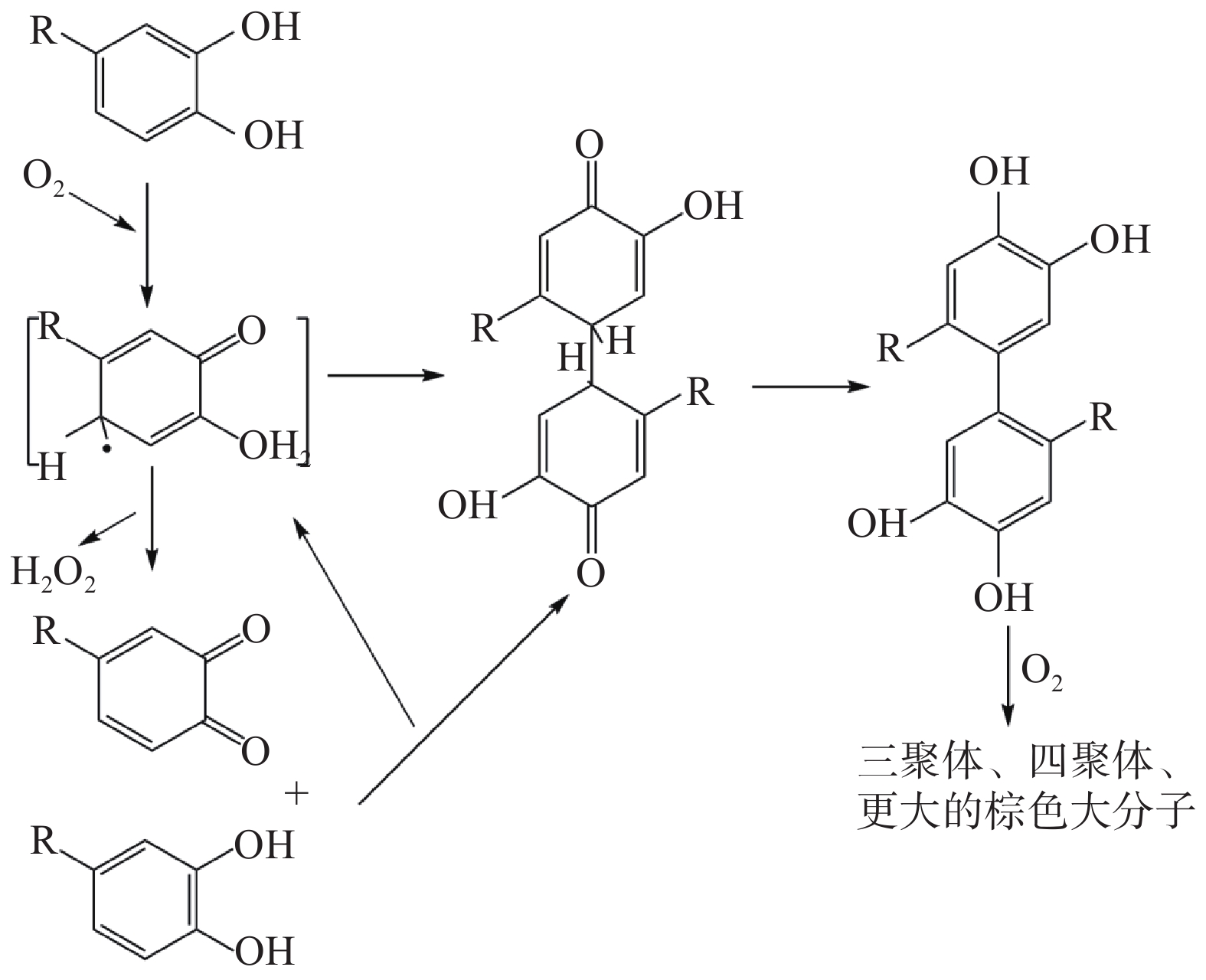
含邻苯二酚基团的多酚在氧气存在的条件下被氧化成醌,醌类物质进一步反应聚合形成黄棕色的大分子,最终导致褐变[40-41],因此具有邻苯二酚等结构的酚类物质是多酚非酶氧化聚合形成褐色物质的前提。酚类物质具有较高的pKa,在pH较低的果蔬汁等酸性条件下很难失去电子,从而延缓了酚类物质与O2直接反应的速率[42]。一些过渡金属离子,尤其是铁和铜,可以改变反应路径,降低反应所需的自由能,从而促进多酚氧化。作为初级氧化产物,醌的形成过程十分复杂,在Fe2+存在的条件下,氧气被连续的单电子还原产生超氧阴离子自由基,而Fe2+氧化为Fe3+[43],超氧阴离子自由基会迅速转化为氢过氧自由基(HOO·),邻苯二酚基团是HOO·的主要反应底物(邻苯三酚的反应类似),这些邻苯二酚和邻苯三酚基团可以通过与HOO·反应或与Fe3+配位被迅速氧化成半醌类化合物[44],同时产生过氧化氢。生成的半醌自由基立即与氢原子等其他自由基发生歧化反应,生成新的邻苯二酚结构或进一步氧化成醌[41-42]。
酚类的氧化偶联是一种双电子氧化,一般可能有外部和内部氧化两种耦合模式。在前一个过程中,电子从酚醛基团转移到外部氧化剂;而在后一个过程中,发生的是内部的氧化还原,其中一个部分在耦合步骤中被氧化,另一个被还原。酚类分子通过碳碳或碳氧耦合可以形成许多不同的产物,例如聚合物和醌类化合物。简单的酚类物质通过邻位或对位的羟基连接,以产生几种可能的二聚体;醌-酚二聚体也可以转化为新的双酚二聚体,或通过两个半醌直接形成二聚体。在氧化耦合反应中产生的二聚体或聚合物比它们的初始酚类具有更低的氧化还原电位,因此更容易氧化,从而加速酚类的聚合反应[45],最终产生更大的聚合物,如图7所示。
复杂的多羟基芳香化合物可能发生分子内或分子间的耦合[44]。黄酮类物质结构中含间苯二酚A环和邻苯二酚B环两种不同的功能基团。A环和B环不结合,一个环上的OH的电离不会显著影响另一个环的OH的电离。Ma等[34]发现A环上的间苯二酚基团能够通过与醌类反应来淬灭醌,生成无色的邻苯二酚和黄酮加合物,从而防止褐变[46]。而B环上的邻苯二酚基团可以通过氧化形成具有反应活性的褐变前体黄酮类醌。产生的黄酮类醌可进一步与另一个黄酮类化合物的A环反应,生成黄酮类化合物二聚体[47]。以儿茶素为例,儿茶素自氧化或化学氧化导致聚合物的形成,是由于一个单元的A环与另一个单元的B环之间反复的缩合反应(“头尾”聚合机理)引起的。当儿茶素醌存在时,邻苯二酚单元的A环的6号碳对儿茶素醌B环的亲核攻击导致脱氢儿茶素(即儿茶素二聚体)的形成,然后,B环氧化为脱氢儿茶素醌后,通过儿茶素醌为氧化剂进行偶联氧化,脱氢儿茶素可能通过两种不同的分子内加成反应,再经过异构化生成黄色二聚体[47]。产物具有相当数量的共轭双键,提供了可见的吸光度,从而导致褐变。因此,醌类物质是褐变形成的重要前体物,如何阻止醌的形成或加速醌的消除是抑制褐变的关键卡脖子问题。
4. 多酚介导非酶褐变的影响因素
前期研究发现,影响酚类非酶褐变的因素有很多,比如金属离子含量、温度、pH以及抗氧化剂。不同影响因素影响褐变的作用机理不同,可以通过影响酚类的氧化或通过与醌发生亲核加成或氧化还原反应从而影响褐变程度。
4.1 金属离子
Danilewicz等发现在酸性条件下,O2无法与酚类物质直接结合[42]。后续研究表明金属离子如铁离子、铜离子等在反应过程中能够起到催化作用,促进酚类物质的氧化[35],单独一种金属离子的催化作用较弱,而多种金属离子之间的协同作用较为明显[48]。在Danilewicz等用邻苯二酚建立了相应的反应模型体系中,添加亚铁离子和铜离子之前,模型当中的酚类物质不会发生显著变化[49];在含有亚铁离子和铜离子葡萄酒中,添加了亚铁氰化钾去除金属离子后,邻苯二酚同样不会发生显著变化[50]。说明一旦体系当中缺少了铁离子与铜离子等金属离子的催化作用,整个反应将会减缓甚至停止。其原因主要分为两方面,一方面O2与Fe2+反应产生氢过氧自由基,进而产生过氧化氢;另一方面Fe3+形成后与酚类物质进行螯合,酚类物质被氧化成半醌自由基和醌类物质,Fe3+则被还原成Fe2+继续循环反应。Danilewicz等在实验中添加了Fe2+,观察到体系中氧气含量下降,且随着金属含量的增加,氧化速度加快,确认了Fe2+和氧气的相互作用关系[51]。
4.2 温度
温度是果蔬汁褐变的重要影响因素,高温将导致醌类物质的稳定性降低,酚类物质与醌类物质之间的转化的平衡倾斜,从而促进酚类物质的氧化。刘静和Dong等分别在果蔬汁体系和化学氧化模型体系中进行了温度与酚类物质氧化之间关系的研究,发现随着温度的升高,酚类物质的含量越来越少,酚类物质氧化加剧[52-53]。李娜研究了温度对红树莓果蔬汁颜色稳定性的影响,发现温度越高,红树莓果蔬汁的吸光度越大[54],吸光度反映了果蔬汁褐变指数,褐变指数的增大表明果蔬汁当中酚类物质的氧化产物的增加。蓝莓汁在不同温度下同样得出高温导致非酶褐变加剧,且总酚含量减少的结果[55]。Fernandezzurbano等[56]比较了20和55 ℃下的葡萄酒的褐变程度,证明了高温条件下葡萄酒褐变速度加快,褐变时间缩短。基于以上研究猜测高温影响了花色苷等酚类物质的化学氧化反应速率,促进了酚类物质的氧化,最终导致果蔬汁颜色的加深。但是,无论是蓝莓汁,红树莓汁还是葡萄酒体系中褐变的加深,都不能完全证明温度升高会影响酚类物质非酶氧化速率,很有可能是酶和美拉德反应的作用。未来可以单独制作酚类物质非酶氧化的模拟体系,在排除多酚氧化酶的干扰下,在不同的温度条件下,深入研究温度对多酚介导的非酶褐变的影响。
4.3 pH
pH是影响多酚介导的非酶褐变的重要因素之一。Dong等[52]用不同的参数,包括pH、温度和酚类物质,模拟了酚类物质化学氧化体系。在酚类物质被氧化以后,根据T420测定褐变程度,得到不同因素的影响能力从大到小排列为pH>酚的种类>温度,证明pH在多酚氧化中的重要性。早在1989年,Cilliers等研究咖啡酸的氧化模型时发现pH的变化与酚类氧化息息相关。随后又发现pH的升高会导致酚类氧化速率加快[57]。接下来研究当中发现酚类物质氧化速率随pH的增加而增加,推测高pH条件下醌类物质不稳定性增加,从而导致酚类物质氧化速率的增加[48]。在模拟酚类物质氧化体系下,发现酚类化合物的氧化更容易在碱性条件下发生,该实验结果与Dong、Hocking、胡燕等的研究结果一致[52,58-59]。这是由于酚类物质在碱性条件下,可与氧气直接反应,酚类化合物的弱酸性特性(pKa9~10)允许它们形成能与氧反应的酚酸阴离子。从酚酸阴离子中去除一个电子会产生半醌,半醌可以不成比例地产生醌和苯酚;在中高pH(pH7~9)时,具有邻苯三酚单位(如表没食子儿茶素)的酚类物质比具有简单邻苯二酚取代的酚类物质更容易氧化[60];在pH>10时,C环上的取代基可被氧化,使酚类化合物与邻苯二酚或邻苯三酚的反应活性平衡[36]。但是,由于果蔬汁是偏酸性的,并且多酚的pKa很高,因此果蔬汁多酚中只有一小部分会被去质子化,从而消除了这种直接的氧化途径,如上文所述,在酸性条件下,多酚需要通过自由基和过渡金属与氧气进行反应。
4.4 抗氧化剂
抗氧化剂在食品中广泛应用,Nikolantonaki等用不同亲核试剂与多酚的氧化产物醌类物质发生反应,得到反应速率从小到大依次为:氨基酸<挥发性硫醇<抗氧化剂,说明在多酚引起的非酶褐变当中,抗氧化剂会先于酚类等亲核试剂与醌发生反应,从而起到保护作用,是未来解决多酚引起的非酶褐变问题的一个方向。目前用抗氧化剂抑制多酚引起的非酶褐变问题主要在葡萄酒领域研究,其中常应用的抗氧化剂有二氧化硫、谷胱甘肽、抗坏血酸等[61]。
4.4.1 二氧化硫
二氧化硫(SO2)是一个被广泛使用的抗氧化剂,同时具有抗微生物特性和抗氧化特性[62]。在葡萄酒中防止多酚介导非酶褐变的主要物质就是SO2。SO2在溶液中以亚硫酸氢盐(
HSO−3 )和亚硫酸盐(SO2−3 )形式存在。亚硫酸盐通过与O2反应阻止氧化,这种观点已存在了多年[63]。而Danilewicz等研究发现,SO2在氧化体系中无法直接与氧气发生反应,而是与H2O2和醌类物质发生反应;Nikolantonaki等用高效液相色谱(HPLC)发现了二氧化硫与醌类发生两种反应:近90% SO2与醌发生氧化还原反应生成多酚,小部分SO2与醌类发生了亲核加成反应,生成了三种加成产物,这三种加成产物具有相同的分子式C7H8O5S [35,44,61,64]。此外,有些葡萄酒中SO2消耗少于其他葡萄酒,说明它们中可能含有反应活性更强的还原剂,推测是抗坏血酸和亚硫酸盐一起添加所致[44]。Nikolantonaki等也发现将谷胱甘肽与SO2结合使用可以降低SO2的添加量以及其对感官品质的负面影响,具有更强的抗氧化效果[61]。这说明SO2与其他抗氧化剂结合具有更强的协同作用。近些年来,越来越多的研究表明二氧化硫可能不是一种有效的抗氧化剂[65-66]。而且SO2能够在特定人群体内产生过敏反应,法律上已经限制了其最高含量。未来的研究方向将使用性能相似但负面影响较小、效率较高的新化学品替代SO2[67]。4.4.2 谷胱甘肽
谷胱甘肽(GSH)是L-谷氨酸、L-半胱氨酸和甘氨酸的三肽。谷胱甘肽主要用做抗氧化剂、免疫增强剂和排毒剂。在过去的几十年中,GSH一直和其他抗氧化剂协同使用,直到最近被提出作为替代SO2的抗氧化剂[68]。GSH的抗氧化机理是捕捉酚类物质生成的邻醌而生成无色化合物,从而防止深色的醌类聚合物的生成。Nikolantonak等建立邻苯二酚生成的醌与GSH的反应模型体系,发现他们之间发生的是亲核加成反应,加成产物为一个或两个GSH与邻苯二酚结合的化合物,说明GSH和邻苯二酚可以发生两次亲核加成反应[61]。Singleton等研究发现GSH和邻醌反应生成GRP(2-S-谷胱甘肽基乙酸),是一种无色的化合物,能防止果肉褐变[69-70]。Webber等也证明了GSH阻止了儿茶素的聚合物生成,减少了褐变反应[71]。在GSH与其他抗氧化剂协同作用方面,Roussis等发现GSH与SO2同时使用能弥补SO2造成的挥发性化合物的损失[72]。Sonni等把GSH和抗坏血酸结合使用,证明在抗氧化能力上该组合比单独使用GSH或抗坏血酸更有效[73]。已有的研究表明GSH拥有SO2的抗氧化效果。未来关于GSH作为抗氧化剂的研究领域可以更为广泛,并逐渐的引入到果蔬汁体系当中。
4.4.3 抗坏血酸
抗坏血酸俗称VC,具有很强的还原性,它广泛存在于新鲜果蔬中。抗坏血酸和异抗坏血酸是异构体,都具有抗氧化性。目前抗坏血酸及其异构体也被认为是优良的抗氧化剂[74],Nikolantonak等研究表明抗坏血酸与醌类物质发生氧化还原反应,直接还原醌类物质成多酚。在反应模型中抗坏血酸不会直接与氧气反应,它通过消耗生成的醌类物质而促进氧气与多酚的反应,进而起到抗氧化作用[61]。但是抗坏血酸没有抗微生物活性,这方面无法替代SO2[75]。目前抗坏血酸多用于SO2的协同剂,共同起到抗氧化作用。
5. 结论与展望
果蔬中含有多种多酚,它们与果蔬汁的非酶褐变密切相关。本文系统介绍了酚类引起褐变的机理,根据酚类的不同结构和氧化的难易程度对多酚进行了分类。多酚的酶促褐变已经被广泛研究报道,可以通过消除多酚氧化酶而抑制褐变,然而目前对于多酚氧化引起的非酶褐变及其机理的相关研究较少,寻找有效预防或者阻止多酚氧化引起的非酶褐变方法是未来果蔬汁产业亟需解决的科学问题。本文从引起酚类非酶氧化的原因及过程入手,揭示含邻苯二酚基团的多酚与氧气接触后,在过渡金属离子和自由基作用下通过电子转移非酶氧化形成醌类物质,醌类再进一步氧化并与多酚聚合最终形成褐色物质,因此多酚氧化聚合形成具有大分子双键的多酚聚合物是导致褐变的主要原因。在今后的研究中,可以从多酚氧化的源头入手,减少易氧化的酚类物质的含量;隔绝氧气,避免其与多酚物质接触;剔除果蔬汁中的金属离子等途径,有效减缓氧化过程。同时可以从氧化过程入手,通过添加抗氧化剂将醌类还原成多酚形式,从而防止褐变;也可通过添加亲核试剂将醌类物质捕获,阻断醌类物质的进一步反应,避免其继续氧化聚合形成大分子聚合物。同时,温度、pH等因素对酚类介导的非酶褐变也具有较强的影响,降低温度及保持酸性环境可延缓多酚的非酶氧化,从而保持果蔬汁的品质。
-
表 1 常见果蔬中多酚
Table 1 Polyphenols in common fruits and vegetables
表 2 易氧化的酚类结构
Table 2 Easily oxidized phenolic structure
名称 结构 代表性多酚
邻苯二酚
儿茶素,表儿茶素
花青素,甲基花青素
3,4-二羟基苯甲酸
咖啡酸邻苯三酚 
没食子儿茶素
表没食子儿茶素
花翠素
没食子酸对苯二酚 
龙胆酸 表 3 不易氧化的酚类结构
Table 3 Not easily oxidized phenolic structure
名称 结构 代表性多酚 间苯二酚 
类黄酮物质的A环 单酚 
p-香豆酸
对羟基苯甲酸
水杨酸
花葵素
山奈酚 -
[1] 刘燕. 中国果蔬汁饮料的发展现状和未来展望综述[J]. 现代食品,2018(6):25−27. [LIU Y. Development status and future prospects of fruit and vegetable juice drink in China[J]. Morden Food,2018(6):25−27. [2] DEPAEGE D, COUDIJZER K, NOTEN B, et al. A comparative study between spiral-filter press and belt press implemented in a cloudy apple juice production process[J]. Food Chemistry,2015,173:986−996. doi: 10.1016/j.foodchem.2014.10.019
[3] MOON K M, KWON E B, LEE B, et al. Recent trends in controlling the enzymatic browning of fruit and vegetable products[J]. Molecules,2020,25(12):2754. doi: 10.3390/molecules25122754
[4] GINER J, GIMENO V, BARBOSA CANOVAS G V, et al. Effects of pulsed electric field processing on apple and pear polyphenoloxidases[J]. Food Science and Technology International,2001,7(4):339−345. doi: 10.1106/MJ46-8J9U-1H11-T0ML
[5] GACCHE R N, WARANGKAR S C, GHOLE V S. Glutathione and cinnamic acid: Natural dietary components used in preventing the process of browning by inhibition of polyphenol oxidase in apple juice[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2004,19(2):175−179. doi: 10.1080/14756360310001640472
[6] 刘琪, 王冰, 欧雅文, 等. 高压均质对菠萝汁贮藏货架期及品质的影响[J]. 中国食品学报,2019,19(1):156−162. [LIU Q, WANG B, OU Y W, et al. Effect of high pressure homogenization on the shelf life and quality of pineapple juice[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(1):156−162. [7] CAO X, CAI C, WANG Y, et al. Effects of ultrasound processing on physicochemical parameters, antioxidants, and color quality of bayberry juice[J]. Journal of Food Quality,2019:12.
[8] SZCZEPAŃSKA J, BARBA F J, SKĄPSKA S, et al. High pressure processing of carrot juice: Effect of static and multi-pulsed pressure on the polyphenolic profile, oxidoreductases activity and colour[J]. Food Chemistry,2020,307:125549. doi: 10.1016/j.foodchem.2019.125549
[9] MA L, WATRELOT A A, ADDISON B, et al. Condensed tannin reacts with SO2 during wine aging, yielding flavan-3-ol sulfonates[J]. J Agric Food Chem,2018,66(35):9259−9268. doi: 10.1021/acs.jafc.8b01996
[10] WATRELOT A A, DAY M P, SCHULKIN A, et al. Oxygen exposure during red wine fermentation modifies tannin reactivity with poly-L-proline[J]. Food Chemistry,2019,297:124923. doi: 10.1016/j.foodchem.2019.05.197
[11] DANILEWICZ J C, STANDINE M J. Reaction mechanisms of oxygen and sulfite in red wine[J]. American Journal of Enology and Viticulture,2018,69(3):189−195. doi: 10.5344/ajev.2018.17095
[12] 陈坚生, 杨幼慧, 詹金花, 等. 果酒中酚类物质及其非酶褐变的研究进展[J]. 食品科学,2009,30(7):281−284. [CHEN J S, YANG Y H, ZHAN J H, et al. Research progress on phenolic compounds and non-enzymatic browning in fruit wine[J]. Food Science,2009,30(7):281−284. doi: 10.3321/j.issn:1002-6630.2009.07.065 [13] WATERHOUSE A L. Wine phenolics[C]//D K DAS, F URSINI. Alcohol and Wine in Health and Disease, 2002: 21−36.
[14] 高金燕, 宋永钢, 毛江华. 果蔬中黄酮类物质的测定[J]. 中国食品添加剂,2007(2):211−213. [GAO J Y, SONG Y G, MAO J H. The determination of flavonoids in some fruits and vegetables[J]. China Food Additives,2007(2):211−213. doi: 10.3969/j.issn.1006-2513.2007.02.044 [15] 张欣珂, 赵旭, 成池芳, 等. 葡萄酒中的酚类物质Ⅰ: 种类、结构及其检测方法研究进展[J]. 食品科学,2019,40(15):255−268. [ZHANG X K, ZHAO X, CHENG C F, et al. Phenolics in wines I: A review of categories, structures and detection methods[J]. Food Science,2019,40(15):255−268. doi: 10.7506/spkx1002-6630-20180916-159 [16] HOLLMAN P C H, ARTS I C W. Flavonols, flavones and flavanols-nature, occurrence and dietary burden[J]. Journal of the Science of Food and Agriculture,2000,80(7):1081−1093. doi: 10.1002/(SICI)1097-0010(20000515)80:7<1081::AID-JSFA566>3.0.CO;2-G
[17] ARON P M, KENNEDY J A. Flavan-3-ols: Nature, occurrence and biological activity[J]. Molecular Nutrition & Food Research,2008,52(1):79−104.
[18] HE F, LIANG N N, MU L, et al. Anthocyanins and their variation in red wines I. Monomeric anthocyanins and their color expression[J]. Molecules,2012,17(2):1571−1601. doi: 10.3390/molecules17021571
[19] MONAGES M, NUNEZ V, BARTOLOME B, et al. Anthocyanin-derived pigments in graciano, tempranillo, and cabernet sauvignon wines produced in spain[J]. American Journal of Enology and Viticulture,2003,54(3):163−169.
[20] 魏云潇, 余作龙, 韩超, 等. 果蔬酚酸的研究及在保鲜中应用进展[J]. 安徽农业科学,2020,48(7):22−26. [WEI Y X, YU Z L, HAN C, et al. Research on phenolic acid of fruits and vegetables and its application progress in preservation[J]. Journal of Anhui Agricultural Sciences,2020,48(7):22−26. doi: 10.3969/j.issn.0517-6611.2020.07.007 [21] 何丽清, 佘志刚. 五倍子染料中没食子酸的分子结构鉴定与性能研究[J]. 化纤与纺织技术,2017,46(2):5−9. [HE L Q, YU Z G. Molecular structure identification and performance study of gallic acid in gallic dye[J]. Chemical Fiber & Textile Technology,2017,46(2):5−9. [22] PACHECO PALENCIA L A, MERTENS TALCOTT S, TALCOTT S T. Chemical composition, antioxidant properties, and thermal stability of a phytochemical enriched oil from acai (Euterpe oleracea Mart.)[J]. Journal of Agricultural and Food Chemistry,2008,56(12):4631−4636. doi: 10.1021/jf800161u
[23] 张慧, 张望宁, 周颖, 等. 利用Briggs-Rauscher振荡反应测定丁香酸[J]. 安徽大学学报(自然科学版),2019,43(6):78−84. [ZHANG H, ZHANG W N, ZHOU Y, et al. Determination of syringic acid by Briggs-Rauscher oscillation reaction[J]. Journal of Anhui University,2019,43(6):78−84. [24] 侯晋, 付杰, 张志明, 等. 咖啡酸衍生物的生物活性与化学结构的改造[J]. 复旦学报(医学版),2011,38(6):546−552. [HOU J, FU J, ZHANG Z M, et al. Biological activity and chemical structure modification of caffeic acid derivatives[J]. Journal of Fudan University,2011,38(6):546−552. [25] CLIFFORD M N, JOHNSTON K L, KNIGHT S, et al. Hierarchical scheme for LC-MSn identification of chlorogenic acids[J]. Journal of Agricultural and Food Chemistry,2003,51(10):2900−2911. doi: 10.1021/jf026187q
[26] GRAF E. Antioxidant potential of ferulic acid[J]. Free Radical Biology and Medicine,1992,13(4):435−448. doi: 10.1016/0891-5849(92)90184-I
[27] 凌关庭. 有“第七类营养素”之称的多酚类物质[J]. 中国食品添加剂,2000(1):28−37. [LING G T. Polyphenols known as “the seventh nutrient”[J]. China Food Additives,2000(1):28−37. [28] 张晋芬, 袁冰, 冷平, 等. 梨、苹果和香蕉中8种多酚类物质的微波提取与高效液相色谱法测定[J]. 分析测试学报,2008,27(12):1371−1374,1378. [ZHANG J F, YUAN B, LENG P, et al. Determination of polyphenols in fruit by the combination of microwave extraction and high performance liquid chromatography[J]. Journal of Industrumental Analysis,2008,27(12):1371−1374,1378. doi: 10.3969/j.issn.1004-4957.2008.12.025 [29] 李葵花, 高玉亮, 玄春吉, 等. 不同马铃薯品种抗氧化物质含量及抗氧化活性比较[J]. 吉林农业大学学报,2014,36(1):56−60. [LI K H, GAO Y L, XUAN C J, et al. Comparison of antioxidant content and antioxidant activity of different potato cultivars[J]. Journal of Jilin Agricultural University,2014,36(1):56−60. [30] NEVEU V, PEREZ JIMENEZ J, VOS F, et al. Phenol-explorer: An online comprehensive database on polyphenol contents in foods[J]. Database the Journal of Biological Databases and Curation,2010,10:bap024.
[31] 韩明虎, 王春林, 胡浩斌, 等. 庆阳红富士苹果中多酚类成分组成及含量分析[J]. 食品工业科技,2018,39(20):244−248. [HANG M H, WANG C L, HU H B, et al. Analysis of compostion and content of polyphenols in qingyang red fuji apple[J]. Science and Technology of Food Industry,2018,39(20):244−248. [32] 孟实, 张晓书, 赵余庆. 树莓与蓝莓中多酚类成分的HPLC测定[J]. 食品研究与开发,2014,35(3):81−84. [MENG S, ZHANG X S, ZHAO Y Q. Analysis of phenolic compounds in blue berry and raspberry by HPLC[J]. Food Research and Development,2014,35(3):81−84. doi: 10.3969/j.issn.1005-6521.2014.03.022 [33] 郑妍, 张春岭, 刘慧, 等. UPLC法测定猕猴桃果汁中的酚类物质含量[J]. 果树学报,2018,35(8):1006−1015. [ZHENG Y, ZHANG C L, LIU H, et al. Determination of phenolic compounds in kiwifruit juice by UPLC[J]. Journal of Fruit Science,2018,35(8):1006−1015. [34] MA L, WATERHOUSE A L. Flavanols react preferentially with quinones through an electron transfer reaction, stimulating rather than preventing wine browning[J]. Analytica Chimica Acta,2018,1039:162−171. doi: 10.1016/j.aca.2018.07.013
[35] WATERHOUSE A L, LAURIE V F. Oxidation of wine phenolics: A critical evaluation and hypotheses[J]. American Journal of Enology and Viticulture,2006,57(3):306−313.
[36] MOCHIZUKI M, YAMAZAKI S, KANO K, et al. Kinetic analysis and mechanistic aspects of autoxidation of catechins[J]. Biochimica Et Biophysica Acta-General Subjects,2002,1569(1-3):35−44. doi: 10.1016/S0304-4165(01)00230-6
[37] LI H, GUO A, WANG H. Mechanisms of oxidative browning of wine[J]. Food Chemistry,2008,108(1):1−13. doi: 10.1016/j.foodchem.2007.10.065
[38] LOPEZ TOLEDANO A, MAYEN M, MERIDA J, et al. Yeast-induced inhibition of (+)-catechin and (-)-epicatechin degradation in model solutions[J]. Journal of Agricultural and Food Chemistry,2002,50(6):1631−1635. doi: 10.1021/jf0109930
[39] ENACHE T A, OLIVEIRA BRETT A M. Phenol and para-substituted phenols electrochemical oxidation pathways[J]. Journal of Electroanalytical Chemistry,2011,655(1):9−16. doi: 10.1016/j.jelechem.2011.02.022
[40] GUYOT S, VERCAUTEREN J, CHEYNIER V. Structural determination of colourless and yellow dimers resulting from (+)-catechin coupling catalysed by grape polyphenoloxidase[J]. Phytochemistry,1996,42(5):1279−1288. doi: 10.1016/0031-9422(96)00127-6
[41] 刘伟伟. 苹果酒中酚类物质氧化聚合反应的研究[D]. 无锡: 江南大学, 2006. LIU W W. Oxidative polymerization of the phenolic compounds in ciders[D]. Wuxi: Jiangnan University, 2006.
[42] DANILEWICZ J C. Review of reaction mechanisms of oxygen and proposed intermediate reduction products in wine: Central role of iron and copper[J]. American Journal of Enology and Viticulture,2003,54(2):73−85.
[43] VIDOT K, MAURY C, SIRET R, et al. Phenolic compounds limit or promote oxidative degradation of pectin related to iron-H2O2 ratio[J]. Lwt-Food Science and Technology,2020,125:109324. doi: 10.1016/j.lwt.2020.109324
[44] DANILEWICZ J C. Reaction of oxygen and sulfite in wine[J]. American Journal of Enology and Viticulture,2016,67(1):13−17. doi: 10.5344/ajev.2015.15069
[45] MCDONALD P D, HAMILTON G A. Mechanism of phenolic oxidative coupling reactions-ferricyanide oxidation of 2, 3', 4-trihydroxybenzophenone, an example of a radical aromatic substitution mechanism[J]. Journal of the American Chemical Society,1973,95(23):7752−7758. doi: 10.1021/ja00804a035
[46] NIKOLANTONAKI M, MAGIATIS P, WATERHOUSE A L. Measuring protection of aromatic wine thiols from oxidation by competitive reactions vs wine preservatives with ortho-quinones[J]. Food Chemistry,2014,163:61−67. doi: 10.1016/j.foodchem.2014.04.079
[47] MA L, BUESCHL C, SCHUHMACHER R, et al. Tracing oxidation reaction pathways in wine using C-13 isotopolog patterns and a putative compound database[J]. Analytica Chimica Acta,2019,1054:74−83. doi: 10.1016/j.aca.2018.12.019
[48] DANILEWICZ J C. Review of oxidative processes in wine and value of reduction potentials in enology[J]. American Journal of Enology and Viticulture,2012,63(1):1−10. doi: 10.5344/ajev.2011.11046
[49] DANILEWICZ J C. Interaction of sulfur dioxide, polyphenols, and oxygen in a wine-model system: Central role of iron and copper[J]. American Journal of Enology and Viticulture,2007,58(1):53−60.
[50] DANILEWICZ J C, WALLBRIDGE P J. Further studies on the mechanism of interaction of polyphenols, oxygen, and sulfite in wine[J]. American Journal of Enology and Viticulture,2010,61(2):166−175.
[51] DANILEWICZ J C. Mechanism of autoxidation of polyphenols and participation of sulfite in wine: Key role of iron[J]. American Journal of Enology and Viticulture,2011,62(3):319−328. doi: 10.5344/ajev.2011.10105
[52] DONG X, ZHANG Y L, WANG F, et al. Relationship in between chemical oxidation and browning of flavanols[C]//M H GOLABI. 2nd International Conference on Agricultural and Biological Sciences. 2016.
[53] 刘静. 红枣浓缩汁加工和贮藏过程中非酶褐变的研究[D]. 西安: 西北大学, 2011. LIU J. Study on the non-enzymatic brow-ning of jujube juice concentrate during processing and storage[D]. Xi'an: Xibei University, 2011.
[54] 李娜. 红树莓果汁稳定性的研究[D]. 哈尔滨: 东北农业大学, 2010. LI N. Study on the stability of red raspberry juice[D]. Harbin: Northeast Agricultural University, 2010.
[55] 王鑫, 魏婧, 马蕊, 等. 蓝莓果汁贮藏中非酶褐变影响因素评价[J]. 食品工业科技,2019,40(14):94−99. [WANG X, WEI J, MA R, et al. Evaluation of non-enzymatic browning factors during storage of blueberry juice[J]. Science and Technology of Food Industry,2019,40(14):94−99. [56] FERNANDEZZURBANO P, FERREIRA V, PENA C, et al. Prediction of oxidative browning in white wines as a function of their chemical-composition[J]. Journal of Agricultural and Food Chemistry,1995,43(11):2813−2817. doi: 10.1021/jf00059a008
[57] CILLIERS J J L, SINGLETON V L. Nonenzymic autoxidative phenolic browning reactions in a caffeic acid model system[J]. Journal of Agricultural and Food Chemistry,1989,37(4):890−896. doi: 10.1021/jf00088a013
[58] HOCKING M B, INTIHAR D J. Oxidation of phenol by aqueous hydrogen-peroxide catalyzed by ferric ion-catechol complexes[J]. Journal of Chemical Technology and Biotechnology A-Chemical Technology,1985,35(7):365−381.
[59] 胡燕, 陈忠杰. 莲藕中酚类化合物的化学氧化模拟试验[J]. 湖北农业科学,2013,52(13):3128−3130. [HU Y, CHEN Z J. Simulation experiment of chemical oxidation of polyphenols in lotus root[J]. Hubei Agricultural Sciences,2013,52(13):3128−3130. doi: 10.3969/j.issn.0439-8114.2013.13.043 [60] MIURA Y H, TOMITA I, WATANABE T, et al. Active oxygens generation by flavonoids[J]. Biological & Pharmaceutical Bulletin,1998,21(2):93−96.
[61] NIKOLANTONAKI M, WATERHOUSE A L. A method to quantify quinone reaction rates with wine relevant nucleophiles: A key to the understanding of oxidative loss of varietal thiols[J]. Journal of Agricultural and Food Chemistry,2012,60(34):8484−8491. doi: 10.1021/jf302017j
[62] CARRASCON V, VALLVERDU QUERALT A, MEUDEC E, et al. The kinetics of oxygen and SO2 consumption by red wines. What do they tell about oxidation mechanisms and about changes in wine composition?[J]. Food Chemistry,2018,241:206−214. doi: 10.1016/j.foodchem.2017.08.090
[63] RIBEREAU GAYON P, GLORIES Y, MAUJEAN A, et al. Handbook of enology[M]// The chemistry of wine stabilization and treatments. Chichester: John Wiley & Sons Ltd. Chichester, 2000: 404.
[64] DANILEWICZ J C, SECCOMBE J T, WHELAN J. Mechanism of interaction of polyphenols, oxygen, and sulfur dioxide in model wine and wine[J]. American Journal of Enology and Viticulture,2008,59(2):128−136.
[65] CARRASCON V, FERNANDEZ-ZURBANO P, BUENO M, et al. Oxygen consumption by red wines. Part II: Differential effects on color and chemical composition caused by oxygen taken in different sulfur dioxide-related oxidation contexts[J]. Journal of Agricultural and Food Chemistry,2015,63(51):10938−10947. doi: 10.1021/acs.jafc.5b02989
[66] FERREIRA V, CARRASCON V, BUENO M, et al. Oxygen consumption by red wines. Part I: Consumption rates, relationship with chemical composition, and role of SO2[J]. Journal of Agricultural and Food Chemistry,2015,63(51):10928−10937. doi: 10.1021/acs.jafc.5b02988
[67] GUERRERO R F, CANTOS VILLAR E. Demonstrating the efficiency of sulphur dioxide replacements in wine: A parameter review[J]. Trends in Food Science & Technology,2015,42(1):27−43.
[68] KRITZINGER E C, BAUER F F, DU TOIT W J. Role of glutathione in winemaking: A review[J]. Journal of Agricultural and Food Chemistry,2013,61(2):269−277. doi: 10.1021/jf303665z
[69] CHEYNIER V F, TROUSDALE E K, SINGLETON V L, et al. Characterization of 2-s-glutathionylcaftaric acid and its hydrolysis in relation to grape wines[J]. Journal of Agricultural and Food Chemistry,1986,34(2):217−221. doi: 10.1021/jf00068a016
[70] SINGLETON V L, SALGUES M, ZAYA J, et al. Caftaric acid disappearance and conversion to products of enzymic oxidation in grape must and wine[J]. American Journal of Enology and Viticulture,1985,36(1):50−56.
[71] WEBBER V, DUTRA S V, SPINELLI F R, et al. Effect of glutathione during bottle storage of sparkling wine[J]. Food Chemistry,2017,216:254−259. doi: 10.1016/j.foodchem.2016.08.042
[72] ROUSSIS I G, LAMBROPOULOS I, TZIMAS P. Protection of volatiles in a wine with low sulfur dioxide by caffeic acid or glutathione[J]. American Journal of Enology and Viticulture,2007,58(2):274−278.
[73] SONNI F, CLARK A C, PRENZLER P D, et al. Antioxidant action of glutathione and the ascorbic acid/glutathione pair in a model white wine[J]. Journal of Agricultural and Food Chemistry,2011,59(8):3940−3949. doi: 10.1021/jf104575w
[74] CLARK A C, VESTNER J, BARRIL C, et al. The influence of stereochemistry of antioxidants and flavanols on oxidation processes in a model wine system: Ascorbic acid, erythorbic acid, (+)-catechin and (−)-epicatechin[J]. Journal of Agricultural and Food Chemistry,2010,58(2):1004−1011. doi: 10.1021/jf903233x
[75] SKOUROUMOUNIS G K, KWIATKOWSKI M J, FRANCIS I L, et al. The influence of ascorbic acid on the composition, colour and flavour properties of a Riesling and a wooded Chardonnay wine during five years’ storage[J]. Australian Journal of Grape and Wine Research,2005,11(3):355−368. doi: 10.1111/j.1755-0238.2005.tb00035.x
-
期刊类型引用(3)
1. 陈鑫龙,张媛媛,徐令斌,白雪冰,李爱华,陶永胜. 用多酚类指标表征干红葡萄酒味感质量的模型构建. 农业工程学报. 2024(08): 281-289 .  百度学术
百度学术
2. 赵越凡,王升楠,赵鹏涛,赵擎豪,刘炎,王飞,杜国荣,王晓宇. 酵母多糖对葡萄酒品质的影响机理研究进展. 食品与发酵工业. 2023(17): 316-323 .  百度学术
百度学术
3. 文有青,李芷瑶,宁滢,王海霞. 拉曼光谱技术在灵敏检测气味物质中的应用进展. 分析试验室. 2023(10): 1412-1420 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:






 下载:
下载:



