Extraction Process Optimization and Antioxidant, Anti-Inflammatory Activity of Total Flavonoids from Aletris spicata (Thunb.) Franch.
-
摘要: 为优化粉条儿菜总黄酮的提取工艺,并探究抗氧化、抗炎活性。本研究以总黄酮得率为指标,采用单因素实验考察乙醇浓度、料液比、提取时间对粉条儿菜总黄酮得率的影响,在此基础上利用Box-Behnke响应面法对提取条件进行优化;以DPPH自由基、ABTS+自由基、羟基自由基清除能力为指标评价粉条儿菜总黄酮的抗氧化活性;采用脂多糖诱导巨噬细胞RAW264.7建立炎症模型以评价粉条儿菜总黄酮抗炎活性。结果表明,粉条儿菜总黄酮的最佳提取工艺为:乙醇浓度40%、料液比1:125 g/mL、提取时间30 min,得到粉条儿菜总黄酮平均得率为1.34%;粉条儿菜总黄酮对DPPH自由基、ABTS+自由基、羟基自由基的清除能力与其质量浓度呈正相关,IC50值分别为5.46、21.69和56.01 µg/mL;粉条儿菜总黄酮在12.5~100 µg/mL范围内能明显抑制脂多糖诱导的RAW264.7巨噬细胞NO的分泌,其IC50为6.95 µg/mL。该提取工艺稳定、可靠,可用于粉条儿菜总黄酮的提取,且粉条儿菜总黄酮具有一定的抗氧化、抗炎活性。Abstract: The objective of this study was to optimize the extraction process of total flavonoids from Aletris spicata (Thunb.) Franch. and explore its antioxidant, anti-inflammatory activity. With the yield of total flavonoids as an evaluation index, single factor tests were used to investigate the effects of ethanol concentration, material liquid ratio and the extraction time on the total flavonoids content of Aletris spicata (Thunb.) Franch. On this basis, the Box-Behnken method was used to optimize the extraction conditions. The antioxidant activity of total flavonoids from Aletris spicata (Thunb.) Franch. were evaluated by measuring DPPH free radical, ABTS+ free radical, hydroxyl free radical scavenging ability. The inflammatory model was established by lipopolysaccharide-induced RAW 264.7 macrophages to evaluate the anti-inflammatory activity of total flavonoids from Aletris spicata (Thunb.) Franch.. The results showed that optimum extraction process was ethanol concentration of 40%, material liquid ratio of 1:125 g/mL, the extraction time of 30 min. The average yield of total flavonoids from Aletris spicata (Thunb.) Franch. was 1.34%. The scavenging ability of total flavonoids on DPPH radical, ABTS+ radical and hydroxyl radical were positively correlated with the concentration, and the IC50 values were 5.46, 21.69 and 56.01 µg/mL, respectively. The total flavonoids of Aletris spicata (Thunb.) Franch. could significantly inhibit the secretion of NO in LPS-induced RAW 264.7 macrophages within a certain concentration range, and the IC50 value was 6.95 µg/mL. The extraction process of total flavonoids is stable and reliable, which can be used for the extraction of total flavonoids, and the total flavonoids from Aletris spicata (Thunb.) Franch. has certain antioxidant and anti-inflammatory activity.
-
粉条儿菜为百合科植物粉条儿菜Aletris spicata (Thunb.) Franch.的全草[1],既可作为食品,也可作为药品[2],为我省少数民族常用药。其性味甘、苦、平,具有清肺止咳,活血调经,杀虫的功效,用于治疗咳嗽,咯血,百日咳,肺痈等[3]。粉条儿菜别名又叫肺筋草、小肺筋草、金线吊白米等,主要分布于自甘肃南延至华东和西南各省[4],通常生长在茂密的山坡、路旁或灌木丛中,喜潮湿、稍阴凉的环境,耐旱,适应性较强[5]。粉条儿菜在民间应用广泛,在清明后可作为野生蔬菜食用[6],在食品及药品领域具有较好的开发应用前景。
目前对粉条儿菜的基础研究较薄弱,仅有少量关于化学成分的研究。通过查阅文献可知,粉条儿菜含有生物碱、挥发油、甾体、黄酮等多类成分[7−11]。有学者从粉条儿菜中分离出美商陆酚A、异美商陆酚A[9]、5-羟基-3,7,4'-三甲氧基黄酮[10]、芹菜素[11]等黄酮类化合物。研究表明,多数黄酮类化合物具有抗氧化[12]、神经保护、抗心肌缺血、降压、抗炎、抗肿瘤及降血糖等药理作用[13−14],且多种疾病的发生均可能与炎症及氧化应激反应有关。因此,粉条儿菜中以芹菜素为代表的黄酮类化合物可能为该植物抗炎及抗氧化的有效组分之一,具有一定的研究意义。
植物中总黄酮类化合物的提取方法主要有溶剂提取法、酶解提取法、回流提取法及超声辅助提取法等[15],其中超声辅助提取法是利用超声波的空化、粉碎、搅拌等特殊作用,通过破坏植物体的细胞壁,同时促使颗粒破碎变小,有利于溶剂和底物之间的相互作用,使活性物质从植物体中释放出来。较多研究者采用超声辅助提取法结合响应面法对其工艺参数进行考察,以提高提取率。与其它提取方法相比,该提取方法具有提取时间短、提取效率高、操作简单的优点,近年来多用于植物中有效成分的提取[16−17]。王念等[18]以干燥桑叶为原料,采用不同提取溶剂,对浸提法和超声辅助提取法制备得到的桑叶提取物的提取率、提取物中总酚含量、抗氧化能力和对DPPH自由基的清除能力进行了比较,发现超声辅助提取法的提取率、提取物中总酚含量均高于浸提法,超声辅助提取法制备得到的桑叶提取物清除DPPH自由基的能力和总抗氧化能力略高于浸提法。张晓南等[19]通过超声辅助法从拐枣种子中提取二氢杨梅素,采用单因素和Box-Behnken响应面设计法考察了乙醇体积分数、超声辐照功率、提取温度、液料比和超声辐照时间对二氢杨梅素得率的影响,获取最佳提取工艺条件,这种提取方法简单快速,效率高,有利于拐枣资源的综合加工利用。
关于粉条儿菜中总黄酮的提取及抗氧化抗炎活性的研究未见相关报道。因此,本研究以粉条儿菜总黄酮为研究目标,采用超声辅助提取法,结合单因素实验和Box-Behnken响应面法对总黄酮的提取工艺进行优化,同时对体外抗氧化抗炎活性进行初步研究,旨在为其在食品及医药行业的充分开发利用奠定基础。
1. 材料与方法
1.1 材料与仪器
粉条儿菜 采自贵州省安顺市关岭县,经贵州中医药大学王波老师鉴定为百合科(Liliaceae)粉条儿菜属(Aletris)植物粉条儿菜Aletris spicata (Thunb.) Franch.的全草,干燥后粉碎,过40目筛,备用;芹菜素 标准品 (纯度≥98%) 成都曼思特生物科技有限公司;DPPH(1,1-苯基-2-苦肼基自由基,纯度≥98%)、ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐,纯度≥99.0%)、水杨酸 合肥干盛生物科技有限公司;L-抗坏血酸 (纯度≥99.5%) 上海易恩化学技术有限公司;RAW264.7细胞株 武汉普诺赛生命科技有限公司;脂多糖 Sigma公司;DMEM高糖培养基 Gibco公司;胎牛血清 Biological公司;CCK-8试剂盒 上海陶术生物科技有限公司;一氧化氮试剂盒 碧云天生物技术;其他试剂均为分析纯。
UV-5500紫外可见分光光度计 上海元析仪器有限公司;PS-40AD超声清洗机 深圳市洁康洗净电器有限公司;FA2204N电子天平 上海菁海仪器有限公司;EX225DZH电子天平 奥豪斯仪器常州有限公司;BB150二氧化碳培养箱、1550型全波长酶标仪 赛默飞世尔科技公司;CKX63倒置相差显微镜 上海蛮吉光电科技有限公司。
1.2 实验方法
1.2.1 总黄酮含量测定
1.2.1.1 标准品溶液的制备
取干燥至恒重的芹菜素标准品5.500 mg,精密称定,用40%乙醇溶解后转移至100 mL容量瓶中,定容至刻度,摇匀,即得55.00 µg/mL芹菜素标准品溶液。
1.2.1.2 测定波长的选择
分别精密移取标准品溶液和总黄酮供试品溶液各1.5 mL,置25 mL容量瓶中,加入1.5%三乙胺乙醇溶液2.0 mL,摇匀,用40%乙醇溶液定容至刻度,在200~800 nm范围内进行光谱扫描,结果显示两种溶液在396 nm处均有最大吸收,试样空白在相应位置无干扰,故选择396 nm作为测定波长。
1.2.1.3 标准曲线的绘制
精密移取标准品溶液1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL,分别置25 mL容量瓶中,按照“1.2.1.2”项下方法,以相应溶剂为空白,采用紫外-可见分光光度法,于396 nm处测定吸光度。以芹菜素浓度为横坐标(C),吸光度为纵坐标(A),绘制标准曲线,得回归方程A=0.0825C+0.0131(R2=0.9998),且在2.20~8.80 µg/mL浓度范围内呈良好线性关系。
1.2.1.4 粉条儿菜总黄酮含量的计算
取粉条儿菜粉末0.2 g,精密称定,置50 mL锥形瓶中,精密加入25 mL 40%乙醇,称定重量,在超声功率为240 W,超声频率为40 kHz,常温条件下超声处理30 min,放冷至室温,再称定重量,用40%乙醇补足减失的重量,摇匀,滤过,取续滤液,按照“1.2.1.2”项下方法测定吸光度(A),根据回归方程计算提取液中总黄酮的质量浓度(C),按式(1)计算粉条儿菜总黄酮得率。
Y=C×25×251.5×W×106×100 (1) 式中,Y为总黄酮得率,%;C为测定样品溶液中总黄酮的质量浓度,µg/mL;25为测定样品溶液体积,mL;25为总黄酮提取液总体积,mL;1.5为移取的总黄酮提取液体积,mL;W为称取粉条儿菜的质量,g。
1.2.2 单因素实验
1.2.2.1 乙醇浓度对总黄酮得率的影响
参照“1.2.1.4”项下方法进行提取,固定料液比1:125 g/mL,提取时间30 min,超声功率为240 W,超声频率为40 kHz,考察不同乙醇浓度(30%、40%、50%、60%、70%)对总黄酮得率的影响。
1.2.2.2 料液比对总黄酮得率的影响
参照“1.2.1.4”项下方法进行提取,固定乙醇浓度40%,提取时间30 min,超声功率为240 W,超声频率为40 kHz,考察不同料液比(1:75、1:100、1:125、1:150、1:175 g/mL)对总黄酮得率的影响。
1.2.2.3 提取时间对总黄酮得率的影响
参照“1.2.1.4”项下方法进行提取,固定料液比1:125 g/mL,乙醇浓度40%,超声功率为240 W,超声频率为40 kHz,考察不同提取时间(10、20、30、40、50 min)对总黄酮得率的影响。
1.2.3 响应面试验
在单因素实验基础上,利用Design-Expert 8.0.6软件,以乙醇浓度(A)、料液比(B)、提取时间(C)为影响因素,总黄酮得率(Y)为评价指标进行响应面试验,因素与水平见表1。
表 1 响应面试验因素与水平设计Table 1. Factors and levels of response surface experiment因素 水平 −1 0 1 A 乙醇浓度(%) 30 40 50 B 料液比(g/mL) 1:100 1:125 1:150 C 提取时间(min) 20 30 40 1.2.4 抗氧化活性测定
将提取得到的粉条儿菜总黄酮提取液浓缩至总黄酮浓度为0.50 mg/mL,即得用于抗氧化活性测定的样品溶液。
1.2.4.1 DPPH自由基清除能力的测定
参考文献[20−21]的方法并做出适当调整。分别精密移取0.025、0.05、0.1、0.5、1.0 mL样品溶液,置10 mL容量瓶中,用蒸馏水补至1 mL,加入3.5 mL 0.2 mmol/L DPPH乙醇溶液,用乙醇定容至刻度,避光反应30 min,在517 nm处测定吸光度值;以不加样品的溶液在同一波长下测定DPPH溶液吸光度值;以不加DPPH的溶液在同一波长下测定样品吸光度值;用同浓度水平VC溶液作为阳性对照,计算清除率。
DPPH自由基清除率(%)=(1−A1−A2A0)×100 (2) 式中,A1为样品溶液反应后的吸光度值;A2为不加DPPH的溶液吸光度值;A0为不加样品的溶液吸光度值。
1.2.4.2 ABTS+自由基清除能力的测定
参考文献[22−23]方法并略作修改。将7 mmol/L ABTS+溶液与2.45 mmol/L过硫酸钾溶液按体积1:1混合,室温避光下静置过夜,即得ABTS+储备液,在12~16 h内,将其用蒸馏水稀释10倍,得到ABTS+工作液。
分别精密移取0.025、0.1、0.5、1.0、1.5 mL样品溶液,置10 mL容量瓶中,各加入2.5 mL ABTS+工作液,加蒸馏水定容至刻度,室温下避光反应10 min,在734 nm处测定吸光度;以不加样品的溶液在同一波长下测定ABTS+工作液吸光度;以不加ABTS+工作液的溶液在同一波长下测定样品吸光度;用同浓度水平VC溶液作为阳性对照,计算清除率。
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 (3) 式中,A1为样品溶液反应后的吸光度值;A2为不加ABTS+工作液的溶液吸光度值;A0为不加样品的溶液吸光度值。
1.2.4.3 羟基自由基清除能力的测定
按陈佳敏等[24]报道的方法。精密移取0.3、0.6、0.9、1.2、1.5 mL样品溶液,置10 mL容量瓶中,用蒸馏水补至1.5 mL,各加入1 mL4.5 mmol/L FeSO4溶液和1 mL 4.5 mmol/L水杨酸-乙醇溶液,再加入1 mL 4.4 mmol/L H2O2溶液1 mL,于37 ℃水浴反应30 min,在510 nm处测定吸光度;以不加样品的溶液在同一波长下测定羟基自由基溶液吸光度;以不加H2O2的溶液在同一波长下测定样品吸光度;用同浓度水平VC溶液为阳性对照,计算清除率。
羟基自由基清除率(%)=(1−A1−A2A0)×100 (4) 式中,A1为样品溶液反应后的吸光度值;A2为不加H2O2的溶液吸光度值;A0为不加样品的溶液吸光度值。
1.2.5 抗炎活性测定
1.2.5.1 细胞活力检测
将RAW264.7细胞复苏于培养瓶中,在37 ℃、5%的CO2培养箱中培养。当细胞生长密度至80%左右时进行传代,用移液枪轻轻将贴壁的细胞吹打下来。
参照文献[25−26],取对数生长期的RAW 264.7细胞,将细胞浓度调整为5×104个/mL接种于96孔板中,每孔100 μL,于37 ℃、5% CO2培养箱中培养24 h。分别设置空白组、对照组及给药组,空白组及对照组加入DMEM培养基100 μL,且空白组不含细胞,给药组以不同质量浓度(12.5、25、50、100、150 μg/mL) 粉条儿菜总黄酮提取物,每组设置6个复孔,培养24 h后,每孔加入10 μL CCK-8试剂,培养箱孵育2 h,用酶标仪在450 nm处测量96孔板的OD值,以细胞存活率表示毒性大小。
细胞存活率(%)=OD给药组−OD空白组OD对照组−OD空白组×100 (5) 1.2.5.2 NO释放量检测
试验分为空白组(仅含DMEM无细胞),LPS模型组(LPS 1.0 μg/mL)及粉条儿菜总黄酮提取物组(LPS 1.0 μg/mL和12.5、25、50、100 μg/mL总黄酮提取物),每孔加入体积为100 μL,于37 ℃ CO2 培养箱中孵育24 h。用培养基稀释亚硝酸盐(NaNO2)对照品,收集96孔板细胞上清液50 μL,室温静置5 min,分别加入50 μL Griess试剂Ⅰ和50 μL Griess试剂Ⅱ,540 nm 处测量96孔板的OD值,代入NaNO2 对照曲线计算产生的NO量。
1.3 数据处理
所有试验均平行操作3份,采用Design-Expert 8.0.6软件进行响应面试验设计及数据处理;采用IBM SPSS Statistics25软件对数据进行差异性显著分析,P<0.05表示差异显著;采用Excel 2010和GraphPad Prism 8.3.0软件绘图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 乙醇浓度对总黄酮得率的影响
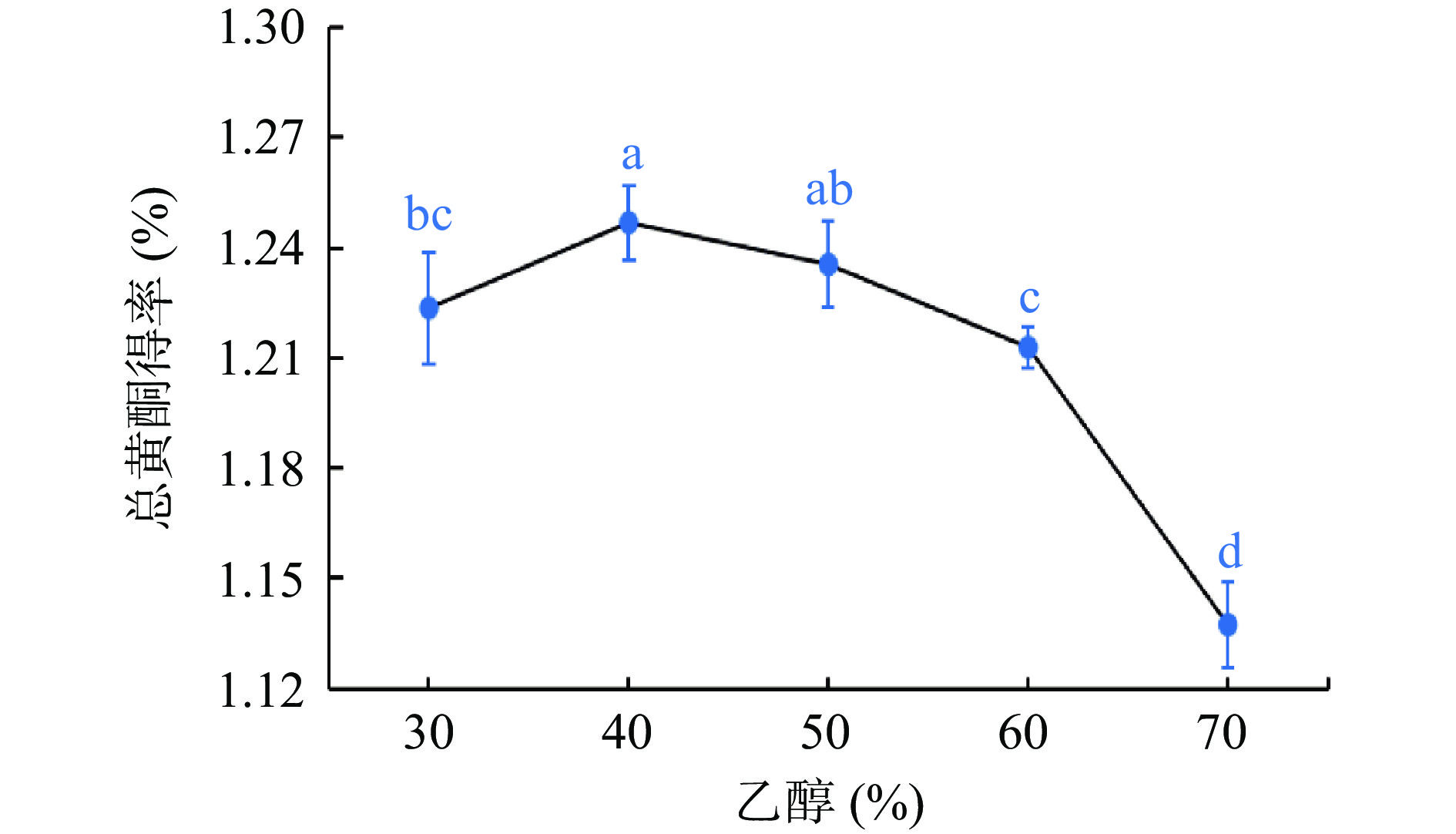
如图1所示,粉条儿菜总黄酮得率随乙醇浓度的增大呈现先升后降的趋势,当乙醇浓度为40%时,总黄酮得率达最大,为1.25%,之后随着乙醇浓度的增大,总黄酮得率逐渐降低。其原因可能是在低浓度范围内,即小于40%时,根据相似相溶原理,粉条儿菜中极性较大的黄酮类化合物易溶于大极性溶剂中,且由于乙醇的强渗透力,随着乙醇浓度的增大,粉条儿菜总黄酮得率逐渐上升;但乙醇浓度继续增大后,一方面是溶剂极性变小,另一方面是一些醇溶性、脂溶性或其它低极性杂质也同时被提出,从而导致总黄酮得率下降[27]。
2.1.2 料液比对总黄酮得率的影响
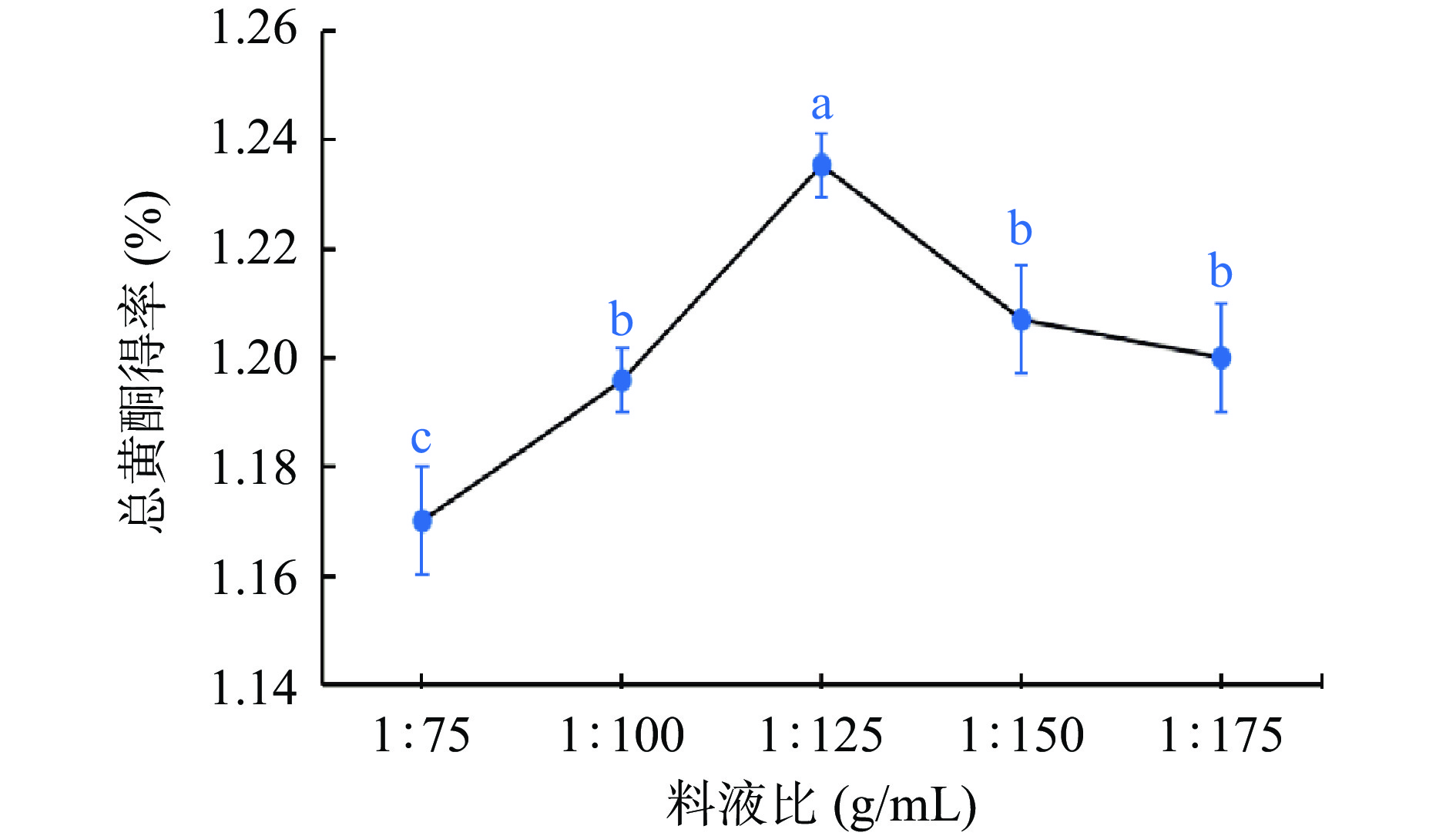
如图2所示,粉条儿菜总黄酮得率随着料液比增加而先升后略降,在1:125 g/mL时达到最大值,为1.24%,但继续增加时总黄酮得率反而略有降低。其原因可能是在提取溶剂体积较小时,固液间的接触面积较小,得到总黄酮较少,而后当料液比大于1:125 g/mL时,过多的提取溶剂会消耗部分超声波的能量,导致作用于粉条儿菜粉末中的超声波能量减弱,降低了黄酮类成分从细胞中溶出的能力,使得总黄酮得率下降[28]。
2.1.3 提取时间对总黄酮得率的影响
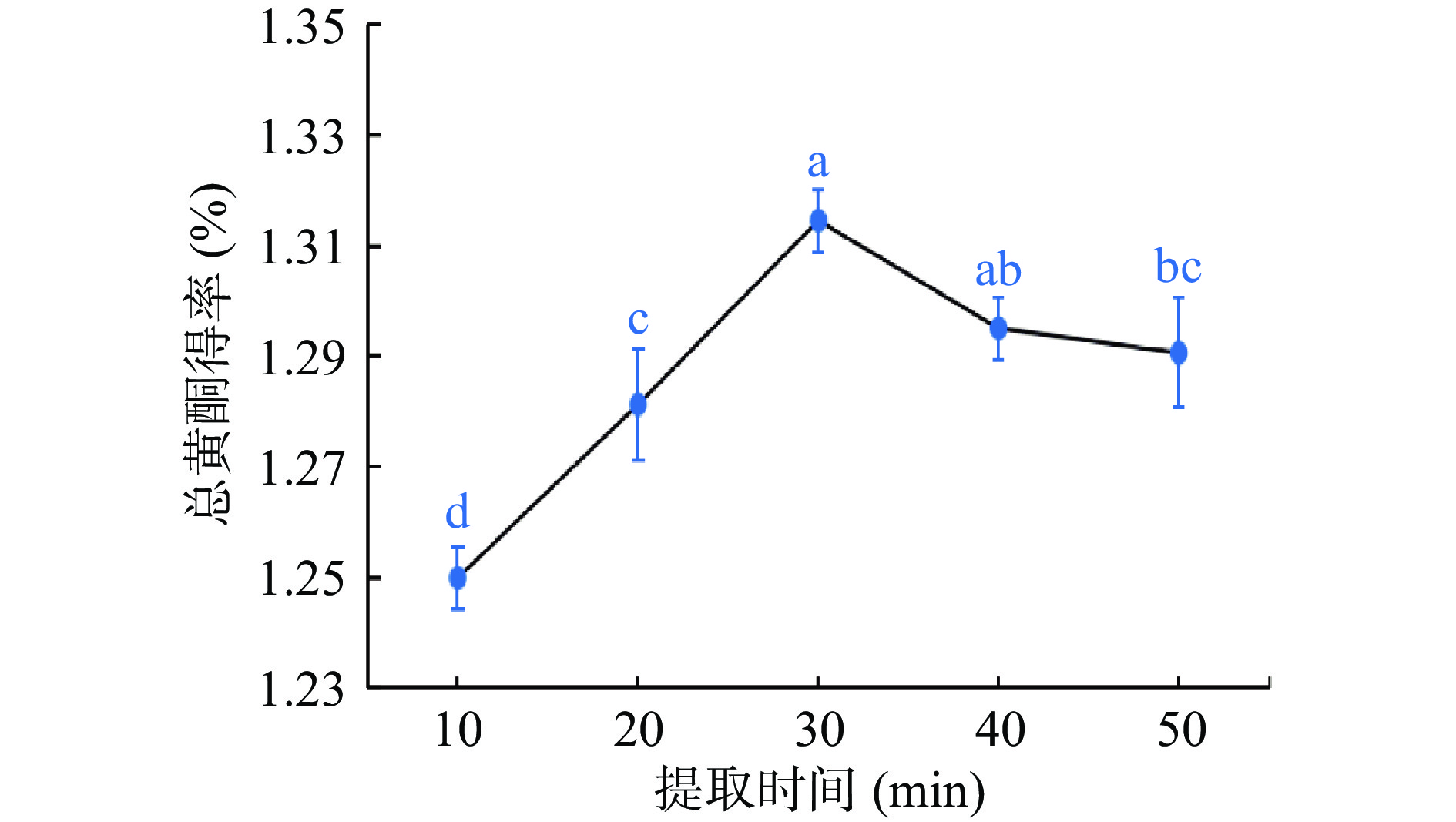
如图3所示,随着提取时间的增加,粉条儿菜总黄酮得率在10~30 min呈直线上升趋势,30 min时得率达最大,为1.31%,随着提取时间的继续延长,总黄酮得率反而出现下降的趋势。其原因可能是当提取时间过短时,粉条儿菜中的黄酮类成分没有被完全溶出,总黄酮得率较低,在30 min之后,随着提取时间的增加,其它杂质逐渐被溶出,或由于长时间超声波振荡的影响,粉条儿菜中一些不稳定黄酮类成分被破坏,导致总黄酮的得率减少[29]。
2.2 响应面试验结果
2.2.1 响应面模型的建立与分析
在单因素实验基础上,以乙醇浓度(A)、料液比(B)、提取时间(C)为影响因素,总黄酮得率(Y)为评价指标进行响应面分析。结果见表2。
表 2 试验设计及结果Table 2. Experiment design and results实验号 A乙醇浓度
(%)B料液比
(g/mL)C提取时间
(min)总黄酮得率
(%)1 40 1:150 40 1.29±0.02 2 30 1:100 30 1.21±0.01 3 50 1:125 40 1.28±0.06 4 50 1:125 20 1.25±0.13 5 40 1:150 20 1.25±0.07 6 30 1:125 40 1.21±0.23 7 50 1:100 30 1.26±0.12 8 40 1:100 40 1.26±0.05 9 40 1:125 30 1.33±0.03 10 50 1:150 30 1.28±0.16 11 30 1:125 20 1.16±0.32 12 30 1:150 30 1.23±0.41 13 40 1:125 30 1.29±0.08 14 40 1:125 30 1.32±0.16 15 40 1:125 30 1.31±0.05 16 40 1:125 30 1.31±0.01 17 40 1:100 20 1.25±0.09 根据Box-Behnken响应面法得到的试验结果,利用Design-Expert 8.0.6软件对实验数据进行多元二次回归,得出总黄酮得率:Y=0.27+0.026A+6.959×10−3B+0.013C−1.614×10−4AB−4.621×10−3AC+5.883×10−3BC−0.042A2−0.011B2−0.028C2,对回归模型进行方差分析,结果见表3。
表 3 方差分析结果Table 3. Results of ANOVA来源 平方和 自由度 均方 F值 P值 显著性 模型 0.020 9 2.173×10−3 16.35 0.0007 ** A 乙醇浓度 5.581×10−3 1 5.581×10−3 41.99 0.0003 ** B 料液比 3.874×10−4 1 3.874×10−4 2.92 0.1315 C 提取时间 1.388×10−3 1 1.388×10−3 10.45 0.0144 * AB 1.042×10−7 1 1.042×10−7 7.837×10−4 0.9784 AC 8.541×10−5 1 8.541×10−5 0.64 0.4491 BC 1.984×10−4 1 1.384×10−4 1.04 0.3414 A2 7.313×10−3 1 7.313×10−3 55.02 0.0001 ** B2 5.026×10−4 1 5.026×10−4 3.78 0.0929 C2 3.199×10−3 1 3.199×10−3 24.07 0.0017 ** 残差 9.303×10−4 7 1.329×10−4 失拟值 4.171×10−4 3 1.390×10−4 1.08 0.4514 绝对误差 5.132×10−4 4 1.283×10−4 总和 0.020 16 注:* 表示差异显著(P<0.05);** 表示差异极显著(P<0.01)。 由表3可知,模型F=16.35,P=0.0007<0.01,说明该回归模型效果极显著,失拟项P=0.4514>0.05,说明模型与数据拟合程度良好;R2=0.9546,表明相关性较强;R2adj和R2pred在合理范围内一致,差异小于0.4,表明模型可很好地解释大部分因素变化引起的响应值变化,可用此模型对粉条儿菜总黄酮的最佳提取工艺条件进行预测。
根据各影响因素的F值可知,各因素对粉条儿菜总黄酮得率的影响程度不同,由高到低依次为乙醇浓度(A)>提取时间(C)>料液比(B)。其中模型一次项B,模型交互项AB、AC、BC以及模型二次项B2,影响不显著(P>0.05);模型一次项C影响显著(P<0.05),模型一次项A,模型二次项 A2、C2,影响极为显著(P<0.01)。
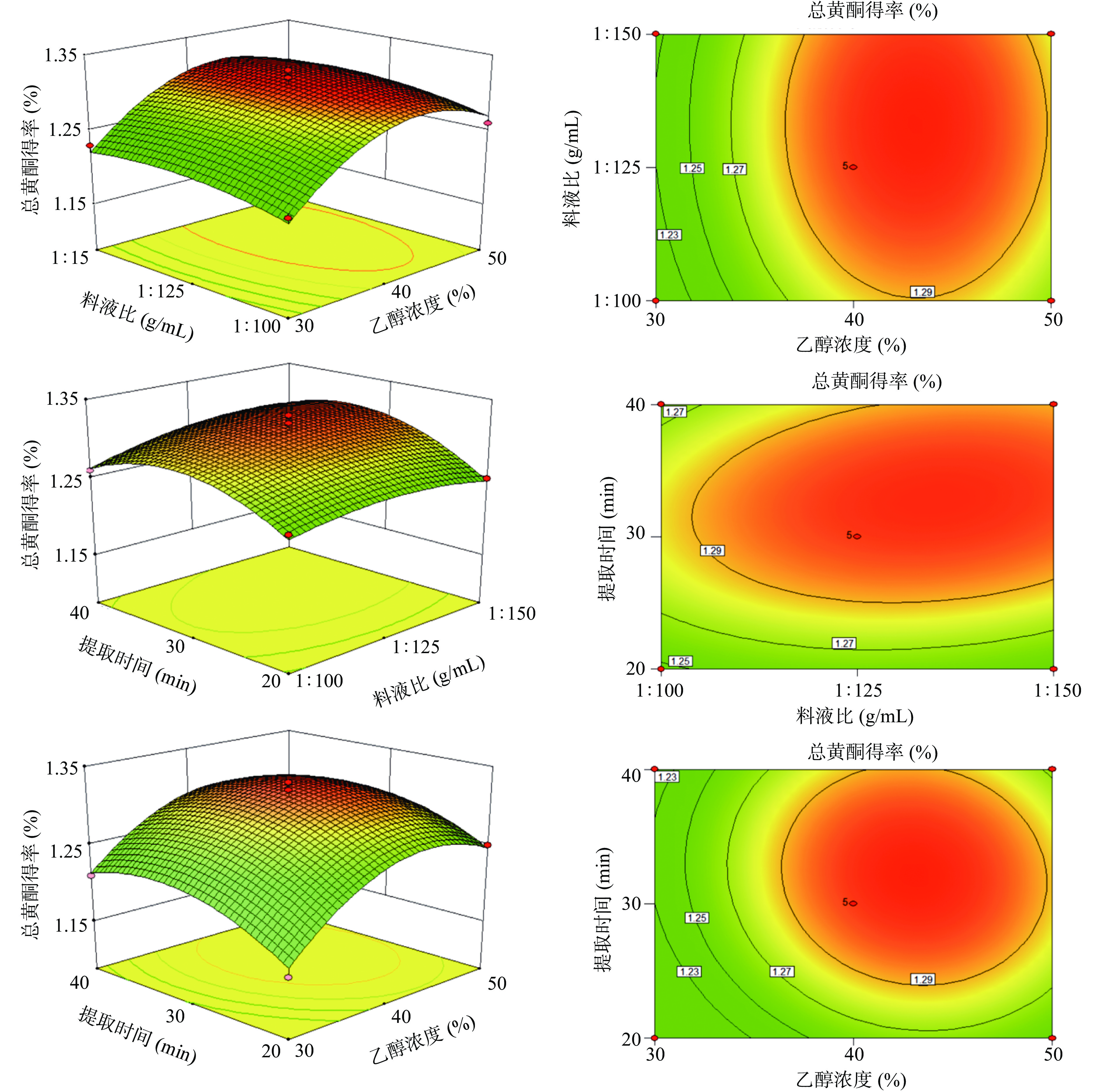
2.2.2 响应面交互作用分析
各因素交互作用对粉条儿菜总黄酮得率的响应面和等高线如图4所示。响应面越陡峭的一方,对总黄酮得率的影响越大。由图4可知,乙醇浓度对总黄酮得率的影响大于料液比和提取时间的影响;提取时间对总黄酮得率的影响大于料液比的影响。由此可得,乙醇浓度对总黄酮得率的影响最大,其次是提取时间,最后是料液比,与方差分析所得结论一致。
2.2.3 最佳提取工艺的确定与验证
通过Design-Expert 8.0.6软件进行计算,得到粉条儿菜总黄酮最佳提取工艺为:乙醇浓度43.1%、料液比1:134.62 g/mL、提取时间32.54 min,理论上粉条儿菜总黄酮得率为1.32%。结合实际情况,将提取条件定为:乙醇浓度40%、料液比1:125 (g/mL)、提取时间30 min。取粉条儿菜粉末0.2 g,按此工艺条件进行提取,平行实验3次。结果测得粉条儿菜总黄酮得率分别为1.34%、1.35%、1.34%,平均得率为1.34%(RSD=0.27%),与模型预测值接近,说明用该数学模型对粉条儿菜总黄酮得率进行预测是可行的。
2.3 抗氧化活性测定
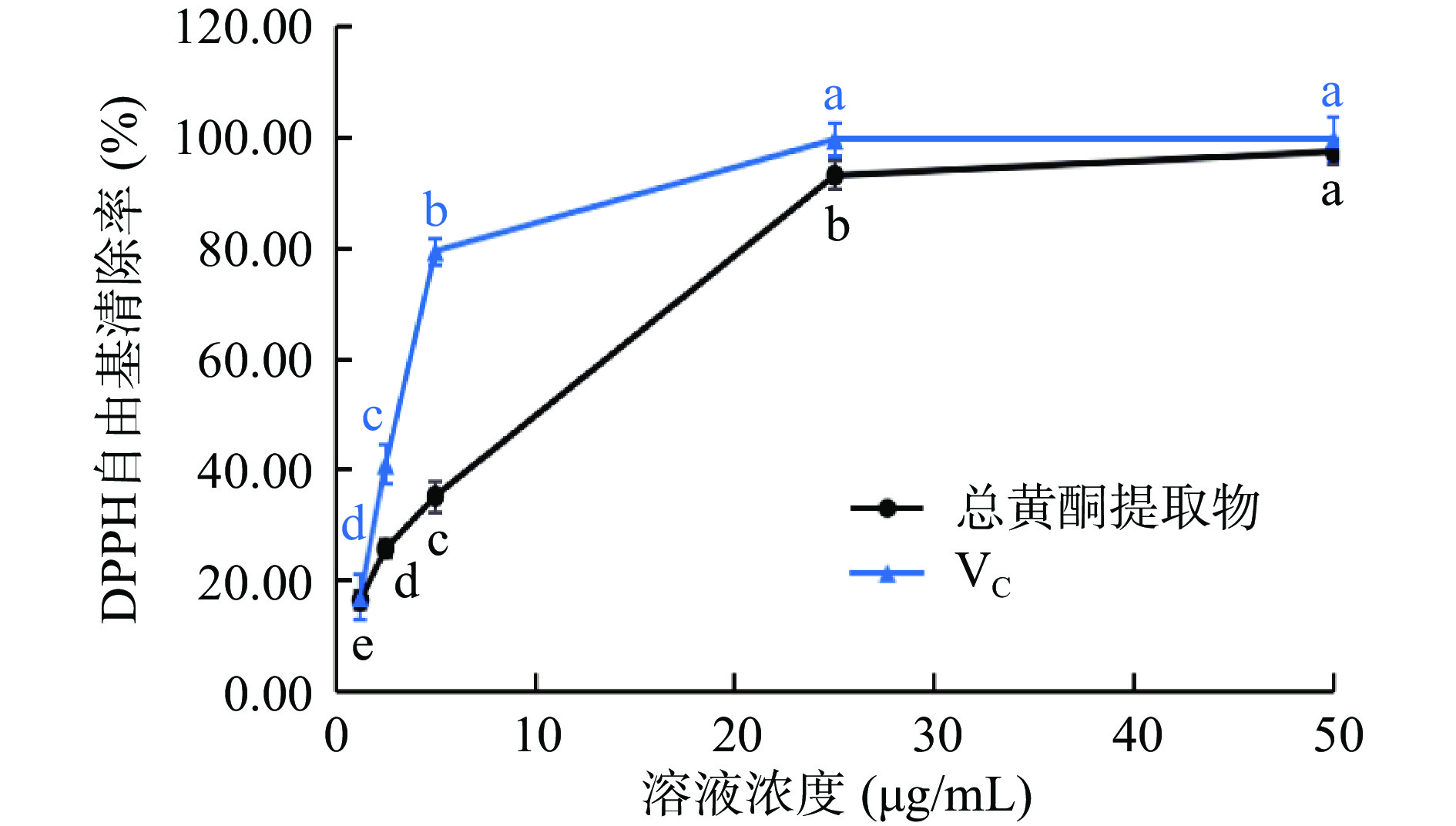
2.3.1 DPPH自由基清除能力
如图5所示,在1.25~25.00 µg/mL范围内,随着VC和粉条儿菜总黄酮浓度的升高,清除DPPH自由基能力均逐渐增强,且总黄酮清除率与其浓度表现出明显的剂量效应关系,但此浓度范围内总黄酮对DPPH自由基清除能力弱于同浓度VC。当浓度大于25.00 µg/mL时,随着浓度继续增大,清除率趋于平缓,总黄酮的清除率与VC接近,在浓度为50.00 µg/mL时,VC的清除率为99.75%,总黄酮的清除率为97.37%。经计算得VC的IC50值为2.76 µg/mL,总黄酮的IC50值为5.46 µg/mL,表现了较好的DPPH自由基清除能力。
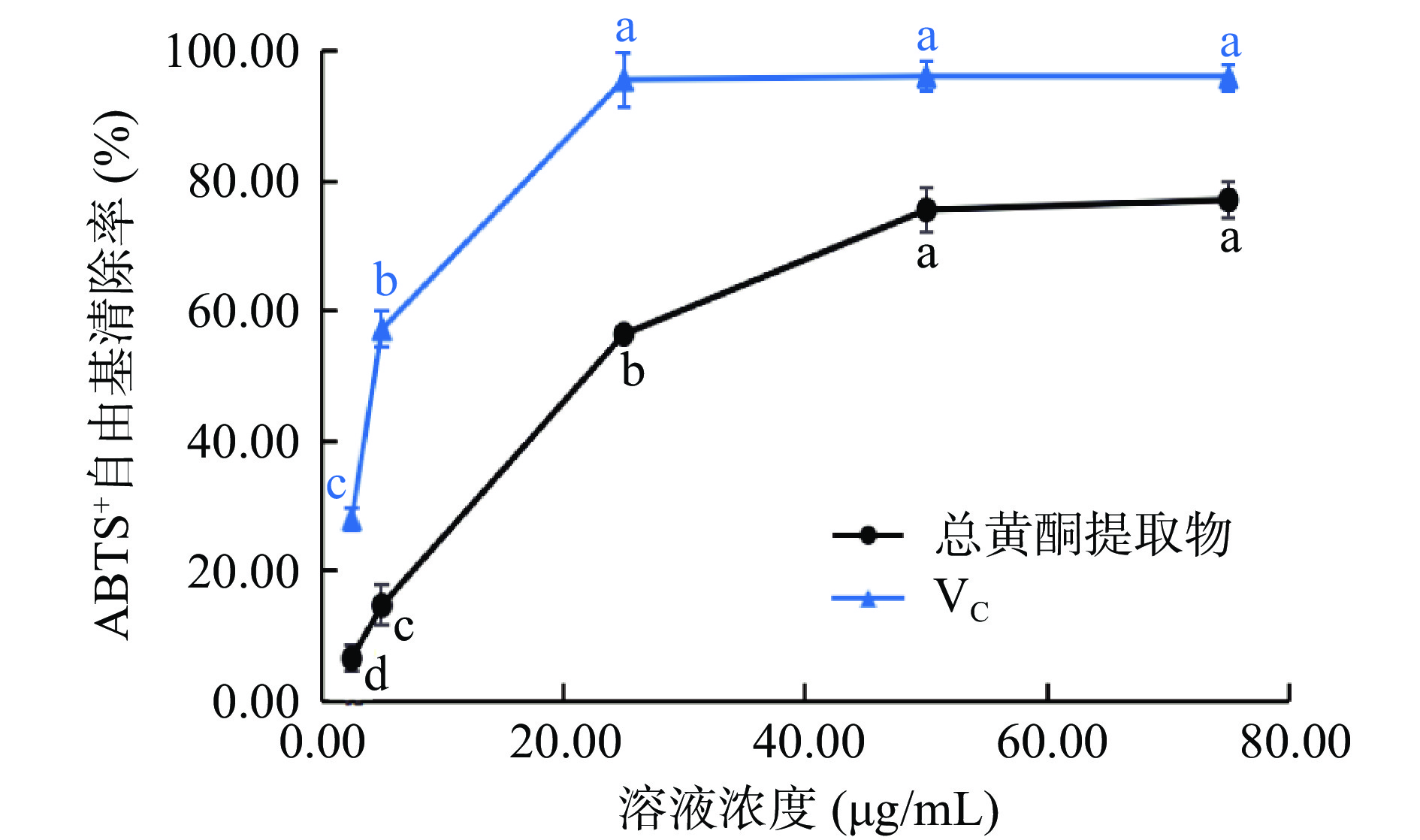
2.3.2 ABTS+自由基清除能力
如图6所示。在2.5~50.00 µg/mL范围内,VC和粉条儿菜总黄酮清除ABTS+自由基的能力均随着浓度的升高而逐渐增强,与浓度呈正相关,之后其清除ABTS+自由基的能力趋于平缓。VC 在50.00 µg/mL时,清除率达最大(96.05%),IC50值为4.39 µg/mL;而总黄酮在浓度为75.00 µg/mL时,清除率达到最大,为77.07%,其IC50值为21.69 µg/mL。 由此可见,粉条儿菜总黄酮具有一定的ABTS+自由基清除能力,但效果低于VC。
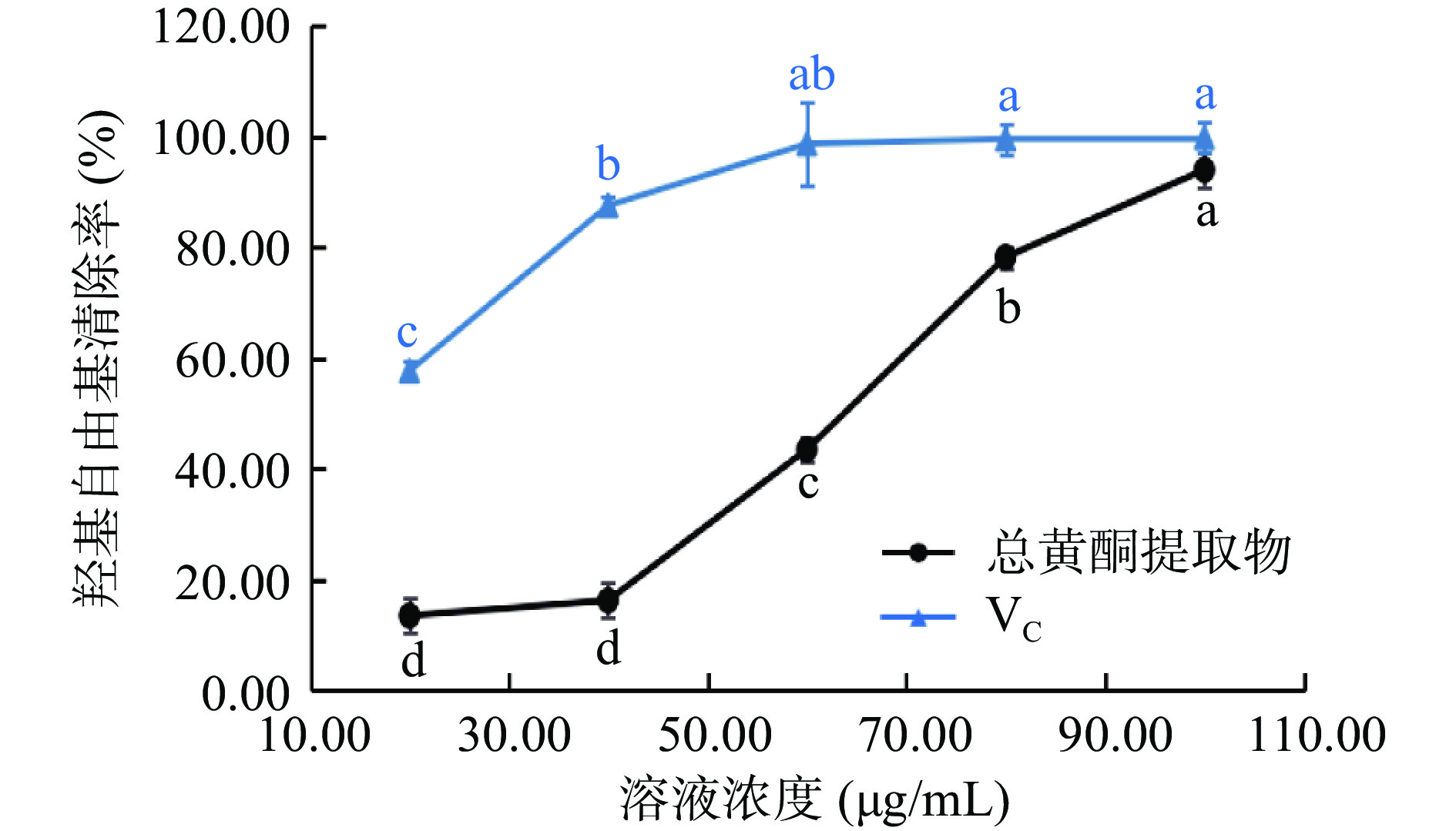
2.3.3 羟基自由基清除能力
如图7所示。VC在20.00~80.00 µg/mL时,清除羟基自由基的能力随浓度的增加呈上升趋势(57.69%~99.63%),浓度继续增加,清除率趋于稳定,并达到最大值,其IC50值为18.56 µg/mL。粉条儿菜总黄酮清除羟基自由基的能力随浓度的增加而明显上升(13.52~94.04%),在浓度为100.00 µg/mL时,清除率最大,为94.04%,与VC的最大清除率接近(99.88%),IC50值为56.01 µg/mL。虽然粉条儿菜总黄酮清除率比VC较弱,但仍表现出一定的抗氧化能力。
2.4 抗炎活性测定
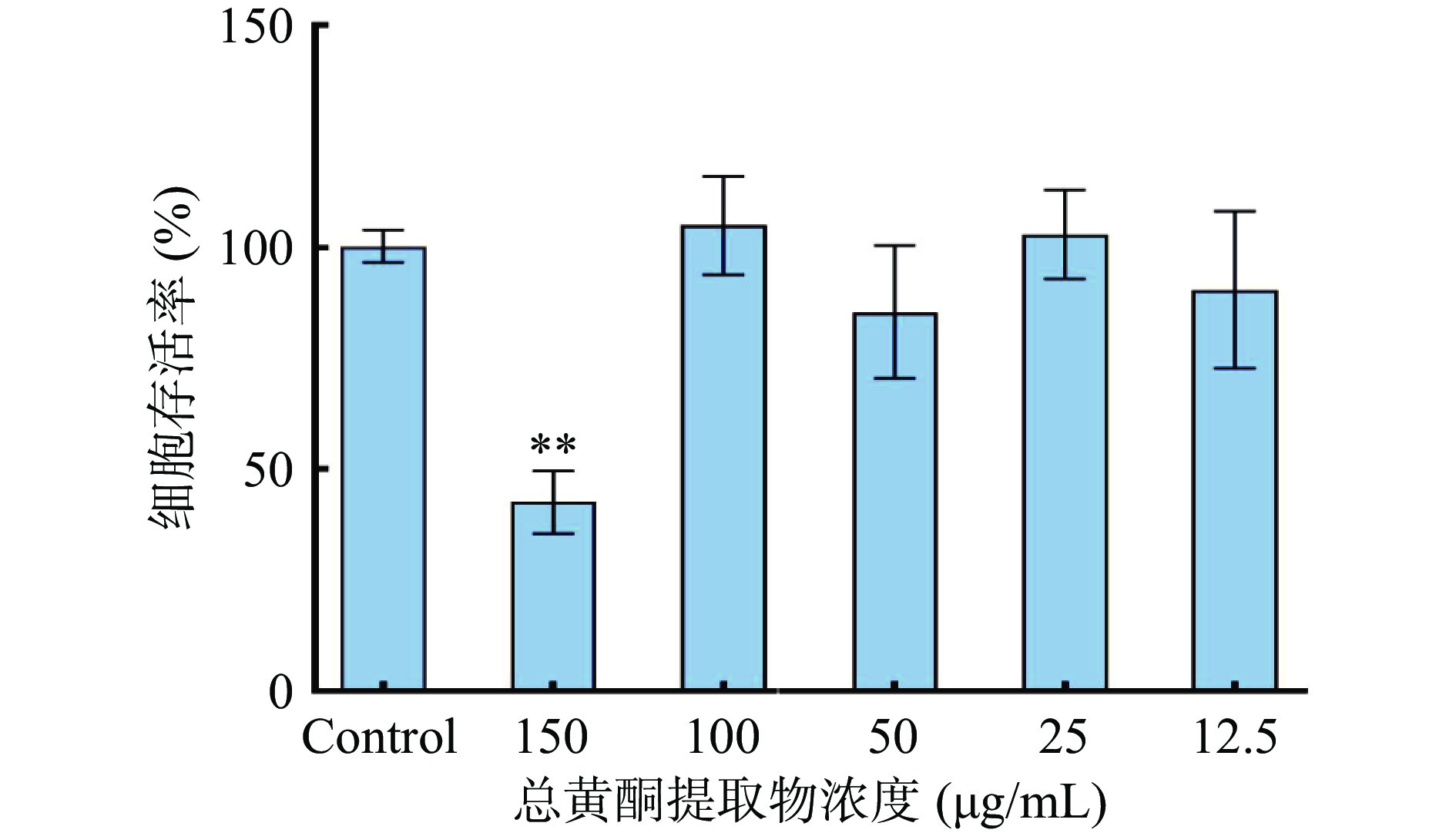
2.4.1 细胞活力检测
采用LPS诱导巨噬细胞RAW264.7构建炎症反应细胞模型,测定粉条儿菜总黄酮提取物在不同浓度下对 RAW264.7细胞存活率的影响。结果如图8所示,与对照组比较,总黄酮提取物浓度在12.5~100 μg/mL范围内对细胞存活率的影响无显著差异,细胞存活率可达85%以上,说明此浓度范围内的总黄酮提取物对细胞基本无毒性。当浓度达150 μg/mL时细胞存活率显著(P<0.05)下降,降到了42%,说明在此浓度下总黄酮提取物产生细胞毒性。因此选取12.5~100 μg/mL浓度范围内的总黄酮提取物进行后续实验。
2.4.2 NO释放量检测
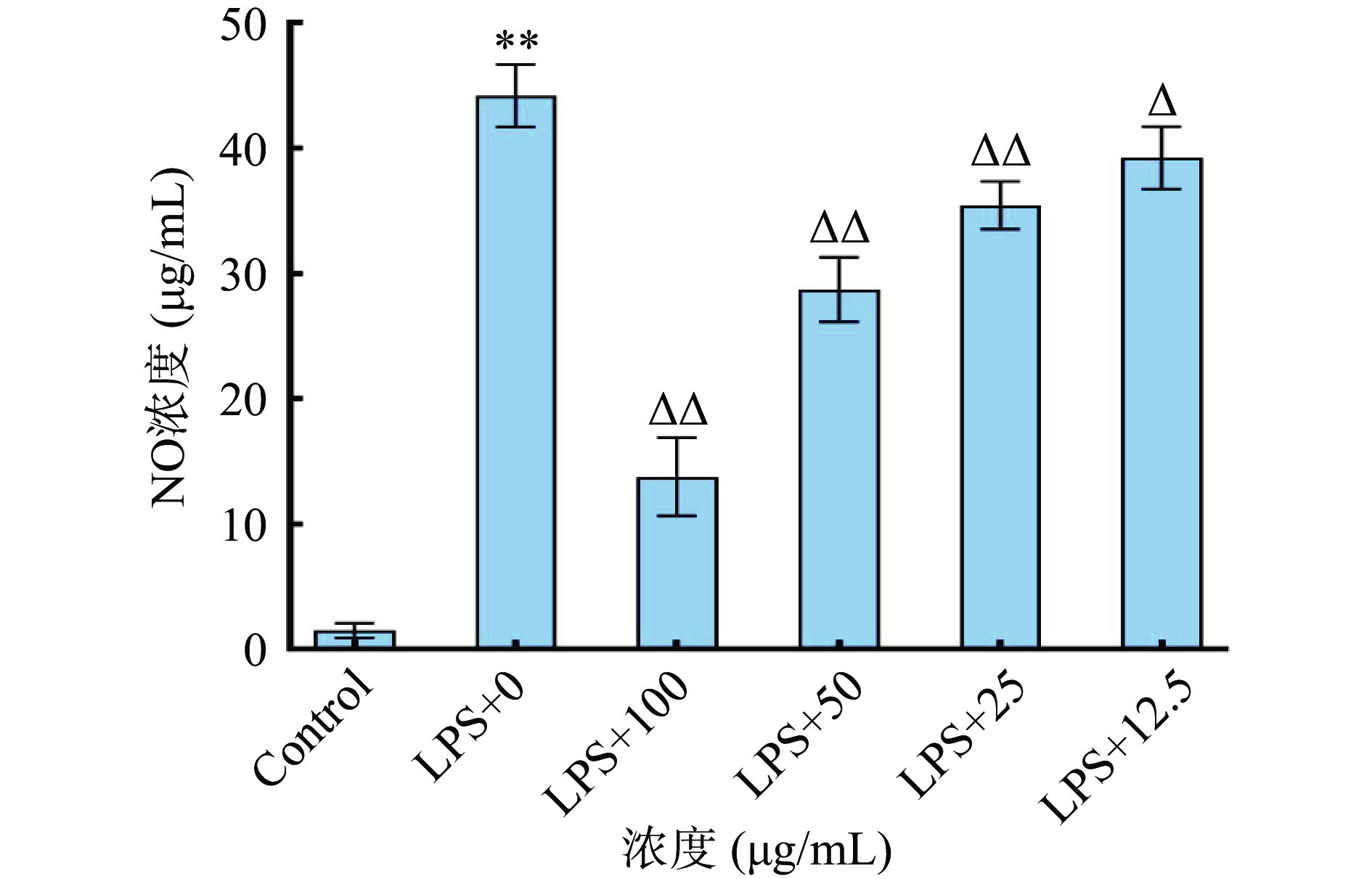
NO参与多种生理功能调节,与炎症密切相关,在LPS诱导的巨噬细胞急性炎症模型过程中起重要作用[30]。粉条儿菜总黄酮提取物对LPS诱导的RAW264.7巨噬细胞分泌NO的结果见图9所示,LPS 1.0 μg/mL作用于细胞24 h后,与对照组比较,模型组细胞培养液中的NO含量显著提高(P<0.01),为44.19 μg/mL,是对照组的29倍,说明细胞炎症模型是成功的;与模型组比较,各浓度总黄酮提取物的细胞培养液中NO含量显著降低(P<0.05),并且随着浓度的增加,NO释放量呈现减少的趋势,IC50为6.95 µg/mL,这说明粉条儿菜总黄酮具有较好的抗炎活性,且表现出一定的浓度依赖性。
3. 结论
本文首次对粉条儿菜总黄酮的提取工艺及抗氧化抗炎活性进行研究。采用黄酮类化合物应用较多的超声辅助提取法,通过单因素和Box-Behnken响应面法对粉条儿菜总黄酮进行提取工艺考察,同时结合实际得到的最佳提取工艺为:乙醇浓度40%、料液比1:125 g/mL、超声提取时间30 min,测得粉条儿菜总黄酮平均得率为1.34%;与模型预测值(1.32%)接近,说明用该数学模型对粉条儿菜总黄酮得率进行预测是可行的,符合超声辅助提取法省时节能、保护热不稳定性成分、效率高的特点,可用于粉条儿菜总黄酮的提取。
常用的抗氧化活性评价方法为自由基清除能力测定,是在自由基溶液中加入抗氧化剂,根据所产生的光学差异来反映抗氧化活性[31]。实验中以DPPH自由基、ABTS+自由基、羟基自由基清除能力为指标,对粉条儿菜总黄酮抗氧化活性进行了分析。结果表明,粉条儿菜总黄酮具有较强的还原力,对DPPH、ABTS+及羟基自由基表现出较好的清除能力,并呈现剂量效应。可见粉条儿菜总黄酮有着作为植物黄酮资源的挖掘潜力和应用价值,可作为一种天然的抗氧化剂开展深入研究。
据文献[32−33]报道,粉条儿菜中的黄酮化合物美商陆酚A和芹菜素均具有一定的抗炎活性。因此本实验中使用LPS诱导的RAW264.7巨噬细胞对粉条儿菜总黄酮进行抗炎活性研究,其结果表明一定浓度(12.5、25、50、100 μg/mL)总黄酮提取物能使细胞培养液中NO含量显著(P<0.05)降低,且随着提取物浓度的增加,NO释放量减少,这说明粉条儿菜总黄酮提取物具有较好的抗炎活性。
此外,本研究仅对粉条儿菜总黄酮的提取工艺、体外抗氧化抗炎活性进行了考察,由于目前总黄酮中已知成分较少,因此后续还需要对总黄酮中的未知成分进行深入挖掘,并结合体内实验研究粉条儿菜总黄酮抗氧化抗炎的物质基础和作用机制,为进一步开发和应用粉条儿菜总黄酮提供理论依据,并为粉条儿菜资源的充分开发利用及提高应用价值奠定基础。
-
表 1 响应面试验因素与水平设计
Table 1 Factors and levels of response surface experiment
因素 水平 −1 0 1 A 乙醇浓度(%) 30 40 50 B 料液比(g/mL) 1:100 1:125 1:150 C 提取时间(min) 20 30 40 表 2 试验设计及结果
Table 2 Experiment design and results
实验号 A乙醇浓度
(%)B料液比
(g/mL)C提取时间
(min)总黄酮得率
(%)1 40 1:150 40 1.29±0.02 2 30 1:100 30 1.21±0.01 3 50 1:125 40 1.28±0.06 4 50 1:125 20 1.25±0.13 5 40 1:150 20 1.25±0.07 6 30 1:125 40 1.21±0.23 7 50 1:100 30 1.26±0.12 8 40 1:100 40 1.26±0.05 9 40 1:125 30 1.33±0.03 10 50 1:150 30 1.28±0.16 11 30 1:125 20 1.16±0.32 12 30 1:150 30 1.23±0.41 13 40 1:125 30 1.29±0.08 14 40 1:125 30 1.32±0.16 15 40 1:125 30 1.31±0.05 16 40 1:125 30 1.31±0.01 17 40 1:100 20 1.25±0.09 表 3 方差分析结果
Table 3 Results of ANOVA
来源 平方和 自由度 均方 F值 P值 显著性 模型 0.020 9 2.173×10−3 16.35 0.0007 ** A 乙醇浓度 5.581×10−3 1 5.581×10−3 41.99 0.0003 ** B 料液比 3.874×10−4 1 3.874×10−4 2.92 0.1315 C 提取时间 1.388×10−3 1 1.388×10−3 10.45 0.0144 * AB 1.042×10−7 1 1.042×10−7 7.837×10−4 0.9784 AC 8.541×10−5 1 8.541×10−5 0.64 0.4491 BC 1.984×10−4 1 1.384×10−4 1.04 0.3414 A2 7.313×10−3 1 7.313×10−3 55.02 0.0001 ** B2 5.026×10−4 1 5.026×10−4 3.78 0.0929 C2 3.199×10−3 1 3.199×10−3 24.07 0.0017 ** 残差 9.303×10−4 7 1.329×10−4 失拟值 4.171×10−4 3 1.390×10−4 1.08 0.4514 绝对误差 5.132×10−4 4 1.283×10−4 总和 0.020 16 注:* 表示差异显著(P<0.05);** 表示差异极显著(P<0.01)。 -
[1] 谢宗万, 范崔生, 朱兆仪. 全国中草药汇编[M]. (第二版) (上册). 北京:人民卫生出版社, 1996:677-678. [XIE Z W, FAN C S, ZHU Z Y. National Compilation of Chinese Herbal Medicine[M]. (second edition) (Volume 1). Beijing:People's Health Publishing Society, 1996:677-678. XIE Z W, FAN C S, ZHU Z Y. National Compilation of Chinese Herbal Medicine[M]. (second edition) (Volume 1). Beijing: People's Health Publishing Society, 1996: 677-678.
[2] 既是药品又是食品的药材 粉条儿菜[N]. 华兴时报, 2012-02-02(第11版:健康周刊). [It is both medicine and food medicine. [Aletris spicata (Thunb.) Franch. [N]. Huaxing Times, 2012-02-02 (Edition 11:Health Weekly). Aletris spicata (Thunb.) Franch. [N]. Huaxing Times, 2012-02-02 (Edition 11: Health Weekly).
[3] 邱德文, 杜江. 中华本草苗药卷[M]. 贵阳:贵州科技出版社, 2005:423-424. [QIU D W, DU J. Chinese Materia Medica of Miao. [Medicinal Volume[M]. Guiyang:Guizhou Science and Technology Publishing House, 2005:423-424. ]. Medicinal Volume[M]. Guiyang: Guizhou Science and Technology Publishing House, 2005: 423-424. ].
[4] 贵州省药品监督管理局. 贵州省中药材、民族药材质量标准[M]. 贵阳:贵州科技出版社, 2003:256. [Guizhou Provincial Drug Administration. Quality standard of Chinese medicinal materials and ethnic medicinal materials in Guizhou Province[M]. Guiyang:Guizhou Science and Technology Publishing Society, 2003:256. Guizhou Provincial Drug Administration. Quality standard of Chinese medicinal materials and ethnic medicinal materials in Guizhou Province[M]. Guiyang: Guizhou Science and Technology Publishing Society, 2003: 256.
[5] AKAHORI A, YASUDA F, OKANISHI T. Steroidal sapog enins of Aletris spicata(THUNB.) Franch[J]. Chemical and Pharmace Utical Bulletin,1971,19(11):2409−2411. doi: 10.1248/cpb.19.2409
[6] 艾怀森. 采集见闻[N]. 大自然, 2002(第三期). [AI H S. Collect information [N]. In Nature, 2002 (Phase 3). AI H S. Collect information [N]. In Nature, 2002 (Phase 3).
[7] 何维维, 吕享, 谢军丽, 等. 黔产民族药肺筋草的化学成分预试验研究[J]. 广东化工,2021,48(13):63−64,54. [HE W W, LÜ X, XIE J L, et al. Preliminary study on chemical components of the Aletris spicata(Thunb. ) Franch doi: 10.3969/j.issn.1007-1865.2021.13.028 J]. Guangdong Chemical Industry,2021,48(13):63−64,54. doi: 10.3969/j.issn.1007-1865.2021.13.028
[8] QIAN H, RONG L, YAO Y, et al. C-glycosylflavone from Aletris spicata[J]. Biochemical Systematics and Ecology,2012,45:191−193. doi: 10.1016/j.bse.2012.07.035
[9] 黄兰, 潘杰, 曹佩雪, 等. 肺筋草化学成分研究[J]. 中草药,2013,44(7):812−815. [HUANG L, PAN J, CAO P X, et al. Study on chemical compositions of Aletris spicata[J]. Chinese Traditional and Herbal Drugs,2013,44(7):812−815. HUANG L, PAN J, CAO P X, et al . Study on chemical compositions of Aletris spicata[J]. Chinese Traditional and Herbal Drugs,2013 ,44 (7 ):812 −815 .[10] 李林珍, 王孟华, 孙建博, 等. 粉条儿菜化学成分的研究[J]. 中国药科大学学报,2014,45(2):175−177. [LI L Z, WANG M H, SUN J B, et al. Chemical constituents from Aletris spicata[J]. Journal of China Pharmaceutical University,2014,45(2):175−177. doi: 10.11665/j.issn.1000-5048.20140208 LI L Z, WANG M H, SUN J B, et al . Chemical constituents from Aletris spicata[J]. Journal of China Pharmaceutical University,2014 ,45 (2 ):175 −177 . doi: 10.11665/j.issn.1000-5048.20140208[11] LI L Z, WANG M H, SUN J B, et al. Flavonoids and other constituents from Aletris spicata and their chemotaxonomic significance[J]. Natural Product Research,2014,28(15):1214−1217. doi: 10.1080/14786419.2014.921918
[12] OJO B A, AFOLABI L B, NWONUMA O C, et al. Puerarin:A review on the pharmacological activity, chemical propertiesand pharmacokinetics of main isoflavonoid[J]. The Natural Products Journal,2022,12(1):1−10. doi: 10.2174/221031551201220118120932
[13] 祁建宏, 董芳旭. 黄酮类化合物药理作用研究进展[J]. 北京联合大学报,2020,34(3):89−92. [[QI J H, DONG F X. Research progress of the pharmacological action of flavonoids[J]. Journal of Beijing Union University,2020,34(3):89−92. [QI J H, DONG F X . Research progress of the pharmacological action of flavonoids[J]. Journal of Beijing Union University,2020 ,34 (3 ):89 −92 .[14] BONIFACE P K, EUTROPHE L D K. Pharmacological activity and mechanism of action of flavonoids from diverse millettia plant organs[J]. The Natural Products Journal,2022,12(7):24−52.
[15] 吴海莹, 倪春林, 王磊. 植物中黄酮类化合物的提取方法及其应用[J]. 广州化工,2022,50(18):23−25. [WU H Y, NI C L, WANG L. Research progress on extraction methods of flavonoids from plant[J]. Guangzhou Chemical Industry,2022,50(18):23−25. doi: 10.3969/j.issn.1001-9677.2022.18.008 WU H Y, NI C L, WANG L . Research progress on extraction methods of flavonoids from plant[J]. Guangzhou Chemical Industry,2022 ,50 (18 ):23 −25 . doi: 10.3969/j.issn.1001-9677.2022.18.008[16] CHAVEZ-GONZALEZ L M , SEPULVEDA L , VERMA K D , et al. Conventional and emerging extraction processes of flavonoids[J]. Processes, 2020, 8(4):434−463.
[17] 郭孝武. 一种提取中草药化学成分的方法-超声提取法[J]. 天然产物研究与开发,1999(3):37−40. [GUO X W. A method to extract chemical components from Chinese herbs-ultrasonic method[J]. Natural Product Research and Development,1999(3):37−40. GUO X W . A method to extract chemical components from Chinese herbs-ultrasonic method[J]. Natural Product Research and Development,1999 (3 ):37 −40 .[18] 王念, 李浚哲, 李鹏飞, 等. 浸提和超声辅助提取法对桑叶提取物抗氧化活性的影响[J]. 中国食品添加剂,2021,32(6):77−82. [WANG N, LI J Z, LI P F, et al. Effects of solvent extraction and ultrasound-assisted extraction on antioxidant activity of mulberry leaf extracts[J]. China Food Additives,2021,32(6):77−82. doi: 10.19804/j.issn1006-2513.2021.06.012 WANG N, LI J Z, LI P F, et al . Effects of solvent extraction and ultrasound-assisted extraction on antioxidant activity of mulberry leaf extracts[J]. China Food Additives,2021 ,32 (6 ):77 −82 . doi: 10.19804/j.issn1006-2513.2021.06.012[19] 张晓南, 朱鸿维, 赵善舶, 等. 响应面优化超声辅助法提取拐枣种子中二氢杨梅素的工艺[J]. 植物研究,2020,40(5):775−781. [ZHANG X N, ZHU H W, ZHAO S B, et al. Optimization of ultrasound-assisted extraction of dihydromyricetin from seeds of Hovenia dulcis Thunb. using response surface methodology[J]. Bulletin of Botanical Research,2020,40(5):775−781. ZHANG X N, ZHU H W, ZHAO S B, et al . Optimization of ultrasound-assisted extraction of dihydromyricetin from seeds of Hovenia dulcis Thunb. using response surface methodology[J]. Bulletin of Botanical Research,2020 ,40 (5 ):775 −781 .[20] 鞠玉旋, 谢倩, 陈清西. 石仙桃总黄酮提取工艺优化及抗氧化活性分析[J]. 园艺与种苗,2021,41(11):15−20,27. [JÜ Y X, XIE Q, CHEN Q X. Optimization of extraction process and analysis of antioxidant activity of total flavonoids from pholidota chinensis lindl[J]. Horticulture & Seed,2021,41(11):15−20,27. doi: 10.16530/j.cnki.cn21-1574/s.2021.11.007 JÜ Y X, XIE Q, CHEN Q X . Optimization of extraction process and analysis of antioxidant activity of total flavonoids from pholidota chinensis lindl[J]. Horticulture & Seed,2021 ,41 (11 ):15 −20,27 . doi: 10.16530/j.cnki.cn21-1574/s.2021.11.007[21] CAO Q Q, FU Y Q, ZHANG C B, et al. Effect of brewing water on the antioxidant capacity of green tea infusion with DPPH assay[J]. Journal of Chemistry,2022,2022:1−8.
[22] YISEOP K, YOUNGBAE K, KIHAN K. A study on DPPH and ABTS antioxidant activity and sensory evaluation of seolgitteok with walnut and health CRISIS(Juglans Regia)[J]. International Journal of Crisis & Safety,2021,6(4):25−37.
[23] 唐文文, 陈垣. 党参地上茎叶总黄酮提取工艺及其抗氧化活性[J]. 江苏农业科学,2021,49(17):171−177. [TANG W W, CHEN H. Extraction process of total flavonoids and their antioxidant activity[J]. Jiangsu Agricultural Science,2021,49(17):171−177. doi: 10.15889/j.issn.1002-1302.2021.17.031 TANG W W, CHEN H . Extraction process of total flavonoids and their antioxidant activity[J]. Jiangsu Agricultural Science,2021 ,49 (17 ):171 −177 . doi: 10.15889/j.issn.1002-1302.2021.17.031[24] 陈佳敏, 汪涛, 郭巧生, 等. 基于熵权TOPSIS法对不同产地野菊花醇提物抗氧化性抗炎活性的比较[J]. 中国中药杂志, 2021, 46(4):907−914. [CHEN J M, WANG T, GUO Q S, et al. Comprehensive antioxidant and anti-inflammatory activity of alcohol extracts from Chrysanthemum indicum in different areas based on entropy weight and TOPSIS methodology[J]. Chinese Journal of Traditional Chinese Medicine, 2021, 46(4):907−914. CHEN J M, WANG T, GUO Q S, et al. Comprehensive antioxidant and anti-inflammatory activity of alcohol extracts from Chrysanthemum indicum in different areas based on entropy weight and TOPSIS methodology[J]. Chinese Journal of Traditional Chinese Medicine, 2021, 46(4): 907−914.
[25] 吴莉娟, 彭效明, 居瑞军, 等. 响应面法优化微波超声辅助提取重楼及其抗炎活性研究[J]. 中药材,2022(7):1700−1704. [WU L J, PENG X M, JÜ R J, et al. Optimization of microwave ultrasound-assisted extraction of heavy floor and its anti-inflammatory activity[J]. Journal of Chinese Medicinal Materials,2022(7):1700−1704. WU L J, PENG X M, JÜ R J, et al . Optimization of microwave ultrasound-assisted extraction of heavy floor and its anti-inflammatory activity[J]. Journal of Chinese Medicinal Materials,2022 (7 ):1700 −1704 .[26] MERLIN T, BASHI M B, DEVI S J R, et al. Evaluation of the anti-Inflammatory activity of kokilaksham kashayam on lipopolysaccharide stimulated RAW 264.7 macrophages[J]. Proceedings of the National Academy of Sciences, India Section B:Biological Sciences,2022,92(4):807−815. doi: 10.1007/s40011-022-01370-2
[27] 夏雨弘, 刘颖, 周茗, 等. 小二仙草总黄酮提取工艺的优化及其抗氧化活性分析[J/OL]. 食品工业科技:1−14[2023-04-03]. doi:10.13386/j.issn1002-0306.2022100235. [XIA Y H, LIU Y, ZHOU M, et al. Extraction process optimization and antioxidant activity of total flavonoids from Haloragis micrantha (Thunb.) R. Brown[J/OL]. Science and Technology of Food Industry:1−14 [2023-04-03]. doi:10.13386/j.issn1002-0306.2022100235. XIA Y H, LIU Y, ZHOU M, et al. Extraction process optimization and antioxidant activity of total flavonoids from Haloragis micrantha (Thunb.) R. Brown[J/OL]. Science and Technology of Food Industry: 1−14 [2023-04-03]. doi: 10.13386/j.issn1002-0306.2022100235.
[28] 孔方, 李莉, 刘言娟. 超声辅助低共熔溶剂提取苹果叶中的总黄酮[J]. 食品工业科技,2020,41(14):134−139,147. [KONG F, LI L, LIU Y J. Ultrasonic-assisted deep eutectic solvents extraction of total flavonoids from apple leaves[J]. Science and Technology of Food Industry,2020,41(14):134−139,147. doi: 10.13386/j.issn1002-0306.2020.14.022 KONG F, LI L, LIU Y J . Ultrasonic-assisted deep eutectic solvents extraction of total flavonoids from apple leaves[J]. Science and Technology of Food Industry,2020 ,41 (14 ):134 −139,147 . doi: 10.13386/j.issn1002-0306.2020.14.022[29] 王丽焕, 郭文娟, 钱晓明. 基于响应面法的艾草总黄酮提取工艺优化[J]. 天津工业大学学报,2022,41(2):42−48. [WANG L H, GUO W J, QIAN X M. Optimization of extraction process of total flavonoids from Artemisia argyi based on response surface methodology[J]. Journal of Tianjin Polytechnic University,2022,41(2):42−48. WANG L H, GUO W J, QIAN X M . Optimization of extraction process of total flavonoids from Artemisia argyi based on response surface methodology[J]. Journal of Tianjin Polytechnic University,2022 ,41 (2 ):42 −48 .[30] HWANG D, KANG M J, JO M J, et al. Anti-inflammatory activity of β-thymosin peptide derived from pacific oyster (crassostrea gigas) on NO and PGE2 production by down-regulating NF- κB in LPS-Induced RAW264.7 macrophage cells[J]. Marine Drugs,2019,17(2):129. doi: 10.3390/md17020129
[31] 曾文俊, 吕彩梦, 丁建宝, 等. 体外抗氧化活性评价方法的反应机理研究进展[J]. 化学与生物工程,2022,39(12):13−19. [ZENG W J, LÜ C M, DING J B, et al. Research progress in reaction mechanism of evaluation method for antioxidant activity in vitro[J]. Chemistry Bioengineering,2022,39(12):13−19. doi: 10.3969/j.issn.1672-5425.2022.12.003 ZENG W J, LÜ C M, DING J B, et al . Research progress in reaction mechanism of evaluation method for antioxidant activity in vitro[J]. Chemistry Bioengineering,2022 ,39 (12 ):13 −19 . doi: 10.3969/j.issn.1672-5425.2022.12.003[32] BI C C, HAN W W, YU J R, et al. Insights into the pharmacological and therapeutic effects of apigenin in liver injuries and diseases[J]. Heliyon,2023,9(5):e15609. doi: 10.1016/j.heliyon.2023.e15609
[33] 廖慧君, 张叶金, 王钰, 等. 基于网络药理学探讨巴戟天治疗类风湿性关节炎的物质基础及作用机制[J]. 按摩与康复医学,2021,12(15):47−52. [LIAO H J, ZHANG Y J, WANG Y, et al. Study on material basis and mechanism of morinda officinalis in treating rheumatoid arthritis based on network pharmacology[J]. Chinese Manipulation and Rehabilitation Medicine,2021,12(15):47−52. doi: 10.19787/j.issn.1008-1879.2021.15.015 LIAO H J, ZHANG Y J, WANG Y, et al . Study on material basis and mechanism of morinda officinalis in treating rheumatoid arthritis based on network pharmacology[J]. Chinese Manipulation and Rehabilitation Medicine,2021 ,12 (15 ):47 −52 . doi: 10.19787/j.issn.1008-1879.2021.15.015 -
期刊类型引用(7)
1. 徐暘,梁静汶,潘俊因,温春雨. 优化蓝靛果果渣的提取工艺及抗氧化活性研究. 食品工业. 2024(04): 63-68 .  百度学术
百度学术
2. 刘威良,蔡建,高文荣,朱铃,吕涛. 云南野生火棘叶甾醇提取工艺优化及体外活性研究. 食品工业科技. 2024(11): 187-194 .  本站查看
本站查看
3. 苗春霖,许欢欢,焦利元,何爱民,吉洋洋,牟德华,高山. 分心木多酚提取工艺优化、组分及抗氧化分析. 中国食品添加剂. 2024(08): 97-104 .  百度学术
百度学术
4. 李颖滔,陈浩,张尚师,蔡延渠,李苑新. 不同产地白簕茎总黄酮提取工艺优化及抗氧化活性研究. 中国饲料. 2024(19): 33-38 .  百度学术
百度学术
5. 宋巧英. 超声辅助深共熔溶剂提取栀子黄酮及其对HepG2细胞的降血糖作用. 精细化工. 2024(10): 2223-2230 .  百度学术
百度学术
6. 排合尔丁·穆太力甫,木艾塔尔·努尔麦麦提,艾尼娃尔·艾克木,田树革. 响应面法优化圆苞车前子多酚与总黄酮超声提取工艺及其抗氧化活性分析. 湖南中医药大学学报. 2024(10): 1801-1809 .  百度学术
百度学术
7. 张紫玉,刘畅,杨小英,周英,权伟,俸婷婷,刘雄伟. 苗药肺筋草调控NF-κB/JAK途径改善大鼠急性肺损伤的作用机制研究. 药物评价研究. 2024(11): 2548-2558 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



