Optimization of Extraction Process and in Vitro Activity Study of Total Sterols from Wild Pyracantha fortuneana Leaves in Yunnan
-
摘要: 为优化野生火棘叶总甾醇的提取工艺,并探究抗氧化、美白活性。该研究以总甾醇得率为指标,采用单因素实验考察提取溶剂、料液比、超声温度和超声时间对野生火棘叶总甾醇得率的影响,在此基础上利用正交试验设计对提取条件进行优化;采用DPPH、ABTS和亚硝酸盐法,体外评价野生火棘叶总甾醇的抗氧化活性;通过考察对酪氨酸酶抑制作用来评价火棘叶总甾醇的美白活性。结果表明,野生火棘叶总甾醇的最佳提取工艺为提取溶剂无水乙醇,超声温度50 ℃,料液比1:16 g/mL,超声时间25 min,得到的野生火棘叶总甾醇得率为(11.00±0.03)mg/g;在0.5~5 mg/mL范围内,野生火棘叶总甾醇对DPPH自由基、ABTS+自由基、亚硝酸根离子有很强的清除作用;对酪氨酸酶有很强的抑制作用,且呈现良好的量效关系。该提取工艺稳定、可靠,可用于野生火棘叶总甾醇的提取,野生火棘叶总甾醇可作为一种新型的天然抗氧化剂和酪氨酸酶抑制剂,应用于功能食品中。Abstract: The objective of this study was to optimize the extraction process of total sterols from wild Pyracantha fortuneana leaves (WPFL), and explore their antioxidant and whitening activities. The yield of total sterols (WPFLTPS) was used as indicator, and the single factor experiment was used to investigate the effects of extraction solvent, solid-liquid ratio, ultrasonic temperature and ultrasonic time on the yield of WPFLTPS. Based on this, the orthogonal experimental design was used to optimize the extraction conditions. The DPPH (2,2-diphenyl-1-picrylhydrazyl), ABTS [2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)] and nitrite methods were used to evaluate the antioxidant activity of WPFLTPS in vitro. The whitening activity was evaluated by the inhibitory effect on tyrosinase. The results showed that for optimal extraction process of WPFLTPS, the extraction solvent was absolute ethanol, ultrasonic temperature was 50 ℃, solid-liquid ratio was 1:16 g/mL, and ultrasonic time was 25 minutes. Under these conditions, the yield of WPFLTPS was (11.00±0.03) mg/g. In the range of 0.5~5 mg/mL, WPFLTPS had strong scavenging effects on DPPH radicals, ABTS+ radicals and nitrite ions, as well as a strong inhibitory effect on tyrosinase, demonstrating a good dose-response relationship. This extraction process was stable and reliable for extracting WPFLTPS. The WPFLTPS can be used as a new, natural antioxidant and tyrosinase inhibitor in functional foods.
-
Keywords:
- wild Pyracantha fortuneana leaves /
- total sterols /
- extraction process /
- antioxidant /
- whitening
-
火棘[Pyracantha fortuneana (Maxim.) Li],蔷薇科火棘属的常绿小灌木,生长于海拔200~2800 m的丘陵、山地、灌丛草地和河沟旁,以野生为主,资源丰富[1−2]。火棘作为云南“药食两用”植物资源之一,其浑身是宝,根、茎、叶、花、果等部位均可入药,据《滇南本草》《云南中草药》等古籍记载,火棘具有极高的药用保健功效,如清热解毒、健脾消积、生津止渴等[3−4]。此外,据《农部琐录》记载,早在1700年前的三国时代就以火棘果代粮食用[5−7]。
植物甾醇(Phytosterol,PS)普遍存在植物的种子、花、茎叶中,是一类以环戊烷全氢菲为母核结构的甾体化合物,已鉴定40多种,天然的PS主要以酯化态或游离态形式存在,其中游离态的以β-谷甾醇、豆甾醇、菜籽甾醇等为主[8]。大量研究发现,PS具有降血脂、抗炎、解痉、抗氧化、抗肿瘤等生理功能,被美誉为“生命的钥匙”,因此被广泛应用于食品、医药及化妆品等行业[9]。国内外关于PS的提取方法有超声辅助溶剂萃取法、皂化法、分子蒸馏法、超临界流体萃取法等[10]。
本研究以云南野生火棘叶为原料,采用超声辅助法提取PS粗提物,并对提取工艺进行优化,通过体外抗氧化和酪氨酸酶抑制实验探讨总甾醇的抗氧化能力和美白功效,为功能产品的研发提供理论依据,同时拓展了火棘叶资源利用的空间。
1. 材料与方法
1.1 材料与仪器
野生火棘叶 采自云南省曲靖师范学院校园内,经曲靖师范学院蔡建副教授鉴定为蔷薇科植物火棘的叶子;豆甾醇(≥98%)、β-谷甾醇(纯度≥98%)、L-抗坏血酸(VC,纯度≥99%)、熊果苷(纯度≥98%)、DPPH(2,2-联苯基-1-苦基肼基)、ABTS[2,2'-联氮基双[3-(乙基苯并噻唑啉-6-磺酸)二铵盐]、酪氨酸酶(≥1120 U/mg) 购自Sigma-Aldrich公司;L-酪氨酸、左旋多巴(纯度≥99.0%) 均为分析纯,购自上海源叶生物科技有限公司;其余化学试剂 均为分析纯,国药集团化学试剂有限公司。
KQ-500DE型数控超声机 昆山市超声仪器有限公司;UV-5600PC紫外可见分光光度计 上海元析仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;HSB-Ш型循环水式多用真空泵 上海亚荣生化仪器厂;DHE-9101-3型电热鼓风干燥箱 金坛市杰瑞尔电器有限公司;JK-G-350A3高速多功能粉碎机 上海精学科学仪器有限公司;DK-S26型电热恒温水浴锅 上海右一仪器公司制造。
1.2 实验方法
1.2.1 野生火棘叶总甾醇(WPFLTPS)超声辅助提取流程
采摘火棘叶→65 ℃烘干→粉碎→称取样品→加入提取溶剂→超声→抽滤→旋蒸浓缩→测总体积→稀释→加入显色剂→显色→测吸光度→计算WPFLTPS得率[11]。
1.2.2 标准曲线的绘制
参考张云焕等[12]实验方法,配制质量浓度为0.05 mg/mL豆甾醇为标准品溶液,分别吸取0、1、2、3、4、5、6、7 mL至干燥比色管中,而后加无水乙醇定容至8 mL,接着加入4 mL硫磷铁显色剂振动摇匀,静置显色15 min,以空白管调零,在200~800 nm范围内进行光谱扫描,确定最大吸收波长为440 nm,使用紫外分光光度计在440 nm处测定各管吸光度值。豆甾醇的质量浓度为横坐标(C),以吸光度值(A)为纵坐标,绘制标准曲线,得到回归方程A=15.946C−0.0046。该方程的决定系数R2=0.9997,说明线性关系良好,能够用于定量分析。
按照上述方法,调整适当的样品浓度,按照式(1)进行WPFLTPS得率的计算,公式如下:
Y=C×V×bm (1) 式中,Y为WPFLTPS得率,mg/g;C为野生火棘叶提取液吸光度对应的豆甾醇标准溶液的质量浓度,mg/mL;V为浓缩样液的总体积,mL;b为稀释倍数;m为火棘叶质量,g。
1.2.3 单因素实验
1.2.3.1 最佳提取溶剂的筛选
参考文献[13]的方法,称取5 g样品,固定提取温度为20 ℃,超声提取时间为15 min,料液比为 1:16 g/mL,超声功率为400 W,分别选用无水乙醇、正己烷、丙酮、乙酸乙酯、石油醚作为提取溶剂,来提取火棘叶中的甾醇,运用公式计算出WPFLTPS的得率,探究提取溶剂对WPFLTPS得率的影响。
1.2.3.2 超声辅助提取火棘叶总甾醇的条件优化
参考靳若周等[14]的实验方法略作改进,以无水乙醇为提取溶剂,在料液比1:16 g/mL、超声时间15 min、超声温度20 ℃的基础条件下,保持其他条件不变,只改变其中一个因素,以总甾醇得率为指标,设置超声温度20、30、40、50、60 ℃,料液比1:8、1:12、1:16、1:20、1:24 g/mL,超声时间15、25、35、45、55 min进行单因素实验,每组重复3次。
1.2.4 正交试验设计
根据单因素实验所得结果和正交表进行3因素3水平正交试验设计,如表1。计算该条件下WPFLTPS得率,再对所得数据进行方差分析,得到最佳提取工艺。最后,对正交试验所得的最佳提取工艺条件进行验证实验。
表 1 正交试验因素水平Table 1. Orthogonal experimental factor level水平 因素 A温度(℃) B料液比(g/mL) C超声时间(min) 1 40 1:12 15 2 50 1:16 25 3 60 1:20 35 1.2.5 WPFLTPS抗氧化试验
1.2.5.1 DPPH自由基清除率的测定
参考杨菁等[15]实验方法并改进,用无水乙醇配制浓度为0.2 mmol/L DPPH溶液,现用现配。量取2 mL不同浓度(0.5、1、2、3、4、5 mg/mL)的WPFLTPS溶液,加入DPPH溶液2 mL,室温下避光反应30 min,以无水乙醇为空白对照,β-谷甾醇、豆甾醇和VC溶液(0.5、1、2、3、4、5 mg/mL)为阳性对照,于517 nm处测吸光度值。每个样品重复测3次,按照下列公式计算DPPH自由基清除率:
清除率(%)=(1−Ai−AjA0)×100 (2) 式中,Ai代表加入待测液的吸光度值;Aj代表待测液的本底值;A0为不加待测液的对照值。
1.2.5.2 ABTS+自由基清除能力的测定
参考文献的实验方法并改进[16],取7 mmol/L ABTS 5 mL和140 mmol/L过硫酸钾 88 μL混合均匀,配制成ABTS+自由基储备液,避光保存备用。取0.1 mL不同浓度(0.5、1、2、3、4、5 mg/mL)的WPFLTPS溶液,加入3.9 mL ABTS工作液,振荡30 s,室温下静置6 min后,以无水乙醇为对照,于734 nm处测吸光度值,采用β-谷甾醇、豆甾醇和VC溶液(0.5、1、2、3、4、5 mg/mL)作为阳性对照。每个样品重复测3次,按照下列公式计算ABTS+自由基的清除率:
清除率(%)=(1−Ai−AjA0)×100 (3) 式中,Ai代表加入待测液的吸光度值;Aj代表待测液的本底值;A0为不加待测液的对照值。
1.2.5.3 亚硝酸根(NO2−)离子清除率的测定
参考童钰琴等[17]和吴海成[18]的实验方法并略作改进,以NaNO2标准溶液浓度(C)为横坐标,以吸光度值A为纵坐标,在最大吸收波长538 nm处比色,绘制标准曲线,可得回归方程为A=0.0519C+0.0877,R2=0.9998;分别吸取不同浓度(0.5、1、2、3、4、5 mg/mL)的WPFLTPS、β-谷甾醇、豆甾醇和VC溶液置于比色管中,加入5 μg/mL的NaNO2溶液2 mL,37 ℃恒温水浴30 min,取出立即加入1 mL 0.4%对氨基苯磺酸,混匀,反应5 min后加入0.2%盐酸萘乙二胺溶液0.5 mL,加水至10 mL,混匀反应15 min,以不加NaNO2溶液的管为空白,在538 nm处测定各管的吸光度值,每个样品重复测3次。通过NaNO2标准曲线得出残留的NaNO2量,按照下列公式计算NO2−清除率:
NO−2清除率(%)=加入标准亚硝酸钠量−亚硝酸钠残留量加入标准亚硝酸钠量×100 (4) 式中,标准亚硝酸钠量和亚硝酸钠残留量的单位为 μg/mL。
1.2.6 WPFLTPS对酪氨酸酶活性抑制作用的测定
酪氨酸酶的活力测定有两个步骤,酪氨酸酶单酚酶活力测定是以L-酪氨酸为底物,酪氨酸酶二酚酶活力测定是以左旋多巴为底物[19]。样品用无水乙醇溶解并用蒸馏水配制成质量浓度分别为0.5、1、2、3、4、5 mg/mL的溶液。测定时按表2所示体积,用吸量管准确吸取A、B、C、D组反应液,每组都需要设置3个平行,充分混匀后,在37 ℃水浴中温育30 min,迅速倒入10 mL离心管中用台式高速离心机在转速为6000 r/min的条件下离心15 min,迅速转移至比色皿中,于475 nm处测定吸光度值[20−21]。豆甾醇、熊果苷、VC按上述方法进行测定。按下式(5)计算酪氨酸酶的抑制率:
表 2 反应液的组成Table 2. Composition of reaction solution实验组号 A组 B组 C组 D组 底物(mL) 1.0 1.0 1.0 1.0 样品(mL) 0.0 0.0 1.0 1.0 磷酸缓冲溶液(mL) 4.0 5.0 3.0 4.0 酪氨酸酶液(mL) 1.0 0.0 1.0 0.0 合计(mL) 6.0 6.0 6.0 6.0 酪氨酸酶抑制率(%)=[(A−B)−(C−D)]A−B×100 (5) 式中,A、B、C、D为各组反应液在波长为475 nm处的吸光度值。
1.3 数据处理
所有实验均重复3次,数据分析采用T检验进行差异性比较,结果用均值±标准差(¯X±SD)表示,使用SPSS 25.0软件进行方差分析及显著性检验,采用Origin 9.0软件绘图。
2. 结果与分析
2.1 单因素实验
2.1.1 不同提取溶剂对WPFLTPS提取效果的影响
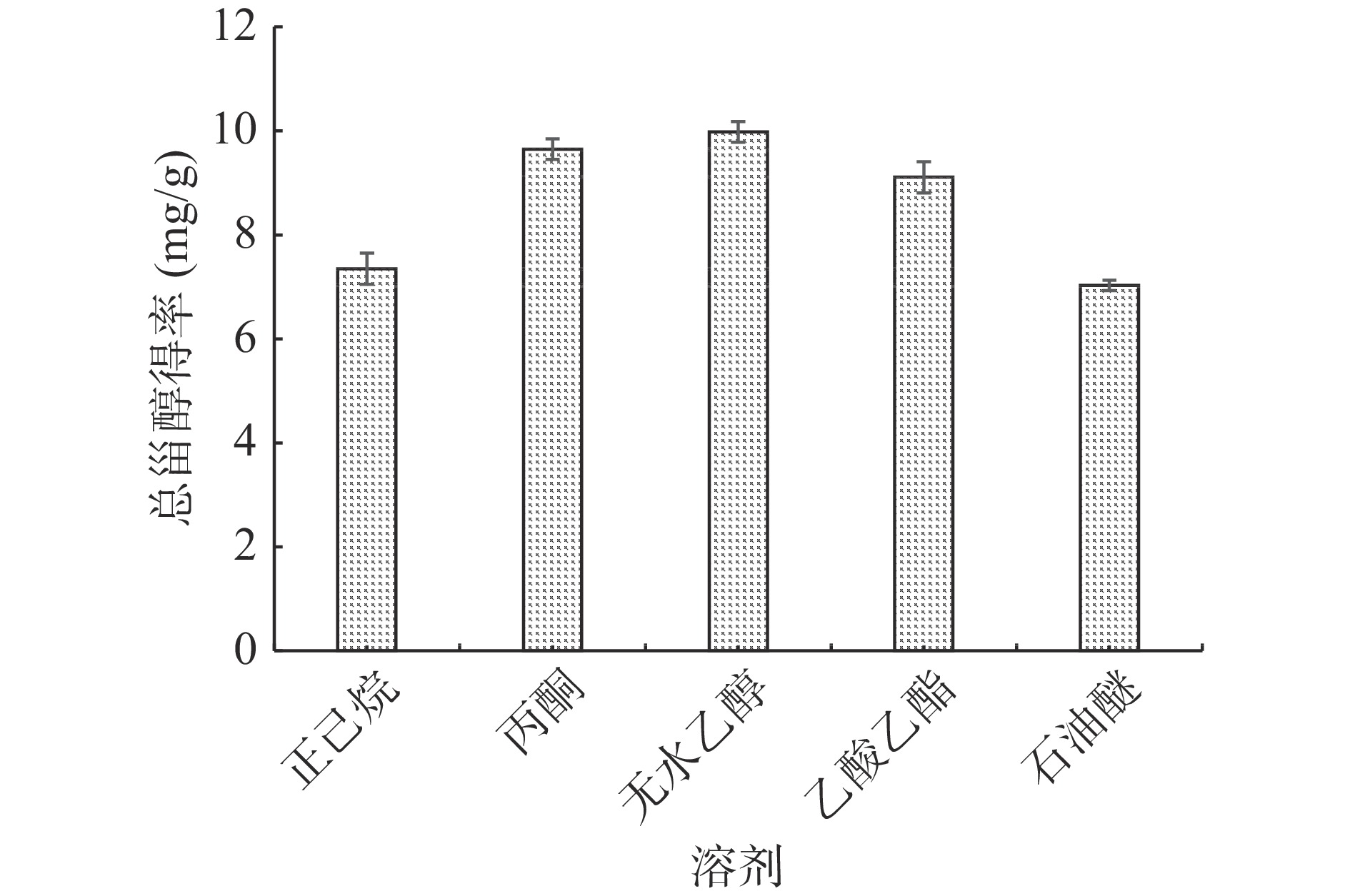
如图1所示,不同提取溶剂的WPFLTPS得率为:无水乙醇>丙酮>乙酸乙酯>正己烷>石油醚,丙酮和无水乙醇提取效果接近,但考虑到乙醇价格便宜,采购方便,丙酮属于易制毒化学品,因此,选择无水乙醇作为WPFLTPS的提取溶剂。
2.1.2 超声温度对WPFLTPS提取效果的影响
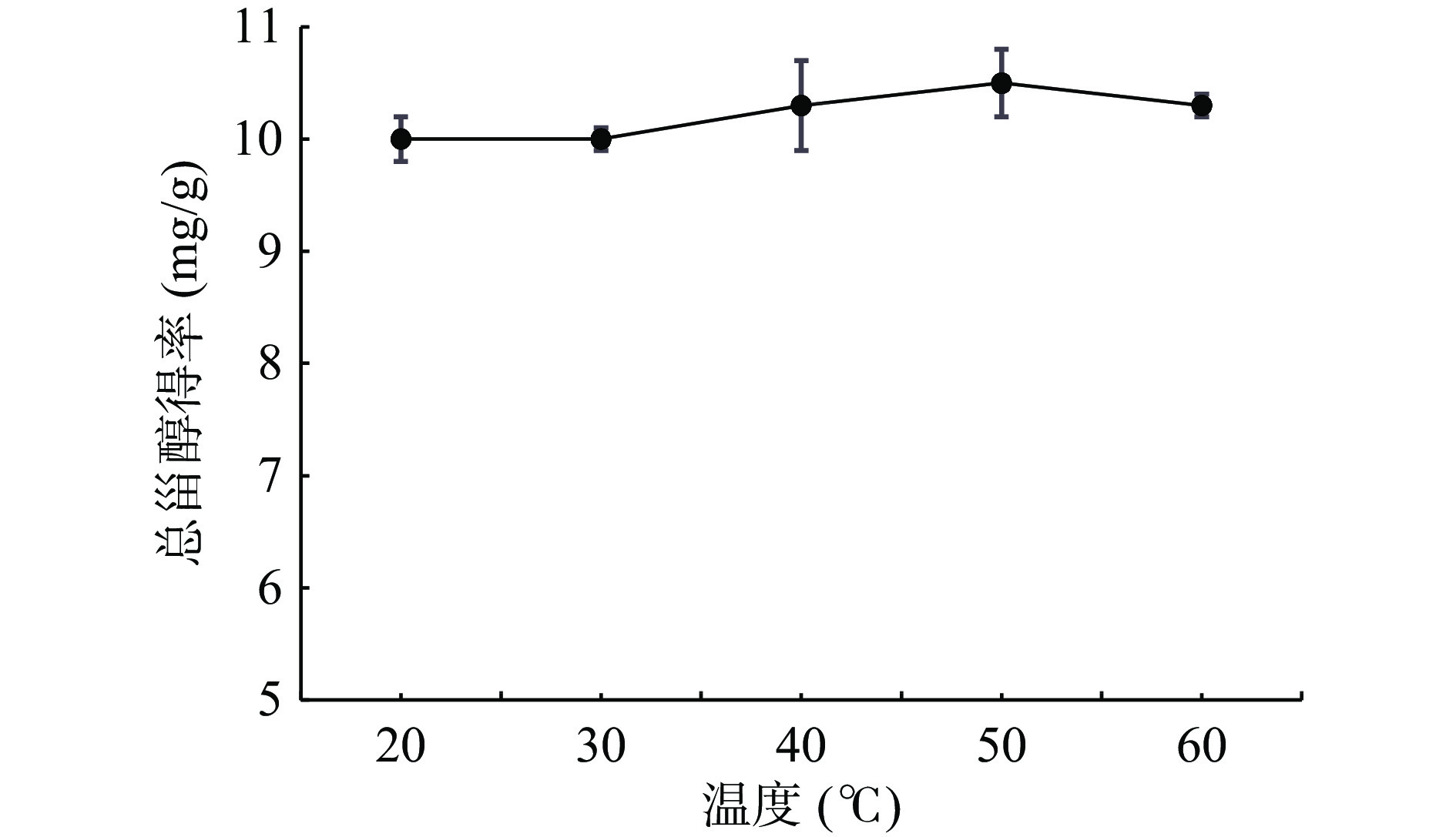
由图2可知,随着温度逐渐升高,WPFLTPS得率会逐渐增大,当温度升高到50 ℃时总甾醇得率最高。当温度高于50 ℃时,总甾醇得率开始下降,这可能由于温度过高,甾醇在提取过程中被破坏,从而WPFLTPS得率下降[22]。此外,有研究表明当超声温度过高会加快杂质的溶出和甾醇的分解,进而降低了甾醇的得率[23]。因此,选择50 ℃作为火棘叶中甾醇的提取温度。
2.1.3 料液比对WPFLTPS提取效果的影响
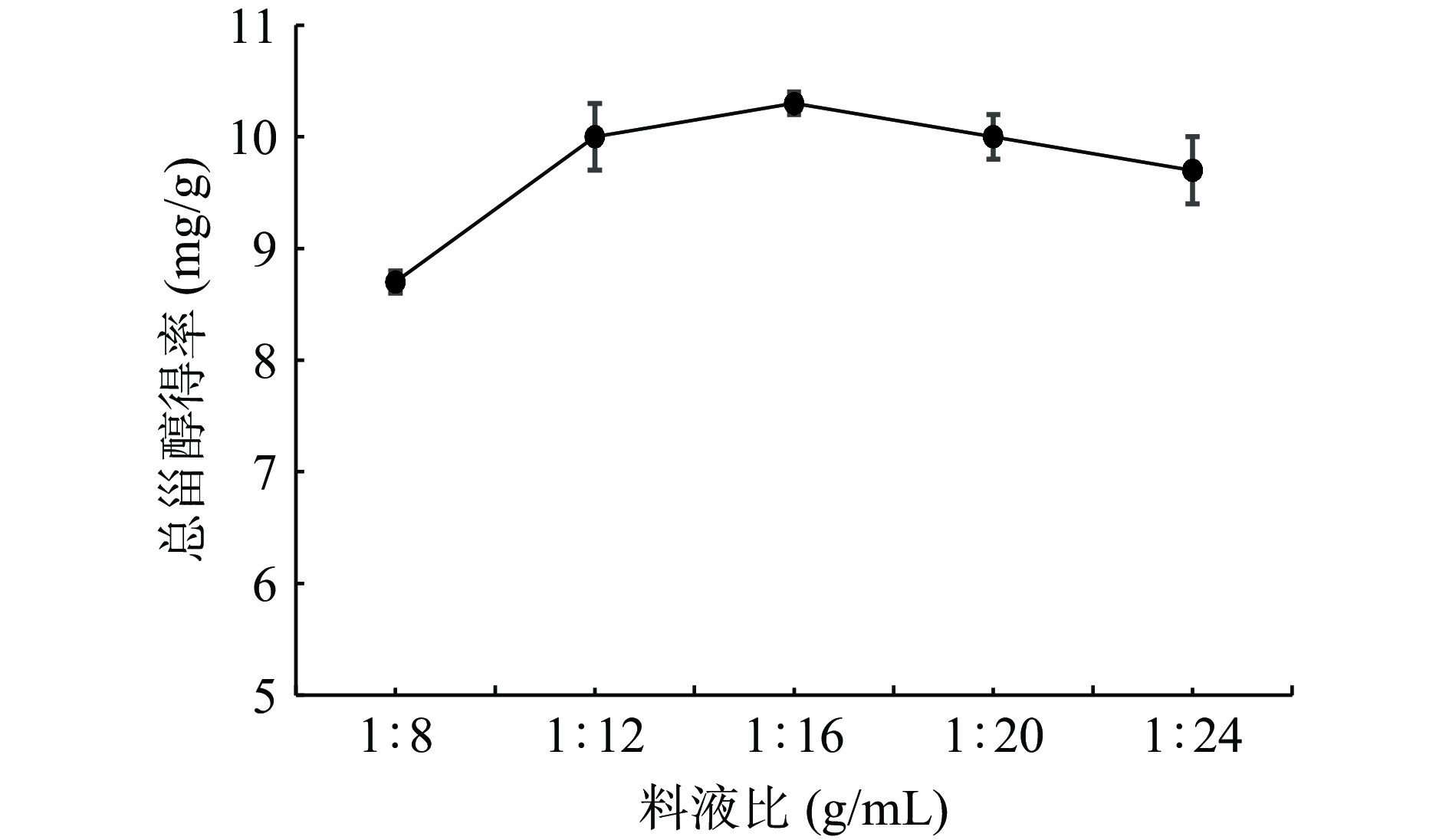
由图3可知,WPFLTPS得率随提取溶剂量的增加,总甾醇的得率先快速增大,当料液比为1:16(g/mL)时达到峰值后开始下降。这可能是当提取溶剂用量达到一定值时,样品中的甾醇的溶解量达到饱和,继续增加提取溶剂的用量也不会提高总甾醇得率,反而造成试剂的浪费或者由于长时间超声波振荡影响,一些不稳定的甾醇被破坏,导致得率下降。从经济角度考虑,溶剂的用量不宜过大,因此,选择料液比1:16(g/mL)作为火棘叶中甾醇的提取料液比。这与刘真阳等[24]研究结果规律相似。
2.1.4 超声时间对WPFLTPS提取效果的影响
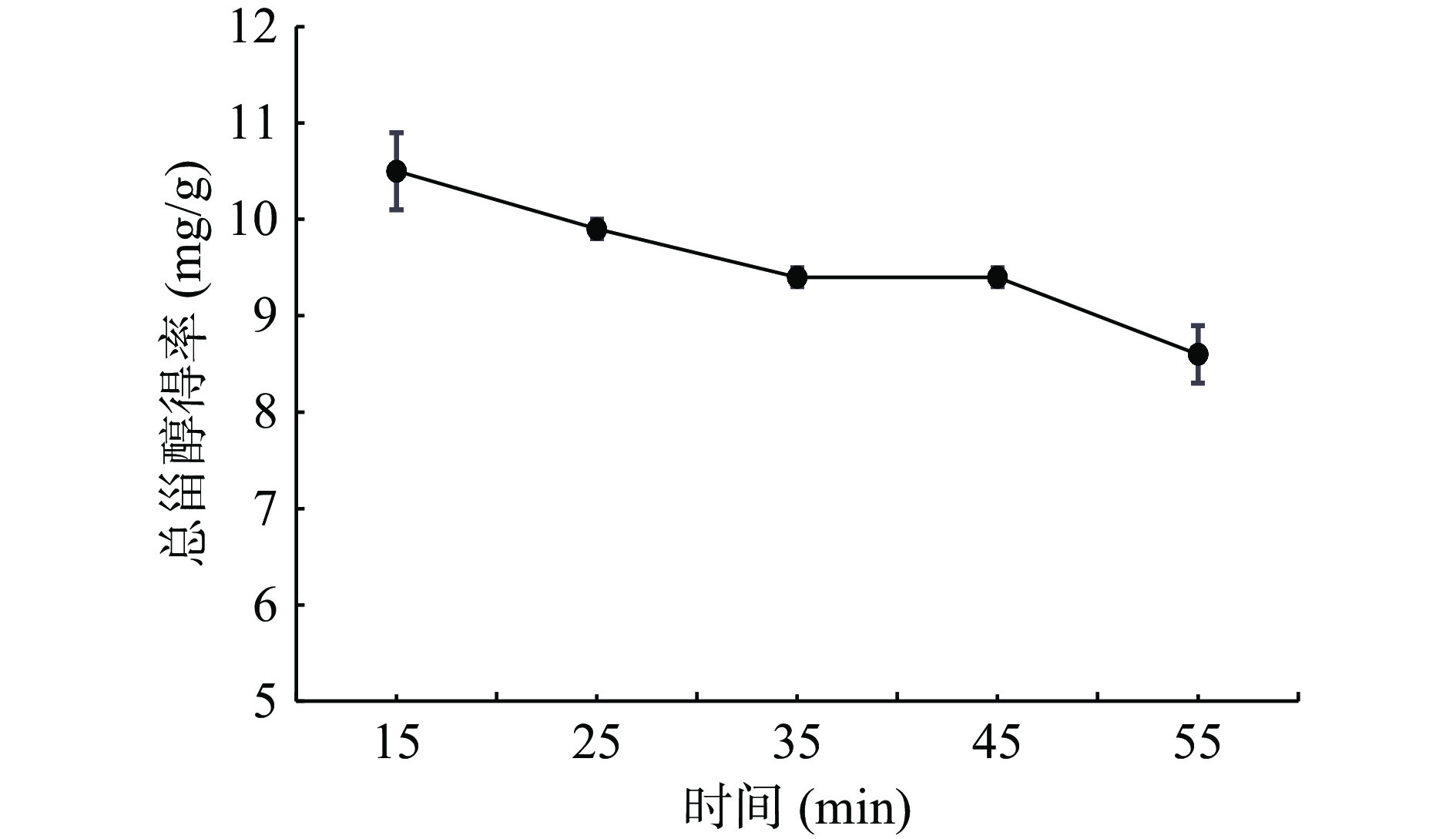
由图4可知,火棘叶中总甾醇得率随提取时间的延长逐渐降低。这是由于随着超声提取时间的延长,火棘叶中的甾醇逐渐地溶出,同时可能火棘叶中的其他杂质也逐渐溶解出来且溶出的越来越多,从而影响火棘叶中总甾醇的得率。此外,提取时间的延长可能会破坏甾醇结构,进而降低得率[25]。因此,选择15 min作为火棘叶中甾醇的超声时间。
2.2 正交试验结果
根据单因素实验结果,确定A温度(℃)、B料液比(g/mL)、C超声时间(min)三个影响因素的三个水平,进行三因素三水平正交试验(如表3所示),以确定提取火棘叶中甾醇提取的最佳工艺参数。
表 3 正交试验结果Table 3. Orthogonal test results试验号 A B C 总甾醇得率(mg/g) 1 1 1 1 10.045 2 1 2 2 10.422 3 1 3 3 10.220 4 2 1 2 10.366 5 2 2 3 10.353 6 2 3 1 10.281 7 3 1 3 10.110 8 3 2 1 10.207 9 3 3 2 10.214 K1 10.299 10.174 10.178 K2 10.333 10.327 10.334 K3 10.177 10.238 10.228 R 0.156 0.153 0.156 由表3可知,K为平均值,R为极差,温度、料液比和超声时间对火棘叶中总甾醇得率的影响相近。最佳因素水平组合为A2B2C2,即在提取火棘叶中的甾醇时,提取溶剂无水乙醇,超声功率400 W,超声温度50 ℃,料液比1:16 g/mL,超声时间25 min,因为该方案在正交试验表中并没有出现,为了确定上述方案为超声波辅助有机溶剂提取火棘叶中甾醇的最佳方案,按照A2B2C2的条件对火棘叶样品再次进行超声波辅助有机溶剂提取,并计算得率,以此来验证火棘叶总甾醇提取的最佳工艺条件。
利用软件SPSS 20.0对试验数据进行方差分析,结果见表4,显示各因素对火棘叶总甾醇的提取的影响。
表 4 正交试验方差分析Table 4. Variance analysis of orthogonal test因素 离均差平方和 自由度 均方 F P A 0.038 2 0.019 4.653 0.177 B 0.036 2 0.018 4.370 0.186 C 0.038 2 0.019 4.679 0.176 误差 0.008 2 0.004 总计 945.027 9 2.3 验证实验
通过上述优化试验得到的WPFLTPS提取最佳组合为A2B2C2,分别做3组平行实验,WPFLTPS得率为(11.00±0.03)mg/g,高于正交试验表3中WPFLTPS得率最高组合A1B2C2(10.422 mg/g),说明验证实验结果具有可靠性。
2.4 WPFLTPS体外抗氧化活性
2.4.1 对DPPH自由基清除效果
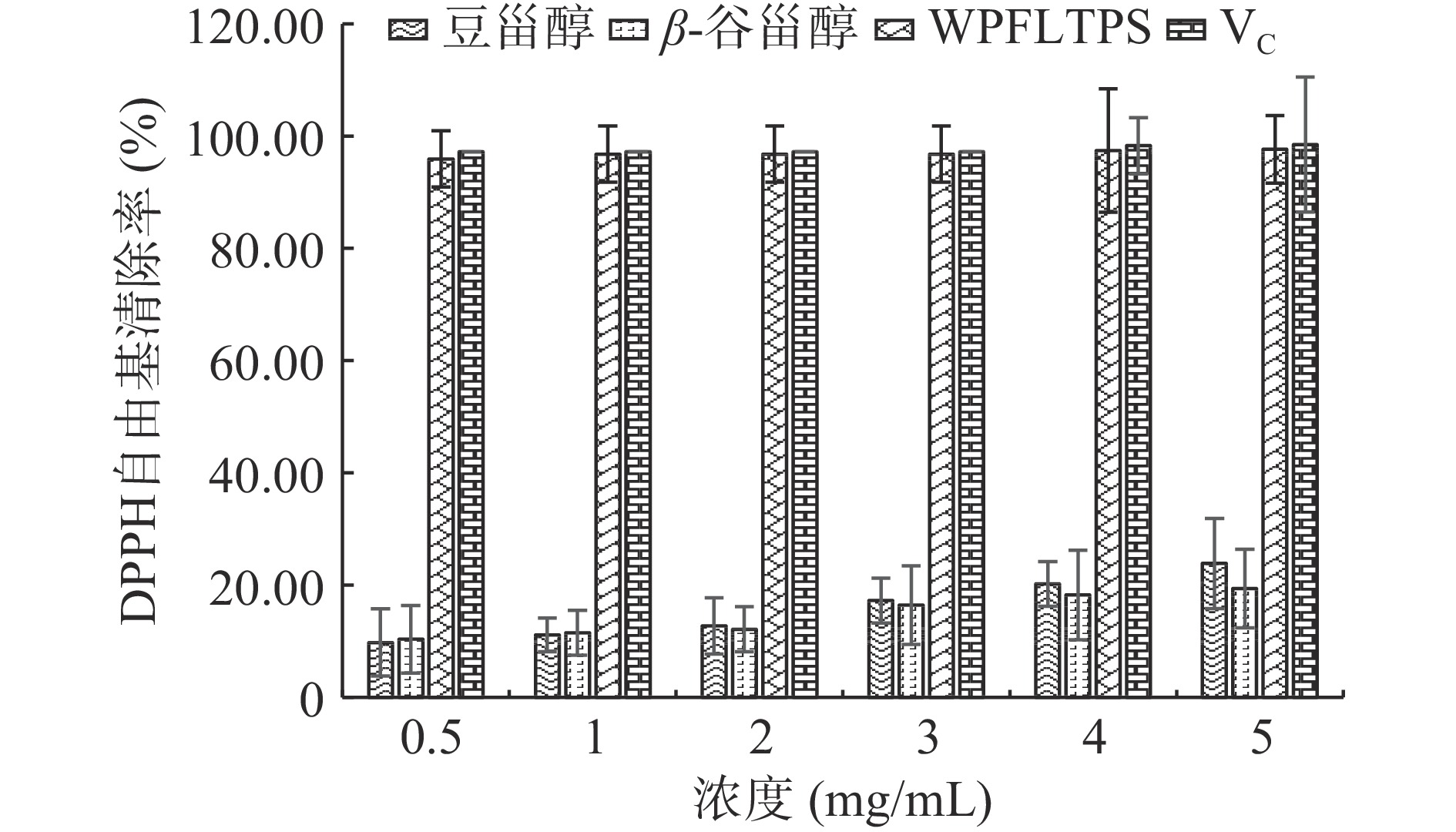
由图5可知,在0.5~5 mg/mL范围内,WPFLTPS、豆甾醇、β-谷甾醇对DPPH自由基均有不同程度的清除能力,随着浓度的增大清除作用也增大,达到一定程度后趋于平缓,呈良好的量效关系,其中WPFLTPS清除效果最佳,当浓度为5 mg/mL时,清除率达97.64%与阳性对照组VC清除率接近(98.49%),豆甾醇清除略高于β-谷甾醇,两者均明显低于WPFLTPS。此研究结果与张东阳[11]实验规律相似。贾硕[26]研究发现,黑灵芝甾醇在5 mg/mL浓度时,对DPPH自由基清除率最高约为25.86%,而WPFLTPS抗氧化能力远高于黑灵芝甾醇。彭昕等[27]研究发现,雷竹笋甾醇在3 mg/mL浓度时,对DPPH自由基清除率最高约为35%,而WPFLTPS抗氧化能力远高于雷竹笋甾醇。综上可知,WPFLTPS具有很强的抗氧化能力可以作为天然的抗氧剂,应用前景广阔。
2.4.2 对ABTS+自由基清除效果
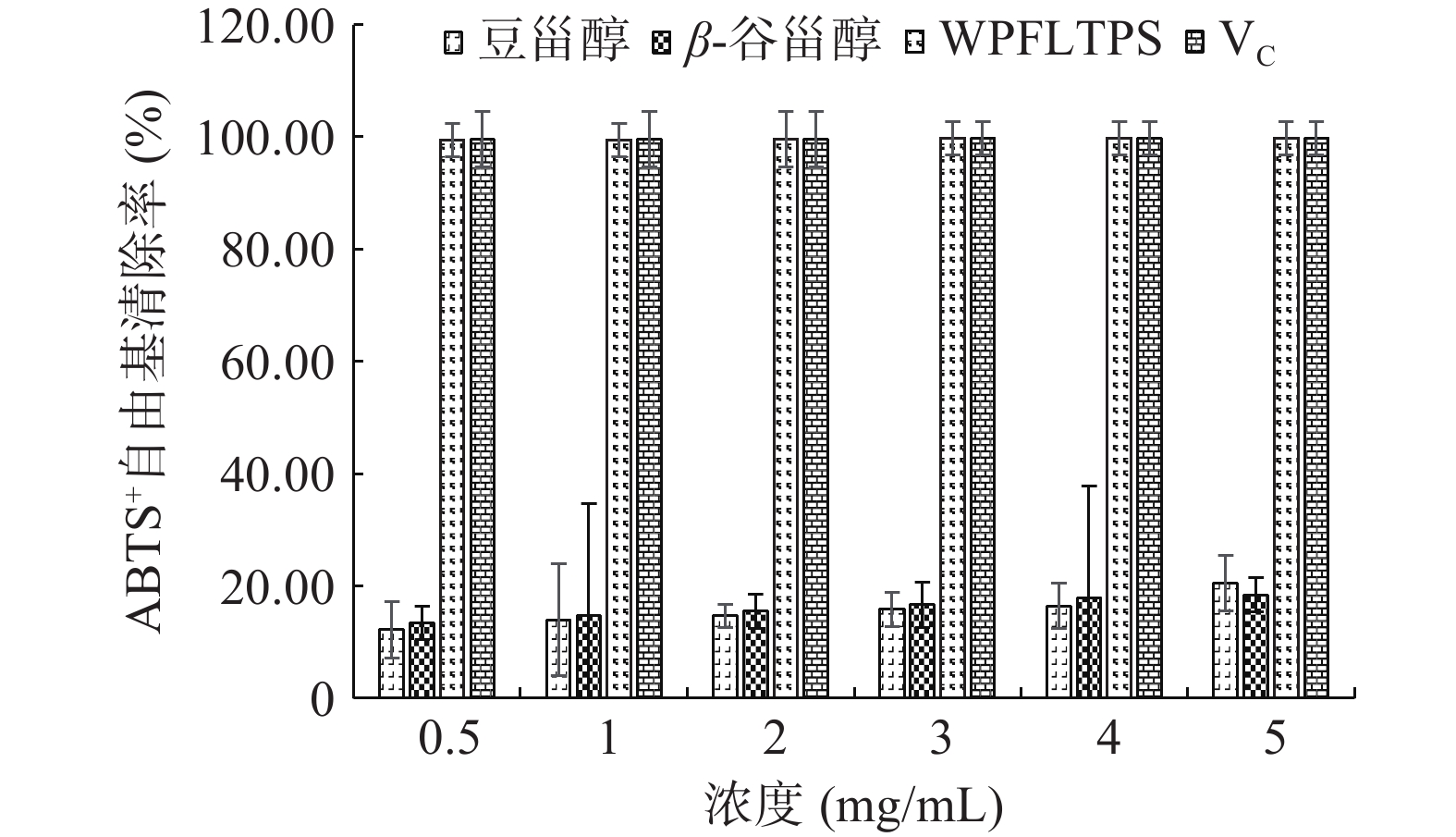
由图6可知,在0.5~5 mg/mL范围内,WPFLTPS、豆甾醇、β-谷甾醇对ABTS+自由基均有不同程度的清除能力,随着浓度的增大清除作用也增大,达到一定程度后趋于平缓,呈良好的量效关系,其中WPFLTPS清除效果最佳,当浓度为5 mg/mL时,清除率高达99.81%,与阳性对照组VC清除率持平,豆甾醇清除略高于β-谷甾醇,两者均明显低于WPFLTPS。本研究结果发现火棘叶粗提物对ABTS+自由基的清除作用比单体效果好,可能由于粗提物还含有其他甾醇类物质,其较强的抗氧化作用是各个单体化合物的协同作用。马雪洁等[28]研究表明,异叶青兰总黄酮在0~1 mg/mL范围内对ABTS+自由基有很好的清除作用,清除能力随着浓度增大而升高,而后趋于平稳,与本研究结果规律相似。
2.4.3 对亚硝酸根(NO2−)清除效果
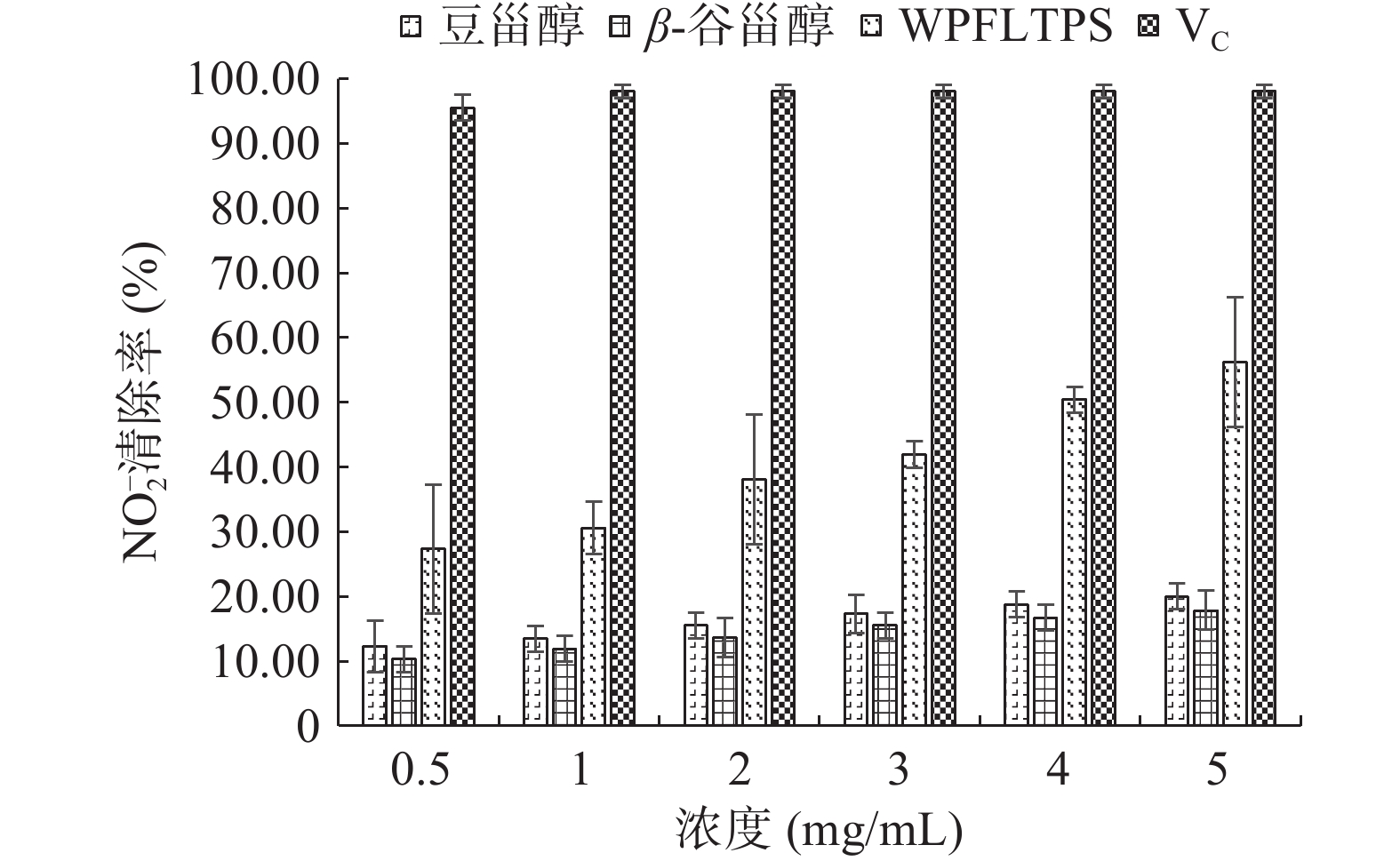
由图7可知,在0.5~5 mg/mL范围内,WPFLTPS、豆甾醇、β-谷甾醇对NO2−均有不同程度的清除能力,随着浓度的增大清除作用也增大,呈良好的量效关系,其中WPFLTPS清除效果最佳,当浓度为5 mg/mL,清除率达56.2%,低于阳性对照组VC(98.00%)。童钰琴等[17]研究发现,苦荞皮总黄酮在2.64 mg/mL时对NO2−清除率约为50%,清除能力随着浓度增大而升高,而后趋于平稳,与本研究结果规律相似。吴海成[18]研究表明,玉米须甾醇的浓度为2 mg/mL时,NO2−清除率达78%,低于阳性对照组VC(92%),亦与本研究结果规律相似。
综上可知,采用3种不同的体外抗氧化实验方法评价野生火棘叶总甾醇的抗氧化能力,结果发现,火棘叶总甾醇粗提物清除能力强于豆甾醇和β-谷甾醇单体化合物,可能与粗提物中还含有其他甾醇类物质有关,同时也可能由于豆甾醇和β-谷甾醇发挥协同作用产生较强的抗氧化作用,有待下一步研究。本次研究为新型天然抗氧化剂的开发提供科学依据,同时为野生火棘植物资源开发利用拓展了空间。
2.5 WPFLTPS体外对酪氨酸酶活性的影响
2.5.1 对酪氨酸酶单酚酶活性的抑制作用
由图8可知,在0.5~5 mg/mL范围内,WPFLTPS、豆甾醇对酪氨酸酶单酚酶活性均有不同程度的抑制作用,随着浓度的增大抑制作用也增强,呈良好的量效关系,其中WPFLTPS抑制效果最佳,当浓度为5 mg/mL,抑制率高达93.63%,其次是豆甾醇,抑制率达82.53%,两者略低于阳性对照组熊果苷(抑制率为96.77%)和VC(抑制率为99.28%)。
王雅等[19]研究发现,在0.1~5 mg/mL范围内,孜然乙醇提取物不同溶剂萃取部位对酪氨酸酶单酚酶具有不同的抑制作用,随着浓度的增大抑制作用也增强,呈良好的量效关系,与本研究结果规律相似。因此,火棘叶甾醇提取物可作为一种较强的新型酪氨酸酶单酚酶的抑制剂,在食品、化妆品、医药等领域具有潜在的应用价值。
2.5.2 对酪氨酸酶二酚酶活性的抑制作用
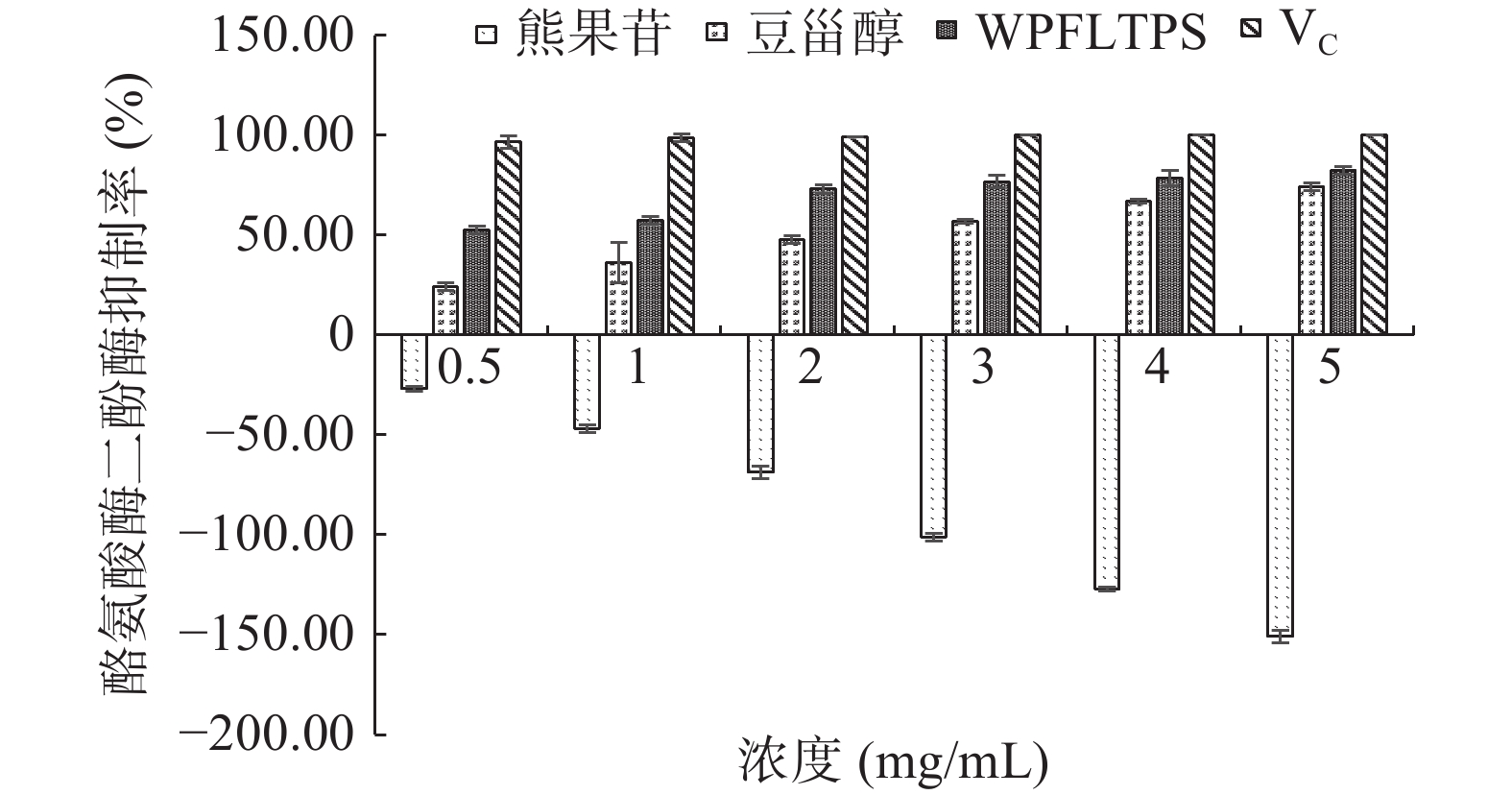
由图9可知,在0.5~5 mg/mL范围内,WPFLTPS、豆甾醇对酪氨酸酶二酚酶活性均有不同程度的抑制作用,随着浓度的增大抑制作用也增强,呈良好的量效关系,其中WPFLTPS抑制效果最佳,当浓度为5 mg/mL,抑制率高达82.53%,其次是豆甾醇,抑制率达74%,两者趋近于阳性对照组VC(抑制率为100%)。黄佳楠等[29]研究发现,在12.5~200 μg/mL范围内,黑果枸杞果实提取物中花色苷对酪氨酸酶二酚酶有一定抑制作用,随着浓度的增大抑制作用也增强后趋于稳定,呈良好的量效关系,当浓度为200 μg/mL时,抑制率达到最高约为56.5%,与本研究结果规律相似。
通过本次研究发现,阳性对照组熊果苷对酪氨酸酶二酚酶呈现激活作用,当浓度为5 mg/mL时,抑制率为−150.99%,其原因可能与熊果苷药物浓度或与其对二酚酶敏感性相关,后期有待进一步探究。马燕燕等[30]研究发现,当浓度为4 mg/mL时,龙井、柿叶、贡菊、银杏叶对酪氨酸酶单酚酶的活性有明显的抑制作用,其中龙井的抑制率最高达到了30.36%,而对二酚酶活力的抑制作用不明显,贡菊对酪氨酸酶二酚酶则表现出一定的激活作用(抑制率为−7.44%),与本实验研究结果规律相似。
综上可知,火棘叶总甾醇提取物、豆甾醇对酪氨酸酶有很好的抑制作用,其作用机制可能有以下几种原因:火棘叶中的甾醇类活性物质可以很好地清除氧自由基,减弱了酪氨酸的氧化反应;火棘叶甾醇作为竞争性底物,抑制了酪氨酸酶对酪氨酸的氧化作用;酪氨酸酶是一种以 Cu2+为辅助因子的金属酶,火棘叶总甾醇提取物中的活性基团与酪氨酸酶分子中的Cu2+络合,影响了酶的活性[30]。
3. 讨论与结论
实验室体外常用的抗氧化活性评价方法为自由基清除能力的测定,即在自由基溶液中加入抗氧化剂,根据所产生的光学差异来评估抗氧化活性[31]。此外,有研究表明,火棘果提取物有一定的美白效果,但在火棘叶中鲜见报道[32]。
因此,本文初步对野生火棘叶总甾醇的提取工艺及体外抗氧化和美白活性进行探究,采用超声辅助溶剂提取法,在单因素实验结果的基础上结合正交试验设计,优化得到最佳提取工艺参数为:提取溶剂无水乙醇,超声功率400 W,超声温度50 ℃,料液比1:16 g/mL,超声时间25 min,此条件下火棘叶总甾醇得率为(11.00±0.03)mg/g;接着采用DPPH、ABTS和亚硝酸盐法对火棘叶总甾醇抗氧化能力进行了分析,结果发现,火棘叶总甾醇很强的抗氧化能力,并呈现剂量效应,可见火棘叶总甾醇可作为一种新型的天然抗氧化剂开展深入开发;最后采用对酪氨酸酶活性抑制作用,初步探究火棘叶总甾醇美白效果,结果发现,火棘叶总甾醇对酪氨酸酶单酚酶和二酚酶均有很强的抑制作用,且优于甾醇单体化合物豆甾醇,可见火棘叶总甾醇可作为一种新型的天然美白活性物质,应用于口服美白功能食品的研发。
-
表 1 正交试验因素水平
Table 1 Orthogonal experimental factor level
水平 因素 A温度(℃) B料液比(g/mL) C超声时间(min) 1 40 1:12 15 2 50 1:16 25 3 60 1:20 35 表 2 反应液的组成
Table 2 Composition of reaction solution
实验组号 A组 B组 C组 D组 底物(mL) 1.0 1.0 1.0 1.0 样品(mL) 0.0 0.0 1.0 1.0 磷酸缓冲溶液(mL) 4.0 5.0 3.0 4.0 酪氨酸酶液(mL) 1.0 0.0 1.0 0.0 合计(mL) 6.0 6.0 6.0 6.0 表 3 正交试验结果
Table 3 Orthogonal test results
试验号 A B C 总甾醇得率(mg/g) 1 1 1 1 10.045 2 1 2 2 10.422 3 1 3 3 10.220 4 2 1 2 10.366 5 2 2 3 10.353 6 2 3 1 10.281 7 3 1 3 10.110 8 3 2 1 10.207 9 3 3 2 10.214 K1 10.299 10.174 10.178 K2 10.333 10.327 10.334 K3 10.177 10.238 10.228 R 0.156 0.153 0.156 表 4 正交试验方差分析
Table 4 Variance analysis of orthogonal test
因素 离均差平方和 自由度 均方 F P A 0.038 2 0.019 4.653 0.177 B 0.036 2 0.018 4.370 0.186 C 0.038 2 0.019 4.679 0.176 误差 0.008 2 0.004 总计 945.027 9 -
[1] YAO Y L, SHU C, FENG G, et al. Polysaccharides from Pyracantha fortuneana and its biological activity[J]. Int J Biol Macromol,2020,150:1162−1174. doi: 10.1016/j.ijbiomac.2019.10.125
[2] XU H, ZHAO C, LI Y, et al. The ameliorative effect of the Pyracantha fortuneana (Maxim.) H. L. Li extract on intestinal barrier dysfunction through modulating glycolipid digestion and gut microbiota in high fat diet-fed rats[J]. Food Funct,2019,10(10):6517−6532. doi: 10.1039/C9FO01599J
[3] 曾佳, 杨蓉, 李跃军, 等. 火棘的化学成分与药理作用研究进展[J]. 湖南中医杂志,2016,32(10):226−228. [ZENG J, YANG R, LI Y J, et al. Research progress on chemical constituents and pharmacological effects of Pyracantha fortuneana (Maxim.) H. L[J]. Hunan Journal of Traditional Chinese Medicine,2016,32(10):226−228.] ZENG J, YANG R, LI Y J, et al. Research progress on chemical constituents and pharmacological effects of Pyracantha fortuneana (Maxim.) H. L[J]. Hunan Journal of Traditional Chinese Medicine, 2016, 32(10): 226−228.
[4] 鄢又玉. 火棘果活性成分分析制备及其制剂基质研究[D]. 武汉:华中科技大学, 2016. [YAN Y Y. Research on analysis and preparation of active ingredients from Pyracantha fortuneana fruit and its pharmaceutical matrix[D]. Wuhan:Huazhong University of Science and Technology, 2016.] YAN Y Y. Research on analysis and preparation of active ingredients from Pyracantha fortuneana fruit and its pharmaceutical matrix[D]. Wuhan: Huazhong University of Science and Technology, 2016.
[5] 乃戈日优, 李佩华, 彭正松, 等. 火棘的研究进展[J]. 四川农业科技,2020,4(10):20−22. [NAI G R Y, LI P H, PENG Z S et al. Research progress of Pyracantha fortuneana (Maxim.) H. L[J]. Sichuan Agricultural Science and Technology,2020,4(10):20−22.] NAI G R Y, LI P H, PENG Z S et al. Research progress of Pyracantha fortuneana (Maxim.) H. L[J]. Sichuan Agricultural Science and Technology, 2020, 4(10): 20−22.
[6] 李三杰. 火棘果资源化学及其抗氧化作用研究[D]. 武汉:华中科技大学, 2011. [LI S J. The bioresource-chemistry and antioxidation of Pyracantha fortuneana (Maxim.) H. L[D]. Wuhan:Huazhong University of Science and Technology, 2011.] LI S J. The bioresource-chemistry and antioxidation of Pyracantha fortuneana (Maxim.) H. L[D]. Wuhan: Huazhong University of Science and Technology, 2011.
[7] 和玉凤, 杨少杰, 张雯, 等. 火棘不同组织中稀土元素含量的测定[J]. 食品工业科技,2019,40(4):257−260,265. [HE Y F, YANG S J, ZHANG W, et al. Determination of the contents of rare earth elements in different tissues of Pyracantha fortunean[J]. Science and Technology of Food Industry,2019,40(4):257−260,265.] HE Y F, YANG S J, ZHANG W, et al. Determination of the contents of rare earth elements in different tissues of Pyracantha fortunean[J]. Science and Technology of Food Industry, 2019, 40(4): 257−260,265.
[8] 张思. 南瓜籽甾醇的分离纯化及功能评价[D]. 长沙:湖南农业大学, 2017. [ZHANG S. Isolation, purification and functional evaluation of pumpkin seed sterol[D]. Changsha:Agricultural University of Hunan, 2017.] ZHANG S. Isolation, purification and functional evaluation of pumpkin seed sterol[D]. Changsha: Agricultural University of Hunan, 2017.
[9] WANG Z, WANG M, LU Y, et al. Single-cell transcriptomics reveals the difference of aortic atherosclerosis response to phytosterols and oxidation products of sterols[J]. Mol Nutr Food Res,2023,67(12):e2200811. doi: 10.1002/mnfr.202200811
[10] 王媛媛, 马改琴, 李跃凡, 等. 植物甾醇的提取纯化方法研究进展[J]. 中国油脂,2024,49(2):114−122. [WANG Y Y, MA G Q, LI Y F, et al. Research progress on extraction and purification methods of phytosterols[J]. China Oils and Fats,2024,49(2):114−122.] WANG Y Y, MA G Q, LI Y F, et al. Research progress on extraction and purification methods of phytosterols[J]. China Oils and Fats, 2024, 49(2): 114−122.
[11] 张冬阳. 薏米中β-谷甾醇的提取、分离、纯化及其功能性的研究[D]. 锦州:锦州医科大学, 2018. [ZHANG D Y. Exrraction, separation, purification and functional research of β-sitosterol from coix seed[D]. Jinzhou:Jinzhou Medical University, 2018.] ZHANG D Y. Exrraction, separation, purification and functional research of β-sitosterol from coix seed[D]. Jinzhou: Jinzhou Medical University, 2018.
[12] 张云焕, 冯亚净, 崔兆蕙, 等. 小麦胚芽中植物甾醇提取条件优化的研究[J]. 粮食与油脂,2018,31(5):35−38. [ZHANG Y H. FENG Y J, CUI Z H, et al. Optimization on extraction of phytosterol from wheat germ by ultrasound-assisted method[J]. Grain and Oil,2018,31(5):35−38.] ZHANG Y H. FENG Y J, CUI Z H, et al. Optimization on extraction of phytosterol from wheat germ by ultrasound-assisted method[J]. Grain and Oil, 2018, 31(5): 35−38.
[13] 孙莉莉, 王维宇, 王振强, 等. 热回流法提取米糠中植物甾醇的工艺优化及分离纯化[J]. 食品工业,2021,42(5):63−66. [SUN L L, WANG W Y, WANG Z Q, et al. Optimization of extraction process of phytosterol from rice bran by heat reflux method and separation purification[J]. Food Industry,2021,42(5):63−66.] SUN L L, WANG W Y, WANG Z Q, et al. Optimization of extraction process of phytosterol from rice bran by heat reflux method and separation purification[J]. Food Industry, 2021, 42(5): 63−66.
[14] 靳若周, 李非凡, 曾媛媛, 等. 鹰嘴豆中植物甾醇的提取工艺优化及其抑菌活性[J]. 食品工业科技,2019,40(24):172−177, 184. [JIN R Z, LI F F, ZENG Y Y, et al. Optimization of extraction process of phytosterol from chickpea and its antimicrobial activity[J]. Science and Technology of Food Industry,2019,40(24):172−177, 184.] JIN R Z, LI F F, ZENG Y Y, et al. Optimization of extraction process of phytosterol from chickpea and its antimicrobial activity[J]. Science and Technology of Food Industry, 2019, 40(24): 172−177, 184.
[15] 杨菁, 刘顶鼎, 陈滕, 等. 粉条儿菜总黄酮提取工艺优化及抗氧化、抗炎活性分析[J]. 食品工业科技,2024,45(2):192−200. [YANG Q, LIU D D, CHEN T, et al. Extraction process optimization and antioxidant, anti-inflammatory activity of total flavonoids from Aletris spicata (Thunb.) Franch J]. Science and Technology of Food Industry,2024,45(2):192−200.
[16] YISEOP K, YOUNGBAE K, KIHAN K A. study on DPPH and ABTS antioxidant activity and sensory evaluation of seolgitteok with walnut and health CRISIS (Juglans Regia)[J]. Int J Crisis Safe,2021,6(4):2021.
[17] 童钰琴, 李姝, 牛曼思, 等. 苦荞麸皮总黄酮体外抗氧化活性及体内解酒护肝作用[J]. 食品工业科技,2020,41(17):314−319, 326. [TONG Y Q, LI S, NIU M S, et al. Antioxidant activity of total flavonoids from tartary buckwheat bran in vitro and its effect on antialcoholism and liver protection in vivo[J]. Science and Technology of Food Industry,2020,41(17):314−319, 326.] TONG Y Q, LI S, NIU M S, et al. Antioxidant activity of total flavonoids from tartary buckwheat bran in vitro and its effect on antialcoholism and liver protection in vivo[J]. Science and Technology of Food Industry, 2020, 41(17): 314−319, 326.
[18] 吴海成. 玉米须甾醇的提取纯化及抑菌活性[D]. 长春:吉林大学, 2013. [WU H C. Extraction purification and antimicrobial activity of phytosterol from corn silk[D]. Changchun:Jilin University, 2013.] WU H C. Extraction purification and antimicrobial activity of phytosterol from corn silk[D]. Changchun: Jilin University, 2013.
[19] 王雅, 杜国英, 邹红梅, 等. 孜然乙醇提取物的工艺优化及对酪氨酸酶活性的抑制作用[J]. 食品工业科技,2018,39(9):164−169. [WANG Y, DU G Y, ZOU H M, et al. Optimization of extraction process of ethanol extracts from cumin (Cuminum cyminum L.) and measurement of anti-tyrosinase activity[J]. Science and Technology of Food Industry,2018,39(9):164−169.] WANG Y, DU G Y, ZOU H M, et al. Optimization of extraction process of ethanol extracts from cumin (Cuminum cyminum L.) and measurement of anti-tyrosinase activity[J]. Science and Technology of Food Industry, 2018, 39(9): 164−169.
[20] 彭思琪, 王娟. 香蕉皮总黄酮的提取及其抗氧化和抑制酪氨酸酶的活性[J]. 食品研究与开发,2022,43(20):132−140. [PENG S Q, WANG J. Antioxidant activity and inhibition on tyrosinase of total flavonoids extracted from banana peels[J]. Food Research and Development,2022,43(20):132−140.] PENG S Q, WANG J. Antioxidant activity and inhibition on tyrosinase of total flavonoids extracted from banana peels[J]. Food Research and Development, 2022, 43(20): 132−140.
[21] 陈荣达, 史玉蕊, 刘桂明, 等. 紫娟茶花青素提取物抑制酪氨酸酶活性研究[J]. 长春师范大学学报,2020,39(12):90−93. [CHEN R D, SHI Y R, LIU G M, et al. Study on inhibitory effect of anthocyanin extract from Zi juan tea on tyrosinase activity[J]. Journal of Changchun Normal University,2020,39(12):90−93.] CHEN R D, SHI Y R, LIU G M, et al. Study on inhibitory effect of anthocyanin extract from Zi juan tea on tyrosinase activity[J]. Journal of Changchun Normal University, 2020, 39(12): 90−93.
[22] 刘晓飞, 宋洁, 王薇, 等. 发芽糙米植物甾醇的提取优化及抗氧化性研究[J]. 哈尔滨商业大学学报(自然科学版),2019,35(1):44−48,70. [LIU X F, SONG J, WANG W, et al. Study on extraction of phytosterol from germinated brown riceby ultrasonic assisted method and its antioxidant activity[J]. Journal of Harbin University of Commerce (Natural Sciences Edition),2019,35(1):44−48,70.] LIU X F, SONG J, WANG W, et al. Study on extraction of phytosterol from germinated brown riceby ultrasonic assisted method and its antioxidant activity[J]. Journal of Harbin University of Commerce (Natural Sciences Edition), 2019, 35(1): 44−48,70.
[23] 曾夏雨, 何佳慧, 许泽文, 等. 超声波辅助提取玉竹植物甾醇工艺的优化[J]. 湖北农业科学,2016,55(20):5345−5348. [ZENG X Y, HE J H, XU Z W, et al. Optimization of extracting phytosterol from Polygonatum odoratum (Mill) Druce with ultrasonic assisted method[J]. Hubei Agricultural Sciences,2016,55(20):5345−5348.] ZENG X Y, HE J H, XU Z W, et al. Optimization of extracting phytosterol from Polygonatum odoratum (Mill) Druce with ultrasonic assisted method[J]. Hubei Agricultural Sciences, 2016, 55(20): 5345−5348.
[24] 刘真阳, 张碧霄, 李非凡, 等. 白果中植物甾醇的提取工艺优化及体外释放研究[J]. 中国食物与营养,2020,26(8):19−23. [LIU Z Y, ZHANG B Q, LI F F, et al. Extraction optimization and in vitro release of phytosterol from ginkgo[J]. Food and Nutrition in China,2020,26(8):19−23.] LIU Z Y, ZHANG B Q, LI F F, et al. Extraction optimization and in vitro release of phytosterol from ginkgo[J]. Food and Nutrition in China, 2020, 26(8): 19−23.
[25] 龚晨, 高庆超, 常应九, 等. 沙棘甾醇化合物的分离纯化研究[J]. 食品研究与开发,2019,40(9):82−87. [GONG C, GAO Q C, CHANG Y J, et al. The separation and purification of sterol compound of Hippophae rhamnoides L J]. Food Research and Development,2019,40(9):82−87.
[26] 贾硕. 黑灵芝甾醇组分制备、抑菌活性及其体外抗氧化活性研究[D]. 南昌:南昌大学, 2019. [JIA S. Preparation, antibacterial activity and antioxidant activity of sterol compound from Ganoderma atrum[D]. Nanchang:Nanchang University, 2019.] JIA S. Preparation, antibacterial activity and antioxidant activity of sterol compound from Ganoderma atrum[D]. Nanchang: Nanchang University, 2019.
[27] 彭昕, 黄亮, 王平, 等. 雷竹笋总黄酮和总甾醇的抗氧化性与抑菌性[J]. 经济林研究,2017,35(3):179−185. [PENG X, HUANG L, WANG P, et al. Antioxidant and antibacterial activities of total flavonoids and total sterols in Phyllostachys praecox shoots[J]. Nonwood Forest Research,2017,35(3):179−185.] PENG X, HUANG L, WANG P, et al. Antioxidant and antibacterial activities of total flavonoids and total sterols in Phyllostachys praecox shoots[J]. Nonwood Forest Research, 2017, 35(3): 179−185.
[28] 马雪洁, 程路峰, 杨淑梅, 等. 异叶青兰总黄酮的含量测定及体外抗氧化活性研究[J]. 中南药学,2021,19(6):1130−1133. [MA X J, CHENG L F, YANG S M, et al. Content determination of total flavonoid and its in vitro antioxidant activity of Dracocephalum heterophyllum Benth[J]. Central South Pharmacy,2021,19(6):1130−1133.] MA X J, CHENG L F, YANG S M, et al. Content determination of total flavonoid and its in vitro antioxidant activity of Dracocephalum heterophyllum Benth[J]. Central South Pharmacy, 2021, 19(6): 1130−1133.
[29] 黄佳楠, 管福琴, 李林蔚, 等. 黑果枸杞果实提取物中花色苷对酪氨酸酶活性的抑制作用初探[J]. 植物资源与环境学报,2020,29(3):75−77. [HUANG J N, GUAN F Q, LI L W, et al. Preliminary study on inhibitory effect of anthocyanins from fruit extracts of Lycium ruthenicum on tyrosinase activity[J]. Journal of Plant Resources and Environment,2020,29(3):75−77.] HUANG J N, GUAN F Q, LI L W, et al. Preliminary study on inhibitory effect of anthocyanins from fruit extracts of Lycium ruthenicum on tyrosinase activity[J]. Journal of Plant Resources and Environment, 2020, 29(3): 75−77.
[30] 马燕燕, 鲁晓翔. 龙井乙醇提取物对酪氨酸酶活性的抑制作用[J]. 食品工业科技,2010,31(11):141−143. [MA Y Y, LU X X. Inhibitory mechanism of ethanol extracts from Longjing on tyrosinase activity[J]. Science and Technology of Food Industry,2010,31(11):141−143.] MA Y Y, LU X X. Inhibitory mechanism of ethanol extracts from Longjing on tyrosinase activity[J]. Science and Technology of Food Industry, 2010, 31(11): 141−143.
[31] 王红, 彭励, 宋乐, 等. 银柴胡多糖超声辅助提取工艺优化及抗氧化活性分析[J]. 食品工业科技,2024,45(1):185−191. [WANG H, PENG L. SONG L, et al. Optimization of ultrasonic-assisted extraction process and analysis of antioxidant activity of polysaccharide from Stellariae Radix J]. Science and Technology of Food Industry,2024,45(1):185−191.
[32] 黄荣, 傅小红. 火棘黄酮的提取及美白功效研究[J]. 化学研究与应用,2015,27(3):324−328. [HUANG R, FU X H. Research on the extraction of flavonoids from the fruits of Pyracantha fortuneana and their whitening activity[J]. Chemical Research and Application,2015,27(3):324−328.] HUANG R, FU X H. Research on the extraction of flavonoids from the fruits of Pyracantha fortuneana and their whitening activity[J]. Chemical Research and Application, 2015, 27(3): 324−328.





 下载:
下载:

 下载:
下载:
