Antifungal Effects of ε-Poly-L-lysine on Lasiodiplodia theobromae Causing Fruit Rot of Passiflora caerulea L. and Its Mechanism
-
摘要: 为研究ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)对西番莲果实采后果腐病菌可可毛色二孢(Lasiodiplodia theobromae)的抑制作用和抑菌机理,本实验测定了ε-PL对L. theobromae菌丝生长、电导率、丙二醛含量、细胞内物质渗漏、细胞膜和细胞壁组分含量、腺苷三磷酸酶活性的影响,分析了碘化丙啶染色和傅里叶变换红外光谱变化,并探究了ε-PL对L. theobromae侵染所致西番莲采后果腐病的抑制效果。体外实验结果表明,ε-PL对L. theobromae菌丝生长具有抑制作用,且随着ε-PL浓度升高而增强,100 mg/L为最佳抑制浓度。ε-PL还提高了L. theobromae菌丝体的电导率和丙二醛含量,促进核酸和蛋白质等细胞内物质渗漏,降低麦角固醇、总脂质和几丁质含量及腺苷三磷酸酶活性。另外,ε-PL可改变L. theobromae菌丝形态,使其卷曲和弯折,减少其菌丝体的亚甲基、甲基、羟基、碳氧键等数量。此外,ε-PL延缓了接种L. theobromae西番莲果实采后果腐病发生。因此,ε-PL可破坏L. theobromae细胞膜与细胞壁结构,促进内容物溶出,扰乱能量代谢,破坏生物大分子结构,进而起到抑菌作用。Abstract: To investigate the inhibitory effects and mechanism of ε-poly-L-lysine (ε-PL) against the Lasiodiplodia theobromae causing fruit rot on postharvest passions, the changes of L. theobromae mycelial growth, conductivity, malonaldehyde content, intracellular materials leakage, contents of cell membrane and cell wall components, adenosine triphosphatase activity, propidium iodide staining, and Fourier transform infrared spectroscopy were determined after being treated with ε-PL, and the inhibition effects of ε-PL on L. theobromae-induced fruit rot of harvested passion fruits were studied. In vitro assay showed that ε-PL inhibited the mycelial growth of L. theobromae, and the inhibitory effects increased with increasing ε-PL concentration. The optimal inhibitory concentration of ε-PL was 100 mg/L. Additionally, ε-PL might increase the conductivity and malondialdehyde content, promote the leakage of intercellular nucleic acid and protein, decrease the contents of ergosterol, total lipids and chitin, reduce the activity of adenosine triphosphate. Moreover, ε-PL also changed the mycelial morphology of L. theobromae, resulting in the mycelial distortion, and lowered the number of methylene, methyl, hydroxyl and carbon-oxygen bonds in mycelium of L. theobromae. Furthermore, ε-PL could suppress the L. theobromae-induced fruit rot development of harvested passion fruits. Therefore, ε-PL could display the antifungal activity on L. theobromae through destroying the structure of cell membrane and cell wall, promoting the leakage of intracellular materials, disordering the energy metabolism, and destroying the structure of biological macromolecules.
-
Keywords:
- passion fruit /
- fruit rot /
- Lasiodiplodia theobromae /
- ε-PL /
- antifungal mechanism
-
西番莲(Passiflora caerulea L.),亦称百香果,是我国南方特色的亚热带、热带水果,主要分布在广西、福建、云南、广东等省区,其果实含有丰富的膳食纤维、酚类、维生素、矿物质、有机酸等人体所需活性物质,同时具有抗氧化、降血脂、降血压、抗肿瘤等药用价值,因而深受消费者喜爱[1−2]。黄果与紫果是市场上主要销售的西番莲品种,相比之下,黄果更具营养价值[3]。然而,西番莲果实一般在高温高湿的季节成熟与采收,此时果实具有较强的呼吸作用,使得果皮容易失水而皱缩,果实发生腐烂等症状,这极大限制了西番莲果实采后贮藏保鲜及其品质的保持[4−6]。病原菌侵染是引起西番莲果实采后病害、腐烂发生的重要原因[7−8]。其中,可可毛色二孢(Lasiodiplodia theobromae)诱导的果腐病是黄果西番莲果实采后主要病害之一[8]。目前,丙氯灵、二氯异氰尿酸钠等化学杀菌剂的使用能减轻西番莲果实病害症状,而随之产生的药物残留、环境污染、危害人体健康等问题,使其不宜在果实采后病害防治中继续使用[2,6]。因此,寻求一种安全、有效的天然防腐技术以抑制L. theobromae侵染所引起的西番莲果腐病迫在眉睫。
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种从白色链霉菌NO.346中分离而得的安全、高效的抑菌多肽[9−10]。它是由25~35个L-赖氨酸残基通过ε-氨基与α-羧基间所形成的酰胺键构成,且具备强抗菌性、安全性、热稳定性、生物可降解等优点[11−12]。基于这些优点,在中国、美国、韩国、日本等国家已批准ε-PL作为食品添加剂使用[9,13]。有研究报道,ε-PL对灰葡萄孢(Botrytis cinerea)菌丝生长、孢子萌发和芽管伸长等具有较强的抑制作用,同时造成B. cinerea细胞膜的损伤;还能控制樱桃番茄、草莓、葡萄等果实采后发生灰霉病[11]。ε-PL可破坏梨果实黑斑病菌(Alternaria alternata)的细胞膜与线粒体结构,提升菌丝体的电导率,进而降低A. alternata的致病性[12]。另外,Wei等[14]研究表明,ε-PL可损伤粉红单端孢的孢子形态,使其变得粗糙、收缩,致使孢子质膜及细胞壁结构丧失。近期研究发现,ε-PL对黄果西番莲另一个主要致病菌—褐腐病菌Diaporthe passiflorae具有显著的抑制作用,同时也能减缓D. passiflorae侵染诱导的果实采后病害发生[8]。然而,目前未见ε-PL对黄果西番莲果腐病菌L. theobromae的抑制作用及其机理的研究报道。因此,本文以黄果西番莲果腐病菌L. theobromae为研究对象,研究ε-PL对L. theobromae的抑制作用,进一步探索可能的内在机理,旨在为抑制西番莲果实采后病害、增强果实品质提供理论依据。
1. 材料与方法
1.1 材料与仪器
西番莲果实 福建省主栽的‘黄金’(Passiflora caerulea L. cv. ‘Huangjin’)品种为试材,果实采摘于福建省泉州市瑞龙生态农业有限公司,选择大小色泽均一、成熟度一致、健康的果实用于研究;L. theobromae 本课题组自行分离、鉴定和保存的菌种,将L. theobromae接种到燕麦米糠琼脂培养基上,培养21 d(连续光照),用无菌水洗脱成熟孢子,制成1×105个孢子/mL的孢子悬浮液;ε-PL(食品级) 江苏一鸣生物股份有限公司;马铃薯葡萄糖水(potato dextrose broth,PDB)培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基 青岛海博生物技术有限公司;其他化学试剂(分析纯) 国药集团化学试剂有限公司。
ZRX-260型人工气候箱 宁波赛福实验仪器有限公司;SQ510C型立式压力蒸汽灭菌器 重庆雅马拓科技有限公司;BXJ803E型生物光学显微镜 上海启步生物科技有限公司;Infinite M200 Pro型酶标仪 瑞士帝肯公司;SQP型电子天平 赛多利斯科学仪器(北京)有限公司;DM 1L LED型荧光倒置显微镜 德国徕卡公司;S230型电导率仪 梅特勒-托利多仪器(上海)有限公司;Czone G6T型全自动菌落计数联用仪 杭州迅数科技有限公司;Nicolet iS10型傅里叶变换红外光谱仪 美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 L. theobromae菌丝体的制备
参考Phyo等[15]的方法,取0.5 mL 1×105个孢子/mL的L. theobromae孢子悬浮液,接种至50 mL PDB培养基,在摇床(28 ℃、150 r/min)中培养3 d,离心(28 ℃、8000 r/min),收集菌丝体备用。
1.2.2 L. theobromae菌落直径的测定
参考Pérez-Alfonso等[16]的方法,将ε-PL添加至冷却的灭菌的PDA培养基中,制成含有0(对照)、20、40、60、80、100、120 mg/L等不同浓度ε-PL的PDA培养基,随后倒平板(∅=90 mm)。在平板中心接种一个已预先培养3 d的L. theobromae菌饼(∅=5 mm),置于28 ℃下培养3 d,期间每12 h测量菌落直径,最终获得ε-PL的最佳抑制浓度。
1.2.3 L. theobromae菌丝体干重和抑制率的测定
在获得ε-PL的最佳抑制浓度的基础上,参考袁康等[17]的方法,把ε-PL添加至PDB培养基中,使培养基ε-PL浓度分别为0(对照)、50、100、200 mg/L;把L. theobromae孢子悬浮液加到上述培养基中,并调节浓度至1×105个孢子/mL。置于摇床(28 ℃、150 r/min)中培养,每12 h取出,离心,干燥,测定菌丝体干重,同时计算抑制率。
1.2.4 L. theobromae菌丝的形态观察
参考Liu等[9]的方法,将预先培养3 d的L. theobromae菌饼(∅=5 mm)接种到含有0(对照组)、50、100、200 mg/L ε-PL的PDA平板中心,置于28 ℃下培养3 d,每12 h收集菌丝,用生物光学显微镜观察其形态。
1.2.5 L. theobromae菌丝体电导率的测定
参考王小佳等[18]和Wang等[19]的方法,分别测定10 mL的0(对照)、50、100、200 mg/L ε-PL的电导率C1,取1 g菌丝体加到上述溶液中,静置,测定0、0.5、1、1.5、2、2.5、3 h时的电导率C2,以C1和C2的差值表示菌丝体电导率,结果以ms/m表示。
1.2.6 L. theobromae菌丝体丙二醛(malonaldehyde,MDA)含量的测定
参照Jiao等[11]和Yu等[20]的方法,取0.1 g菌丝体,添加至0(对照)、50、100、200 mg/L ε-PL中,静置0、1、2、3、4、5 h,离心(28 ℃、15000 r/min离心),取上清液1 mL,用硫代巴比妥酸法测定MDA含量,结果以nmol/g。
1.2.7 L. theobromae菌丝体碘化丙啶(propidium iodide,PI)染色
参照王玢等[21]、Yue等[22]的方法,在1.5 mL的最佳抑制浓度的ε-PL中加0.1 g菌丝体、500 μL 100 mg/L PI染液,室温下置于暗室中0、2、4、6、8、10 min,随后用荧光倒置显微镜观察。
1.2.8 L. theobromae菌丝体细胞内物质溶出量的测定
参照Phyo等[15]、王小佳等[18]的方法,分别测定10 mL的0(对照)、50、100、200 mg/L ε-PL在波长为260、280 nm时的吸光值,之后分别加入1 g菌丝体,静置0、1、2、3、4、5 h后,离心(28 ℃、15000 r/min离心),取上清液再次测定吸光值,分别用△A260 nm和△A280 nm表示核酸和蛋白质溶出量。
1.2.9 L. theobromae菌丝体麦角固醇、总脂质、几丁质含量和线粒体腺苷三磷酸酶(adenosine triphosphate,ATPase)活性的测定
取0.1 g的菌丝体,参照李瑞一等[23]的方法测定L. theobromae菌丝体麦角固醇、总脂质、几丁质含量和线粒体ATPase活性。麦角固醇含量以%表示,总脂质、几丁质含量以μg/mg表示,线粒体ATPase活性以U/mg protein表示。
1.2.10 L. theobromae菌丝体傅里叶变换红外光谱的测定
参考袁康等[17]、李瑞一等[23]的方法,用0.01 mol/L磷酸钠缓冲液(pH7.0)洗涤菌丝体,冻干后和光谱级溴化钾混合,研磨,之后用傅里叶变换红外光谱仪测定与分析。
1.2.11 ε-PL对西番莲采后果腐病的抑制研究
将挑选的西番莲果实分成6组,第1组浸泡在无菌水(未打孔)中10 min,取出晾干,作为空白组(Blank);第2组浸泡在无菌水中10 min,取出晾干,用灭菌打孔器在果实赤道面打孔1个(∅=5 mm,d=3 mm,下同),接种20 μL无菌水,晾干,作为对照组(Control);第3~6组分别在0(无菌水)、50、100、200 mg/L ε-PL中浸泡10 min,取出晾干,打孔,接种20 μL 1×105个孢子/mL的L. theobromae孢子悬浮液,晾干。将处理的果实包装后贮藏在(28±1)℃、相对湿度90%环境中。在贮藏期间,取样观察病害发生情况。另外,参照Gong等[24]的方法测定果实病斑直径。
1.3 数据处理
每个指标重复3次,结果以平均值表示。用SPSS 20.0软件的ANOVA(方差分析)和Duncan检验对不同处理组间的差异水平进行比较,用P<0.05表示差异达统计学显著水平。
2. 结果与分析
2.1 ε-PL对L. theobromae菌丝生长和菌落直径的影响
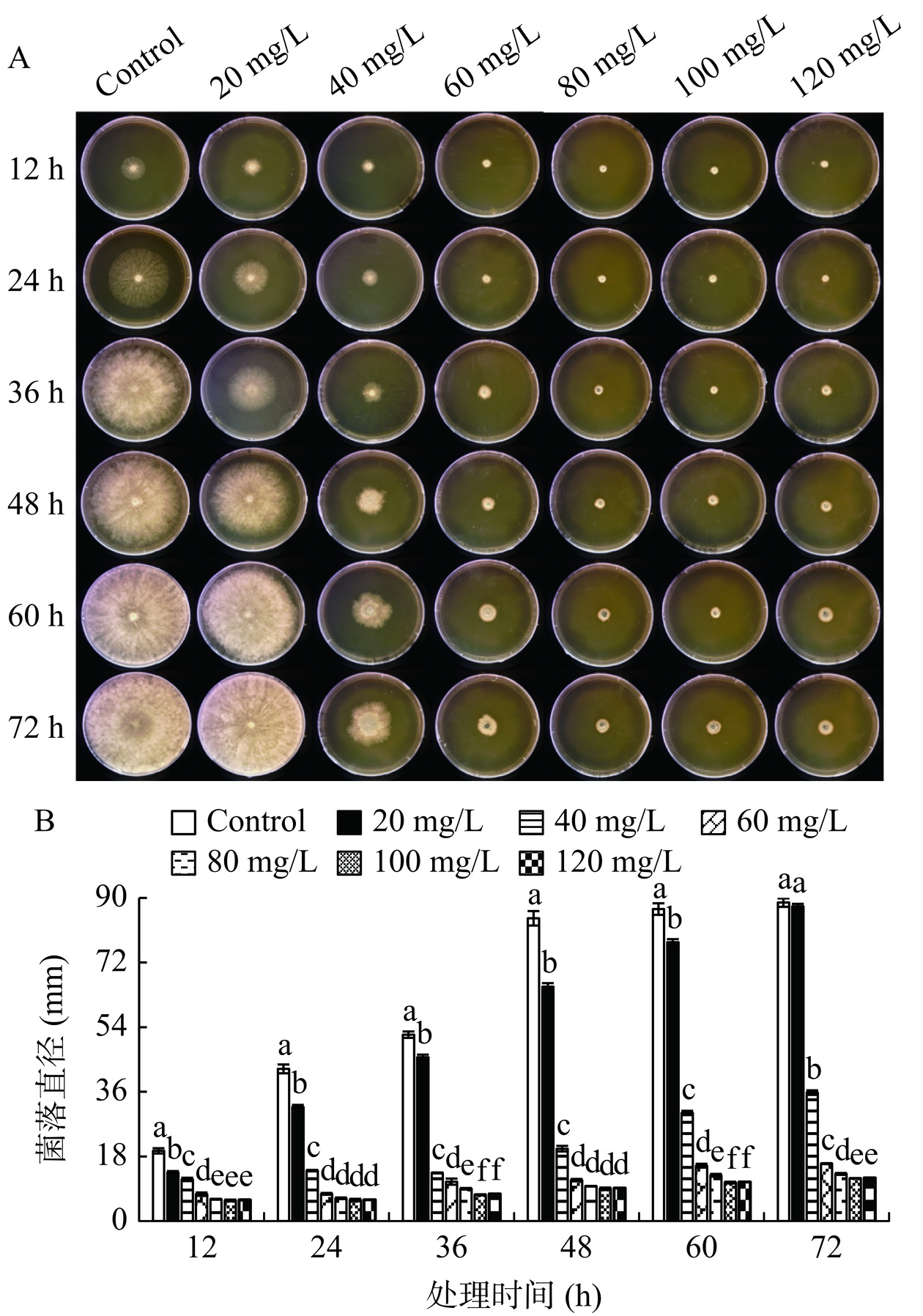
菌落直径的大小可评价病原菌的菌丝生长能力。由图1A可知,随着培养时间的延长,对照组的L. theobromae菌丝快速生长,到培养72 h时,已基本长满整个PDA平板。然而,在含有ε-PL的PDA平板中,L. theobromae菌丝生长均受到了不同程度的抑制,并随着ε-PL浓度的升高而增强。其中,20 mg/L ε-PL在一定程度上能显著(P<0.05)抑制L. theobromae菌丝生长,但是抑制效果比其他ε-PL处理组小。
由图1B可知,对照组的L. theobromae菌落直径快速扩展,在培养72 h时,其菌落直径为88.69±1.18 mm。然而,ε-PL能有效减缓L. theobromae菌落直径的扩展,且在培养72 h时,20、40、60、80、100、120 mg/L ε-PL处理组的L. theobromae菌落直径分别为对照组的98.82%、40.34%、18.04%、14.80%、13.43%、13.55%;除培养72 h时的20 mg/L ε-PL处理组外,所有ε-PL处理组的L. theobromae菌落直径均显著(P<0.05)低于对照组。当ε-PL浓度高于100 mg/L时,对L. theobromae菌落直径扩展的抑制作用将不再显著提升。
综上,一定浓度的ε-PL对L. theobromae菌丝生长具有明显的抑制作用,其中以100 mg/L为最佳抑制浓度。这与Li等[10]研究结果一致,即ε-PL可抑制B. Cinerea菌落直径的扩展,从而起到抑菌作用。
2.2 ε-PL对L. theobromae菌丝体干重和抑制率的影响
菌丝体干重可间接反应病原菌的生长情况。由图2A可知,L. theobromae菌丝体干重随着培养时间的延长而增加;而ε-PL能显著(P<0.05)降低其干重,且抑制作用随着ε-PL浓度的增加而增强。在培养72 h时,50、100、200 mg/L ε-PL处理组的菌丝体干重分别为对照组的77.91%、18.15%、2.32%。
通过测定ε-PL对L. theobromae菌丝生长的抑制率可评价ε-PL的抑菌活性。从图2B发现,ε-PL对L. theobromae菌丝生长的抑制率与ε-PL浓度呈现正相关,即随着ε-PL浓度的升高,其抑制率迅速提升。在培养72 h时,50、100、200 mg/L ε-PL处理组对L. theobromae菌丝生长的抑制率分别是69.64%±0.01%、88.11%±0.01%、93.09%±0.01%,均显著(P<0.05)高于对照组。
综上,ε-PL对L. theobromae菌丝的生长具有显著的抑制作用。刘志恬等[12]研究发现,ε-PL可降低A. alternata菌丝质量,进而起到抑菌效果。Sun等[25]研究报道,壳寡糖对B. cinerea菌丝生长的抑制率随着浓度的升高而增强。这些研究结果均与本文一致。
2.3 ε-PL对L. theobromae菌丝形态的影响
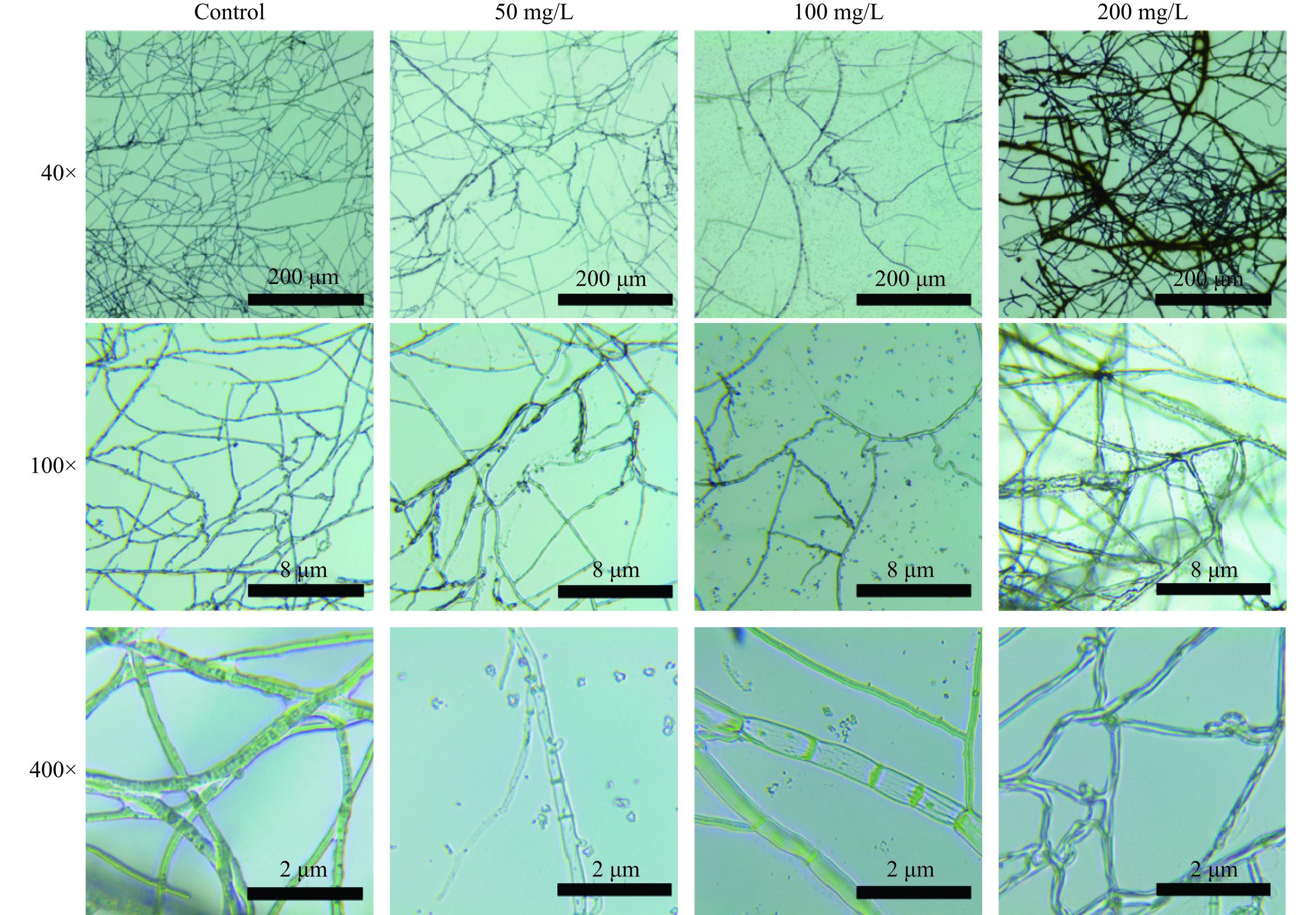
为了明确ε-PL是否影响L. theobromae菌丝形态,采用生物光学显微镜对其形态变化进行观察。由图3可知,对照组的L. theobromae菌丝表面光滑、形态完整。然而,经ε-PL处理之后,L. theobromae菌丝表面变得粗糙、不规则,失去光滑性,有球状凸起;菌丝出现弯折、卷曲等现象,颜色变深。在高倍镜观察下,其菌丝呈中空状态、有分节。进一步比较发现,ε-PL对L. theobromae的致畸作用随着其浓度的升高而增强。因而推测,ε-PL对L. theobromae菌丝形态具有致畸作用,可破坏菌丝形态。袁康等[17]研究报道,紫苏精油可致使灰绿曲霉(Aspergillus glaucus)菌丝体表面失去光滑,产生凹陷、皱缩、扭曲变形,从而达到抑菌作用,这与本文研究结果类似。
2.4 ε-PL对L. theobromae菌丝体电导率和MDA含量的影响
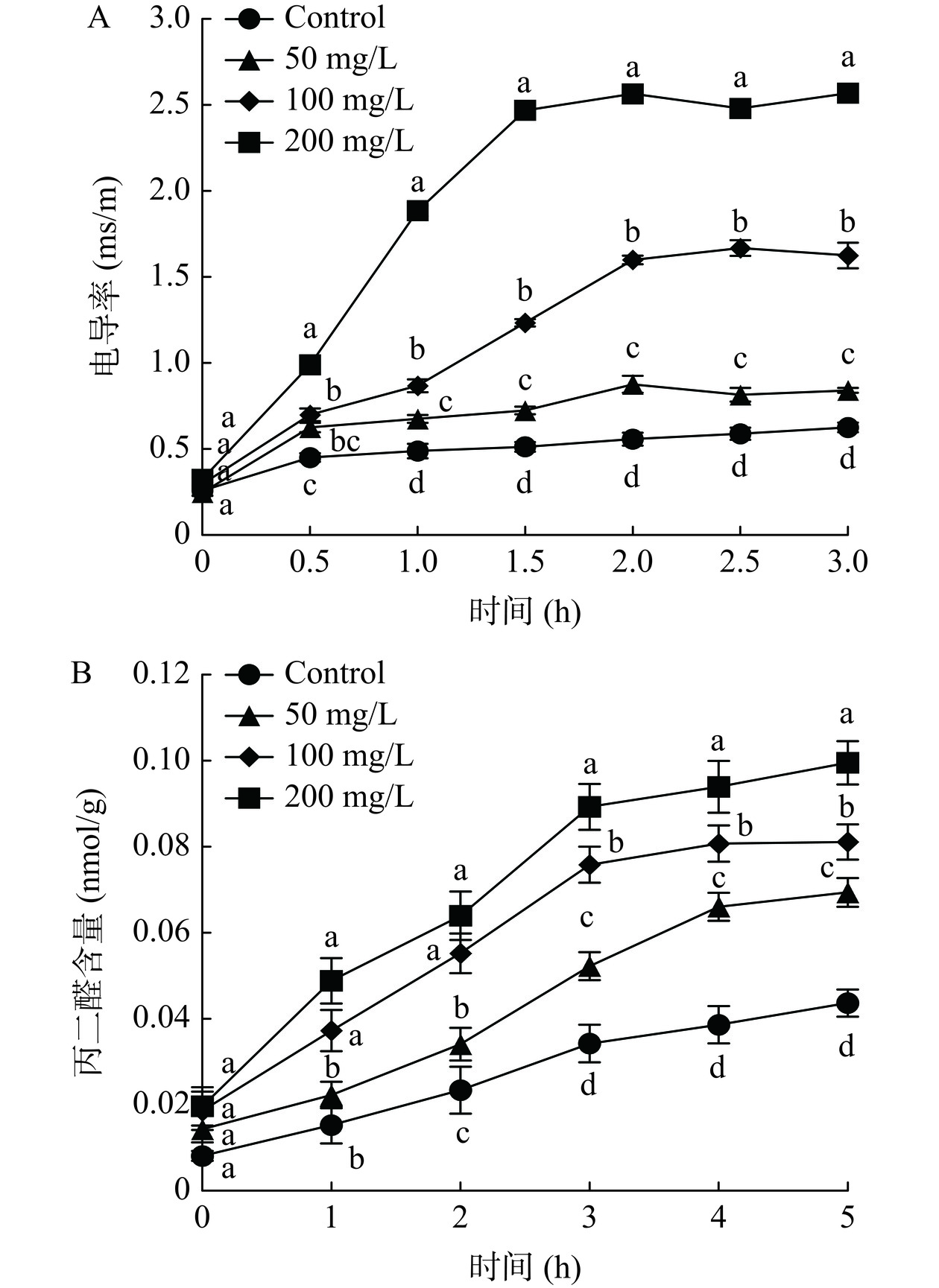
细胞膜电导率水平可间接评价抑菌效果。当细胞膜发生损伤时,导致其电导率升高、细胞内物质泄露,进而抑制病原菌[18]。从图4A可知,对照组的L. theobromae菌丝体电导率随着处理时间的推移而缓慢升高;然而,ε-PL能显著(P<0.05)提高其菌丝体电导率,且随浓度升高而升高。和对照组比较,50 mg/L ε-PL处理虽能提高L. theobromae菌丝体电导率,但提高程度明显低于100和200 mg/L ε-PL处理组。在处理3 h时,50、100、200 mg/L ε-PL处理组分别是对照组的1.35、2.60、4.11倍。
MDA是细胞膜脂质过氧化的产物,能损伤细胞膜结构;其含量越高,说明细胞膜的损伤越严重[26]。由图4B发现,在处理时间0~5 h,L. theobromae菌丝体MDA含量呈现升高变化。和对照组比较,ε-PL处理组保持显著(P<0.05)较高水平。同时,随着ε-PL浓度的提高,L. theobromae菌丝体MDA含量亦快速累积。在处理时间5 h时,50、100、200 mg/L ε-PL处理组分别是对照组的1.59、1.86、2.28倍。
因此,ε-PL可促进L. theobromae菌丝体细胞膜脂质过氧化而累积MDA,进而损伤细胞膜结构。本研究结果与李瑞一等[23]研究结果类似,即紫苏醛提高桔青霉(Penicillium citrinum)的MDA累积,破坏细胞膜结构及提高通透性,进而达到抑菌效果。
2.5 ε-PL对L. theobromae菌丝体细胞膜PI染色的影响
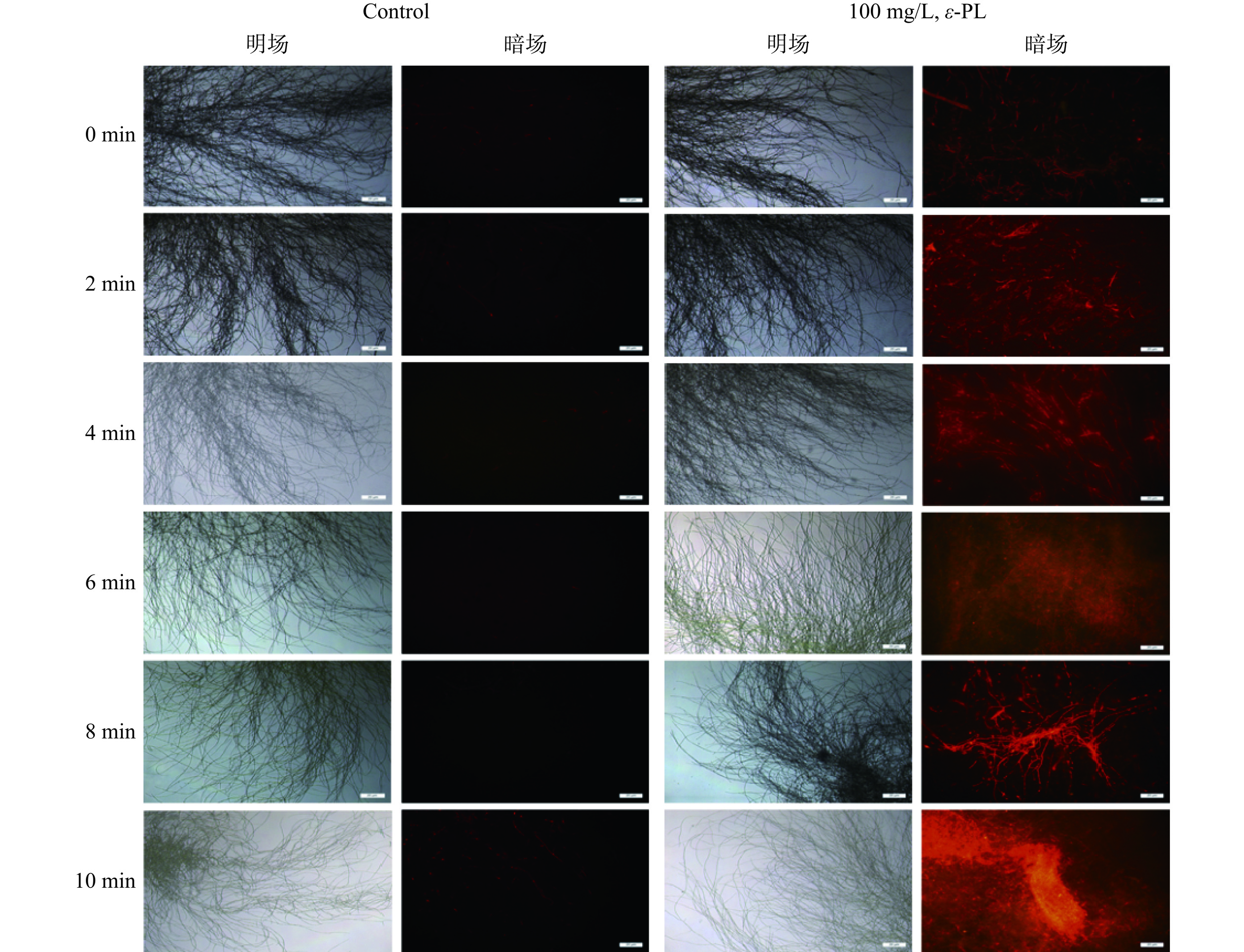
PI染液可穿透已破损的细胞膜,对细胞内的细胞核进行染色,通过判别荧光强度来说明细胞膜的损伤水平[12]。荧光强度越高则细胞膜完整性越低[9]。从图5可知,对照组的L. theobromae菌丝体只有个别细胞膜能观察到微弱的红色荧光。然而,100 mg/L ε-PL处理的L. theobromae菌丝体细胞膜中所观察到的红色荧光明显增多,其荧光强度随着处理时间的延长而显著增强。因此,ε-PL能有效破坏L. theobromae菌丝体的细胞膜结构,进而致使其死亡。类似地,Fan等[27]研究表明,在PI染色试验中,抗菌肽Epinecidin-1能明显增强B. Cinerea细胞膜中的红色荧光,因而该抗菌肽对B. Cinerea细胞膜具有损伤作用。此外,Yu等[20]研究结果也与本文类似。
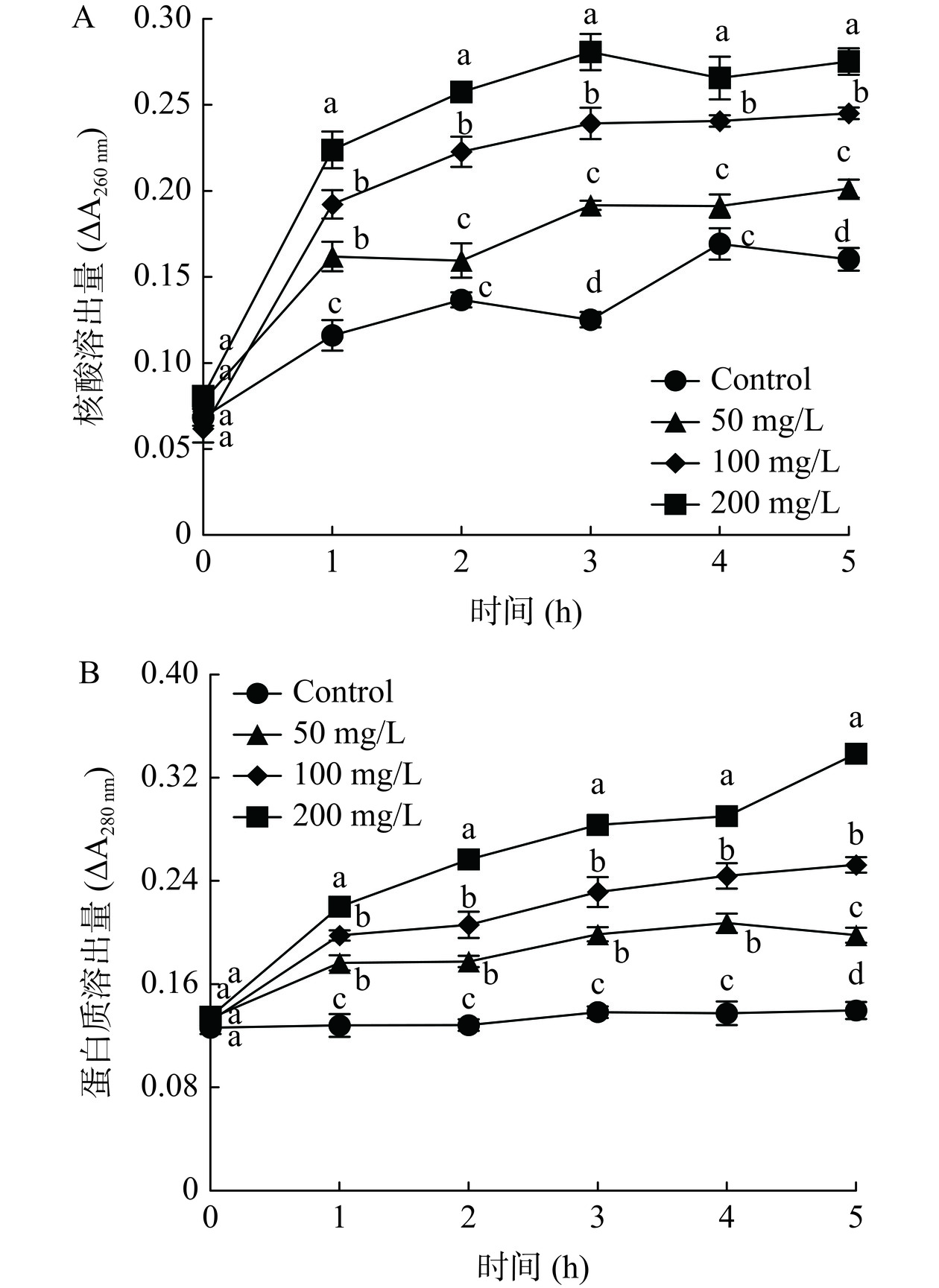
2.6 ε-PL对L. theobromae菌丝体细胞内物质渗漏的影响
细胞内容物的溶出量是细胞膜结构损伤的评价指标[23]。核酸能编码合成蛋白质,对于细胞正常生命活动具有关键作用,若细胞中的核酸丢失,则引起细胞死亡[28]。由图6A发现,L. theobromae菌丝体核酸溶出量随着处理时间的延长而增加,而ε-PL可快速提高核酸溶出速度,导致细胞内遗传物质的大量渗漏,且和浓度成正相关。特别在处理时间5 h时,50、100、200 mg/L ε-PL处理组分别是对照组的1.26、1.53、1.72倍。
由图6B发现,对照组的L. theobromae菌丝体蛋白质溶出量在处理时间0~5 h内整体变化不大,而ε-PL能显著(P<0.05)促进蛋白质溶出,且和浓度呈现正相关。例如,在处理时间5 h时,50、100、200 mg/L ε-PL处理组分别是对照组的1.41、1.80、2.42倍。
因此,ε-PL能促进L. theobromae菌丝体核酸与蛋白质等细胞内物质的渗漏,进而表明ε-PL对其菌丝体细胞膜具有损伤作用。类似地,Dou等[29]研究发现,ε-PL能损伤扩展青霉(Penicillium expansum)细胞膜结构,致使核酸、蛋白质泄露。另外,Shu等[30]研究发现,ε-PL可破坏A. alternata细胞膜,促进蛋白质和核酸等细胞内物质溶出。
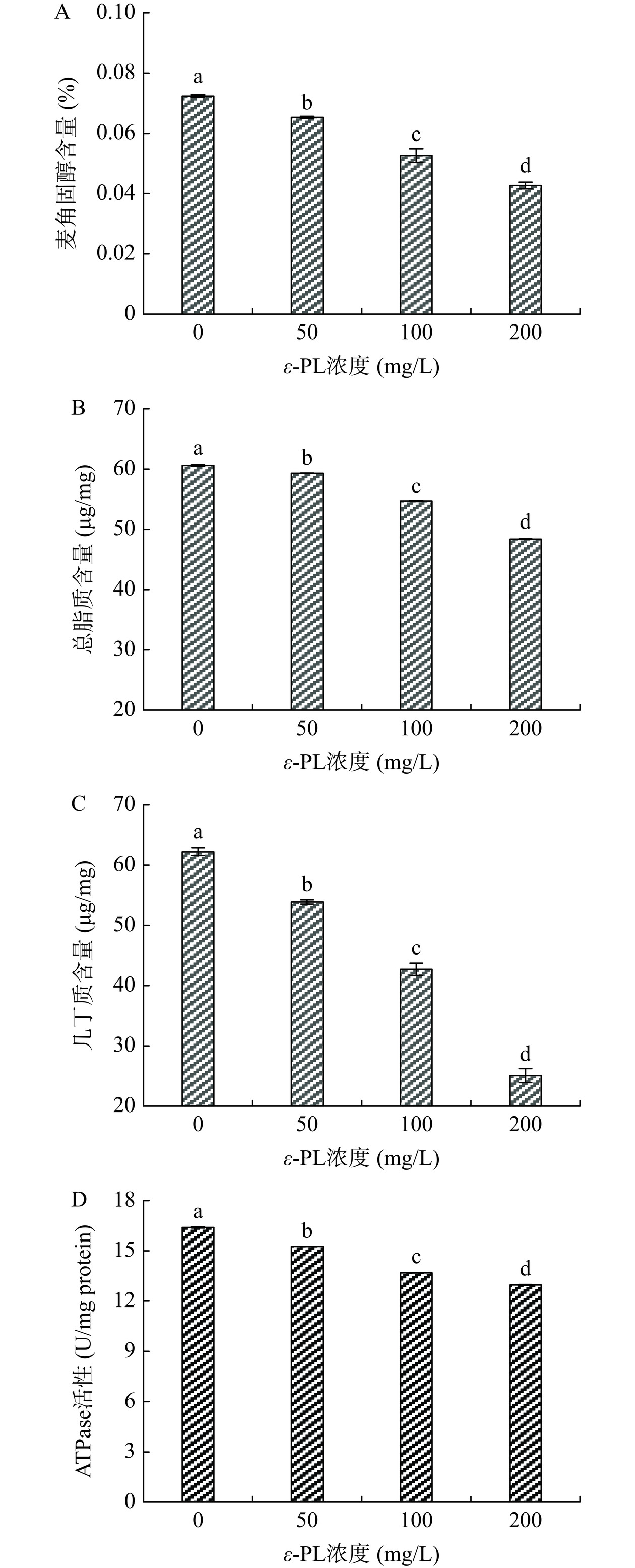
2.7 ε-PL对L. theobromae菌丝体细胞组分含量和线粒体ATPase活性的影响
作为细胞膜的构成成分之一,麦角固醇对细胞膜流动性具有重要的调节作用[17,23]。总脂质水平和细胞膜完整性密切相关。此外,这两种物质水平的降低可反映细胞膜的不可逆损伤[31]。L. theobromae菌丝体麦角固醇(图7A)和总脂质(图7B)含量随着ε-PL浓度的升高而显著(P<0.05)降低。另外,50、100、200 mg/L ε-PL处理组的麦角固醇含量分别是对照组的90.32%、72.75%、58.92%,而其总脂质含量分别是对照组的98.88%、90.21%、79.83%。
作为真菌细胞壁的组成成分,几丁质含量可评价细胞壁的完整水平。由图7C可知,ε-PL能显著(P<0.05)降低L. theobromae菌丝体几丁质含量,而ε-PL浓度越高,其降低效果越显著。另外,50、100、200 mg/L ε-PL处理组分别是对照组的86.56%、68.62%、40.31%。
线粒体ATPase活性下降会诱导细胞能量生成不足,扰乱正常的能量代谢,进而致使细胞死亡[17,23]。从图7D可知,ε-PL能显著(P<0.05)降低L. theobromae菌丝体的线粒体ATPase活性,进而扰乱正常的能量代谢活动。较高浓度ε-PL处理组具有较低的线粒体ATPase活性。另外,50、100、200 mg/L ε-PL处理组分别比对照组低6.91%、16.52%、20.93%。
综上,ε-PL通过降低L. theobromae菌丝体麦角固醇、总脂质含量而损伤细胞膜,及降低几丁质含量而破坏细胞壁,进而损伤菌丝体细胞结构;还减小菌丝体的线粒体ATPase活性而扰乱能量代谢、诱导细胞死亡,最终抑制L. theobromae生长。李瑞一等[23]研究发现,紫苏醛能降低P. Citrinum菌丝体的麦角固醇、总脂质、几丁质含量、ATPase活性,进而破坏菌丝体细胞结构,本文研究结果与之一致。另外,袁康等[17]研究报道,紫苏精油能损伤A. glaucus细胞完整性,是由于降低A. glaucus的麦角固醇含量与ATPase活性,本文研究结果与之类似。
2.8 ε-PL对L. theobromae菌丝体傅里叶变换红外光谱的影响
利用傅里叶变换红外光谱测定L. theobromae菌丝体在ε-PL的作用下其内部官能团的变化,进而阐明其结构的改变。从图8可知,不同组的L. theobromae菌丝体的特征峰所出现位置大致相同,但是峰强度存在差异。在波数3300 cm−1附近有羟基(-OH)的伸缩振动,在波数2924 cm−1峰值附近有甲基(-CH3)和亚甲基(-CH2)的伸缩振动,波数1635 cm−1峰值附近有芳香族骨架振动,波数1040 cm−1峰值附近有碳氧键(-C-O)的伸缩振动,并且上述峰强度随着ε-PL浓度的提高而下降,推测L. theobromae菌丝体中羟基、亚甲基、甲基、碳氧键等数量降低,蛋白质、脂质、碳水化合物等物质含量减少。因此,ε-PL可使L. theobromae菌丝体内部化合物的结构性质及其含量发生改变,从而达到抑菌效果。袁康等[17]研究报道,紫苏精油通过影响A. glaucus菌丝体的碳水化合物、蛋白质、脂质等化合物水平,进而起到抑菌效果,本文研究结果与之类似。
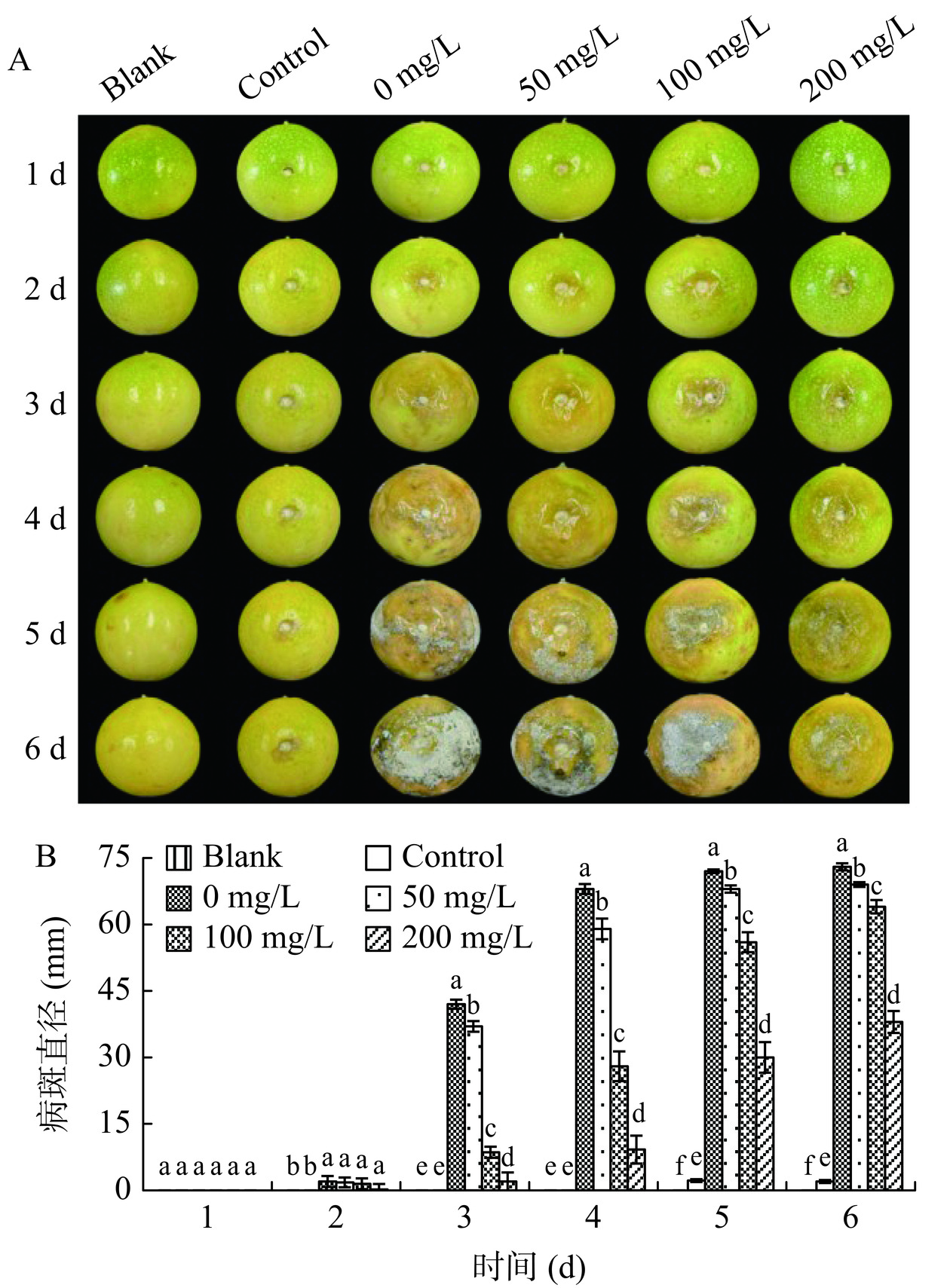
2.9 ε-PL对L. theobromae接种西番莲果腐病发生的影响
由图9可知,空白组的西番莲在整个贮藏时间内均未出现果腐病,而对照组从贮藏5 d开始才出现轻微的果腐病症状。和对照组对比,0 mg/L ε-PL处理组的果腐病从贮藏3 d开始急剧发生,病斑直径加速增大,在贮藏6 d,其病斑直径为73.00±0.80 mm。然而,与0 mg/L ε-PL处理组相比,50、100、200 mg/L ε-PL处理能有效抑制西番莲发生果腐病,同时维持较低的病斑直径,且抑制作用随着ε-PL浓度的升高而增强。在贮藏6 d,50、100、200 mg/L ε-PL处理组的病斑直径分别是0 mg/mL ε-PL处理组的94.52%、87.67%、52.05%。
因此,ε-PL处理可抑制西番莲果腐病的发生。Li等[10]研究发现,ε-PL能控制B. Cinerea接种冬枣果实病斑直径的扩展,进而减缓灰霉病的发生。Wu等[31]研究发现,ε-PL可以明显抑制C. gloeosporioide接种芒果、番茄、苹果等果实病斑直径的增加。本文与这些研究结果类似。
3. 结论
本研究结果表明,ε-PL对L. theobromae具有显著的抑菌作用,可损伤菌丝形态,使其弯折、扭曲;降低菌丝体细胞膜与细胞壁组分含量,破坏细胞结构,促进遗传物质与蛋白质等细胞内物质溶出;降低菌丝体ATPase活性,扰乱能量代谢,致使细胞死亡。另外,傅里叶变换红外光谱显示,ε-PL可减少菌丝体的蛋白质、脂质、碳水化合物等含量,进而达到抑菌作用。ε-PL能够抑制西番莲果腐病菌L. theobromae的生长,是一种安全、有效的抑菌技术,可用于西番莲果实采后果腐病的防治。然而,从分子层面解析ε-PL对L. theobromae的抑菌机理还需深入研究。
-
-
[1] 陈果, 林育钊, 郭欣, 等. 西番莲采后品质劣变及贮藏保鲜技术研究进展[J]. 亚热带植物科学,2020,49(4):323−328. [CHEN G, LIN Y Z, GUO X, et al. Research advances in quality deterioration and storage technologies of harvested passion fruit[J]. Subtropical Plant Science,2020,49(4):323−328.] doi: 10.3969/j.issn.1009-7791.2020.04.014 CHEN G, LIN Y Z, GUO X, et al. Research advances in quality deterioration and storage technologies of harvested passion fruit[J]. Subtropical Plant Science, 2020, 49(4): 323−328. doi: 10.3969/j.issn.1009-7791.2020.04.014
[2] 林育钊, 陈蕾伊, 陈佳怡, 等. ε-聚赖氨酸对西番莲果实采后病害与抗病物质代谢的影响[J]. 食品科学,2024,45(3):142−149. [LIN Y Z, CHEN L Y, CHEN J Y, et al. Effect of ε-poly-L-lysine on postharvest diseases and disease-resistant substance metabolism in passion fruits[J]. Food Science,2024,45(3):142−149.] doi: 10.7506/spkx1002-6630-20230406-043 LIN Y Z, CHEN L Y, CHEN J Y, et al. Effect of ε-poly-L-lysine on postharvest diseases and disease-resistant substance metabolism in passion fruits[J]. Food Science, 2024, 45(3): 142−149. doi: 10.7506/spkx1002-6630-20230406-043
[3] 陈洪彬, 邹文杰, 郑金水, 等. 采后‘黄金’和‘紫香’西番莲果实的耐贮性比较[J]. 中国南方果树, 2021, 50(6):69−73. [CHEN H B, ZOU W J, ZHENG J S, et al. Comparison between of postharvest ‘Huangjin’ and ‘Zixiang’ passion fruits in the storability[J]. South China Fruits,2021,50 (6):69−73.] CHEN H B, ZOU W J, ZHENG J S, et al. Comparison between of postharvest ‘Huangjin’ and ‘Zixiang’ passion fruits in the storability[J]. South China Fruits, 2021, 50 (6): 69−73.
[4] 郭欣, 林育钊, 曾玲珍, 等. 不同浓度壳聚糖处理对采后西番莲果实耐贮性和贮藏品质的影响[J]. 热带作物学报,2020,41(8):1665−1673. [GUO X, LIN Y Z, ZENG L Z, et al. Effects of different concentrations of chitosan treatment on storability and storage quality of passion fruit postharvest[J]. Chinese Journal of Tropical Crops,2020,41(8):1665−1673.] doi: 10.3969/j.issn.1000-2561.2020.08.022 GUO X, LIN Y Z, ZENG L Z, et al. Effects of different concentrations of chitosan treatment on storability and storage quality of passion fruit postharvest[J]. Chinese Journal of Tropical Crops, 2020, 41(8): 1665−1673. doi: 10.3969/j.issn.1000-2561.2020.08.022
[5] 郭欣, 林育钊, 邓礼艳, 等. 壳聚糖处理对采后西番莲果实贮藏期间果皮活性氧代谢的影响[J]. 热带作物学报,2020,41(12):2526−2533. [GUO X, LIN Y Z, DENG L Y, et al. Effects of chitosan treatment on reactive oxygen species metabolism in pericarp of harvested passion fruit during storage[J]. Chinese Journal of Tropical Crops,2020,41(12):2526−2533.] doi: 10.3969/j.issn.1000-2561.2020.12.022 GUO X, LIN Y Z, DENG L Y, et al. Effects of chitosan treatment on reactive oxygen species metabolism in pericarp of harvested passion fruit during storage[J]. Chinese Journal of Tropical Crops, 2020, 41(12): 2526−2533. doi: 10.3969/j.issn.1000-2561.2020.12.022
[6] 郭欣, 林育钊, 林河通, 等. 壳聚糖处理对西番莲果实感病指数、抗病相关酶活性和抗病物质含量的影响[J]. 食品科学,2021,42(15):206−212. [GUO X, LIN Y Z, LIN H T, et al. Effect of chitosan treatment on disease index, disease resistant-related enzyme activities and disease resistance-related substance contents in Passiflora caerulea L. fruit during storage[J]. Food Science,2021,42(15):206−212.] doi: 10.7506/spkx1002-6630-20200723-315 GUO X, LIN Y Z, LIN H T, et al. Effect of chitosan treatment on disease index, disease resistant-related enzyme activities and disease resistance-related substance contents in Passiflora caerulea L. fruit during storage[J]. Food Science, 2021, 42(15): 206−212. doi: 10.7506/spkx1002-6630-20200723-315
[7] 林育钊, 陈月莉, 蒋璇靓, 等. 福建黄果西番莲果腐病菌分离鉴定及其生物学特性[J]. 中国南方果树,2024,53(1):24−29. [LIN Y Z, CHEN Y L, JIANG X J, et al. Isolation, identification and biological characteristics of fruit rot pathogen from yellow passion fruit in Fujian Province[J]. South China Fruits,2024,53(1):24−29.] LIN Y Z, CHEN Y L, JIANG X J, et al. Isolation, identification and biological characteristics of fruit rot pathogen from yellow passion fruit in Fujian Province[J]. South China Fruits, 2024, 53(1): 24−29.
[8] WANG H L, CHEN H B, LIN Y, et al. Insights into the isolation, identification, and biological characterization analysis of and novel control strategies for Diaporthe passiflorae in postharvest passion fruit[J]. Journal of Fungi,2023,9(10):1034. doi: 10.3390/jof9101034
[9] LIU K W, ZHOU W X, FU M R. Inhibiting effects of epsilon-poly-lysine (ε-PL) on Pencillium digitatum and its involved mechanism[J]. Postharvest Biology and Technology,2017,123:94−101. doi: 10.1016/j.postharvbio.2016.08.015
[10] LI H, HE C, LI G J, et al. The modes of action of epsilon-polylysine (ε-PL) against Botrytis cinerea in jujube fruit[J]. Postharvest Biology and Technology,2019,147:1−9. doi: 10.1016/j.postharvbio.2018.08.009
[11] JIAO W X, LIU X, CHEN Q M, Epsilon-poly-L-lysine (ε-PL) exhibits antifungal activity in vivo and in vitro against Botrytis cinerea and mechanism involved[J]. Postharvest Biology and Technology, 2020, 168:111270.
[12] 刘志恬, 董玉鹏, 李永才, 等. ε-聚赖氨酸对梨果实黑斑病菌Alternaria alternata的抑制作用及其机理[J]. 食品科学,2021,42(11):213−220. [LIU Z T, DONG Y P, LI Y C, et al. Antifungal effect of ε-polylysine on Alternaria alternata isolated from pears with black spot and its possible mechanism[J]. Food Science,2021,42(11):213−220.] doi: 10.7506/spkx1002-6630-20200523-275 LIU Z T, DONG Y P, LI Y C, et al. Antifungal effect of ε-polylysine on Alternaria alternata isolated from pears with black spot and its possible mechanism[J]. Food Science, 2021, 42(11): 213−220. doi: 10.7506/spkx1002-6630-20200523-275
[13] SUN J Z, CHEN H B, CHEN Y H, et al. ε-Poly-L-lysine enhances fruit disease resistance in postharvest longans (Dimocarpus longan Lour.) by modulating energy status and ATPase activity[J]. Foods,2022,11(5):773. doi: 10.3390/foods11050773
[14] WEI M L, GE Y H, LI C Y, et al. Antifungal activity of ε-poly-L-lysine on Trichothecium roseum in vitro and its mechanisms[J]. Physiological and Molecular Plant Pathology,2018,103:23−27. doi: 10.1016/j.pmpp.2018.04.005
[15] PHYO H M, JU J, AL-MAQTARI Q A, et al. Evaluation of the synergistic antifungal effects of thymol and cinnamaldehyde combination and its mechanism of action against Rhizopus stolonifer in vitro and in vivo[J]. Biocatalysis and Agricultural Biotechnology,2023,49:102658. doi: 10.1016/j.bcab.2023.102658
[16] PÉREZ-ALFONSO O C, MARTÍNEZ-ROMERO D, ZAPATA P J, et al. The effects of essential oils carvacrol and thymol on growth of Penicillium digitatum and P. italicum involved in lemon decay[J]. International Journal of Food Microbiology,2012,158(2):101−106. doi: 10.1016/j.ijfoodmicro.2012.07.002
[17] 袁康, 胡振阳, 陈可欣, 等. 紫苏精油抑制灰绿曲霉的活性与机理[J]. 食品科学,2020,41(23):63−69. [YUAN K, HU Z Y, CHEN K X, et al. Activity and mechanism of Perilla essential oil in inhibiting Aspergillus glaucus[J]. Food Science,2020,41(23):63−69.] doi: 10.7506/spkx1002-6630-20191103-022 YUAN K, HU Z Y, CHEN K X, et al. Activity and mechanism of Perilla essential oil in inhibiting Aspergillus glaucus[J]. Food Science, 2020, 41(23): 63−69. doi: 10.7506/spkx1002-6630-20191103-022
[18] 王小佳, 于有伟, 张少颖, 等. ε-聚赖氨酸对樱桃采后病原菌橘青霉和链格孢菌的抑菌作用研究[J]. 食品安全质量检测学报,2022,13(4):1301−1309. [WANG X J, YU Y W, ZHANG S Y. Inhibitory effects of ε-polylysine on Penicillium citrinum and Alternaria alternata inoculated on fresh cherry[J]. Journal of Food Safety and Quality,2022,13(4):1301−1309.] doi: 10.3969/j.issn.2095-0381.2022.4.spaqzljcjs202204037 WANG X J, YU Y W, ZHANG S Y. Inhibitory effects of ε-polylysine on Penicillium citrinum and Alternaria alternata inoculated on fresh cherry[J]. Journal of Food Safety and Quality, 2022, 13(4): 1301−1309. doi: 10.3969/j.issn.2095-0381.2022.4.spaqzljcjs202204037
[19] WANG W J, DENG L L, YAO S X, et al. Control of green and blue mold and sour rot in citrus fruits by the cationic antimicrobial peptide PAF56[J]. Postharvest Biology and Technology,2018,136:132−138. doi: 10.1016/j.postharvbio.2017.10.015
[20] YU L, ZHOU Y X, CHEN Y C, et al. Antifungal activity and mechanism of Litsea cubeba (Lour.) Persoon essential oil against the waxberry spoilage fungi Penicillium oxalicum and its potential application[J]. International Journal of Food Microbiology,2023,411:110512.
[21] 王玢, 徐世友, 杨俊杰, 等. 汉逊酵母活性及活力荧光素二乙酸酯-碘化丙啶双荧光染色检测方法的建立及应用[J]. 中国生物制品学杂志,2023,36(11):1347−1352. [WANG B, XU S Y, YANG J J, et al. Development and application of a method for determination of activity and vitality of Hansenula polymorpha by carboxyfluorescein diacetate-propidium iodide dua fluorescent staining[J]. Chinese Journal of Biologicals,2023,36(11):1347−1352.] WANG B, XU S Y, YANG J J, et al. Development and application of a method for determination of activity and vitality of Hansenula polymorpha by carboxyfluorescein diacetate-propidium iodide dua fluorescent staining[J]. Chinese Journal of Biologicals, 2023, 36(11): 1347−1352.
[22] YUE Y S, WANG Z R, ZHONG T, et al. Antifungal mechanisms of volatile organic compounds produced by Pseudomonas fluorescens ZX as biological fumigants against Botrytis cinereal[J]. Microbiological Research,2023,267:127253. doi: 10.1016/j.micres.2022.127253
[23] 李瑞一, 吴伟杰, 房祥军, 等. 紫苏醛对杨梅主要致病菌桔青霉的抑菌活性及作用机制[J]. 食品科学,2023,44(15):196−203. [LI R Y, WU W J, FANG X J, et al. Antifungal activity and mechanism of perillaldehyde against Penicillium citrinum, a major fungal pathogen of Myrica rubra[J]. Food Science,2023,44(15):196−203.] doi: 10.7506/spkx1002-6630-20221202-016 LI R Y, WU W J, FANG X J, et al. Antifungal activity and mechanism of perillaldehyde against Penicillium citrinum, a major fungal pathogen of Myrica rubra[J]. Food Science, 2023, 44(15): 196−203. doi: 10.7506/spkx1002-6630-20221202-016
[24] GONG D, BI Y, ZHANG X M, et al. Benzothiadiazole treatment inhibits membrane lipid metabolism and straight-chain volatile compound release in Penicillium expansum-inoculated apple fruit[J]. Postharvest Biology and Technology,2021,181:111671. doi: 10.1016/j.postharvbio.2021.111671
[25] SUN G Z, YANG Q C, ZHANG A C, et al. Synergistic effect of the combined bio-fungicides ε-poly-L-lysine and chitooligosaccharide in controlling grey mould (Botrytis cinerea) in tomatoes[J]. International Journal of Food Microbiology,2018,276:46−53. doi: 10.1016/j.ijfoodmicro.2018.04.006
[26] LIN Y Z, LIN H T, ZENG L Z, et al. DNP and ATP regulate the breakdown occurrence in the pulp of Phomopsis longanae Chi-infected longan fruit through modulating the metabolism of membrane lipid[J]. Food Chemistry,2023,409:135330. doi: 10.1016/j.foodchem.2022.135330
[27] FAN L, WEI Y Y, CHEN Y, et al. Epinecidin-1, a marine antifungal peptide, inhibits Botrytis cinerea and delays gray mold in postharvest peaches[J]. Food Chemistry,2023,403:134419. doi: 10.1016/j.foodchem.2022.134419
[28] 黄伟英, 刘晓婷, 关玉凤, 等. 壳聚糖和ε-聚赖氨酸对肉食杆菌抑菌机制初步研究[J]. 食品工业科技,2024,45(5):144−152. [HUANG W Y, LIU X T, GUAN Y F, et al. Preliminary study on the mechanism of chitosan and ε-polylysine inhibition against Carbibacterium divergens[J]. Science and Technology of Food Industry,2024,45(5):144−152.] HUANG W Y, LIU X T, GUAN Y F, et al. Preliminary study on the mechanism of chitosan and ε-polylysine inhibition against Carbibacterium divergens[J]. Science and Technology of Food Industry, 2024, 45(5): 144−152.
[29] DOU Y, ROUTLEDGE M N, GONG Y Y, et al. Efficacy of epsilon-poly-L-lysine inhibition of postharvest blue mold in apples and potential mechanisms[J]. Postharvest Biology and Technology,2021,171:111346. doi: 10.1016/j.postharvbio.2020.111346
[30] SHU C, CUI K B, LI Q Q, et al. Epsilon-poly-L-lysine (ε-PL) exhibits multifaceted antifungal mechanisms of action that control postharvest Alternaria rot[J]. International Journal of Food Microbiology,2021,348:109224. doi: 10.1016/j.ijfoodmicro.2021.109224
[31] WU J J, HU J J, JIAO W X, et al. Inhibitory effect of ε-poly-L-lysine on fruit Colletotrichum gloeosporioides through regulating organic acid metabolism and exerting membrane-targeted antifungal activity[J]. Postharvest Biology and Technology,2023,200:112339. doi: 10.1016/j.postharvbio.2023.112339





 下载:
下载:


 下载:
下载:
