Research Progress and Functional Applications of Food Protein Fibrils
-
摘要: 近年来,蛋白质纤维化因其赋予食品良好的功能特性和良好的稳定性而受到广泛关注。蛋白纤维在适当的外界条件下可以自组装形成,是一种具有广泛应用前景的食品原料。为了更全面地认识食品蛋白纤维,本文针对食品蛋白纤维的自组装、结构特征、来源以及功能特性等方面的研究进展进行了综述。重点介绍了蛋白质纤维的纤维化条件、自组装形成机理、蛋白纤维的功能特性(包括理化特性和生物活性)及其在食品领域的应用。最后,本文在现有研究基础上,创新性地提出了蛋白纤维的未来研究方向,旨在为其在食品工业的高质量应用提供参考。Abstract: Recently, protein fibrillization has attracted widespread attention due to its ability to endow food with good functional properties and better stability. Protein fibrils, a kind of food raw material with wide application prospect, can be self-assembled under proper external conditions. To comprehensively understand food protein fibers, this paper provides a review of research progress in the self-assembly, structural characteristics, sources, and functional properties of food protein fibers. The fibrillation conditions of protein fibers, the mechanism of self-assembly, the functional properties (including physicochemical properties and biological activity), and applications in the food industry are emphasized. Finally, building upon existing research, this review innovatively provides new insight into the research trends of protein fibrils, aiming to provide reference for their high-quality application in the food industry.
-
蛋白质是维持人体正常生命活动的重要营养素,是人体结构的基本物质之一。食源性蛋白质在适当的加工条件下能够通过自组装形成蛋白纤维,不仅可以作为食品配料(如起泡剂、凝胶剂、增稠剂和乳化剂)应用于食品加工,还可以赋予食品抗氧化和抗菌活性等功能特性,改善食品风味[1−3]。
蛋白纤维,又称淀粉样纤维,直径在纳米与微米之间[4],是一种高度有序的大分子结构[5]。食源性蛋白质自组装形成的蛋白纤维具有高纵横比、分子取向明确和机械强度高等特点,可以显著提高体系的粘度,有助于形成凝胶网络[6]。此外,食品蛋白纤维含有大量的β片层结构与“拉链式”结构使其具有较高的结构稳定性[7]。相比于天然蛋白质,食品蛋白纤维结构更加稳定且在部分功能特性上也有所改善,如抗氧化、抗菌活性、乳化性和发泡性等[8]。食源性蛋白质改性是蛋白纤维提升食品感官、改善蛋白功能性的有效途径。因此,掌握食品蛋白纤维的制备方法、形成机理和其功能特性是十分必要的。
本文综述了不同来源的食源性蛋白质形成蛋白纤维的制备条件,并对其形成机理与结构特征、理化特性和生物活性以及在食品领域的应用进行概述。最后,对食品蛋白纤维的未来研究进行了展望,以期为其大规模生产以及在食品工业中的应用提供参考。
1. 食品蛋白纤维的制备方法及辅助手段
食品蛋白纤维可以在特定条件下形成,加热酸水解法是目前制备食品蛋白纤维的最常用方法。食源性蛋白质在酸热条件下形成蛋白纤维过程中,蛋白质的疏水基团暴露,肽链由于范德华力、氢键、疏水作用力和静电力的作用定向排列,形成更加稳定的微观结构[9]。尽管大多数食源性蛋白质可在酸热条件下形成蛋白纤维,但不同来源的蛋白质的制备条件如表1所示。例如:在酸性条件下(pH2,85 ℃)加热48 h可使蛋清蛋白和大豆蛋白发生纤维化[10−11],而扁豆蛋白在pH2的酸性条件下,90 ℃水浴加热2 h即可形成扁豆蛋白纤维[12]。Cao等[13]总结出蛋白纤维的标准制备条件为:pH低于等电点、温度高于蛋白质的变形温度、低离子强度、磁力搅拌数小时(通常为pH2.0、80~90 ℃、不加盐、300 r/min转速下搅拌5~24 h),在该条件下,蛋白质单体水解且肽键裂解速率较快,更容易形成蛋白纤维。因此,食源性蛋白质在高于变性温度、低pH和低离子强度等条件下加热搅拌一定时间即可得到蛋白纤维。
表 1 食品蛋白纤维的形成条件Table 1. Formation conditions of food protein fibrils来源 制备条件 功能特性 参考文献 动物来源 α-乳白蛋白 pH7.4,37 ℃,30 h
pH5.0~6.0,25 ℃,7 d递送载体 [14−16] β-乳球蛋白 pH2.0,80 ℃,48 h
pH≤3,温度≥75 ℃
超声功率250 W,频率20 kHz具有较强泡沫稳定性、抗菌与抗氧化 [17−21] 乳清分离蛋白 pH2.0,80 ℃,48 h
超声功率250 W,频率20 kHz增强包封效率、抗氧化、抗菌性、发泡性、
增稠性、凝胶性、递送载体[21−26] κ-酪蛋白 pH2.0,37~80 ℃,48 h 药物递送
增稠性[27−29] 卵铁传递蛋白 pH2.0,90 ℃,6 h 乳化性 [30−31] 鸡蛋清溶菌酶 pH2.0,60 ℃,72 h,(100 mmol/L AlCl3,100 mmol/L MgCl2,
200 mmol/LNaCl)超声功率100 kHz,频率1 MHz递送载体 [32−33] 铁蛋白 pH2.0,90 ℃,9 h 递送载体 [34−35] 卵清蛋白 pH7.0,80~90 ℃,67.95 mmol/L NaCl
超声预处理15 min,功率400 W,脉冲时间5 s开/3 s关发泡性、稳定性 [36−37] 血红蛋白 pH2.8,80 ℃,125 mmol/L NaCl,24 h 稳定性 [38] 牛血清蛋白 pH7.4,60~75 ℃,24 h
超声预处理0~20 min,功率200 W,频率40 kHz乳化性、发泡性 [39] αS2-酪蛋白 pH6.5~6.7,50 ℃, 7 d [40] 植物来源 豌豆分离蛋白 pH2.0,85 ℃,20 h
超声预处理30 min,功率300 W,脉冲时间5 s开/5 s关凝胶性 [24,41−43] 大豆分离蛋白 pH2.0,85 ℃,8~10 h
pH2.0,85 ℃,12 h
超声预处理8 h,功率750 W,脉冲时间5 s开/5 s关,频率 20 kHz乳化性
发泡性、增稠性[44−49] 红豆蛋白 pH2.0,85 ℃,12 h 凝胶性 [50−51] 豇豆分离蛋白 pH2.0,90 ℃,24 h 流变性能 [52−53] 扁豆蛋白 pH2.0,90 ℃,2 h 乳化性、增稠性 [12,54] 玉米醇溶蛋白 50%~90% v/v 乙醇-水,60 ℃,pH4~10 凝胶性 [55−56] 大米谷蛋白 pH2.0,90 ℃,4 h 凝胶性 [57−58] 已有较多研究证明超声波预处理作为一种辅助结合加热酸水解法能够高效制备蛋白纤维[8,43,59]。目前制备食品蛋白纤维的超声频率一般在20 kHz,功率为800 W以内[60−62]。超声波能够加速蛋白纤维形成的主要原因是由于超声预处理过程中会产生空化、剪切和湍流[63],促进蛋白质高级结构的展开,加快蛋白纤维的形成速率[59]。此外,超声处理可明显改善蛋白纤维的功能特性,如提高稳定性、乳化性和溶解度等。例如,Hu等[63]探究了超声预处理对大豆分离蛋白(SPI)纳米纤维的结构、功能特性的影响,结果表明,经超声预处理的SPI纳米纤维能更好的包裹油滴,提高其乳化性与溶解度,加快SPI纳米纤维在油-水和气-水的吸附速率,使其发泡性能得到改善[64−65]。同样地,Yang等[66]将超声技术与空气喷雾纺丝技术相结合,制备出直径与孔隙较均匀的大豆蛋白纤维,且随着超声时间的延长显著提高了大豆蛋白纤维的亲水性和热稳定性等性质。因此,在加热酸水解法的基础上使用超声波处理等辅助手段是高效制备蛋白纤维并改善其功能特性的有效手段。
2. 食品蛋白纤维的自组装形成机理
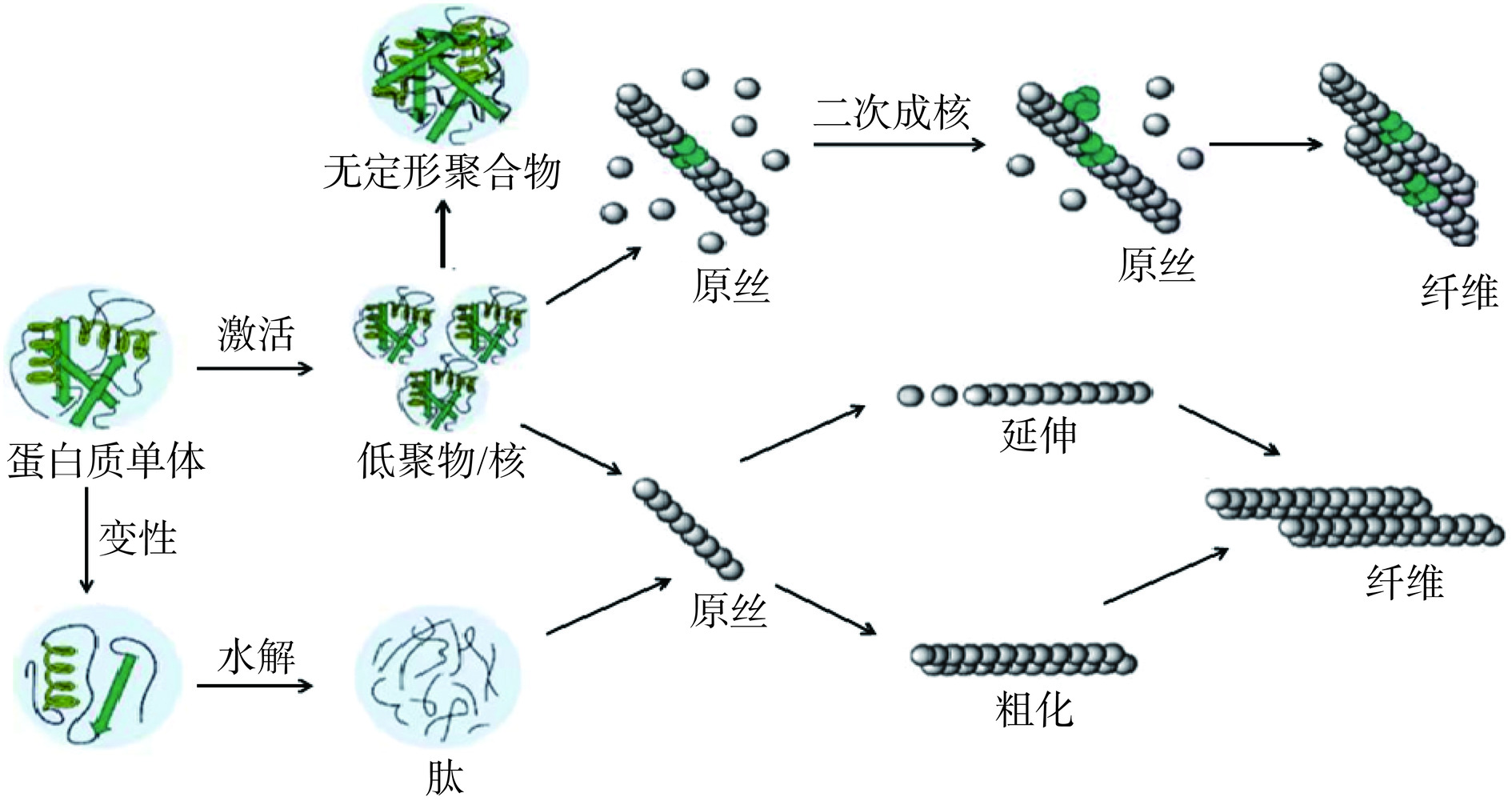
蛋白质的自组装是大分子自发形成高度有序结构,以达到热力学平衡状态的过程,即蛋白质在特定条件下(温度、离子强度、pH或其他因素)疏水基团暴露并由于其疏水性聚集在一起,形成一种可控的分子结构[8,67]。蛋白质的自组装是一种分子间或分子内相互协调的过程,不仅可以在蛋白质与自身结构之间发生,还可以在与其他分子(多糖、酚类化合物等)之间发生[68]。目前许多食源性球状蛋白主要是通过范德华力、静电力、疏水相互作用自组装成蛋白纤维。关于蛋白纤维形成所提出的NCC(成核构象转换)模型已被普遍接受,该模型主要分为三个阶段,分别是滞后阶段、生长阶段和成熟阶段,这三个阶段共同构成蛋白纤维的“S”型生长动力曲线[69]。滞后阶段是一个缓慢自发成核的过程,随后在生长阶段中蛋白质或肽的总转化率达到最大,原丝快速生长并拉伸形成纤维[70],最后在成熟阶段中蛋白纤维达到平衡状态。
而对于蛋白纤维的形成是由蛋白质单体聚集或多肽形成目前还尚有争议,根据早期蛋白纤维生成的研究基础,提出了蛋白纤维的单体模型与多肽模型。单体模型表明,蛋白质单体在变性或激活后可进一步形成蛋白纤维;多肽模型表明,蛋白质应先被水解形成多肽,随后再形成蛋白纤维。Moayedzadeh等[71]将球状蛋白在酸性条件下加热处理,使其自组装成纳米-微米之间长度的纤维结构,得出结论蛋白纤维是由水解所产生的多肽自组装而成,而不是完整的蛋白质单体组成。近期有研究表明,蛋白质单体和肽都是蛋白纤维的主要成分,除上述机制和模型外,二次生核也是蛋白质纤维形成机制之一[72]。如图1所示,将低聚物添加在初级均匀成核表面,当其聚合成一定规模时,它可以形成一种自由能较高的“临界核”,它比蛋白质单体具有更强的相互凝聚力,因此蛋白质单体附着在“核”表面并开始不断延伸,最终形成成熟的蛋白纤维[8]。
3. 食品蛋白纤维的结构特征
食源性蛋白质通过自组装可形成相同的交叉β结构,使其具有较强的稳定性,并赋予了食品蛋白纤维特定的功能特性,但相同的食源性蛋白质所产生的蛋白纤维可以有两个或多个不同的结构,即食品蛋白纤维的多态性。下面重点介绍食品蛋白纤维结构的交叉β结构与结构多态性。
3.1 交叉β结构
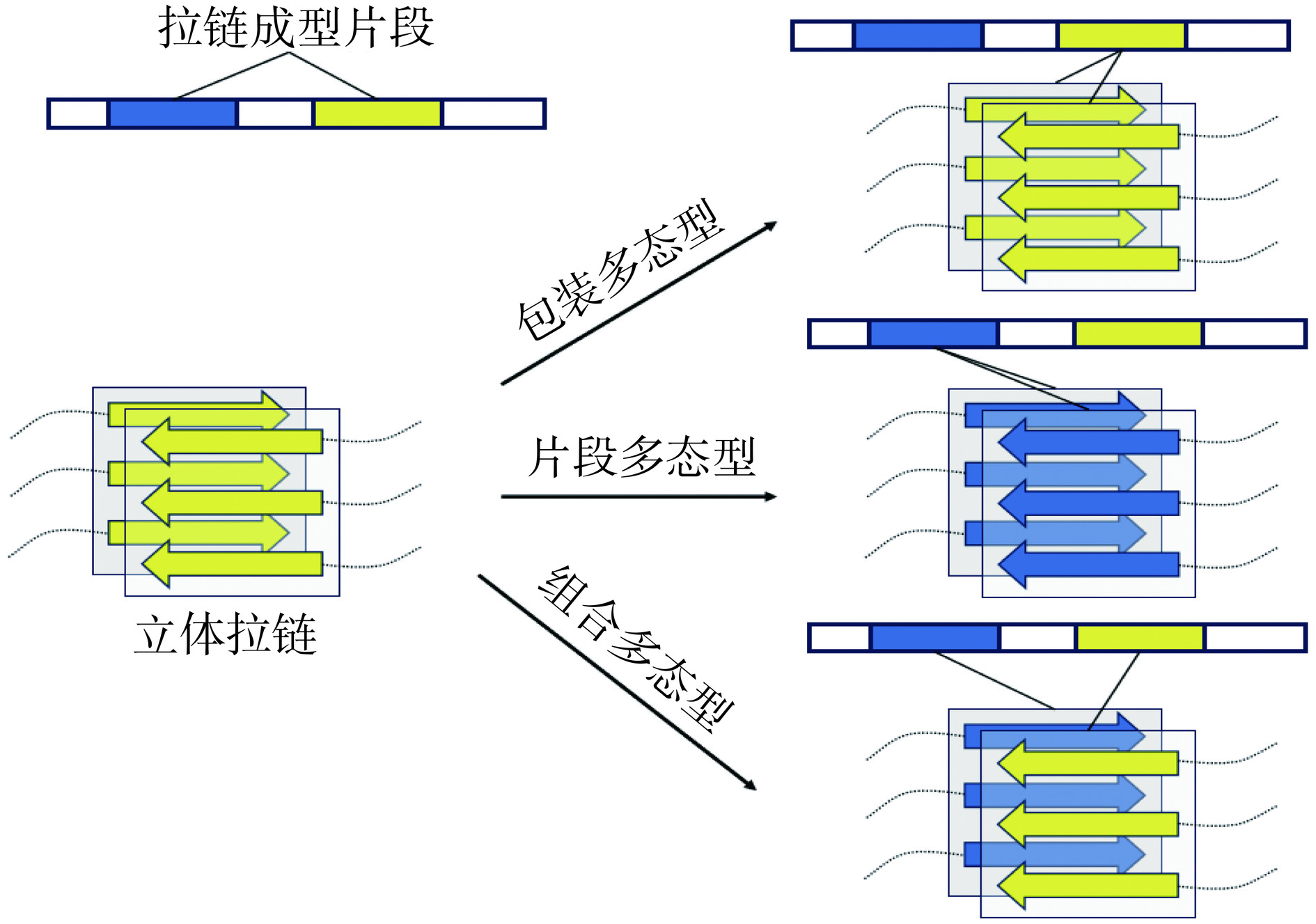
在适当的外部条件下(如温度、pH、离子强度等),食源性蛋白质自组装形成蛋白纤维,尽管蛋白纤维结构存在多态性,但还是具有较为显著的结构相似性,即β-片状结构和交叉β结构。β-片平行于原纤维轴,单个β链间隔约为4.8 Å,这主要是由于两个肽链中亚氨基与羰基之间的氢键所导致;单个β链垂直于纤维轴,β链内部间隔约为6~10 Å。它们通过氨基酸侧链非共价作用相互平行排列,沿着纵向持续延伸形成交叉β结构,并进一步聚合形成蛋白纤维[30]。交叉β结构是一种高度有序的三维结构(立体拉链结构),正因为这种结构赋予了蛋白纤维在化学、机械和生物等方面具有较强的稳定性[74−75]。称其“立体拉链”是因为向下观察纤维轴时,侧链相互交错,类似拉链中的齿。单个β-片易于形成与断裂,但交叉的β-片则可以通过外力的作用来增强自身的稳定性,其中主要包括[13]:a:β-片相互交错中的范德华力[76],即具有交叉β-片结构的蛋白纤维比其他蛋白质复合物的结构更为稳定;b:沿薄片上下排列的氢键酰胺基团的相互极化;c:“拉链式”立体结构的形成,导致β-片内水分子的释放,熵增加,即疏水效应。因此,如果附加力a和c消失,则会导致该蛋白纤维的结构稳定性降低。
3.2 食品蛋白纤维的结构多态性
食品蛋白纤维的多态性是指在相同环境条件下,由同一蛋白质产生的食品蛋白纤维具有不同的结构。目前食品蛋白纤维的多态性分为由原丝组装差异引起的结构多态性与由单个原丝内部差异引起的分子多态性,结构多态性主要是由于不同数量的原丝和原丝排列的变异所引起,分子多态性主要是由组成肽的结构的差异所引起[13]。此外,蛋白纤维通过自组装形成的结构并不是只有唯一的立体拉链模型,具有两个易纤维化片段的蛋白质由于其聚合能力不同,通过片段之间的组合配对可以产生多种形式的结构,如一个片段中可以形成一个同位或异位的拉链,将其进一步分为包装型、片段型、组合型[13]。如图2所示,两个易纤维化的片段(黄色与蓝色片段),若片段相同,则可以填充到不同的立体拉链中,产生包装多态型;若两个片段不同,则可以分别装进一个立体拉链中,产生片段多态型;若一个片段可以同时形成同位与异位拉链,则可以形成组合多态型。因此,一个蛋白纤维中存在多个纤维片段,且纤维片段的结构存在明显差异。例如,Svitlana等[77]通过圆二光谱及红外光谱等分析,观察到苋菜蛋白中存在多种富含β-片结构的蛋白纤维,并且这些结构存在明显差异。因此,蛋白纤维结构中存在不止一个纤维片段,且纤维片段的结构有明显的差异。
4. 食品蛋白纤维的来源
食源性蛋白质无毒,营养丰富,易于消化,农业上可持续,价格低廉。不同食物来源的蛋白质可以通过自组装机制形成高度有序的纤维结构,并且能够应用于食品加工领域。目前制备食品蛋白纤维的主要来源为动物蛋白质与植物蛋白质。表1总结了食品中部分蛋白质来源及其形成蛋白纤维的条件。
4.1 动物蛋白纤维
在关于动物蛋白质自组装形成蛋白纤维的现有研究中,牛乳蛋白是最常用的蛋白质之一。牛乳蛋白可在适当的外部条件下形成蛋白纤维,其中不仅纯蛋白可以形成蛋白纤维,蛋白混合物也可形成蛋白纤维。牛乳蛋白的主要成分是酪蛋白与乳清蛋白。酪蛋白的一级结构中含有大量的脯氨酸,并且二级结构中没有二硫键,因此,酪蛋白是一种易变性蛋白质[78],其中αS2-酪蛋白与κ-酪蛋白有助于纤维结构的形成。乳清蛋白(WPI)约由80%的β-乳球蛋白(β-LG)和15%的α-乳白蛋白(α-La)组成,在酸热条件下可自行组装成乳清蛋分离蛋白纤维(WPNFs)[79]。当乳清蛋白溶液被加热到60 ℃时,肽链具有流动性,使得WPI蛋白之间发生相互作用,导致蛋白质之间形成化学键,进而发生聚集形成纤维化[79]。Hu等[18]发现与纯β-LG形成的蛋白纤维相比,WPNFs其自组装阶段更为缓慢,这是因为WPI中的β-La与β-LG之间会发生相互作用,进而延迟纤维的形成。然而,在生成的WPNFs中被证实会发生褐变反应,这可能与在体系中存在碳水化合物引起的美拉德反应以及蛋白质的氧化有关。
蛋清因具有良好的凝胶性能与发泡特性而被广泛应用于食品工业,蛋清蛋白(EWP)占蛋清总干物质的80%以上,因其较高的营养价值和优异的两亲性而成为纳米载体工业的潜在生物材料[80]。蛋清蛋白的主要成分是球蛋白、溶菌酶、卵清蛋白(OVA)、卵铁传递蛋白(OVT)等。目前,许多研究利用EWP的自组装开发新型递送材料,Chang等[80]研究发现EWP纤维状纳米颗粒的凝胶结构均匀、密切且交联较好,可作为姜黄素封装载体。此外,卵铁传递蛋白(OVT)在酸热条件下可自组装形成蛋白纤维,在食品和生物材料的领域具有重要价值。Wei等[30]研究证实OVT自组装的蛋白纤维无体外细胞毒性,具有较高的生物相容性,具有应用于食品和制药等领域的巨大潜力。此外,可以通过外源性添加剂(如山梨醇和甘油的多元醇)来控制OVT纤维的形状,从而控制纤维的形态和产量,构建出更为理想化的纤维结构[81]。
除以上蛋白质外,也有部分学者研究牛血清蛋白与血红蛋白经自组装所形成蛋白纤维的形态和功能特性。牛血清蛋白纤维的形态随加热时间的延长,逐渐从规则的球形颗粒转变为扩展的纤维聚集体,最终在加热12 h后呈蠕虫状纤维聚集体,且具有较好的乳化和发泡性能[82]。在肉类副产品工业中,血红蛋白纤维形态呈左旋扭曲带,且具有较高稳定性,将血红蛋白纤维化可使其获得能够承受外部环境极端变化并保持自身稳定性的能力,以此扩大食品工业相关应用[38]。
4.2 植物蛋白纤维
为响应可持续发展的需求,一些植物蛋白也可作为可持续的经济资源,取代动物蛋白作为制备食品蛋白纤维的优质资源,其中大豆蛋白、玉米蛋白与豌豆蛋白已被证实具有较高的营养价值且具有制备食品蛋白纤维的潜力。
大豆蛋白包括球蛋白与白蛋白,其中以球蛋白为主,占大豆蛋白的50%~90%[83]。大豆分离蛋白(SPI)在适当的外部条件下可自组装成蛋白纤维,并且水解加热和孵育时间对原纤维的形成至关重要。Foegding等[5]研究发现在一定加热时间范围内,孵育时间的适当延长,有利于原丝的形成,原纤维的凝胶性能更好,呈现出一定的有序排列与纤维结构。大豆球蛋白纤维的某些性质类似于β-LG,且大豆球蛋白纤维比动物蛋白形成的纤维更稳定和持久,这也决定了其在食品工业中的发展和利用潜力[84]。
豌豆蛋白也是一种优质植物蛋白,因具有营养价值与过敏性较低等优点,可用于食品工业中的新食品配方,被认为大豆蛋白质的潜在替代品。Liu等[85]在加热豌豆蛋白形成蛋白纤维的过程中发现,其形态受pH与加热时间影响,这是由于豌豆蛋白纤维的柔韧性随着pH的增加而增加,其表面疏水性随pH与温度的增加而降低。Wu等[41]研究发现豌豆蛋白纤维具有较高的多态性,呈蠕虫样,并且可以稳定高内相乳状液,但豌豆蛋白纤维不能形成乳清蛋白等自支持凝胶,这可能是由于豌豆蛋白纤维和乳清蛋白纤维之间的灵活性不同。
玉米醇溶蛋白是一种天然的、大分子的、可生物降解的、不致敏的,存在于玉米中的一种两亲性贮藏蛋白,其平均分子量为25~45 kDa[86]。近年来,玉米醇溶蛋白自组装形成的原纤维结构也得到了广泛的研究。玉米蛋白纤维的形态取决于蛋白质与溶剂之间的亲水性和疏水性,其蛋白纤维的聚集受到疏水相互作用的影响,并随着溶剂的极性而改变[55]。玉米蛋白可以在水-乙醇的体系中自发形成凝胶,形成棒状或颗粒状纤维,但是pH、浓度等因素决定玉米醇溶蛋白纤维呈立方、螺旋形态排列[87]。当玉米醇溶蛋白处于酸性条件和高乙醇浓度情况下,由于疏水蛋白的相互作用和乙醇对原纤维的抑制作用,原纤维形态受到破坏,形成球形聚集体[88]。
5. 食品蛋白纤维的功能特性及其在食品中的应用
由于蛋白质可以自组装成不同的结构,因其突出的界面和流变特性而在食品制造中具有宝贵的应用前景,这些特性赋予了广泛的理化特性和生物活性,包括发泡性、乳化性、抗菌和递送载体等。本综述将重点介绍食源性蛋白质的理化特性、生物活性及其在食品中的应用。部分食品蛋白纤维及理化特性和生物活性如表1所示。
5.1 食品蛋白纤维的理化特性及其在食品中的应用
5.1.1 增稠性和凝胶性
在食品中加入增稠剂可改善口感,并提高食品稳定性,与食源性蛋白质相比,食品蛋白纤维具有更高的粘度和胶凝性。这是由于食品蛋白纤维具有非常高的长径比,其厚度为纳米,轮廓长度为微米,长径比超过100,较高的长径比赋予了其较好的凝胶性能[88]。食源性蛋白质纤维化可以显著提高蛋白质溶液的粘度并改变其流动性,这与蛋白质在纤维化过程中流体动力直径的增加以及缠结网络的形成有关[8]。蛋白质形成纤维状结构后,其长径比将急剧增大。与蛋白质聚集体相比,纤维状结构可更有效地形成物理缠结网络,从而可急剧增大体系的黏度[89]。蛋白纤维和多糖在富水环境下可以交联为生物聚合物,形成具有较强持水能力和一定弹性的水凝胶体系。有研究表明,乳清蛋白纤维化后,黏度和凝胶性显著增强[25]。Ge等[90]研究发现,随着熊猫豆蛋白纤维(PDPF)的加入,显著增强了豌豆分离蛋白(PPI)水凝胶的强度,其PPI-PDF相互连接的凝胶结构更为致密、均匀,且具有更好的持水性。Hu等[91]观察到溶菌酶形成的蛋白纤维通过氢键、疏水相互作用和π-π相互作用与儿茶素(EGCG)结合,从而提高体系的粘度。因此,可以利用食品蛋白纤维这一特性,将其运用在食品加工中,从而增加食品的粘稠度和凝胶性能。
5.1.2 乳化性和发泡性
目前应用于食品工业的乳剂主要由两种不溶于溶液的分散体组成,一种是油包水乳剂(W/O),另一种是水包油乳剂(O/W)[92],油包水乳液与水包油乳液主要应用于制造黄油、奶油、涂抹剂等[92]。近年来,食品工业中新型乳剂的开发研究主要是利用食源性蛋白质的自组装,所以食品蛋白纤维被广泛应用于乳化剂与泡沫稳定剂[93]。WPI是开发新型乳剂的主要原材料之一,其主要原因是pI(等电点)范围较广(4.2~5.2)、温度范围较广,可以形成较为理想的自组装结构[94]。殷静霖等[95]研究发现卵白蛋白纤维的乳液比卵白蛋白的乳液更均匀,这可能是因为具有较高表面疏水性的蛋白原纤维更可能被吸附在油水界面上,并且随着纳米原纤维的形成,体系的粘度也相应增加,有助于乳液的稳定。
已有研究表明,食品蛋白纤维比食源性蛋白质具有更高的泡沫稳定性,这是因为泡沫的稳定性与界面流变特性有关,而食品蛋白纤维比食源性蛋白质具有更强的粘性,较高的粘度可以促进高弹性界面的形成,提高泡沫稳定性[94]。因此,可利用食品蛋白纤维这一特性改善在诸如冰淇淋、蛋糕和蛋白酥等食品中的结构及质地[96]。Qi等[97]将大米蛋白经碱性蛋白酶酶解后酸热处理形成大米蛋白水解物纤维(RPHF),不仅具有较高的吸附能力及泡沫稳定性,还提高了其蛋糕的质量。Alavi等[10]发现EWP纤维相比于EWP,其具有更高的泡沫稳定性,而且提高了其蛋白酥皮产量及粘稠度。因此,可将食品蛋白纤维视为一种发泡剂,以促进所需食品的质地及感官。
5.2 食品蛋白纤维的生物活性及其在食品中的应用
5.2.1 抗氧化性
食品蛋白纤维相比于食源性蛋白质具有更优的抗氧化活性,这是由于在蛋白质水解过程中,埋藏在蛋白质结构中的氨基酸被暴露出来,氢离子的可用性及羧酸基团浓度的增加有助于提高其抗氧化活性。已有的研究表明,Hu等[98]将乳清蛋白原纤维(WPF)和壳聚糖用作姜黄素的载体,该复合物不仅抗氧化活性显著提高,还提高了姜黄素的稳定性及水溶性,且WPF相比于单独姜黄素也具有更强的DPPH自由基活性。Zhao等[99]在研究中提出WPI在纤维化后抗氧化活性随着加热时间的增加而提高,这主要是因为在纤维化过程中暴露的含硫基团与芳香侧链的氨基酸发生了结构转变,以及它们在蛋白纤维中的有序排列促进了相邻氨基酸向氧化剂的电子转移[100]。有研究表明,在pH为3.0时,由乳清纤维稳定的鱼油乳状液与天然乳清蛋白稳定的乳状液相比具有更高的氧化稳定性,这可能是由于蛋白纤维中存在抗氧化肽,且蛋白纤维具有成膜特性和一定的刚性结构,形成的界面膜较厚导致氧化物质较难渗透[94]。
5.2.2 抗菌性
抗菌性是指物质具有抑制细菌或微生物生长的能力,这种能力很大程度上决定了食品能否在长时间的保存下依然保持较好的品质。食品加工完成后在运输与贮藏过程中易受到微生物的污染会显著降低食品的口感、香气、质地等品质,并产生食品安全隐患。食品蛋白纤维相比于食源性蛋白质具有更强的抗菌性,这是因为蛋白质在自组装过程中通常伴随着蛋白质单体水解,而水解过程中将释放小分子抗菌肽。Ma等[101]发现β-LG纤维与EGCG相互结合形成的水凝胶能破坏大肠杆菌和金黄色葡萄球菌细胞膜的完整性,具有很强的抗菌活性,除此之外,EGCG诱导β-LG的结合进一步改善其凝胶特性。Silva等[102]制备了直链淀粉(PL)和溶菌酶纤维(LNFs)的纳米复合薄膜,研究发现该复合薄膜对金黄色葡萄球菌展示出良好的抑制作用,其抑制率高达77%。因此,蛋白纤维可以在一定程度上提高食品的保质期,并被视为潜在的抗菌剂[103]。
5.2.3 递送载体
在食品工业中,生物活性物质和营养素的应用大多因其生物利用度低、不稳定、不愉快的感官刺激而受到限制。蛋白纤维在加热和酸性条件下的高度稳定性和耐受能力使可以使其突破肠胃消化屏障,实现对功能物质的靶向输送[8]。此外,许多蛋白质纤维结构稳定的食品级乳化剂可作为活性物质和营养物质的有效屏障,抵御不利的外部环境刺激,保护其不被降解与破坏[104]。Zhang等[25]将乳清蛋白纤维作为亲脂性载体递送花生油,不仅提高了体系的乳化性和抗菌性,还使其成功进入消化系统且释放良好。经研究表明,蛋白原纤维也可以通过形成乳化剂来提高被封装的食品成分的活性[26]。早在2014年,Serfert及其团队就发现了使用乳清纤维作为乳化剂可以提高生物活性鱼油的稳定性[21]。但是目前对于蛋白纤维的工业化研究较少,多数还停留在实验层面,如何在食品产业中运用其特性还需更深入的研究。
尽管有上述关于食物蛋白纤维的研究,但食品领域蛋白纤维的应用还没有完全建立。目前的研究主要集中在动物蛋白,而可持续的植物蛋白大多集中在实验室研究阶段。然而纤维化的植物蛋白可能具有更优越的功能,从而更好地满足食品工业的需求。此外,真菌、藻类和昆虫蛋白等新出现的食物蛋白的纤维化研究以及其在食品工业中的应用也有待进一步开发。
6. 结论与展望
综上所述,食品蛋白衍生的蛋白纤维受到极大的关注,众多食源性蛋白质已被证实可自组装形成蛋白纤维,从而改善蛋白结构获得预期的食品功能特性。食品蛋白纤维与食源性蛋白质相比,具有更高的稳定性及生物相容性,使蛋白纤维可被应用于诸多领域,如环境耐受食品和食品传递载体等,且蛋白纤维的来源广泛、工艺简单、功能突出,这些特征共同决定了其在未来食品工业中的重要地位。但是,目前蛋白纤维的相关研究大多处于实验室阶段,将其大规模应用于食品领域仍需解决以下几个难题:a.尽管蛋白纤维具有诸多优异的功能特性,其被食用后是否会对消化系统产生负面影响尚不得知,应建立动态仿生胃肠消化系统,探究其蠕动和排空对食品蛋白纤维消化的影响;b.蛋白纤维以蛋白质作为原料,尽管来源广泛,但蛋白纤维的得率偏低,并且对生产设备及人员要求颇高。此外,蛋白纤维从实验室走向工厂的过程中,仍需解决部分关键性问题,如生产成本、产品安全性以及纤维类食品的消化问题等;c.目前食品蛋白纤维研究主要集中于动植物来源的蛋白质,但真菌、藻类和昆虫蛋白等新出现的食物蛋白来源的食品蛋白纤维较少,应进一步开发新型蛋白资源;d.食源性蛋白质在纤维化过程中形成的肽和单体对其界面和流变特性的影响是不容忽视的,因此需研究高纯度食品蛋白纤维制备技术。总之,目前蛋白纤维化技术仍处于初步研究阶段,食品蛋白纤维在食品工业中的产业化应用还需要更深入的研究及实验。
-
表 1 食品蛋白纤维的形成条件
Table 1 Formation conditions of food protein fibrils
来源 制备条件 功能特性 参考文献 动物来源 α-乳白蛋白 pH7.4,37 ℃,30 h
pH5.0~6.0,25 ℃,7 d递送载体 [14−16] β-乳球蛋白 pH2.0,80 ℃,48 h
pH≤3,温度≥75 ℃
超声功率250 W,频率20 kHz具有较强泡沫稳定性、抗菌与抗氧化 [17−21] 乳清分离蛋白 pH2.0,80 ℃,48 h
超声功率250 W,频率20 kHz增强包封效率、抗氧化、抗菌性、发泡性、
增稠性、凝胶性、递送载体[21−26] κ-酪蛋白 pH2.0,37~80 ℃,48 h 药物递送
增稠性[27−29] 卵铁传递蛋白 pH2.0,90 ℃,6 h 乳化性 [30−31] 鸡蛋清溶菌酶 pH2.0,60 ℃,72 h,(100 mmol/L AlCl3,100 mmol/L MgCl2,
200 mmol/LNaCl)超声功率100 kHz,频率1 MHz递送载体 [32−33] 铁蛋白 pH2.0,90 ℃,9 h 递送载体 [34−35] 卵清蛋白 pH7.0,80~90 ℃,67.95 mmol/L NaCl
超声预处理15 min,功率400 W,脉冲时间5 s开/3 s关发泡性、稳定性 [36−37] 血红蛋白 pH2.8,80 ℃,125 mmol/L NaCl,24 h 稳定性 [38] 牛血清蛋白 pH7.4,60~75 ℃,24 h
超声预处理0~20 min,功率200 W,频率40 kHz乳化性、发泡性 [39] αS2-酪蛋白 pH6.5~6.7,50 ℃, 7 d [40] 植物来源 豌豆分离蛋白 pH2.0,85 ℃,20 h
超声预处理30 min,功率300 W,脉冲时间5 s开/5 s关凝胶性 [24,41−43] 大豆分离蛋白 pH2.0,85 ℃,8~10 h
pH2.0,85 ℃,12 h
超声预处理8 h,功率750 W,脉冲时间5 s开/5 s关,频率 20 kHz乳化性
发泡性、增稠性[44−49] 红豆蛋白 pH2.0,85 ℃,12 h 凝胶性 [50−51] 豇豆分离蛋白 pH2.0,90 ℃,24 h 流变性能 [52−53] 扁豆蛋白 pH2.0,90 ℃,2 h 乳化性、增稠性 [12,54] 玉米醇溶蛋白 50%~90% v/v 乙醇-水,60 ℃,pH4~10 凝胶性 [55−56] 大米谷蛋白 pH2.0,90 ℃,4 h 凝胶性 [57−58] -
[1] WANG Y, SHEN Y, QI G, et al. Formation and physicochemical properties of amyloid fibrils from soy protein[J]. Int J Biol Macromol,2020,149:609−616. doi: 10.1016/j.ijbiomac.2020.01.258
[2] JOSEFSSON L, CRONHAMN M, EKMAN M, et al. Structural basis for the formation of soy protein nanofibrils[J]. RSC Adv,2019,9(11):6310−6319. doi: 10.1039/C8RA10610J
[3] MOURE A, SINEIRO J, DOMíNGUEZ H, et al. Functionality of oilseed protein products:A review[J]. Food Research International,2006,39(9):945−963. doi: 10.1016/j.foodres.2006.07.002
[4] GUICHARD E. Flavour retention and release from protein solutions[J]. Biotechnol Adv,2006,24(2):226−229. doi: 10.1016/j.biotechadv.2005.11.003
[5] FOEGEDING E A, DAVIS J P. Food protein functionality:A comprehensive approach[J]. Food Hydrocolloids,2011,25(8):1853−1864. doi: 10.1016/j.foodhyd.2011.05.008
[6] BOURBON A I, PEREIRA R N, PASTRANA L M, et al. Protein-based nanostructures for food applications[J]. Gels,2019,5(1):9. doi: 10.3390/gels5010009
[7] ROLAND R, S E D. The activities of amyloids from a structural perspective[J]. Nature, 2016, 539(7628).
[8] MENG Y, WEI Z H, XUE C H. Protein fibrils from different food sources:A review of fibrillation conditions, properties, applications and research trends[J]. Trends in Food Science & Technology,2022,121:59−75.
[9] DONG W Y, ZHANG X Y, DING L X, et al. Enhancement of emulsification properties by modulation of egg white protein fibril structure with different heating times[J]. Food Hydrocolloids,2023,135:108203. doi: 10.1016/j.foodhyd.2022.108203
[10] ALAVI F, EMAM-DJOMEH Z, MOHAMMADIAN M, et al. Physico-chemical and foaming properties of nanofibrillated egg white protein and its functionality in meringue batter[J]. Food Hydrocolloids,2020,101:105554. doi: 10.1016/j.foodhyd.2019.105554
[11] XU Z J, WANG X S, GAO Y, et al. Structural insights into acidic heating-induced amyloid fibrils derived from soy protein as a function of protein concentration[J]. Food Hydrocolloids, 2023, 145.
[12] WYNNYCHUK C, JO Y J, CHU Y, et al. Long-term stable emulsions prepared from lentil protein fibrillar aggregates[J]. Food Structure,2021,29(7):100204.
[13] CAO Y P, MEZZENGA R. Food protein amyloid fibrils:Origin, structure, formation, characterization, applications and health implications[J]. Adv Colloid Interface Sci,2019,269:334−356. doi: 10.1016/j.cis.2019.05.002
[14] LORIA K G, PILOSOF A M R, FARÍAS M E. Influence of calcium and sodium chloride on caseinomacropeptide self-assembly and flow behaviour at neutral pH[J]. Lwt,2018,98:598−605. doi: 10.1016/j.lwt.2018.09.029
[15] TALEBPOUR F, GHAHGHAEI A. Effect of green synthesis of gold nanoparticles (AuNPs) from Hibiscus sabdariffa on the aggregation of α-lactalbumin[J]. International Journal of Peptide Research and Therapeutics,2020,26(4):2297−2306. doi: 10.1007/s10989-020-10023-9
[16] ROMANO A, LESMES U, ENGELBERG Y, et al. Alpha-lactalbumin amyloid-like fibrils for intestinal delivery:Formation, physiochemical characterization, and digestive fate of capsaicin-loaded fibrils[J]. Food hydrocolloids,2023,136(PA):108248.
[17] LOVEDAY S M, ANEMA S G, SINGH H. β-lactoglobulin nanofibrils:The long and the short of it[J]. International Dairy Journal,2017,67:35−45. doi: 10.1016/j.idairyj.2016.09.011
[18] HU Y, HE C X, WOO M W, et al. Formation of fibrils derived from whey protein isolate:structural characteristics and protease resistance[J]. Food & Function,2019,10(12):8106−8115.
[19] DENGFENG P, JINCHU Y, JING L, et al. Foams Stabilized by β-lactoglobulin amyloid fibrils:Effect of pH[J]. Journal of Agricultural and Food Chemistry,2017,65(48):10658−10665. doi: 10.1021/acs.jafc.7b03669
[20] ZHAO D, LI L, XU D, et al. Application of ultrasound pretreatment and glycation in regulating the heat-induced amyloid-like aggregation of β-lactoglobulin[J]. Food Hydrocolloids,2018,80:122−129. doi: 10.1016/j.foodhyd.2018.02.001
[21] SERFERT Y, LAMPRECHT C, TAN C P, et al. Characterisation and use of β-lactoglobulin fibrils for microencapsulation of lipophilic ingredients and oxidative stability thereof[J]. Journal of Food Engineering,2014,143:53−61. doi: 10.1016/j.jfoodeng.2014.06.026
[22] FARJAMI T, MADADLOU A, LABBAFI M. Modulating the textural characteristics of whey protein nanofibril gels with different concentrations of calcium chloride[J]. Journal of Dairy Research,2016,83(1):109−114. doi: 10.1017/S0022029915000667
[23] ZHANG C, FU Y Y, LI Z Y, et al. Application of whey protein isolate fibrils in encapsulation and protection of β-carotene[J]. Food Chemistry,2020,346(6):128963.
[24] DING S, YE X, QU L L, et al. Modification of whey protein isolate by ultrasound-assisted pH shift for complexation with carboxymethylcellulose:Structure and interfacial properties[J]. International Journal of Biological Macromolecules,2023,252:126479. doi: 10.1016/j.ijbiomac.2023.126479
[25] ZHANG Y, LIANG S, ZHANG J S, et al. Preparation of whey protein isolate nanofibrils by microwave heating and its application as carriers of lipophilic bioactive substances[J]. LWT,2020,125(prepublish):109213.
[26] MOHAMMADIAN M, SALAMI M, MOMEN S, et al. Enhancing the aqueous solubility of curcumin at acidic condition through the complexation with whey protein nanofibrils[J]. Food Hydrocolloids,2019,87:902−914. doi: 10.1016/j.foodhyd.2018.09.001
[27] PAN K, ZHONG Q X. Amyloid-like fibrils formed from intrinsically disordered caseins:Physicochemical and nanomechanical properties[J]. Soft Matter,2015,11(29):5898−5904. doi: 10.1039/C5SM01037C
[28] LEE J, JI-HYEPALK, SEUNG R. YEOM, BONGJUNCHAR, KOOKHEON. Thermally triggered self-assembly of kappa-casein amyloid nanofibrils and their nanomechanical properties[J]. Polymer:The International Journal for the Science and Technology of Polymers,2019,179:121626.
[29] CHUN J, BHAK G, LEE J-H, et al. Protein-Based Hierarchical Suprastructures Derived from κ-casein Amyloid Fibrils and their use for Neuronal Differentiation[J]. Biophysical Journal,2013,104(2):392a.
[30] WEI Z H, HUANG Q R. Assembly of iron-bound ovotransferrin amyloid fibrils[J]. Food Hydrocolloids,2018,89:579−589.
[31] DONG Y, WEI Z H, XUE C H. Effect of interaction between ovotransferrin fibrils and pectin on properties of oleogel-based Pickering emulsions[J]. Food Hydrocolloids, 2023:108620.
[32] WAWER J, MICHALOLSZEWSKI, MARCINPIATEK, et al. Influence of the ionic strength on the amyloid fibrillogenesis of hen egg white lysozyme[J]. International Journal of Biological Macromolecules:Structure, Function and Interactions,2019,121:63−70.
[33] PARINAZ L, PEYMAN S S, KHOSRO K, et al. Frequency dependence of ultrasonic effects on the kinetics of hen egg white lysozyme fibrillation[J]. International Journal of Biological Macromolecules,2023,254(P3):127871.
[34] JURADO R, ADAMCIK J, SÁNCHEZ-FERRER A, et al. Understanding the formation of apoferritin amyloid fibrils[J]. Biomacromolecules,2021,22(5):2057−2066. doi: 10.1021/acs.biomac.1c00176
[35] JURADO R, CASTELLO F, BONDIA P, et al. Apoferritin fibers:A new template for 1D fluorescent hybrid nanostructures[J]. Nanoscale,2016,8(18):9648−9656. doi: 10.1039/C6NR01044J
[36] EIKE J, STEPHAN D, STEFAN T, et al. Formation of amyloid fibrils from ovalbumin under Ohmic heating[J]. Heliyon,2023,9(11):e22061. doi: 10.1016/j.heliyon.2023.e22061
[37] PI J Z, WANG J, LÜ J R, et al. Modification of ovalbumin by the enzymatic method:Consequences for foaming characteristics of fibrils[J]. Food Hydrocolloids,2023,139:108492. doi: 10.1016/j.foodhyd.2023.108492
[38] NADISHKA J, MANMEET K, SMITHA N, et al. Amyloid fibrils from hemoglobin[J]. Biomolecules,2017,7(4):37.
[39] HOLM N K, JESPERSEN S K, THOMASSEN L V, et al. Aggregation and fibrillation of bovine serum albumin[J]. BBA - Proteins and Proteomics,2007,1774(9):1128−1138. doi: 10.1016/j.bbapap.2007.06.008
[40] ECROYD H, SUNDE M, POON S, et al. Amyloid fibril formation by bovine milk αs2-casein occurs under physiological conditions yet is prevented by its natural counterpart, αs1-casein[J]. Biochemistry,2008,47(12):3926−3936. doi: 10.1021/bi701278c
[41] WU H Q, NIAN Y Q, LIU Y H, et al. Formation of pea protein amyloid fibrils to stabilize high internal phase emulsions for encapsulation of lutein[J]. Journal of Functional Foods,2022,94:105110. doi: 10.1016/j.jff.2022.105110
[42] ZHU X S, ZHANG J X, LIU S H, et al. Relationship between molecular structure and heat-induced gel properties of duck myofibrillar proteins affected by the addition of pea protein isolate[J]. Foods (Basel, Switzerland),2022,11(7):1040.
[43] CHEN X T, YI J, WEN Z, et al. Ultrasonic pretreatment and epigallocatechin gallate incorporation enhance the formation, apparent viscosity, and antioxidant activity of pea protein amyloid-like fibrils[J]. Food Hydrocolloids,2024,149:109630. doi: 10.1016/j.foodhyd.2023.109630
[44] LASSÉ M, ULLUWISHEWA D, HEALY J, et al. Evaluation of protease resistance and toxicity of amyloid-like food fibrils from whey, soy, kidney bean, and egg white[J]. Food Chemistry,2016,192:491. doi: 10.1016/j.foodchem.2015.07.044
[45] WANG Y J, SHEN Y T, QI G Y, et al. Formation and physicochemical properties of amyloid fibrils from soy protein[J]. International Journal of Biological Macromolecules,2020,149(15):609−616.
[46] WANG L, WU M, LIU H M, et al. Emulsifying and physicochemical properties of soy hull hemicelluloses-soy protein isolate conjugates[J]. Carbohydrate Polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides,2017,163:181−190.
[47] HU A N, LI L. Effects of ultrasound pretreatment on functional property, antioxidant activity, and digestibility of soy protein isolate nanofibrils[J]. Ultrasonics Sonochemistry,2022,90:106193. doi: 10.1016/j.ultsonch.2022.106193
[48] XIA W J, ZHANG H, CHEN J Y, et al. Formation of amyloid fibrils from soy protein hydrolysate:Effects of selective proteolysis on β-conglycinin[J]. Food Research International,2017,100:268−276. doi: 10.1016/j.foodres.2017.08.059
[49] YU Z C, LI N, LIU Y, et al. Formation, structure and functional characteristics of amyloid fibrils formed based on soy protein isolates[J]. International Journal of Biological Macromolecules,2024,254:127956. doi: 10.1016/j.ijbiomac.2023.127956
[50] LIU J, TANG C H. Heat-induced fibril assembly of vicilin at pH 2.0:Reaction kinetics, influence of ionic strength and protein concentration, and molecular mechanism[J]. Food Research International,2013,51(2):621−632. doi: 10.1016/j.foodres.2012.12.049
[51] LEE H C, JANG H S, KANG I, et al. Effect of red bean protein isolate and salt levels on pork myofibrillar protein gels mediated by microbial transglutaminase[J]. LWT- Food Science and Technology,2016,76:95−100.
[52] CLAIRE, DARIZU, MUNIALO, et al. Fibril formation from pea protein and subsequent gel formation[J]. Journal of Agricultural and Food Chemistry,2014,62(11):2418−2427. doi: 10.1021/jf4055215
[53] LI T, WANG L, ZHANG X X, et al. Assembly behavior, structural characterization and rheological properties of legume proteins based amyloid fibrils[J]. Food Hydrocolloids,2021,111:106396. doi: 10.1016/j.foodhyd.2020.106396
[54] JO Y J, CHU Y, CHEN L Y. Enhanced stabilization of oil-in-water (O/W) emulsions by fibrillar gel particles from lentil proteins[J]. Food Research International,2023,172:113203. doi: 10.1016/j.foodres.2023.113203
[55] ZOU Y, THIJSSEN P P, YANG X Q, et al. The effect of oil type and solvent quality on the rheological behavior of zein stabilized oil-in-glycerol emulsion gels[J]. Food Hydrocolloids,2019,91:57−65. doi: 10.1016/j.foodhyd.2019.01.016
[56] AN B Z, WU X C, LI M J, et al. Hydrophobicity-modulating self-assembled morphologies of alpha-zein in aqueous ethanol[J]. International Journal of Food Science and Technology,2016(12):51.
[57] LI S, JIANG Z Y, WANG F X, et al. Characterization of rice glutelin fibrils and their effect on in vitro rice starch digestibility[J]. Food Hydrocolloids, 2020, 106: 105918.
[58] ZHANG Y H, HUANG L H, WEI Z C. Effects of additional fibrils on structural and rheological properties of rice bran albumin solution and gel[J]. European Food Research and Technology,2014,239(6):971−978. doi: 10.1007/s00217-014-2294-9
[59] HU A, LI L. Effect mechanism of ultrasound pretreatment on fibrillation Kinetics, physicochemical properties and structure characteristics of soy protein isolate nanofibrils[J]. Ultrasonics Sonochemistry, 2021, 78.
[60] WEN-CHIEN L, CHIEN-SHAN C, YUNG-JIA C, et al. Characterization and biological properties of marine by-product collagen through ultrasound-assisted extraction[J]. Aquaculture Reports,2023,29:101514. doi: 10.1016/j.aqrep.2023.101514
[61] WU D, WU C, MA W C, et al. Effects of ultrasound treatment on the physicochemical and emulsifying properties of proteins from scallops(Chlamys farreri)[J]. Food Hydrocolloids,2018,89:707−714.
[62] SHEN X, FANG T Q, GAO F, et al. Effects of ultrasound treatment on physicochemical and emulsifying properties of whey proteins pre- and post-thermal aggregation[J]. Food Hydrocolloids,2017,63:668−676. doi: 10.1016/j.foodhyd.2016.10.003
[63] HU H, WU J H, LI-CHAN E C Y, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids,2013,30(2):647−655. doi: 10.1016/j.foodhyd.2012.08.001
[64] AMIRI A, SHARIFIAN P, SOLTANIZADEH N. Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins[J]. International Journal of Biological Macromolecules,2018,111:139−147. doi: 10.1016/j.ijbiomac.2017.12.167
[65] MOHAMMADIAN M, MADADLOU A. Technological functionality and biological properties of food protein nanofibrils formed by heating at acidic condition[J]. Trends in Food Science & Technology,2018,75:115−128.
[66] YANG F T, WANG F, JANINE M, et al. Ultrasound-assisted air-jet spinning of silk fibroin-soy protein nanofiber composite biomaterials[J]. Ultrasonics sonochemistry,2023,94:106341. doi: 10.1016/j.ultsonch.2023.106341
[67] HODA K, SUN C X, HE J, et al. The role of amyloid fibrils in the modification of whey protein isolate gels with the form of stranded and particulate microstructures[J]. Food Research International,2020,140:109856.
[68] DOOST S A, NASRABADI N M, KASSOZI V, et al. Pickering stabilization of thymol through green emulsification using soluble fraction of almond gum-Whey protein isolate nano-complexes[J]. Food Hydrocolloids,2019,88:218−227. doi: 10.1016/j.foodhyd.2018.10.009
[69] JANSENS J K, ROMBOUTS I, GROOTAERT C, et al. Rational design of amyloid-like fibrillary structures for tailoring food protein techno-functionality and their potential health implications[J]. Comprehensive Reviews in Food Science and Food Safety,2019,18(1):84−105. doi: 10.1111/1541-4337.12404
[70] ANĐELA Š, T M T C, ALESSIO Z, et al. Kinetics of spontaneous filament nucleation via oligomers:Insights from theory and simulation[J]. The Journal of chemical physics,2016,145(21):211926. doi: 10.1063/1.4965040
[71] MOAYEDZADEH S, MADADLOU A, ASL A K. Formation mechanisms, handling and digestibility of food protein nanofibrils[J]. Trends in Food Science & Technology,2015,45(1):50−59.
[72] WEI Z H, HUANG Q R. Modification of ovotransferrin by Maillard reaction:Consequences for structure, fibrillation and emulsifying property of fibrils[J]. Food Hydrocolloids,2019,97:105186. doi: 10.1016/j.foodhyd.2019.105186
[73] CAO Y, TANG X, YUAN M, et al. Computational studies of protein aggregation mediated by amyloid:Fibril elongation and secondary nucleation[J]. Progress in Molecular Biology and Translational Science,2020,170:461−504.
[74] EISENBERG D S, SAWAYA M R. Structural studies of amyloid proteins at the molecular level[J]. Annual Review of Biochemistry,2017,86(1):69−95. doi: 10.1146/annurev-biochem-061516-045104
[75] LUTTER L, AUBREY L D, XUE W F. On the Structural diversity and individuality of polymorphic amyloid protein assemblies[J]. J Mol Biol,2021,433(20):167124. doi: 10.1016/j.jmb.2021.167124
[76] R S M, SHILPA S, REBECCA N, et al. Atomic structures of amyloid cross-beta spines reveal varied steric zippers[J]. Nature,2007,447(7143):453−457. doi: 10.1038/nature05695
[77] SVITLANA M, LONG W S, RAFFAELE M. Production and characterization of amaranth amyloid fibrils from food protein waste[J]. Food Hydrocolloids, 2024, 149.
[78] ANEMA S G. Spontaneous interaction of lactoferrin with casein micelles or individual caseins[J]. Journal of the Royal Society of New Zealand,2018,48(2-3):1−22.
[79] NICOLAI T. Formation and functionality of self-assembled whey protein microgels[J]. Colloids and Surfaces B:Biointerfaces,2016,137:32−38. doi: 10.1016/j.colsurfb.2015.05.055
[80] CHANG C H, MEIKLE T G, SU Y J, et al. Encapsulation in egg white protein nanoparticles protects anti-oxidant activity of curcumin[J]. Food Chemistry,2018,280:65−72.
[81] WEI Z H, CHEN Y S, WAHYU W, et al. Hydrogels assembled from ovotransferrin fibrils and xanthan gum as dihydromyricetin delivery vehicles[J]. Food & Function,2020,11(2):1478−1488.
[82] YANG Y P, PAN Z R, YANG T Y, et al. Effects of ultrasonic pretreatment on fibrillation kinetics, morphologies, and functional properties of bovine serum albumin fibrils[J]. Food Hydrocolloids, 2024, 149:109520.
[83] TOMADONI B, CAPELLO C, VALENCIA G A, et al. Self-assembled proteins for food applications:A review[J]. Trends in Food Science & Technology,2020,101:1−16.
[84] WAN Y L, GUO S T. The Formation and disaggregation of soy protein isolate fibril:Effects of pH[J]. Food Biophysics,2019,14(2):164−172. doi: 10.1007/s11483-019-09567-1
[85] LIU C R, WU D, WANG P J, et al. Study on the formation mechanism of pea protein nanofibrils and the changes of structural properties of fibril under different pH and temperature[J]. Food Hydrocolloids,2024,150:109735. doi: 10.1016/j.foodhyd.2024.109735
[86] YUAN D, HUANG X, MENG Q R, et al. Recent advances in the application of zein-based gels:A review[J]. European Polymer Journal,2022,179:111557. doi: 10.1016/j.eurpolymj.2022.111557
[87] SUN C X, XIONG Z Q, ZHANG J W, et al. Environmental parameters-dependent self-assembling behaviors of α-zein in aqueous ethanol solution studied by atomic force microscopy[J]. Food Chemistry,2020,331:127349. doi: 10.1016/j.foodchem.2020.127349
[88] CECILE V, HARRY B, C S L M, et al. A new multistep Ca2+-induced cold gelation process for beta-lactoglobulin[J]. Journal of Agricultural and Food Chemistry,2003,51(13):3880−3885. doi: 10.1021/jf0261396
[89] 张宏声, 陈业明, 华欲飞, 等. 内源性蛋白酶对花生蛋白纤维化凝胶的影响[J]. 中国油脂,2020,45(12):12−16. [ZHANG H S, CHEN Y M, HUA Y F, et al. Effects of endogenous proteases on peanut protein fibrosis gel[J]. China Oils and Fats,2020,45(12):12−16.] doi: 10.12166/j.zgyz.1003-7969/2020.12.003 ZHANG H S, CHEN Y M, HUA Y F, et al. Effects of endogenous proteases on peanut protein fibrosis gel[J]. China Oils and Fats, 2020, 45(12): 12−16. doi: 10.12166/j.zgyz.1003-7969/2020.12.003
[90] GE J, SUN C X, CHANG Y Y, et al. Heat-induced pea protein isolate gels reinforced by panda bean protein amyloid fibrils:Gelling properties and formation mechanism[J]. Food Research International,2022,162(PA):112053.
[91] HU B, SHEN Y, JOZEF A, et al. Polyphenol-binding amyloid fibrils self-assemble into reversible hydrogels with antibacterial activity[J]. ACS Nano,2018,12(4):3385−3396. doi: 10.1021/acsnano.7b08969
[92] GHOSH S, ROUSSEAU D. Emulsion breakdown in foods and beverages[M]. Britain:Woodhead Publishing, 2010:260−295.
[93] FENG Y M, IBARRA-SáNCHEZ L A, LUU L, et al. Co-assembly of nisin and zein in microfluidics for enhanced antilisterial activity in Queso Fresco[J]. LWT,2019,111:355−362. doi: 10.1016/j.lwt.2019.05.059
[94] DICKINSON E. Hydrocolloids as emulsifiers and emulsion stabilizers[J]. Food Hydrocolloids,2008,23(6):1473−1482.
[95] 殷静霖, 熊舟翼, 熊汉国. 热聚合卵白蛋白自组装纤维及其稳定乳液的研究[J]. 中国调味品,2021,46(10):1−7,14. [YIN J L, XIONG Z Y, XIONG H G. Study on the thermally polymerized ovalbumin self-assembled fibers and its use as emulsion stabilizer[J]. China Condiment,2021,46(10):1−7,14.] doi: 10.3969/j.issn.1000-9973.2021.10.001 YIN J L, XIONG Z Y, XIONG H G. Study on the thermally polymerized ovalbumin self-assembled fibers and its use as emulsion stabilizer[J]. China Condiment, 2021, 46(10): 1−7,14. doi: 10.3969/j.issn.1000-9973.2021.10.001
[96] YUE J X, YAO X L, GOU Q X, et al. Recent advances of interfacial and rheological property based techno-functionality of food protein amyloid fibrils[J]. Food Hydrocolloids,2022,132:107827. doi: 10.1016/j.foodhyd.2022.107827
[97] QI X, LI Y L, ZHANG W D, et al. Proteolysis improves the foaming properties of rice protein fibrils:Structure, physicochemical properties changes, and application in angel food cake[J]. Food Chemistry,2024,437:137765. doi: 10.1016/j.foodchem.2023.137765
[98] HU Y, HE C X, JIANG C J, et al. Complexation with whey protein fibrils and chitosan:A potential vehicle for curcumin with improved aqueous dispersion stability and enhanced antioxidant activity[J]. Food Hydrocolloids,2020,104:105729. doi: 10.1016/j.foodhyd.2020.105729
[99] ZHAO Y G, WANG C X, LU W, et al. Evolution of physicochemical and antioxidant properties of whey protein isolate during fibrillization process[J]. Food Chemistry,2021,357:129751. doi: 10.1016/j.foodchem.2021.129751
[100] 操义平, 方亚鹏. 淀粉样蛋白纤维作为食品配料的研究进展与思考[J]. 中国食品添加剂,2023,34(1):46−54. [CAO Y P, FANG Y P. Research progress on amyloid fibrils as food ingredients[J]. China Food Additives,2023,34(1):46−54.] CAO Y P, FANG Y P. Research progress on amyloid fibrils as food ingredients[J]. China Food Additives, 2023, 34(1): 46−54.
[101] MA J Q, ZHANG X Y, DU Z X, et al. Construction of protein hydrogels with antibacterial activity by interaction of β-lactoglobulin amyloid fibrils with epigallocatechin-3-gallate[J]. Food Bioscience, 2024, 58.
[102] SILVA H N,VILELA C, ALMEIDA A, et al. Pullulan-based nanocomposite films for functional food packaging:Exploiting lysozyme nanofibers as antibacterial and antioxidant reinforcing additives[J]. Food Hydrocolloids,2018,77:921−930. doi: 10.1016/j.foodhyd.2017.11.039
[103] ZHANG M Z, ZHAO J, ZHENG J. Molecular understanding of a potential functional link between antimicrobial and amyloid peptides[J]. Soft Matter,2014,10(38):7425−7451. doi: 10.1039/C4SM00907J
[104] 郑为君, 张玲莺, 陈星. 可持续蛋白纳米纤维及其功能因子递送研究进展[J]. 食品与发酵工业,2023,49(15):320−325. [ZHENG W J, ZHANG L Y, CHEN X. Research progress on sustainable protein nanofibers and their delivery of functional nutrients[J]. Food and Fermentation Industries,2023,49(15):320−325.] ZHENG W J, ZHANG L Y, CHEN X. Research progress on sustainable protein nanofibers and their delivery of functional nutrients[J]. Food and Fermentation Industries, 2023, 49(15): 320−325.
-
期刊类型引用(10)
1. 袁陈婷,杨容,王立玮,景凌洁,陈璐阳,加羊卓玛,孙小祥,孙锦秀,杨欢. 基于特征多肽抗原的阿胶基原鉴定. 中成药. 2024(04): 1214-1219 .  百度学术
百度学术
2. 王晶,杨彤,芦云,王芳. 不同核酸提取方法用于检测明胶动物源性成分的比较分析. 食品科技. 2024(03): 312-319 .  百度学术
百度学术
3. 蒋洁莹,史万忠,刘瑾,元唯安,朱蕾蕾. 河蚌多糖生物活性与提取、纯化工艺研究进展. 中国药业. 2024(08): 125-128 .  百度学术
百度学术
4. 李晶峰,孙佳明,赵润怀,段金廒,万德光,吴楠,杜延佳,张辉. 动物源中药材鉴定学发展及面临的问题与挑战. 中国医院药学杂志. 2024(08): 973-978+984 .  百度学术
百度学术
5. 范小龙,朱晓玲,江丰,陈梦圆,吴婉琴,黄坤,王福燕. 高分辨质谱靶向筛查技术鉴别阿胶中杂皮源成分. 中南农业科技. 2024(07): 94-98 .  百度学术
百度学术
6. 杨帅,鲁婷婷,周祖英,迟明艳,巩仔鹏,李月婷,郑林,黄勇. 阿胶化学成分和药理作用及质量控制研究进展. 中国新药杂志. 2023(08): 806-816 .  百度学术
百度学术
7. 蒋文丽,朱晓湉,钟铭慧,谢作桦,芦玲,涂宗财,沙小梅. 阿胶制品中典型明胶特征性多肽的鉴定. 食品工业科技. 2023(12): 73-80 .  本站查看
本站查看
8. 孔浩,田汝芳,曹桂云,孟兆青. 阿胶质量安全分析研究进展. 畜牧与饲料科学. 2023(04): 109-115 .  百度学术
百度学术
9. 孙铁锋,王平,丁相龙,丁立钧,姜其宝,王金国. 细胞膜色谱技术在多肽类成分筛选的研究进展. 药学研究. 2023(11): 926-931+936 .  百度学术
百度学术
10. 付群,张玲,庞幸,刘岩,韩蓉,杨嫣骊. 苏州市工业园区市售阿胶类保健品基于PCR技术的检测结果分析. 食品安全导刊. 2023(33): 97-100 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:
