Identification of Characteristic Peptides from Typical Gelatin in Ejiao Products
-
摘要: 为了研究不同类型阿胶制品中典型明胶的来源,本文选取9种市面上常见的阿胶制品(阿胶糕、阿胶口服液和阿胶颗粒各3种)为研究对象,分别添加质量分数为1%的牛明胶和猪明胶,采用高效液相色谱-高分辨率质谱联用技术(high-performance liquid chromatography-mass spectrometry,HPLC-MS/MS)鉴定这9种阿胶制品中典型明胶的特征性多肽。结果表明,不同数量的典型明胶特征性多肽被检出于9种阿胶制品。进一步分析发现,所有阿胶制品共有的阿胶、牛明胶、猪明胶的特征性多肽分别为25、3、14条,其中,未经修饰的特征性多肽依次为7、2、3条。在上述共有特征性多肽中,源自α1链的分别有22、2、5条,源自α2链的分别为3、1、9条。这些共有特征性多肽可作为HPLC-MS/MS鉴定复杂体系中明胶源的依据,对不同阿胶制品中明胶来源的鉴定具有指导意义。
-
关键词:
- 阿胶制品 /
- 典型明胶 /
- 特征性多肽 /
- HPLC-MS/MS
Abstract: In order to study the source of typical gelatin in different types of Ejiao products, nine common Ejiao products on the market including three kinds of Ejiao cake, Ejiao oral liquid and Ejiao granule, were selected as the research objects. Moreover, 1% bovine gelatin and porcine gelatin were added in Ejiao products, respectively. High-performance liquid chromatography-mass spectrometry (HPLC-MS/MS) was used to identify the characteristic peptides of typical gelatin including donkey gelatin, bovine gelatin, and porcine gelatin. The results showed that different characteristic peptides of typical gelatin were detected in nine kinds of Ejiao products. Through further analysis, it was found that the common characteristic peptides of donkey gelatin, bovine gelatin, and porcine gelatin shared by these 9 Ejiao products were 25, 3, and 14, respectively, where the unmodified characteristic peptides were 7, 2, and 3 in turn. Among them, 22, 2, and 5 common characteristic peptides were derived from the α1 chain, respectively. Meanwhile, 3, 1, and 9 common characteristic peptides were derived from the α2 chain, respectively. These common characteristic peptides could be used as the basis for the identification of gelatin sources in complex systems by HPLC-MS/MS, and give guiding significance in gelatin identification for different Ejiao products. -
阿胶作为我国特有的一种名贵中药,有着“补血圣药”之称[1]。现代药理研究结果显示,阿胶不仅具有止血、补血的作用,而且在抗疲劳、抗氧化、抗肿瘤、提高免疫力、耐缺氧等方面具有一定的疗效[2]。近年来,为了满足阿胶市场的需要,阿胶制品的类型得以不断丰富,如阿胶糕是阿胶的延伸类产品,因其具有滋补养颜、增强抵抗力等复合保健功效而具有悠久的食用历史[3];由阿胶改良后的颗粒剂制品-阿胶颗粒相比阿胶更方便服用,其中熟地黄、党参、黄芪、枸杞等多样化辅料的添加也对人体健康有益[4-5];阿胶类口服液常由阿胶和其他中药材混合熬制而成,是一种服用方便、质量稳定的制剂[6],具有提高细胞免疫、体液免疫和补血补肾的功能[7-9]。现今,人们对阿胶制品的大量需求导致驴皮资源紧缺,阿胶价格逐年上涨[10-11],进而不法商家使用其它明胶替代阿胶制成假冒伪劣的阿胶制品并流通于市场,造成了消费者的购买担忧以及对产品真假性的质疑[12-13]。因此,对阿胶制品中明胶的来源进行鉴别和溯源对帮助阿胶行业打假、树立消费者购买信心具有重要的意义。
高效液相色谱-高分辨率质谱技术(high-performance liquid chromatography-mass spectrometry,HPLC-MS/MS)是一项公认的能够准确鉴定明胶来源的技术,具有针对性强、灵敏度高等优点[14-15],如HPLC-MS/MS不仅可以鉴别来自马皮明胶、牛皮明胶和驴皮明胶的特征性多肽[16],还能定量检测目标明胶在明胶混合物中的含量[12]。除此之外,质谱技术还能检测出非明胶混合物复杂体系中的阿胶,如陈鸿玉等[17]利用HPLC-MS/MS测定了妇科止带片中的阿胶。目前,HPLC-MS/MS鉴定明胶来源主要存在于相关理论研究,而应用于阿胶类产品中明胶的鉴定研究非常少。虽然课题组前期也利用HPLC-MS/MS鉴定出4种阿胶块产品中不同明胶(阿胶、猪明胶和牛明胶)的共有特征性多肽数量、氨基酸序列和修饰情况[18],但阿胶市场中占比越来越大的阿胶制品中明胶的来源鉴定还未被深入探究。此外,相较原材料种类较少的阿胶块而言,不同的阿胶制品将存在多种原辅料、产品剂型、加工工艺等因素引起的综合影响。因此,利用HPLC-MS/MS技术准确鉴定各类阿胶制品中明胶的来源值得深入研究和探索。
本文以3种类型阿胶制品,包括阿胶糕(东阿桃花姬阿胶糕、福牌阿胶糕、同仁堂阿胶糕)、阿胶颗粒(驴胶补血颗粒、阿归养血颗粒、阿胶补血颗粒)、阿胶口服液(复方阿胶浆、阿胶补血口服液、阿胶益寿口服液)为研究对象,分别添加质量分数1%的牛明胶和猪明胶,再通过HPLC-MS/MS检测并鉴定出阿胶制品中典型明胶的特征性多肽。阿胶制品中阿胶、低含量牛明胶和猪明胶的特征性多肽数据库的建立可为明胶的准确溯源提供依据,对阿胶制品的品质保障具有重要意义。
1. 材料与方法
1.1 材料与仪器
阿胶糕 东阿桃花姬阿胶糕、福牌阿胶糕、同仁堂阿胶糕分别来自东阿阿胶股份有限公司、山东福牌阿胶股份有限公司、北京同仁堂科技发展股份有限公司;阿胶颗粒 驴胶补血颗粒、阿归养血颗粒、阿胶补血颗粒分别来自九芝堂股份有限公司、江西新远健有限公司和东阿阿胶股份有限公司;阿胶口服液 复方阿胶浆、阿胶补血口服液、阿胶益寿口服液产品分别来自东阿阿胶股份有限公司、山东福牌阿胶股份有限公司、仁和药业有限公司。
牛皮明胶、猪皮明胶、乙腈、甲酸(FA)、碳酸氢铵(NH4HCO3) 美国Sigma公司;胰蛋白酶(19385 U/mg) 美国Promega Corporation公司;尿素、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(C2H4INO,IAA) 上海Bio-Rad实验室。
RP-C18色谱柱(75 μm×150 mm,5 μm) 安捷伦科技有限公司;EASY-nLC™ 1000色谱系统、Q-Exactive质谱仪 美国Thermo Fisher Scientific公司;Nanosep 10K Omega离心机 德国Eppendorf公司;LGJ-1D-80型冷冻干燥机 北京亚泰科隆仪器技术有限公司。
1.2 实验方法
1.2.1 9种阿胶制品的处理
参考沙小梅等[18]的实验方法并稍做修改。3种阿胶糕样品和3种阿胶颗粒样品于50 ℃去离子水中溶解后制成100 mg/mL的阿胶制品溶液,分别加入质量分数为1%的牛明胶和猪明胶后搅拌均匀,14000×g离心25 min后取上清液过滤(0.45 μm),冻干备用。复方阿胶浆、阿胶补血口服液、阿胶益寿口服液用水分测定仪测出固形物含量分别为21.75%、30.66%和15.52%,后按以上阿胶糕和阿胶颗粒的步骤得到冻干样品。
1.2.2 样品的酶解
参照Sha等研究的方法进行酶解[19]。冻干后的样品溶解于SDT缓冲液(4% SDS、100 mmol/L DTT、150 mmol/L pH8.0 Tris-HCl)制成1 μg/μL溶液,煮沸3 min后以12000×g离心15 min。取上清液于10 kDa超滤离心管,加入200 μL尿素裂解液(8 mol/L尿素,150 mmol/L pH8.0 Tris-HCl)后14000×g离心15 min,重复此操作1次。之后,加入100 μL 50 mmol/L IAA溶液,于暗室放置30 min后14000×g离心15 min。取上清液后加入100 μL尿素裂解液后以14000×g离心15 min,重复此操作2次。向上清液中加入100 μL的25 mmol/L NH4HCO3溶液并离心,重复操作2次。最后加入40 μL 25 mmol/L NH4HCO3溶液(含2 μg胰蛋白酶),37 ℃孵育16 h后14000×g离心20 min收集滤液。
1.2.3 高效液相色谱-质谱检测
将收集的滤液经毛细管高效液相色谱分离后用Q-Exactive质谱仪进行质谱分析,液相色谱分离柱为C18柱。在250 nL/min流速下,流动相A(体积分数0.1%甲酸的水溶液)线性梯度洗脱至流动相B(体积分数84%的乙腈溶液、含有体积分数0.1%的甲酸)。MS数据从300~1800 m/z范围内获得后再进行HCD裂解。目标值的确定基于预测性自动增益控制(pAGC)。
1.3 数据处理
采用MASCOT软件进行匹配分析,目标胶原蛋白(驴皮、牛皮和猪皮胶原蛋白)数据库已设置。为了准确识别肽段,一些参数设置为如下条件:氧化修饰(M、P、K);最大的未酶切位点为2;肽段容错率为±20×10−6;酶解碎片容错率为±0.1 Da。当Mascot分数大于40时,多肽峰被认定为阳性[20]。此外,将依据课题组前期建立的三种胶原蛋白理论特征性多肽数据库比对分析阿胶、牛明胶和猪明胶特征性多肽[21]。
2. 结果与分析
2.1 9种阿胶制品中阿胶、牛明胶和猪明胶的特征性多肽综合性分析
本实验选取阿胶市场上比较常见的阿胶糕(东阿桃花姬阿胶糕、福牌阿胶糕、同仁堂阿胶糕)、阿胶颗粒(驴胶补血颗粒、阿归养血颗粒、阿胶补血颗粒)和阿胶口服液(复方阿胶浆、阿胶补血口服液和阿胶益寿口服液)为研究对象,分别向其中添加质量分数为1%的猪明胶和牛明胶,再利用HPLC-MS/MS对三类阿胶产品中的阿胶、牛明胶和猪明胶的特征性多肽进行鉴定分析。由表1可知,阿胶糕产品-福牌阿胶糕、东阿桃花姬阿胶糕和同仁堂阿胶糕中检测出212、222和256条明胶特征性多肽;阿胶颗粒产品-驴胶补血颗粒、阿归养血颗粒和阿胶补血颗粒中分别有281、258和200条明胶特征性多肽被鉴定出;阿胶口服液产品-复方阿胶浆、阿胶补血口服液和阿胶益寿口服液中分别鉴定出195、203和165个明胶特征性多肽。如表1所示,在9种阿胶制品(福牌阿胶糕、东阿桃花姬阿胶糕、同仁堂阿胶糕、驴胶补血颗粒、阿归养血颗粒、阿胶补血颗粒、阿胶补血口服液、阿胶益寿口服液、复方阿胶浆)中发现来自阿胶的特征性多肽分别有112、68、193、67、26、24、109、11、10条;同样,21、121、35、23、41、31、19、30、38个牛明胶特征性多肽和79、33、28、191、191、145、75、124、147个猪明胶特征性多肽分别在这些产品中被鉴定出。由此可见,在不同阿胶制品中,所含有的阿胶特征性多肽数量均会存在差别。另外,虽然同样比例的猪、牛明胶被添加到阿胶制品中,但在不同阿胶制品中检测筛选出的猪、牛明胶特征性多肽数量也大不相同。阿胶与猪明胶和牛明胶类似,加热温度、提取时间、酸碱性等会对其分子链的断裂产生不同程度的影响,进而干扰其溯源性[22]。另外,鉴定过程导致的明胶稀释也会降低目标明胶特征性多肽的检出数目[22];不同类型甚至是同类型不同品牌的阿胶制品也可能会因制作工艺和辅料添加的不同及物质间的相互作用而对目标明胶的检出效果产生不同程度的影响。因此,探究不被制作工艺和辅料影响的共有典型明胶特征性多肽对于阿胶制品的溯源鉴定非常关键。
表 1 9种阿胶制品中的特征性多肽Table 1. Characteristic peptides in nine Ejiao products样品 检测出的
总多肽数驴皮明胶的
多肽数猪皮明胶的
多肽数牛皮明胶的
多肽数福牌阿胶糕 212 112 79 21 东阿桃花姬阿胶糕 222 68 33 121 同仁堂阿胶糕 256 193 28 35 驴胶补血颗粒 281 67 191 23 阿归养血颗粒 258 26 191 41 阿胶补血颗粒 200 24 145 31 阿胶补血口服液 203 109 75 19 阿胶益寿口服液 165 11 124 30 复方阿胶浆 195 10 147 38 2.2 9种阿胶制品中阿胶的共有特征性多肽
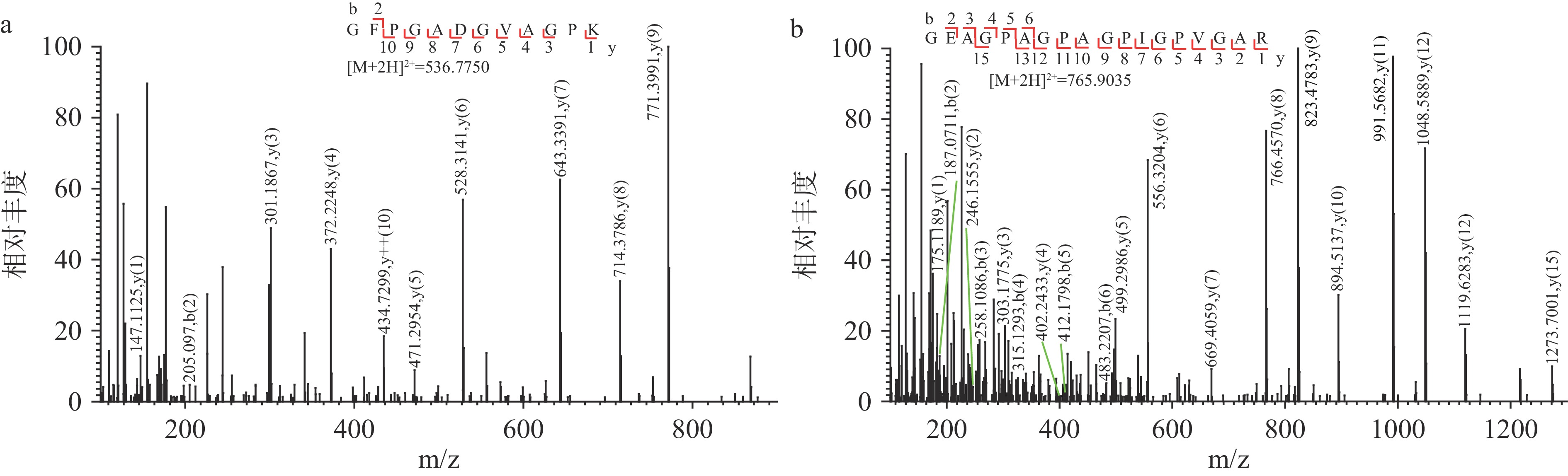
为降低原料基质、阿胶用量等因素对阿胶鉴定的负面影响,筛选不同阿胶制品中阿胶的共有特征性多肽是非常关键的环节。如表2所示,25条来自阿胶的共有特征性多肽在这9种阿胶制品中被筛选出,其中来自于α1链的占比88%。未被修饰的7条共有特征性多肽依次是来自于α2链的相对较短的一条多肽1052GPAGPTGPVGK1062,以及来自α1链的598GVPGPPGAVGPAGK611、612DGEAGAQGPPGPAGPAGER630、1066GEAGPAGPAGPIGPVGAR1083、493GFPGADGVAGPK504、268GFSGLDGAK276和1062SGDRGEAGPAGPAGPIGPVGAR1083。肽段鉴定的难度会随着修饰情况的复杂程度增大而增加,那些未被修饰的肽段在质谱峰鉴定中更易被识别而受人青睐[19,23]。在识别和匹配的过程中,这些未被修饰的肽段在裂解过程中产生的碎片离子更具有优势,能有效提升质谱峰鉴定过程中的容易度,从而提高多肽鉴定的准确度。例如,如图1所示,A、B分别表示9种阿胶制品中共有的2条不含修饰基团的特征性多肽的二级质谱图,这两条来自阿胶α1链的特征性多肽序列为493GFPGADGVAGPK504(m/z 536.77502+)和1066GEAGPAGPAGPIGPVGAR1083(m/z 765.90352+)。这两条多肽序列的一级质谱峰error值均低于2×10−6(表2),且二级质谱图中一系列的y离子和b离子能够准确地辨识多肽的序列,免去了修饰基团带来的鉴定干扰。上述肽段1066GEAGPAGPAGPIGPVGAR1083(图1B)和另外几条多肽829AGETGASGP*PGFAGEK844、1062SGDRGEAGPAGPAGPIGPVGAR1083、881GL*PGVAGSLGE*PGPLGIAGP*PGAR904、1052GPAGPTGPVGK1062(表2)都被课题组前期报道过[12,18,21];Liu等[24]也通过区别不同明胶样品鉴定出阿胶的特征性多肽829AGETGASGP*PGFAGEK844。因此,这些多肽稳定性较高,在阿胶的溯源中可发挥十分重要的作用。
表 2 阿胶的共有特征性多肽Table 2. Common characteristic peptides of donkey gelatin多肽序列 m/z 相对分子质量 实测值 理论值 误差(10−6) α1:538GLTGS*PGSPGPDGK551 621.80612+ 1241.5888 1241.5976 7.09 α1:538GLTGS*PGS*PGPDGK551 629.79932+ 1257.5837 1257.5840 0.22 α1:574GQAGVMGF*PGPK585 581.28982+ 1160.5648 1160.5650 0.15 α1:574GQAGV*MGF*PGPK585 589.28702+ 1176.5598 1176.5594 −0.30 α2:881GL*PGVAGSLGE*PGPLGIAGP*PGAR904 1073.06982+ 2144.1226 2144.1250 1.13 α1:1111GFSGLQGPPG*P*PGS*PGEQGPSGASGPAGPR1140 902.42383+ 2704.2478 2704.2495 0.64 α1:598GV*PGP*PGAVGPAGK611 596.81942+ 1191.6248 1191.6242 −0.50 α1:598GVPGPPGAVGPAGK611 580.82512+ 1159.6350 1159.6356 0.55 α1:598GVPGP*PGAVGPAGK611 588.82242+ 1175.6299 1175.6302 0.28 α1:612DGEAGAQGPPGPAGPAGER630 845.89142+ 1689.7707 1689.7682 −1.45 α1:612DGEAGAQGP*PGPAGPAGER630 853.88932+ 1705.7656 1705.7640 −0.92 α1:268GFSGLDGA*KGDAGPAGPK285 809.39872+ 1616.7794 1616.7828 2.08 α1:865GSAGP*PGATGF*PGAAGR881 730.34972+ 1458.6852 1458.6848 −0.25 α1:415GPSGPQGPSGP*PGPK429 666.82992+ 1331.6470 1331.6452 −1.34 α1:415GPSGPQG*PSGP*PGPK429 674.82912+ 1347.6419 1347.6436 1.26 α1:1066GEAGPAGPAGPIGPVGAR1083 765.90352+ 1529.7950 1529.7924 −1.71 α1:493GFPGADGVAGPK504 536.77502+ 1071.5349 1071.5354 0.47 α1:493GF*PGADGVAGPK504 544.77232+ 1087.5298 1087.5300 0.17 α1:970GF*PGL*PGPSGE*PGK983 672.82502+ 1343.6358 1343.6354 −0.26 α1:970GF*PGL*PGPSGEPGK983 664.82762+ 1327.6408 1327.6406 −0.17 α1:268GFSGLDGAK276 851.42631+ 850.4185 850.4190 0.64 α2:829AGETGASGP*PGFAGEK844 724.83622+ 1447.6579 1447.6578 −0.08 α1:1062SGDRGEAGPAGPAGPIGPVGAR1083 649.33153+ 1944.9766 1944.9726 −2.04 α2:1052GPAGPTGPVGK1062 469.25902+ 936.5029 936.5034 0.56 α1:733GAAGL*PGPK741 392.22152+ 782.4286 782.4284 −0.29 注:*表示氧化修饰;表3~表4同。 2.3 9种阿胶制品中牛明胶的共有特征性多肽
牛明胶作为另外一种常见的哺乳动物明胶被广泛运用生产生活中。为了探索低添加牛明胶特征性多肽的检出效果,每种阿胶制品中均添加质量分数为1%的牛明胶。在明胶混合体系中,低浓度明胶的检出效率与质谱仪的分辨率密不可分。不同质谱仪分辨两个离子质荷比的能力存在高低之分。一般来说,当分辨率大于或等于10000时,该质谱仪将具有高分辨率;而分辨率越高,质谱仪可辩别的物质种类越多,准确性越大。本实验采用的高分辨率质谱仪(m/z 200:一级质谱分辨率70000,二级质谱分辨率:17500)可以从复杂的基质中高效分离不同峰,其鉴定出的目标多肽的相对分子质量也能达到小数点后四位;而低分辨率质谱仪只能取整数。因此,高分辨率质谱仪可为典型明胶的特征性多肽鉴定保驾护航。另外值得注意的是,每条肽段的一级离子质量容差必须保持在±20×10−6;同时,二级离子质量容差则小于0.1 Da,且每条确定下来的多肽的检测结果需满足过滤标准(Mascot Score≥40)。如上文“2.1”所述,经过HPLC-MS/MS的检测,福牌阿胶糕、东阿桃花姬阿胶糕、同仁堂阿胶糕、驴胶补血颗粒、阿归养血颗粒、阿胶补血颗粒、阿胶补血口服液、阿胶益寿口服液和复方阿胶浆中分别有21、121、35、23、41、31、19、30、38个牛明胶特征性多肽,它们共有3条牛明胶特征性多肽,其中2个来自于α1链,1个来自于α2链。这3条多肽一级质谱峰的error值均低于3×10−6,且其序列和修饰基团的确定还通过了二级质谱图的检测,说明这3条多肽鉴定的准确度高,可用于阿胶制品中低含量牛明胶的鉴定分析。如表3所示,在这些共有特征性多肽中,有2个多肽是不包含任何修饰基团的,分别是来自α1链的1062SGDRGETGPAGPAGPIGPVGAR1083和1066GETGPAGPAGPIGPVGAR1083。肽段1066GETGPAGPAGPIGPVGAR1083(m/z为520.94253+)、590GP*PGESGAAGPTGPIGSR607(m/z为527.59333+)和1062SGDRGETGPAGPAGPIGPVGAR1083(m/z为988.50302+)已多次被报道[12,22,25-26],表明其用于牛明胶的溯源鉴定具有较高的稳定性。在本文中,当牛明胶在固形物中的占比低至1%时,依然可以在9种阿胶制品中稳定地检测出这3条牛明胶特征性多肽。一般情况下,在质谱峰中同时找到一种蛋白质的两个多肽可证明该蛋白质的存在[27]。上述结果证明不同剂型阿胶制品中的低含量牛明胶能被HPLC-MS/MS有效鉴别出来。
表 3 牛明胶的共有特征性多肽Table 3. Common characteristic peptides of bovine gelatin样品 m/z 相对分子质量 实测值 理论值 误差(10−6) α1:1062SGDRGETGPAGPAGPIGPVGAR1083 988.50302+ 1974.9871 1974.9914 2.16 α2:590GP*PGESGAAGPTGPIGSR607 527.59333+ 1579.7590 1579.7580 −0.66 α1:1066GETGPAGPAGPIGPVGAR1083 520.94253+ 1559.8056 1559.8056 0.01 2.4 阿胶制品中猪明胶的共有特征性多肽
在工业生产过程中猪明胶被广泛使用[20,28],例如,在欧洲,由猪皮制备而成的食用明胶占到了食用明胶总量的80%[25]。猪明胶被掺入阿胶产品中以次充好多次被爆出,因而,本文进一步研究了阿胶制品中低含量猪明胶(质量分数为1%)的特征性多肽。由表4可知,在9种阿胶制品中猪明胶的共有特征性多肽有14条。如表4所示,5个特征性多肽来自α1链,9个特征性多肽则源自α2链。在这些共有特征性多肽中,不包含任何修饰基团的多肽只有3条,分别是1052GETGPAGPAGPVGPVGAR1069、1048SGDRGETGPAGPAGPVGPVGAR1069和225VGAPGPAGAR234。
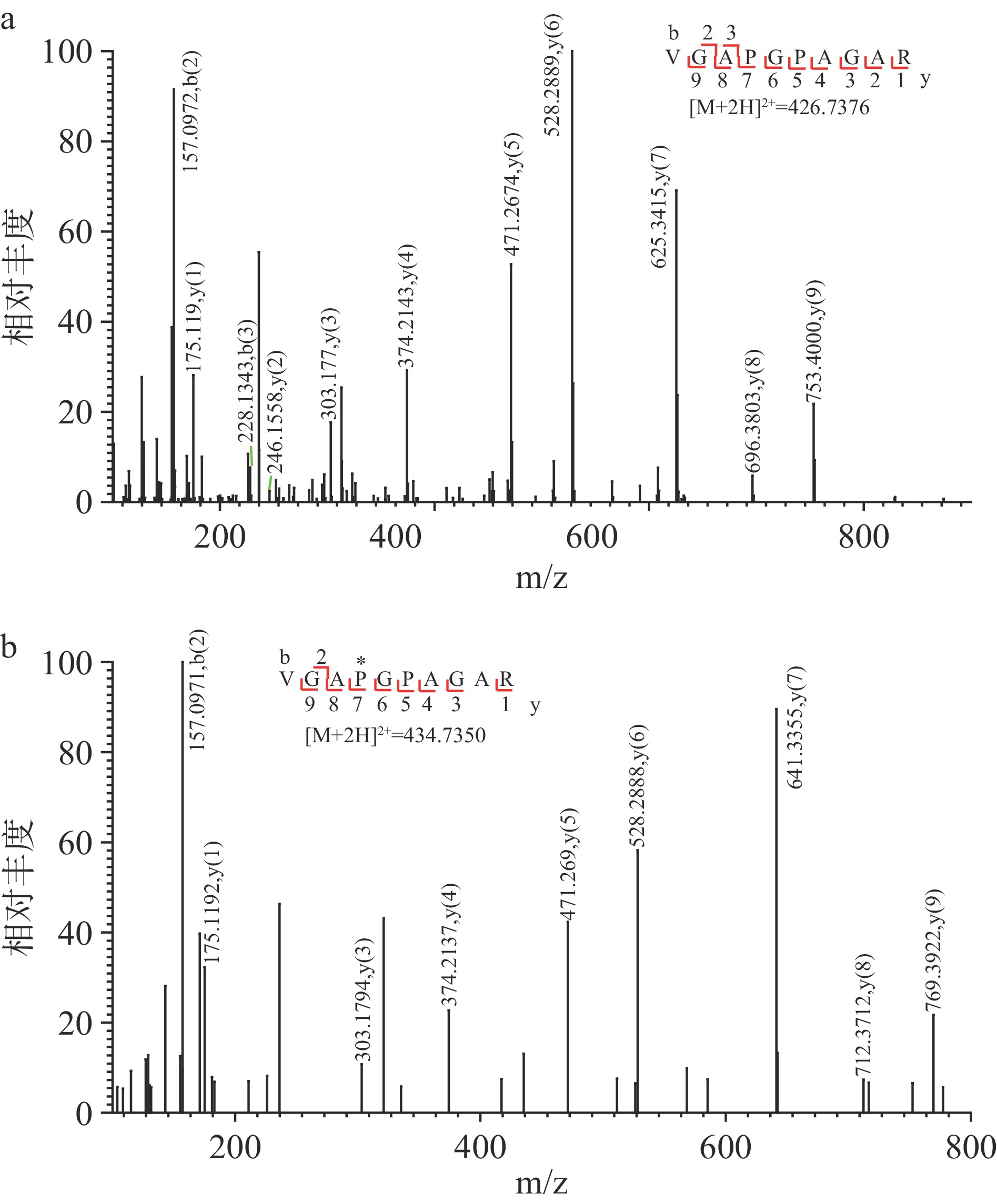
表 4 猪明胶的共有特征性多肽Table 4. Common characteristic peptides of porcine gelatin多肽序列 m/z 相对分子质量 实测值 理论值 误差(10−6) α1:980G*PPGP*MGPPGLAGP*PGESGR999 916.93352+ 1831.8523 1831.8524 0.05 α2:831TGETGASGP*PGFAGEK846 739.84112+ 1477.6685 1477.6676 −0.60 α2:979GE*PGPAGSVGPAGAVGPR996 774.89202+ 1547.7692 1547.7694 0.12 α1:1048SGDRGETGPAGPAGPVGPVGAR1069 981.49372+ 1960.9715 1960.9728 0.66 α2:592GP*PGESGAAGPAGPIGSR609 775.88152+ 1549.7485 1549.7484 −0.05 α1:451GEPG*PTGVQGP*PGPAGEEGKR471 1003.48722+ 2004.9501 2004.9598 4.84 α2:574GI*PGEFGL*PGPAGPR588 485.25263+ 1452.7361 1452.7359 −0.15 α1:1052GETGPAGPAGPVGPVGAR1069 516.27123+ 1545.7900 1545.7917 1.13 α2:225VGAPGPAGAR234 426.73762+ 851.4613 851.4606 −0.86 α2:225VGA*PGPAGAR234 434.73502+ 867.4562 867.4554 −0.97 α2:328GI*PGPAGAAGATGAR342 413.88643+ 1238.6367 1238.6373 0.46 α1:475GE*PGPAGL*PGP*PGER489 718.34452+ 1434.6739 1434.6744 0.34 α2:451GF*PGS*PGNVGPAGK464 637.31412+ 1272.6099 1272.6136 2.93 α2:406GL*PGADGR413 379.69292+ 757.3719 757.3712 −0.86 如表4所示,11个猪明胶的共有特征性多肽(全部来自于α2链)被鉴定出有羟脯氨酸,占共有特征性多肽总数的78.57%。因此,这些翻译后修饰的多肽(尤其是含有脯氨酸残基羟基化修饰)的准确鉴定不容忽视。有报道指出,某些氨基酸经氧化修饰后的质量会和其他氨基酸残基的质量相差细微,可能导致质谱鉴定中多肽的氨基酸组成误判[28]。氨基酸残基的氧化修饰情况既有修饰基团数目的不同,又存在修饰位置的差异。此时,质谱仪是否能准确识别特征性多肽成为关键一环,本实验使用的拥有高分辨率的Orbitrap质量分析器(m/z 200:一级质谱分辨率70000,二级质谱分辨率:17500)能有效解决这种情况[15],如脯氨酸羟基化后的分子量(分子量:131.13)和亮氨酸或异亮氨酸残基(分子量:131.18)很接近,而这细微的质量差能被Orbitrap质量分析器准确分辨[15]。如表3,2条氨基酸序列均为225VGAPGPAGAR234,而氧化修饰的数目分别为0和1个的多肽(如图2)。理论上当多肽质谱峰的价态为+2时,每增加一个氧化修饰,多肽质谱峰就对应增加8 Da。而这2条只相差一个氧化修饰的多肽的m/z分别为426.73762+、434.73502+,其质谱峰之间的实测值差距(7.9974 Da)恰好与理论差值对应。这也能更好地体现高分辨率质谱在明胶鉴定中的高效性。
不同剂型阿胶制品(阿胶糕、阿胶颗粒和阿胶口服液)在加工工艺和辅料添加上都大不相同,但仍有25条共有阿胶特征性多肽被稳定的检测并筛选出来(如表2)。这些阿胶共有特征性多肽能排除基质效应和复杂工艺等外界因素的干扰而被准确鉴定,对阿胶制品中阿胶的真实性检测具有重要意义。另外,在9种阿胶制品中均添加质量分数为1%的猪明胶和牛明胶,但不同阿胶制品中检测到的来自猪明胶和牛明胶的特征性多肽数量均不同(如表1),这可能是加工工艺和原辅料添加情况不同导致阿胶制品物质体系存在差异,进而影响外加明胶(牛明胶和猪明胶)与体系间的相互作用,使得牛/猪明胶在处理过程中的保留情况不同,因而HPLC-MS/MS检测特征性多肽的鉴定结果不同。总体而言,在明胶鉴定过程中,明胶制备工艺、明胶制品加工工艺、食品体系中明胶占比等情况均会影响目标明胶特征性多肽的检出效果。课题组前期研究发现,制备过程中的加热温度、时间、提取次数等工艺因素均会影响明胶特征性多肽的鉴定[18-19],且混合体系中明胶占比(浓度)也将直接影响目标明胶特征性多肽在质谱试验中的识别和检测结果[21]。此外,Yilmaz等[23]报道显示同批次明胶在纯明胶体系和奶制品(酸奶/奶酪/冰淇淋)中检测到的特征性多肽也会有所不同。因此,本文选取了3种阿胶制品类型(9种阿胶制品)为实验对象,排除不同因素带来的鉴定干扰,筛选出共有的牛明胶和猪明胶特征性多肽,为HPLC-MS/MS检测阿胶制品是否掺入其他明胶提供判断依据。
3. 结论
阿胶是滋补良品,其衍生出来的阿胶制品也深受广大消费者的喜爱。与此同时,阿胶掺假事件也让广大消费者对阿胶制品中明胶的来源存有疑虑。因此,本文以9种(3类)常见的阿胶制品为原料,按照质量分数1%的比例向其中分别添加典型明胶(牛明胶和猪明胶),酶解后采用HPLC-MS/MS鉴定阿胶、牛明胶和猪明胶的特征性多肽。经分析,在福牌阿胶糕、东阿桃花姬阿胶糕、同仁堂阿胶糕、驴胶补血颗粒、阿归养血颗粒、阿胶补血颗粒、阿胶补血口服液、阿胶益寿口服液和复方阿胶浆中分别鉴定出了不同数量的阿胶、牛明胶和猪明胶特征性多肽。在这9种不同阿胶制品中共有的阿胶、牛明胶和猪明胶的特征性多肽分别有25、3和14,这些共有特征性多肽能排除加工工艺和添加辅料等复杂条件的干扰而被稳定检测出,因此可作为阿胶制品中明胶来源鉴定的依据。基于本文的研究方法,后期可进一步开展更多阿胶制品(如阿胶枣、阿胶糖、阿胶粉等)中明胶来源的鉴定探索,为阿胶产品的质量保障提供技术支撑。
-
表 1 9种阿胶制品中的特征性多肽
Table 1 Characteristic peptides in nine Ejiao products
样品 检测出的
总多肽数驴皮明胶的
多肽数猪皮明胶的
多肽数牛皮明胶的
多肽数福牌阿胶糕 212 112 79 21 东阿桃花姬阿胶糕 222 68 33 121 同仁堂阿胶糕 256 193 28 35 驴胶补血颗粒 281 67 191 23 阿归养血颗粒 258 26 191 41 阿胶补血颗粒 200 24 145 31 阿胶补血口服液 203 109 75 19 阿胶益寿口服液 165 11 124 30 复方阿胶浆 195 10 147 38 表 2 阿胶的共有特征性多肽
Table 2 Common characteristic peptides of donkey gelatin
多肽序列 m/z 相对分子质量 实测值 理论值 误差(10−6) α1:538GLTGS*PGSPGPDGK551 621.80612+ 1241.5888 1241.5976 7.09 α1:538GLTGS*PGS*PGPDGK551 629.79932+ 1257.5837 1257.5840 0.22 α1:574GQAGVMGF*PGPK585 581.28982+ 1160.5648 1160.5650 0.15 α1:574GQAGV*MGF*PGPK585 589.28702+ 1176.5598 1176.5594 −0.30 α2:881GL*PGVAGSLGE*PGPLGIAGP*PGAR904 1073.06982+ 2144.1226 2144.1250 1.13 α1:1111GFSGLQGPPG*P*PGS*PGEQGPSGASGPAGPR1140 902.42383+ 2704.2478 2704.2495 0.64 α1:598GV*PGP*PGAVGPAGK611 596.81942+ 1191.6248 1191.6242 −0.50 α1:598GVPGPPGAVGPAGK611 580.82512+ 1159.6350 1159.6356 0.55 α1:598GVPGP*PGAVGPAGK611 588.82242+ 1175.6299 1175.6302 0.28 α1:612DGEAGAQGPPGPAGPAGER630 845.89142+ 1689.7707 1689.7682 −1.45 α1:612DGEAGAQGP*PGPAGPAGER630 853.88932+ 1705.7656 1705.7640 −0.92 α1:268GFSGLDGA*KGDAGPAGPK285 809.39872+ 1616.7794 1616.7828 2.08 α1:865GSAGP*PGATGF*PGAAGR881 730.34972+ 1458.6852 1458.6848 −0.25 α1:415GPSGPQGPSGP*PGPK429 666.82992+ 1331.6470 1331.6452 −1.34 α1:415GPSGPQG*PSGP*PGPK429 674.82912+ 1347.6419 1347.6436 1.26 α1:1066GEAGPAGPAGPIGPVGAR1083 765.90352+ 1529.7950 1529.7924 −1.71 α1:493GFPGADGVAGPK504 536.77502+ 1071.5349 1071.5354 0.47 α1:493GF*PGADGVAGPK504 544.77232+ 1087.5298 1087.5300 0.17 α1:970GF*PGL*PGPSGE*PGK983 672.82502+ 1343.6358 1343.6354 −0.26 α1:970GF*PGL*PGPSGEPGK983 664.82762+ 1327.6408 1327.6406 −0.17 α1:268GFSGLDGAK276 851.42631+ 850.4185 850.4190 0.64 α2:829AGETGASGP*PGFAGEK844 724.83622+ 1447.6579 1447.6578 −0.08 α1:1062SGDRGEAGPAGPAGPIGPVGAR1083 649.33153+ 1944.9766 1944.9726 −2.04 α2:1052GPAGPTGPVGK1062 469.25902+ 936.5029 936.5034 0.56 α1:733GAAGL*PGPK741 392.22152+ 782.4286 782.4284 −0.29 注:*表示氧化修饰;表3~表4同。 表 3 牛明胶的共有特征性多肽
Table 3 Common characteristic peptides of bovine gelatin
样品 m/z 相对分子质量 实测值 理论值 误差(10−6) α1:1062SGDRGETGPAGPAGPIGPVGAR1083 988.50302+ 1974.9871 1974.9914 2.16 α2:590GP*PGESGAAGPTGPIGSR607 527.59333+ 1579.7590 1579.7580 −0.66 α1:1066GETGPAGPAGPIGPVGAR1083 520.94253+ 1559.8056 1559.8056 0.01 表 4 猪明胶的共有特征性多肽
Table 4 Common characteristic peptides of porcine gelatin
多肽序列 m/z 相对分子质量 实测值 理论值 误差(10−6) α1:980G*PPGP*MGPPGLAGP*PGESGR999 916.93352+ 1831.8523 1831.8524 0.05 α2:831TGETGASGP*PGFAGEK846 739.84112+ 1477.6685 1477.6676 −0.60 α2:979GE*PGPAGSVGPAGAVGPR996 774.89202+ 1547.7692 1547.7694 0.12 α1:1048SGDRGETGPAGPAGPVGPVGAR1069 981.49372+ 1960.9715 1960.9728 0.66 α2:592GP*PGESGAAGPAGPIGSR609 775.88152+ 1549.7485 1549.7484 −0.05 α1:451GEPG*PTGVQGP*PGPAGEEGKR471 1003.48722+ 2004.9501 2004.9598 4.84 α2:574GI*PGEFGL*PGPAGPR588 485.25263+ 1452.7361 1452.7359 −0.15 α1:1052GETGPAGPAGPVGPVGAR1069 516.27123+ 1545.7900 1545.7917 1.13 α2:225VGAPGPAGAR234 426.73762+ 851.4613 851.4606 −0.86 α2:225VGA*PGPAGAR234 434.73502+ 867.4562 867.4554 −0.97 α2:328GI*PGPAGAAGATGAR342 413.88643+ 1238.6367 1238.6373 0.46 α1:475GE*PGPAGL*PGP*PGER489 718.34452+ 1434.6739 1434.6744 0.34 α2:451GF*PGS*PGNVGPAGK464 637.31412+ 1272.6099 1272.6136 2.93 α2:406GL*PGADGR413 379.69292+ 757.3719 757.3712 −0.86 -
[1] 张金聚, 张英, 孟江, 等. 阿胶历史沿革考[J]. 中国中药杂志,2020,45(10):2464−2472. [ZHANG J J, ZHANG Y, MENG J, et al. A research on the history of Ejiao[J]. China Journal of Chinese Materia Medica,2020,45(10):2464−2472. ZHANG J J, ZHANG Y, MENG J, et al. A research on the history of Ejiao[J]. China Journal of Chinese Materia Medica, 2020, 45(10): 2464-2472.
[2] 王子凤. 中药阿胶临床应用分析及药理作用研究[J]. 基层医学论坛,2020,24(29):4248−4249. [WANG Z F. Analysis of clinical application and pharmacological action of traditional chinese medicine Ejiao[J]. Primary Medicine Forum,2020,24(29):4248−4249. WANG Z F. Analysis of clinical application and pharmacological action of traditional chinese medicine Ejiao[J]. Primary Medicine Forum, 2020, 24(29): 4248-4249.
[3] 田洪芸, 吴鸿敏, 毕婷婷, 等. 阿胶糕中脂肪含量测定方法研究[J]. 食品科技,2020,45(4):282−285. [TIAN H Y, WU H M, BI T T, et al. Study on determination method of fat content in Ejiao cake[J]. Food Technology,2020,45(4):282−285. TIAN H Y, WU H M, BI T T, et al. Study on determination method of fat content in Ejiao cake[J]. Food Technology, 2020, 45(4): 282-285.
[4] 王素利, 张元丽, 张宇. 胶枣补血颗粒治疗肾性贫血血虚证的临床观察[J]. 中华中医药杂志,2019,34(1):401−403. [WANG S L, ZHANG Y L, ZHANG Y. Clinical observation of Jiaozao buxue granules in treating renal anemia with blood deficiency syndrome[J]. Chinese Journal of Traditional Chinese Medicine and Pharmacy,2019,34(1):401−403. WANG S L, ZHANG Y L, ZHANG Y. Clinical observation of Jiaozao buxue granules in treating renal anemia with blood deficiency syndrome[J]. Chinese Journal of Traditional Chinese Medicine and Pharmacy, 2019, 34(1): 401-403.
[5] 闵永峰. 阿胶颗粒对原发性肝癌TACE治疗患者肠道微生态和机体炎症的影响[D]. 济南: 济南大学, 2019. MIN Y F. Effects of Ejiao granules on intestinal microecology and body inflammation in patients with primary liver cancer treated with TACE[D]. Jinan: Jinan Universty, 2019.
[6] 徐琳. 当归及其补血口服液研究[D]. 成都: 西南交通大学, 2015. XU L. Study on Angelica sinensis and its blood-enriching oral liquid[D]. Chengdu: Southwest Jiaotong University, 2015.
[7] 韩彦彬, 彭亮, 赵鹏, 等. 云亭牌阿胶口服液改善大鼠营养性贫血的效果评价[J]. 中国卫生检验杂志,2009,19(8):1765−1766. [HAN Y B, PENG L, ZHAO P, et al. Evaluation of the effect of Yunting brand Ejiao oral liquid in improving nutritional anemia in rats[J]. Chinese Health Laboratory Technology,2009,19(8):1765−1766. HAN Y B, PENG L, ZHAO P, et al. Evaluation of the effect of Yunting brand Ejiao oral liquid in improving nutritional anemia in rats[J]. Chinese Health Laboratory Technology, 2009, 19(8): 1765-1766.
[8] 李志, 陈壁锋, 黄俊明, 等. 阿胶口服液对小鼠细胞免疫和体液免疫功能的影响[J]. 中国卫生检验杂志,2008(7):1426−1427. [LI X, CHEN B F, HUANG J M, et al. Effects of Ejiao oral liquid on cellular immunity and humoral immunity in mice[J]. Chinese Health Laboratory Technology,2008(7):1426−1427. LI X, CHEN B F, HUANG J M, et al. Effects of Ejiao oral liquid on cellular immunity and humoral immunity in mice[J]. Chinese Health Laboratory Technology, 2008(7): 1426-1427.
[9] 邓素坚, 廖雪珍, 黄桂英. 首乌阿胶口服液补血、补肾作用的实验研究[J]. 广东药学院学报,2006(3):294−296. [DENG S J, LIAO X Z, HUANG G Y. Experimental study on the functions of Shouwu Ejiao oral liquid to invigorate blood and kidney[J]. Journal of Guangdong Pharmaceutical University,2006(3):294−296. DENG S J, LIAO X Z, HUANG G Y. Experimental study on the functions of Shouwu Ejiao oral liquid to invigorate blood and kidney[J]. Journal of Guangdong Pharmaceutical University, 2006(3): 294-296.
[10] 陈思秀, 张馨方, 刘玟妍, 等. 阿胶中动物源性DNA提取方法的改进及驴源性成分鉴定[J]. 中国药学杂志,2019,54(22):1840−1845. [CHEN S X, ZHANG X F, LIU W Y, et al. Improvement of extraction method of animal-derived DNA in donkey-hide gelatin and identification of donkey-derived components[J]. Chinese Pharmaceutical Journal,2019,54(22):1840−1845. CHEN S X, ZHANG X F, LIU W Y, et al. Improvement of extraction method of animal-derived DNA in donkey-hide gelatin and identification of donkey-derived components[J]. Chinese Pharmaceutical Journal, 2019, 54(22): 1840-1845.
[11] 那丽丹. 代谢组学技术在阿胶原料及其产品质量控制中的应用初探[D]. 太原: 山西大学, 2015. NA L D. Application of metabolomics technology in quality control of Ejiao raw materials and products[D]. Taiyuan: Shanxi University, 2015.
[12] 沙小梅, 胡姿姿, 涂宗财, 等. ~(18)O标记联合高效液相色谱-高分辨率质谱技术定量测定阿胶中的明胶[J]. 食品科学,2018,39(12):288−294. [SHA X M, HU Z Z, TU Z C, et al. Quantification of gelatin in donkey-hide gelatin by oxygen-18 labelling and high performance liquid chromatography linear ion trap/orbitrap high resolution mass spectrometry[J]. Food Science,2018,39(12):288−294. SHA X M, HU Z Z, TU Z C, et al. Quantification of gelatin in donkey-hide gelatin by oxygen-18 labelling and high performance liquid chromatography linear ion trap/orbitrap high resolution mass spectrometry[J]. Food Science, 2018, 39(12): 288-294.
[13] 乔琰. 动物皮中脂溶性成分的指纹图谱研究[D]. 天津: 天津科技大学, 2015. QIAO Y. Fingerprint study of fat-soluble components in animal skin[D]. Tianjin: Tianjin University of Science and Technology, 2015.
[14] 规范阿胶市场从“健字号”开始[N]. 中国食品报, 2019-07-05(005). Regulating the Ejiao market starts with the "Jianzihao"[N]. China Food News, 2019-07-05(005).
[15] KLEINNIJENHUIS A J, VAN HOLTHOON F L, HERREGODS G. Validation and theoretical justification of an LC-MS method for the animal species specific detection of gelatin[J]. Food Chemistry,2018,243:461−467. doi: 10.1016/j.foodchem.2017.09.104
[16] 焦阳, 汪冰, 周倩倩, 等. 超高效液相色谱-质谱联用技术检测阿胶中马皮源成分[J]. 药物分析杂志,2019,39(5):864−869. [JIAO Y, WANG B, ZHOU Q Q, et al. Detection of horsepi source components in Ejiao by ultra-high performance liquid chromatography-mass spectrometry[J]. Journal of Pharmaceutical Analysis,2019,39(5):864−869. JIAO Y, WANG B, ZHOU Q Q, et al. Detection of horsepi source components in Ejiao by ultra-high performance liquid chromatography-mass spectrometry[J]. Journal of Pharmaceutical Analysis, 2019, 39(5): 864-869.
[17] 陈鸿玉, 李文莉, 李劲平, 等. 高效液相色谱-质谱联用技术测定妇科止带片中阿胶[J]. 海峡药学,2017,29(8):32−35. [CHEN H Y, LI W L, LI J P, et al. Determination of Ejiao in Fuke Zhidai tablets by HPLC-MS[J]. Strait Pharmaceutical Journal,2017,29(8):32−35. doi: 10.3969/j.issn.1006-3765.2017.08.015 CHEN H Y, LI W L, LI J P, et al. Determination of Ejiao in Fuke Zhidai tablets by HPLC-MS[J]. Strait Pharmaceutical Journal, 2017, 29(8): 32-35. doi: 10.3969/j.issn.1006-3765.2017.08.015
[18] 沙小梅, 张丽君, 蒋文丽, 等. 高效液相色谱-高分辨率质谱联用技术鉴定阿胶块中不同胶类的特征性多肽[J]. 食品工业科技,2022,43(4):97−104. [SHA X M, ZHANG L J, JIANG W L, et al. Identification of characteristic peptides of different gelatins in donkey-hide gelatin lump by high performance liquid chromatography-high resolution mass spectrometry[J]. Science and Technology of Food Industry,2022,43(4):97−104. SHA X M, ZHANG L J, JIANG W L, et al. Identification of characteristic peptides of different gelatins in donkey-hide gelatin lump by high performance liquid chromatography-high resolution mass spectrometry[J]. Science and Technology of Food Industry, 2022, 43(4): 97-104.
[19] SHA X M, HU Z Z, YE Y H, et al. Effect of extraction temperature on the gelling properties and identification of porcine gelatin[J]. Food Hydrocolloids,2019,92:163−172. doi: 10.1016/j.foodhyd.2019.01.059
[20] ZHANG Q T, TU Z C, WANG H, et al. Improved glycation after ultrasonic pretreatment revealed by high-performance liquid chromatography-linear ion trap/orbitrap high-resolution mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2014,62(12):2522−2530. doi: 10.1021/jf5002765
[21] SHA X M, ZHANG L J, TU Z C, et al. The identification of three mammalian gelatins by liquid chromatography-high resolution mass spectrometry[J]. LWT-Food Science and Technology,2018,89:74−86. doi: 10.1016/j.lwt.2017.10.001
[22] SCHRIEBER R, GAREIS H. Gelatine handbook: Theory and industrial practice[M]. Wiley-VCH Verlag GmbH & Co. KGaA, 2007.
[23] YILMAZ M T, KESMEN Z, BAYKAL B, et al. A novel method to differentiate bovine and porcine gelatins in food products: Nano UPLC-ESI-Q-TOF-MS E based data independent acquisition technique to detect marker peptides in gelatin[J]. Food Chemistry,2013,141(3):2450−2458. doi: 10.1016/j.foodchem.2013.05.096
[24] LIU R, HUANG Y, XU H K, et al. A strategy for identifying species-specific peptide biomarkers in deer-hide gelatin using untargeted and targeted mass spectrometry approaches[J]. Analytica Chimica Acta,2019,1092:32−41. doi: 10.1016/j.aca.2019.09.064
[25] DEMIRHAN Y, ULCA P, SENYUVA H Z. Detection of porcine DNA in gelatine and gelatine-containing processed food products-Halal/Kosher authentication[J]. Meat Sci,2012,90(3):686−689. doi: 10.1016/j.meatsci.2011.10.014
[26] 孙坤, 杨帆, 孔英俊, 等. 基于生物质谱的胶原蛋白定量检测方法[J]. 生物工程学报,2015,31(11):1660−1668. [SUN K, YANG Y, KONG Y J, et al. Collagen quantitation by detection of marker peptides with HPLC-MS[J]. Chinese Journal of Biotechnology,2015,31(11):1660−1668. SUN K, YANG Y, KONG Y J, et al. Collagen quantitation by detection of marker peptides with HPLC-MS[J]. Chinese Journal of Biotechnology, 2015, 31(11): 1660-1668.
[27] GRUNDY H H, REECE P, BUCKLEY M, et al. A mass spectrometry method for the determination of the species of origin of gelatine in foods and pharmaceutical products[J]. Food Chemistry,2016,190:276−284. doi: 10.1016/j.foodchem.2015.05.054
[28] SU S N K, HYEON G L, HYUNSOOK K. Development and comparison of a porcine gelatin detection system targeting mitochondrial markers for Halal authentication[J]. LWT-Food Science and Technology,2018,97:697−702. doi: 10.1016/j.lwt.2018.07.062
-
期刊类型引用(1)
1. 王博,张维清,高涵,王超,刘玉春,郭超. 不同温度发酵的全麦酸面团质量评价及乳酸菌多样性分析和选育. 食品工业科技. 2025(08): 182-191 .  本站查看
本站查看
其他类型引用(2)





 下载:
下载:
 下载:
下载:
