Effects of Portulaca oleracea Extracts on Gelation and Emulsification Properties of Pork Myofibrillar Proteins
-
摘要: 本研究以猪肉肌原纤维蛋白(Myofibrillar proteins,MPs)为研究对象,探究马齿苋提取物(Portulaca oleracea extracts,PE)对其凝胶和乳化特性的影响,建立肌原纤维蛋白-Fenton氧化体系(0.0049 g/L FeCl3、0.0176 g/L抗坏血酸、5 mmol/L H2O2),加入不同浓度PE(0.00、2.00、4.00、8.00 mg/mL),通过分析肌原纤维蛋白凝胶和乳化特性的变化,研究氧化条件下PE对猪里脊肉中肌原纤维蛋白功能特性的影响。结果表明:与氧化对照组相比,PE极显著降低凝胶的蒸煮损失率(P<0.01),提高了凝胶的持水性(P<0.01),当PE浓度为4.00 mg/mL时蒸煮损失率较氧化组降低6.72%,持水性较氧化对照组提高了11.98%。但是,PE的加入会显著降低凝胶的白度(P<0.05),且浓度越高,白度值越小。PE的加入使得凝胶的储能模量(G')和损耗模量(G'')增大。PE浓度为4.00 mg/mL时,凝胶微观结构较氧化后变得更规则有序,且该浓度的PE使凝胶的硬度和弹性分别提高了10.10%和7.16%。SDS-PAGE结果显示PE与蛋白质之间的交联是可以被还原的,同时PE极显著地提高了蛋白质的乳化活性和乳化稳定性(P<0.01)。综合各指标数据,4.00 mg/mL PE能够有效抑制MPs氧化并改善蛋白功能特性。Abstract: This study aimed to investigate the effects of Portulaca oleracea extracts (PE) on the gelation and emulsification properties of pork myofibrillar proteins (MPs). A myofibrillar protein-Fenton oxidation system (0.0049 g/L FeCl3, 0.0176 g/L ascorbic acid, 5 mmol/L H2O2) was established, and different concentrations of PE (0.00, 2.00, 4.00, 8.00 mg/mL) were added. The changes in gelation and emulsification properties of MPs were analyzed to assess the impact of PE on the functional characteristics of MPs in pork tenderloin under oxidative conditions. The results demonstrated that PE significantly reduced the cooking loss of the gel (P<0.01) and improved its water-holding capacity (P<0.01) compared with the oxidation control group. Specifically at a concentration of 4.00 mg/mL, the addition of PE resulted in a 6.72% decrease in cooking loss and a 11.98% increase in water-holding capacity compared with the oxidation control group. However, the addition of PE led to a significant decrease in the whiteness of the gel (P<0.05), with the degree of whiteness being inversely related to the concentration of PE. Furthermore, the addition of PE increased the storage modulus (G') and loss modulus (G'') of the gel. At a concentration of 4.00 mg/mL PE, the microscopic structure of the gel exhibited greater regularity and order than that after oxidation, with an increase of 10.10% in hardness and 7.16% in elasticity. SDS-PAGE results indicated that the cross-linking between PE and proteins could be reduced, and PE significantly enhanced the emulsifying activity and emulsifying stability of the proteins (P<0.01). Overall, based on the comprehensive findings, it can be concluded that 4.00 mg/mL PE effectively inhibits the oxidation of MPs and improves the functional characteristics of proteins.
-
肉蛋白是饮食中重要的优质蛋白质来源,它容易受到食品加工过程中产生的氧化自由基的攻击,导致其物理化学和结构特征发生变化,从而改变肉及肉制品的功能品质,如胶凝能力和乳化性能[1−2]。肌原纤维蛋白可以从侧面反映出肉的某些特性(如弹性和嫩度)。在肉制品加工过程中,肌原纤维蛋白的氧化可能会对其功能特性产生影响,氧化程度不同,造成的影响也不同,轻度氧化可能会有益于肌原纤维蛋白的功能特性,但过度氧化则可能会破坏其结构和功能,从而对肉制品的品质与营养造成不良影响[3]。针对以上情况,目前肉制品的抗氧化主要添加抗氧化剂,包括合成抗氧化剂和天然抗氧化剂。合成抗氧化剂如:丁基羟基茴香醚(BHA),二丁基羟基甲苯(BHT)等[4],但这些抗氧化剂也可能带来潜在的危害,例如引发过敏反应、致癌、致畸等[5]。天然抗氧化剂如天然提取物、香精、香油、植物多酚等正在被研究用于替代合成抗氧化剂,以满足肉制品的绿色加工和消费者的健康需求[6]。研究结果显示,植物多酚有良好的自由基清除能力,能够改善肉制品品质,抑制细菌繁殖,减少脂肪的氧化,并且可以有效地延长食品的保质期[7]。
马齿苋(Portulaca oleracea L.)是广泛分布于热带和亚热带地区的一种药食同源植物,属于马齿苋科,马齿苋属,一年生肉质草本植物,又俗称为长寿菜、蚂蚁菜和五行草等,具有杀菌、解热、杀虫等功效[8]。马齿苋中含有较多活性成分,如黄酮类、多酚类、生物碱类、萜类、多糖类及有机酸类[9]。现代药理研究表明马齿苋具有抗炎、抗氧化、抗肿瘤、降血糖、降血脂和保护肝脏等作用[10]。现有研究表明马齿苋提取物(Portulaca oleracea extracts,PE)中的黄酮类多酚物质是一种有效的自由基清除剂,具有较强的还原能力与良好的抗氧化能力,可抑制油脂的氧化酸败[11]。WANG等[12]将马齿苋提取物加入兔肉馅饼中,发现马齿苋提取物可以有效抑制脂肪氧化、微生物生长,使兔肉具有更好的感官指标。FAN等[13]将马齿苋提取物加入基于壳聚糖和淀粉的活性包装膜中,结果表明该膜具有良好的抗氧化效果,能够抑制脂质的氧化,延长肉类的保质期。马齿苋提取物对肌原纤维蛋白的氧化干预机制比较复杂,其对猪肉肌原纤维蛋白凝胶特性和乳化特性影响的研究甚少,缺乏深入研究。
因此,本文以猪肉肌原纤维蛋白为研究对象,探究不同浓度的马齿苋提取物对肌原纤维蛋白凝胶和乳化特性的影响,进而探究马齿苋提取物对MPs氧化和乳化凝胶特性调控机制,为有效调控蛋白质氧化程度、提高肉类及其制品品质提供理论和技术支持。
1. 材料与方法
1.1 材料与仪器
实验所用原材料选用猪背最长肌 购买于重庆市南岸区五公里人人乐超市;马齿苋提取物(PE,总酚含量43.3 mg GAE/g) 常青藤生物工程有限公司;大豆油 福临门有限公司;3,5-二氧杂-1,8-辛二胺四乙酸(Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid,EGTA,AR)、抗坏血酸(AR) 上海阿拉丁生化科技股份有限公司;哌嗪-1,4-二乙磺酸(piperazine-1,4-bisethanesulfonic acid,PIPES,AR)、三氯化铁、叔丁醇(AR) 上海泰坦科技股份有限公司;水溶性维生素E(Trolox) 北京索莱宝科技有限公司;30%过氧化氢、氯化钠(AR) 重庆川东化工(集团)有限公司;溴酚蓝(AR) 天津市科密欧化学试剂有限公司;磷酸二氢钠(AR)、氯化镁(AR) 成都市科隆化学品有限公司。
S3500激光粒度仪 美国Microtrac公司;CR-10Plus色差仪 日本柯尼卡美能达;Ultra-Turrax T25高速匀浆机 德国 IKA-WERKE;MARS40(哈克)旋转流变仪 赛默飞世尔科技有限公司;Universal TA质构仪 上海腾拔仪器科技有限公司;S-8020扫描电镜 日本 Hitachi 公司;UV-1800 PC紫外可见分光光度计 上海高致精密仪器有限公司;DYCZ-MINNI2电泳仪 北京六一生物科技有限公司;TGL-20M高速台式冷冻离心机 湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 样品处理
新鲜猪背最长肌,剔除可见的脂肪组织后,顺着肌纤维方向切成100 g左右的肉条,真空密封包装后,储存于4 ℃下备用。
1.2.2 肌原纤维蛋白(MPs)提取
猪肉肌原纤维蛋白的提取参考PARK等[14]的方法并结合实际进行修改,实验方法如下:将切小块的里脊肉加入其4倍体积的蛋白提取液(10 mmol/L磷酸钠,0.1 mol/L氯化钠,2 mmol/L氯化镁,1 mol/L EGTA,pH7.0),绞肉机绞成肉糜;过滤掉肉浆里的结缔组织,将滤液离心(4 ℃,8000 r/min,10 min),去掉滤液,取下层沉淀,再加入4倍体积蛋白提取液,均质(6000×g,1 min)、离心,重复三次;沉淀加入4倍体积0.1 mol/L NaCl溶液均质后,用四层纱布过滤,去除滤液,得到的沉淀物即为MPs,提取过程在0~4 ℃下完成。所得的MPs在4 ℃条件下保存,48 h内使用完毕,蛋白质浓度使用双缩脲法测定。
1.2.3 样品制备
参考曹云刚[15]的方法并作适当修改,将提取的MPs重悬于15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH6.25),以此为氧化底物。实验样品设为5组:第一组为空白组(Non-Ox),不加入任何抗氧化剂,且用PIPES缓冲液替代Fenton氧化体系;第二组:加入Fenton氧化体系(0.0049 g/L FeCl3、0.0176 g/L抗坏血酸、5 mmol/L H2O2)和0.00 mg/mL PE溶液;第三组:加入Fenton氧化体系和2.00 mg/mL的PE溶液;第四组:加入Fenton氧化体系和4.00 mg/mL的PE溶液;第五组:加入Fenton氧化体系和8.00 mg/mL的PE溶液。MPs的最终浓度为40 mg/mL。将各实验组放入冰箱4 ℃恒温氧化12 h。
1.2.4 凝胶制作及品质测定
将氧化完成的样品取出加入1 mL 1 mmol/L的Trolox终止液,摇匀,参考费英等[16]的方法并做出适当改进,方法如下:将样品在80 ℃恒温水浴条件下加热20 min,加热完成后在冰水混合物中冷却至室温,由此制得凝胶样品。将样品放入4 ℃冰箱过夜,凝胶经过夜后在室温下平衡2 h后测定性能。
1.2.4.1 凝胶蒸煮损失测定
蒸煮损失的测定根据LI等[17]的测定方法并稍作修改:将过夜后的凝胶样品拿出,先测定出离心管和样品的重量,用小勺轻轻地将凝胶与离心管壁分开,在滤纸上倒放30 min,蒸煮汁液全部排出后称量凝胶及离心管的质量。
蒸煮损失按公式(1)计算:
蒸煮损失(%)=m2−m3m2−m1×100 (1) 式中:m1:离心管质量(g);m2:样品和离心管质量(g);m3:去除水后样品和离心管质量(g)。
1.2.4.2 凝胶持水性测定
分别称取10 g制得的蛋白凝胶于离心管中,称量此时离心管的重量,记为m1,然后进行离心(4 ℃,8000 r/min,10 min),将离心后析出在离心管中的水用滤纸吸干,再称量此时离心管的重量,记为m2。按照公式(2)计算:
持水性(%)=m2m1×100 (2) 1.2.4.3 凝胶白度测定
参考夏秀芳等[18]的方法,将制得的凝胶放在室温下平衡2 h,用色差计测定凝胶色差,平行测定三次,取平均值,并记录L*、a*、b*。凝胶白度按公式(3)计算:
白度值=100−√(100−L∗)2+(a∗)2+(b∗)2 (3) 1.2.4.4 凝胶动态流变测定
参考LIN等[19]的方法。先将凝胶样品低速离心做脱气处理:4 ℃,1000 r/min,1 min。使用振荡温度扫描测试模式,转子类型为P20/Ti-01210465。测试参数为:频率为0.1 Hz,最大应变力2%,上下板缝1 mm,以2.1 ℃/min从20 ℃升温到80 ℃加热样品。在20 ℃保温20 min,用硅油密封平板外蛋白质和空气的接触位置,以防加热导致蛋白液蒸发,记录20~80 ℃的升温曲线。每个样品平行测定3次,记录储能模量(G')和损耗模量(G'')。
1.2.4.5 凝胶质构测定
参考伯朝英等[20]的方法,将制好的凝胶样品放入培养皿,利用质构仪进行测定,测试参数:探头型号:P/75,测试前速率2 mm/s;测试速率1 mm/s;测试后速率1 mm/s;压缩比50%;引发力5 g,样品平行测定三次。
1.2.4.6 SDS-PAGE凝胶电泳测定
参考熊杰[21]的方法,使用的电泳胶为12%的分离胶和15%的浓缩胶,将样品稀释为10 mg/mL,取100 μL的上样缓冲液和400 μL的蛋白样液(V:V=1:4),混合均匀后在沸水中煮制6 min,样品经冷却恢复至室温后上样,通过添加或不添加5%的β-巯基乙醇进行SDS-PAGE凝胶电泳。在上样的第一个小孔加入10 μL Marker,而后依次加入15 μL的样品。电泳前30 min浓缩胶时,电压60 V,电流20 mA,当样品至下方分离胶后改变电流与电压,电压120 V,电流40 mA。电泳完成后使用考马斯亮蓝染色1 h,脱色液为冰乙酸:乙醇(V:V=2:1),摇床脱色12 h后拍照。
1.2.4.7 凝胶微观结构测定
根据JIA等[22]的实验方法并做修改,将样品大小修整为5 mm×2 mm×2 mm,用2.5%的戊二醛(pH6.8)浸泡24 h,过夜固定;倒掉戊二醛,用0.1 mol/L,pH6.8的磷酸缓冲液冲洗10 min,重复3次;依次增大乙醇溶液的浓度(50%、70%、80%、90%)进行脱水,每次重复3遍;接着用无水乙醇脱水3次,每次10 min;氯仿脱脂1 h;用无水乙醇:叔丁醇(1:1,V:V)以及叔丁醇,各进行一次置换,每次15 min;样品冷冻干燥36 h后,用离子溅射仪在样品表面镀一层厚度为10 nm的金膜后观察样品微观结构(电压15.0 kV,放大倍数800倍)。
1.2.5 乳化液的制作及品质测定
参考AGYARE等[23],将样品用PIPES缓冲溶液稀释4倍后,加入一定体积的大豆油(蛋白样液:大豆油=4:1,V:V),随后在8000 r/min条件下均质1 min,由此制得乳化液。
1.2.5.1 乳化性能测定
参考ZHAO等[24]的方法并做适当修改,吸取100 μL均质后的乳化液加入10 mL 1%的SDS溶液,吸取距底部1 mm处的匀浆液,在波长500 nm处测定吸光值A0,将其静置10 min后再重复上述步骤测吸光值A10。采用公式(4)和(5)分别计算:
EAI(m2/g)=2×3.303C×(1−φ)×104×N×A0 (4) ESI(%)=A10A0×100 (5) 式中:EAI:乳化活性(m2/g);ESI:乳化稳定性(%);C:MPs浓度(g/mL);φ:乳液中油的体积比;N:稀释倍数。
1.2.5.2 乳化粒度测定
使用激光粒度分析仪测定肌原纤维蛋白粒度分布。按照HU等[25]的方法并加以修改,用PIPES缓冲液将蛋白浓度调整为5 mg/mL,加入激光粒度分析仪的微量检测皿中,设置参数为物质折射率1.52,介质为水,介质折射率为1.33,待浓度达到正常后开始测试。
1.3 数据处理
每组实验设计三个平行,使用Excel和Origin 2021整理数据和作图,使用 SPSS 23.0进行ANOVA分析,差异显著水平为显著:P<0.05,极显著:P<0.01。
2. 结果与分析
2.1 凝胶特性变化
2.1.1 凝胶蒸煮损失
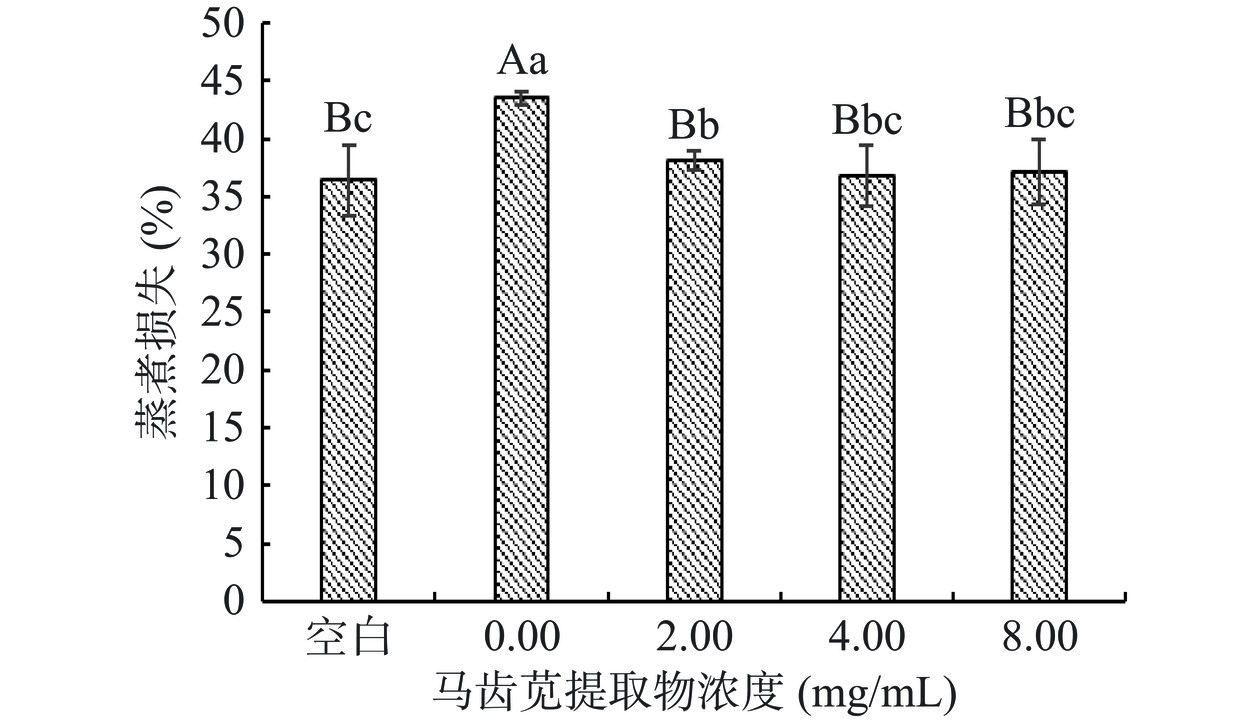
蒸煮损失率是评价蛋白质凝胶性能的重要指标。蒸煮损失率低表明蛋白质凝胶内部保水能力强,间接证明蛋白质凝胶网络结构致密[26]。如图1所示,与空白组相比,Ox+0.00 mg/mL PE组的蒸煮损失率上升了7.09%,两组间差异极显著(P<0.01)。与Ox+0.00 mg/mL PE组相比,添加不同浓度PE后,凝胶蒸煮损失率极显著降低(P<0.01)。当PE添加量为4.00 mg/mL时,凝胶的蒸煮损失率下降最多,为6.72%,继续增大PE浓度,凝胶的蒸煮损失率变化不显著(P>0.05)。这可能是马齿苋提取物中的多酚物质能与蛋白质中的α或ε-NH2产生共价交联作用,在较大范围内产生多酚-蛋白质复合物[27],使得蛋白质与水的结合更加牢固,从而使得蒸煮损失率较未添加PE时降低。孙科等[28]研究发现鱼糜凝胶的蒸煮损失率随着苹果多酚的添加量增多,呈现先下降后上升的趋势。因此,添加PE后,可能会由于PE中的酚类物质与蛋白质之间发生的相互作用,从而降低肌原纤维蛋白凝胶的蒸煮损失率。
2.1.2 凝胶持水性
持水性是食品凝胶的一个重要特性,因为水分从凝胶网络中分离会影响其质地。从图2可以看出,与空白组相比,Ox+0.00 mg/mL PE组的持水性极显著降低了16.00%(P<0.01),这可能是氧化使得蛋白质结构松散,或是氧化产生的羟基自由基诱导α-螺旋的解绕,导致氢键断裂,从而使蛋白质凝胶的持水性降低[29]。Ox+2.00、Ox+4.00、Ox+8.00 mg/mL PE组的持水性较氧化对照组分别极显著提高了11.07%、11.98%、19.97%(P<0.01)。PE增加蛋白氧化凝胶的持水性,可能是因为PE有较好的自由基清除能力,延缓了蛋白质的氧化过程[30]。此外,巯基和醌类物质的适度交联会使得蛋白质通过酚类连接,形成多酚-蛋白质聚合物,有益于凝胶的形成[31],马齿苋提取物中的酚类物质可能与蛋白质发生上述反应,改善蛋白质凝胶结构,使蛋白质结构变得紧密有规则,从而提高凝胶的持水性。
2.1.3 凝胶白度
蛋白质凝胶的白度值会影响其物理品质[32]。如图3所示,经氧化后,蛋白质凝胶的白度下降,这可能是氧化使得过氧自由基增加,从而使得凝胶的白度降低[33]。加入PE后,随着PE浓度的增加,凝胶白度在不断下降,PE浓度为8.00 mg/mL时,白度值由空白组的94.25极显著下降至90.71(P<0.01);与Ox+0.00 mg/mL PE组相比,PE添加浓度为2.00和4.00 mg/mL时,白度值较氧化组的变化不显著(P>0.05),当PE浓度为8.00 mg/mL时,白度值极显著下降了2.83(P<0.01)。这可能是因为PE溶液本身呈淡黄绿色,且溶液颜色随着PE浓度增大而加深,从而增大凝胶黄度b*值,影响凝胶的白度值,导致凝胶白度值随着PE浓度增加而下降,且在8.00 mg/mL时出现极显著的下降(P<0.01)。WANG等[12]研究发现增加PE的掺入水平会导致兔肉馅饼的L*、a*值减少,而b*值增大,从而减少了兔肉馅饼的白度值。
2.1.4 凝胶动态流变
储能模量(G')表示凝胶形成过程中的弹性特征,损耗模量(G'')表示凝胶形成过程中的黏性特征。当蛋白质形成三维网络空间结构时,G'值和G''值可以反映出蛋白质的交联、折叠和聚集。在加热过程中,氧化系统中的MPs溶液的G'值和G''值如图4、图5所示。G'值总体在45~53 ℃范围呈现上升趋势,这表明MPs溶液开始形成凝胶的网络结构;温度在53~60 ℃时,G'值下降,这是由于高温使得肌球蛋白部分发生变性,肌球蛋白丝的流动性增强,破坏了最初蛋白质凝胶形成的网络结构[34]。60 ℃以上的高温环境会使蛋白质结构变性而展开,蛋白质之间发生交联作用,形成不可逆的凝胶网络结构[35],G'值呈现持续增大。G'值在加热过程中,MPs经氧化后G'值较空白组增大,在凝胶形成的最终阶段,G'值仍大于空白组,说明MPs在该氧化程度下氧化后有利于蛋白凝胶的形成。加入PE后G'值较空白组和氧化组均增大,说明PE的加入促进了形成更具弹性的蛋白凝胶网络结构,这可能是PE促进大部分肌球蛋白分子展开,增强了蛋白与蛋白以及蛋白与PE之间的交联作用[36]。此外,马齿苋提取物对肌原纤维蛋白氧化具有保护作用,有益于形成更稳定的蛋白凝胶网络结构[30]。在图5中G''的趋势是先增大后减小,大体呈现一个“人”字分布状态,与G'相似,温度为53 ℃时最有利于凝胶的形成,这时的凝胶黏性达到最大值,随着温度的上升,凝胶蛋白开始变性,蛋白结构开始展开,凝胶黏度也逐渐变小。在PE含量为8.00 mg/mL时G''值最大,说明高浓度的马齿苋提取物会使凝胶蛋白的胶黏性增加,这与后面的凝胶质构测定中的胶黏性趋势相似。
2.1.5 凝胶质构
蛋白凝胶的硬度、弹性、胶黏性、回复性是凝胶性能好坏的重要指标。从表1可以看出,与空白组比较,蛋白质氧化后凝胶的硬度、胶黏性和回复性分别显著下降了32.40%、43.13%和17.14%(P<0.05),而弹性的变化不显著(P>0.05)。添加PE后,凝胶的硬度随着PE浓度的增大而增大,当PE浓度为8.00 mg/mL时,凝胶的硬度值最大,较0.00 mg/mL时增加了28.63%,这可能是一定浓度的PE中的酚类物质可以抑制蛋白质的氧化,从而增强凝胶的网络结构和提升凝胶的质构特性[21]。添加PE后,凝胶的胶黏性和回复性较氧化后总体呈现上升趋势但差异不显著(P>0.05)。凝胶的弹性在PE浓度为4.00 mg/mL时较0.00 mg/mL时显著增加(P<0.05),说明适量PE的加入有利于形成具有弹性的蛋白质凝胶。
表 1 马齿苋提取物对肌原纤维蛋白凝胶质构的影响Table 1. Effect of PE on gel texture of myofibrillar protein指标 空白 马齿苋提取物添加量(mg/mL) 0.00 2.00 4.00 8.00 硬度(g) 535.7±46.54Aa 362.15±24.46Bb 369.56±39.89Bb 398.73±5.29ABb 465.84±27.34ABab 弹性(MPa) 247±4.04Bb 256±6.81ABb 251.67±4.41Bb 274.33±2.33Aa 248.33±5.24Bb 胶黏性(g) 147.87±24.65Aa 84.10±6.1Ab 92.25±12.99Ab 90.29±3.45Ab 111.49±6.75Aab 回复性(MPa) 0.35±0.01Aa 0.29±0.01Bb 0.30±0.02Bb 0.31±0.01ABb 0.32±0.02ABb 注:同行肩注大写字母表示差异极显著(P<0.01),小写字母表示差异显著(P<0.05)。 2.1.6 凝胶电泳
肌原纤维蛋白是一种复合蛋白质,它主要有以下几个条带:肌球蛋白重链(MHC,约135 kDa)、副肌球蛋白(PM,100~135 kDa),肌动蛋白(Actin,35~48 kDa),以及肌球蛋白轻链(MLC,15~24 kDa)[37]。如图6A所示,肌原纤维蛋白分子量分布主要集中在75~180和35~48 kDa范围内。如图6B所示,在未添加β-巯基乙醇的MPs中,MHC和Action条带强度减弱,这表明蛋白质聚合物含量的增加,从而导致条带减弱[38],MHC和Actin单体的含量减少,且随着PE浓度的增加,聚合物的含量增加。从图6A、图6B可以看出,添加β-巯基乙醇后,MHC和Actin单体含量增加,说明蛋白质和PE的结合是可以被还原的。肌原纤维蛋白聚合物含量增多可能是因为PE会与羟基自由基作用形成酚羟基,当PE浓度增大时,多余的酚羟基与蛋白质相互作用,导致交联增多[39]。
2.1.7 凝胶微观结构
不同马齿苋提取物添加量对MPs混合凝胶微观结构的影响如图7所示。从图7电镜图可以看出,空白组的凝胶结构比较光滑、致密、孔径小,经过氧化后,凝胶表面变得粗糙、孔径也变大,结构变得松散,添加PE后,蛋白质的凝胶网络结构得到了一定程度的改善,PE浓度为2.00和4.00 mg/mL时,凝胶表面较氧化对照组更加光滑、紧致,孔径也较小,蛋白质凝胶网络结构更加规则有序,表明PE的添加可以减少氧化对MPs凝胶结构的破坏。PE对凝胶微观结构的改善也进一步解释了PE提高凝胶持水性的作用。
2.2 乳化特性变化
2.2.1 乳化活性
乳化活性指蛋白质在水与油互相融合过程中单位重量内稳定油与水界面的能力,是评定蛋白质乳化性能的一个重要指标。如图8所示,肌原纤维蛋白经氧化后,乳化活性极显著增加(P<0.01)。这可能是蛋白质经适当氧化后,结构展开,较多亲水和亲油基团暴露出来,使得油水发生较好的交联作用,进而提高了乳化活性[40]。添加PE后,随着PE浓度的增加,蛋白质的乳化活性呈上升趋势,且组间差异显著(P<0.05),当PE浓度为8.00 mg/mL时,乳化活性提高最多。这可能是PE中的多酚物质与MPs发生相互作用,提高界面膜的稳定性,从而提高了MPs的乳化活性[41],且与氧化组相比,PE的加入更有利于蛋白质乳化活性的提高。
2.2.2 乳化稳定性
乳化稳定性是指蛋白质能够在外界的干扰下维持油水不分离,保持乳化液稳定的抗应变能力。如图9所示,空白组的乳化稳定性最低,氧化可以极显著地增加蛋白质的乳化稳定性(P<0.01)。添加PE后,乳化稳定性与乳化活性的变化趋势相似。PE浓度为2.00、4.00、8.00 mg/mL时,与0.00 mg/mL PE相比乳化稳定性由20.58%分别极显著增加至33.13%、39.60%和48.38%(P<0.01)。这可能是适度的氧化会使蛋白质的亲水基团和亲油基团暴露,从而有利于乳液的稳定[42];加入PE后,乳化稳定性也处于上升趋势,这表明PE可能对维持乳化液稳定有促进作用。
2.2.3 乳化粒度
乳化粒度是指乳化液中分子的大小。PE对肌原纤维蛋白乳化粒度的影响如图10所示,MPs经氧化后,体积等效平均粒度(D4,3)和表面积等效平均粒度(D3,2)极显著增加(P<0.01)。这可能是氧化使得蛋白质分子聚集以及二硫键的形成所造成的[43],加入PE后,D4,3和D3,2较空白组也极显著增加(P<0.01),当PE浓度为4.00 mg/mL时,D4,3和D3,2较空白组分别增加了10.98%和14.76%,这可能是PE与蛋白质分子发生了交联作用生成大分子聚集体。而与0.00 mg/mL组相比,添加不同浓度PE后,乳化粒度的变化不显著(P>0.05)。乳化粒度结果说明,氧化会使得乳液粒度增加,而PE的加入对氧化后乳液粒度的影响效果不显著。
3. 结论
PE对猪肉肌原纤维蛋白的凝胶性能和乳化特性有一定的影响。氧化后,蛋白质凝胶的蒸煮损失率升高,持水性、硬度、胶黏性、回复性下降,使得肉的品质变差,PE添加浓度为4.00 mg/mL时,凝胶的蒸煮损失率较氧化后显著下降(P<0.05),持水性较氧化后显著上升(P<0.05),凝胶的弹性、胶黏性、回复性较氧化后增加。凝胶白度值在PE浓度为8.00 mg/mL出现极显著的下降(P<0.01)。此外,在氧化条件下,PE的加入使得G'和G"增大,促进蛋白质分子之间的交联作用,使之形成更具有弹性的凝胶结构,PE浓度为4.00 mg/mL时对蛋白质凝胶网络结构有较好的改善作用,SDS-PAGE结果显示PE与蛋白质之间的交联是可被还原的。同时,PE的添加会极显著增加氧化蛋白质的乳化活性、乳化稳定性(P<0.01),而对乳化粒度的影响不显著(P>0.05)。综合各凝胶特性和乳化特性数据,PE浓度为4.00 mg/mL时对蛋白质的功能特性有较好的改善。
-
表 1 马齿苋提取物对肌原纤维蛋白凝胶质构的影响
Table 1 Effect of PE on gel texture of myofibrillar protein
指标 空白 马齿苋提取物添加量(mg/mL) 0.00 2.00 4.00 8.00 硬度(g) 535.7±46.54Aa 362.15±24.46Bb 369.56±39.89Bb 398.73±5.29ABb 465.84±27.34ABab 弹性(MPa) 247±4.04Bb 256±6.81ABb 251.67±4.41Bb 274.33±2.33Aa 248.33±5.24Bb 胶黏性(g) 147.87±24.65Aa 84.10±6.1Ab 92.25±12.99Ab 90.29±3.45Ab 111.49±6.75Aab 回复性(MPa) 0.35±0.01Aa 0.29±0.01Bb 0.30±0.02Bb 0.31±0.01ABb 0.32±0.02ABb 注:同行肩注大写字母表示差异极显著(P<0.01),小写字母表示差异显著(P<0.05)。 -
[1] ZHAO X, XU X L, ZHOU G H. Covalent chemical modification of myofibrillar proteins to improve their gelation properties:A systematic review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,20(1):924−959.
[2] LÜ Y Q, FENG X C, WANG Y J, et al. The gelation properties of myofibrillar proteins prepared with malondialdehyde and (−)-epigallocatechin-3-gallate[J]. Food Chemistry,2021,340:127817. doi: 10.1016/j.foodchem.2020.127817
[3] UTRERA M, MORCUENDE D, ESTEVEZ M. Temperature of frozen storage affects the nature and consequences of protein oxidation in beef patties[J]. Meat Science,2014,96:1250−1257. doi: 10.1016/j.meatsci.2013.10.032
[4] 张秋会, 孙灵霞, 李苗云, 等. 肉制品的抗氧化控制措施[J]. 肉类研究,2009,7:33−36. [ZHANG Q H, SUN L X, LI M Y, et al. Antioxidation measures of meat[J]. Meat Research,2009,7:33−36.] doi: 10.3969/j.issn.1001-8123.2009.01.012 ZHANG Q H, SUN L X, LI M Y, et al. Antioxidation measures of meat[J]. Meat Research, 2009, 7: 33−36. doi: 10.3969/j.issn.1001-8123.2009.01.012
[5] RIBEIRO S J, SANTOS C M J M, SILVA R K L, et al. Natural antioxidants used in meat products:A brief review[J]. Meat Science,2018,148:181−188.
[6] BONADIO R E B, VESPÚCIO C B, RUBÉN D, et al. Addition of natural extracts with antioxidant function to preserve the quality of meat products[J]. Biomolecules,2022,12(10):1506. doi: 10.3390/biom12101506
[7] XU Q D, YU Z L, ZENG W C. Structural and functional modifications of myofibrillar protein by natural phenolic compounds and their application in pork meatball[J]. Food Research International,2021,148:110593. doi: 10.1016/j.foodres.2021.110593
[8] ZHAO C C, ZHANG C G, HE F, et al. Two new alkaloids from Portulaca oleracea L and their bioactivities[J]. Fitoterapia,2019,136:104166. doi: 10.1016/j.fitote.2019.05.005
[9] XU G Y, HAN X, AN G X, et al. Screening for the protective effect target of deproteinized extract of calf blood and its mechanisms in mice with CCl4-induced acute liver injury[J]. PLoS One,2017,12(7):e0180899. doi: 10.1371/journal.pone.0180899
[10] MIAO L C, TAO H X, PENG X, et al. The anti-inflammatory potential of Portulaca oleracea L. (purslane) extract by partial suppression on NF-κB and MAPK activation[J]. Food Chemistry,2019,290:239−245. doi: 10.1016/j.foodchem.2019.04.005
[11] 林宝妹, 张帅, 洪佳敏, 等. 马齿苋不同溶剂提取物的抗氧化活性[J]. 食品工业,2020,282(3):146−150. [LIN B M, ZHANG S, HONG J M, et al. Antioxidant activities of different solvent extracts from Portulaca oleracea L J]. The Food Industry,2020,282(3):146−150.
[12] WANG Z F, HE Z F, ZHANG D, et al. Effects of purslane extract on the quality indices of rabbit meat patties under chilled storage[J]. Journal of Food Processing and Preservation,2021,45(9):e15644.
[13] FAN X J, ZHANG B, ZHANG X, et al. Incorporating Portulaca oleracea extract endows the chitosan-starch film with antioxidant capacity for chilled meat preservation[J]. Food Chemistry:X,2023,18:100662.
[14] PARK D, XIONG Y L, ALDERTON A L, et al. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry,2006,101(3):1239−1246.
[15] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D]. 无锡:江南大学, 2016. [CAO Y G. Effects of plant polyphenols on oxidative stability and functional properties of meat protein and its application[D]. Wuxi:Jiangnan University, 2016.] CAO Y G. Effects of plant polyphenols on oxidative stability and functional properties of meat protein and its application[D]. Wuxi: Jiangnan University, 2016.
[16] 费英, 韩敏义, 杨凌寒, 等. pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学,2010,43(1):164−170. [FEI Y, HAN M Y, YANG L H, et al. Studies on the secondary structure and heat-induced gelation of pork myofibrillar proteins as affected by pH[J]. Scientia Agricultura Sinica,2010,43(1):164−170.] doi: 10.3864/j.issn.0578-1752.2010.01.019 FEI Y, HAN M Y, YANG L H, et al. Studies on the secondary structure and heat-induced gelation of pork myofibrillar proteins as affected by pH[J]. Scientia Agricultura Sinica, 2010, 43(1): 164−170. doi: 10.3864/j.issn.0578-1752.2010.01.019
[17] LI X Q, XIONG Y L L, CHEN J. Protein oxidation at different salt concentrations affects the cross-linking and gelation of pork myofibrillar protein catalyzed by microbial transglutaminase[J]. Journal of Food Science,2013,78(6):823−831.
[18] 夏秀芳, 李芳菲, 田佳艺, 等. 低温冻藏对肌原纤维蛋白凝胶特性的影响[J]. 中国食品学报,2019,19(1):163−170. [XIA X F, LI F F, TIAN J Y, et al. Effect of the low temperature freezing storage on gel property of myofibril protein[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(1):163−170.] XIA X F, LI F F, TIAN J Y, et al. Effect of the low temperature freezing storage on gel property of myofibril protein[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(1): 163−170.
[19] LIN D Q, ZHAO L T, LI R J, et al. Effect of plant protein mixtures on the microstructure and rheological properties of myofibrillar protein gel derived from red sea bream (Pagrosomus major)[J]. Food Hydrocolloids,2019,96:537−545. doi: 10.1016/j.foodhyd.2019.05.043
[20] 伯朝英, 熊杰, 常海军, 等. 马齿苋提取物抑制冷藏猪肉糜脂肪和蛋白氧化及对品质特性的影响[J]. 食品与发酵工业,2022,48(22):172−179. [BO Z Y, XIONG J, CHANG H J, et al. Effects of purslane extract on oxidation and quality of fat and protein inrefrigerated minced pork[J]. Food and Fermentation Industries,2022,48(22):172−179.] BO Z Y, XIONG J, CHANG H J, et al. Effects of purslane extract on oxidation and quality of fat and protein inrefrigerated minced pork[J]. Food and Fermentation Industries, 2022, 48(22): 172−179.
[21] 熊杰. 鼠曲草提取物对猪肉肌原纤维蛋白氧化、结构及凝胶特性影响研究[D]. 重庆:重庆工商大学, 2022. [XONG J. Study on the effect of extracts of gnaphalium affine on the oxidation structure and gel properties of pork myofibrillar proteins[D]. Chongqing:Chongqing Technology and Business University, 2022.] XONG J. Study on the effect of extracts of gnaphalium affine on the oxidation structure and gel properties of pork myofibrillar proteins[D]. Chongqing: Chongqing Technology and Business University, 2022.
[22] JIA N, WANG L T, SHAO J H, et al. Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J]. Meat Science,2017,127:45−50. doi: 10.1016/j.meatsci.2017.01.004
[23] AGYARE K, ADDO K, XIONG Y, et al. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids,2009,23(1):72−81. doi: 10.1016/j.foodhyd.2007.11.012
[24] ZHAO X, WU T, XING T, et al. Rheological and physical properties of O/W protein emulsions stabilized by isoelectric solubilization/ precipitation isolated protein:The underlying effects of varying protein concentrations[J]. Food Hydrocolloids,2019,95:580−589. doi: 10.1016/j.foodhyd.2018.03.040
[25] HU H, CHEUNG I W Y, PAN S, et al. Effect of high intensity ultrasound on physicochemical and functional properties of aggregated soybean β-conglycinin and glycinin[J]. Food Hydrocolloids,2015,45:102−110. doi: 10.1016/j.foodhyd.2014.11.004
[26] 张海璐, 黄翔, 杨燃, 等. 蛋白质氧化对羊肉糜流变与凝胶特性的影响[J]. 食品科学,2020,41(8):17−22. [ZHANG H L, HUANG X, YANG R, et al. Effect of protein oxidation on rheological and gelation properties of mutton batters[J]. Food Science,2020,41(8):17−22.] ZHANG H L, HUANG X, YANG R, et al. Effect of protein oxidation on rheological and gelation properties of mutton batters[J]. Food Science, 2020, 41(8): 17−22.
[27] 李颖畅, 师丹华, 张馨元, 等. 超声波辅助没食子酸改善海鲈鱼肌原纤维蛋白的凝胶性能[J]. 食品科学,2022,43(11):82−91. [LI Y C, SHI D H, ZHANG X Y, et al. Gallic acid combined with ultrasound treatment improves the gel properties of Lateolabrax japonicas myofibrillar protein[J]. Food Science,2022,43(11):82−91.] LI Y C, SHI D H, ZHANG X Y, et al. Gallic acid combined with ultrasound treatment improves the gel properties of Lateolabrax japonicas myofibrillar protein[J]. Food Science, 2022, 43(11): 82−91.
[28] 孙科, 闫方华, 许晓敏, 等. 苹果多酚改性蛋清改善鲅鱼鱼糜的凝胶性质[J]. 现代食品科技,2020,36(10):210−217,164. [SUN K, YAN F H, XU X M, et al. Apple polyphenols-modified egg white improves the gelling properties of Spanish mackerel surimi[J]. Modern Food Science and Technology,2020,36(10):210−217, 164.] SUN K, YAN F H, XU X M, et al. Apple polyphenols-modified egg white improves the gelling properties of Spanish mackerel surimi[J]. Modern Food Science and Technology, 2020, 36(10): 210−217, 164.
[29] CHENG J R, LIN Y S, TANG D B, et al. Structural and gelation properties of five polyphenols-modified pork myofibrillar protein exposed to hydroxyl radicals[J]. LWT-Food Science and Technology,2022,156:113073. doi: 10.1016/j.lwt.2022.113073
[30] WANG Z F, HE Z H, ZHANG D, et al. Antioxidant activity of purslane extract and its inhibitory effect on the lipid and protein oxidation of rabbit meat patties during chilled storage[J]. Journal of the Science of Food and Agriculture,2021,101(5):1953−1962. doi: 10.1002/jsfa.10811
[31] NIE X H, ZHAO L M, WANG N N, et al. Phenolics-protein interaction involved in silver carp myofibrillar protein films with hydrolysable and condensed tannins[J]. LWT-Food Science and Technology,2017,81:258−264. doi: 10.1016/j.lwt.2017.04.011
[32] 王悦松, 刘香玲, 李学鹏, 等. 白藜芦醇对鲢鱼肌原纤维蛋白凝胶特性的影响[J]. 食品科学,2023,44(12):42−49. [WANG Y S, LIU X L, LI X P, et al. Effects of resveratrol on gel properties of silver carp myofibrillar protein[J]. Food Science,2023,44(12):42−49.] doi: 10.7506/spkx1002-6630-20220923-235 WANG Y S, LIU X L, LI X P, et al. Effects of resveratrol on gel properties of silver carp myofibrillar protein[J]. Food Science, 2023, 44(12): 42−49. doi: 10.7506/spkx1002-6630-20220923-235
[33] 周非白. 氧化修饰对猪肉肌原纤维蛋白结构与功能特性的调控研究[D]. 广州:华南理工大学, 2016. [ZHOU F B. Oxidative modification on porcine myofibrillar protein in relation to structural changes and functional properties[D]. Guangzhou:South China University of Technology, 2016.] ZHOU F B. Oxidative modification on porcine myofibrillar protein in relation to structural changes and functional properties[D]. Guangzhou: South China University of Technology, 2016.
[34] 李可, 李燕, 康超娣, 等. 常压等离子体射流对鸡肉肌原纤维蛋白结构和流变特性的影响[J]. 食品科学,2020,41(19):124−131. [LI K, LI Y, KANG C D, et al. Effect of atmospheric pressure plasma jet on structural and rheological properties of chicken myofibrillar protein[J]. Food Science,2020,41(19):124−131.] doi: 10.7506/spkx1002-6630-20190916-202 LI K, LI Y, KANG C D, et al. Effect of atmospheric pressure plasma jet on structural and rheological properties of chicken myofibrillar protein[J]. Food Science, 2020, 41(19): 124−131. doi: 10.7506/spkx1002-6630-20190916-202
[35] PAGLARINI C D S, FURTADO G D F, HONÓRIO A R, et al. Functional emulsion gels as pork back fat replacers in Bologna sausage[J]. Food Structure,2019,20:100105. doi: 10.1016/j.foostr.2019.100105
[36] 贾娜, 刘丹, 宋立, 等. 没食子酸抑制猪肉肌原纤维蛋白氧化及其与蛋白的交联作用[J]. 中国食品学报,2019,19(1):12−19. [JIA N, LIU D, SONG L, et al. The inhibition effect of gallic acid on oxidation of pork myofibrillar proteins and the crosslinking interaction between gallic acid and proteins[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(1):12−19.] JIA N, LIU D, SONG L, et al. The inhibition effect of gallic acid on oxidation of pork myofibrillar proteins and the crosslinking interaction between gallic acid and proteins[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(1): 12−19.
[37] XIA T L, CAO Y Y, CHEN X, et al. Effects of chicken myofibrillar protein concentration on protein oxidation and water holding capacity of its heat-induced gels[J]. Journal of Food Measurement and Characterization,2018,12(4):2302−2312. doi: 10.1007/s11694-018-9847-8
[38] ZHOU Y, DAI H J, MA L, et al. Effect and mechanism of psyllium husk (Plantago ovata) on myofibrillar protein gelation[J]. LWT-Food Science and Technology,2021,138:110651. doi: 10.1016/j.lwt.2020.110651
[39] 贾娜, 孙嘉, 刘丹, 等. 槲皮素对氧化条件下猪肉肌原纤维蛋白结构及凝胶特性的影响[J]. 食品科学,2021,42(10):45−51. [JIA N, SUN J, LIU D, et al. Effect of quercetin on the structure and gel properties of pork myofibrillar protein under oxidative conditions[J]. Food Science,2021,42(10):45−51.] JIA N, SUN J, LIU D, et al. Effect of quercetin on the structure and gel properties of pork myofibrillar protein under oxidative conditions[J]. Food Science, 2021, 42(10): 45−51.
[40] 叶凤凌, 池玉闽, 周敏之, 等. 氧化对兔肉肌原纤维蛋白结构、乳化性和凝胶性的影响研究[J]. 食品工业科技,2020,41(24):22−30. [YE F L, CHI Y M, ZHOU M Z, et al. Effect of oxidation on the structure, emulsification and gel ability of rabbit meat myofibrillar protein[J]. Science and Technology of Food Industry,2020,41(24):22−30.] YE F L, CHI Y M, ZHOU M Z, et al. Effect of oxidation on the structure, emulsification and gel ability of rabbit meat myofibrillar protein[J]. Science and Technology of Food Industry, 2020, 41(24): 22−30.
[41] 李立敏, 杨豫菘, 成立新, 等. 茶多酚对羊肉肌原纤维蛋白凝胶特性的影响[J]. 肉类研究,2020,34(3):8−13. [LI L M, YANG Y S, CHENG L X, et al. Effect of tea polyphenols on gelation properties of mutton myofibrillar protein[J]. Meat Research,2020,34(3):8−13.] doi: 10.7506/rlyj1001-8123-20200131-030 LI L M, YANG Y S, CHENG L X, et al. Effect of tea polyphenols on gelation properties of mutton myofibrillar protein[J]. Meat Research, 2020, 34(3): 8−13. doi: 10.7506/rlyj1001-8123-20200131-030
[42] 吴菊清. 猪肉肌原纤维蛋白乳化特性研究[D]. 南京:南京农业大学, 2015. [WU J Q. Emulsifying properties of myofibrillar protein of pork[D]. Nanjing:Nanjing Agricultural University, 2015.] WU J Q. Emulsifying properties of myofibrillar protein of pork[D]. Nanjing: Nanjing Agricultural University, 2015.
[43] PROMEYRAT A, GATELLIER P, LEBRET B, et al. Evaluation of protein aggregation in cooked meat[J]. Food Chemistry,2009,121(2):412−417.
-
期刊类型引用(7)
1. 杨敏,张密,叶贤胜,曾长立,马爱民,牛蒙亮,许丹云. 大球盖菇多肽的制备、抗氧化及抗肿瘤活性的研究. 山西农业大学学报(自然科学版). 2025(01): 123-132 .  百度学术
百度学术
2. 魏磊,景炳年,李宁洁,金饶,谢晓阳,刘雨晴,马艳妮,梁雅辉,王韬,王伟. 赤松茸乙醇提取物不同萃取相生物活性对比. 食品研究与开发. 2025(04): 39-45 .  百度学术
百度学术
3. 王小平,刘忠莹,钟洋,张定秋,陆阳,朱敏敏,郑红毅,何叶馨,王鑫,黄韬睿,江祖彬. 基于离子色谱-电感耦合等离子体质谱法分析木耳、香菇、松茸和茶树菇中砷形态分布. 食品工业科技. 2024(07): 254-260 .  本站查看
本站查看
4. 韦菡燕,蒋军文. 等离子体对松茸多糖抗疲劳作用的影响. 保鲜与加工. 2024(10): 128-133 .  百度学术
百度学术
5. 黄磊,何春梅,司灿,石鸿宇,段俊. 大球盖菇栽培研究进展. 中国食用菌. 2023(03): 8-14 .  百度学术
百度学术
6. 魏磊,王伟,谢晓阳,周雍,刘雨晴,马艳妮,宁二娟,王韬,李宁洁,景炳年. 响应面优化博爱赤松茸多糖提取工艺及其抑菌和抗氧化活性研究. 食品工业科技. 2023(15): 213-220 .  本站查看
本站查看
7. 曹燕妮,华蓉,邓雅元,王娟,游金坤. 食用菌中维生素测定方法研究. 中国食用菌. 2022(09): 44-47 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:









 下载:
下载:



