Process Optimization of Total Saponins from Adventitious Roots of Ginseng and Their Antioxidant and Anti-fatigue Effects
-
摘要: 目的:探究人参不定根总皂苷(ginseng adventitious roots total saponins,GARS)的最佳提取工艺及抗氧化和抗疲劳作用。方法:利用乙醇回流法提取GARS,通过正交试验考察乙醇浓度、料液比、提取温度、提取时间对GARS含量的影响;以1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+)、3-氧代-2-苯基-4,4,5,5-四甲基咪唑啉-1-氧(PTIO)、羟自由基(·OH)、超氧阴离子自由基(O2−·)清除能力及还原力作为测定抗氧化活性指标;通过测定小鼠力竭游泳和爬杆时间,测定肌/肝糖原、乳酸(LD)、尿素氮(BUN)含量及乳酸脱氢酶(LDH)活性来判定GARS抗疲劳能力。结果:通过正交试验得到最佳提取工艺条件为乙醇浓度70%、料液比1:30 g/mL、提取温度70 ℃、提取时间40 min,得到GARS含量为107.85 mg/g;GARS对DPPH、ABTS+、PTIO、OH、O2−自由基都有一定程度清除作用,且具有还原性,其清除能力和还原性与浓度呈正比;GARS能够显著延长小鼠力竭游泳和爬杆时间(P<0.05),显著增加肌/肝糖原含量(P<0.05),降低LD、BUN含量,提高LDH活性,并与其浓度呈正比。结论:GARS提取的最优条件为乙醇浓度70%、料液比1:30 g/mL、提取温度70 ℃、提取时间40 min,可为GARS产业化生产提供依据,且GARS具有一定的抗氧化和抗疲劳作用,可为明确人参不定根营养成分和活性物质提供理论支持,为开发人参不定根药食同源的相关产品提供技术参考。Abstract: Objective: To investigate the optimal extraction process and antioxidant and anti-fatigue activities of ginseng adventitious roots total saponins (GARS). Methods: GARS was extracted using ethanol reflux method, and the effects of different factors such as ethanol concentration, solvent-to-solid ratio, extraction temperature, and extraction time on the content of GARS were studied by orthogonal test. The antioxidant and anti-fatigue activities of GARS were determined by measuring the scavenging abilities of DPPH, ABTS+, PTIO, ·OH, and O2−·, as well as the reducing power. The effects of GARS on the swimming and climbing times of mice, the contents of muscle/gallbladder glycogen, lactate (LD), and urea nitrogen (BUN) were determined to evaluate its anti-fatigue ability. Results: The optimal extraction conditions were ethanol concentration of 70%, solvent-to-solid ratio of 1:30 g/mL, extraction temperature of 70 ℃, and extraction time of 40 min, with a GARS content of 107.85 mg/g. GARS showed significant antioxidant and anti-fatigue activities, with its antioxidant and reducing power being positively correlated with its concentration. GARS significantly prolonged the swimming and climbing times of mice (P<0.05), increased the contents of muscle/gallbladder glycogen (P<0.05), decreased the levels of LD and BUN, and increased the activity of lactate dehydrogenase (LDH), indicating its anti-fatigue ability. Conclusion: The optimal extraction process of GARS was ethanol reflux method with ethanol concentration of 70%, solvent-to-solid ratio of 1:30 g/mL, extraction temperature of 70 ℃, and extraction time of 40 min. GARS showed significant antioxidant and anti-fatigue activities, which can support the development of ginseng adventitious roots as a food or health supplement ingredient.
-
疲劳是指由于运动过度而引起的机能生理功能减弱,导致不能持续维持特定的运动水平的现象,即运动性疲劳[1]。通常会表现为极度疲倦、疲惫或虚弱,若疲劳不能及时消除,还可造成一系列继发性问题,如焦虑、失眠、抑郁、身体功能障碍、认知障碍、能量失衡,严重甚至会导致与生物调节和免疫系统相关的严重疾病[2−3]。疲劳的机制很复杂,主要包括以下几种理论,一种是LD和BUN等代谢物的过度产生和积累导致肌肉疲劳[4];另一种是“自由基理论”,即自由基是体内各种生化反应的结果,具有强氧化性。自由基过度积累可导致生物大分子氧化,并影响人体器官。因此抗氧化和抗疲劳之间可能存在着关联[5]。
人参(Panax ginseng C.A. Mey)具有很高的药用价值,其主要成分是人参皂苷,是人参中主要活性成分,属于固醇类化合物,又称为三萜皂苷。人参皂苷主要的功效与作用包括提高机体免疫力、抗菌、改善心脑血管的供血不足、调节中枢神经系统以及抗疲劳和延缓衰老等,人参开发前景巨大,但由于野生人参受气候环境的变化经常造成质量波动,且随着近年来野生人参资源被过度开采,再加上人工种植栽培时间长,易受环境因素影响,不能满足国内外市场的需要。因此使用组织培养技术诱导和大规模生产不定根,是缓解人参皂苷供给不足,实现可持续生产的有效手段[6−7]。人参不定根(ginseng adventitious roots, GAR)是一种通过生物发酵技术培养出的人参组织培养物[8],GAR在遗传信息层面与野生人参具有很高的相似性,还具有成本低、产量高、易于控制和生长周期短等独特优势[9−10],可得到更多的生物量及代谢产物,其所产生的人参皂苷含量、种类也与天然人参相似。Murthy等[11]通过高效液相色谱法对组织培养的山参不定根和栽培的高丽参根中的人参皂苷进行了化学分析,发现两种植物中活性成分都含有Rb1、Rc、Rd、Rg1等,且与正常人参相比,GAR中人参皂苷的含量更高。屈青松等[12]优化了人参皂苷的提取工艺,提高人参皂苷转化率,并测定其具有抗氧化活性。蓝瑞高等[13]研究发现人参皂苷可以增加肌/肝糖原含量,降低LA、BUN水平,有效缓解运动性疲劳。吕世鑫等[14]研究发现西洋参不定根总皂苷具有较好的DPPH和OH自由基清除能力,有较强的抗氧化性。目前GAR已批准认为与5年以下人参实质等同,可以作为新食品原料在食品中应用,但是利用生物反应器生产出的GAR,其化学成分积累及生物活性可能与传统人参相比具有其独特性,因此研究GAR中的总皂苷具有重要意义。
本试验以乙醇回流法提取的GARS为研究对象,采用单因素实验考察提取时间、提取温度、乙醇浓度、料液比对GARS得率的影响,进一步进行正交试验对GARS的提取工艺进行优化,测定其体外抗氧化活性,通过动物实验来评定其抗疲劳作用。本文探究了影响GARS含量的多种因素及抗氧化、抗疲劳作用,为GAR资源的开发利用提供了良好理论基础,为GAR作为一种良好的抗氧化剂原料和开发具有抗疲劳性质的功能性食品提供参考。
1. 材料与方法
1.1 材料与仪器
人参不定根 大连农科院提供,将其根洗净、切断、晒干;昆明小鼠 20只,雄性,2周龄,体重(18~22 g),延边大学实验动物中心提供,在恒温(23±2 ℃)、相对湿度55%±10%的食品研究中心动物室饲养,动物许可号:SYXK(吉)2020-0009;人参皂苷Re标准品、ABTS 上海源叶生物科技有限公司;抗坏血酸(VC) 国药集团化学试剂有限公司;DPPH、PTIO 梯希爱(上海)化成工发展有限公司;刺五加片 上海华源安徽仁济制药有限公司;肌/肝糖原测试盒、乳酸(LD)测试盒、乳酸脱氢酶(LDH)测试盒、尿素氮(BUN)测试盒 南京建成生物工程研究所。
DF-35型落地式连续投料粉碎机 温岭市林大机械有限公司;HWS-24型电热恒温水浴锅 上海一恒仪器有限公司;KQ3200DE型数控超声波清洗器 昆山超声仪器公司;DHG-9620A型立式鼓风干燥箱 上海百典设公司;LyoQuest-55型实验型冷冻干燥机 西班牙Telstar集团公司;N-1110型旋蒸支架 东京理化器械株式会社;SK-0180-E型摇床 大龙兴创试验仪器(北京)有限公司;TG16A-WS型离心机、BXM-30R型立式压力蒸汽灭菌 上海卢湘仪器有限公司;MS 3 basic型涡旋混匀器 德国IKA集团;SP-Max3500FL型多功能荧光酶标仪 上海闪谱生物科技有限公司。
1.2 实验方法
1.2.1 人参不定根总皂苷的提取
将GAR粉碎过80目筛,得到粉末,用70%乙醇溶液按料液比1:10浸泡过夜,抽滤取上清液,沉淀继续按料液比1:10添加70%乙醇溶液混匀,重复抽滤步骤,合并滤液。将上清液在60 ℃条件下旋转蒸发,将残留物溶解于蒸馏水中,用水饱和正丁醇于分液漏斗中多次萃取至上层有机层澄清,合并上层,使用旋转蒸发器在50 ℃下蒸发正丁醇部分,加少量蒸馏水溶解后置于−80 ℃冷冻,冻干[15]。
1.2.2 人参不定根总皂苷含量测定
1.2.2.1 标准曲线的制备
取人参Re对照品适量,精密称定,加甲醇制成每1 mL含1 mg的溶液,得到对照品溶液。精密吸取对照品溶液20、40、80、120、160、200 μL,分别置于具塞试管中,低温挥去溶剂,加入1%香草醛高氯酸试液0.5 mL,置60 ℃恒温水浴充分混匀后加热15 min,立即用冰水冷却2 min,加入77%硫酸溶液5 mL,摇匀;以对照品溶液作空白。消除气泡后按照“紫外-可见分光光度法”(通则0401),在540 nm的波长处测定吸光度[16−17],经测定GARS的标准曲线为y=1.9498x+0.0018(R2=0.9991)。
1.2.2.2 总皂苷含量测定
根据中国药典2015版中人参总皂苷含量测定方法,取待测品约50 mg,精密称定,置于烧杯中,用25 mL甲醇溶解并摇匀,精密吸取50 μL,照1.3.2.1的方法,测定吸光度,带入GARS的标准曲线,计算溶液中人参皂苷Re含量,单位为mg/g,计算结果乘以校正系数0.84,即得[18]。
1.2.3 单因素实验
在利用乙醇水浴浸提法对GAR中的皂苷提取时,会有多种因素对提取效果产生影响。对主要影响因素:乙醇浓度、料液比、提取温度和提取时间进行单因素实验[19]。分别精密称取4 g GAR粉末6个样品,确定提取时间40 min,提取温度80 ℃,乙醇溶液浓度70%,料液比1:35 g/mL。分别考察乙醇浓度(40%、50%、60%、70%、80%、90%),料液比(1:20、1:25、1:30、1:35、1:40、1:45 g/mL),提取温度(40、50、60、70、80、90 ℃),提取时间(10、20、30、40、50、60 min)对GARS含量的影响。
1.2.4 正交试验
在单因素实验结果的基础上,选择对GARS含量影响最大的4个因素[20],进行四因素三水平正交试验,因素与水平见表1。
表 1 正交试验因素与水平Table 1. Factors and levels of orthogonal test水平 因素 A提取时间(min) B提取温度(℃) C乙醇浓度(%) D料液比(g/mL) 1 40 60 60 1:25 2 50 70 70 1:30 3 60 80 80 1:35 1.2.5 人参不定根总皂苷抗氧化活性测定
1.2.5.1 DPPH自由基清除能力测定
用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL的人参不定根总皂苷提取液,取不同质量浓度的样品溶液20 μL加入配置好的DPPH溶液180 μL并充分混匀,在摇床450 r/min避光反应20 min,以蒸馏水作为空白对照,以Vc作为阳性对照,用酶标仪测量560 nm波长处各组的吸光值,平行测定3次,按公式(1)计算DPPH自由基清除率[21]:
(1) 式中:A0为空白组吸光度;A1为实验组吸光度;A2为阴性对照组吸光度。
1.2.5.2 ABTS+自由基清除能力测定
用蒸馏水配制浓度为0.1、0.15、0.2、0.25、0.3 mg/mL的人参不定根总皂苷提取液,取不同质量浓度的样品溶液30 μL加入配置好的ABTS+溶液270 μL并充分混匀,反应10 min,以蒸馏水作为空白对照,以Vc作为阳性对照,用酶标仪测量405 nm波长处各组的吸光值,平行测定3次,按公式(2)计算ABTS+自由基清除率[22]:
(2) 式中:A0为空白组吸光度;A1为为实验组吸光度;A2为阴性对照组吸光度。
1.2.5.3 PTIO自由基清除能力测定
用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL的人参不定根总皂苷提取液,取不同质量浓度的样品溶液0.2 mL加入配置好的PBS贮备液、PTIO溶液,水浴37 ℃避光反应3 h,以VC为阳性对照,用酶标仪测量在557 nm波长处各组的吸光值,平行测定3次,按公式(3)计算PTIO自由基清除率[23]:
(3) 式中:A0为空白组吸光度;A为实验组吸光度。
1.2.5.4 OH自由基清除率的测定
用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL的人参不定根总皂苷提取液,取不同质量浓度的样品溶液2 mL、2 mL FeSO4溶液(10 mmol/L)、2 mL水杨酸乙醇溶液(10 mmol/L)、再加入2 mL H2O2溶液(8.8 mmol/L)启动反应,在37 ℃恒温水浴加热30 min,以蒸馏水作为空白对照,以Vc作为阳性对照,用酶标仪测量510 nm波长处各组的吸光值,平行测定3次[24],按公式(4)计算羟自由基清除率:
(4) 式中:A0为空白组吸光度;A1为实验组吸光度;A2阴性对照组吸光度。
1.2.5.5 O2−自由基清除率的测定
用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL的人参不定根总皂苷提取液,取不同质量浓度的样品溶液0.2 mL,加入pH8.2的50 mmol/L的Tris-HCl缓冲液5.6 mL,于25 ℃水浴20 min,立即加入3 mmol/L邻苯三酚溶液0.2 mL,反应5 min,用酶标仪测量510 nm波长处各组的吸光值[25],平行测定3次,按公式(5)计算O2−自由基清除率:
(5) 式中:A0为空白组;A1为实验组;A2为阴性对照组。
1.2.5.6 还原力的测定
用蒸馏水配制浓度为0.4、0.8、1.2、1.6、2.0 mg/mL的人参不定根总皂苷提取液,取不同质量浓度的样品溶液2.5 mL,依次加入2.5 mL 0.2 mol/L的磷酸盐缓冲溶液(pH6.6),2.5 mL 1%的K3Fe(CN)6溶液,于50 ℃水浴20 min,再加入2.5 mL 10%的三氯乙酸溶液,4000 r/min下离心10 min。取2.5 mL上清液,加入2.5 mL蒸馏水,0.5 mL 0.1%的FeC13溶液,混匀反应10 min,以VC为阳性对照,用酶标仪测量700 nm波长处各组的吸光值[26],平行三次测定。
1.2.6 试验动物分组与给药
将20只昆明鼠平均分成五组,每组各4只,依次分为空白对照组(蒸馏水)、阳性对照组(刺五加 500 mg/kg·BW)、高剂量组(GARS 500 mg/kg·BW)、中剂量组(GARS 250 mg/kg·BW)、低剂量组(GARS 50 mg/kg·BW)[27],正常饲养,并每天记录体重,适应性培养7 d后连续灌胃28 d[28]。
1.2.7 小鼠爬杆时间测定
第28 d灌胃1 h后,进行小鼠爬杆实验。准备一根表面光滑的塑料棒,并把爬杆架放置于水温20~25 ℃、水深约30 cm的水箱中进行试验,将小鼠放置在塑料棒的顶端,使其肌肉处于静力紧张状态,记录小鼠从爬杆开始,持续到肌肉疲劳,无力抱住塑料棒而掉落到水中的时间。按照此方法,于小鼠第3次跌落时停止实验,累计3次的总时间作为爬杆时间,爬杆结束后将小鼠擦干继续饲养[29]。
1.2.8 小鼠力竭游泳时间测定
待小鼠休息一晚后,将小鼠放置于水温20~25 ℃、水深约30 cm的游泳箱中进行游泳实验,时刻观察小鼠,要保证小鼠尾部不触碰游泳箱底部,当发现小鼠静止漂浮于水面时用玻璃棒轻轻敲击小鼠身体,使其肌肉一直处于紧张状态,让小鼠不停的游泳。小鼠游泳力竭表现为头部沉入水中并在10 s内不露出水面,将其捞出并记录时间[30]。
1.2.9 小鼠基础指标的测定
1.2.9.1 小鼠试验前后体重、体重增加量测定
每天在灌胃前测量小鼠的体重[31]并加以记录,于28 d后依据各组数据进行分析。
1.2.9.2 小鼠肌糖原/肝糖原含量的测定
小鼠在力竭游泳实验后休息0.5 h,用乙醚迷晕后取眼球血,装入EP试管中。将小鼠脱颈取出小鼠的肝脏、腿部肌肉,将其浸泡于生理盐水漂洗后,滤纸吸干,称重(样品重量≤100 mg为宜,不要>100 mg),具体试验操作方法按照试剂盒说明书,对肌糖原/肝糖原含量进行测定。
1.2.9.3 小鼠血液中乳酸、乳酸脱氢酶、尿素氮含量的测定
用乙醚将小鼠迷晕后取眼球血,装入EP试管中,置于冰袋上保持低温。将得到的血液进行离心,转速3000 r/min,温度25 ℃,时间10 min后,按照试剂盒说明书,吸取上层血清测定乳酸、乳酸脱氢酶、尿素氮含量。
1.3 数据处理
使用Origin软件对数据进行统计并绘制图表,以均值±标准偏差的形式表示;利用SPSS 22.0进行统计学分析,采用单因素方差分析,P<0.05表示存在显著性差异,P>0.05表示无显著性差异。
2. 结果与分析
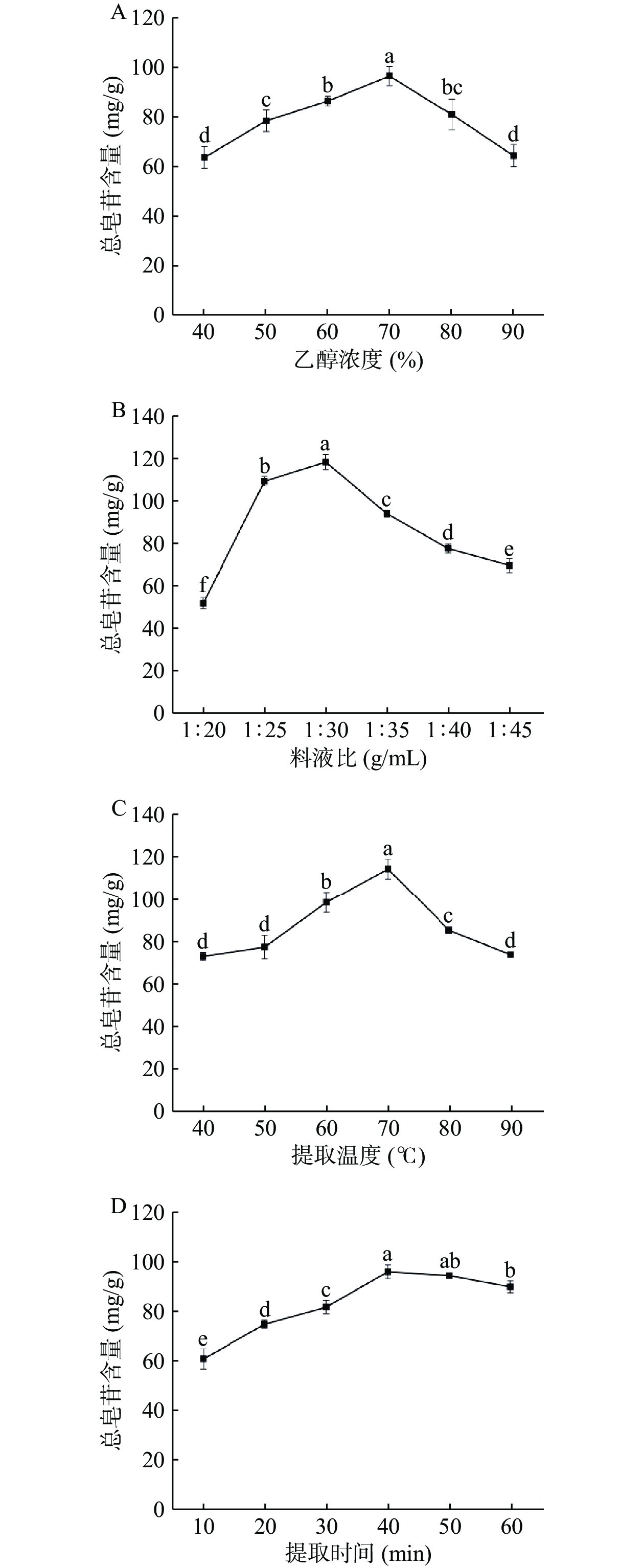
2.1 人参不定根总皂苷提取工艺单因素实验结果
如图1A所示,随着乙醇浓度的增加,GARS含量也随之提高,当乙醇浓度达到70%时,GARS含量最高。而当乙醇浓度持续增加,GARS含量会有所下降,其极性降低,这是因为乙醇浓度的不同导致极性也不同,70%乙醇极性与GARS极性相似,根据相似相溶原理,得率较高,但乙醇浓度超出一定范围时,提取溶剂与GARS极性会有很大差别,某些脂溶性物质的溶出量增加,各种杂质增多,会对皂苷的浸出有一定的影响,从而导致总皂苷含量降低,所以70%的乙醇溶液为最佳溶剂体积分数。
如图1B所示,当料液比增加,GARS含量呈现出递增趋势,在料液比1:30 g/mL时,GARS含量最大,之后呈现出下降趋势,其原因是当溶剂量增加时,试样与溶剂的接触面积也会随之增加,在料液比1:30 g/mL时,溶剂充分包裹试样,然后持续增大溶剂量,不会影响GARS的含量。另外,随着溶剂量的增加,非皂苷的杂质溶出也会随之增大,从而阻碍GARS的溶出,并降低其含量,因此最优料液比是1:30 g/mL。
如图1C所示,温度在40~70 ℃,GARS含量随温度的增大而增大,当温度高于70 ℃,GARS含量达到峰值,温度上升到90 ℃,GARS含量也随之下降,但随着温度的升高,分子的热量提高溶液的粘度,总皂苷萃取系数的增加随水解速度的增加而增加;但温度过高易分解总皂苷的分子结构,对总皂苷的分子结构造成损伤,使其含量下降,因此70 ℃是提取最佳温度。
如图1D所示,提取时间低于40 min,GARS含量随提取时间的延长而增加,在40 min时达到高峰值,在超过40 min后则渐趋稳定,但随着提取时间的逐步拉长,GARS含量有小幅度降低,可能由于在最初阶段萃取溶液迅速包裹试样,提取液中皂苷类物质浓度迅速增加,而随着浸泡时间的增长,试样在提取液中慢慢沉淀,从而使得提取液中的有效物质降低,所以40 min是最佳提取时间。
2.2 人参不定根总皂苷提取正交试验结果
在单因素实验的基础上,进行四因素三水平正交试验,正交试验结果与分析见表2。
表 2 正交试验结果与分析Table 2. Experimental results and analyses for optimization of total flavonoids实验号 A B C D 总皂苷含量
(mg/g)提取时间
(min)提取温度
(℃)乙醇浓度
(%)料液比
(g/mL)1 40 60 60 1:25 89.67 2 40 70 70 1:30 107.85 3 40 80 80 1:35 86.38 4 50 60 70 1:35 89.93 5 50 70 80 1:25 90.79 6 50 80 60 1:30 97.74 7 60 60 80 1:30 95.53 8 60 70 60 1:35 86.67 9 60 80 70 1:25 90.46 K1j 283.90 275.03 274.28 270.92 835.02(T) K2j 278.36 285.51 288.14 301.12 K3j 272.86 274.58 272.70 263.08 `K1j 94.63 91.68 91.43 90.31 `K2j 92.79 95.17 96.05 100.37 `K3j 90.95 91.53 90.90 87.69 极差R 1.83 3.64 5.15 12.68 由表2可知,依据直观分析法中极差R的大小,对因素进行主次排列,次序为:D>C>B>A,即料液比是最主要的因素,其次为乙醇浓度,其最佳组合为A1B2C2D2。由表3可知,乙醇浓度、料液比、提取温度和提取时间对GARS的得率均有显著影响(P<0.05)。因此GARS含量最高时的正交试验最佳方案为:乙醇浓度70%,料液比1:30 g/mL,提取温度70 ℃,提取时间40 min,该条件下提取到的GARS含量为107.85 mg/g。方差分析结果如表3所示。
表 3 方差分析结果Table 3. Analysis of variance results源 III类平方和 自由度 均方 F 显著性 修正模型 9211.073a 8 1151.384 256.843 显著 截距 151839.072 1 151839.072 33871.271 显著 A 2061.787 2 1030.894 229.965 显著 B 2917.242 2 1458.621 325.380 显著 C 915.860 2 457.930 102.152 显著 D 3316.183 2 1658.092 369.876 显著 误差 40.345 9 4.483 总计 161090.491 18 修正后总计 9251.418 17 2.3 人参不定根总皂苷抗氧化活性测定
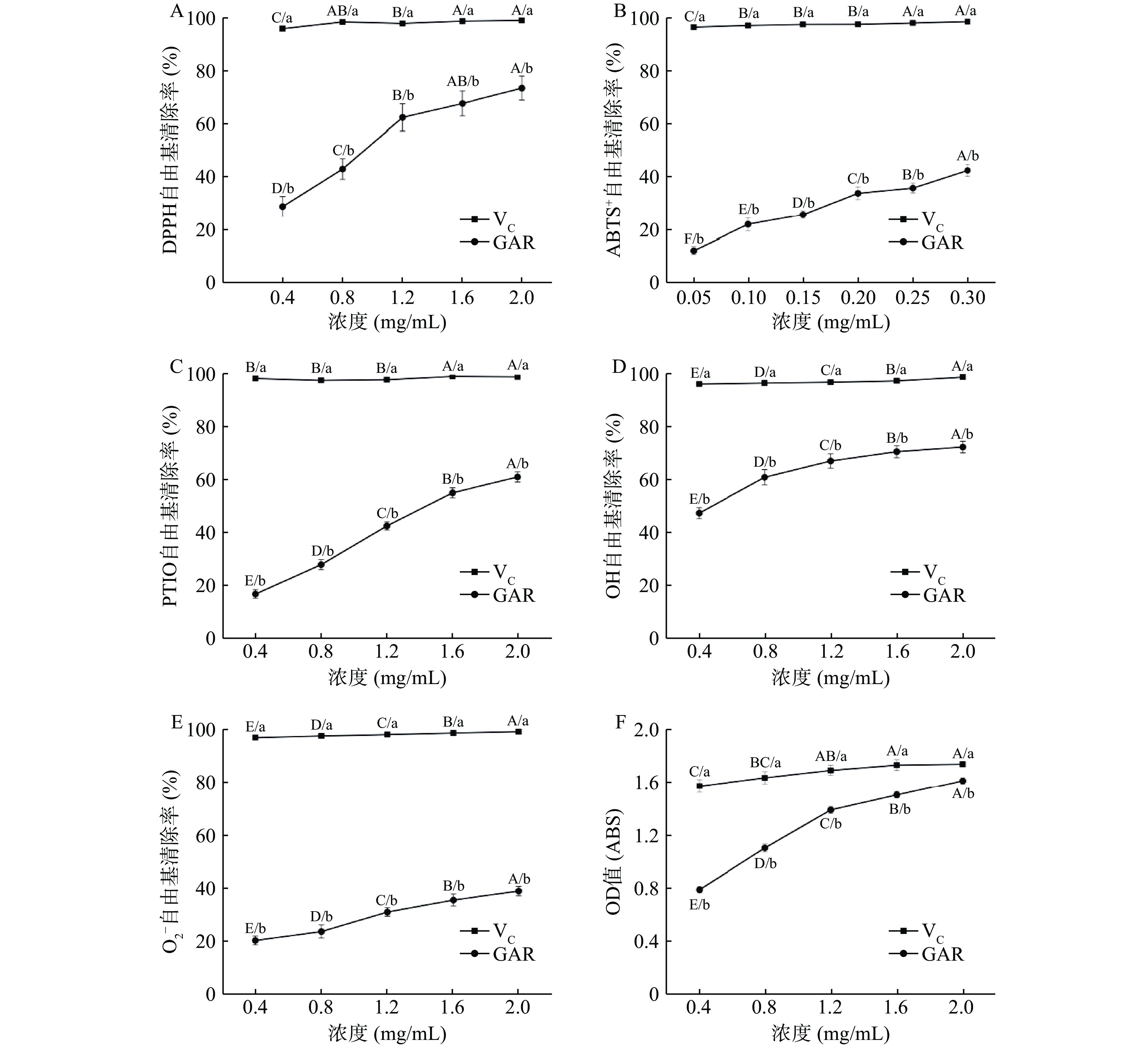
DPPH自由基在有机溶剂中长期存在的,其在波长715 nm处的吸收能力最强。当DPPH被清除时,其在最大吸收波长715 nm处可以检测到吸光值逐渐减小,来判断抗氧化活性的强弱。由图2A可知,随着浓度的不断增加,GARS对DPPH自由基的清除能力逐渐加强,并且在浓度0.4~1.2 mg/mL,GARS对DPPH自由基清除率均有显著性差异(P<0.05),但浓度在1.2~2.0 mg/mL,GARS对DPPH自由基清除率逐渐放缓。由此可见,GARS对DPPH自由基具有一定的清除作用。
过硫酸钾与ABTS+反应生成稳定的阳离子自由基,GARS与自由基反应,使反应体系褪色,以此来检测样品的抗氧化能力。由图2B可知,GARS对ABTS+自由基的清除能力随着浓度增大而逐渐加强。虽然在浓度0.4~2 mg/mL,GARS对ABTS+自由基清除率均有显著性差异(P<0.05),但与VC相比有较大的差距。由此可见,GARS对ABTS+自由基有一定程度的清除作用。
PTIO溶解后为紫色溶液,当有抗氧化剂清除PTIO时,溶液颜色会减淡,通过测量吸光度的改变可以测量抗氧化活性。PTIO有良好的稳定性,呈剂量依赖性关系且测量简单直接。由图2C可知,随着浓度的不断增加,GARS对PTIO自由基的清除能力逐渐加强。GARS浓度在0.4~2.0 mg/mL,其对PTIO自由基清除率均有显著性差异(P<0.05)。由此可见GARS对PTIO自由基具有一定的清除能力。
OH自由基是活性氧自由基中毒性最大的一种自由基,若人体中有过多的OH自由基,会影响细胞膜而产生活性氧和过氧化氢,从而导致诸如易疲劳、老化、突变、动脉硬化等症状,使人体的健康受到严重危害。由图2D可知,随着GARS浓度的不断增加,OH自由基的清除能力逐渐加强。GARS浓度从0.4 mg/mL增长到2.0 mg/mL过程中,其对OH自由基清除率均有显著性差异(P<0.05)。但随着浓度增长,其对OH自由基清除能力逐渐趋于平稳。由此可见,GARS对OH自由基具有一定程度的清除能力。
O2−自由基是指在人体代谢中产生的未配对电子原子团,虽然其氧化性与其他氧自由基比较弱,但它在代谢过程中会分解成氧化性很强的单线态氧自由基或OH自由基,从而造成生物大分子结构的变化或细胞组织损伤,使人产生疲劳。由图2E可知,O2−自由基清除率随GARS浓度的增加而升高,GARS浓度在0.4~2.0 mg/mL,其对O2−自由基清除率均有显著性差异(P<0.05),但其对O2−自由基的清除率要远远低于VC。由此可见,GARS对O2−自由基仅仅只有一定程度的清除作用。
抗氧化活性的机制主要包括还原力机制,链引发的抑制机制,过渡金属离子催化剂的折叠机制,过氧化物的分解和自由基清除机理。因此,一种化合物的还原能力可以作为具有潜在抗氧化活性的一个重要指标。由图2F可知,随着浓度不断升高,GARS的还原性不断增强,并且还原性与其浓度呈正相关。GARS的最大OD值与VC只相差了0.13,由此可见,GARS具有较强的铁离子还原能力。
2.4 人参不定根总皂苷抗疲劳作用测定
2.4.1 人参不定根总皂苷对小鼠爬杆与力竭游泳时间的影响
小鼠爬杆和力竭游泳时间是评价抗疲劳能力的两种实验模型,它们能够很好地评价小鼠的疲劳耐受能力,再现性较高。由表4可知,灌胃高剂量组时,小鼠运动时间延长最多,灌胃蒸馏水与灌胃低剂量组的爬杆时间不存在显著性差异(P>0.05),灌胃中剂量组、高剂量组与低剂量组的爬杆时间相比存在显著性差异(P<0.05)。高、中、低剂量组均增加小鼠爬杆和力竭游泳时间,高剂量组增加小鼠运动时间最多,表明GARS具有增强疲劳小鼠运动耐力作用,并随着浓度的增加,效果越明显。
表 4 小鼠爬杆和力竭游泳时间结果Table 4. Results of mice pole climbing and exhausted swimming time组别 动物数(n) 爬杆运动时间(min) 游泳运动时间(min) 空白对照组 4 1.34±0.09c 35.19±2.06c 高剂量组 4 3.41±0.13a 66.61±3.99a 中剂量组 4 2.72±0.40b 56.70±2.91b 低剂量组 4 1.95±0.32c 40.96±1.68c 阳性对照组 4 2.06±0.74c 45.90±3.33b 注:同列不同小写英文字母表示数据差异显著(P<0.05)。 2.4.2 小鼠试验前后体重、体重增加量结果
体重变化可以直接反映小鼠运动量的多少。由表5可知,经过28 d的灌胃后,空白对照组小鼠体重增长较快;灌胃刺五加提取物的阳性对照组小鼠体重较空白对照组小鼠有下降;灌胃蒸馏水小鼠的体重增加量与灌胃GARS的高、中、低剂量组的体重增加量存在显著性差异(P<0.05),相比于空白对照组小鼠,高、中、低剂量组小鼠体重有明显降低,其中高剂量组体重最轻,表明小鼠运动加剧,并随着GARS浓度增加,小鼠运动量逐渐增加。
表 5 试验前后小鼠体重指标变化Table 5. Mouse index results before and after the test指标 空白对照组 高剂量组 中剂量组 低剂量组 阳性对照组 第1 d体重(g) 35.5±1.9a 32.7±1.2a 34.0±3.3a 35.2±1.3a 35.0±0.7a 28 d体重(g) 53.4±3.4a 45.5±3.7b 46.1±4.3b 48.9±1.5ab 50.4±3.1ab 体重增加量(g) 17.9±4.5a 13.3±2.6b 11.8±1.0b 13.6±0.9b 15.4±2.9a 注:同行不同小写英文字母表示数据差异显著(P<0.05)。 2.4.3 小鼠肌糖原和肝糖原含量测定结果
糖原是主要的能源储备物质,糖和糖原在体内可以相互转化。在机体调节下,血糖浓度高时,糖可以转化为糖原储存;血糖浓度低时,糖原又可以转化为糖释放到血液中,以维持血糖浓度。所以,糖原储备的多少直接影响运动能力的强弱。在机体剧烈运动时,肝糖原可以转化为糖进入血液而供能;肌糖原通过无氧酵解,直接为肌肉供能,以延长运动时间。因此,能量储备物质肝糖原和肌糖原可以作为机体抗疲劳指标。由表6可知,灌胃蒸馏水小鼠的肌/肝糖原含量与低剂量组相比不存在显著性差异(P>0.05),灌胃中剂量组、高剂量组的肌/肝糖原含量与低剂量组相比存在显著性差异(P<0.05)。低剂量组灌胃剂量较少,对肌/肝糖原含量影响较小,因此与空白对照组相比差异不显著(P<0.05)。而高剂量组灌胃剂量最多,小鼠肌/肝糖原含量最高,所以高剂量对提高小鼠肌/肝糖原含量最有效,表明GARS能增加小鼠体内肌/肝糖原的贮存,从而为运动提供更多能量。
表 6 各组小鼠肌糖原与肝糖原含量Table 6. Muscle glycogen and liver glycogen content in mice of each group组别 动物数(n) 肌糖原含量(mg/g) 肝糖原含量(mg/g) 空白对照组 4 1.23±0.06c 16.17±0.47c 高剂量组 4 1.55±0.03a 19.73±1.20a 中剂量组 4 1.39±0.08b 18.29±0.56b 低剂量组 4 1.28±0.09c 17.06±0.40c 阳性对照组 4 1.34±0.18b 17.48±0.58b 注:同列不同小写英文字母表示数据差异显著(P<0.05)。 2.4.4 小鼠乳酸、尿素氮含量和乳酸脱氢酶活性测定结果
长时间的剧烈运动会增加肌肉的氧气消耗,导致机体相对缺氧,此时肌肉中的糖原会被分解产生乳酸,为机体提供能量。但大量乳酸的产生则会影响机体内环境的酸碱平衡,引起肌肉酸痛,导致肌肉运动能力下降。同时为了满足能量需求,蛋白质的代谢显著增加,使肝脏中的尿素水平明显增加,过量的尿素会在体内积累并对机体造成危害。BUN的含量在一定程度上可以反映机体的疲劳程度。LDH的主要作用是将肌肉中过多乳酸转变为丙酮酸,从而减少乳酸的积累。LDH活力越强,乳酸的转变越多,抗疲劳性就越强。由表7可知,灌胃蒸馏水小鼠的LD含量与低剂量组相比存在显著性差异(P<0.05),灌胃中剂量组与低剂量组相比不存在显著性差异(P>0.05)。空白对照组小鼠LD含量最高,高剂量组LD含量最低。灌胃高剂量组时对于降低LD含量最有效;灌胃蒸馏水小鼠的BUN含量与低剂量组相比存在显著性差异(P<0.05),灌胃中剂量组与低剂量组相比不存在差异性显著(P>0.05)。空白对照组小鼠BUN含量最高,高剂量组BUN含量最低,灌胃高剂量组对于降低BUN含量最有效,表明GARS能减少蛋白质分解,降低疲劳小鼠血清尿素氮的生成;灌胃蒸馏水小鼠的LDH活性与低剂量组相比存在显著性差异(P<0.05),灌胃中剂量组与低剂量组相比存在显著性差异(P<0.05),灌胃高剂量组与中剂量组相比存在显著性差异(P<0.05)。空白对照组LDH活性最低,高剂量组LDH活性最高。灌胃高剂量组时对于提高LDH活性最有效,表明随着GARS浓度增大,体内乳酸脱氢酶的活力增强,从而减少体内乳酸的累积。
表 7 各组小鼠LD、BUN含量和LDH活性Table 7. LD, BUN content and LDH activity of mice in each group组别 动物数
(n)LD含量
(mmol/L)BUN含量
(mmol/L)LDH活性
(U/L)空白对照组 4 8.70±0.41a 7.33±0.39a 3617.73±241.23d 高剂量组 4 5.26±0.34c 6.02±0.29c 5698.58±358.28a 中剂量组 4 6.33±0.53b 6.68±0.19b 5054.08±634.96b 低剂量组 4 7.13±0.98b 6.94±0.24b 4302.48±323.38c 阳性对照组 4 7.28±0.62b 7.00±0.43b 4814.18±289.37b 注:同列不同小写英文字母表示数据差异显著(P<0.05)。 3. 结论
本实验通过优化提取工艺,有效减少对提取活性成分的影响,缩短提取时间,从而提高GARS含量。通过体外抗氧化实验和动物实验,表明GARS具有抗氧化和抗疲劳活性,与人参总皂苷的功能相似。因此本研究为研发GARS抗氧化和抗疲劳相关药物和功能性食品等深加工产品提供理论基础和技术参考。但本试验没有测定体内抗氧化活性,难以反映GAR在体内真实的抗氧化水平,不能确定GARS是否有通过清除体内自由基来缓解疲劳的作用,有待进一步研究。
-
表 1 正交试验因素与水平
Table 1 Factors and levels of orthogonal test
水平 因素 A提取时间(min) B提取温度(℃) C乙醇浓度(%) D料液比(g/mL) 1 40 60 60 1:25 2 50 70 70 1:30 3 60 80 80 1:35 表 2 正交试验结果与分析
Table 2 Experimental results and analyses for optimization of total flavonoids
实验号 A B C D 总皂苷含量
(mg/g)提取时间
(min)提取温度
(℃)乙醇浓度
(%)料液比
(g/mL)1 40 60 60 1:25 89.67 2 40 70 70 1:30 107.85 3 40 80 80 1:35 86.38 4 50 60 70 1:35 89.93 5 50 70 80 1:25 90.79 6 50 80 60 1:30 97.74 7 60 60 80 1:30 95.53 8 60 70 60 1:35 86.67 9 60 80 70 1:25 90.46 K1j 283.90 275.03 274.28 270.92 835.02(T) K2j 278.36 285.51 288.14 301.12 K3j 272.86 274.58 272.70 263.08 `K1j 94.63 91.68 91.43 90.31 `K2j 92.79 95.17 96.05 100.37 `K3j 90.95 91.53 90.90 87.69 极差R 1.83 3.64 5.15 12.68 表 3 方差分析结果
Table 3 Analysis of variance results
源 III类平方和 自由度 均方 F 显著性 修正模型 9211.073a 8 1151.384 256.843 显著 截距 151839.072 1 151839.072 33871.271 显著 A 2061.787 2 1030.894 229.965 显著 B 2917.242 2 1458.621 325.380 显著 C 915.860 2 457.930 102.152 显著 D 3316.183 2 1658.092 369.876 显著 误差 40.345 9 4.483 总计 161090.491 18 修正后总计 9251.418 17 表 4 小鼠爬杆和力竭游泳时间结果
Table 4 Results of mice pole climbing and exhausted swimming time
组别 动物数(n) 爬杆运动时间(min) 游泳运动时间(min) 空白对照组 4 1.34±0.09c 35.19±2.06c 高剂量组 4 3.41±0.13a 66.61±3.99a 中剂量组 4 2.72±0.40b 56.70±2.91b 低剂量组 4 1.95±0.32c 40.96±1.68c 阳性对照组 4 2.06±0.74c 45.90±3.33b 注:同列不同小写英文字母表示数据差异显著(P<0.05)。 表 5 试验前后小鼠体重指标变化
Table 5 Mouse index results before and after the test
指标 空白对照组 高剂量组 中剂量组 低剂量组 阳性对照组 第1 d体重(g) 35.5±1.9a 32.7±1.2a 34.0±3.3a 35.2±1.3a 35.0±0.7a 28 d体重(g) 53.4±3.4a 45.5±3.7b 46.1±4.3b 48.9±1.5ab 50.4±3.1ab 体重增加量(g) 17.9±4.5a 13.3±2.6b 11.8±1.0b 13.6±0.9b 15.4±2.9a 注:同行不同小写英文字母表示数据差异显著(P<0.05)。 表 6 各组小鼠肌糖原与肝糖原含量
Table 6 Muscle glycogen and liver glycogen content in mice of each group
组别 动物数(n) 肌糖原含量(mg/g) 肝糖原含量(mg/g) 空白对照组 4 1.23±0.06c 16.17±0.47c 高剂量组 4 1.55±0.03a 19.73±1.20a 中剂量组 4 1.39±0.08b 18.29±0.56b 低剂量组 4 1.28±0.09c 17.06±0.40c 阳性对照组 4 1.34±0.18b 17.48±0.58b 注:同列不同小写英文字母表示数据差异显著(P<0.05)。 表 7 各组小鼠LD、BUN含量和LDH活性
Table 7 LD, BUN content and LDH activity of mice in each group
组别 动物数
(n)LD含量
(mmol/L)BUN含量
(mmol/L)LDH活性
(U/L)空白对照组 4 8.70±0.41a 7.33±0.39a 3617.73±241.23d 高剂量组 4 5.26±0.34c 6.02±0.29c 5698.58±358.28a 中剂量组 4 6.33±0.53b 6.68±0.19b 5054.08±634.96b 低剂量组 4 7.13±0.98b 6.94±0.24b 4302.48±323.38c 阳性对照组 4 7.28±0.62b 7.00±0.43b 4814.18±289.37b 注:同列不同小写英文字母表示数据差异显著(P<0.05)。 -
[1] 陈慧, 马璇, 曹丽行, 等. 运动疲劳机制及食源性抗疲劳活性成分研究进展[J]. 食品科学,2020,41(11):247−258. [CHEN H, MA X, CAO L X, et al. Research progress on the mechanism of exercise fatigue and foodborne antifatigue active ingredients[J]. Food Science,2020,41(11):247−258.] doi: 10.7506/spkx1002-6630-20190620-235 CHEN H, MA X, CAO L X, et al . Research progress on the mechanism of exercise fatigue and foodborne antifatigue active ingredients[J]. Food Science,2020 ,41 (11 ):247 −258 . doi: 10.7506/spkx1002-6630-20190620-235[2] LI Zilin, ZHU Hongkang, HUA Hanyi, et al. Anti-fatigue activity of brassica rapa l. extract and correlation among biochemical changes in forced swimming mice[J]. Food Bioscience,2022,47:101633. doi: 10.1016/j.fbio.2022.101633
[3] WANG Yu, ZHANG Yubiao, HOU Mingxiao, et al. Anti-fatigue activity of parsley ( Petroselinum crispum) flavonoids via regulation of oxidative stress and gut microbiota in mice[J]. Journal of Functional Foods,2022,89:104963. doi: 10.1016/j.jff.2022.104963
[4] 李秋阳, 唐金鑫, 刘士伟, 等. 黑参发酵对疲劳应激诱导氧化损伤的防护作用及与白参、红参和人参浆果的比较[J]. 食品科学,2022,43(21):226−232. [LI Q Y, TANG J X, LIU S W, et al. The protective effect of black ginseng fermentation on oxidative damage induced by fatigue stress and its comparison with white ginseng, red ginseng, and ginseng berries[J]. Food Science,2022,43(21):226−232.] doi: 10.7506/spkx1002-6630-20211214-160 LI Q Y, TANG J X, LIU S W, et al . The protective effect of black ginseng fermentation on oxidative damage induced by fatigue stress and its comparison with white ginseng, red ginseng, and ginseng berries[J]. Food Science,2022 ,43 (21 ):226 −232 . doi: 10.7506/spkx1002-6630-20211214-160[5] ZHU Song, YANG Wei, LIN Yue, et al. Antioxidant and anti-fatigue activities of selenium-enriched peptides isolated from Cardamine violifolia protein hydrolysate[J]. Journal of Functional Foods,2021,79:104412. doi: 10.1016/j.jff.2021.104412
[6] WANG Shihui, WANG June, LIANG Wenxia, et al. Promotion of ginsenosides production in a co-cultivation system of Panax ginseng adventitious roots and immobilized Aspergillus niger[J]. Industrial Crops & Products,2019,140(C):111564.
[7] 苗佳琪. 人参、西洋参不定根诱导及培养条件对其生长和皂苷含量的影响[D]. 长春:吉林农业大学, 2022. [MIAO J Q. Effects of adventitious root induction and culture conditions on the growth and saponin content of ginseng and american ginseng[D]. Changchun:Jilin Agricultural University, 2022.] MIAO J Q. Effects of adventitious root induction and culture conditions on the growth and saponin content of ginseng and american ginseng[D]. Changchun: Jilin Agricultural University, 2022.
[8] 陈一豪, 刘益凤, 曲雪峰, 等. 人参不定根乙醇提取物保护异丙肾上腺素诱导的心肌缺血作用研究[J]. 食品安全质量检测学报,2022,13(12):4014−4020. [CHEN Y H, LIU Y F, QU X F, et al. Study on the protective effect of ethanol extract from ginseng adventitious roots on isoproterenol induced myocardial ischemia[J]. Journal of Food Safety and Quality Testing,2022,13(12):4014−4020.] doi: 10.3969/j.issn.2095-0381.2022.12.spaqzljcjs202212036 CHEN Y H, LIU Y F, QU X F, et al . Study on the protective effect of ethanol extract from ginseng adventitious roots on isoproterenol induced myocardial ischemia[J]. Journal of Food Safety and Quality Testing,2022 ,13 (12 ):4014 −4020 . doi: 10.3969/j.issn.2095-0381.2022.12.spaqzljcjs202212036[9] 王曼莹, 付宝玉, 徐晓浩, 等. 人参组培不定根蛋白对小鼠的抗疲劳作用及其机制[J]. 吉林大学学报(医学版),2022,48(1):18−25. [WANG M Y, FU B Y, XU X H, et al. Antifatigue effect and mechanism of ginseng tissue cultured adventitious root protein on mice[J]. Journal of Jilin University (Medical Edition),2022,48(1):18−25.] WANG M Y, FU B Y, XU X H, et al . Antifatigue effect and mechanism of ginseng tissue cultured adventitious root protein on mice[J]. Journal of Jilin University (Medical Edition),2022 ,48 (1 ):18 −25 .[10] ZHANG L, QI X, LU X T, et al. Study on hypoglycemic effects of irradiated ginseng adventitious roots[J]. Food Chemistry: X,2022,13:100234. doi: 10.1016/j.fochx.2022.100234
[11] MURTHY H N, DANDIN V S, LEE E J, et al. Efficacy of ginseng adventitious root extract on hyperglycemia in streptozotocin-induced diabetic rats[J]. Journal of Ethnopharmacology,2014,153(3):917−921. doi: 10.1016/j.jep.2014.03.062
[12] 屈青松, 林峰, 赵崇妍, 等. 发酵乳杆菌发酵人参工艺优化及人参皂苷抗氧化活性测定[J]. 中成药,2020,42(10):2738−2743. [QU Q S, LIN F, ZHAO C Y, et al. Optimization of ginseng fermentation by Lactobacillus fermentans and determination of antioxidant activity of Ginsenoside[J]. Chinese Patent Drug,2020,42(10):2738−2743.] doi: 10.3969/j.issn.1001-1528.2020.10.038 QU Q S, LIN F, ZHAO C Y, et al . Optimization of ginseng fermentation by Lactobacillus fermentans and determination of antioxidant activity of Ginsenoside[J]. Chinese Patent Drug,2020 ,42 (10 ):2738 −2743 . doi: 10.3969/j.issn.1001-1528.2020.10.038[13] 蓝瑞高, 梁益军. 人参皂苷CK对力竭游泳大鼠抗疲劳作用及骨骼肌氧化应激的影响[J]. 云南农业大学学报(自然科学),2022,37(3):491−496. [LAN R G, LIANG Y J. Effects of Ginsenoside CK on anti fatigue and oxidative stress of skeletal muscle in exhaustive swimming rats[J]. Journal of Yunnan Agricultural University (Natural Science),2022,37(3):491−496.] doi: 10.12101/j.issn.1004-390X(n).202109040 LAN R G, LIANG Y J . Effects of Ginsenoside CK on anti fatigue and oxidative stress of skeletal muscle in exhaustive swimming rats[J]. Journal of Yunnan Agricultural University (Natural Science),2022 ,37 (3 ):491 −496 . doi: 10.12101/j.issn.1004-390X(n).202109040[14] 吕世鑫, 田潇然, 王洪涛, 等. 西洋参不定根总皂苷的响应面优化提取工艺及抗氧化活性研究[J]. 食品科技,2019,44(9):248−254. [LÜ S X, TIAN X R, WANG H T, et al. Optimization of extraction process and antioxidant activity of total saponins from american ginseng adventitious roots by response surface methodology[J]. Food Technology,2019,44(9):248−254.] LÜ S X, TIAN X R, WANG H T, et al . Optimization of extraction process and antioxidant activity of total saponins from american ginseng adventitious roots by response surface methodology[J]. Food Technology,2019 ,44 (9 ):248 −254 .[15] 宋志花, 李盛红, 杨刚强, 等. 人参皂苷类化合物样品前处理及分析检测[J]. 化学进展,2020,32(Z1):239−248. [SONG Z H, LI S H, YANG G Q, et al. Sample pretreatment and analysis of Ginsenoside[J]. Progress in Chemistry,2020,32(Z1):239−248.] SONG Z H, LI S H, YANG G Q, et al . Sample pretreatment and analysis of Ginsenoside[J]. Progress in Chemistry,2020 ,32 (Z1 ):239 −248 .[16] 孙乐, 李春梅, 郭迎迎, 等. 人参花中总皂苷的提取工艺优选[J]. 中国实验方剂学杂志,2015,21(1):21−23. [SUN L, LI C M, GUO Y Y, et al. Optimization of extraction process for total saponins in ginseng flowers[J]. Chinese Journal of Experimental Traditional Medical Formulae,2015,21(1):21−23.] SUN L, LI C M, GUO Y Y, et al . Optimization of extraction process for total saponins in ginseng flowers[J]. Chinese Journal of Experimental Traditional Medical Formulae,2015 ,21 (1 ):21 −23 .[17] 徐启祥, 鄢海燕, 阮玲, 等. Box-Behnken响应面优化分光光度法测定瓜蒌总皂苷的显色条件[J]. 国际药学研究杂志,2017,44(1):65−69. [XU Q X, YAN H Y, RUAN L, et al. Optimization of coloring conditions for the determination of total saponins in fructus trichosanthes by box behnken response surface methodology[J]. International Journal of Pharmaceutical Research,2017,44(1):65−69.] XU Q X, YAN H Y, RUAN L, et al . Optimization of coloring conditions for the determination of total saponins in fructus trichosanthes by box behnken response surface methodology[J]. International Journal of Pharmaceutical Research,2017 ,44 (1 ):65 −69 .[18] 国家药典委员会. 中华人民共和国药典:2015年版一部[M]. 北京:中国医药科技出版社, 2015. [Chinese Pharmacopoeia Commission. pharmacopoeia of the people's republic of china:2015 Edition One[M]. Beijing:The Medicine Science and Technology Press of China, 2015.] Chinese Pharmacopoeia Commission. pharmacopoeia of the people's republic of china: 2015 Edition One[M]. Beijing: The Medicine Science and Technology Press of China, 2015.
[19] 程晶, 雷建都, 刘静, 等. 响应面法优化人参叶总皂苷提取工艺的研究[J]. 北京林业大学学报,2015,37(2):142−147. [CHENG J, LEI J D, LIU J, et al. Optimization of extraction process of total saponins from ginseng leaves using response surface methodology[J]. Journal of Beijing Forestry University,2015,37(2):142−147.] CHENG J, LEI J D, LIU J, et al . Optimization of extraction process of total saponins from ginseng leaves using response surface methodology[J]. Journal of Beijing Forestry University,2015 ,37 (2 ):142 −147 .[20] 刘斌, 邵美玲, 杨洋, 等. 重楼中4种皂苷提取方法的正交试验优化设计[J]. 时珍国医国药,2020,31(7):1591−1594. [LIU B, SHAO M L, YANG Y, et al. Orthogonal experimental optimization design of four saponin extraction methods from Paris polyphylla[J]. Lishizhen Medicine and Materia Medica Research,2020,31(7):1591−1594.] doi: 10.3969/j.issn.1008-0805.2020.07.016 LIU B, SHAO M L, YANG Y, et al . Orthogonal experimental optimization design of four saponin extraction methods from Paris polyphylla[J]. Lishizhen Medicine and Materia Medica Research,2020 ,31 (7 ):1591 −1594 . doi: 10.3969/j.issn.1008-0805.2020.07.016[21] 葛思琪, 赵庆生, 孙广利, 等. 芦笋总皂苷的提取纯化及抗氧化研究[J]. 食品研究与开发,2018,39(20):57−62. [GE S Q, ZHAO Q S, SUN G L, et al. Extraction, purification and antioxidant study of total saponins from Asparagus[J]. Food Research and Development,2018,39(20):57−62.] doi: 10.3969/j.issn.1005-6521.2018.20.011 GE S Q, ZHAO Q S, SUN G L, et al . Extraction, purification and antioxidant study of total saponins from Asparagus[J]. Food Research and Development,2018 ,39 (20 ):57 −62 . doi: 10.3969/j.issn.1005-6521.2018.20.011[22] WANG Yunxiao, GU Dongyu, LIU Chang, et al. Enrichment, analysis, identification and mechanism of antioxidant components in toona sinensis[J]. Chinese Journal of Analytical Chemistry,2022,14:100198.
[23] 王钦波, 王晓东. PTIO自由基清除分析法的PH值效应与黄芩素及黄芩苷的构效分析[J]. 现代医院,2019,19(1):145−148,153. [WANG Q B, WANG X D. pH effect of ptio free radical scavenging assay and structure activity analysis of baicalein and baicalin[J]. Modern Hospitals,2019,19(1):145−148,153.] doi: 10.3969/j.issn.1671-332X.2019.01.046 WANG Q B, WANG X D . pH effect of ptio free radical scavenging assay and structure activity analysis of baicalein and baicalin[J]. Modern Hospitals,2019 ,19 (1 ):145 −148,153 . doi: 10.3969/j.issn.1671-332X.2019.01.046[24] 农彦彦, 吴子瑜, 林诗堃, 等. 铁皮石斛花黄酮含量及其自由基清除力分析[J]. 食品安全导刊,2022,363(34):42−44,54. [NONG Y Y, WU Z Y, LIN S K, et al. Analysis of flavonoids content and free radical scavenging ability in Dendrobium officinale flower[J]. Food Safety Guide,2022,363(34):42−44,54.] NONG Y Y, WU Z Y, LIN S K, et al . Analysis of flavonoids content and free radical scavenging ability in Dendrobium officinale flower[J]. Food Safety Guide,2022 ,363 (34 ):42 −44,54 .[25] 张璐. 洋槐花总皂苷提取工艺及抗氧化活性研究[J]. 饲料研究,2022,45(1):82−86. [ZHANG L. Study on the extraction process and antioxidant activity of total saponins from Robinia pseudoacacia flower[J]. Feed Research,2022,45(1):82−86.] ZHANG L . Study on the extraction process and antioxidant activity of total saponins from Robinia pseudoacacia flower[J]. Feed Research,2022 ,45 (1 ):82 −86 .[26] JUNG Jieun, JANG Hyeji, EOM Sujin, et al. Fermentation of red ginseng extract by the probiotic lactobacillus plantarum kccm 11613p:ginsenoside conversion and antioxidant effects[J]. Journal of Ginseng Research,2019,43(1):20−26. doi: 10.1016/j.jgr.2017.07.004
[27] 王艳艳, 翟春梅, 申柯欣, 等. 东北刺人参抗疲劳及改善睡眠节律作用研究[J]. 食品工业科技,2020,41(2):307−311,323. [WANG Y Y, ZHAI C M, SHEN K X, et al. A study on the anti fatigue and improving sleep rhythm effects of northeast ginseng[J]. Science and Technology of Food Industry,2020,41(2):307−311,323.] WANG Y Y, ZHAI C M, SHEN K X, et al . A study on the anti fatigue and improving sleep rhythm effects of northeast ginseng[J]. Science and Technology of Food Industry,2020 ,41 (2 ):307 −311,323 .[28] 田沙沙. 黄芪总皂苷抗小鼠运动疲劳作用及机制研究[D]. 南昌:江西科技师范大学, 2021:11−13. [TIAN S S, Study on the anti exercise fatigue effect and mechanism of total saponins of Astragalus membranaceus in mice[D]. Nanchang:Jiangxi Science and Technology Normal University, 2021:11−13.] TIAN S S, Study on the anti exercise fatigue effect and mechanism of total saponins of Astragalus membranaceus in mice[D]. Nanchang: Jiangxi Science and Technology Normal University, 2021: 11−13.
[29] 藏威, 李国金, 耿红梅. 欧亚旋覆花总黄酮增强小鼠/抗疲劳抗缺氧能力研究[J]. 时珍国医国药,2013,24(2):384−385. [ZANG W, LI G J, GENG H M. Study on the enhancement of mice/anti fatigue and anti hypoxia ability of total flavonoids from eurasian convolvulus[J]. Lishizhen Medicine and Materia Medica Research,2013,24(2):384−385.] doi: 10.3969/j.issn.1008-0805.2013.02.064 ZANG W, LI G J, GENG H M . Study on the enhancement of mice/anti fatigue and anti hypoxia ability of total flavonoids from eurasian convolvulus[J]. Lishizhen Medicine and Materia Medica Research,2013 ,24 (2 ):384 −385 . doi: 10.3969/j.issn.1008-0805.2013.02.064[30] 刘兴琴, 丁济超, 李继兴, 等. 西归粗多糖对运动疲劳小鼠的免疫调节作用[J]. 食品工业科技,2021,42(5):317−321,327. [LIU X Q, DING J C, LI J X, et al. Immunomodulatory effect of Xigui crude polysaccharide on exercise fatigue mice[J]. Science and Technology of Food Industry,2021,42(5):317−321,327.] LIU X Q, DING J C, LI J X, et al . Immunomodulatory effect of Xigui crude polysaccharide on exercise fatigue mice[J]. Science and Technology of Food Industry,2021 ,42 (5 ):317 −321,327 .[31] YU Yang, LIU Hao, NIE Jianing, et al. Acidic polysaccharides of mountain cultivated ginseng:the potential source of anti-fatigue nutrients[J]. Journal of Functional Foods,2022,95:105198. doi: 10.1016/j.jff.2022.105198
-
期刊类型引用(7)
1. 杨敏,张密,叶贤胜,曾长立,马爱民,牛蒙亮,许丹云. 大球盖菇多肽的制备、抗氧化及抗肿瘤活性的研究. 山西农业大学学报(自然科学版). 2025(01): 123-132 .  百度学术
百度学术
2. 魏磊,景炳年,李宁洁,金饶,谢晓阳,刘雨晴,马艳妮,梁雅辉,王韬,王伟. 赤松茸乙醇提取物不同萃取相生物活性对比. 食品研究与开发. 2025(04): 39-45 .  百度学术
百度学术
3. 王小平,刘忠莹,钟洋,张定秋,陆阳,朱敏敏,郑红毅,何叶馨,王鑫,黄韬睿,江祖彬. 基于离子色谱-电感耦合等离子体质谱法分析木耳、香菇、松茸和茶树菇中砷形态分布. 食品工业科技. 2024(07): 254-260 .  本站查看
本站查看
4. 韦菡燕,蒋军文. 等离子体对松茸多糖抗疲劳作用的影响. 保鲜与加工. 2024(10): 128-133 .  百度学术
百度学术
5. 黄磊,何春梅,司灿,石鸿宇,段俊. 大球盖菇栽培研究进展. 中国食用菌. 2023(03): 8-14 .  百度学术
百度学术
6. 魏磊,王伟,谢晓阳,周雍,刘雨晴,马艳妮,宁二娟,王韬,李宁洁,景炳年. 响应面优化博爱赤松茸多糖提取工艺及其抑菌和抗氧化活性研究. 食品工业科技. 2023(15): 213-220 .  本站查看
本站查看
7. 曹燕妮,华蓉,邓雅元,王娟,游金坤. 食用菌中维生素测定方法研究. 中国食用菌. 2022(09): 44-47 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



