Research on Properties and Applications of Biodegradable Modified Starch-based Films
-
摘要: 石油基塑料制品滥用带来的环境问题日益严重,具有不可再生性的石油资源也日益短缺,导致生物聚合物基材料的出现。淀粉具有可生物降解性和可再生性,可以作为石油基的良好替代品。然而,淀粉基可生物降解薄膜具有机械性能差和亲水性等缺陷,限制了其在商业上的进一步应用。因此,对淀粉进行物理或化学改性是改善薄膜特性的主要方法之一。本文介绍了淀粉的多尺度结构特性,综述了制备生物降解薄膜的淀粉改性方法及研究进展。重点介绍了改性手段对淀粉基薄膜机械性能、水蒸气渗透性能、透明度和生物降解性等特性的影响,淀粉基材料的性质决定着其应用的方向。最后阐述了淀粉基可生物降解薄膜的应用。改性淀粉基薄膜特性的研究为改善淀粉基薄膜性能提供了一定的理论基础。Abstract: The increasingly severe environmental problems caused by the abuse of petroleum-based plastics and the increasing shortage of nonrenewable petroleum resources have led to the emergence of biopolymer-based materials. Starch is biodegradable and renewable and can be used as a good substitute for petroleum bases. However, further commercial application of starch-based biodegradable films is limited by their poor mechanical properties and hydrophilicity. Therefore, the physical or chemical modification of starch is one of the main methods to improve the properties of films. In this review, the multiscale structural properties of starch are introduced, and the modification methods and current research of starch for preparing biodegradable films are reviewed. The effects of modification methods on the mechanical properties, water vapor permeability, transparency and biodegradability of starch-based films are mainly introduced. The properties of starch-based materials determine the direction of their application. Finally, the application of starch-based biodegradable fims is described. The study of the properties of modified starch-based films provides a theoretical basis for improving the properties of starch-based films.
-
Keywords:
- biodegradable /
- starch-based films /
- modified starch /
- physicochemical properties
-
随着塑料制品逐渐出现在人们的生活中,人们对塑料越发依赖[1]。然而,石油基塑料的高消耗率和低降解率造成塑料垃圾的大量堆积[2],危害人类健康以及生态环境。同时,塑料的大量生产导致石油资源被过度开采[3],资源短缺问题愈发严峻。使用可生物降解材料可以缓解上述问题,因此,由可生物降解聚合物[4]制成的塑料成为近年来的研究热点,其包括研究应用于食品涂层与包装[5]、药物缓释载体[6]、组织工程支架[7]、农业地膜[8]和智能薄膜[9]等多个领域。
淀粉的低成本、可生物降解和可再生性等优点,是作为不可再生和不可降解石油基塑料的可持续替代品的关键[10]。淀粉基可降解塑料已应用于食品包装薄膜[11]、农用地膜、垃圾袋[12]、餐叉和制药[13]等多个领域。然而,淀粉基薄膜疏水性能较差和机械性能较弱等缺陷限制其大规模商业化使用。为改善淀粉基薄膜性能,学者们进行了许多研究[14-16]。目前常用的方法是添加多元醇,纳米填料、复合纤维素纳米晶体[17]等。此外,对淀粉改性也是近年来的研究热点[10,14-15]。
淀粉改性方法有物理改性、化学改性、酶改性[15]。淀粉的物理改性是通过光、热、电、机械力等手段改变淀粉颗粒原有的结构和性质,如湿热处理、超声波处理、等离子体处理[18]和挤压处理等[19]。化学改性的方法有氧化、交联、酯化、醚化、接枝等。化学改性主要通过化学反应增强淀粉的热塑性和可加工性[20]。酶改性法近年来备受研究者的喜爱,然而目前酶改性淀粉膜只适合在实验室进行制备。影响薄膜性能的主要因素,包括基质的种类、增塑剂、增强剂、无机物、活性物质等,此前研究者们对不同增塑剂[21]、不同的多糖基质[11]等对包装膜性能的影响进行综述,而了解不同改性淀粉对薄膜性能影响也有重要意义。本文重点介绍了制备生物降解薄膜的淀粉改性方法,综述了改性手段对淀粉基薄膜溶解性、机械性能、水蒸气渗透性能、透明度和生物降解性等特性的影响,并阐述了可生物降解淀粉基薄膜的应用进展,旨在让研究者们更清楚地了解目前改性淀粉基薄膜的研究进展,为改善膜性能提供新的思路与方法,提高生物降解淀粉基膜的商业价值。
1. 淀粉结构与特性
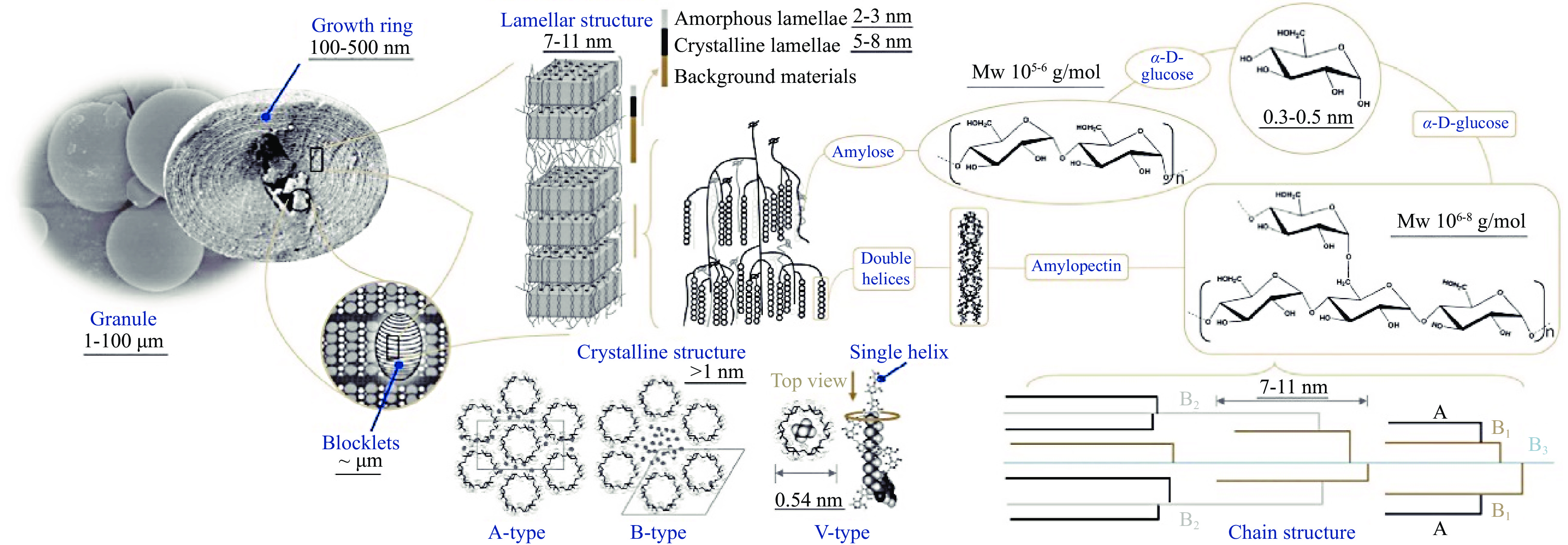
淀粉是一种复杂的碳水化合物聚合物,以淀粉颗粒的形式积累。淀粉颗粒由两种主要多糖组成,即直链淀粉和支链淀粉。直链淀粉构成淀粉颗粒晶体结构的无定形区,支链淀粉双螺旋结构构成结晶区[22]。淀粉的结构一般认为主要分为如下四个不同的尺度水平:颗粒结构、生长环结构、片层结构、分子链结构[23]。
1.1 颗粒结构
天然淀粉是一种丰富的生物聚合物,以半结晶和不溶性颗粒形式存在,由直链淀粉和支链淀粉分子组成。不同植物来源的淀粉,其颗粒形状和大小具有显著性差异(P<0.05)。颗粒形状可借助光学显微镜、扫描电子显微镜(scanning electron microscope,SEM)、激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)、透射电子显微镜(transmission electron microscopy,TEM)等观察[24]。如表1所示,淀粉颗粒形态会根据植物来源不同而存在差异。
SEM是观察淀粉颗粒形貌最常用的一种设备。图1为几种淀粉颗粒形态的扫描电镜图[25]。玉米和小米淀粉颗粒表面存在通道和随机分布的孔隙[26],通常呈簇状,小麦淀粉颗粒沿赤道沟有气孔,而豌豆淀粉表面有皱纹,这些孔和通道导致淀粉颗粒对酶或化学试剂高度敏感[24]。
1.2 生长环结构
生长环的实质为淀粉的半结晶壳层与无定形壳层呈周期性交替排列[27]。生长环又称为壳结构,是指围绕细胞脐的同心环状结构,主要由blocklets组成[28]。晶态和非晶态片层的交替排列是进一步形成blocklets的基础。无定形层由直链淀粉和支链淀粉无序构象组成,无定形生长环中的blocklets具有更多缺陷的结构。半结晶层是以结晶区和无定形区交替形成的层状结构,每7~11 nm为一个重复距离[27]。通过SEM可以观察和研究淀粉颗粒经酸或酶水解后的壳结构[29]。Wang等[30]通过SEM和TEM清楚观察到豌豆淀粉的半结晶环。结果表明,酸改性程度不同,淀粉颗粒的破碎程度也不同。疏松的无定形区比结晶区更容易发生水解。淀粉层次结构如图2所示[31]。
1.3 片层结构
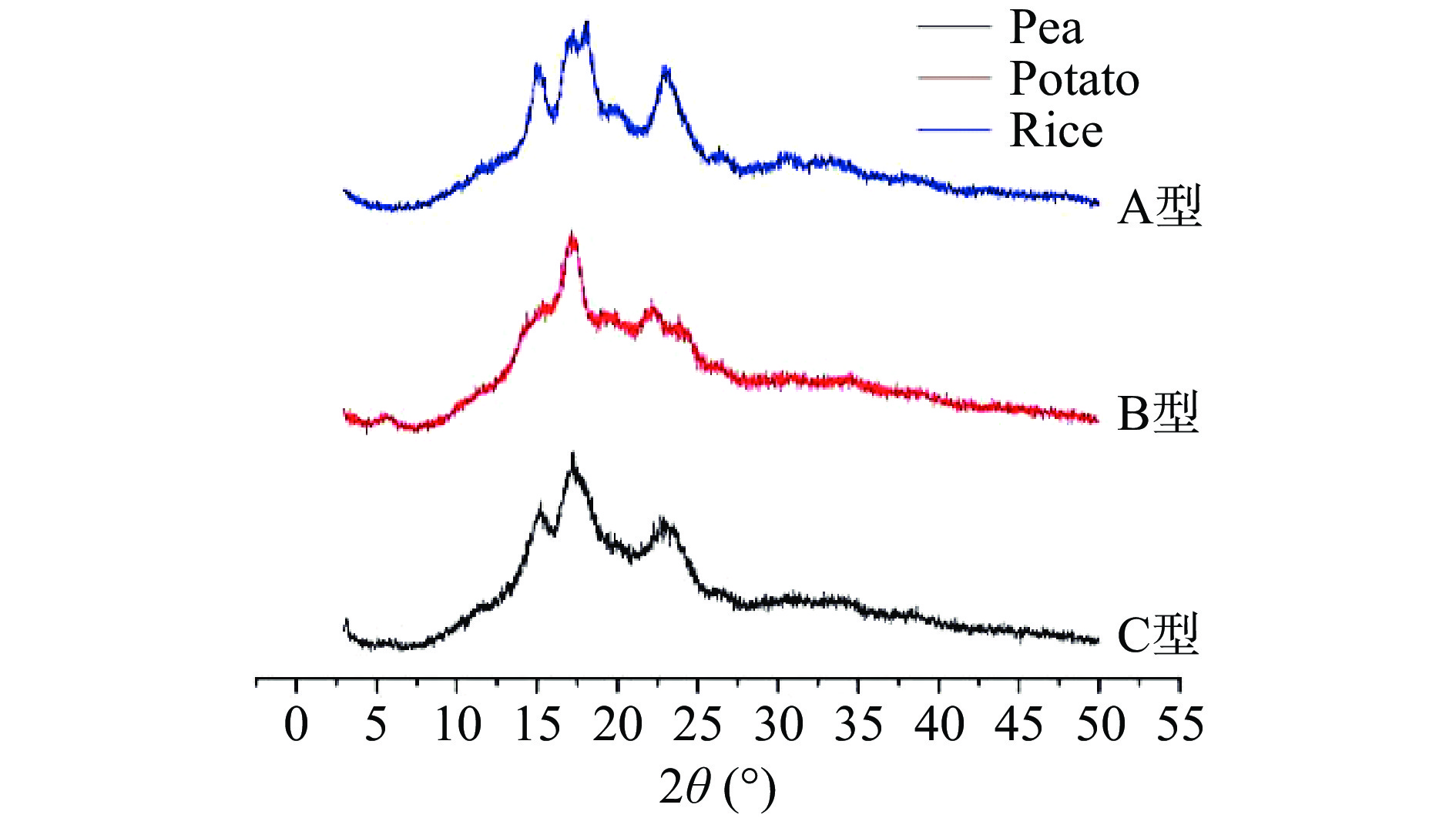
淀粉的片层结构,即半结晶结构,由结晶片层和无定形片层交替而成[27]。淀粉颗粒具有A、B、C和V型。A型晶体是单斜晶胞构型,B型结晶是六边形晶胞构型,如图2所示。谷物淀粉如大麦、玉米、小麦等大多属于A型,2θ观察到15°和23°的两个强峰以及17°和18°的双峰;高直链谷物淀粉、块茎淀粉和老化淀粉属于B型,2θ观察到在5.4°、17°、20°、22°和23°处具有强峰[23];从A型到B型连续变化,位于变化中间状态的即为C型,C型结晶特征衍射峰在2θ为5.7°、15.3°、17.3°、18.3°、23.5°,根和豆类淀粉属C型者居多。V型结晶形态特征衍射峰出现在2θ为7.4°、13.0°和20.5°处,淀粉V型结晶是直链淀粉与其他配体形成的复合物,如脂肪酸、醇类、碘和乳化剂等[26,32]。不同晶型淀粉的XRD如图3所示[33]。
1.4 分子链结构
淀粉是一种葡萄糖支链聚合物,其直链淀粉和支链淀粉的分子量和大小分布范围很广。淀粉由D-葡萄糖通过α-1,4-糖苷键相连,分支点由α-1,6-糖苷键组成。不同分子结构会影响淀粉的理化性质。淀粉分子结构,即链长分布和分子大小分布对淀粉性质至关重要,直链淀粉和支链淀粉的比例和结构决定了淀粉的粘性、弹性、膨胀能力等,进而影响形成薄膜和涂层的能力[34-35]。直链淀粉显著影响淀粉凝胶的形成,而支链淀粉会影响淀粉颗粒的逆变、糊化、酸水解、酶水解和流变特性[36]。尺寸排阻色谱和荧光辅助毛细管电泳最常用于测定淀粉链长分布[37]。支链淀粉链通常根据分支点和聚合度(DP)分为A链(DP 6~12)、B链和C链三种类型。其中B链可以细分B1(DP 13~24)、B2(DP 25~36)、B3(DP≥37)。C链为主链,包含唯一的还原末端残基[28]。
2. 制备薄膜的淀粉改性方法
目前研究应用于改善淀粉基膜性能的方法众多,对淀粉进行改性是改善膜性能的重要方法之一。化学、物理以及复合改性是淀粉改性的常见方法。对可生物降解淀粉进行改性的常用方法有湿热处理、低温等离子体改性、氧化、交联、接枝、酯化改性和酸改性等。
湿热处理的物理改性促进了无定形和半结晶区域的淀粉螺旋结构的重排,促进分子流动性和成膜。湿热处理香蕉淀粉制得的生物塑料力学性能得到改善,水蒸气渗透率更低[21],可作为水果包装材料。低温等离子体改性处理是一种干法非热物理改性方法,等离子体使淀粉分子发生交联、解聚和刻蚀。低温等离子体技术提高了淀粉基薄膜的热稳定性和力学性能,降低了薄膜的透气性[47]。
化学改性(氧化、交联、羟丙基化、乙酰化和这些方法的组合),可以改善淀粉基薄膜颜色、阻隔性能和机械性能等。常见的用于淀粉氧化改性的氧化剂有次氯酸钠、高锰酸钾和过氧化氢等。据报道,用臭氧氧化反应修饰马铃薯淀粉制备可生物降解薄膜,薄膜的力学性能增强,疏水性得到改善[48]。为了进一步改善可生物降解薄膜的性能,对淀粉进行双改性(即淀粉先后进行两次不同方法的改性处理)被用于改善淀粉基薄膜性能的研究。通过过氧化氢氧化与戊二醛交联改性,双重改性淀粉膜的膨胀力和吸湿性明显低于单改性膜。此外,双改性薄膜还具有良好的刚度和延展性,并表现出良好的热性能和生物降解性[49]。还有文献报道交联和乙酰化木薯淀粉基薄膜疏水性和机械性能均优于天然木薯淀粉制备的薄膜,交联木薯淀粉表现出更强的疏水性[50]。经羟丙基化和交联改性的大米淀粉制成的薄膜,机械性能、透明度值和水蒸气渗透性均得到改善,并且两种改性试剂的浓度影响薄膜的性能[51]。
将天然淀粉与性能优良的合成聚合物通过化学反应结合在一起是制备淀粉接枝共聚物的主要方式之一,王雪[20]通过研究淀粉/乳酸接枝共聚物辅助以羧甲基纤维素制备淀粉基薄膜发现其增强了膜的力学性能。利用乳酸和氧化法改性高粱淀粉[52]、月桂酰氯修饰玉米淀粉[53]制备的淀粉基薄膜均显示出拉伸强度和刚度的增加,可适用于硬包装。
3. 改性对可降解淀粉基薄膜性能影响
3.1 厚度、溶解度和溶胀力(swelling power,SP)
淀粉基薄膜的厚度是其阻隔性能以及水蒸气渗透性的重要参数。通常对淀粉进行改性处理并不会改变薄膜的厚度,但淀粉浓度以及增塑剂的添加会影响膜的厚度,是由于成膜溶液中固体成分增加[54]。随着醋酸酐浓度的增加,高粱淀粉基膜厚度趋于增加[55]。淀粉基薄膜的溶解度与SP值很大程度上取决于淀粉的改性剂。从文献可知,羟丙基化淀粉基薄膜溶解度大于乙酰化淀粉基薄膜,交联淀粉基薄膜溶解度最低。可能原因是羟丙基亲水性较强,交联使淀粉链间氢键作用加强,淀粉疏水性增强[55-56]。Mehboob等[55]研究发现乙酰化高粱淀粉基膜的溶解度高于交联改性或双改性淀粉制得的薄膜溶解度,但均低于天然淀粉基薄膜。在交联改性淀粉的基础上加入氧化钙进行改性,由于氧化钙与淀粉分子强相互作用,使淀粉基薄膜的SP值降低[57]。经过湿热处理的香蕉淀粉制备的薄膜溶解度没有显著变化[16]。
3.2 机械性能
淀粉基薄膜的抗拉强度(tensile strength,TS)和断裂伸长率(elongation at break,EAB)是两个重要的机械性能指标,有助于判断薄膜的拉伸强度和延展性。淀粉基薄膜需要足够的机械强度和拉伸性能来满足消费者日常生活的包装需求。通过研究表明,无论是物理改性还是化学改性,所制备的淀粉基薄膜均表现出比天然淀粉基薄膜更好的机械性能。交联剂具有疏水性,且易与淀粉分子发生相互作用,形成强有力的网络结构,致使交联淀粉基薄膜具有更高的TS,但EAB降低[58],如表2所示。淀粉双改性可以实现每个单独改性的功能优势。环氧丙烷羟丙基化导致淀粉分子中的键合减弱,从而为交联试剂提供更多的空间在淀粉分子中发生作用,使羟丙基化交联淀粉基薄膜TS增加,疏水性增强。环氧丙烷充当了类似增塑剂的作用,薄膜的EAB增加[51]。对于双改性淀粉基膜,改性的先后顺序以及改性试剂添加的浓度也是影响膜性能的重要因素,研究者们需要探究出最佳的改性剂配比。Prachayawarakorn等[49]曾报道,双改性淀粉膜获得了良好的强度和延展性,机械性能明显高于单改性淀粉膜,特别是对于交联氧化薄膜,表现出比氧化交联淀粉膜更好的拉伸性能。
表 2 不同类型改性淀粉对淀粉基薄膜理化特性的影响Table 2. Effects of different types of modified starch on physicochemical properties of starch-based films淀粉类型 改性方法 功能特性 参考文献 拉伸强度TS
(MPa)断裂伸长率EAB
(%)水蒸气渗透率WVP
(g/m·s·Pa)×10−9玉米淀粉 未改性 0.29~0.43 59.33~66.59 1.80~2.10 [58] 玉米淀粉 三偏磷酸钠 (STMP) 0.23~0.53 13.94~19.00 1.30~1.50 [58] 绿香蕉淀粉 湿热处理 20.21~29.85 2.94~5.98 0.65~0.88 [16] 大米淀粉 环氧丙烷醚化+三偏磷酸钠和三聚磷酸钠混合物交联 6.18~8.71 68.70~126.11 1.23~1.89 [51] 山药淀粉 氧化+三偏磷酸钠交联 2.18~6.09 8.49~16.62 0.45~1.5 [54] 高粱淀粉 交联+乙酰化 0.68~8.33 1.01~15.38 1.10~2.50 [55] 木薯淀粉 羟丙基化热塑性淀粉+聚己二酸对苯二甲酸丁二醇酯 (PBAT) − − 0.43~0.76 [59] 小麦淀粉 支链淀粉酶脱支 19.47~22.07 5.94~6.72 − [15] 3.3 水蒸气渗透率(water vapor permeability,WVP)
作为食品包装材料,薄膜具有良好的阻隔性能对保护产品质量尤为重要。水和亲水性基质之间的高亲和力促进了淀粉膜的吸附和扩散,从而影响包装食品的保质期。物理或化学改性淀粉均能降低淀粉基薄膜的WVP值。物理处理条件可以改变淀粉与水分子间的氢键作用[16],而对于化学改性淀粉基薄膜,除了试剂与淀粉分子间的反应之外,改性试剂本身的疏水性能是影响薄膜WVP值的重要因素[58]。交联剂与淀粉分子的强相互作用限制了淀粉链在无定形区域的流动性并防止水分与淀粉羟基结合,使薄膜WVP值降低。相反,环氧丙烷具有亲水性,阻隔水蒸气的性能较弱[51]。因此,对于需要阻隔水蒸气的包装材料,选用交联改性淀粉基薄膜是一个不错的选择。山药淀粉氧化[56]使得淀粉亲水性羟基被更疏水的醛基取代,因此,氧化淀粉膜吸收水蒸气的能力降低,其阻隔水蒸气的能力高于报道的乙酰化交联改性淀粉基薄膜[55],低于羟丙基化改性热塑性木薯淀粉基薄膜[59]的阻隔性能。不相容的热塑性淀粉(thermoplastic starch,TPS)和PBAT之间的高度相分离消除了TPS的亲水性。TPS层的表面相互作用被疏水性PBAT覆盖,而羟基被迫进入核心。因此,基体中暴露的羟基数目减少,降低了基体对水蒸气的亲和力,导致扩散率降低[59]。
3.4 薄膜颜色与透明度特性
光学特性对食品包装材料具有重要意义,因为它直接影响产品的外观和消费者的接受度。包装材料的光学特性会影响食品的质量,给消费者的直观感受会影响产品的销量。食品包装膜的主要作用之一是保护食品免受紫外线伤害。改性淀粉基薄膜与天然淀粉基薄膜在颜色与透明度方面产生差异与淀粉浓度和改性剂类型有关。Yıldırım-Yalçın等[58]研究发现,所有薄膜的亮度(L*)值较高,STMP交联改性淀粉会增加膜的绿度(a*)和黄度(b*)值。此外,可食用薄膜中的交联淀粉显著降低了薄膜的透明度。可能原因是改性剂与淀粉分子发生反应,使淀粉颗粒内的分子间或分子内缔合受到阻碍,导致薄膜颜色变浅,不透明度增加。直链淀粉与支链淀粉分子结构是影响淀粉透明度的重要因素之一。据报道,与原淀粉相比,经支链淀粉酶脱支后的淀粉制备淀粉基薄膜的透明度会显著降低(P<0.05)[15]。羟丙基淀粉中较高的取代度会增强吸水性,从而导致增塑剂和聚合物溶胀并增加自由体积和光传输路径,有效提高薄膜的透明度,增加光透射率[59]。Cheng等[14]研究发现双重改性后,薄膜的不透明度显著降低。与天然木薯淀粉薄膜相比,乙酰化淀粉薄膜具有更高的透明度。木薯淀粉基薄膜覆盖的图像仍然清晰可见,可识别出被覆盖物体的颜色,这表明木薯淀粉基薄膜具有良好的光学性质。
3.5 可生物降解性
可降解性是淀粉基材料最大的优势。淀粉基材料的生物降解是指可在土壤或堆肥等环境下,通过微生物生物活性作用分解。Prachayawarakorn等[49]通过测定土埋试验前后力学性能的变化来判断聚合物薄膜的生物降解性。结果表明,试验膜在土壤中掩埋16 d后最大载荷下的应力、杨氏模量和最大载荷下的应变相较于土埋前均显著下降(P<0.05)。整体机械性能的下降可能归因于薄膜吸收水分发生一定的溶解以及土壤中存在可能降解薄膜的微生物。淀粉改性方法在一定程度上影响着薄膜可生物降解速度。交联剂具有疏水作用,且能够与淀粉分子形成致密的网络结构,减少水分扩散到薄膜样品中,从而减少微生物的攻击,致使微生物降解速度较慢。将未改性淀粉基薄膜与柠檬酸交联改性淀粉基薄膜在相同湿度和温度的蔬菜堆肥中相同天数,取出后发现所有的薄膜均显示出色调的改变以及薄膜表面出现不同程度和数量的气孔,但交联改性淀粉气孔小且数目少,即发生降解的程度最低[60]。这一现象可以用交联剂的疏水性以及与淀粉相互作用来解释。通过薄膜生物降解性研究表明,改性淀粉基薄膜在开发环保包装材料方面具有广阔的潜力。
4. 可生物降解淀粉基薄膜的应用
目前塑料污染现象严重以及石油资源有限等问题突出,可生物降解薄膜有助于减少石油资源产生的环境污染和废弃物,并且减少对海洋生物和人体健康的危害。基于生物聚合物的食用涂层已成为一种新兴的包装策略,可延长鲜切水果和蔬菜的保质期。淀粉基薄膜已被应用于水果涂层,但由于其自身缺陷,需要与其他聚合物结合以增强其机械特性和耐水性。木薯淀粉,明胶和壳聚糖与葡萄糖醇混合,通过使用浇铸技术配制具有更好机械和阻隔性能的可生物降解薄膜,用于水果涂层[61]。
基于明胶-壳聚糖-玉米淀粉并掺入乳酸链球菌素制备的三层薄膜应用于番茄保鲜。放置相同天数后,相较于直接暴露在空气中的番茄和用聚乙烯塑料袋包装的番茄,生物复合薄膜在保持番茄质量、表皮紧致度和表面色泽度方面更胜一筹。此外,在生物复合薄膜保鲜的番茄中检测到很少的细菌,即掺入乳酸链球菌素的复合膜抑菌效果良好[62]。
鲜肉的储存对于保持肉质色泽和口感新鲜尤为重要。基于百里香精油和微胶囊的马铃薯淀粉基抗菌复合膜,应用于包装鲜猪肉时,无论是保鲜护色,还是抑制细菌,均表现出比聚乙烯塑料袋优异的结果。此外,复合膜包装的猪肉口感更佳[63]。通过研究证明,淀粉基薄膜在未来将会有更广阔的市场。综上,淀粉基薄膜的功能特性受淀粉、增塑剂、复合物种类和配比等影响,研究者们需要探究出优质薄膜性能的最佳配比,将淀粉基薄膜应用达到利益最大化。
5. 结论与展望
随着环保理念的推广,将淀粉作为可生物降解薄膜基质是大势所趋。然而,淀粉基薄膜成膜能力差,难以制备满足消费者环保包装需求的可生物降解包装材料。对不同淀粉进行单一改性并不能解决包装材料亲水且机械性能差等问题。要想获取能大量应用于市场的食品包装,必须结合复杂的多重改性方法以及添加增塑剂、增强剂和纳米填料等。此外,淀粉基可降解塑料的生产成本较高。所以研究薄膜性能的同时,研究者们尝试选择低成本的改性手段、试剂、共混物和开发简单而快速的加工方法生产淀粉基材料也是相当重要的。
目前改善淀粉基薄膜性能的方式越来越多,未来需要对淀粉、增塑剂和纳米颗粒进行更多研究,重点是减少吸水率和减少材料的回生,避免储存期间材料机械强度降低。此外,研究者们不应该只关注于对薄膜性能的研究,还应对淀粉多尺度结构进行更深入的研究,淀粉结构与材料性能之间存在的关系急需研究者们分析解决。研究者制备的薄膜的应用性也具有研究意义。探索低成本、高性能的淀粉基可降解塑料是未来的目标,使淀粉基薄膜能够作为塑料包装材料、可食性膜以及医用膜等在更多领域得到应用。
-
表 1 不同植物来源淀粉颗粒形态与大小
Table 1 Starch granule morphology, size and crystal form from different plant sources
表 2 不同类型改性淀粉对淀粉基薄膜理化特性的影响
Table 2 Effects of different types of modified starch on physicochemical properties of starch-based films
淀粉类型 改性方法 功能特性 参考文献 拉伸强度TS
(MPa)断裂伸长率EAB
(%)水蒸气渗透率WVP
(g/m·s·Pa)×10−9玉米淀粉 未改性 0.29~0.43 59.33~66.59 1.80~2.10 [58] 玉米淀粉 三偏磷酸钠 (STMP) 0.23~0.53 13.94~19.00 1.30~1.50 [58] 绿香蕉淀粉 湿热处理 20.21~29.85 2.94~5.98 0.65~0.88 [16] 大米淀粉 环氧丙烷醚化+三偏磷酸钠和三聚磷酸钠混合物交联 6.18~8.71 68.70~126.11 1.23~1.89 [51] 山药淀粉 氧化+三偏磷酸钠交联 2.18~6.09 8.49~16.62 0.45~1.5 [54] 高粱淀粉 交联+乙酰化 0.68~8.33 1.01~15.38 1.10~2.50 [55] 木薯淀粉 羟丙基化热塑性淀粉+聚己二酸对苯二甲酸丁二醇酯 (PBAT) − − 0.43~0.76 [59] 小麦淀粉 支链淀粉酶脱支 19.47~22.07 5.94~6.72 − [15] -
[1] REINOLD S, HERRERA A, HERNÁNDEZ-GONZÁLEZ C, et al. Plastic pollution on eight beaches of Tenerife (Canary Islands, Spain): An annual study[J]. Marine Pollution Bulletin,2020,151:110847. doi: 10.1016/j.marpolbul.2019.110847
[2] SAEAUNG K, PHUSUNTI N, PHETWAROTAI W, et al. Catalytic pyrolysis of petroleum-based and biodegradable plastic waste to obtain high-value chemicals[J]. Waste Management,2021,127:101−111. doi: 10.1016/j.wasman.2021.04.024
[3] 姚顺. 玄武岩纤维增强聚乳酸绿色复合材料的制备及性能调控[D]. 西安: 西安理工大学, 2020 YAO S. Preparation and property control of basalt fiber reinforced polylactic acid green composites[D]. Xi'an: Xi'an University of Technology, 2020.
[4] ZHANG L, ZHAO J, ZHANG Y, et al. The effects of cellulose nanocrystal and cellulose nanofiber on the properties of pumpkin starch-based composite films[J]. International Journal of Biological Macromolecules,2021,192:444−451. doi: 10.1016/j.ijbiomac.2021.09.187
[5] AHMAD M, NIRMAL N P, DANISH M, et al. Characterisation of composite films fabricated from collagen/chitosan and collagen/soy protein isolate for food packaging applications[J]. RSC Advances,2016,6(85):82191−82204. doi: 10.1039/C6RA13043G
[6] VALENTI S, DIAZ A, ROMANINI M, et al. Amorphous binary dispersions of chloramphenicol in enantiomeric pure and racemic poly-lactic acid: Morphology, molecular relaxations, and controlled drug release[J]. International Journal of Pharmaceutics,2019,568:118565. doi: 10.1016/j.ijpharm.2019.118565
[7] IRASTORZA A, ZARANDONA I, ANDONEGI M, et al. The versatility of collagen and chitosan: From food to biomedical applications[J]. Food Hydrocolloids,2021,116:106633. doi: 10.1016/j.foodhyd.2021.106633
[8] RIZZARELLI P, RAPISARDA M, ASCIONE L, et al. Influence of photo-oxidation on the performance and soil degradation of oxo- and biodegradable polymer-based items for agricultural applications[J]. Polymer Degradation and Stability,2021,188:109578. doi: 10.1016/j.polymdegradstab.2021.109578
[9] PERERA K Y, SHARMA S, PRADHAN D, et al. Seaweed polysaccharide in food contact materials (active packaging, intelligent packaging, edible films, and coatings)[J]. Foods,2021,10(9):2088. doi: 10.3390/foods10092088
[10] WANG B, YAN S, GAO W, et al. Antibacterial activity, optical, and functional properties of corn starch-based films impregnated with bamboo leaf volatile oil[J]. Food Chemistry,2021,357:129743. doi: 10.1016/j.foodchem.2021.129743
[11] CAZÓN P, VELAZQUEZ G, RAMÍREZ J A, et al. Polysaccharide-based films and coatings for food packaging: A review[J]. Food Hydrocolloids,2017,68:136−148. doi: 10.1016/j.foodhyd.2016.09.009
[12] ZHANG C, CHEN F, MENG W, et al. Polyurethane prepolymer-modified high-content starch-PBAT films[J]. Carbohydrate Polymers,2021,253:117168. doi: 10.1016/j.carbpol.2020.117168
[13] SHA H, CUI B, YUAN C, et al. Catechin/β-cyclodextrin complex modulates physicochemical properties of pre-gelatinized starch-based orally disintegrating films[J]. International Journal of Biological Macromolecules,2022,195:124−131. doi: 10.1016/j.ijbiomac.2021.11.206
[14] CHENG M, CUI Y, YAN X, et al. Effect of dual-modified cassava starches on intelligent packaging films containing red cabbage extracts[J]. Food Hydrocolloids,2022,124:107225. doi: 10.1016/j.foodhyd.2021.107225
[15] TANG J, ZOU F, GUO L, et al. The relationship between linear chain length distributions of amylopectin and the functional properties of the debranched starch-based films[J]. Carbohydrate Polymers,2022,279:119012. doi: 10.1016/j.carbpol.2021.119012
[16] VIANA E B M, OLIVEIRA N L, RIBEIRO J S, et al. Development of starch-based bioplastics of green plantain banana (Musa paradisiaca L.) modified with heat-moisture treatment (HMT)[J]. Food Packaging and Shelf Life,2022,31:100776. doi: 10.1016/j.fpsl.2021.100776
[17] PUNIA BANGAR S, WHITESIDE W S, DUNNO K D, et al. Starch-based bio-nanocomposites films reinforced with cellulosic nanocrystals extracted from Kudzu (Pueraria montana) vine[J]. International Journal of Biological Macromolecules,2022,203:350−360. doi: 10.1016/j.ijbiomac.2022.01.133
[18] GUO Z, GOU Q, YANG L, et al. Dielectric barrier discharge plasma: A green method to change structure of potato starch and improve physicochemical properties of potato starch films[J]. Food Chemistry,2022,370:130992. doi: 10.1016/j.foodchem.2021.130992
[19] 徐丽娟, 娄新曼. 改性淀粉的生产技术现状与发展趋势[J]. 粮油仓储科技通讯,2021,37(3):38−42. [XU L J, LOU X M. Production technology status and development trend of modified starch[J]. Grain and Oil Storage Technology Newsletter,2021,37(3):38−42. XU L J, LOU X M. Production technology status and development trend of modified starch[J]. Grain and Oil Storage Technology Newsletter, 2021, 37(3): 38-42.
[20] 王雪. 淀粉/乳酸接枝共聚物及其淀粉基薄膜的制备与性能研究[D]. 北京: 中国地质大学, 2018 WANG X. Preparation and properties of starch/lactic acid graft copolymer and its starch-based films[D]. Beijing: China University of Geosciences, 2018.
[21] WANG B, YU B, YUAN C, et al. An overview on plasticized biodegradable corn starch-based films: The physicochemical properties and gelatinization process[J]. Critical Reviews in Food Science and Nutrition,2022,62(10):2569−2579. doi: 10.1080/10408398.2020.1868971
[22] 周冬冬. 小麦籽粒淀粉结构形成特点及其对高温的响应[D]. 扬州: 扬州大学, 2016 ZHOU D D. Starch structure formation in wheat grain and its response to high temperature[D]. Yangzhou: Yangzhou University, 2016.
[23] JUNEJO S A, FLANAGAN B M, ZHANG B, et al. Starch structure and nutritional functionality-Past revelations and future prospects[J]. Carbohydrate Polymers,2022,277:118837. doi: 10.1016/j.carbpol.2021.118837
[24] ZAN K, WANG J, REN F, et al. Structural disorganization of cereal, tuber and bean starches in aqueous ionic liquid at room temperature: Role of starch granule surface structure[J]. Carbohydrate Polymers,2021,258:117677. doi: 10.1016/j.carbpol.2021.117677
[25] 翟一潭, 柏玉香, 李晓晓, 等. 酶法改性淀粉颗粒的研究进展[J]. 食品科学,2021,42(7):319−328. [ZHAI Y T, BAI Y X, LI X X, et al. Research progress of enzymatic modification of starch granules[J]. Food Science,2021,42(7):319−328. ZHAI Y T, BAI Y X, LI X X, et al. Research progress of enzymatic modification of starch granules[J]. Food Science, 2021, 42(7): 319-328.
[26] MA M, XU Z, CHEN X, et al. Architecture of outer shell and inner blocklets of rice starch granule is related to starch granule-associated proteins[J]. Food Hydrocolloids,2022,127:107551. doi: 10.1016/j.foodhyd.2022.107551
[27] 韩文芳. 玉米淀粉中间级分的分子结构研究[D]. 武汉: 华中农业大学, 2016 HAN W F. Molecular structure of intermediate fractions of corn starch[D]. Wuhan: Huazhong Agricultural University, 2016.
[28] CHI C, LI X, HUANG S, et al. Basic principles in starch multi-scale structuration to mitigate digestibility: A review[J]. Trends in Food Science & Technology,2021,109:154−168.
[29] SUN X, SUN Z, SALEH A S M, et al. Understanding the granule, growth ring, blocklets, crystalline and molecular structure of normal and waxy wheat A- and B- starch granules[J]. Food Hydrocolloids,2021,121:107034. doi: 10.1016/j.foodhyd.2021.107034
[30] WANG S, YU J, YU J. The semi-crystalline growth rings of C-type pea starch granule revealed by SEM and HR-TEM during acid hydrolysis[J]. Carbohydrate Polymers,2008,74(3):731−739. doi: 10.1016/j.carbpol.2008.03.001
[31] RAO M, OKECHUKWU P, DA SILVA P, et al. Rheological behavior of heated starch dispersions in excess water: Role of starch granule[J]. Carbohydrate Polymers,1997,33(4):273−283. doi: 10.1016/S0144-8617(97)00025-8
[32] 史苗苗, 李丹, 闫溢哲, 等. 不同结晶结构淀粉的拉曼光谱分析[J]. 食品与发酵工业,2018,44(3):241−246. [SHI M M, LI D, YAN Y Z, et al. Raman Spectroscopy analysis of starches with different crystalline structures[J]. Food and Fermentation Industry,2018,44(3):241−246. doi: 10.13995/j.cnki.11-1802/ts.015059 SHI M M, LI D, YAN Y Z, et al. Raman Spectroscopy analysis of starches with different crystalline structures [J]. Food and Fermentation Industry, 2018, 44(3): 241-246. doi: 10.13995/j.cnki.11-1802/ts.015059
[33] 孙莹. 魔芋葡甘聚糖对三种晶型淀粉物理化学性质的影响[D]. 合肥: 安徽农业大学, 2020 SUN Y. Effects of konjac glucomannan on physical and chemical properties of three crystalline starches[D]. Hefei: Anhui Agricultural University, 2020.
[34] 何洁, 闫飞燕, 黄芳, 等. 双波长法测定薯芋类农产品中直链淀粉和支链淀粉的含量[J]. 食品工业科技,2022,43(7):309−309. [HE J, YAN F Y, HUANG F, et al. Determination of amylose and amylopectin in potato and potato products by dual wavelength method[J]. Science and Technology of Food Industry,2022,43(7):309−309. HE J, YAN F Y, HUANG F, et al. Determination of amylose and amylopectin in potato and potato products by dual wavelength method [J]. Science and Technology of Food Industry, 2022, 43(7): 309-309.
[35] LI E, YANG C, WANG J, et al. Leached starch content and molecular size during sorghum steaming for Baijiu production is not determined by starch fine molecular structures[J]. International Journal of Biological Macromolecules,2021,184:50−56. doi: 10.1016/j.ijbiomac.2021.06.031
[36] CAI L, SHI Y. Structure and digestibility of crystalline short-chain amylose from debranched waxy wheat, waxy maize, and waxy potato starches[J]. Carbohydrate Polymers,2010,79(4):1117−1123. doi: 10.1016/j.carbpol.2009.10.057
[37] LI C, WU A, YU W W, et al. Parameterizing starch chain-length distributions for structure-property relations[J]. Carbohydrate Polymers,2020,241:116390. doi: 10.1016/j.carbpol.2020.116390
[38] HUANG J, WANG Z, FAN L, et al. A review of wheat starch analyses: Methods, techniques, structure and function[J]. International Journal of Biological Macromolecules,2022,203:130−142. doi: 10.1016/j.ijbiomac.2022.01.149
[39] 孙沛然. 高静压对玉米淀粉颗粒结构的影响[D]. 北京: 中国农业大学, 2015 SUN P R. Effect of high Static pressure on grain structure of corn starch [D]. Beijing: China Agricultural University, 2015.
[40] ZHENG B, GUO X, TANG Y, et al. Development changes in multi-scale structure and functional properties of waxy corn starch at different stages of kernel growth[J]. International Journal of Biological Macromolecules,2021,191:335−343. doi: 10.1016/j.ijbiomac.2021.09.120
[41] SHU L, DHITAL S, JUNEJO S A, et al. Starch retrogradation in potato cells: Structure and in vitro digestion paradigm[J]. Carbohydrate Polymers,2022,286:119261. doi: 10.1016/j.carbpol.2022.119261
[42] RAHAMAN A, KUMARI A, ZENG X, et al. Ultrasound based modification and structural-functional analysis of corn and cassava starch[J]. Ultrasonics Sonochemistry,2021,80:105795. doi: 10.1016/j.ultsonch.2021.105795
[43] PEREIRA D G, DEL PINO BELEIA A. Characterization of acid-thinned cassava starch and its technological properties in sugar solution[J]. LWT,2021,151:112151. doi: 10.1016/j.lwt.2021.112151
[44] GAO L, WU Y, WAN C, et al. Structural and physicochemical properties of pea starch affected by germination treatment[J]. Food Hydrocolloids,2022,124:107303. doi: 10.1016/j.foodhyd.2021.107303
[45] AJALA A, KAUR L, LEE S J, et al. Influence of seed microstructure on the hydration kinetics and oral-gastro-small intestinal starch digestion in vitro of New Zealand pea varieties[J]. Food Hydrocolloids,2022,129:107631. doi: 10.1016/j.foodhyd.2022.107631
[46] LI P, DHITAL S, ZHANG B, et al. Surface structural features control in vitro digestion kinetics of bean starches[J]. Food Hydrocolloids,2018,85:343−351. doi: 10.1016/j.foodhyd.2018.07.007
[47] GUO Y, CUI Y, CHENG M, et al. Development and properties of active films based on potato starch modified by low-temperature plasma and enriched with cinnamon essential oil coated with nanoparticles[J]. LWT,2022,172:114159. doi: 10.1016/j.lwt.2022.114159
[48] LA FUENTE C I A, CASTANHA N, MANIGLIA B C, et al. Biodegradable films produced from ozone-modified potato starch[J]. Journal of Packaging Technology and Research,2020,4(1):3−11. doi: 10.1007/s41783-020-00082-0
[49] PRACHAYAWARAKORN J, KANSANTHIA P. Characterization and properties of singly and dually modified hydrogen peroxide oxidized and glutaraldehyde crosslinked biodegradable starch films[J]. International Journal of Biological Macromolecules,2022,194:331−337. doi: 10.1016/j.ijbiomac.2021.11.150
[50] COLIVET J, CARVALHO R A. Hydrophilicity and physicochemical properties of chemically modified cassava starch films[J]. Industrial Crops and Products,2017,95:599−607. doi: 10.1016/j.indcrop.2016.11.018
[51] WOGGUM T, SIRIVONGPAISAL P, WITTAYA T. Properties and characteristics of dual-modified rice starch based biodegradable films[J]. International Journal of Biological Macromolecules,2014,67:490−502. doi: 10.1016/j.ijbiomac.2014.03.029
[52] BIDUSKI B, SILVA F T D, SILVA W M D, et al. Impact of acid and oxidative modifications, single or dual, of sorghum starch on biodegradable films[J]. Food Chemistry,2017,214:53−60. doi: 10.1016/j.foodchem.2016.07.039
[53] OJOGBO E, JARDIN J, MEKONNEN T H. Robust and sustainable starch ester nanocomposite films for packaging applications[J]. Industrial Crops and Products,2021,160:113153. doi: 10.1016/j.indcrop.2020.113153
[54] NARVÁEZ-GÓMEZ G, FIGUEROA-FLÓREZ J, SALCEDO-MENDOZA J, et al. Development and characterization of dual-modified yam (Dioscorea rotundata) starch-based films[J]. Heliyon,2021,7(4):e06644. doi: 10.1016/j.heliyon.2021.e06644
[55] MEHBOOB S, ALI T M, SHEIKH M, et al. Effects of cross linking and/or acetylation on sorghum starch and film characteristics[J]. International Journal of Biological Macromolecules,2020,155:786−794. doi: 10.1016/j.ijbiomac.2020.03.144
[56] SHAIKH M, HAIDER S, ALI T M, et al. Physical, thermal, mechanical and barrier properties of pearl millet starch films as affected by levels of acetylation and hydroxypropylation[J]. International Journal of Biological Macromolecules,2019,124:209−219. doi: 10.1016/j.ijbiomac.2018.11.135
[57] SORNSUMDAENG K, SEEHARAJ P, PRACHAYAWARAKORN J. Property improvement of biodegradable citric acid-crosslinked rice starch films by calcium oxide[J]. International Journal of Biological Macromolecules,2021,193:748−757. doi: 10.1016/j.ijbiomac.2021.10.157
[58] YıLDıRıM-YALÇıN M, ŞEKER M, SADıKOĞLU H. Development and characterization of edible films based on modified corn starch and grape juice[J]. Food Chemistry,2019,292:6−13. doi: 10.1016/j.foodchem.2019.04.006
[59] WADAUGSORN K, PANRONG T, WONGPHAN P, et al. Plasticized hydroxypropyl cassava starch blended PBAT for improved clarity blown films: Morphology and properties[J]. Industrial Crops and Products,2022,176:114311. doi: 10.1016/j.indcrop.2021.114311
[60] SELIGRA P G, MEDINA JARAMILLO C, FAMÁ L, et al. Biodegradable and non-retrogradable eco-films based on starch-glycerol with citric acid as crosslinking agent[J]. Carbohydrate Polymers,2016,138:66−74. doi: 10.1016/j.carbpol.2015.11.041
[61] SILVA O A, PELLÁ M G, PELLÁ M G, et al. Synthesis and characterization of a low solubility edible film based on native cassava starch[J]. International Journal of Biological Macromolecules,2019,128:290−296. doi: 10.1016/j.ijbiomac.2019.01.132
[62] CHEN J, ZHANG J, LIU D, et al. Preparation, characterization, and application of edible antibacterial three-layer films based on gelatin-chitosan-corn starch-incorporated nisin[J]. Food Packaging and Shelf Life,2022,34:100980. doi: 10.1016/j.fpsl.2022.100980
[63] 张昭. 基于百里香精油微乳液层层自组装微胶囊的淀粉基薄膜的抗菌保鲜应用[D]. 武汉: 华中农业大学, 2019 ZHANG Z. Antibacterial and fresh-keeping application of starch-based film based on Layer self-assembled microcapsules of thyme essential oil microemulsion[D]. Wuhan: Huazhong Agricultural University, 2019.
-
期刊类型引用(19)
1. 许津阁,郑卓琦,侯鹏颉,马高兴,熊彦娣,马壮,刘萌,赵靓,廖小军. 不同产地酱用卡宴辣椒原料品质评价. 食品工业科技. 2025(01): 317-332 .  本站查看
本站查看
2. 任朝辉,何建文,田怀志,田浩,廖卫琴. 基于主成分和聚类分析不同辣椒资源农艺和品质性状的综合评价. 中国瓜菜. 2025(02): 50-58 .  百度学术
百度学术
3. 杨晶,沙迪昕,张月,麦迪乃·尤努斯,沙黑兰·尼亚孜,杨海燕,黄文书. 不同贮藏条件下干辣椒颜色劣变的主要途径. 食品研究与开发. 2024(04): 58-67 .  百度学术
百度学术
4. 龙会英,张德. 干热区紫花苜蓿的生产性能和营养价值评价. 草业科学. 2024(01): 117-125 .  百度学术
百度学术
5. 李莹,张娇,杨树辉,朱月,陈滕,汪祖华. 不同温度和气体微环境对遵义干辣椒贮藏品质的影响. 食品研究与开发. 2024(11): 80-88 .  百度学术
百度学术
6. 裴艳婷,魏龙雪,李娜娜,白静,朱金英. 不同辣椒种质资源品质性状分析. 安徽农业科学. 2024(11): 27-31 .  百度学术
百度学术
7. 马唯钦,赵牧其尔,孙鹏波,刘逸超,李子琪,贾玉山,格根图,王志军. 10个饲用燕麦品种在沿黄盐碱地区生产性能评价. 饲料研究. 2024(22): 139-144 .  百度学术
百度学术
8. 廖卫琴,何建文,苟晓松,任朝辉,田浩. 不同辣椒种质资源果实中脂肪酸组成分析. 辣椒杂志. 2024(04): 13-18 .  百度学术
百度学术
9. 年国芳,郭超男,徐建宗,周建中. 新疆制干辣椒品质综合评价及加工适宜性分析. 食品工业科技. 2023(04): 317-325 .  本站查看
本站查看
10. 林巧,辛竹琳,孔令博,王晓梅,杨小薇,何微. 我国辣椒产业发展现状及育种应对措施. 中国农业大学学报. 2023(05): 82-95 .  百度学术
百度学术
11. 詹磊,徐卓越,蓝国玮,钟庆玲,刘倩桐,陈佩. 基于主成分分析构建混合多糖凝胶品质综合评价模型. 现代食品科技. 2023(04): 214-223 .  百度学术
百度学术
12. 杨创创,何建文,张正海,于海龙,冯锡刚,吴华茂,曹亚从,王立浩. 绥阳子弹头干椒风味品质分析. 辣椒杂志. 2023(01): 1-5+13 .  百度学术
百度学术
13. 张新悦,连畅,宋文胜,郭涛,杜心宇,徐嘉悦,张新贵,孙志健,廖小军,赵靓. 新疆地区辣椒自然干制的关键节点品质分析. 食品工业科技. 2023(12): 90-101 .  本站查看
本站查看
14. 屠大伟,翁盈秋,李青青,冯露萍,刘文俊. 火锅常用干辣椒品质及挥发性成分研究. 食品工业科技. 2023(16): 358-366 .  本站查看
本站查看
15. 向家勇,杨莎,梁成亮,陈文超,李雪峰,欧立军,戴雄泽,马艳青,邹学校,张竹青. 鲜食青椒果实的品质性状分析与评价. 湖南农业大学学报(自然科学版). 2023(04): 436-441 .  百度学术
百度学术
16. 杨芳,袁海彬,贾洪锋,邓凤琳,王珍妮. 基于气相色谱-离子迁移谱结合多元统计方法分析辣椒品种对辣椒油理化性质和风味物质的影响. 食品与发酵工业. 2023(19): 319-328 .  百度学术
百度学术
17. 林素钦,马文婧,何新超,付桂明,钟剑,彭红,万茵. 不同油温对辣椒油风味和辣度的影响. 河南工业大学学报(自然科学版). 2023(05): 25-32 .  百度学术
百度学术
18. 周鹏,杨娅,付文婷,王楠艺,彭世清,何建文. 贵州25个辣椒主栽品种品质分析与评价. 食品安全质量检测学报. 2023(21): 292-298 .  百度学术
百度学术
19. 吴梓仟,周劲松,刘特元,蒋立文,刘洋,尹世鲜,荣智兴,陈欢. 基于HS-SPME-GC-MS分析不同卤制条件下卤制液香气差异. 食品工业科技. 2023(24): 311-318 .  本站查看
本站查看
其他类型引用(7)





 下载:
下载:


 下载:
下载:
