Ultrasound-Assisted Extraction and Analysis of Antioxidation and Hypolipidemia Activities of Polysaccharides from Lilium brownii var. viridulum
-
摘要: 龙牙百合(Lilium brownii var. viridulum)是我国主要传统食用药用百合之一,本试验拟探究龙牙百合多糖提取工艺及其理化性质和功能活性,以龙牙百合鳞茎为原料,以多糖得率为指标,料液比、浸提时间和浸提温度为因素,对龙牙百合多糖提取工艺进行优化,再进一步去蛋白纯化多糖,分析其理化性质,测定其体外抗氧化和降血脂能力。结果显示:龙牙百合粗多糖最佳提取工艺为料液比1:20 g/mL,浸提时间20 min,浸提温度75 ℃,粗多糖得率为11.98%。粗多糖总糖、糖醛酸和蛋白质含量分别为58.46%、8.06%和10.85%,经过去蛋白后多糖的总糖和糖醛酸含量分别提高到84.78%和15.41%,蛋白质含量降低至4.73%。龙牙百合去蛋白多糖在10 mg/mL时对DPPH和ABTS+自由基清除率为8.75%和38.59%,低于对照VC;对胰脂肪酶的抑制率为85.78%,高于对照奥利司他,有较好的体外抑制胰脂肪酶效果。实验结果将为进一步研究龙牙百合多糖的构效关系和开发具有潜力的功能性食品提供依据,并为百合的应用提供理论参考。Abstract: Lilium brownii var. viridulum is one of the main traditional edible and medicinal lily in China. This study aimed to explore the extraction technology, physicochemical properties and functional activity of polysaccharide from Lilium brownii var. viridulum, used Lilium brownii var. viridulum scales as materials, polysaccharide yield as the index, solid-liquid ratio, extraction time and extraction temperature as factors to optimize the extraction process of lily polysaccharide. Then the polysaccharide was purified through removing protein. The physicochemical properties of the polysaccharides were analyzed, and the antioxidant and lipid-lowering abilities were measured in vitro. The results showed that the optimal extraction conditions were the material to liquid ratio 1:20 g/mL, extraction time 20 min, extraction temperature 75℃, and polysaccharide yield was 11.98%. The contents of total sugar, uronic acid and protein of crude polysaccharide were 58.46%, 8.06% and 10.85%, respectively. After deproteinization, the contents of total sugar and uronic acid of polysaccharide were increased to 84.78% and 15.41%, respectively, and the content of protein was reduced to 4.73%. The scavenging rates of 10 mg/mL deproteinized polysaccharide for DPPH and ABTS+ free radicals were 8.75% and 38.59%, respectively, which were lower than those of control VC. The inhibition rate of deproteinized polysaccharide for pancreatic lipase was 85.78%, which was higher than that of the control orlistat, indicating good inhibit pancreatic lipase effect in vitro. These results would provide a basis for further study on the structure-activity relationship and development of potential functional food, and provide theoretical reference for the application of lily.
-
百合通常指百合科(Liliaceae)百合属(Lilium)植物,百合属中真正中文名称为“百合”的种是指Lilium brownii var. viridulum,也被称为龙牙百合[1]。百合广泛分布于北半球,是非常重要的高档蔬菜、药材,也是世界4大切花之一。同时它也是中国卫生部审批通过的首批药食同源植物之一,具有确定医药疗效,而且还具有很高的食用、观赏价值[2-3]。百合中含有丰富的多糖、多酚、黄酮和皂苷等活性成分,多糖是主要活性功能成分之一[4],具有抗氧化、降血糖、降血脂等多种生理活性功能作用[5]。
近年来,随着人们生活水平的不断提高,肥胖成为一个重要的公共健康问题,而营养过剩成为肥胖的重要诱因[6]。饮食中的脂肪摄入量经常被认为是肥胖的增加的罪魁祸首,且膳食脂肪摄入量与肥胖呈正相关[7]。在人体消化系统中膳食脂肪的消化主要依靠胰腺脂肪酶(human pancreatic lipase,HPL),如果可以抑制胰脂肪酶就可以减少脂肪吸收,从而控制和治疗肥胖[8]。目前市场上应用的胰脂肪酶抑制剂类减肥产品主要是奥利司他[9-10]。尽管奥利司他具有良好的减肥作用,但会引起一些较为严重的副作用,如腹泻、腹胀、油性粪便、大便紧急感,以及一些对肝脏的负面影响[11-13]。因此,探寻一种天然的、安全有效的药食同源类降脂产品具有重要的现实意义。李鑫鑫等[14]检测了12种植物粗多糖对胰脂肪酶抑制率,均具有一定的抑制效果,同时多具有良好的抗氧化活性,而龙牙百合多糖在降血脂抗肥胖方面鲜见报道。
百合多糖提取方法主要有热水浸提法、超声法、微波辅助法、高压法和酶法等,而不同的提取方法会影响多糖的得率、结构和生物活性[15-17]。王荣琨等[18]比较了超声辅助提取、压力辅助提取法和不同pH水浸提法所得竹荪纯多糖的提取率,其中超声提取法提取率最高,且其抗氧化活性最强。马高兴等[19]采用热水浸提法和超声提取法提取杏鲍菇多糖测定了其免疫活性,结果表明超声提取杏鲍菇多糖具有更高的免疫活性。
目前在百合多糖的报道中,主要对卷丹和兰州百合多糖提取工艺及功能研究较多,而针对龙牙百合多糖提取工艺优化及其多糖的结构功能鲜有报道。超声辅助提取能有效提高百合多糖得率,且所得多糖可能具有较高的生物活性。因此,本实验主要研究了超声辅助提取龙牙百合多糖的最佳工艺参数和初步分离纯化方法,并以纯化的多糖进行抗氧化、降血脂功效初步验证,以期为龙牙百合的深加工和新产品开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
龙牙百合 8月份采收自湖南隆回,将其鳞片洗净,60 ℃烘干至恒重,破壁机打粉过100目筛网,置于干燥器中常温保存备用;NaOH、硫酸、苯酚 北京化工厂有限责任公司;无水葡萄糖 山东齐鲁生物科技有限公司;牛血清蛋白、考马斯亮蓝、D-半乳糖醛酸、蒽酮、橄榄油、VC 源叶生物科技有限公司;DPPH试剂盒、ABTS试剂盒 苏州科铭生物技术有限公司;酚酞 上海凛恩科技发展有限公司;奥利司他 鲁南制药集团股份有限公司;胰脂肪酶 上海阿拉丁生化科技股份有限公司;聚乙二醇4000 日本青木工贸株式会社;无水乙醇 天津市致远化学试剂有限公司;磷酸二氢钾 北京化学试剂公司;十二水合磷酸氢二钠 西陇化工股份有限公司;正丁醇 国药集团化学试剂有限公司。
Pilot2-4M型真空冷冻干燥机 博医康(北京)仪器有限公司;WFZ UV-2802PC型紫外分光光度计 尤尼柯(上海)仪器有限公司;BSM-220.4型电子天平 上海卓精电子科技有限公司;JBT/C-YCL600T/3P(D)型超声波药品处理机 济宁金百特电子有限责任公司;HH-4型数显恒温水浴锅 常州越新仪器制造有限公司;DHG-9143BS-III型电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;H4-20K型台式高速离心机 湖南可成仪器设备有限公司;THD-200D型台式恒温振荡器 北京天林恒泰科技有限公司。
1.2 实验方法
1.2.1 龙牙百合粗多糖的提取工艺
取龙牙百合粉3.00 g,按照单因素实验条件超声辅助提取,提取结束后多糖液用70%乙醇溶液过夜醇沉,6000 r/min离心10 min弃去上清液得到沉淀,室温酒精挥发1 h后放入烘箱中60 ℃烘干至恒重,称重,重复3次。按照公式(1)计算多糖得率。
$$ {\rm{A}}(\text{%}) = \frac{{{{{\rm{m}}}}_1}}{{{\rm{m}}_2}} \times 100 $$ (1) 式中:A:多糖得率;m1:粗多糖质量,g;m2:原料质量,g。
1.2.2 水溶性粗多糖超声提取单因素实验
1.2.2.1 料液比对多糖得率的影响
准确称取龙牙百合粉3.00 g,将蒸馏水按照料液比1:10、1:15、1:20、1:25和1:30 g/mL的比例加入锥形瓶中,搅拌均匀后在提取温度55 ℃,提取时间20 min,超声功率400 W条件下进行多糖提取,每个料液比梯度3次平行实验。
1.2.2.2 浸提时间对多糖得率影响
准确称取龙牙百合粉3.00 g,选取提取时间5、10、15、20和25 min,在料液比1:10 g/mL,提取温度55 ℃,超声功率400 W条件下进行多糖提取,每个时间梯度3次平行实验。
1.2.2.3 浸提温度对多糖得率影响
准确称取龙牙百合粉3.00 g,选取提取温度35、45、55、65和75 ℃,在料液比1:10 g/mL,提取时间20 min,超声功率400 W条件下进行多糖提取,每个温度梯度3次平行实验。
1.2.3 水溶性粗多糖提取的正交试验
在单因素实验基础上以料液比、浸提时间和浸提温度为因素,每个因素取3个水平进行L9(34)正交试验对提取条件进一步优化,因素与水平见表1。
表 1 正交试验因素与水平Table 1. Factors and their levels used in orthogonal array design水平 A:料液比(g/mL) B:浸提时间(min) C:浸提温度(℃) 1 1:15 10 55 2 1:20 15 65 3 1:25 20 75 1.2.4 龙牙百合粗多糖除蛋白纯化
将制备好的龙牙百合粗多糖10.00 g以1:60 g/mL的料液比加入蒸馏水于60 ℃水浴锅汇中搅拌充分溶解,将多糖溶液用1%的醋酸调节pH至6.4,加入木瓜蛋白酶于60 ℃水浴锅酶解3 h。冷却至室温后,6000 r/min条件离心3 min,收集上清液。在上清液中加入1/2体积Sevag试剂(氯仿:正丁醇3:1),剧烈振荡40 min,6000 r/min离心5 min除蛋白层,吸取上清,重复进行Sevage去蛋白操作,直至无法去除蛋白层。除蛋白后样液用5000 d透析袋透析,流水透析1 d,纯水1 d,透析液用3倍体积无水乙醇醇沉,4 ℃冰箱静置过夜。6000 r/min离心5 min分离沉淀,分别用丙酮,乙醚洗涤2遍,真空冷冻干燥得纯化多糖[20-22]。
1.2.5 多糖成分测定分析
1.2.5.1 基本成分测定
以葡萄糖为标准品,采用苯酚-硫酸法测定总糖含量[23];以半乳糖醛酸为标准品,采用咔唑-硫酸比色法测量糖醛酸含量[21];以牛血清蛋白为标准品,采用考马斯亮蓝法测定蛋白质含量[24]。
1.2.5.2 百合多糖红外光谱分析
采用傅里叶红外色谱法,称取1.00 mg完全干燥的多糖样品,与100 mg完全干燥的KBr粉末在玛瑙研钵中研磨均匀,后压片,用傅里叶变换红外色谱仪FT-IR进行红外扫描,扫描范围 4000~400 cm−1。
1.2.6 体外抗氧化活性测定
1.2.6.1 ABTS+自由基清除率测定
配制多糖样品溶液(0.50、1.00、2.00、5.00、10.00 mg/mL)。使用ABTS+自由基试剂盒进行测定,在734 nm测吸光值,VC为对照。
$$\rm ABTS^+自由基清除率(\text{%})=\frac{({\rm{A}}_{空白}-{\rm{A}}_{测定})}{{\rm{A}}_{空白}}\times 100 $$ (2) 式中:A空白:空白对照吸光度;A测定:样品溶液吸光度。
1.2.6.2 DPPH自由基清除率测定
配制多糖样品溶液(0.50、1.00、2.00、5.00、10.00 mg/mL)。使用DPPH自由基试剂盒进行测定,在避光反应20 min后6000 r/min离心1 min取上清在517 nm处测定吸光度,VC为对照。计算公式如下:
$$\rm DPPH自由基清除率(\text{%})=\frac{({\rm{A}}_{空白}-{\rm{A}}_{测定})}{{\rm{A}}_{空白}}\times 100 $$ (3) 式中:A空白:空白对照吸光度;A测定:样品溶液吸光度。
1.2.7 胰脂肪酶抑制率测定
胰脂肪酶测定参考何执中等[25]的方法略作改动。取若干锥形瓶,加入5 ml pH为7.5的0.025 mol/L的磷酸缓冲液,将其和橄榄油乳化液于40 ℃预热5 min,剧烈振荡乳化液,取乳化液4 mL加入锥形瓶,加入1 mL 0.02 g/mL胰脂肪酶,加入酶液开始计时,继续保温5 min。取出后立即加入95%乙醇15 mL,终止酶反应。加入3滴酚酞指示剂,用0.0025 mol/L 氢氧化钠滴定至溶液呈粉红色为止,记录氢氧化钠消耗量。空白组脂肪酶替换1 mL蒸馏水。奥利司他做阳性对照。
$$ \rm 胰脂肪酶活力(UI,\text{%})= \frac{[1000\times (A-B)\times M]}{T\times W}\times 100 $$ (4) 式中:A:平行组消耗氢氧化钠滴定液的平均体积,mL;B:空白试验消耗氢氧化钠的体积,mL;M:氢氧化钠滴定的摩尔浓度,mol/L;W:脂肪酶的取样量,g;T为反应时间,min。
胰脂肪酶抑制活性测定:预热完毕后,向测定组和对照组加入抑制剂1 mL,再向测定组加1 mL脂肪酶,对照组加1 mL蒸馏水,反应5 min,操作同胰脂肪酶抑制率测定。试验重复3次。
$$ \begin{split} &抑制率(\text{%})=\\ &\qquad \frac{(脂肪酶活力-抑制后脂肪酶活力)}{脂肪酶活力}\times 100 \end{split}$$ (5) 1.3 数据处理
所有测定指标均作3次平行处理,结果以平均值±标准差表示。实验数据用IBM SPASS Statistics 26软件进行分析,数据分析采用Origin 9.2软件进行分析。方差分析采用(one-way AVONA)进行显著性检验,显著水平P<0.05。
2. 结果与分析
2.1 超声辅助提取龙牙百合粗多糖
2.1.1 单因素实验
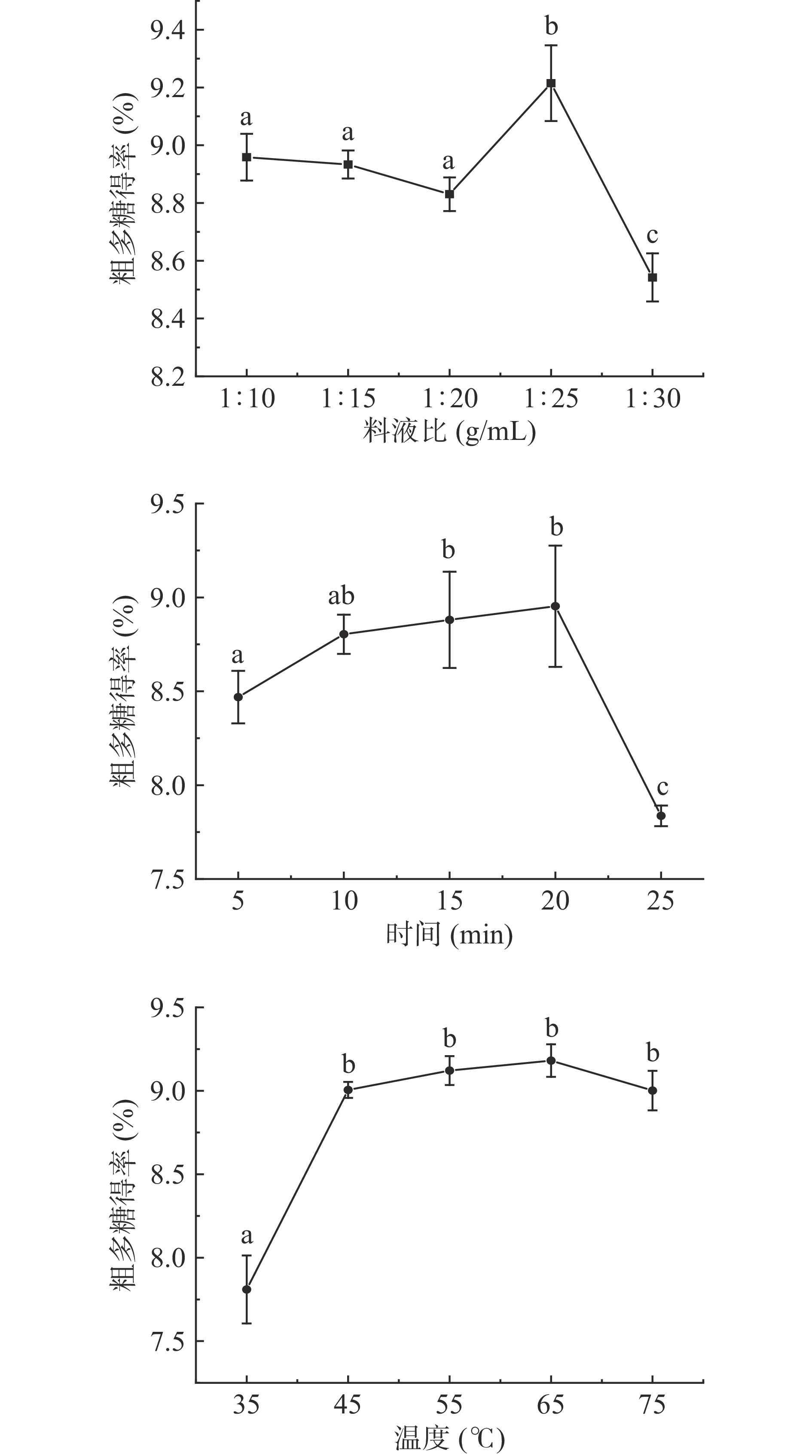
从图1a中可以看出,其他条件一致的情况下,在料液比1:10到1:20 g/mL时,龙牙百合粗多糖得率随着料液比的增大略有下降。当料液比是1:25 g/mL时,粗多糖得率达到最大值9.21%,这可能是随着溶剂用量增大,植物内部细胞与外部溶剂充分接触,有利于多糖物质快速溶出[26]。当料液比为1:30 g/mL时,多糖得率开始下降,这是因为随着溶剂的增多,多糖溶量达到饱和,水溶剂与植物内部物质分子相互作用可能已经减弱[27],水溶剂用量过大使得后面处理过程中多糖损失增大,多糖得率反而下降[28]。因此,料液比选择1:25 g/mL。
从图1b中可以看出,其他条件一致的情况下,在5到20 min时龙牙百合粗多糖得率随着浸提时间的增加而呈现上升趋势,在20 min的时候多糖得率达到最大值8.95%。当浸提时间为25 min时,多糖得率明显下降,这可能是由于超声具有强剪切作用,使大分子多糖糖苷键断裂[29],过长的浸提时间导致损失变大。因此,适宜超声提取时间在20 min。
从图1c中可以看出,其他条件一致的情况下,在35到45 ℃时龙牙百合粗多糖的得率随着浸提温度升高而明显提高,在45到65 ℃时龙牙百合粗多糖得率平缓上升,当浸提温度为65 ℃时,多糖得率达到最大值9.18%。当温度为75 ℃时,多糖得率呈现明显下降趋势,一方面可能是温度过高使得多糖降解[30],另一方面,是温度过高使得其他物质溶出,增加了溶液的粘稠度,阻碍了多糖溶出[31]。因此,浸提温度选择65 ℃。
2.1.2 正交试验提取优化
根据上述单因素实验,以料液比、浸提时间、浸提温度为影响因素,进行三因素三水平的正交试验,因素与水平见表1,试验结果见表2。
表 2 正交试验设计与结果Table 2. Orthogonal array design with experimental results实验号 A:料液比 B:浸提时间 C:浸提温度 粗多糖得率(%) 1 1 1 1 8.42±0.34 2 1 2 2 7.71±0.26 3 1 3 3 10.20±0.18 4 2 1 3 10.18±0.41 5 2 2 1 8.05±0.10 6 2 3 2 9.25±0.39 7 3 1 2 7.73±0.25 8 3 2 3 11.10±0.30 9 3 3 1 8.22±0.29 k1 8.78 8.78 8.23 k2 9.16 8.95 8.23 k3 9.01 9.22 10.49 R 0.38 0.44 2.26 主次顺序 C>B>A 优组合 A2B3C3 由表2可以看出,各因素对龙牙百合粗多糖提取得率影响主次顺序为C(浸提温度)>B(浸提时间)>A(料液比),即影响得率的最大因素是浸提温度,其次是浸提时间,料液比影响较小。这与余倩莎等[32]热水浸提法的研究结果:提取温度>料液比>提取时间不同,可能是在超声的作用下,多糖在溶剂较少时也能充分析出,使得料液比的影响变小。龙牙百合粗多糖提取的最佳工艺组合为A2B3C3,即料液比1:20,提取时间20 min,浸提温度75 ℃。以此条件进行试验,粗多糖得率达11.98%,转化为多糖提取率后为7.00%。这在结果上比余倩莎等[32]使用热水浸提法优化后工艺:提取温度60 ℃,料液比1:5 g/mL,提取时间30 min,提取次数5次,提取龙牙百合多糖提取率6.27%要高,且超声辅助提取明显比热水浸提法效率也更高。因此选择料液比1:20 g/mL,浸提时间20 min,浸提温度75 ℃为龙牙百合粗多糖最佳提取工艺。
2.2 龙牙百合多糖结构特性分析
2.2.1 化学组成
龙牙百合粗多糖及去蛋白多糖化学组成如表3所示。龙牙百合粗多糖的总糖、糖醛酸和蛋白质含量分别为58.46%、8.06%和10.85%,去蛋白后总糖、糖醛酸和蛋白质含量分别为84.78%,15.41%和4.73%,较陈小蒙等[21]采用相同方法的蛋白脱除率低,这可能是在具体脱除蛋白过程中Sevege试剂组成成分比例不同。
表 3 龙牙百合多糖化学组成Table 3. Chemical composition of Lilium brownii var. viridulum polysaccharides龙牙百合多糖 总糖含量(%) 糖醛酸含量(%) 蛋白质含量(%) 龙牙百合粗多糖 58.46±0.010 8.06±0.002 10.85%±0.004 龙牙百合去蛋白多糖 84.78±0.033 15.41±0.008 4.73±0.004 2.2.2 红外光谱分析
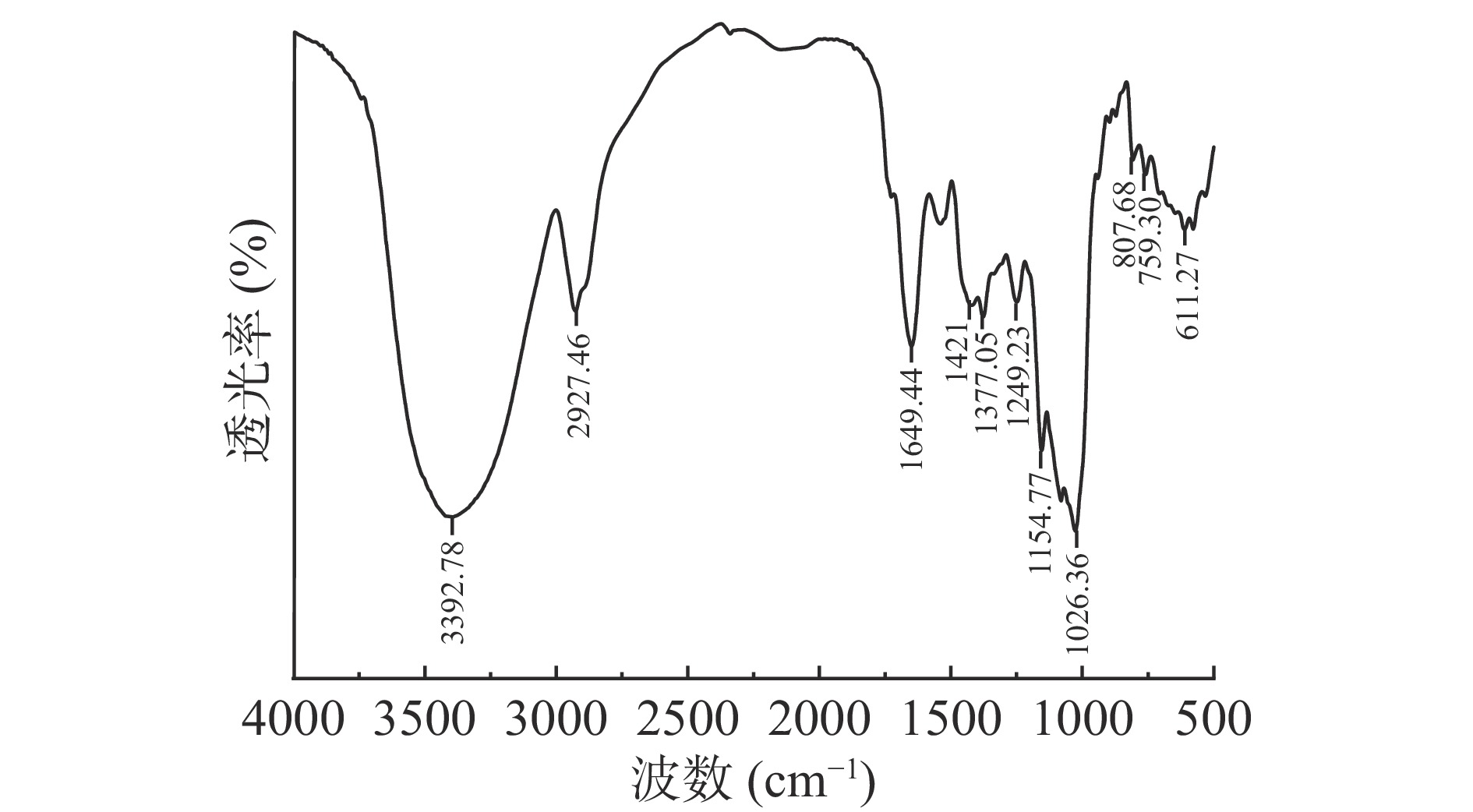
龙牙百合多糖的傅里叶红外光谱图见图2。吸收光谱在3392.78和2927.46 cm−1处有强且宽的的吸收峰,是多糖上的O-H形成分子间、内氢键和C-H伸缩振动的信号[33];1649.44和1421 cm−1处的强吸收峰分别是由C=O弯曲震动和C-H弯曲震动引起,表明多糖为酸性多糖[34],这与化学组成测定中存在糖醛酸相符;在1377~1240 cm−1处吸收峰由糖的C-H变角震动引起,它和C-H键的伸缩振动构成了糖类的特征吸收峰[21];1249.23 cm−1附近的吸收峰应为磺酸基的S=O伸缩震动峰,证明了多糖组分中有S元素的存在,表明多糖中可能有硫酸根。1154.77、1026.36 cm−1两个峰为吡喃糖环特征吸收峰,是其糖苷键C-O-C的非对称振动峰,是葡聚糖典型的红外光谱信号[35];红外光谱在890 cm−1附近无吸收峰,而在807.68 cm−1附近形成峰表明多糖主要为α型糖苷键,且为吡喃己糖[36],这与陈小蒙等[21]热水提取法提取龙牙百合多糖研究结果一致。
2.3 龙牙百合去蛋白多糖功能特性分析
2.3.1 抗氧化活性分析
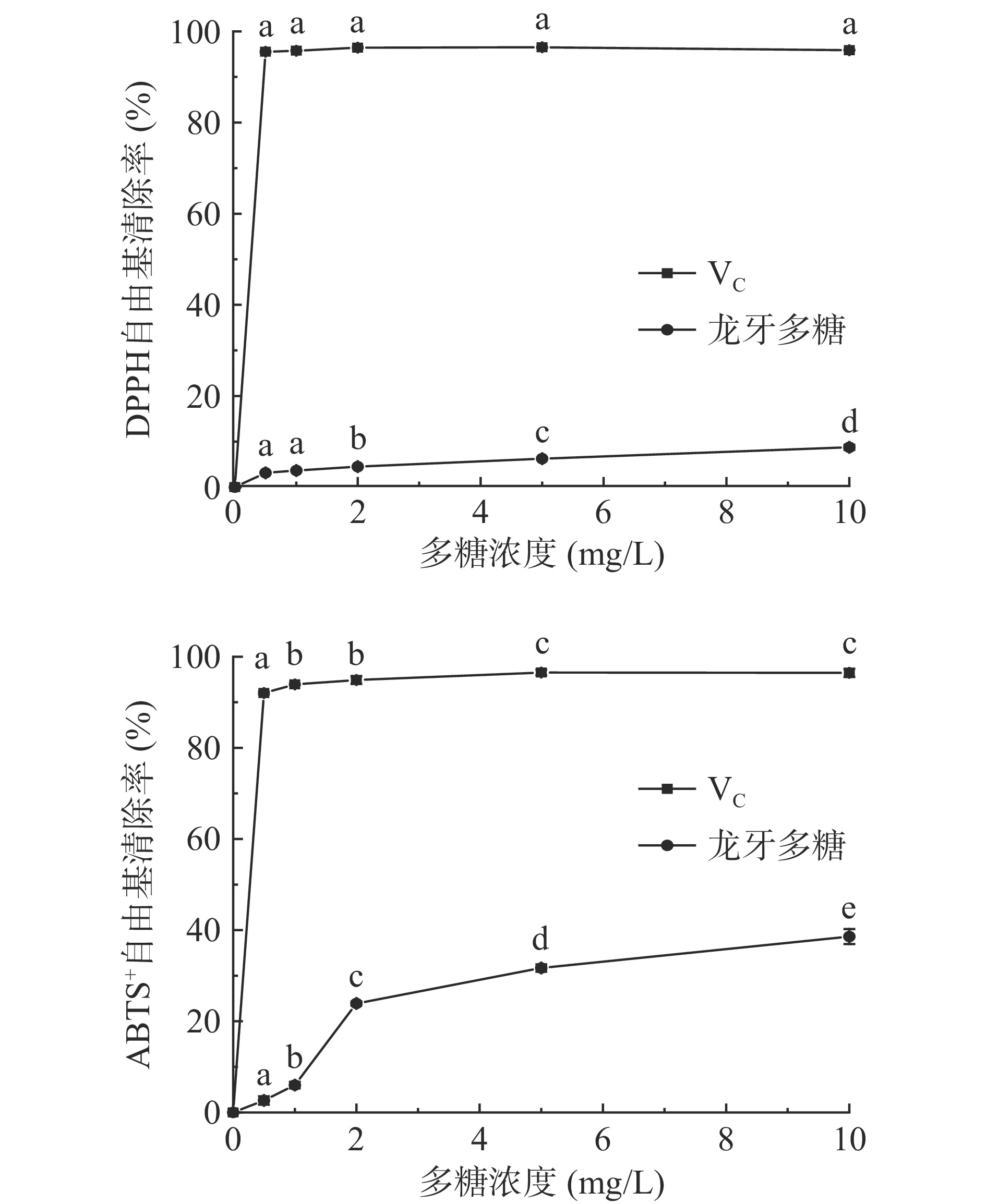
由图3a可知,龙牙百合去蛋白多糖具有一定的DPPH自由基清除作用,清除能力弱于阳性对照VC。随着多糖溶液质量浓度的增加,对DPPH自由基的清除能力逐渐强。当多糖质量浓度达到10 mg/mL时,其对DPPH自由基的清除率达8.75%。龙牙百合去蛋白多糖在质量浓度在10 mg/mL时显著低于李化强等对龙牙百合精制多糖和粗多糖对DPPH自由基清除率的研究[37],这可能是由于材料、超声提取条件和纯化程度差异造成的。
由图3b可知,龙牙百合去蛋白多糖具有良好的ABTS+自由基清除作用,清除能力弱于阳性对照VC。随着多糖溶液质量浓度的增加,对ABTS+自由基的清除率呈上升趋势。当多糖质量浓度达到10 mg/mL时,其对ABTS+自由基清除率达38.59%。
2.3.2 龙牙百合去蛋白多糖对胰脂肪酶抑制作用
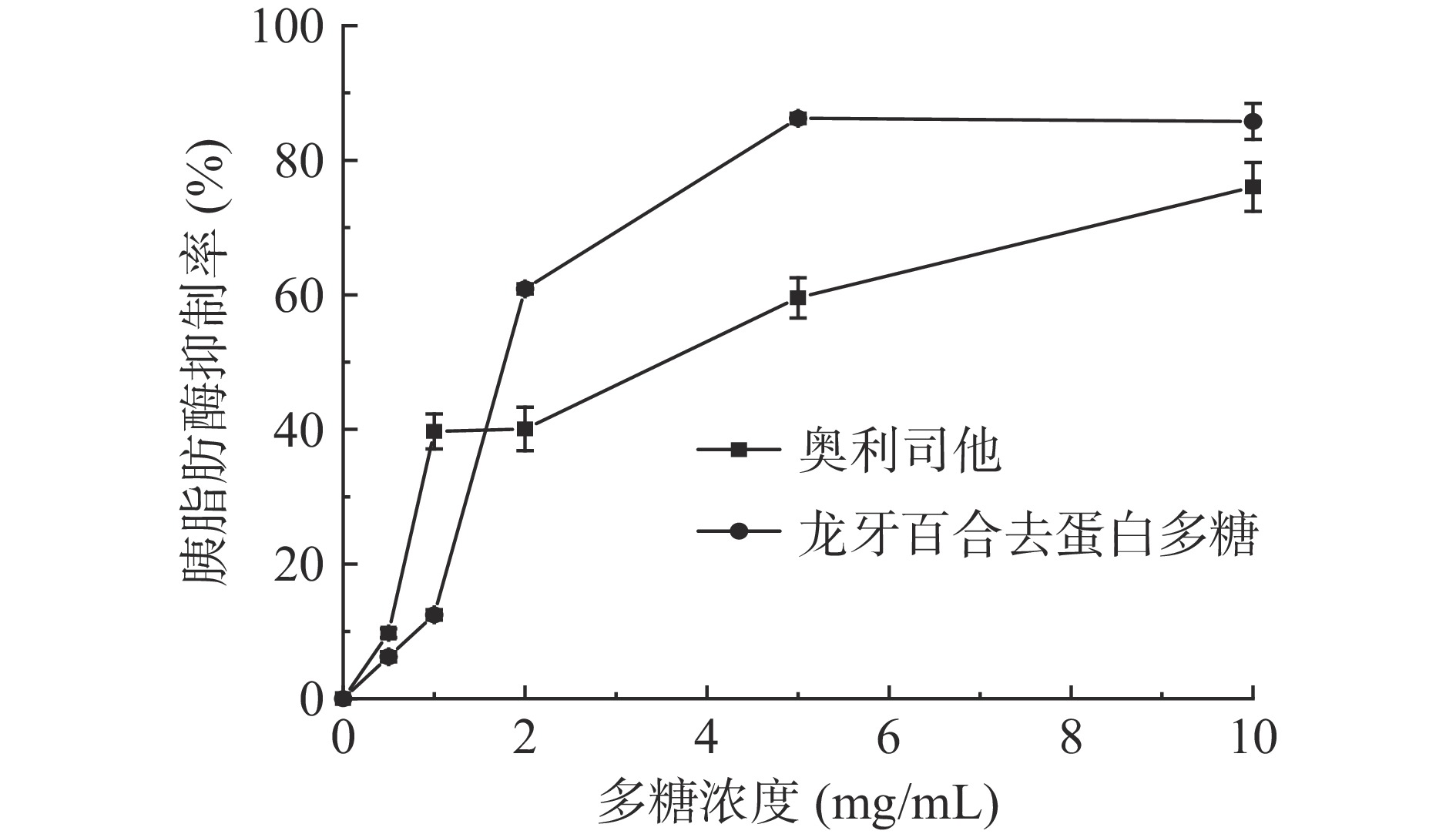
由图4可知,阳性对照奥利司他和龙牙百合去蛋白多糖随着浓度的增加对胰脂肪酶的抑制率显著增加,当浓度大于2 mg/mL时,龙牙百合去蛋白多糖对胰脂肪酶的抑制效果好于奥利司他。当龙牙百合去蛋白多糖浓度在5 mg/mL时,对胰脂肪酶的抑制率可达到86.22%,优于莲子红衣多糖和黑木耳等中药多糖[38-39]。这说明,龙牙百合去蛋白多糖对胰脂肪酶的抑制效果较好,具有降血脂药物替代潜力。
3. 结论
本文以龙牙百合制成的干粉为原料,在超声辅助条件下选择料液比、浸提时间、浸提温度进行龙牙百合粗多糖制备单因素实验,进一步通过正交试验对多糖制备条件进行了优化,获得超声辅助提取龙牙百合粗多糖的最佳提取工艺,为料液比1:20 g/mL,浸提时间20 min,浸提温度75 ℃,该条件下的粗多糖得率为11.98%。去蛋白的龙牙百合多糖的总糖、糖醛酸、蛋白质含量分别为84.78%、15.41%和4.73%,表明龙牙百合多糖中含有中性糖较多,去蛋白效果良好。红外光谱分析表明,龙牙百合多糖是一种酸性多糖。龙牙百合多糖具有一定的抗氧化能力和良好降血脂能力,对胰脂肪酶的抑制率高达86.22%,具有开发降血脂食品药品的潜力。研究结果为龙牙百合多糖开发抗氧化、降血脂功能食品提供理论依据,而不同提取方法对多糖抗氧化活性影响和体内降血脂活性需进一步研究探讨。
-
表 1 正交试验因素与水平
Table 1 Factors and their levels used in orthogonal array design
水平 A:料液比(g/mL) B:浸提时间(min) C:浸提温度(℃) 1 1:15 10 55 2 1:20 15 65 3 1:25 20 75 表 2 正交试验设计与结果
Table 2 Orthogonal array design with experimental results
实验号 A:料液比 B:浸提时间 C:浸提温度 粗多糖得率(%) 1 1 1 1 8.42±0.34 2 1 2 2 7.71±0.26 3 1 3 3 10.20±0.18 4 2 1 3 10.18±0.41 5 2 2 1 8.05±0.10 6 2 3 2 9.25±0.39 7 3 1 2 7.73±0.25 8 3 2 3 11.10±0.30 9 3 3 1 8.22±0.29 k1 8.78 8.78 8.23 k2 9.16 8.95 8.23 k3 9.01 9.22 10.49 R 0.38 0.44 2.26 主次顺序 C>B>A 优组合 A2B3C3 表 3 龙牙百合多糖化学组成
Table 3 Chemical composition of Lilium brownii var. viridulum polysaccharides
龙牙百合多糖 总糖含量(%) 糖醛酸含量(%) 蛋白质含量(%) 龙牙百合粗多糖 58.46±0.010 8.06±0.002 10.85%±0.004 龙牙百合去蛋白多糖 84.78±0.033 15.41±0.008 4.73±0.004 -
[1] 中国科学院中国植物志编辑委员会. 中国植物志: 第14卷[M]. 北京: 科学出版社, 1980: 157−166 Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China: Volume 14[M]. Beijing: Science Press, 1980: 166−157.
[2] 国家药典委员会. 中华人民共和国药典[M].2010年版. 一部. 北京: 中国医药科技出版社, 2010 Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia[M]. 2010. Part I. Beijing: China Medical Science Press, 2010
[3] 李玉帆, 明军, 刘新艳, 等. 15个百合种和品种的食用性比较研究[C]// 中国园艺学会2013年学术年会论文摘要集[A]. 成都: 园艺学报, 2013: 124 LI Y F, MING J, LIU X Y, et al. Comparative study on edible applicability of 15 lily species and varieties[C]// Collection of abstracts from 2013 annual conference papers of Chinese Society for Horticultural Science[A]. Chengdu: Acta Horticulturae Sinica, 2013: 124.
[4] 袁泽玥, 张典, 崔迎春. 百合多糖的药理作用研究进展[J]. 科学技术创新,2020(15):25−26. [YUAN Z Y, ZHANG D, CUI Y C. Research progress on pharmacological effects of lily polysaccharide[J]. Scientific and Technological Innovation,2020(15):25−26. YUAN Z Y, ZHANG D, CUI Y C. Research progress on pharmacological effects of lily polysaccharide[J]. Scientific and technological innovation, 2020(15): 25-26.
[5] 赵祥杰, 杨荣玲, 邝哲师, 等. 植物来源多糖的研究进展[J]. 安徽农业科学,2012,40(35):17016−17018. [ZHAO X J, YANG R L, CUI Y C, et al. Research progress of polysaccharides derived from plants[J]. Journal of Anhui Agri,2012,40(35):17016−17018. Zhao X J, Yang R L, Cui Y C, et al. Research progress of polysaccharides derived from plants[J]. Journal of Anhui Agri. 2012, 40(35): 17016-17018
[6] KOPELMAN P G. Obesity as a medical problem[J]. Nature,2000,404(6778):635−643. doi: 10.1038/35007508
[7] ALLISON D B, NEALE M C, KEZIS M I, et al. Assortative mating for relative weight: Genetic implications[J]. Behavior Genetics,1996,26(2):103−111. doi: 10.1007/BF02359888
[8] HARIRI N, THIBAULT L. High-fat diet-induced obesity in animal models[J]. Nutrition Research Reviews,2010,23(2):270−299. doi: 10.1017/S0954422410000168
[9] SEYEDAN A, ABDULLAH M A, ALSHAGGA M A, et al. Medicinal plants and their inhibitory activities against pancreatic lipase: A review[J]. Evidence-Based Complementary and Alternative Medicine, 2015: 1-13.
[10] WEIBEL E K, HADBARY P, HOCHULI E, et al. Lipstatin, an inhibitor of pancreatic lipase, produced by Streptomyces toxytricini. II. Chemistry and structure elucidation[J]. Journal of Antibiotics,1987,40(8):1081−1085. doi: 10.7164/antibiotics.40.1081
[11] TISS A, LENGSFELD H, CARRIÈRE F, et al. Inhibition of human pancreatic lipase by tetrahydrolipstatin: Further kinetic studies showing its reversibility[J]. Journal of Molecular Catalysis B Enzymatic,2009,58(1-4):41−47. doi: 10.1016/j.molcatb.2008.11.003
[12] VINER R, HSIA Y, TOMSIC T, et al. Efficacy and safety of anti-obesity drugs in children and adolescents: Systematic review and meta-analysis: Obesity management[J]. Obesity Reviews An Official Journal of the International Association for the Study of Obesity,2010,11(8):593−602.
[13] FILIPPATOS T D, DERDEMEZIS C S, GAZI I F, et al. Orlistat-associated adverse effects and drug interactions: A critical review[J]. Drug Safety,2008,31(1):53−65. doi: 10.2165/00002018-200831010-00005
[14] 李鑫鑫, 王一棠, 陈琛, 等. 12种植物粗多糖的体外抗肥胖及抗氧化活性研究[J]. 食品科技,2018,43(2):222−227. [LI X X, WAGN Y T, CHEN S, et al. The anti-obesity and anti-oxidant activities of 12 crude polysaccharide[J]. Food Science and Technology,2018,43(2):222−227. LI X X, WAGN Y T, CHEN S, et al. The anti-obesity and anti-oxidant activities of 12 crude polysaccharide[J]. Food Science and Technology, 2018, 43(2): 222-227.
[15] ZHOU X, WANG D, SUN P, et al. Effects of soluble tea polysaccharides on hyperglycemia in alloxan-diabetic mice[J]. Journal of Agricultural & Food Chemistry,2007,55(14):5523−5528.
[16] ZHANG J, WEN C, WEI Q, et al. Ultrasonic-enhanced subcritical water extraction of polysaccharides by two steps and its characterization from Lentinus edodes[J]. International Journal of Biological Macromolecules,2018,118:2269−2277. doi: 10.1016/j.ijbiomac.2018.07.098
[17] CHEN G, FANG C, RAN C X, et al. Comparison of different extraction methods for polysaccharides from bamboo shoots (Chimonobambusa quadrangularis) processing by-products[J]. International Journal of Biological Macromolecules,2019,130:903−914. doi: 10.1016/j.ijbiomac.2019.03.038
[18] 王荣琨, 王钦, 罗欣, 等. 不同提取方法对竹荪多糖提取率及抗氧化性影响[J]. 中国食用菌,2020,39(3):24−28. [WANG R K, WAGN Q, LUO X, et al. Effects of different extraction methods on the extraction rate and antioxidant properties of dictyophora indusiata polysaccharide[J]. Edible Fungi of China,2020,39(3):24−28. WANG R K, WAGN Q, LUO X, et al. Effects of different extraction methods on the extraction rate and antioxidant properties of dictyophora indusiata polysaccharide[J]. Edible Fungi of China, 2020, 39(3): 24-28.
[19] 马高兴, 王晗, 杨文建, 等. 不同提取工艺对杏鲍菇多糖结构特征及免疫活性的影响[J]. 食品科学,2022,43(17):42−49. [MA G X, WANG H, YANG W J, et al. Effects different extraction processes on structural characteristic and immunomodulatory activity of pleurotus eryngii polysaccharide[J]. Food Science,2022,43(17):42−49. MA G X, WANG H, YANG W J, et al. Effects different extraction processes on structural characteristic and immunomodulatory activity of pleurotus eryngii polysaccharide[J]. Food Science, 2022, 43(17): 42-49.
[20] 钟敏. 百合多糖的提纯、结构表征及免疫调节作用研究[D]. 北京: 北京林业大学, 2021 ZHOGN M. Extraction, purification, structure characterization and immunomodulatory activity of polysaccharides from edible lily[D]. Beijing: Beijing Forestry University, 2021.
[21] 陈小蒙. 水溶性龙牙百合多糖的纯化、一级结构及其生物活性研究[D]. 南昌: 南昌大学, 2008 CHEN X M. Study on the purification and primary structure of water-soluble longya lily polysaccharide and its biological activities[D]. Nanchang: Nanchang University, 2008.
[22] 唐明. 百合多糖的提取、纯化及抑菌活性研究[D]. 长沙: 湖南农业大学, 2010 TANG M. Research on extraction, purification and bacteriostatic activity of polysaccharides in Lilium[D]. Changsha: Hunan Agricultural University, 2010.
[23] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 15672-2009 食用菌中总糖含量的测定[S]. 北京: 中国标准出版社, 2009 General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. GB/T 15672-2009 Determination of total sugar content in edible fungi[S]. Beijing: Standards Press of China, 2009.
[24] MEYER A S, ISAKSEN A. Application of enzymes as food antioxidants[J]. Trends in Food Science & Technology,1995,6(9):300−304.
[25] 何执中, 金瓯, 何执静. 介绍一种胰脂肪酶的简便测定方法[J]. 生化药物杂志,1991(2):79−81. [HE Z Z, JIN O, HE Z J. A simple method for the determination of pancreatic lipase was introduced[J]. Chinese Journal of Biochemical Pharmaceutics,1991(2):79−81. HE Z Z, JIN O, HE Z J. A simple method for the determination of pancreatic lipase was introduced[J]. Chinese Journal of Biochemical Pharmaceutics, 1991(2): 79-81.
[26] 杨文雅, 李长征, 张海晖, 等. 蛹虫草多糖的亚临界水萃取及其抗氧化活性研究[J]. 食品工业科技,2016,37(5):252−257. [YANG W Y, LI C Z, ZHAGN H H, et al. Study on the optimization for the extraction and antioxidant activity of polysaccharide from cordyceps militaris by subcritical water[J]. Science and Technology of Food Industry,2016,37(5):252−257. YANG W Y, LI C Z, ZHAGN H H, et al. Study on the optimization for the extraction and antioxidant activity of polysaccharide from cordyceps militaris by subcritical water[J]. Science and Technology of Food Industry, 2016, 37(5): 252-257.
[27] 秦德利, 贾坤, 窦珺荣, 等. 茶树花多糖超声波辅助热水浸提工艺优化[J]. 食品工业科技,2015,36(4):215−218,223. [QIN D L, JIA K, DOU Q R, et al. Optimization of ultrasound-assisted hot water extraction of polysaccharides from tea flower[J]. Science and Technology of Food Industry,2015,36(4):215−218,223. QIN D L, JIA K, DOU Q R, et al. Optimization of ultrasound-assisted hot water extraction of polysaccharides from tea flower[J]. Science and Technology of Food Industry, 2015, 36(4): 215-218+223.
[28] MING M, BAI A, BO J, et al. Characterisation of a novel water-soluble polysaccharide from Leuconostoc citreum SK24.002[J]. Food Hydrocolloids,2014,36(4):265−272.
[29] ZHANG Z, WANG X, MO X, et al. Degradation and the antioxidant activity of polysaccharide from Enteromorpha linza[J]. Carbohydrate Polymers,2013,92(2):2084−2087. doi: 10.1016/j.carbpol.2012.11.096
[30] 曾桥, 韦承伯, 韩国锋, 等. 桑叶茯砖茶多糖的响应面提取工艺优化及其体外抗氧化降血脂作用[J]. 食品工业科技,2018,39(18):193−200. [ZENG Q, WEI C B, HAN G F, et al. Optimization of polysaccharides extraction from mulberry leaves fu brick tea by response surface methodology and its antioxidant activities & hypolipidemic effects in vitro[J]. Science and Technology of Food Industry,2018,39(18):193−200. ZENG Q, WEI C B, HAN G F, et al. Optimization of polysaccharides extraction from mulberry leaves fu brick tea by response surface methodology and its antioxidant activities & hypolipidemic effects in vitro[J]. Science and Technology of Food Industry, 2018, 39(18): 193-200.
[31] 钟丽霞, 江震宇, 汪嘉妮, 等. 山楂多糖提取工艺优化及其降血糖、降血脂活性[J]. 食品工业科技,2019,40(13):119−124,147. [ZHONG L X, JIANG Z Y, WAGN J N, et al. Optimization of extraction technology of hawthorn polysaccharides and its hypoglycemic and hypolipidemic activity[J]. Science and Technology of Food Industry,2019,40(13):119−124,147. ZHONG L X, JIANG Z Y, WAGN J N, et al. Optimization of extraction technology of hawthorn polysaccharides and its hypoglycemic and hypolipidemic activity[J]. Science and Technology of Food Industry, 2019, 40(13): 119-124+147.
[32] 余倩莎. 龙牙百合多糖提取物抗氧化活性及其对肿瘤细胞生长影响[D]. 长沙: 湖南农业大学, 2017 YU Q S. Lilium polysaccharide extract antioxidant activity and its effect on tumor cell. Changsha: Hunan Agricultural University, 2017.
[33] LI Q, YU N, WANG Y, et al. Extraction optimization of Bruguiera gymnorrhiza polysaccharides with radical scavenging activities[J]. Carbohydrate Polymers,2013,96(1):148−155. doi: 10.1016/j.carbpol.2013.03.054
[34] 朱泉. 百合多糖分离纯化、结构鉴定及其生物活性研究[D]. 南京: 南京农业大学, 2012 ZHU Q. Isolation, purification, structure determination and biological activities of polysaccharides from bulb of lily (Lilium Lancifolium Thunb.)[D]. Nanjing: Nanjing Agricultural University, 2012.
[35] WANG X, ZHANG Z, YAO Q, et al. Phosphorylation of low-molecular-weight polysaccharide from Enteromorpha linza with antioxidant activity[J]. Carbohydrate Polymers,2013,96(2):371−375. doi: 10.1016/j.carbpol.2013.04.029
[36] 黄菊青. 竹茹多糖的化学结构和免疫活性研究[D]. 杭州: 浙江大学, 2015 HAUNG J Q. Chemical characterization and immunomodulatory activity of polysaccharides from bamboo shavings[D]. Hangzhou: Zhejiang University, 2015.
[37] 李化强, 吴菲菲, 龙艳珍, 等. 隆回龙牙百合多糖的体外抗氧化活性研究[J]. 食品安全质量检测学报,2017,8(8):3068−3073. [LI H Q, WU F F, LONG Y Z, et al. In vitro antioxidative effects of Longhui Longya lilium polysaccharides[J]. Journal of Food Safety and Quality,2017,8(8):3068−3073. doi: 10.3969/j.issn.2095-0381.2017.08.038 LI H Q, WU F F, LONG Y Z, et al. In vitro antioxidative effects of Longhui Longya lilium polysaccharides[J]. Journal of Food Safety and Quality, 2017, 8(8): 3068-3073. doi: 10.3969/j.issn.2095-0381.2017.08.038
[38] 冉琳, 何钢, 梁立, 等. 黑木耳多糖对胰脂肪酶活性的抑制作用[J]. 食品工业科技,2017,38(22):56−60. [RAN L, HE G, LAIGN L, et al. Inhibitory effect of Auricularia auricula polysaccharides on pancreatic lipase activity[J]. Science and Technology of Food Industry,2017,38(22):56−60. RAN L, HE G, LAIGN L, et al. Inhibitory effect of Auricularia auricula polysaccharides on pancreatic lipase activity[J]. Science and Technology of Food Industry, 2017, 38(22): 56-60.
[39] 高航, 吴楠, 高延芬, 等. 莲子红衣多糖对胰脂肪酶活性抑制作用的研究[J]. 粮食与油脂,2017,30(5):87−91. [GAO H, WU N, GAO Y F, et al. Inhibitory effect on pancreatic lipase activity of polysaccharide from lotus seed skin[J]. Cereals & Oils,2017,30(5):87−91. GAO H, WU N, GAO Y F, et al. Inhibitory effect on pancreatic lipase activity of polysaccharide from lotus seed skin[J]. Cereals & Oils, 2017, 30(5): 87-91.
-
期刊类型引用(11)
1. 于新海,李濛,周红昕,吴海英,姚文平. 大花卷丹的百合粗多糖提取工艺的研究与分析. 农业与技术. 2025(04): 41-44 .  百度学术
百度学术
2. 何念武,董玉珊,朱姝俣. 连翘多糖提取工艺优化及抗氧化和抑菌活性研究. 商洛学院学报. 2024(02): 59-65 .  百度学术
百度学术
3. 王鑫,周卓,遇世友,岳振歌,修伟业,马永强. 甜玉米芯多糖纳米银的合成、表征及体外活性研究. 食品工业科技. 2024(13): 58-66 .  本站查看
本站查看
4. 杨迎东,王伟东,张睿琪,冯秀丽,白一光,杨盼盼,周俐宏,李雪艳,胡新颖. 不同百合食药用功能指标检测分析. 沈阳农业大学学报. 2024(03): 276-284 .  百度学术
百度学术
5. 伍乔,范茂清. 百合的研究进展. 中国食品工业. 2024(14): 132-134 .  百度学术
百度学术
6. 陈强,王璐,徐峥嵘,罗金超,邓千千,方雨婷,李从虎,程旭. 玉米植物糖原超声辅助提取工艺优化及其生物活性评价. 食品工业科技. 2024(19): 177-186 .  本站查看
本站查看
7. 康桥,孙越,刘梦瑶,赵保龙,李贺贺,王柏文,赵东瑞,孙宝国,孙金沅. 金铃子果皮多糖超声辅助提取工艺优化及其抗氧化和降糖活性研究. 食品工业科技. 2024(21): 164-173 .  本站查看
本站查看
8. 藏颖,梁钟文,刘松,高丹,黄羽诺,李媚,刘红全. 雨生红球藻藻渣多糖提取条件优化及降血脂活性分析. 食品研究与开发. 2024(22): 102-110 .  百度学术
百度学术
9. 于武华,桂明明,何平平,邓小燕. 百合的营养价值及加工技术研究进展. 食品安全导刊. 2024(35): 186-189 .  百度学术
百度学术
10. 代琪,杨海媚,李林珍,叶俏波,罗霄,李及,叶俊龙. 不同品种百合的化学成分及药理作用研究进展. 中国药物评价. 2024(06): 459-463 .  百度学术
百度学术
11. 许梦粤,曾长立,王红波. 药食同源植物多糖提取方法、结构解析和生物活性研究进展. 食品研究与开发. 2023(19): 216-224 .  百度学术
百度学术
其他类型引用(7)





 下载:
下载:
 下载:
下载:



