Optimization of Ultrasound-assisted Extraction of Phytoglycogen from Sweet Corn and Its Bioactivity Evaluation
-
摘要: 本文主要探究超声辅助法从甜玉米中提取植物糖原(phytoglycogen,PG)的最佳工艺并对其理化性质和生物活性进行初步评价。该实验以PG的得率为指标,考查固液比、超声功率和超声时间对PG得率的影响,并利用正交试验优化工艺参数。在此基础上,研究了超声辅助法制备得到的PG的理化性能,并开展PG的体外抗氧化、细胞毒性、凋亡以及溶血评价。结果表明:正交试验优化后得到最佳工艺为固液比1:9(g/mL)、超声功率160 W、超声时间80 min,在此条件下实际得率为14.31%±0.38%;表征结果显示超声辅助法获取的PG颗粒尺寸低于传统水提醇沉法;体外抗氧化实验表明PG具有一定的抗氧化能力,尤其是对DPPH自由基更为敏感,在20 mg/mL时清除率达到54.58%±1.39%;生物安全性评价结果显示不同浓度的PG在与小鼠成纤维细胞(3T3)孵育24或48 h后,细胞存活率均高于95%;同时,PG也没有对细胞产生明显的凋亡效应,在最大浓度时,凋亡率低于7%;此外,在共孵育2 h后,PG对红细胞造成的溶血率也远低于国家标准(5%),这些结果证实了PG对正常细胞和红细胞均有良好的生物相容性。总体上,本研究表明超声辅助法有助于提高PG的得率和理化性能,同时,也证实了PG是一种无毒的天然纳米颗粒,在药物或食品因子递送方面具有较大的应用潜力。Abstract: The optimal extraction process of phytoglycogen (PG) from sweet corn by ultrasound-assisted method was studied, and the physicochemical properties and biological activities of PG were evaluated in this paper. The effects of solid-liquid ratio, ultrasonic power and ultrasonic time on the yield of PG were investigated and the process parameters were further optimized by orthogonal experiment. Furthermore, the physicochemical properties of PG obtained by ultrasound-assisted method were investigated. Meanwhile, the antioxidation, cytotoxicity, apoptosis and hemolysis of PG were evaluated in vitro. The results showed that the optimal extraction conditions were as follows: Solid-liquid ratio of 1:9 (g/mL), ultrasonic power of 160 W and ultrasonic time of 80 min, the actual yield was 14.31%±0.38%. The PG particle size obtained by ultrasound-assisted method was lower than that obtained by traditional water extraction and alcohol precipitation method. In vitro antioxidant experiment showed that PG had a certain antioxidant capacity, especially it was more sensitive to DPPH free radicals, and the clearance rate reached 54.58%±1.39% at 20 mg/mL. The results of biosafety evaluation showed that the survival rate of mouse fibroblasts (3T3) was higher than 95% after incubation with different concentrations of PG for 24 or 48 h. Meanwhile, PG had no obvious apoptotic effect on cells, and the apoptotic rate was lower than 7% at the maximum concentration. After 2 h of co-incubation, the hemolysis rate caused by PG on red blood cells was also much lower than the national standard (5%), which confirmed that PG had good biocompatibility with normal cells and red blood cells. Overall, this study showed that ultrasound-assisted method could improve the yield and physicochemical properties of PG, and also confirmed that PG was a non-toxic natural nanoparticle, which had great application potential in drug or food factor delivery.
-
植物糖原(phytoglycogen,PG)是近年来新发现的一种超支化的α-D-葡聚糖,主要存在甜玉米、高梁、水稻等植物中[1−2]。由于这些植物体内缺乏淀粉脱支酶,内部多糖的合成不能向淀粉转化,而是形成分枝程度更高,外紧内松,尺寸约30~100 nm纳米级支化多糖,整体结构上趋向于动物糖原,因而称之为植物糖原[3]。这种特殊的树枝状大分子结构使其与传统植物多糖(如淀粉、果胶、纤维素等)在理化性质上有所不同,如易溶于冷水,具有良好的分散稳定性、生物相容性、消化性、高保水性等[4−6]。这些优良属性促使PG可以作为保湿剂、乳化剂、纳米载体等生物材料[7−8],广泛应用于化妆品、纳米医学、食品安全等领域。
PG作为一种植物聚多糖,目前关于它的提取主要采用水提醇沉的方法进行,但该法耗时久、工作量大,并且获取的多糖产物纯度和复溶稳定性差[9−10]。Xue等[1]系统比较了四种不同水提醇沉工艺对PG的影响,发现通过脱壳、调节pH、高压灭菌等处理能显著降低产物中蛋白含量,获取尺寸和分散性较好的PG纳米多糖。然而,这些操作加剧了提取工艺的复杂性,同时也降低了PG产率。因此,在保障PG产率的前提上,如何获取高质量的PG仍有待探究。
近年来,超声辅助提取由于其具有提取时间短、效率高、杂质少等优势,已被广泛应用在各种植物多糖的提取,如纳米纤维晶、淀粉等[11−12]。超声辅助主要是利用超声波的高频振荡、空化效应以及热效应破坏植物组织、分离结合性物质,因而获取的植物多糖产率和纯度均相对较高[13−14]。然而,目前关于利用超声辅助提取PG的研究尚未有报道。此外,关于PG的研究目前局限在利用其作为纳米递送载体[15],而对其自身的生物活性研究缺乏探讨。基于此,本实验拟以甜玉米为原料,利用超声辅助法结合正交试验优化PG提取工艺,并对其理化性质进行详细比较;同时,从抗氧化性和生物安全性两方面评价PG的生物活性,从而为PG的开发利用提供理论和技术上的参考。
1. 材料与方法
1.1 材料与仪器
甜玉米 唐山楚乐食品有限公司;无水乙醇 西陇科学股份有限公司;浓硫酸(98%)、浓盐酸(HCl,37%)、过氧化氢(30%)、水溶性维生素C(Vitamin C,VC)、三氯乙酸 国药集团化学试剂有限公司;七水合硫酸亚铁、水杨酸、对1,1-二苯基苦基苯肼(P-1,1-diphenylpicryl phenylhydrazine,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、冰醋酸、二甲基亚砜、过硫酸钾、铁氰化钾、三氯化铁、苯酚 上海麦克林生化科技股份有限公司;葡萄糖 美国Sigma公司;RPMI-1640培养基 Hyclone;胎牛血清 Clark;0.25%胰蛋白酶(≥250 units/mg)、青-链霉素 Gibco公司;Hoechst 33342/PI双染细胞凋亡检测试剂盒(货号CA1120)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,98%) 北京索莱宝科技有限公司;α-淀粉酶(100 U/mg) 西格玛奥德里奇(上海)贸易有限公司;小鼠胚胎成纤维细胞(3T3细胞) 南京凯基生物科技有限公司;SPF级ICR小鼠 10只,雄性,6~8周龄,体质量22~25 g,购自中国常州卡文斯实验动物有限公司,生产许可证号:SCXK(沪)2017-0005。
XM-1000T分体式超声波细胞破碎机 小美超声仪器有限公司;RV 10 auto pro V旋转蒸发仪 德国艾卡科技有限公司; Sorvall LYNX 4000落地离心机、Multiskan SkyHigh酶标仪 德国赛默飞世尔科技公司;LC-10N-50A真空冷冻干燥机 力辰科技有限公司;Zetasizer Nano ZSP Zeta电位粒度仪 英国马尔文仪器有限公司;JEM-1400Flash透射电子显微镜 捷欧路(北京)科贸有限公司;奥林巴斯BX53荧光显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 超声辅助法提取PG
PG的提取参照文献[1]并稍作修改,在水提醇沉的基础上引入超声辅助和冷冻干燥技术提取PG。准确称取50.0 g甜玉米,按一定固液比加入去离子水,沸水浴5 min。设定不同的超声参数(时间、功率、固液比)进行超声提取,再利用纱布(100目)过滤去除纤维素等水不溶性多糖,然后将滤液离心(10000 r/min,15 min),收集上清液并用冰醋酸调节pH为5.0,于4 ℃下静置6 h,诱导蛋白质变性沉淀,再次离心后去除离心管表面乳脂层和底部变性蛋白,然后利用旋转蒸发仪将上清液浓缩,浓缩液加入3倍体积无水乙醇,室温静置30 min去除部分水溶性单糖或寡聚糖,最后,将混合物低速离心(3000 r/min,15 min),收集沉淀后用无水乙醇冲洗两次,然后利用真空冷冻干燥机冷冻干燥获取白色粉末状产物(记为PG-超声),称重并计算得率。此外,根据文献报道[1],利用水提醇沉法制备PG(记为PG-水提)作为对照组。PG得率按以下公式计算:
PG得率(%)=(PG产物质量/甜玉米粒质量)×100 1.2.2 单因素实验
以粗PG得率为指标,选取固液比、超声功率和超声时间三个因素来进行单因素优化实验。
1.2.2.1 固液比对PG得率的影响
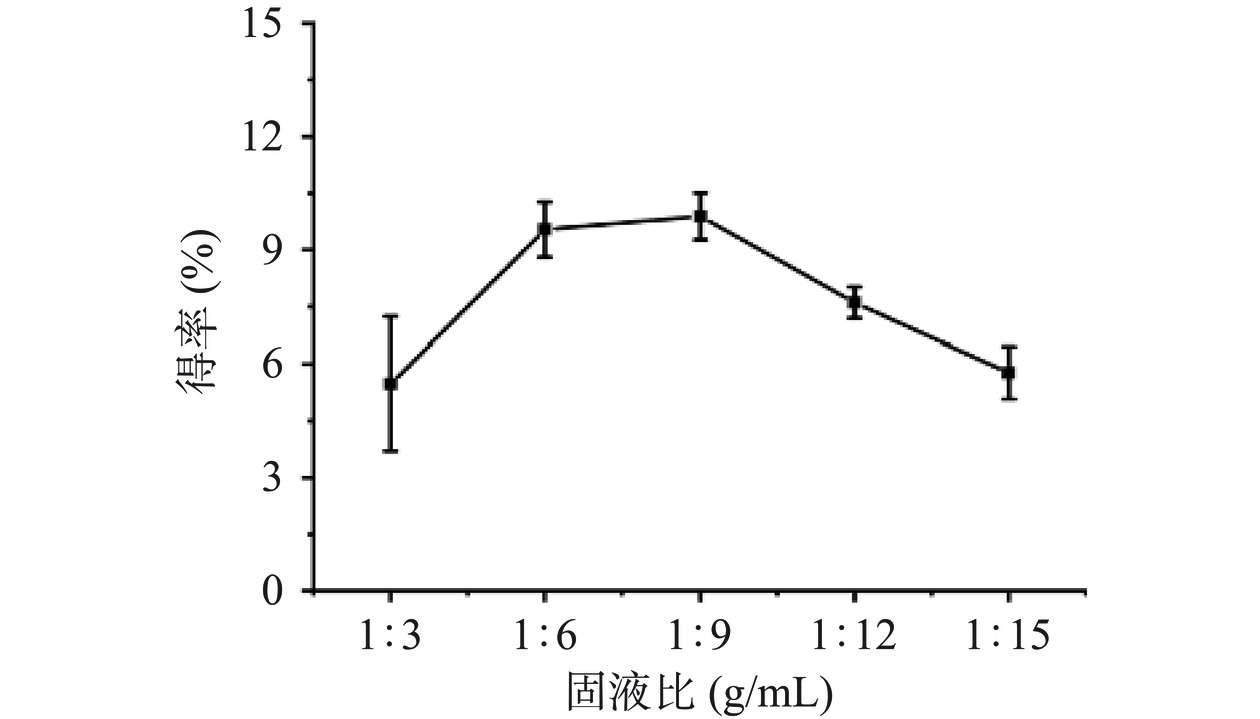
超声功率80 W,超声时间20 min,考察固液比(1:3、1:6、1:9、1:12、1:15 g/mL)对粗PG得率的影响。
1.2.2.2 超声功率对PG得率的影响
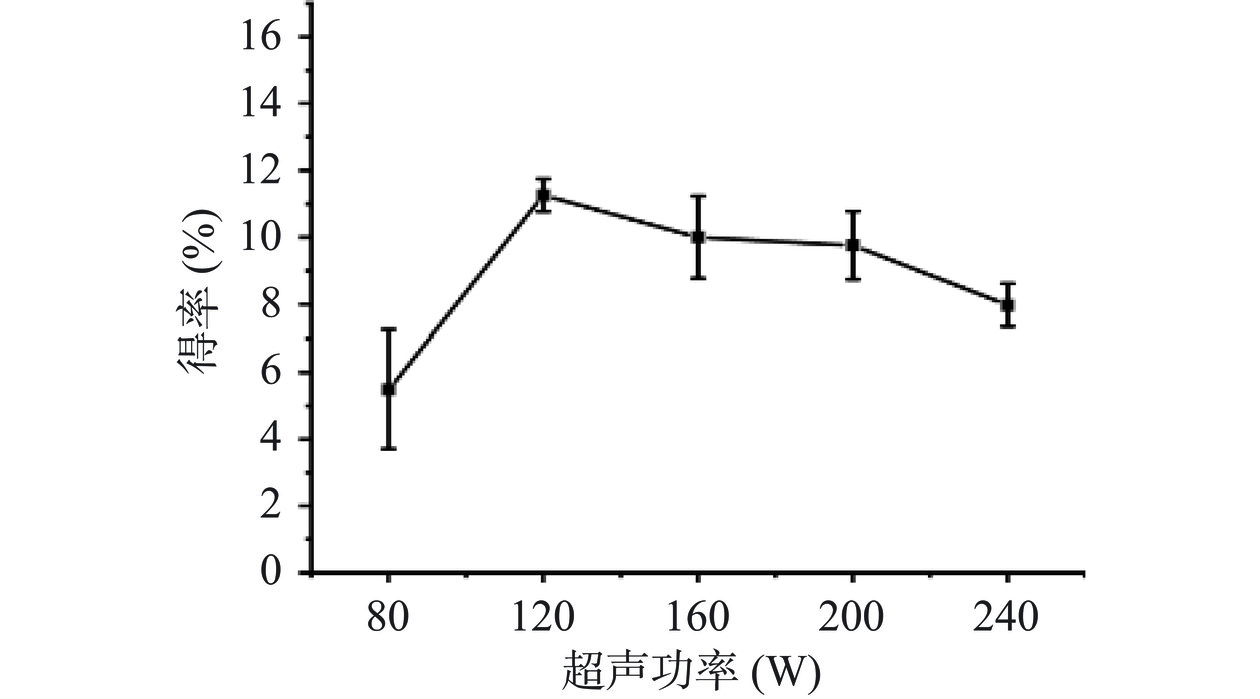
固液比设置为1:3 g/mL,超声时间20 min,考察超声功率(80、120、160、200、240 W)对粗PG得率的影响。
1.2.2.3 超声时间对PG得率的影响
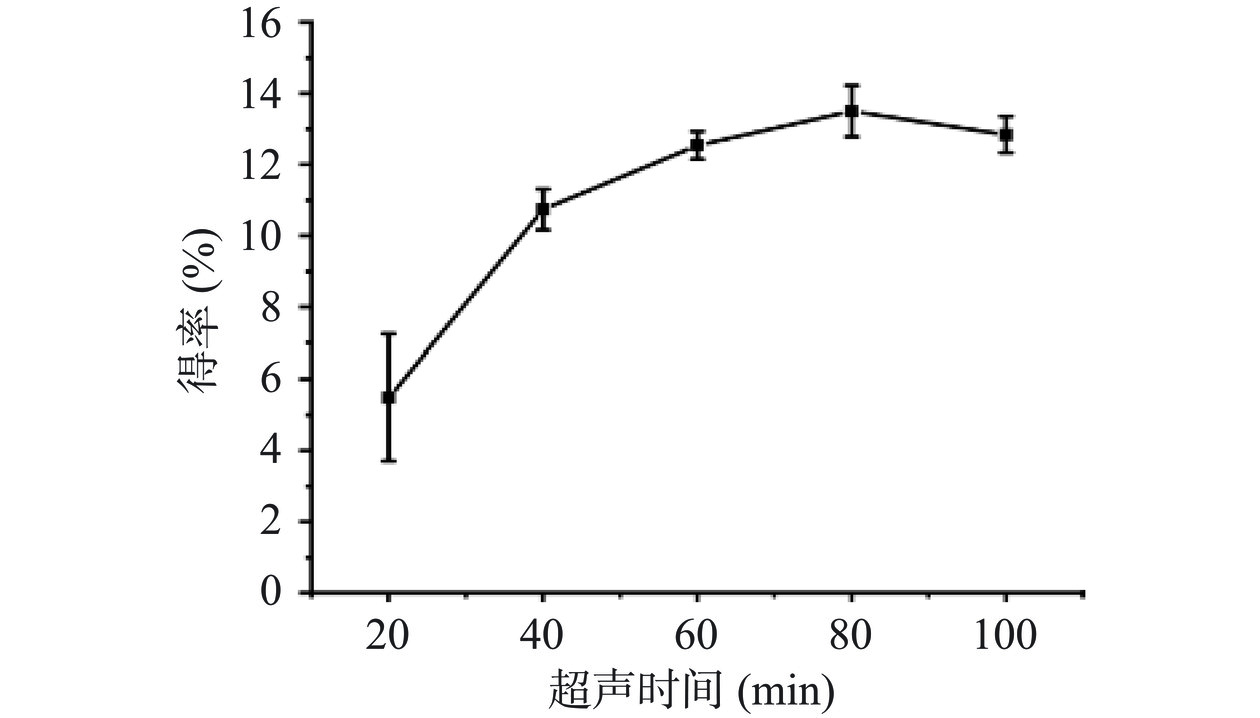
固液比设置为1:3 g/mL,超声功率80 W,考察超声时间(20、40、60、80、100 min)对粗PG得率的影响。
1.2.3 正交试验设计
根据单因素实验结果,采用L9(34)正交试验设计,以粗PG得率为评价指标,以固液比、超声功率、超声时间为因素,每个因素设置3个水平进行正交试验,因素水平见表1。
表 1 正交试验因素水平Table 1. Orthogonal test factor level水平 因素 A固液比
(g/mL)B超声功率
(W)C超声时间
(min)1 1:6 120 60 2 1:9 160 80 3 1:12 200 100 1.2.4 PG表征及蛋白、总糖含量测定
1.2.4.1 PG颗粒的表征
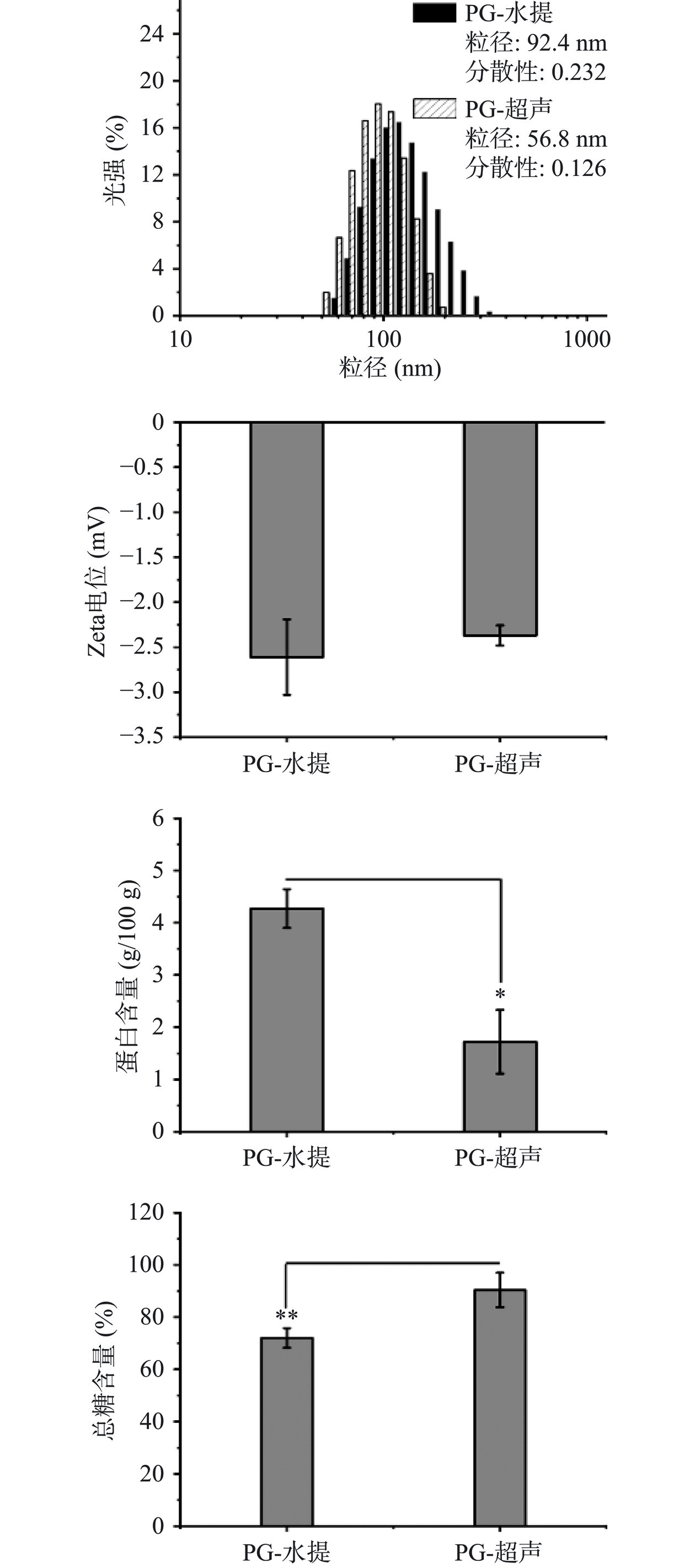
将超声辅助工艺优化后提取的PG用去离子水配成质量分数为0.5%的水溶液,利用Zeta电位粒度仪测定PG粒径分布及表面的Zeta电位,每个样品循环3次;此外,利用TEM在80 kV的加速电压下观察颗粒的形貌。PG颗粒的表征实验中,以PG的水提醇沉法作为对照组。
1.2.4.2 蛋白含量测定
采用凯式定氮法测定PG中的蛋白含量[16−17],样品中蛋白含量按以下公式计算:
X(g/100g)=(V1−V2)×C×0.0140V3M×100×F×100 式中:X-样品中每100 g蛋白质的含量,g/100 g;V1-样品消耗HCl标准液的体积,mL;V2-空白实验时试剂消耗的HCl标准液的体积,mL;C-HCl标准滴定摩尔浓度,mol/L;V3-吸取的消化液的体积,mL;M-样品的质量,g;F-氮换算为蛋白质的系数;玉米蛋白的F值为6.25,蛋白含量以干基计。
1.2.4.3 总糖含量测定
采用苯酚-硫酸法测定PG中的总糖含量[18]。取适量葡萄糖于105 ℃烘箱中烘干至恒重,准确称取0.1 g于100 mL容量瓶中,用去离子水定容至刻度线,得浓度为1 mg/mL的葡萄糖标准溶液。分别吸取2、4、6、8、10 mL的葡萄糖标准溶液于10 mL容量瓶中,加水定容至刻度线。分别吸取1 mL不同浓度的葡萄糖标准溶液于试管中,然后依次加入1 mL 6%的苯酚溶液和5 mL的浓硫酸,振荡混匀,室温放置15 min。利用酶标仪于490 nm处测各个浓度的葡萄糖标准溶液的吸光值。以葡萄糖浓度为横坐标,OD值为纵坐标,制作标准曲线(y=0.789x−0.035,R2=0.999)。分别称取一定重量的PG-水提和PG-超声,用去离子水配制成浓度为1 mg/mL的溶液,按照上述标准曲线的制作方法测定PG-水提和PG-超声的总糖含量,总糖含量按以下公式计算:
总糖(%)=(样品糖含量/所取样品总重量)×100 1.2.5 PG体外抗氧化能力测定
1.2.5.1 PG清除DPPH自由基能力测定
参照文献[19]中的方法来测定DPPH自由基的清除率:PG用蒸馏水稀释成0.1、0.5、1、5、10、20 mg/mL的溶液,取0.5 mL溶液与等体积0.1 mmol/L的DPPH乙醇溶液混匀,室温避光反应0.5 h,阳性对照组以VC溶液代替PG溶液,再在517 nm下测吸光度值。样品对DPPH自由基的清除作用按以下公式计算:
清除率(%)=[1−(Ai−Aj)/A0]×100 式中:A0为对照组(蒸馏水代替样品)吸光值;Ai为样品组吸光值;Aj为样品空白组(不含DPPH的乙醇溶液)吸光值。
1.2.5.2 PG清除羟基自由基能力测定
参照胡晓彤等[20]的方法来计算羟基自由基的清除率:取0.5 mL PG溶液与等体积的6 mmol/L的FeSO4、6 mmol/L的H2O2混匀,静置10 min后再加入等体积的6 mmol/L的水杨酸乙醇溶液,振荡摇晃后37 ℃孵育0.5 h,阳性对照组以相同浓度的VC溶液代替PG溶液,空白组以蒸馏水代替PG溶液。510 nm下测吸光度值。样品对羟基自由基的清除作用按以下公式计算:
清除率(%)=(1−A样品/A空白)×100 式中:A空白为空白组吸光值;A样品为样品组吸光值。
1.2.5.3 PG清除ABTS+自由基能力测定
参照Arnao等[21]的文献,配制ABTS+自由基工作液;再取1 mL不同浓度PG溶液加入4 mL ABTS+自由基工作液,室温避光反应6 min,然后在734 nm处测吸光度值。样品对ABTS+自由基的清除作用按以下公式计算:
清除率(%)=(A对照−A样品)/A对照×100 式中:A对照为对照组(蒸馏水代替样品)吸光值;A样品为样品组吸光值。
1.2.5.4 总还原力测定
利用三氯化铁还原法测PG还原力[22]:向各试管中加入不同浓度样品溶液1.0 mL,依次加入等体积0.2 mol/L的磷酸盐缓冲液(pH6.6)和1%(w/v)的铁氰化钾溶液,50 ℃水浴0.5 h待冷却至室温后加入1.0 mL 10%三氯乙酸溶液,静置10 min,加入1.0 mL的蒸馏水和0.2 mL 0.1%三氯化铁溶液,均匀混合反应10 min,最后700 nm下测吸光度值。
1.2.6 PG体外稳定性测定
将冻干后的PG粉末配制成2 mg/mL的溶液,并进行以下稳定性评估:a.将PG溶液放于37 ℃、100 r/min的恒温水浴振荡器中,每隔24 h利用纳米粒度仪测定其尺寸变化,持续检测5 d;b.将最优工艺下冻干后的PG复溶,利用粒度仪测其粒径和分散系数;c.用1 mol/L的NaOH和HCl调节PG溶液的pH,制备不同pH下(2~9)的PG溶液,利用粒度仪测定PG尺寸变化,判断pH对其稳定性影响;d.在PG溶液中加入0.1 mL α-淀粉酶(2 mg/mL),孵育不同时间后,测定PG颗粒尺寸和浓度变化。
1.2.7 生物相容性评估
1.2.7.1 细胞培养
将3T3细胞置于完全培养基(含90%DMEM培养液,9%胎牛血清,1%青链霉素)中,置于细胞培养箱中培养,培养条件:37 ℃、5% CO2。待细胞生长至95%传代继续培养。
1.2.7.2 MTT细胞活力实验
取对数生长期的3T3细胞(1×105 个/mL)100 μL接种于96孔板中,置于细胞培养箱中培养24 h(培养条件:37 ℃、5%CO2)。参照李龙昱[23]描述的PG浓度,用完全培养基配制稀释PG,然后将20 μL的PG加入到细胞中,使PG终浓度分别为12.5、25、50、100、200 μg/mL,再放入培养箱中避光培养。24 h后弃去孔中培养液,每孔加入100 μL MTT溶液(5 mg/mL)孵育4 h,弃去孔内液体,每孔加入DMSO溶液150 μL,振荡10 min使结晶物充分溶解,490 nm处测每孔吸光度值并计算细胞存活率[24−25]。公式如下:
存活率(%)=(OD实验组−OD空白组)/(OD对照组−OD空白组)×100 式中:空白组为无细胞孔的吸光值;对照组为加入等剂量PBS孔的吸光值。
1.2.7.3 Hoechst 33342/PI检测细胞凋亡
取对数生长期的3T3细胞(1×105 个/mL)100 μL接种于96孔板中,培养24 h后,用完全培养基配制稀释PG,然后将200 μL的PG溶液加入到细胞中,使PG终浓度分别为0.1和0.2 mg/mL,每组6个复孔,继续培养48 h,各组弃去培养液,PBS漂洗细胞1次,弃去孔中PBS,然后每孔加入1 mL细胞染色缓冲液、5 µL Hoechst 33342染色液和5 µL PI染色液,放于4 ℃冰箱染色20 min,PBS漂洗1次后在荧光显微镜下观察,荧光标记的凋亡细胞呈蓝色深染[26]。公式如下:
凋亡率(%)=[凋亡细胞/(凋亡细胞+正常细胞)]×100 1.2.7.4 溶血实验
从小鼠尾静脉取血,收集在抗凝管中,2500 r/min离心15 min,取沉淀。将沉淀用无菌PBS清洗,离心,制成2%的红细胞悬液。参照王晓红[27]的PG使用浓度,将不同浓度(0.1、0.2 mg/mL)的PG溶液与2%红细胞悬液等体积混合;去离子水、生理盐水与红细胞悬液等体积混合分别作为阳性和阴性对照。各组均于37 ℃孵育0.5 h和2 h后,2000 r/min离心15 min,吸取上清液于540 nm处测定吸光度,根据公式计算溶血率(hemolysis rate,HR)[28]:
溶血率(%)=(样品组OD540−阴性组OD540)/(阳性组OD540−阴性组OD540)×100 1.3 数据处理
正交试验设计与分析由正交设计助手生成;Microsoft Excel 2021版进行数据处理和分析,数值采用均数±标准差(mean±SD)表示;使用Origin 2019软件进行绘图。
2. 结果与分析
2.1 超声辅助法提取PG工艺优化
2.1.1 单因素实验
2.1.1.1 固液比对PG得率的影响
由图1可知,随着固液比的减小,即溶剂体积的增加,PG的得率呈现出先增大后降低的趋势。当固液比达到1:9 g/mL时,PG的得率最高,在这之后,PG的得率呈现下降趋势。PG为水溶性多糖,在一定范围内随着溶剂体积增加,固液相中的浓度差增大,PG的溶出率增大,但当溶剂体积进一步增加后,由于机械振动效果受到影响以及超声处理的空化效应从而导致PG得率下降[29−30]。类似的现象同样出现在提取其他植物多糖中,如茶树花多糖和龙牙百合多糖[31−32]。此外,溶剂的增加也会进一步提高生产的成本。因此,综合PG得率和生产成本两个角度考虑,选择固液比为1:6、1:9和1:12 g/mL为正交试验的三个水平。
2.1.1.2 超声功率对PG得率的影响
超声功率对PG得率的影响如图2所示。随着超声功率的增大,PG的得率呈现出先增大后降低的趋势,在超声功率达到120 W时,PG得率最高,当超声功率大于120 W时,PG得率开始下降。推测其原因可能是:在低功率下,超声能够破坏玉米细胞壁,使有效成分释放出来并与溶液相溶,因此在较低功率下能够提高PG得率,而超声功率过高,超声能量过大,破坏PG的结构,从而导致PG得率下降[33]。因此,选取超声功率120、160和200 W为正交试验的三个水平。
2.1.1.3 超声时间对PG得率的影响
超声时间对PG得率的影响如图3所示。在20~80 min内,PG得率呈增长的趋势;当超声时间进一步延长,PG得率开始出现轻微的下降。推测该原因是由于超声长时间的空穴作用会破坏PG的结构,从而导致PG得率的下降[34]。从节约时间和提高得率两方面考虑,选取超声时间60、80和100 min为正交试验的三个水平。
2.1.2 正交试验优化
根据单因素实验,利用L9正交表设计正交试验,确定最优提取工艺。由表2和表3可知:超声时间和固液比对PG得率的影响较为显著(P<0.05),进一步比较极差大小可知对PG得率影响的大小关系依次是C>A>B,即超声时间>固液比>超声功率,正交试验最佳提取工艺条件为A2B2C2,即固液比1:9(g/mL)、超声功率160 W、超声时间80 min。在该工艺条件下,重复三次测得PG得率为14.31%±0.38%。
表 2 正交试验设计及结果Table 2. Design and results of orthogonal test试验号 A固液比 B超声功率 C超声时间 得率(%) 1 1 1 1 8.94±0.36 2 1 2 2 12.28±063 3 1 3 3 10.87±0.68 4 2 1 3 14.08±1.04 5 2 2 1 12.86±0.51 6 2 3 2 11.52±0.84 7 3 1 2 11.48±0.76 8 3 2 3 10.61±0.54 9 3 3 1 12.39±1.07 k1 11.697 11.500 10.357 k2 12.820 11.917 12.917 k3 11.493 11.593 11.737 R 2.123 0.417 2.560 表 3 方差分析结果Table 3. Results of variance analysis因素 偏差平方和 自由度 F比 F临界值 显著性 固液比 6.903 2 19.779 19.00 * 超声功率 0.287 2 0.82 19.00 超声时间 9.850 2 28.223 19.00 * 误差 0.35 2 注:*表示差异显著,P<0.05。 2.2 PG表征、蛋白及总糖含量测定
为了比较超声辅助法和传统水提法两种方法对植物多糖PG性能的影响,本实验进一步测定了PG的形貌、尺寸、电荷及其蛋白含量。TEM成像揭示了两种方法制备的PG颗粒均呈现出近似球型的微观结构,但是PG-超声粒子的大小分布更为均一,而PG-水提颗粒中大尺寸粒子偏多(图4)。进一步比较可以发现,PG-超声的水合粒径(56.8 nm)明显小于PG-水提颗粒的粒径(92.4 nm),同时分散系数(PDI)也优于传统水提PG(图5)。作为一种纳米级多糖,两种方法获取的PG尺寸和PDI均小于传统的支化淀粉纳米粒[7],提示PG在纳米递送领域具有更大的潜力。此外,Zeta电位是反映溶液体系稳定性的另一关键指标,电位的绝对值越大,分子间的静电斥力就越大,溶液越趋于稳定[35]。图5显示了两种PG的Zeta电位均为负值,但两者绝对值无显著性差异(P>0.05),这是由于PG表面主要是羟基组分,在水溶液中通常不电离[36]。据此可以推测,电荷斥力可能不是PG稳定性的主要因素,而PG中羟基与水分子形成的水化膜可能在维持稳定性方面发挥重要作用。最后,通过比较两种方法获取的PG产物中蛋白含量可以发现,PG-超声中蛋白含量显著低于PG-水提中(P<0.05),这可能是由于超声促进蛋白/PG复合物(弱相互作用结合)的解离,在酸性条件下诱导更多游离蛋白质以沉淀形式去除。同时,利用苯酚-硫酸法测得产物中总糖含量分别为72.03%±3.77%(PG-水提)和90.39%±6.61%(PG-超声)。由此可知,超声辅助不仅有利于提升高质量PG的产率,同时在一定程度上还能降低杂蛋白含量,提高PG纯度[9]。
2.3 PG体外抗氧化能力测定
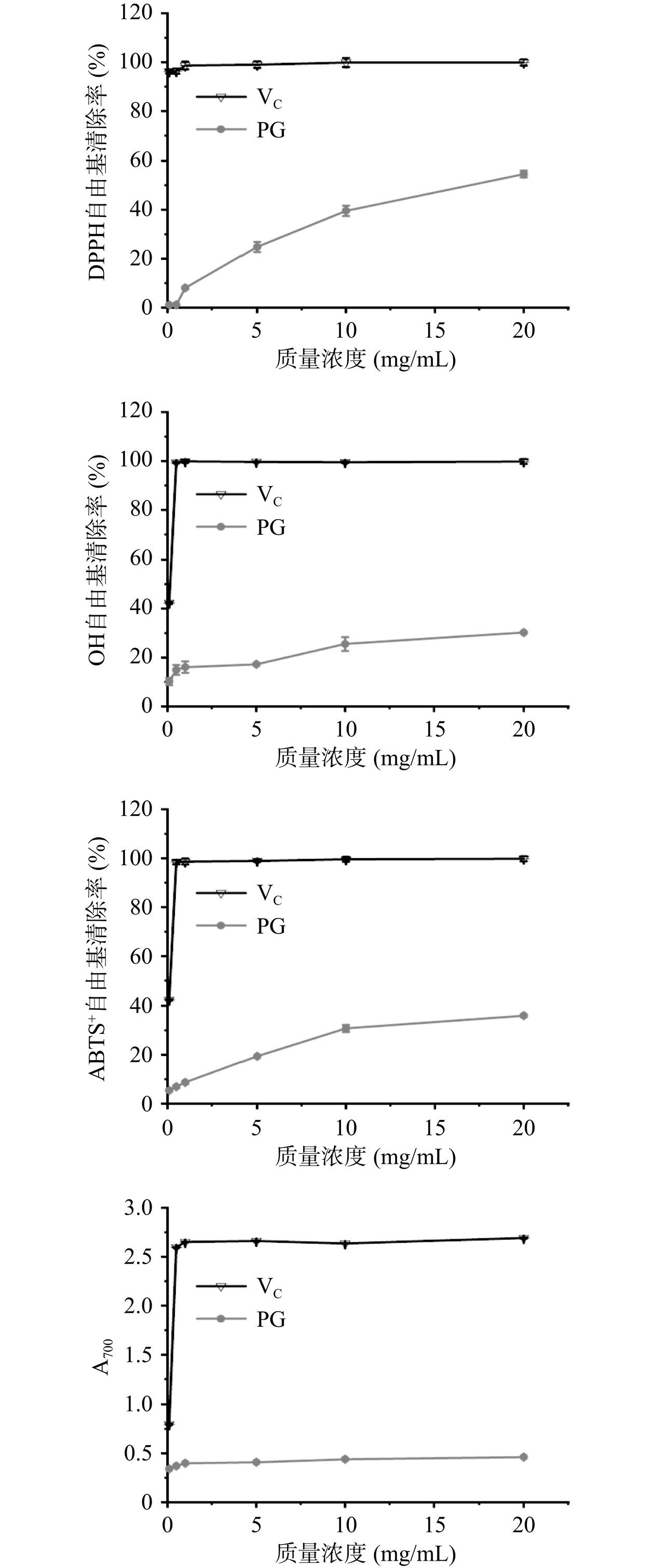
如图6所示,在实验浓度范围内,PG对DPPH自由基、羟基自由基和ABTS+自由基均有一定的清除能力,表现出明显的剂量依赖关系,清除效果均随浓度的增大而增大。当PG质量浓度为20 mg/mL时,PG对DPPH自由基、羟基自由基和ABTS+自由基的清除能力最大,分别达到54.58%±1.39%、30.22%±0.42%和35.95%±0.53%,均低于0.5 mg/mL时VC对三种自由基的清除能力。聚多糖的自由基清除能力与其自身还原力密切相关,而大多数多糖往往只有一个还原性末端,因此聚多糖还原力的高低决定于其糖环侧链基团,如羧基、羟基以及磺酸基等[37]。此外,PG的还原力较弱,即使增大浓度,增幅也相对较小,这主要是因为PG是一种α-D-葡聚糖,仅有一个还原末端半缩醛羟基,而其糖环上其他羟基还原性相对较弱[38]。
2.4 PG稳定性检测
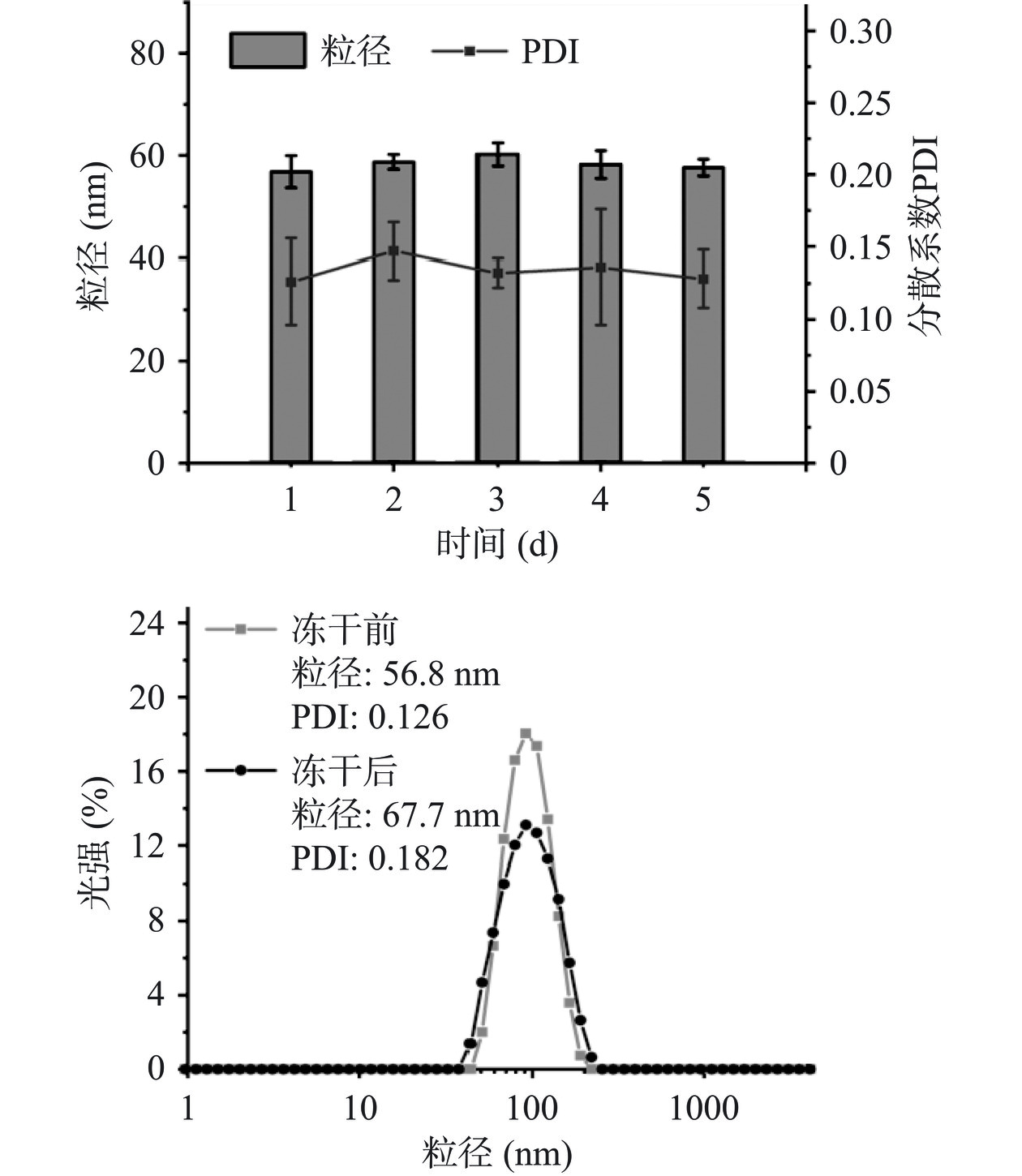
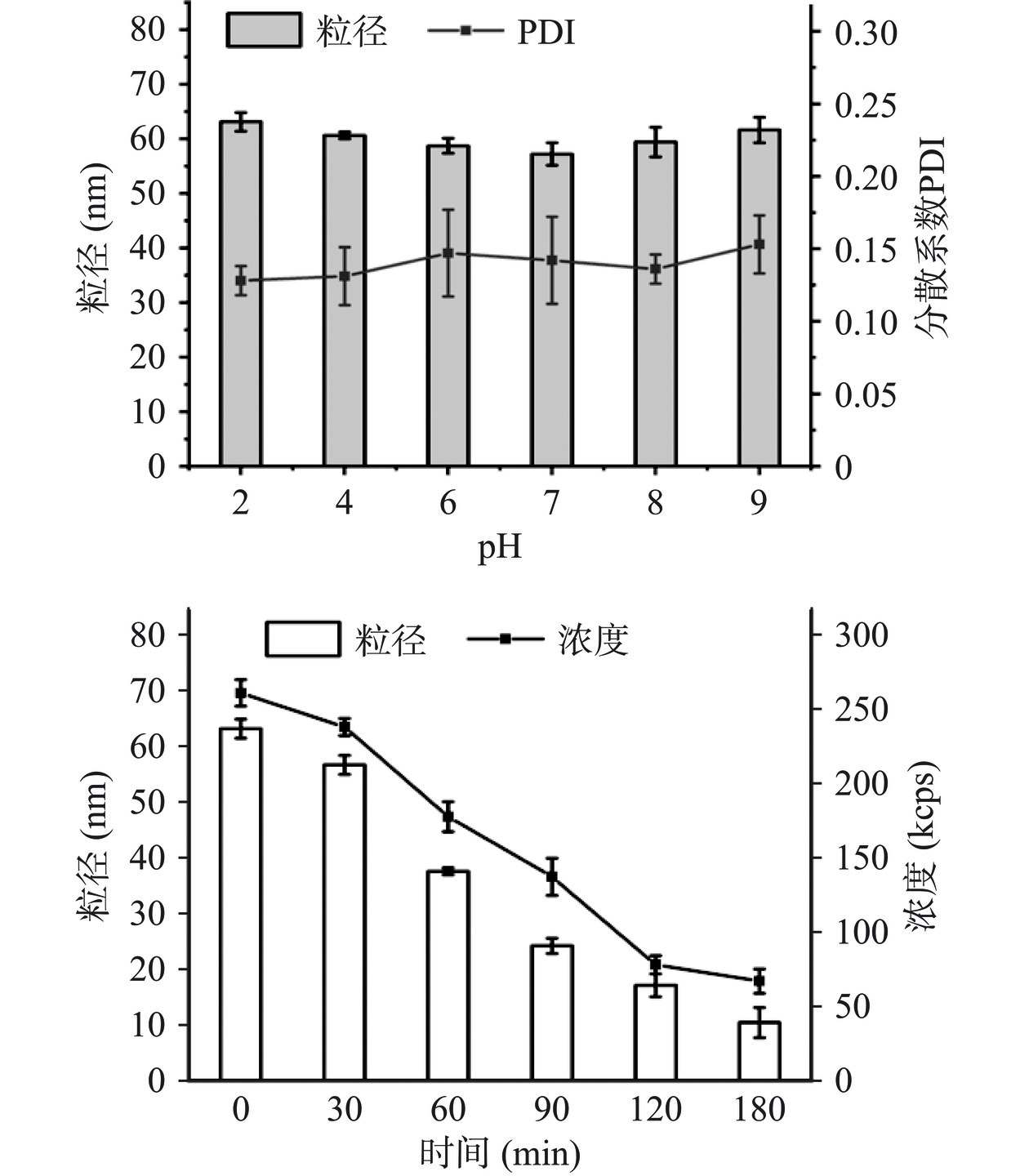
在上述基础上,本实验进一步探究了超声获取的PG在不同环境中的稳定性情况。如图7所示,随着存放时间的延长,PG-超声粒子的粒径并未发生较大变化,同时其PDI仅呈现轻微波动,说明溶液PG能够保持一个相对稳定的状态。通过冻干前后PG尺寸变化,可以发现,冻干复溶后PG尺寸有一定上调,这可能归因于PG颗粒冻融过程中分子间氢键作用引起的局部团聚现象[39]。然而,冻干PG整体尺寸仍未超出理想纳米颗粒的最佳范围(20~100 nm),说明PG具有较好的冻存稳定性。此外,在不同的pH环境下(图8),PG-超声粒子的粒径仍保持在60 nm左右,其PDI数值保持在0.15左右,说明PG能耐受一定程度的酸碱。最后,本实验研究了生物酶对PG的影响,在α-淀粉酶的作用下,PG-超声颗粒的尺寸随时间的延长不断变小,同时PG粒子数量也在不断减少,说明淀粉酶可以有效降解PG中的糖苷键,这有利于活性物质或药物的释放。
2.5 细胞毒性与凋亡
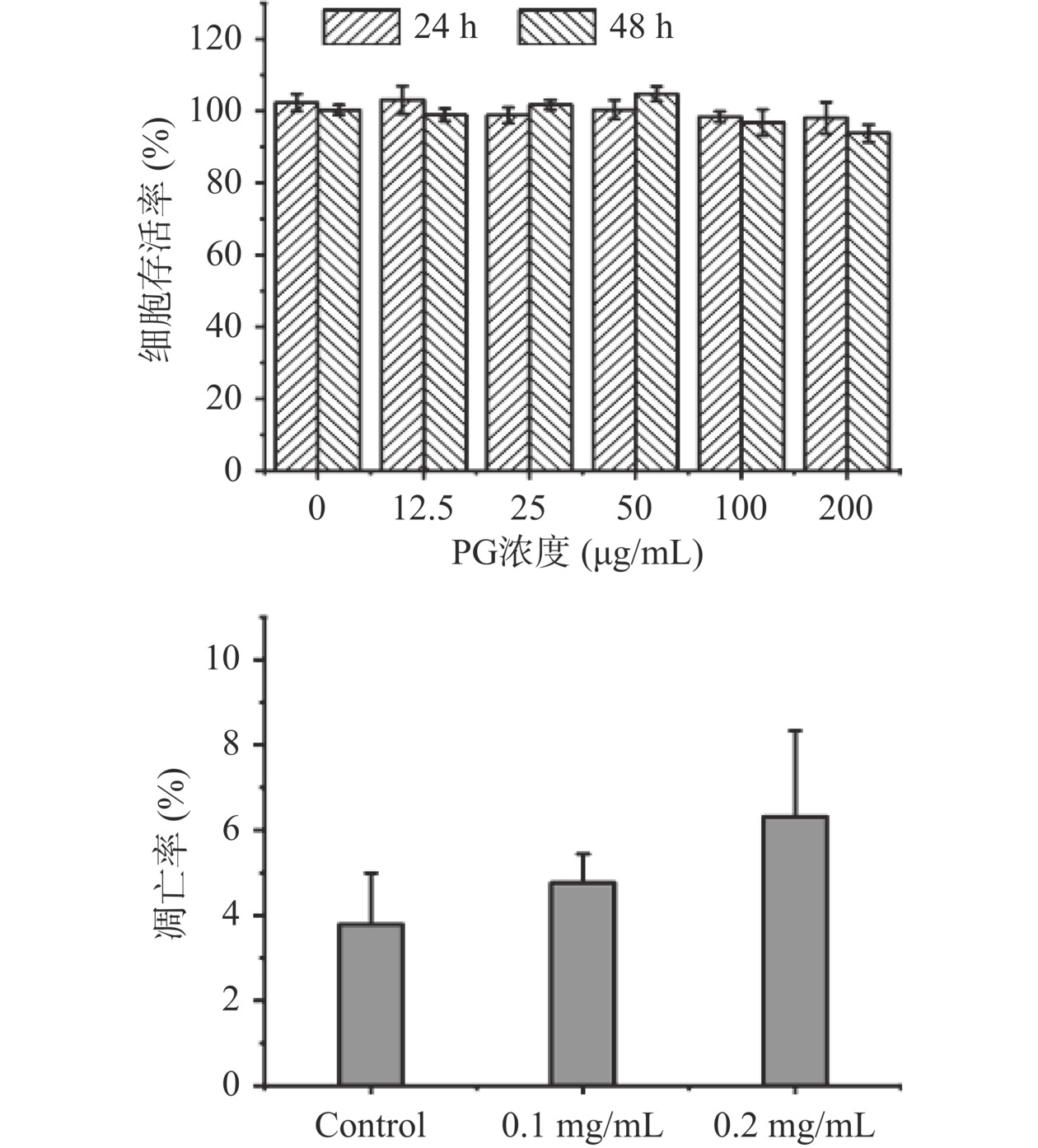
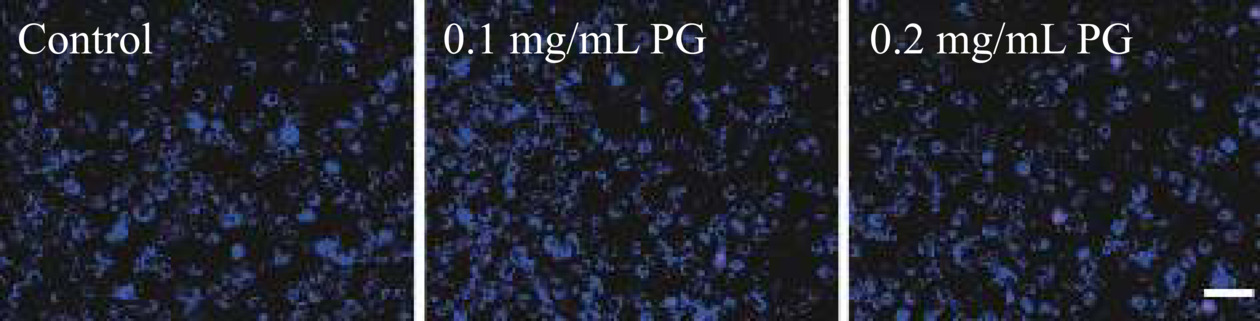
采用MTT法检测PG对人正常成纤维细胞3T3的毒性。由图9可知,在不同浓度下,PG作用于细胞24或48 h,细胞的存活率均大于95%,说明PG没有明显的细胞毒性。此外,在部分测试浓度下,细胞存活率超过100%,提示PG还可以促进细胞增殖,这归因于PG糖苷键断裂可以释放葡萄糖提供了更多能量来源[40]。本实验进一步采用Hoechst 33342/PI评价PG诱导细胞凋亡的能力。如图10所示,未经处理的3T3(Control)细胞核被Hoechst 33342染成蓝色,而经PG处理过后,极少数细胞核出现了淡紫色,提示这些细胞处于晚期细胞凋亡状态。对上述3组细胞进行凋亡率统计分析(图9),可以发现,随着PG浓度的增加,凋亡率呈现微弱的上升,但整体水平低于7%,提示高浓度PG可能对细胞有一定损伤,但影响较小。
2.6 溶血实验
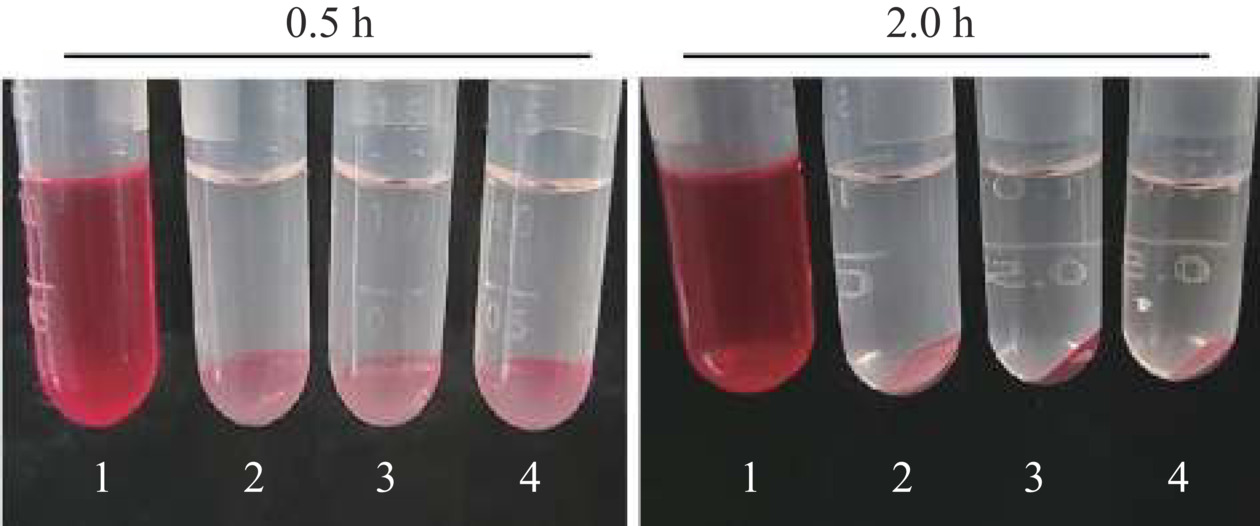
本实验采用溶血评价来检测样品与红细胞之间是否具有良好的生物相容性。从图11可以看出,与红细胞孵育0.5或2 h后,红细胞没有明显的破损,维持良好的形态,说明PG没有导致红细胞损伤;进一步测定上清中血红蛋白水平得出溶血率(表4),在0.5 h时,PG导致的HR在0.15%~0.31%;延长孵育时间至2 h时,HR在0.24%~0.70%之间,均远低于国家标准GB/T 16886.4-2022。因此,PG对红细胞具有良好的生物相容性。
表 4 PG的溶血率(x±s,n=3)Table 4. Hemolysis rate of PG (x±s, n=3)样品 0.5 h 2 h 平均OD值 溶血率(%) 平均OD值 溶血率(%) 去离子水 2.320±0.031 100 2.452±0.011 100 生理盐水 0.076±0.002 0 0.076±0.002 0 0.1 mg/mL PG 0.080±0.001 0.149±0.118 0.082±0.002 0.239±0.071 0.2 mg/mL PG 0.083±0.002 0.313±0.169 0.093±0.003 0.701±0.050 3. 结论
本文主要利用超声辅助提取法获取植物糖原,并对其工艺进行了正交优化,最佳工艺条件为固液比1:9 g/mL、超声功率160 W、超声时间80 min,在此条件下PG得率为14.31%±0.38%。与传统的水提法相比,超声辅助法能够有效降低PG产物中蛋白质含量,提高产物中的PG含量(90.39%±6.61%)。同时,超声法获取的PG颗粒尺寸更小,分散度也优于传统水提法。此外,PG具有一定的抗氧化活性,在20 mg/mL时,PG对DPPH自由基、羟基自由基和ABTS+自由基清除率分别为54.58%±1.39%、30.22%±0.42%和35.95%±0.53%。然而,PG的还原性整体较弱,导致其抗氧化能力远低于VC分子。此外,PG在水溶液中能维持长久的胶体稳定性,即使干燥二次复溶,对颗粒尺寸也仅是轻微的上调,影响较小;同时,PG能耐受一定程度的酸碱,但对α-淀粉酶较为敏感,在酶作用下能够快速水解。体外生物学评价揭示了PG无明显细胞毒性和溶血现象,高浓度时仅导致少许的细胞凋亡,说明PG具有良好的生物安全性。总体上,本实验的研究为PG制备工艺提供了一定的技术参考,同时,也证明了PG是一种生物性能良好的纳米级颗粒,这将拓展PG在体内外的应用潜力,尤其是对活性物质或药物的负载和控释。
-
表 1 正交试验因素水平
Table 1 Orthogonal test factor level
水平 因素 A固液比
(g/mL)B超声功率
(W)C超声时间
(min)1 1:6 120 60 2 1:9 160 80 3 1:12 200 100 表 2 正交试验设计及结果
Table 2 Design and results of orthogonal test
试验号 A固液比 B超声功率 C超声时间 得率(%) 1 1 1 1 8.94±0.36 2 1 2 2 12.28±063 3 1 3 3 10.87±0.68 4 2 1 3 14.08±1.04 5 2 2 1 12.86±0.51 6 2 3 2 11.52±0.84 7 3 1 2 11.48±0.76 8 3 2 3 10.61±0.54 9 3 3 1 12.39±1.07 k1 11.697 11.500 10.357 k2 12.820 11.917 12.917 k3 11.493 11.593 11.737 R 2.123 0.417 2.560 表 3 方差分析结果
Table 3 Results of variance analysis
因素 偏差平方和 自由度 F比 F临界值 显著性 固液比 6.903 2 19.779 19.00 * 超声功率 0.287 2 0.82 19.00 超声时间 9.850 2 28.223 19.00 * 误差 0.35 2 注:*表示差异显著,P<0.05。 表 4 PG的溶血率(x±s,n=3)
Table 4 Hemolysis rate of PG (x±s, n=3)
样品 0.5 h 2 h 平均OD值 溶血率(%) 平均OD值 溶血率(%) 去离子水 2.320±0.031 100 2.452±0.011 100 生理盐水 0.076±0.002 0 0.076±0.002 0 0.1 mg/mL PG 0.080±0.001 0.149±0.118 0.082±0.002 0.239±0.071 0.2 mg/mL PG 0.083±0.002 0.313±0.169 0.093±0.003 0.701±0.050 -
[1] XUE J, INZERO J, HU Q, et al. Development of easy, simple and low-cost preparation of highly purified phytoglycogen nanoparticles from corn[J]. Food Hydrocolloids,2019,95:256−261. doi: 10.1016/j.foodhyd.2019.04.041
[2] 王荣杰. 植物糖原Pickering乳液的制备及其理化性质的研究[D]. 无锡:江南大学, 2022. [WANG R J. Preparation and physicochemical properties of Pickering emulsion stabilized by phytoglycogen[D]. Wuxi:Jiangnan University, 2022.] WANG R J. Preparation and physicochemical properties of Pickering emulsion stabilized by phytoglycogen[D]. Wuxi: Jiangnan University, 2022.
[3] 张瑞琪, 杨成. 阳离子植物糖原的制备及性能研究[J]. 日用化学工业,2019,49(11):727−732. [ZHANG R Q, YANG C. Preparation and properties of cationic phytoglycogen[J]. China Surfactant Detergent & Cosmetics,2019,49(11):727−732.] ZHANG R Q, YANG C. Preparation and properties of cationic phytoglycogen[J]. China Surfactant Detergent & Cosmetics, 2019, 49(11): 727−732.
[4] FUJITA N, HANSHIRO I, SUZUKI S, et al. Elongated phytoglycogen chain length in transgenic rice endosperm expressing active starch synthase IIa affects the altered solubility and crystallinity of the storage α-glucan[J]. Journal of Experimental Botany,2012,63(16):5859−5872. doi: 10.1093/jxb/ers235
[5] PUSHPAMALAR J, VEERAMACHINENI A K, OWH C, et al. Biodegradable polysaccharides for controlled drug delivery[J]. ChemPlusChem,2016,81(6):504−514. doi: 10.1002/cplu.201600112
[6] 韩兴曼, 樊金玲, 王攀, 等. 植物糖原负载提高姜黄素的稳定性和生物活性[J]. 食品科学,2020,41(15):39−47. [HAN X M, FAN J L, WANG P, et al. Enhanced stability and bioactivity of curcumin encapsulated in phytoglycogen nanoparticles[J]. Food Science,2020,41(15):39−47.] doi: 10.7506/spkx1002-6630-20190703-036 HAN X M, FAN J L, WANG P, et al. Enhanced stability and bioactivity of curcumin encapsulated in phytoglycogen nanoparticles[J]. Food Science, 2020, 41(15): 39−47. doi: 10.7506/spkx1002-6630-20190703-036
[7] XUE J, LI Z, DUAN H, et al. Chemically modified phytoglycogen:physicochemical characteri-zations and applications to encapsulate curcumin[J]. Colloids and Surfaces B:Biointerfaces,2021,205:111829−111837. doi: 10.1016/j.colsurfb.2021.111829
[8] CHEN H, YAO Y. Phytoglycogen improves the water solubility and Caco-2 monolayer permeation of quercetin[J]. Food Chemistry,2017,221:248−257. doi: 10.1016/j.foodchem.2016.10.064
[9] 王蕊, 吕肖瑞, 张鹏敏, 等. 植物糖原的提取纯化、结构修饰及应用研究进展[J]. 食品科学,2024,45(3):258−294. [WANG R, LÜ X R, ZHANG P M, et al. Research progress on extraction, purification, structural modification, and application of phytoglycogen. [J]. Food Science,2024,45(3):258−294.] WANG R, LÜ X R, ZHANG P M, et al. Research progress on extraction, purification, structural modification, and application of phytoglycogen. [J]. Food Science, 2024, 45(3): 258−294.
[10] LU F, MENCIA A, BI L, et al. Dendrimer-like alpha-d-glucan nanoparticles activate dendritic cells and are effective vaccine adjuvants[J]. Journal of Controlled Release,2015,204:51−59. doi: 10.1016/j.jconrel.2015.03.002
[11] CHEN C, HUANG D, YANG Q, et al. Structure and thermal properties of cellulose nanofibrils extracted from alkali-ultrasound treated windmill palm fibers[J]. International Journal of Biological Macromolecules,2023,253:126645. doi: 10.1016/j.ijbiomac.2023.126645
[12] MIELES-GÓMEZ L, QUINTANA S E, GARCÍA-ZAPATEIRO L A. Ultrasound-assisted extraction of mango (Mangifera Indica) kernel starch:Chemical, techno-functional, and pasting properties[J]. Gels,2023,9(2):136. doi: 10.3390/gels9020136
[13] LIU R, BOEHLEIN S K, TRACY W F, et al. Characterizing the physical properties and cell compatibility of phytoglycogen extracted from different sweet corn varieties[J]. Molecules,2020,25(3):637. doi: 10.3390/molecules25030637
[14] 贾娟, 王婷婷, 傅航, 等. 响应面优化超声辅助法提取杜仲叶中绿原酸的工艺研究[J]. 保鲜与加工,2021,21(3):97−103. [JIA J, WANG T T, FU H, et al. Ultrasonic assisted extraction technique optimization of chlorogenic acid from Eucommia ulmoides leaves by response surface methodology[J]. Storage and Process,2021,21(3):97−103.] doi: 10.3969/j.issn.1009-6221.2021.03.015 JIA J, WANG T T, FU H, et al. Ultrasonic assisted extraction technique optimization of chlorogenic acid from Eucommia ulmoides leaves by response surface methodology[J]. Storage and Process, 2021, 21(3): 97−103. doi: 10.3969/j.issn.1009-6221.2021.03.015
[15] MIAO M. Phytoglycogen-based systems[J]. Bioactive Delivery Systems for Lipophilic Nutraceuticals:Formulation, Fabrication, and Application,2023(19):322.
[16] HUANG G, CHEN F, YANG W, et al. Preparation, deproteinization and comparison of bioactive polysaccharides[J]. Trends in Food Science & Technology,2021,109:564−568.
[17] HORWITZ W. Official methods of analysis[M]. Washington, DC:Association of Official Analytical Chemists, 1975.
[18] 郭璐璐. 金福菇多糖TLH-3提取分离以及抗氧化活性片段筛选[D]. 合肥:安徽大学, 2014. [GUO L L. Extraction, separation and screening of antioxidant activity of polysaccharide TLH-3 from Tricholoma lobayense[D]. Hefei:Anhui University, 2014.] GUO L L. Extraction, separation and screening of antioxidant activity of polysaccharide TLH-3 from Tricholoma lobayense[D]. Hefei: Anhui University, 2014.
[19] HUANG R, ZHANG Y, SHEN S, et al. Antioxidant and pancreatic lipase inhibitory effects of flavonoids from different citrus peel extracts:An in vitro study[J]. Food Chemistry,2020,326:126785. doi: 10.1016/j.foodchem.2020.126785
[20] 胡晓彤, 叶玉洁, 石光, 等. 桑黄子实体多糖的提取及其对D-半乳糖诱导的3T3细胞损伤的保护作用[J]. 食品科学,2020,41(19):204−211. [HU X T, YE Y J, SHI G, et al. Extraction of polysaccharides from fruiting bodies of Phellinus igniarius and its protective effect on D-galactose induced 3T3 cell injury[J]. Food Science,2020,41(19):204−211.] doi: 10.7506/spkx1002-6630-20190906-078 HU X T, YE Y J, SHI G, et al. Extraction of polysaccharides from fruiting bodies of Phellinus igniarius and its protective effect on D-galactose induced 3T3 cell injury[J]. Food Science, 2020, 41(19): 204−211. doi: 10.7506/spkx1002-6630-20190906-078
[21] ARNAO M B, CANO A, ACOSTA M. The hydrophilic and lipophilic contribution to total antioxidant activity[J]. Food Chem,2001,73(2):239−244. doi: 10.1016/S0308-8146(00)00324-1
[22] GOVARDHAN SINGH R S, NEGI P S, RADHA C. Phenolic composition, antioxidant and antimicrobial activities of free and bound phenolic extracts of Moringa oleifera seed flour[J]. Journal of Functional Foods,2013,5(4):1883−1891. doi: 10.1016/j.jff.2013.09.009
[23] 李龙昱. 基于MTT法研究唐古特大黄多糖对不同肿瘤细胞的抑制作用[J]. 中国高原医学与生物学杂志,2019,40(3):180−183. [LI L Y. The composition of tangufican maxim polysaccharides and the inhibitory effect on different tumor cells[J]. Chinese High Altitude Medicine and Biology,2019,40(3):180−183.] LI L Y. The composition of tangufican maxim polysaccharides and the inhibitory effect on different tumor cells[J]. Chinese High Altitude Medicine and Biology, 2019, 40(3): 180−183.
[24] 包桥桥, 李梦茹, 黄榕, 等. 异鼠李素调控AKT-FOXO1通路改善胰岛素抵抗HepG2细胞糖代谢作用机制[J]. 食品工业科技,2020,41(23):320−324. [BAO Q Q, LI M R, HUANG R, et al. The mechanism of isorhamnetin regulating AKT-FOXO1 pathways on improve the insulin resistance model of HepG2 cells[J]. Science and Technology of Food Industry,2020,41(23):320−324.] BAO Q Q, LI M R, HUANG R, et al. The mechanism of isorhamnetin regulating AKT-FOXO1 pathways on improve the insulin resistance model of HepG2 cells[J]. Science and Technology of Food Industry, 2020, 41(23): 320−324.
[25] 阳丹, 蔡舒, 彭成海, 等. 老香黄多糖的分离纯化及其体外胃黏膜保护活性研究[J]. 食品工业科技,2023,44(19):440−448. [YANG D, CAI S, PENG C H, et al. Studies on isolation, purification and gastric mucosal protective activity in vitro of laoxianghuang polysaccharide[J]. Science and Technology of Food Industry,2023,44(19):440−448.] YANG D, CAI S, PENG C H, et al. Studies on isolation, purification and gastric mucosal protective activity in vitro of laoxianghuang polysaccharide[J]. Science and Technology of Food Industry, 2023, 44(19): 440−448.
[26] 冯朵, 王靖, 蒋勇军, 等. 肉苁蓉总苷对HepG2细胞增殖、凋亡及Wnt/β-catenin通路相关蛋白表达的影响[J]. 食品工业科技,2023,44(20):389−397 [FENG D, WANG J, JIANG Y J, et al. Effects of total glycosides of cistanche deserticola on proliferation, apoptosis and expression of Wnt/β-catenin signaling pathway related protein of HepG2 cells[J]. Science and Technology of Food Industry,2023,44(20):389−397.] FENG D, WANG J, JIANG Y J, et al. Effects of total glycosides of cistanche deserticola on proliferation, apoptosis and expression of Wnt/β-catenin signaling pathway related protein of HepG2 cells[J]. Science and Technology of Food Industry, 2023, 44(20): 389−397.
[27] 王晓红. 新型基于普鲁兰多糖的药物/基因共递送载体研究[D]. 大连:大连理工大学, 2015. [WANG X H. A novel pullulan-based co-carrier for drug and gene[D]. Dalian:Dalian University of Technology, 2015.] WANG X H. A novel pullulan-based co-carrier for drug and gene[D]. Dalian: Dalian University of Technology, 2015.
[28] WEI X, DING S, LIU S, et al. Polysaccharides-modified chitosan as improved and rapid hemostasis foam sponges[J]. Carbohydrate Polymers,2021,264:118028. doi: 10.1016/j.carbpol.2021.118028
[29] 钱燕芳, 石晨莹, 陈贵堂. 桑葚多糖超声提取、脱色工艺优化及其抗氧化活性分析[J]. 食品工业科技,2022,43(16):201−210. [QIAN Y F, SHI C Y, CHEN G T. Optimization of ultrasound-assisted extraction and decolorization process of polysaccharides from Mori Fructus and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(16):201−210.] QIAN Y F, SHI C Y, CHEN G T. Optimization of ultrasound-assisted extraction and decolorization process of polysaccharides from Mori Fructus and its antioxidant activity[J]. Science and Technology of Food Industry, 2022, 43(16): 201−210.
[30] SOROURIAN R, KHAJEHRAHIMI A E, TADAYONI M, et al. Ultrasound-assisted extraction of polysaccharides from Typha domingensis:Structural characterization and functional properties[J]. International Journal of Biological Macromolecules,2020,160:758−768. doi: 10.1016/j.ijbiomac.2020.05.226
[31] 秦德利, 贾坤, 窦珺荣, 等. 茶树花多糖超声波辅助热水浸提工艺优化[J]. 食品工业科技,2015,36(4):215−218,223. [QIN D L, JIA K, DOU J R, et al. Optimization of ultrasound-assisted hot water extraction of polysaccharides from tea flower[J]. Science and Technology of Food Industry,2015,36(4):215−218,223.] QIN D L, JIA K, DOU J R, et al. Optimization of ultrasound-assisted hot water extraction of polysaccharides from tea flower[J]. Science and Technology of Food Industry, 2015, 36(4): 215−218,223.
[32] 王威振, 杨盼盼, 遆永瑞, 等. 龙牙百合多糖的超声辅助提取及其抗氧化、降血脂活性分析[J]. 食品工业科技,2023,44(18):251−257. [WANG W Z, YANG P P, TI Y R, et al. Ultrasound-assisted extraction and analysis of antioxidation and hypolipidemia activities of polysaccharides from Lilium brownii var. Viridulum[J]. Science and Technology of Food Industry,2023,44(18):251−257.] WANG W Z, YANG P P, TI Y R, et al. Ultrasound-assisted extraction and analysis of antioxidation and hypolipidemia activities of polysaccharides from Lilium brownii var. Viridulum[J]. Science and Technology of Food Industry, 2023, 44(18): 251−257.
[33] 冼丽清, 李珊, 冯彬, 等. 百色红茶多糖提取工艺优化及其对油脂抗氧化活性研究[J]. 化学研究与应用,2022,34(5):1025−1031. [XIAN L Q, LI S, FENG B, et al. Optimization of extraction technology of polysaccharides from Baise-black tea and its antioxidant activity on grease[J]. Chemical Research and Application,2022,34(5):1025−1031.] doi: 10.3969/j.issn.1004-1656.2022.05.013 XIAN L Q, LI S, FENG B, et al. Optimization of extraction technology of polysaccharides from Baise-black tea and its antioxidant activity on grease[J]. Chemical Research and Application, 2022, 34(5): 1025−1031. doi: 10.3969/j.issn.1004-1656.2022.05.013
[34] 贺便, 成超超, 王攀. 双酶法-超声辅助提取松针多糖工艺优化[J]. 安徽农学通报,2019,25(7):19−22. [HE B, CHENG C C, WANG P. Optimization of double enzyme method-ultrasonic assisted extraction of pine needle polysaccharide[J]. Anhui Agricultural Science Bulletin,2019,25(7):19−22.] doi: 10.3969/j.issn.1007-7731.2019.07.007 HE B, CHENG C C, WANG P. Optimization of double enzyme method-ultrasonic assisted extraction of pine needle polysaccharide[J]. Anhui Agricultural Science Bulletin, 2019, 25(7): 19−22. doi: 10.3969/j.issn.1007-7731.2019.07.007
[35] 曾凡珂, 潘蕾蔓, 张祎, 等. 荸荠皮多糖的理化性质及抗氧化活性[J]. 现代食品科技,2022,38(3):82−88,81. [ZENG F K, PAN L M, ZHANG Y, et al. Physicochemical properties and antioxidant activities of the polysaccharides from Chinese water chestnut peels[J]. Modern Food Science and Technology,2022,38(3):82−88,81.] ZENG F K, PAN L M, ZHANG Y, et al. Physicochemical properties and antioxidant activities of the polysaccharides from Chinese water chestnut peels[J]. Modern Food Science and Technology, 2022, 38(3): 82−88,81.
[36] DÍAZ-MONTES E. Dextran:Sources, structures, and properties[J]. Polysaccharides,2021,2(3):554−565. doi: 10.3390/polysaccharides2030033
[37] QIN Z, LIU H M, LV T T, et al. Structure, rheological, thermal and antioxidant properties of cell wall polysaccharides from Chinese quince fruits[J]. International Journal of Biological Macromolecules,2020,147:1146−1155. doi: 10.1016/j.ijbiomac.2019.10.083
[38] PEREZ-CASTINEIRA J. Chemistry and biochemistry of food[M]. Walter de Gruyter GmbH & Co KG, 2020.
[39] HOLZER M, VOGEL V, MÄNTELE W, et al. Physico-chemical characterisation of PLGA nanoparticles after freeze-drying and storage[J]. European Journal of Pharmaceutics and Biopharmaceutics,2009,72(2):428−437. doi: 10.1016/j.ejpb.2009.02.002
[40] 李风铃. 嗜热葡萄糖淀粉酶与α-淀粉酶克隆表达和酶学研究[D]. 合肥:安徽大学, 2019. [LI F L. Cloning, expression and enzymology studies of hyperthermophilic glucoamylases and α-amylase[D]. Hefei:Anhui University, 2019.] LI F L. Cloning, expression and enzymology studies of hyperthermophilic glucoamylases and α-amylase[D]. Hefei: Anhui University, 2019.
-
期刊类型引用(0)
其他类型引用(2)





 下载:
下载:

 下载:
下载:



