Extraction Process Optimization and Antioxidant Activity of Total Flavonoids from Haloragis micrantha (Thunb.) R. Brown.
-
摘要: 为优化小二仙草总黄酮的超声提取工艺,并探讨其抗氧化活性。本文采用单因素实验,以总黄酮得率为指标,考察乙醇体积分数、料液比、超声温度、提取时间对小二仙草总黄酮得率的影响,采用Box-Behnken法优化提取工艺。检测小二仙草总黄酮对DPPH和ABTS+自由基的清除能力和总还原力。结果表明:小二仙草总黄酮的最佳提取工艺为乙醇体积分数76.15%、料液比1:39.66 g/mL、超声时间41.14 min,此时小二仙草总黄酮的得率为28.61±0.05 mg/g。小二仙草总黄酮均能有效清除DPPH和ABTS+自由基,且在一定范围内,清除能力随着质量浓度的增加而增强,其中小二仙草总黄酮清除ABTS+自由基能力最强,在浓度为3 mg/mL时,清除率达到98.28%,与3 mg/mL维生素C(清除率为99.81%)相当,且小二仙草总黄酮具有较高还原力,抗氧化活性较好。该工艺简便、可行,且提取的总黄酮具有良好的抗氧化活性。Abstract: The objective of this study was to optimize the extraction process of total flavonoids from Haloragis micrantha (Thunb.) R. Brown. and explore its antioxidant activity. With the yield of total flavonoids as an evaluation index, single factor tests were used to investigate the effects of ethanol volume fraction, solid-liquid ratio, ultrasonic temperature and extraction time on the total flavonoids content of Haloragis micrantha (Thunb.) R. Brown., and the Box-Behnken method was used to optimize the extraction process. The scavenging ability and total reducing power of total flavonoids of Haloragis micrantha (Thunb.) R. Brown. to DPPH and ABTS+ free radicals were detected. The results showed that optimum extraction process was ethanol volume fraction of 76.15%, liquid to material ratio of 1:39.66 g/mL, ultrasonic time of 41.14 min. The yield of total flavonoids from Haloragis micrantha (Thunb.) R. Brown. was 28.61±0.05 mg/g. The total flavonoids of Haloragis micrantha (Thunb.) R. Brown. could effectively scavenge DPPH and ABTS+ free radicals. Within a certain range, the scavenging ability increased with the increasing of mass concentration, and the total flavonoids of Haloragis micrantha (Thunb.) R. Brown. had high reducing power and better antioxidant activity. The total flavonoids of Haloragis micrantha (Thunb.) R. Brown. had the strongest ability to scavenge ABTS+ free radicals. When the concentration of total flavonoids was 3 mg/mL, the clearance rate of ABTS+ were 98.28%, which was equivalent to 3 mg/mL vitamin C (clearance rate was 99.81%). This process would be simple and feasible, and the extracted total flavonoids have good antioxidant activity.
-
小二仙草(Haloragis micrantha(Thunb.)R. Brown.)是小二仙草科植物,又名豆瓣草、水豆瓣、女儿红等,味苦、涩,性凉[1],主要分布于广西、广东、云南、湖南等地,具有调经活血、清热利湿、止咳平喘等功效[2-3]。小二仙草中多酚类化合物含量较多,多为单宁类化合物和黄酮类化合物,黄酮类化合物具有抗氧化[4]、清除自由基[5]、调节免疫力[6]、保肝[7]、降血糖[8]、抗肿瘤[9]、抗炎[10]等多种药理活性,在食品和医药行业应用广泛,常作为保健食品出现在公众的视野,雷永平[11]探讨了刺玫果总黄酮的纯化工艺,并研制了刺玫果总黄酮胶囊,具有抗氧化的功效。林燕燕等[12]提取白凤菜中的总黄酮,并以其为原料调制出白凤菜保健饮料。王莲婧[13]提取了化橘红中多种有效成分,并研制出化橘红维C泡腾片。目前,对于小二仙草的研究仅限于对其化学成分分离提取[14],未见有对其黄酮类物质提取及其药理活性进行研究的文献。
目前总黄酮的提取方法主要有加热回流法、超声提取法、超声复合酶法等[15],超声提取法能使溶剂高速振动,产生剧烈的空化效应,使提取溶剂快速渗入,促进对有效成分的提取[16-17]。超声波提取法具有简单易行、提取效率高、环保等优点。因此,本文选用小二仙草开展研究,采用超声波辅助提取法探讨小二仙草总黄酮的提取工艺,考察了乙醇体积分数、料液比、超声温度、提取时间对小二仙草总黄酮含量的影响;采用Box-Behnken法优化提取工艺,并检测小二仙草总黄酮提取物的抗氧化活性,以期为提高小二仙草的黄酮类化合物的提取效率,及进一步的深入研究提供参考依据。
1. 材料与方法
1.1 材料与仪器
小二仙草 购自广西靖西,经广西中医药大学田慧教授鉴定,干燥后,用粉碎机粉碎,过60目筛,密封备用;芦丁对照品(含量>98%) 中国药品生物制品检定所;1,1-二苯基-2-三硝基苯肼(DPPH) 上海化成有限公司;维生素C 国药集团化学试剂有限公司;2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS) 麦克林生化科技有限公司;其他有机试剂 均为分析纯。
UVmini-1240型紫外可见分光光度计 日本岛津公司;AR224CN电子天平 奥豪斯仪器有限公司;KQ-500DE数控超声波清洗器 昆山市超声仪器有限公司;Epoch型全波长酶标仪 美国Bio Tek公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;LEGEND MICRO17微量台式离心机 美国赛默飞公司。
1.2 实验方法
1.2.1 单因素实验
准确称取小二仙草粉末,每份1.0 g,在设定的实验条件下超声提取,提取3次,过滤,得到小二仙草总黄酮提取液,每组实验平行3次,研究不同提取条件对黄酮得率的影响。
1.2.1.1 不同乙醇体积分数对小二仙草总黄酮得率的影响
设定料液比1:30 g/mL,超声温度60 ℃,超声时间30 min,超声功率为400 W,超声频率为40 kHz,考察乙醇体积分数(55%、65%、75%、85%、95%)对总黄酮得率的影响。
1.2.1.2 不同料液比对小二仙草总黄酮得率的影响
设定乙醇体积分数75%,超声温度60 ℃,超声时间30 min,超声功率为400 W,超声频率为40 kHz,考察料液比(1:10、1:20、1:30、1:40、1:50 g/mL)对总黄酮得率的影响。
1.2.1.3 不同超声时间对小二仙草总黄酮得率的影响
设定乙醇体积分数75%,料液比1:40,超声温度60 ℃,超声功率为400 W,超声频率为40 kHz,考察超声时间(10、20、30、40、50 min)对总黄酮得率的影响。
1.2.1.4 不同超声温度对小二仙草总黄酮得率的影响
设定乙醇体积分数75%,料液比1:40 g/mL,超声时间40 min,超声功率为400 W,超声频率为40 kHz,考察超声温度(40、50、60、70、80 ℃)对总黄酮得率的影响。
1.2.2 响应面试验
以单因素结果为依据,选择其中的显著因素为自变量。使用Design-Expert 8.0.6软件结合Box-Behnken设计法,选取乙醇体积分数(A)、料液比(B)、超声时间(C)为自变量,总黄酮得率为响应值,在超声温度为70 ℃、超声功率为400 W、超声频率为40 kHz的条件下,优化小二仙草总黄酮的提取工艺,因素水平设计如表1所示。
表 1 响应面试验设计因素与水平Table 1. Design factors and levels of response surface experiment因素 水平 −1 0 1 A乙醇体积分数(%) 65 75 85 B料液比(g/mL) 1:30 1:40 1:50 C超声时间(min) 30 40 50 1.2.3 芦丁标准品溶液的制备
取12.5 mg芦丁标准品,精密称定,用75%乙醇充分溶解并定容至25 mL,配制成0.5 mg/mL的芦丁标准品溶液。
1.2.4 检测波长的选择
参照鲁宪坤等[18]方法并加以改进,量取3 mL芦丁标准品溶液于25 mL容量瓶中,加入5% NaNO2溶液1 mL混匀,静置6 min,再加10% Al(NO3)3溶液1 mL混匀,静置6 min,之后加4% NaOH溶液5 mL后,加水定容至25 mL,混匀,静置10 min,以75%乙醇做空白对照,在400~800 nm测定吸收光谱,选择最大吸收波长,发现黄酮类化合物在512 nm处有最大吸收峰。
1.2.5 标准曲线的绘制
精密量取0.5 mg/mL的芦丁标准品溶液0、1、2、3、4、5 mL于25 mL容量瓶中,采用实验1.2.4中的显色法测定吸光度值,绘制以芦丁标准品溶液的质量浓度(X)为横坐标,吸光度(A)为纵坐标的标准曲线,得回归方程为A=11.928X−0.0085,R2=0.9997,且在0.01~100 μg/mL呈良好的线性关系。
1.2.6 小二仙草总黄酮得率的测定
称取小二仙草粉末1.0 g,加入75%乙醇30 mL,在超声温度为60 ℃,超声功率为400 W,超声频率为40 kHz的条件下提取总黄酮30 min,提取3次,过滤,摇匀,得到小二仙草总黄酮提取液。将小二仙草总黄酮提取液用75%乙醇定容至100 mL容量瓶中,精密量取1 mL,采用实验1.2.4中的显色法测定吸光度值(A),代入回归方程计算提取液中总黄酮的质量浓度(C),计算小二仙草总黄酮得率(Y)的公式如下:
$$ {\rm{Y}}={\rm{C}}\times100\times25/{\rm{M}} $$ 式中:Y为小二仙草总黄酮得率,mg/g;C为提取液中总黄酮的质量浓度,mg/mL;M为称取小二仙草的质量,g。
1.2.7 体外抗氧化活性分析
1.2.7.1 DPPH自由基清除能力的测定
参照关奎奎等[19]方法,向96孔板中分别加入100 μL不同浓度的样品溶液,加入0.2 mmol/L的DPPH溶液100 μL,混匀后室温避光孵育30 min,于517 nm处测定溶液的吸光度值A样品。同时以等体积的无水乙醇代替DPPH溶液测定溶液的吸光度值为A对照,以等体积的无水乙醇代替样品溶液测定的吸光度值为A空白。VC作为阳性对照,样品组为不同浓度的总黄酮提取物,为了直观的对比样品组的抗氧化效果,阳性对照与样品组的浓度保持一致,每个浓度的样品做三组平行试验。根据实验所测得的吸光度值计算清除率。DPPH自由基清除率计算公式如下:
$$ 清除率(\text{%})=[1-({\rm{A}}_{样品}-{\rm{A}}_{对照})/{\rm{A}}_{空白}]\times 100$$ 1.2.7.2 ABTS+自由基清除能力的测定
参照杨永涛[20]方法并进行改良,取等体积7 mmoL/L的ABTS+溶液和1.4 mmoL/L过硫酸钾溶液混合均匀,避光24 h,使用时用蒸馏水调节吸光度值为0.7±0.02即可获得工作液。向96孔板中加入150 μL工作液和50 μL样品溶液混合均匀,避光反应6 min,于734 nm波长处测定吸光度值为A样品。空白组用双蒸水代替样品溶液测定的吸光度值为A空白,对照组用双蒸水代替工作液测定的吸光度值为A对照。VC作为阳性对照,样品组为不同浓度的总黄酮提取物,为了直观的对比样品组的抗氧化效果,阳性对照与样品组的浓度保持一致,每个浓度的样品做三组平行试验。根据实验所测得的吸光度值计算清除率。
$$ 清除率(\text{%})=[({\rm{A}}_{空白}-{\rm{A}}_{样品}+{\rm{A}}_{对照})/{\rm{A}}_{空白}]\times 100 $$ 1.2.7.3 还原力测定
参考赵晋彤等[21]方法,将1.0 mL样品溶液,2.5 mL磷酸盐缓冲溶液(pH=6.6)依次加入试管中,混合均匀后向每支试管中加入2.5 mL的1%铁氰化钾溶液,于50 ℃水浴20 min后,分别加入10 %三氯乙酸2.5 mL,混匀之后再以3000 r/min离心10 min,取2.5 mL上清液置于试管中,加入0.5 mL的0.1%三氯化铁溶液和2.5 mL蒸馏水,摇匀后取适量于700 nm处测定吸光度值。VC作为阳性对照,为了直观的对比样品组的抗氧化效果,阳性对照与样品组的浓度保持一致,样品组为不同浓度的总黄酮提取物,所有样品平行测定三组。
1.3 数据处理
所有试验均重复三次,运用Excel 2010、Origin 2021、Design-Expert 8.0.6、SPSS 21.0等软件进行数据处理及统计分析。
2. 结果与分析
2.1 单因素实验结果
2.1.1 乙醇体积分数对小二仙草总黄酮得率的影响
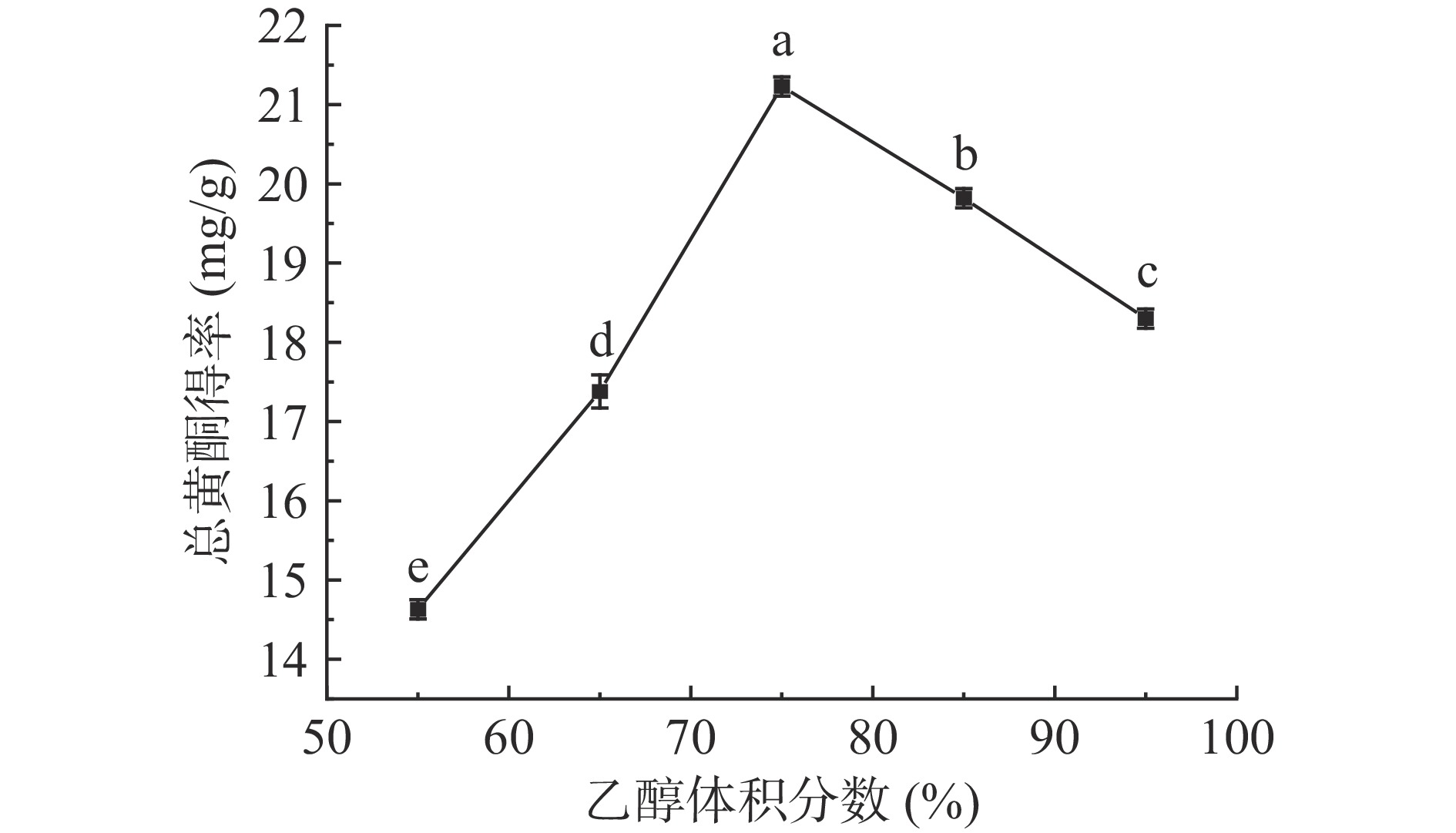
乙醇体积分数对小二仙草总黄酮得率的影响如图1所示,乙醇体积分数由55%增加到75%时,总黄酮得率逐渐升高,在75%时达到最高,总黄酮得率为21.23±0.12 mg/g。在乙醇体积分数由75%增加到95%时,总黄酮得率显著下降(P<0.05),总黄酮得率降低至18.30±0.13 mg/g。分析其原因,黄酮是一类典型的有机化合物,其易溶于乙醇等有机试剂,总黄酮得率会随着乙醇体积分数的升高而增大,但当乙醇体积分数超过75%时,提取液中除黄酮外的其他物质的溶出量也随之提高,从而影响黄酮类物质的提取,此结果与刘晓梅等[22]采用大孔树脂吸附提取川麦冬须根总黄酮的研究结果相似。但乙醇体积分数过高,会导致溶液极性降低,低极性杂质如脂溶性、醇溶性物质等将被大量溶出,并挤占黄酮的溶出空间,使总黄酮得率下降[23]。因此,选取乙醇体积分数在65%~85%范围内作为小二仙草总黄酮的提取溶剂进行优化。
2.1.2 料液比对小二仙草总黄酮得率的影响
料液比对小二仙草总黄酮得率的影响如图2所示,总黄酮得率随着料液比的升高呈先升高后下降的趋势。总黄酮得率在料液比为1:40 g/mL时最高,当料液比大于1:40 g/mL时,总黄酮得率显著降低(P<0.05),得率由24.00±0.10 mg/g降低至22.95±0.21 mg/g,其原因可能是溶剂过多,使小二仙草受到超声波的空化效应减弱[24],且当黄酮完全溶出后,总黄酮得率将不会有显著的变化。为减少实验试剂节约成本,且提高总黄酮得率,设定料液比在1:30~1:50 g/mL范围内进行后续试验。
2.1.3 超声时间对小二仙草总黄酮得率的影响
超声时间对小二仙草总黄酮得率的影响如图3所示,随着超声时间的增加,总黄酮得率在超声10 min到30 min时直线升高,在40 min时达到最高,得率由15.92±0.20 mg/g升高至24.25±0.09 mg/g。随着超声时间的延长,总黄酮得率开始出现下降的趋势(P<0.05)。原因可能是小二仙草中总黄酮含量一定,过长的超声时间可能会导致超声破坏了黄酮的分子结构,降低总黄酮得率[25]。因此,选择超声时间在30~50 min进行后续响应面试验。
2.1.4 超声温度对小二仙草总黄酮得率的影响
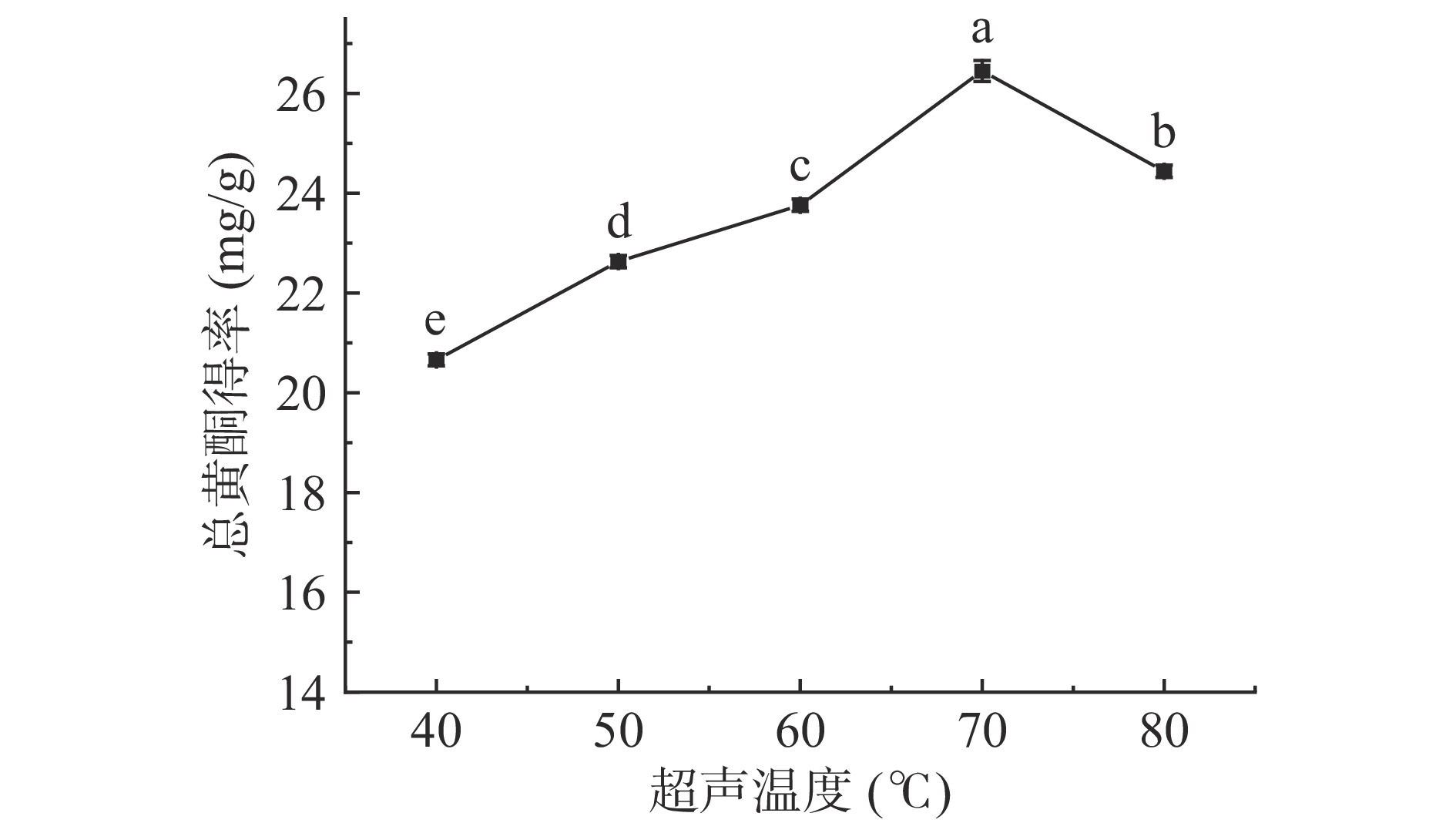
超声温度对小二仙草总黄酮得率的影响如图4所示,小二仙草总黄酮得率随着超声温度的升高呈先升高后下降的趋势,但升高趋势较缓慢。小二仙草总黄酮得率在超声温度为70 ℃时达到最高(26.45±0.21 mg/g),当超声温度大于70 ℃时,得率开始下降。其原因可能是高温可能会破坏部分黄酮的分子结构,导致小二仙草总黄酮得率下降[26]。因此,适宜超声温度为70 ℃。
2.2 响应面实验结果与分析
2.2.1 响应面实验设计结果
采用Design-Expert 8.0.6软件对响应曲面实验数据进行分析,响应实验结果见表2所示,得到小二仙草总黄酮提取液的拟合回归方程为:Y=28.41+0.97A−0.26B+1.23C−0.94AB−2.05AC+0.63BC−3.36A2−4.41B2−4.30C2。
表 2 响应面试验设计与结果Table 2. Response surface experimental design and results实验号 因素 总黄酮得率(mg/g) A B C 1 −1 −1 0 18.71 2 1 −1 0 24.05 3 −1 1 0 19.13 4 1 1 0 20.70 5 −1 0 −1 17.13 6 1 0 −1 21.64 7 −1 0 1 23.95 8 1 0 1 20.28 9 0 −1 −1 19.02 1 0 1 −1 18.18 11 0 −1 1 19.96 12 0 1 1 21.64 13 0 0 0 27.40 14 0 0 0 28.24 15 0 0 0 29.29 16 0 0 0 28.87 17 0 0 0 28.24 2.2.2 响应面回归模型方差分析
回归模型方差分析见表3,由表3可知,模型P<0.01,具有极显著的差异;失拟项P值为0.0984(P>0.05),不显著,表明模型的拟合度良好。该模型调整决定系数R2=0.9695,因此我们得知本实验可靠性高,能够分析和预测小二仙草总黄酮提取工艺实验。根据F值可知考察因素对响应值的影响主次顺序为超声时间(C)>乙醇体积分数(A)>料液比(B),其中一次项A和C的P值小于0.05,有显著性差异,交叉项AC具有极显著差异(P<0.01),其他交互作用影响均不显著,二次项A2、B2、C2均具有极显著性差异(P<0.01)。
表 3 回归模拟的方差分析Table 3. Analysis of variance for regression simulation方差来源 平方和 自由度 均方 F值 P值 显著性 模型 273.03 9 30.34 24.73 0.0002 ** A 7.51 1 7.51 6.12 0.0425 * B 0.55 1 0.55 0.45 0.5250 C 12.15 1 12.15 9.91 0.0163 * AB 3.55 1 3.55 2.90 0.1324 AC 16.73 1 16.73 13.64 0.0078 ** BC 1.59 1 1.59 1.29 0.2937 A2 47.40 1 47.40 38.64 0.0004 ** B2 81.71 1 81.71 66.61 <0.0001 ** C2 77.95 1 77.95 63.55 <0.0001 ** 残差 8.59 7 1.23 失拟项 6.52 3 2.17 4.21 0.0984 不显著 纯误差 2.06 4 0.52 综合 281.61 16 2.2.3 响应面试验交互作用分析
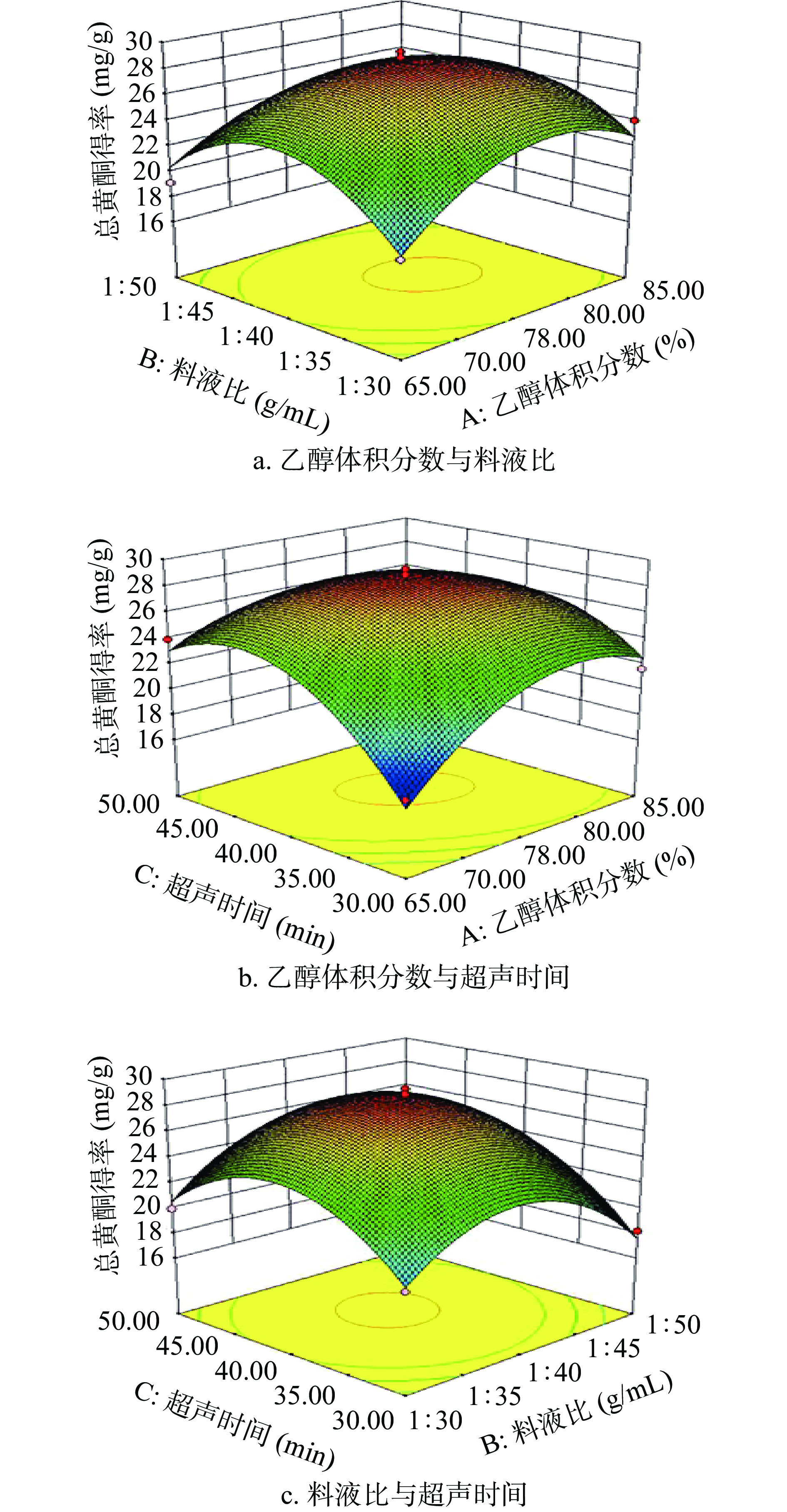
图5为Design-Expert 8.0.6软件绘制的乙醇体积分数、料液比和超声时间三个因素交互作用对小二仙草总黄酮得率的响应面图。由图可知,各因素对响应面的陡峭程度的影响为超声时间>乙醇体积分数>料液比,这说明超声时间对小二仙草总黄酮得率影响最大,其次是乙醇体积分数,料液比影响最小。乙醇体积分数与料液比及超声时间与料液比间的等高线稀疏,为圆形,因素之间的交互作用的响应值的影响不显著。乙醇体积分数与超声时间的等高线密集,为椭圆形,说明二者交互作用对响应值的影响明显,与方差分析结果相对应。
2.2.4 最佳提取工艺的确定与验证
根据方程和响应面图确定小二仙草总黄酮的最佳提取工艺为乙醇体积分数76.15% 、料液比1:39.66 g/mL、超声时间41.14 min,预测值为28.54 mg/g。根据实际情况对提取工艺进行调整,即乙醇体积分数76%、料液比1:40 g/mL、超声时间41 min,进行3次平行验证试验,最终得出小二仙草总黄酮的得率为28.61±0.05 mg/g,接近预测值,表明该响应面模型预测性较好,可用于小二仙草总黄酮的提取工艺。
2.3 小二仙草总黄酮抗氧化活性的测定
2.3.1 小二仙草总黄酮清除DPPH自由基的能力
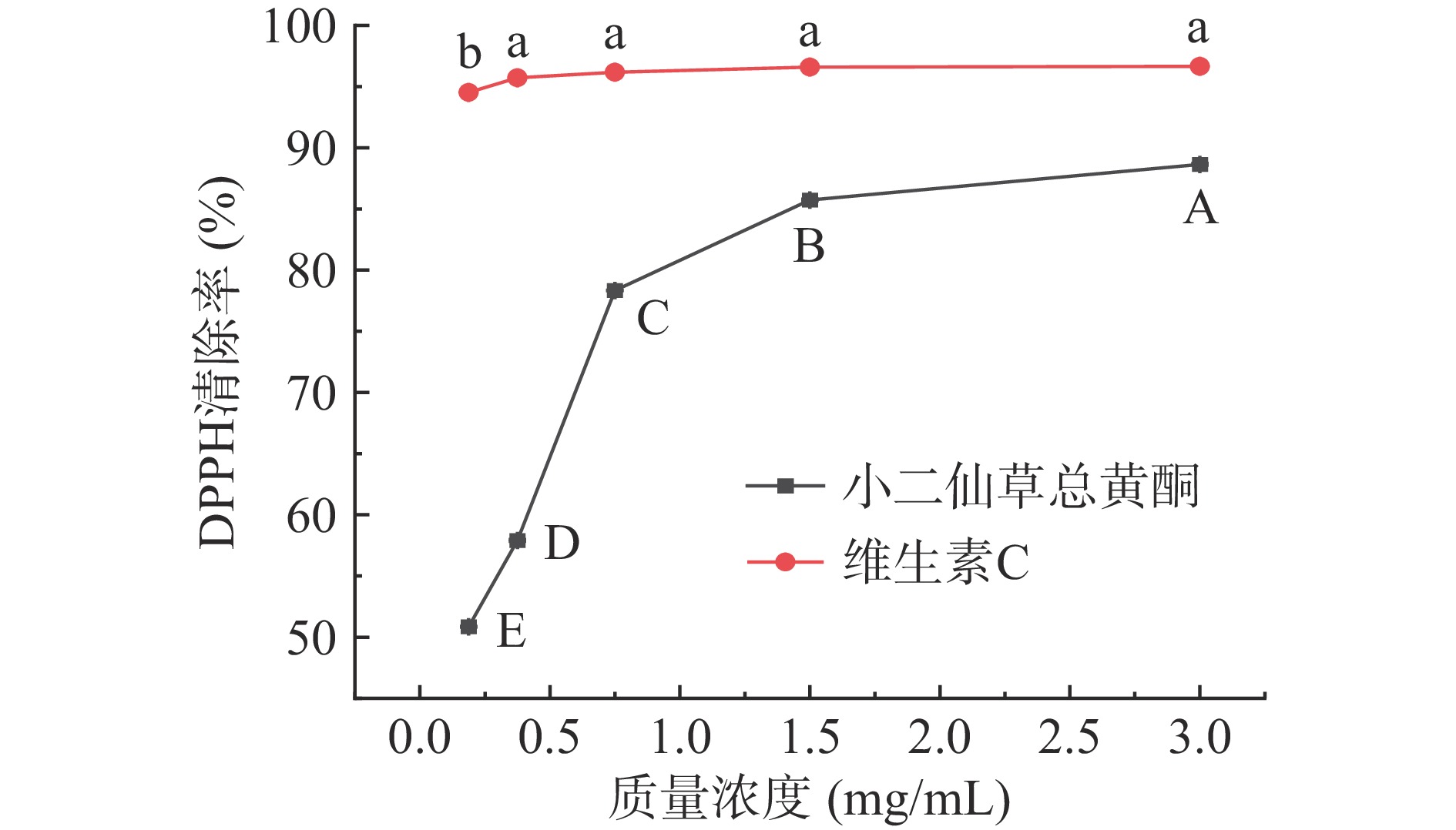
小二仙草总黄酮对DPPH自由基清除能力如图6所示,随着质量浓度的增加,小二仙草总黄酮和维生素C对DPPH自由基清除能力逐渐增强,在0.18~3 mg/mL质量浓度范围内,呈显著的剂量依赖关系。小二仙草总黄酮3 mg/mL清除DPPH自由基能力最强,此时清除率为88.65%,但清除能力低于维生素C。由此得出,小二仙草总黄酮具有一定的DPPH自由基清除能力,但效果低于维生素C。
2.3.2 小二仙草总黄酮清除ABTS+自由基的能力
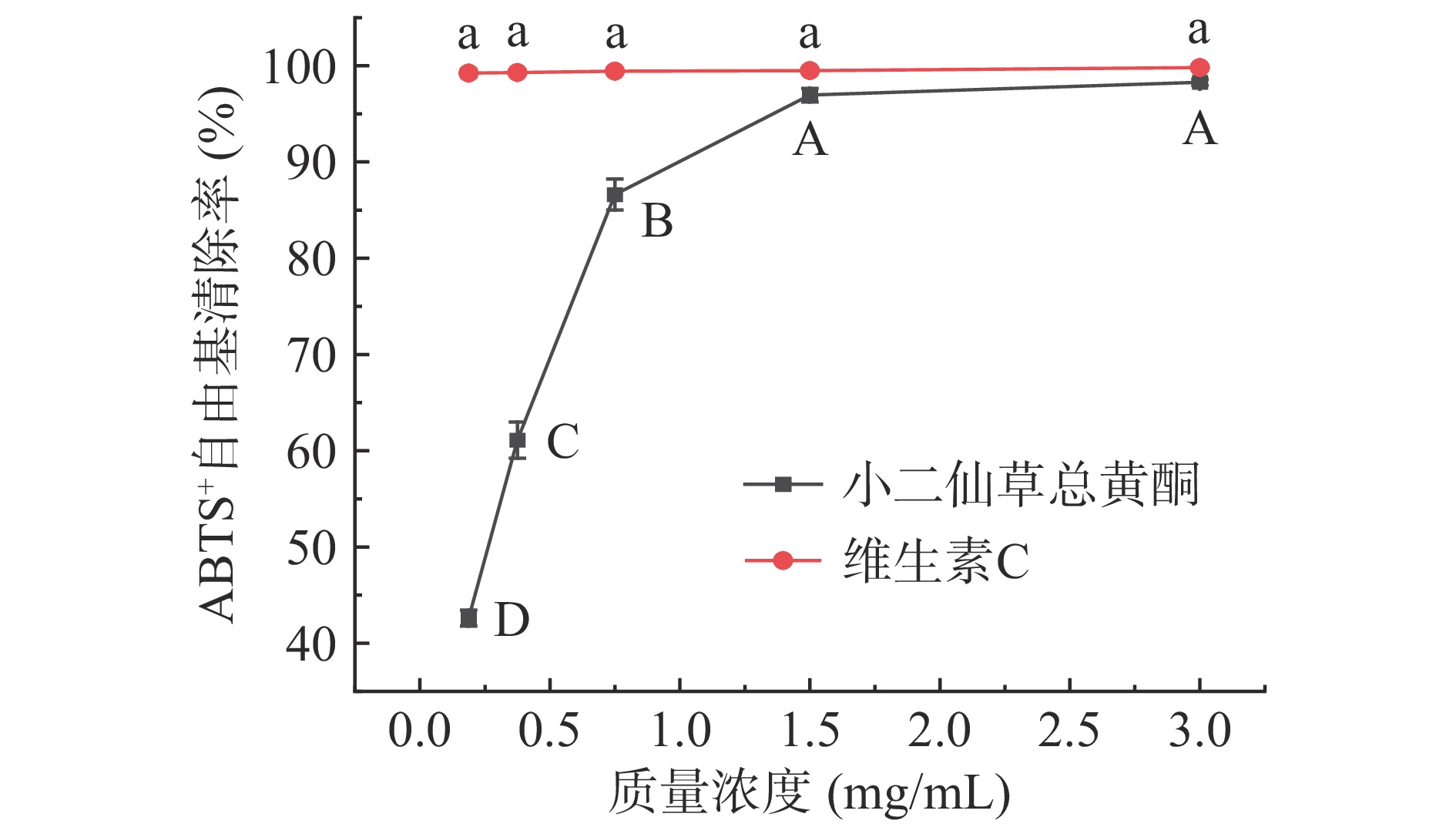
小二仙草总黄酮对ABTS+自由基清除能力如图7所示,小二仙草总黄酮和维生素C对ABTS+自由基清除能力逐渐增强,在0.18~3 mg/mL质量浓度范围内,呈显著的剂量依赖关系。当小二仙草总黄酮浓度为1.5 mg/mL时,其对ABTS+自由基清除能力逐渐接近维生素C;当小二仙草总黄酮浓度为3 mg/mL时,清除率达到98.28%,其对ABTS+自由基清除能力几乎与维生素C(清除率为99.81%)相当,表现了较好的ABTS+自由基清除能力。
2.3.3 小二仙草总黄酮的总还原力
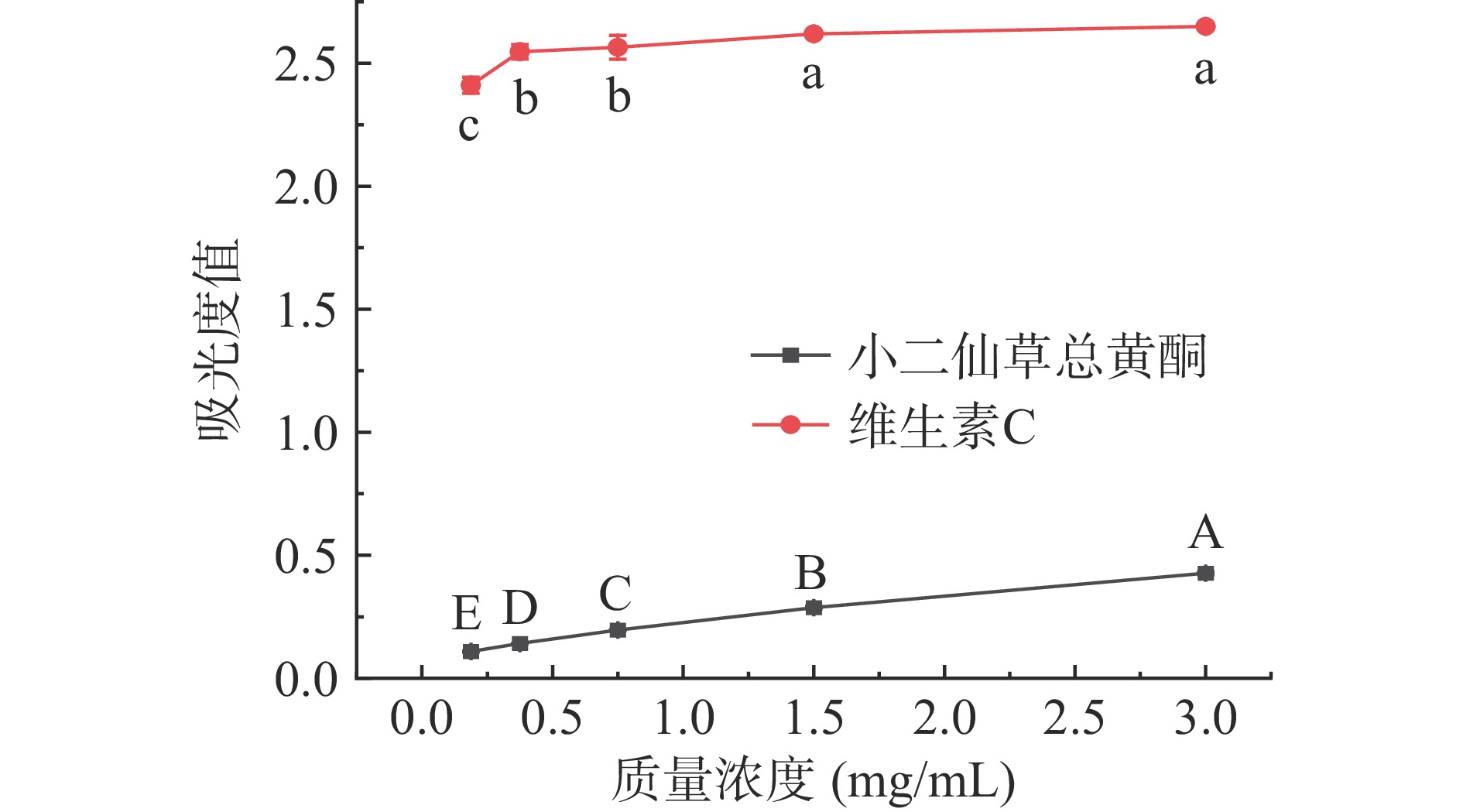
小二仙草总黄酮的总还原力如图8所示,小二仙草总黄酮具有一定的总还原力,且随着质量浓度的增加,总还原力逐渐增强。维生素C比小二仙草总黄酮的总还原力强,在质量浓度为0.18~3 mg/mL时,总还原力趋于稳定,总还原力均在2.5左右,由此得出小二仙草总黄酮具有一定的还原能力,但显著低于相同浓度的维生素C的还原能力。
3. 结论
由于响应曲面法在提取分离中药的有效成分领域应用广泛,因此选择响应曲面分析法优化小二仙草总黄酮的提取工艺参数,并进行抗氧化活性研究。响应面优化结果显示,小二仙草总黄酮的最佳提取工艺为乙醇体积分数76.15%、料液比1:40 g/mL、超声时间41 min,此时得率为28.61±0.05 mg/g,接近预测值,表明该响应面模型预测性较好,可用于小二仙草总黄酮的提取工艺。小二仙草总黄酮对DPPH和ABTS+自由基的清除能力在一定范围内呈递增趋势,具有剂量依赖性,且在质量浓度为1.5和3 mg/mL时,清除ABTS+自由基能力与维生素C效果相当。小二仙草总黄酮还具有较好的还原力,显示其抗氧化活性较好,可作为良好的天然抗氧化剂。本研究只对小二仙草总黄酮的提取工艺和抗氧化活性进行了初步研究,但对抗氧化的药效物质及机制尚未进行深入探究,后续实验可对小二仙草黄酮类化合物进行分离制备,并采用体内、体外药理活性实验探究小二仙草黄酮类化合物抗氧化活性物质基础及抗氧化的机理,为小二仙草的深度研究与开发利用提供理论依据。
-
表 1 响应面试验设计因素与水平
Table 1 Design factors and levels of response surface experiment
因素 水平 −1 0 1 A乙醇体积分数(%) 65 75 85 B料液比(g/mL) 1:30 1:40 1:50 C超声时间(min) 30 40 50 表 2 响应面试验设计与结果
Table 2 Response surface experimental design and results
实验号 因素 总黄酮得率(mg/g) A B C 1 −1 −1 0 18.71 2 1 −1 0 24.05 3 −1 1 0 19.13 4 1 1 0 20.70 5 −1 0 −1 17.13 6 1 0 −1 21.64 7 −1 0 1 23.95 8 1 0 1 20.28 9 0 −1 −1 19.02 1 0 1 −1 18.18 11 0 −1 1 19.96 12 0 1 1 21.64 13 0 0 0 27.40 14 0 0 0 28.24 15 0 0 0 29.29 16 0 0 0 28.87 17 0 0 0 28.24 表 3 回归模拟的方差分析
Table 3 Analysis of variance for regression simulation
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 273.03 9 30.34 24.73 0.0002 ** A 7.51 1 7.51 6.12 0.0425 * B 0.55 1 0.55 0.45 0.5250 C 12.15 1 12.15 9.91 0.0163 * AB 3.55 1 3.55 2.90 0.1324 AC 16.73 1 16.73 13.64 0.0078 ** BC 1.59 1 1.59 1.29 0.2937 A2 47.40 1 47.40 38.64 0.0004 ** B2 81.71 1 81.71 66.61 <0.0001 ** C2 77.95 1 77.95 63.55 <0.0001 ** 残差 8.59 7 1.23 失拟项 6.52 3 2.17 4.21 0.0984 不显著 纯误差 2.06 4 0.52 综合 281.61 16 -
[1] 国家中医药管理局《中华本草》编委会. 中华本草[M]. 第6版. 上海: 上海科学技术出版社, 1999 Chinese Herbalism Editorial Board, State Administration of Traditional Chinese Medicine of the People's Republic of China. Chinese Materia Medica[M]. 6th edition. Shanghai: Shanghai Scientific & Technical Publishers, 1999.
[2] 《广东中药志》编辑委员会编著. 广东中药志[M]. 广东: 广东科技出版社, 1996 Edited by the Editoeial Committee of Guangdong Journal of Traditional Chinese Medicine. Guangdong Journal of traditional Chinese Medicine[M]. Guangdong: Guangdong Science and Technology Press, 1996.
[3] 南京中医药大学编著. 中药大辞典[M]. 第2版. 上海: 上海科学技术出版社, 2006: 357−358 Edited by Nanjing University of Traditional Chinese Medicine. Dictionary of traditional Chinese Medicine[M]. 2nd edition. Shanghai: Shanghai Scientific & Technical Publishers, 2006: 357−358.
[4] CALIS Z, MOGULKOC R, BALTACI A K. The roles of flavonols/flavonoids in neurodegeneration and neuroinflammation[J]. Mini Reviews in Medicinal Chemistry,2020,20(15):1475−1488. doi: 10.2174/1389557519666190617150051
[5] YE H, LUO J, HU D, et al. Total flavonoids of Crocus sativus petals release tert-butyl hydroperoxide-induced oxidative stress in BRL-3A cells[J]. Oxidative Medicine and Cellular Longevity,2021:5453047.
[6] KANG L, SONG Y, FANG X, et al. Total flavonoids of Taraxacum mongolicum inhibit non-small cell lung cancer by regulating immune function[J]. Journal of Ethnopharmacology,2021,281:114514. doi: 10.1016/j.jep.2021.114514
[7] GOU S, HE M, LI B, et al. Hepatoprotective effect of total flavonoids from Glycyrrhiza uralensis Fisch in liver injury mice[J]. Natural Product Research,2021,35(24):6083−6087. doi: 10.1080/14786419.2020.1824223
[8] 王俊朋, 张立攀, 胡桂芳, 等. 牡丹花黄酮的提取及对α-淀粉酶的抑制作用[J]. 食品科技,2022,47(1):196−202. [WANG J P, ZHANG L P, HU G F, et al. Extraction and effect on inhibition of α-amylase of flavonoids from Peony Flower[J]. Food Science and Technology,2022,47(1):196−202. WANG J P, ZHANG L P, HU G F, et al. Extraction and effect on inhibition of α-amylase of flavonoids from Peony Flower[J]. Food Science and Technology, 2022, 47(1): 196-202.
[9] HOU M, HU W, XIU Z, et al. Efficient enrichment of total flavonoids from Pteris ensiformis Burm. extracts by macroporous adsorption resins and in vitro evaluation of antioxidant and antiproliferative activities[J]. Journal of Chromatography B,2020,1138:121960. doi: 10.1016/j.jchromb.2019.121960
[10] ZHAO K, CHEN M, LIU T, et al. Rhizoma drynariae total flavonoids inhibit the inflammatory response and matrix degeneration via MAPK pathway in a rat degenerative cervical intervertebral disc model[J]. Biomedicine & Pharmacotherapy,2021,138:111466.
[11] 雷永平. 刺玫果总黄酮的纯化工艺及保健食品的研究[D]. 吉林: 吉林化工学院, 2019 LEI Y P. Purification technology of total flavonoids from fruit of Rosa davurica pall. and research on function food[D]. Jilin: Jilin Institute of Chemical Technology, 2019.
[12] 林燕燕, 黄仲庆, 付达华, 等. 白凤菜总黄酮保健饮料的加工工艺优化及其品质评价[J]. 贵州农业科学,2017,45(11):126−129. [LIN Y Y, HUANG Z Q, FU D H, et al. Processing technology optimization and quality evaluation of Gynura formosana total flavonoids health beverage[J]. Guizhou Agricultural Sciences,2017,45(11):126−129. LIN Y Y, HUANG Z Q, FU D H, et al. Processing technology optimization and quality evaluation of Gynura formosana total flavonoids health beverage [J]. Guizhou Agricultural Sciences, 2017, 45(11): 126-129.
[13] 王莲婧. 化橘红抗氧化保健(功能)食品的研究[D]. 广州: 广州中医药大学, 2012 WANG L J. The study of antioxidant health (functional) foods from Exocarpium Citri Grandis[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2012.
[14] 贵晓霞. 小二仙草化学成分研究[D]. 杭州: 浙江工业大学, 2008 GUI X X. Study on chemical constituents of Haloragis micrantha (Thunb.) R. Brown[D]. Hangzhou: Zhejiang University of Technology, 2008.
[15] 魏婧, 韩朋春, 吴明月, 等. 响应面法优化爵床总黄酮的提取工艺及理化性质[J]. 食品工业科技,2023,44(3):240−247. [WEI Q, HAN P C, WU M Y, et al. Extraction optimization by response surface methodology and physicochemical properties of total flavonoids from Rostellularia procumbens (L.) Ness[J]. Science and Technology of Food Industry,2023,44(3):240−247. WEI Q, HAN P C, WU M Y, et al. Extraction optimization by response surface methodology and physicochemical properties of total flavonoids from Rostellularia procumbens (L. ) Ness[J]. Science and Technology of Food Industry, 2023, 44(3): 240-247.
[16] 李卓瓦, 袁晓芸, 赵鑫磊, 等. 超声波辅助提取石榴根皮多酚工艺优化及其抗氧化活性[J]. 食品工业科技,2019,40(1):136−142. [LI Z W, YUAN X Y, ZHAO X L, et al. Optimization of ultrasonic-assisted extraction of polyphenols from pomegranate root bark and its antioxidant capacity[J]. Science and Technology of Food Industry,2019,40(1):136−142. LI Z W, YUAN X Y, ZHAO X L, et al. Optimization of ultrasonic-assisted extraction of polyphenols from pomegranate root bark and its antioxidant capacity[J]. Science and Technology of Food Industry, 2019, 40(1): 136-142.
[17] 李颖, 侯诗, 廖婉婷, 等. 响应面法优化黄晶果果皮总黄酮提取工艺及抗氧化活性[J]. 食品科技,2022,47(7):175−181. [LI Y, HOU S, MIAO W T, et al. Optimization of extraction process by response surface methodology and antioxidant activity of total flavonoids from Abiu. peels[J]. Food Science and Technology,2022,47(7):175−181. LI Y, HOU S, MIAO W T, et al. Optimization of extraction process by response surface methodology and antioxidant activity of total flavonoids from Abiu. peels[J]. Food Science and Technology, 2022, 47(7): 175-181.
[18] 鲁宪坤, 翟鑫源, 李方红, 等. 补骨脂总黄酮提取工艺的优化[J]. 中成药,2022,44(1):193−197. [LU X K, HUO X Y, LI F H, et al. Optimization of extraction process of total flavonoids from Psoralea corylifolia[J]. Chinese Traditional Patent Medicine,2022,44(1):193−197. LU X K, HUO X Y, LI F H, et al. Optimization of extraction process of total flavonoids from Psoralea corylifolia[J]. Chinese Traditional Patent Medicine, 2022, 44(1): 193-197.
[19] 关奎奎, 汪露, 李聪聪, 等. 马蹄黄总黄酮、总酚酸提取工艺优化及其抗氧化、抗菌活性研究[J]. 中成药,2022,44(1):6−12. [GUAN K K, WANG L, LI C C, et al. Optimization of extraction process for total flavonoids and total phenolic acids from Spenceria ramalana and their anti-oxidant, anti-bacterial activities[J]. Chinese Traditional Patent Medicine,2022,44(1):6−12. GUAN K K, WANG L, LI C C, et al. Optimization of extraction process for total flavonoids and total phenolic acids from Spenceria ramalana and their anti-oxidant, anti-bacterial activities[J]. Chinese Traditional Patent Medicine, 2022, 44(1): 6-12.
[20] 杨永涛. 罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D]. 广州: 华南理工大学, 2018 YANG Y T. Study on extraction, purification and antioxidant activity of total flavonoids from Apocynum venetum[D]. Guangzhou: South China University of Technology, 2008.
[21] 赵晋彤, 贾莹莹, 李苏苏, 等. 绵马贯众总多酚超声提取工艺的优化及其抗氧化活性[J]. 中成药,2018,40(3):729−732. [ZHAO J T, JIA Y Y, LI S S, et al. Optimization of ultrasonic extraction process and antioxidant activity of total polyphenols from Hypericum perforatum[J]. Chinese Traditional Patent Medicine,2018,40(3):729−732. ZHAO J T, JIA Y Y, LI S S, et al. Optimization of ultrasonic extraction process and antioxidant activity of total polyphenols from Hypericum perforatum[J]. Chinese Traditional Patent Medicine, 2018, 40(3): 729-732.
[22] 刘晓梅, 李沛霞, 甘蓝湘, 等. 川麦冬须根总黄酮和总皂苷提取和富集工艺研究[J]. 天然产物研究与开发,2020,32(8):1285−1294. [LI X M, LI P X, GAN L X, et al. Optimization on extraction and enrichment technology of total flavonoids and total spaonins from fibrous roots of Ophiopogon japonicas[J]. Natural Product Research and Development,2020,32(8):1285−1294. LI X M, LI P X, GAN L X, et al. Optimization on extraction and enrichment technology of total flavonoids and total spaonins from fibrous roots of Ophiopogon japonicas[J]. Natural Product Research and Development, 2020, 32(8): 1285-1294.
[23] 黄东滨, 李珊, 秦高燕, 等. 百色红茶总黄酮提取工艺优化及理化性质研究[J]. 食品科技,2021,46(11):210−217. [HUANG D B, LI S, QIN G Y, et al. Optimizing extraction and physicochemical properties of total flavonoid in Baise black tea[J]. Food Science and Technology,2021,46(11):210−217. HUANG D B, LI S, QIN G Y, et al. Optimizing extraction and physicochemical properties of total flavonoid in Baise black tea[J]. Food Science and Technology, 2021, 46(11): 210-217.
[24] 王敏, 徐国辉, 赵一灵, 等. 黄蜀葵花总黄酮提取工艺优化及其对黄嘌呤氧化酶的抑制作用[J]. 食品工业科技,2022,43(12):223−230. [WANG M, XU G H, ZHAO Y L, et al. Optimization of extraction process for total flavonoids from Abelmoschus manihot and its inhibitory effect on xanthine oxidase[J]. Science and Technology of Food Industry,2022,43(12):223−230. WANG M, XU G H, ZHAO Y L, et al. Optimization of extraction process for total flavonoids from Abelmoschus manihot and its inhibitory effect on Xanthine Oxidase[J]. Science and Technology of Food Industry, 2022, 43(12): 223-230.
[25] 金伟嘉, 卢利平, 刘晓莹, 等. 花椒叶黄酮的提取工艺优化及其抗氧化活性检测[J]. 浙江农业科学,2022,63(2):345−351,422. [JIN J W, LU L P, LIU X Y, et al. Optimization of extraction process of flavonoids from Zanthoxylum bungeanum leaves and its antioxidant activity[J]. Acta Agriculturae Zhejiangensis,2022,63(2):345−351,422. JIN J W, LU L P, LIU X Y, et al. Optimization of extraction process of flavonoids from Zanthoxylum bungeanum leaves and its antioxidant activity [J]. Acta Agriculturae Zhejiangensis, 2022, 63(2): 345-351, 422.
[26] 李国峰, 陈海芳, 郎一帆, 等. 诃子总黄酮提取工艺的优化及其体外生物活性研究[J]. 中成药,2021,43(11):2945−2951. [LI G F, CHEN H F, LANG Y F, et al. Extraction process optimization and in vitro biological activities of total flavonoids from Terminalia chebula[J]. Chinese Traditional Patent Medicine,2021,43(11):2945−2951. LI G F, CHEN H F, LANG Y F, et al. Extraction process optimization and in vitro biological activities of total flavonoids from Terminalia chebula[J]. Chinese Traditional Patent Medicine, 2021, 43(11): 2945-2951.
-
期刊类型引用(17)
1. 杨菁,刘顶鼎,陈滕,刘静,麻秀萍,汪祖华. 粉条儿菜总黄酮提取工艺优化及抗氧化、抗炎活性分析. 食品工业科技. 2024(02): 192-200 .  本站查看
本站查看
2. 刘静,刘继华,叶朋飞,李秋达,张春艳,黄慧福. 罗平小黄姜总黄酮提取工艺的优化及抗氧化活性研究. 食品工业. 2024(02): 64-68 .  百度学术
百度学术
3. 龚受基,覃媚,戴梓茹,蒋红明,郭德军. 响应面法优化相思藤黄酮提取工艺及其体外抗氧化活性分析. 食品工业科技. 2024(06): 178-185 .  本站查看
本站查看
4. 李俊,杜文娟,高天慧,崔蕾,何俊婷. 葫芦七总黄酮超声辅助提取工艺优化. 中成药. 2024(04): 1319-1322 .  百度学术
百度学术
5. 王俊龙,蔺永刚,陈凤霞,时文盼,陈禹. 弯萼金丝桃总黄酮提取及抗氧化、降糖活性. 精细化工. 2024(05): 1050-1059+1083 .  百度学术
百度学术
6. 张露,程鑫鹏,邓梅,陈明舜,周祺溟,彭春彦,谢作桦,涂宗财. 丹皮乙醇提取物的抗氧化和抗糖尿病活性研究. 天然产物研究与开发. 2024(05): 762-770 .  百度学术
百度学术
7. 杜国军,李占锋,洪婉婷,张以超,蔡有杰. 黄芪、枸杞、沙果果醋的研制及其抗氧化活性研究. 中国调味品. 2024(06): 131-134 .  百度学术
百度学术
8. 胡宁宁,陈明,侯大富,李俊峰,贺轶洁,康冰. 陕西省1个新记录属和4种新记录植物. 西北植物学报. 2024(07): 1169-1174 .  百度学术
百度学术
9. 单红芳,李宏,高路,马剑. 仙人掌总黄酮提取工艺的优化. 中国中医药科技. 2024(04): 617-622 .  百度学术
百度学术
10. 周希,蒋屿,袁叶飞. 脱油油樟叶总酚提取纯化工艺优化及体外抗氧化研究. 中国现代应用药学. 2024(11): 1499-1507 .  百度学术
百度学术
11. 祝荣涛,梁志彬,王日华,郭智健,黄梓芸,成燕琴. 煮制加工对红豆中总黄酮含量的影响及抗氧化活性研究. 广州化工. 2024(16): 29-31+89 .  百度学术
百度学术
12. 陈智刚,杜缘园,罗兆飞,林华娟,王宇峰,王剑锋,蔡翔宇. 分光光度法测定仙草胶粉中黄酮含量——重复性与准确度的研究. 南方农机. 2024(20): 81-84 .  百度学术
百度学术
13. 排合尔丁·穆太力甫,木艾塔尔·努尔麦麦提,艾尼娃尔·艾克木,田树革. 响应面法优化圆苞车前子多酚与总黄酮超声提取工艺及其抗氧化活性分析. 湖南中医药大学学报. 2024(10): 1801-1809 .  百度学术
百度学术
14. 时文盼,郭嘉欣,蔺永刚,柴雨阳,郭玉锦,武斌,王俊龙. 弯萼金丝桃总多酚提取工艺优化及抗氧化、降糖活性研究. 食品与发酵工业. 2024(21): 206-215 .  百度学术
百度学术
15. 郭丽丽,高欣缘,谷兆怡,李小兰,王小敏,秦楠. 黄芪茎叶总黄酮脂质体的制备及其理化性质分析. 食品科技. 2024(10): 284-292 .  百度学术
百度学术
16. 段文亚,吴静,颜玉锜,田雅馨,毛鸿仪,陈银芝,杨艳. 响应面法优化赶黄草茎、叶总黄酮加热回流提取工艺及其抗氧化性研究. 现代食品. 2024(23): 55-62 .  百度学术
百度学术
17. 贺诗茹,王茜,阿依努尔·白克热,刘梦文,沈静,李文宇,肖辉. 新疆桑葚总黄酮含量与其抗氧化活性的研究. 陕西农业科学. 2023(09): 13-21+74 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:


 下载:
下载:



