Process Optimization and Characteristic Analysis of Sea Buckthorn Juice Deacidification by Compound Lactic Acid Bacteria Fermentation
-
摘要: 为了研究复合乳酸菌发酵对沙棘汁降酸效果的影响,以酒酒球菌和短乳杆菌为菌株发酵沙棘汁。以总酸降解率为指标,通过单因素实验和响应面试验优化沙棘汁发酵降酸工艺,并研究发酵过程中黄酮、多酚、总酸、pH、总可溶性固形物(TSS)、还原糖、有机酸以及抗氧化活性的变化。结果表明:复合乳酸菌发酵的最优工艺条件为酒酒球菌:短乳杆菌比例为1:1、初始pH3.7、发酵温度31 ℃、发酵时间18 h、接种量5%,在该条件下总酸降解率为38.52%,此时,黄酮、多酚、总酸、pH和TSS含量与发酵前相比,均具有显著性差异(P<0.05)。沙棘发酵液中黄酮、多酚含量比发酵前分别增加了44.74%和22.22%,pH由3.71升高至3.85,总酸含量由8.49 g/L下降至5.22 g/L,TSS含量下降了20.29%,还原糖含量无显著变化(P>0.05)。发酵液中苹果酸含量显著下降(P<0.05),降解率为94.59%,乳酸含量显著增加(P<0.05),达到10.37 mg/mL,奎宁酸、抗坏血酸、酒石酸、草酸和柠檬酸的变化不显著(P>0.05)。沙棘汁经复合乳酸菌发酵后,对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率及铁离子还原能力最大值分别达到78.20%、64.48%和1.1626 mmol/L。因此,复合乳酸菌发酵沙棘汁能有效降低其酸度,提高其品质和抗氧化活性,为沙棘汁的降酸工艺和相关产品的开发提供了理论依据。Abstract: In order to study the effect of compound lactic acid bacteria fermentation on reducing acid of sea buckthorn juice, the Oenococcus oeni and Lactobacillus brevis were used to ferment sea buckthorn juice. With the total acid degradation rate as the index, the fermentation process of sea buckthorn juice was optimized by single factor experiment and response surface experiment, and the changes of flavonoids, polyphenols, total acid, pH, total soluble solids (TSS), reducing sugar, organic acid and antioxidant activity during fermentation were studied. The results showed that the optimal fermentation conditions were as follows: The ratio of Oenococcus oeni to Lactobacillus brevis was 1:1, the initial pH was 3.7, fermentation temperature was 31 ℃, fermentation time was 18 h, inoculation amount was 5%. Under these conditions, the total acid degradation rate reached 38.52%. At this time, the contents of flavonoids, polyphenols, total acid, pH and TSS were significantly different from those before fermentation (P<0.05). The contents of flavonoids and polyphenols in sea buckthorn fermentation broth increased by 44.74% and 22.22%, respectively, compared with those before fermentation. The pH increased from 3.71 to 3.85, the total acid content decreased from 8.49 g/L to 5.22 g/L, the TSS content decreased by 20.29%, and the reducing sugar content did not change significantly (P>0.05). The content of malic acid in fermentation broth decreased significantly (P<0.05), the degradation rate was 94.59%, and the content of lactic acid increased significantly (P<0.05), reached 10.37 mg/mL. The changes of quinic acid, ascorbic acid, tartaric acid, oxalic acid and citric acid were not significant (P>0.05). The maximum values of DPPH and ABTS+ free radical scavenging rate and ferric reducing antioxidant power (FRAP) of sea buckthorn juice after lactic acid fermentation reached 78.20%, 64.48% and 1.1626 mmol/L, respectively. Therefore, the sea buckthorn juice fermented by compound lactic acid bacteria could effectively reduce its acidity and improve its quality and antioxidant activity, which would provide a theoretical basis for the development of acid-reducing technology and related products.
-
沙棘是一种药食同源植物,属胡颓子科,所结浆果呈橙色或红色,因其富含抗坏血酸、多酚、类胡萝卜素和类黄酮等生物活性物质而备受关注[1]。另外,沙棘是公认的抗氧化活性非常高的浆果,已有研究证明沙棘果汁的氧自由基吸收能力可达111.57 μmol TE/mL,分别是蓝莓汁、柠檬汁和柑橘汁的2.82、15.96和60.97倍[2]。然而,高含量的苹果酸使沙棘果具有强烈的酸味,这对其在食品工业中的应用构成了障碍。最近的研究表明,乳酸菌在改善产品风味或提高保质期方面有着巨大的发展前景。例如,李维妮等[3]以嗜酸乳杆菌、嗜热链球菌、乳双歧杆菌和副干酪乳杆菌发酵苹果汁,在菌株比例1:1:1:1、接种量2%、发酵温度37 ℃、发酵时间24 h的条件下处理苹果汁,苹果酸含量为1574.36 mg/L,较发酵前下降了46.06%,且风味物质更加丰富。张晟等[4]使用酒酒球菌6066对北五味子汁进行发酵,在初始pH3.4、接种量7%、发酵温度24 ℃、发酵时间8 d的条件下处理北五味子汁,发酵后苹果酸含量降低了59.00%,DPPH、ABTS+自由基清除率和还原力分别是发酵前的1.22、1.10和1.444倍。由此可见,乳酸菌发酵果汁具有使产品风味和香气复杂性增强、酸性降低的优点[5]。沙棘具有强烈的酸性和收敛性,因此,乳酸菌发酵也是提升沙棘汁感官品质的一个潜在方法。
已有研究证实复合菌种发酵不仅可使产品品质提升,而且复合菌株发酵体系中自由基清除效果要优于单一菌株发酵[6]。目前,尚未有采用酒酒球菌与短乳杆菌复合使用对沙棘汁降酸的报道。本研究以酒酒球菌与短乳杆菌为复合菌种,通过单因素实验和响应面法优化其对沙棘汁的降解工艺,并对发酵沙棘汁的理化指标与抗氧化活性进行分析,以期为拓宽沙棘汁的商业用途提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
沙棘果 购于黑龙江省孙吴县宝江大果沙棘展销中心;酒酒球菌SP-2T(Oeniococcus oeni SP-2T)、短乳杆菌(Lactobacillus brevis) 黑龙江八一农垦大学微生物实验室保藏;芦丁、没食子酸标准品 上海麦克林生化科技有限公司;酒石酸钾钠、3,5-二硝基水杨酸、NaOH、苯酚、无水亚硫酸钠、葡萄糖、无水乙醇、NaNO2、Al(NO3)3、K2S2O4、乙酸钠、冰醋酸、浓盐酸、FeCl3·6H2O、FeSO4、福林酚试剂、碳酸氢钠 天津大茂化学试剂厂;MRS培养基、Na2CO3、蛋白胨、酵母膏、MnSO4·H2O、MgSO4·7H2O、L-盐酸半胱氨酸 北京奥博星生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、三吡啶基三嗪(TPTZ) 分析纯,梯希爱(上海)化成工业发展有限公司;甲醇、磷酸二氢钾、磷酸 色谱纯,天津大茂化学试剂厂;草酸、抗坏血酸、乳酸、奎宁酸、苹果酸、柠檬酸、酒石酸标准品 美国Sigma公司。
980力邦全自动破壁料理机 宁波禾高电子科技有限公司;AHP9052电热恒温培养箱 上海澳程检测仪器有限公司;高压灭菌器 西班牙SELECTA;EX324型电子天平 奥豪斯仪器(上海)有限公司;TD4C台式低速离心机 盐城市凯特实验仪器有限公司;752N紫外可见分光光度计 上海仪电(集团)有限公司;SW-CJ-2F超净工作台 常州恩培仪器制造有限公司;HWS电热恒温水浴锅 上海一恒科技有限公司;PHS-25型pH计 上海仪电科学仪器股份有限公司;2WAJ型单目阿贝折光仪 上海申光仪器仪表有限公司;1260 Infinity高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 复合乳酸菌发酵沙棘汁工艺流程与操作要点
1.2.1.1 工艺流程
1.2.1.2 操作要点
打浆:取解冻后的沙棘果与蒸馏水按照5:2(W:V)的比例进行打浆。
调pH:用1 mol/L的NaHCO3调pH。
杀菌:置于85 ℃的水浴中杀菌40 min。
菌种活化:ATB培养基参照参考文献[7]制备。将适量酒酒球菌冻干粉接种到ATB液体培养基中,31 ℃培养2 d,将所得菌液离心(4000 r/min、10 min),收集菌泥,蒸馏水悬重,使细胞浓度为1×109 CFU/mL;取短乳杆菌冻干粉放入已经灭菌后的MRS培养基中溶解均匀,放入37 ℃培养基中培养24 h,用蒸馏水悬重,使细胞浓度为1×109 CFU/mL。
接种:冷却后的沙棘汁,按照一定的比例接入酒酒球菌与短乳杆菌种子液进行发酵。
发酵:接种后的样品,置于设定的恒温培养箱中发酵一定时间后取出,留样置于−80 ℃冻存,备用。
1.2.2 乳酸菌株接种液比例确定
沙棘汁经杀菌后,分别接入酒酒球菌:短乳杆菌为1:0、2:1、1:1、1:2和0:1比例的混合菌,接种量为7%,于31 ℃恒温培养箱中发酵,每6 h取样,通过比较总酸降解率确定其最佳混菌比例。
1.2.3 单因素实验
1.2.3.1 初始pH对沙棘汁总酸降解率的影响
以发酵温度31 ℃,发酵时间18 h,接种量7%,初始pH分别为3.2、3.4、3.6、3.8、4.0的条件下进行复合乳酸菌发酵,确定其优选初始pH。
1.2.3.2 发酵温度对沙棘汁总酸降解率的影响
以初始pH3.4,发酵时间18 h,接种量7%,发酵温度分别为25、28、31、34、37 ℃的条件下进行复合乳酸菌发酵,确定其优选发酵温度。
1.2.3.3 发酵时间对沙棘汁总酸降解率的影响
以初始pH3.4,发酵温度31 ℃,接种量7%,发酵时间分别为6、12、18、24、30 h的条件下进行复合乳酸菌发酵,确定其优选发酵时间。
1.2.3.4 接种量对沙棘汁总酸降解率的影响
以初始pH3.4,发酵温度31 ℃,发酵时间18 h,接种量分别为1%、3%、5%、7%、9%的条件下进行复合乳酸菌发酵,确定其优选接种量。
1.2.4 响应面优化复合乳酸菌降酸工艺
以初始pH(A)、发酵温度(B)、发酵时间(C)、接种量(D)为因素,总酸降解率为响应值,优化复合乳酸菌降酸的工艺参数,因素与水平编码表见表1。
表 1 Box-Behnken试验设计因素及水平Table 1. Factors and levels used in Box-Behnken design水平 A初始pH B发酵温度(℃) C发酵时间(h) D接种量(%) −1 3.4 28 12 3 0 3.6 31 18 5 1 3.8 34 24 7 1.2.5 总酸降解率的测定
采用张晟等[4]的方法测定总酸降解率。按式(1)计算总酸降解率。
总酸降解率(%)=m1−m2m1×100 (1) 式中:m1表示未经发酵的沙棘汁总酸含量,g/L;m2表示发酵后沙棘汁总酸含量,g/L。
1.2.6 黄酮含量的测定
采用NaNO2-Al(NO3)3比色法测定沙棘发酵汁黄酮含量[8]。以浓度为横坐标、吸光度为纵坐标绘制标准曲线,回归方程为:y=0.4595x−0.0084(R2=0.9968)。
1.2.7 多酚含量的测定
采用Folin-ciocalteu法测定沙棘发酵汁多酚含量[8]。以浓度为横坐标、吸光度为纵坐标绘制标准曲线,回归方程为:y=8.8017x+0.0059(R2=0.9993)。
1.2.8 总酸含量的测定
参照国标GB/T 12456-2021食品安全国家标准 食品中总酸的测定中pH计电位滴定法,总酸含量以苹果酸计。
1.2.9 pH测定
pH计直接测定。
1.2.10 TSS的测定
阿贝折射仪法测定。
1.2.11 还原糖含量的测定
采用3,5-二硝基水杨酸比色法测定[9]。以浓度为横坐标、吸光度为纵坐标绘制标准曲线,回归方程为:y=0.7117x−0.0472(R2=0.9993)。
1.2.12 有机酸含量的测定
参考樊秋元等[10]的方法,略作修改。HPLC条件如下:色谱柱:VP-ODS柱(150 mm×4.6 mm I,d,5 μm);流动相为20 mmol/L KH2PO4溶液(pH2.8);流速为0.8 mL/min;柱温30 ℃;进样量20 μL;等度洗脱10 min,并在210 nm处使用紫外检测器进行监测。
标准溶液配制:分别配制奎宁酸、苹果酸、柠檬酸、乳酸、抗坏血酸、草酸、酒石酸等浓度为4、4、3、3、1、1、1 mg/mL的母液,根据需要稀释到不同浓度,用0.45 μm微孔滤膜过滤后分别进样。在分析前,将不同沙棘汁样品稀释10倍,并通过0.45 μm尼龙微滤器过滤。所测有机酸标准曲线见表2。
表 2 有机酸标准曲线Table 2. Organic acid standard curve有机酸 回归方程 相关系数 线性范围(mg/L) 苹果酸 y=1337.8x+23.25 1.0000 10~4000 奎宁酸 y=1065.9x−11.21 0.9999 6~4000 乳酸 y=951.28x−29.87 0.9995 4~3000 柠檬酸 y=1783.9x+2.73 1.0000 25~3000 抗坏血酸 y=11731x+32.82 0.9999 2~1000 草酸 y=18749x−61.272 0.9993 2~1000 酒石酸 y=3191.7x+28.73 0.9990 1~1000 1.2.13 DPPH自由基清除能力测定
采用张琪等[11]的方法,略有改动。吸取2 mL沙棘稀释液于比色管中,加入0.5 mL的0.5 mmol/L DPPH乙醇溶液混合均匀,暗处37 ℃反应20 min后,在517 nm处测样品吸光值A1。用相应体积的无水乙醇分别代替DPPH乙醇溶液与样液,重复上述操作,分别测定对照组A2和空白组A0的吸光度值,并按式(2)计算清除率。
DPPH自由基清除率(%)=A0−(A1−A2)A0×100 (2) 式中:A1=2 mL样液+0.5 mL DPPH;A2=2 mL样液+0.5 mL无水乙醇;A0=2 mL无水乙醇+0.5 mL DPPH。
1.2.14 ABTS+自由基清除能力测定
采用张璇[12]的方法,略有改动。吸取0.4 mL沙棘稀释液于比色管中,加入3.6 mL的ABTS+工作液混合均匀,暗处室温反应20 min后,在734 nm处测样品吸光值A1。用相应体积的蒸馏水分别代替ABTS+工作液与样液,重复上述操作,分别测定对照组A2和空白组A0的吸光度值,并按式(3)计算清除率。
ABTS+自由基清除率(%)=A0−(A1−A2)A0×100 (3) 式中:A1=0.4 mL样液+3.6 mL ABTS工作液;A2=0.4 mL样液+3.6 mL蒸馏水;A0=0.4 mL蒸馏水+3.6 mL ABTS工作液。
1.2.15 铁离子还原能力(FRAP)的测定
参照倪俊等[13]的方法将配置好的醋酸缓冲液、TPTZ溶液、FeCl3溶液按照体积比10:1:1混合得到FRAP溶液。分别取0.5 mL不同浓度的FeSO4溶液与3 mL FRAP溶液充分混合,37 ℃下反应30 min,在593 nm下测定吸光值。以浓度为横坐标、吸光度为纵坐标绘制标准曲线,得回归方程为:y=0.0011x+0.114(R2=0.9972)。
1.3 数据处理
所有试验重复三次,结果采用表示,使用Origin 8.6、Design-Expert V8.0.6和SPSS 26.0软件进行数据处理与分析,以及图表制作。
2. 结果与分析
2.1 不同乳酸菌比例对沙棘汁总酸降解率的影响
通过沙棘汁的总酸降解率来评价其发酵能力和质量,由表3可知,酒酒球菌与短乳杆菌复合菌种发酵,可使沙棘汁总酸含量降低。在沙棘汁发酵中,酒酒球菌与短乳杆菌比例为1:0时的总酸降解率低于0:1,表明在沙棘汁降酸实验中,短乳杆菌的降酸效果要优于酒酒球菌,这可能由于初始pH过低抑制了酒酒球菌生长[5]。复合菌种发酵时,在酒酒球菌∶短乳杆菌比例为1:1、1:2、2:1的条件下,总酸降解率都要优于酒酒球菌或短乳杆菌单独发酵,表明两种乳酸菌是可以协同发酵的。另外,混菌发酵可使果汁口感更加柔和,并有明显香味物质生成[14]。当菌株比例1:1时,沙棘发酵汁总酸含量与其他比例复合菌之间无显著差异(P>0.05),且更易于操作,因此,选择酒酒球菌:短乳杆菌比例1:1作为沙棘汁后续发酵接种用菌株比例。
表 3 乳酸菌配比对沙棘汁总酸降解率的影响Table 3. Effect of lactobacillus ratio on total acid degradation rate of sea buckthorn juice乳酸菌
配比总酸降解率(%) 6 h 12 h 18 h 24 h 30 h 1:0 11.57±0.08a 16.98±0.55b 25.42±0.84d 22.56±0.27c 21.75±1.12c 2:1 13.31±1.83a 23.73±1.26b 28.51±0.15c 28.05±0.35c 27.95±0.50c 1:1 12.81±1.12a 23.04±0.98b 29.70±0.28d 28.30±0.43cd 27.34±0.21c 1:2 12.31±1.12a 23.14±1.12b 28.90±0.01c 28.35±0.21c 28.65±0.21c 0:1 13.21±1.12a 22.24±1.26b 27.31±1.54c 27.21±0.56c 26.40±0.69c 注:同行字母不同表示差异显著(P<0.05);表6~表8同。 2.2 初始pH对沙棘汁总酸降解率的影响
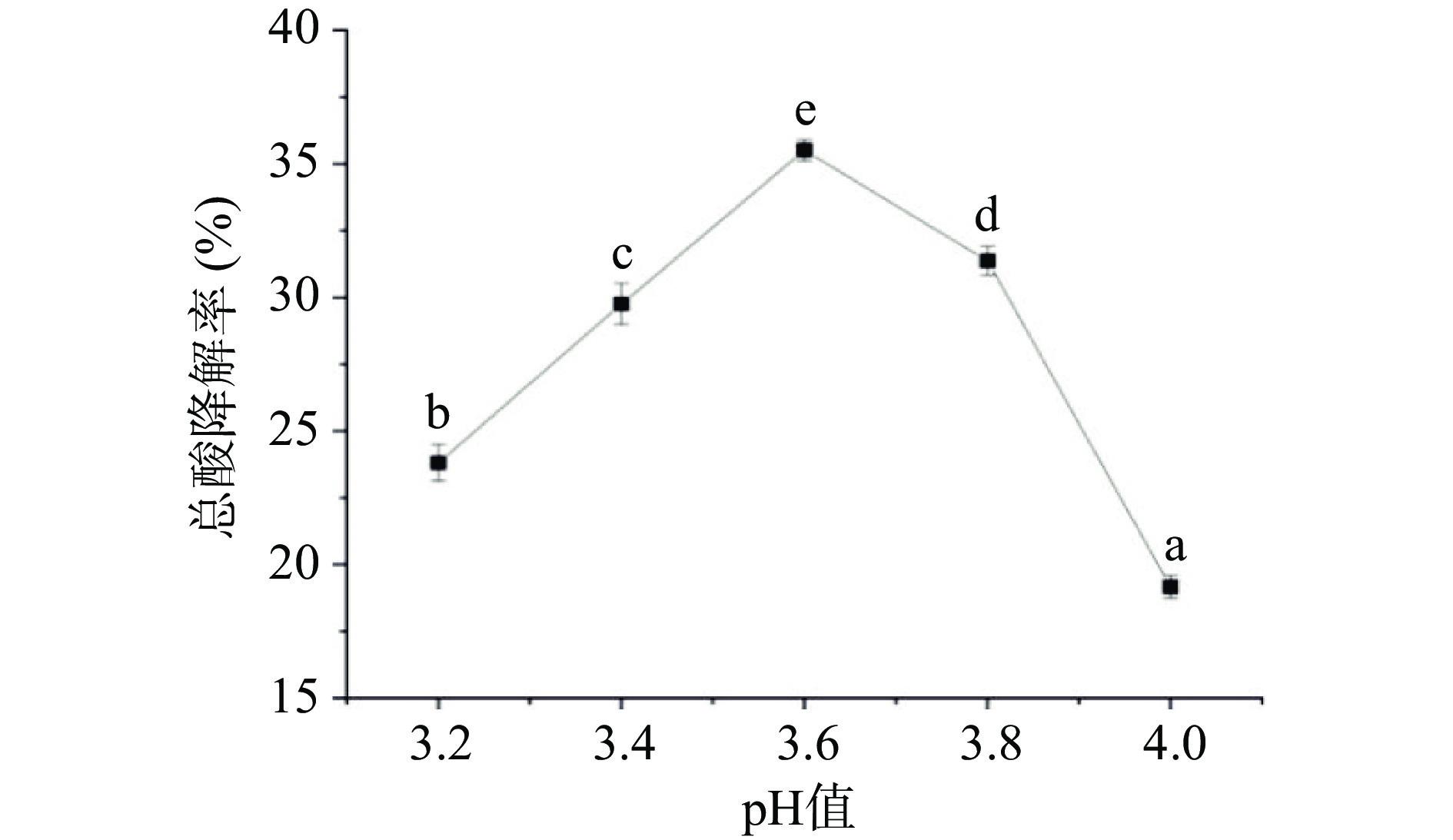
由图1可知,沙棘汁总酸降解率在初始pH3.2~3.6时呈上升趋势,在pH3.6时发生显著增高(P<0.05),达到最大值35.51%,说明pH为3.6时最适宜这两种乳酸菌的生长,而较低的初始pH使总酸降解率下降,这可能是因为低pH会使乳酸菌细胞内环境和蛋白质结构发生变化,从而抑制了乳酸菌生长和代谢[15]。沙棘汁总酸降解率在初始pH大于3.6时呈下降趋势,这可能是由于过高的pH对苹果酸-乳酸酶等关键酶的合成起不到诱导作用[16],使得总酸降解率下降。这一规律与韩诚武等[17]在实验中明确的苹果酸降解率随初始pH的增加先上升后下降的研究结果一致。因此,优选初始pH为3.6进行响应面试验。
2.3 发酵温度对沙棘汁总酸降解率的影响
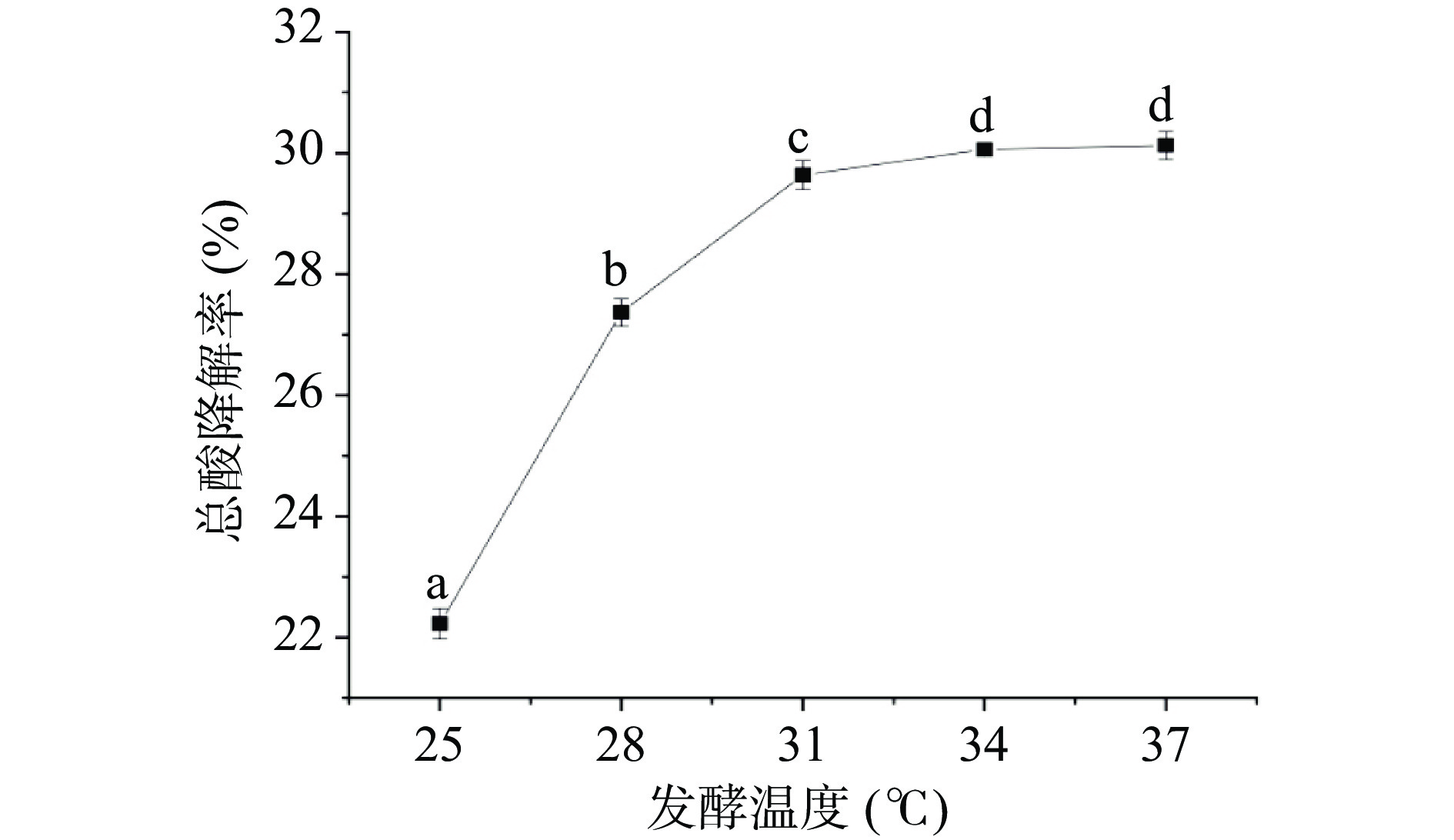
由图2可知,在发酵温度为25~31 ℃范围内,沙棘汁总酸降解率随着发酵温度的升高不断增加,当发酵温度为31 ℃时,降解率达到29.64%。这可能是因为较低温度会使菌株增殖缓慢以及降低细胞内的酶活性[18-19],从而抑制了细胞内各种生化反应。在发酵温度大于31 ℃时总酸降解率趋于平稳且不再发生显著变化(P>0.05),这与张晟等[4]报道的苹果酸降解率伴随发酵温度升高而先上升后下降的规律不同,可能是由于酒酒球菌与短乳杆菌的适宜生长温度和代谢温度产生了互补。李维妮[3]通过实验也证明了复合乳酸菌活菌数在较高的温度下无显著变化,从而进一步使总酸降解率变化不明显。因此,优选发酵温度为31 ℃进行响应面试验。
2.4 发酵时间对沙棘汁总酸降解率的影响
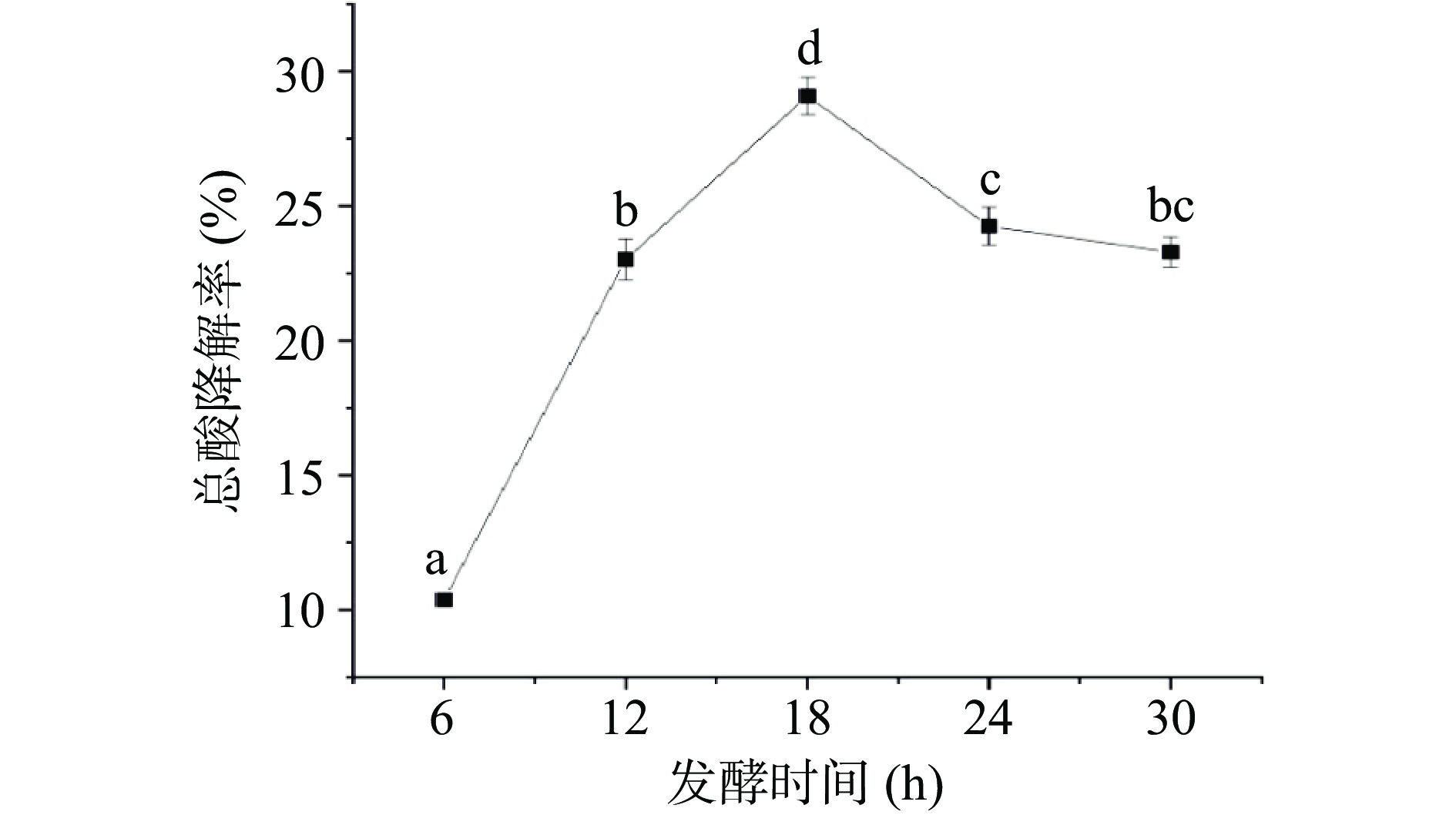
如图3可知,当发酵时间低于18 h时,随着发酵时间的增加,沙棘汁总酸降解率也不断增加。在发酵18 h时,沙棘汁总酸降解率上升到最高值(P<0.05),达到29.13%,这是因为随着时间的延长,两种乳酸菌大量繁殖与代谢,发酵越来越充分[20],使得总酸不断被转化和消耗;而当发酵时间大于18 h时,沙棘汁总酸降解率随着发酵时间的增加而降低,这是由于发酵时间过长使菌株活力下降。这与张晟等[4]报道的苹果酸降解率伴随发酵时间的增加先上升后下降的规律相一致。因此,在本实验中优选发酵时间为18 h进行响应面试验。
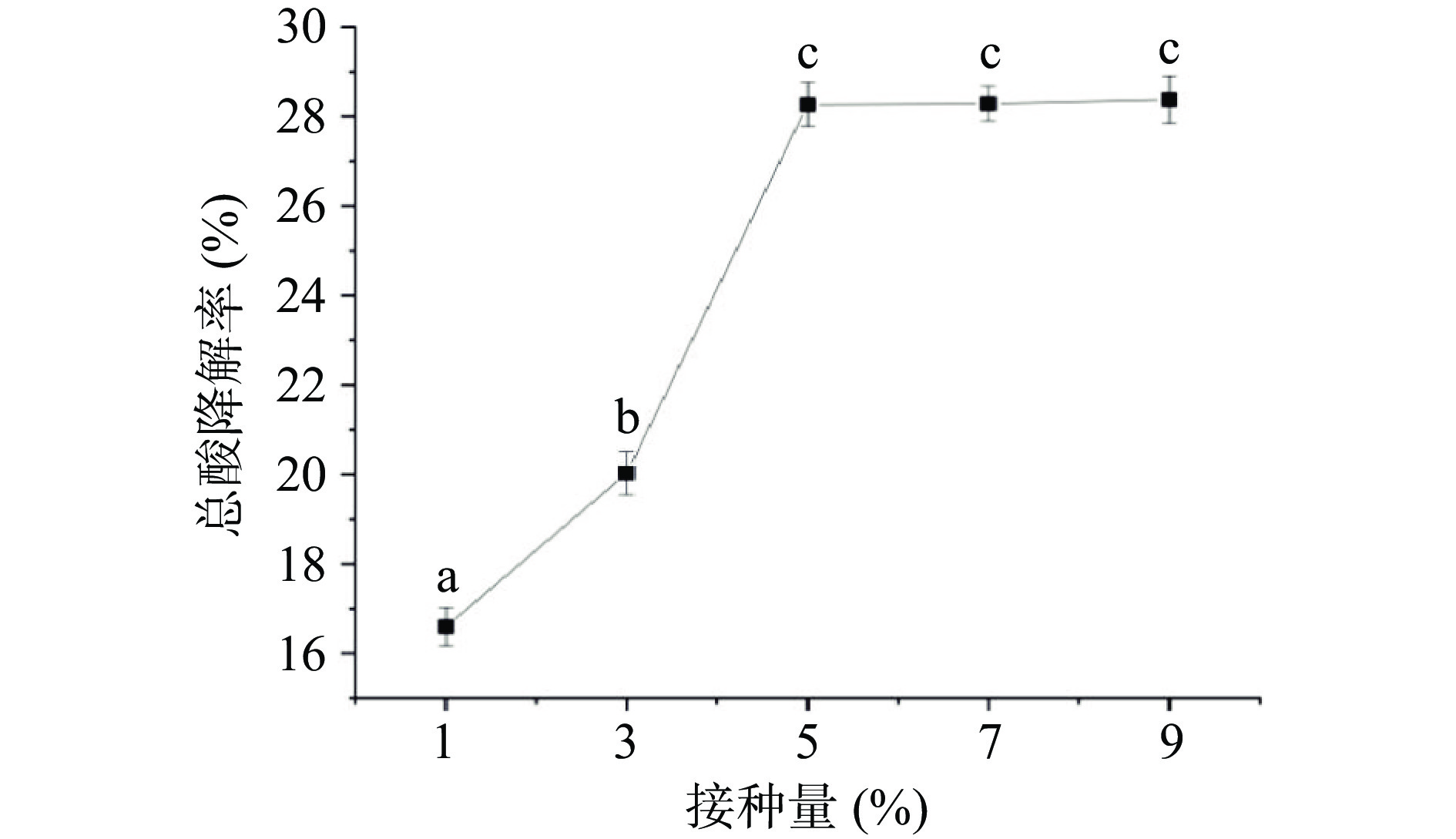
2.5 接种量对沙棘汁总酸降解率的影响
由图4可知,当接种量从1%增加到5%时,沙棘汁总酸降解率迅速上升,当接种量为5%时,沙棘汁总酸降解率达到28.27%。有机酸的降解遵循乳酸菌生长模式,当接种量过低时,因乳酸菌长时间处于迟滞阶段,受损群体修复损伤和开始增长所需的时间延长,使得分解苹果酸的能力较弱[21]。当接种量超过5%时,总酸降解率不再发生显著变化(P>0.05),这可能是因为接种量大,乳酸菌克服滞后时间快,使细胞的代谢能力完全恢复,同时,Selma等[22]的研究结果表明在克服滞后时间后,乳酸菌最大生长量不会受到接种量大小的影响。因此,总酸降解率变化不明显。这与辛宇等[23]在实验中明确的灵芝菌发酵北五味子果汁中接种量对总酸降解率的影响一致。因此,在本实验中优选接种量为5%进行响应面试验。
2.6 响应面试验结果与分析
2.6.1 模型的建立与分析
以初始pH(A)、发酵温度(B)、发酵时间(C)和接种量(D)为试验因素,总酸降解率Y(%)为评价指标进行响应面设计,其试验设计及结果见表4。
表 4 沙棘汁降酸工艺的响应面试验设计与结果Table 4. Response surface experiment design and results of reducing acid process of sea buckthorn juice实验号 A初始pH B发酵温度(℃) C发酵时间(h) D接种量(%) Y总酸降解率(%) 1 3.4 28 18 5 19.53 2 3.8 28 18 5 35.95 3 3.4 34 18 5 26.00 4 3.8 34 18 5 33.33 5 3.6 31 12 3 23.45 6 3.6 31 24 3 35.03 7 3.6 31 12 7 28.11 8 3.6 31 24 7 30.23 9 3.4 31 18 3 19.90 10 3.8 31 18 3 36.27 11 3.4 31 18 7 28.62 12 3.8 31 18 7 30.88 13 3.6 28 12 5 21.61 14 3.6 34 12 5 28.95 15 3.6 28 24 5 32.49 16 3.6 34 24 5 28.81 17 3.4 31 12 5 14.05 18 3.8 31 12 5 34.80 19 3.4 31 24 5 27.74 20 3.8 31 24 5 27.12 21 3.6 28 18 3 30.29 22 3.6 34 18 3 33.91 23 3.6 28 18 7 32.19 24 3.6 34 18 7 32.59 25 3.6 31 18 5 38.37 26 3.6 31 18 5 39.11 27 3.6 31 18 5 38.35 28 3.6 31 18 5 37.41 29 3.6 31 18 5 37.81 上述试验结果通过多元回归方程拟合,得初始pH、发酵时间、发酵温度、接种量为影响因素的多元二次方程为:
Y=38.21+5.21A+0.96B+2.54C+0.31D−2.27AB−5.34AC−3.53AD−2.76BC−0.80BD−2.37CD−6.16A2−3.48B2−6.38C2−2.75D2。
从表5可知模型P<0.0001,极显著,回归模型的失拟项P=0.1187>0.05,模型校正决定系数R2Adj=0.9710,决定系数R2值为0.9855,表明该模型与实验拟合程度较好,可用于复合乳酸菌发酵沙棘汁降酸过程的分析和优化。由F值可知,各因素对沙棘汁总酸降解率的影响大小顺序为A>C>B>D,即初始pH>发酵时间>发酵温度>接种量。
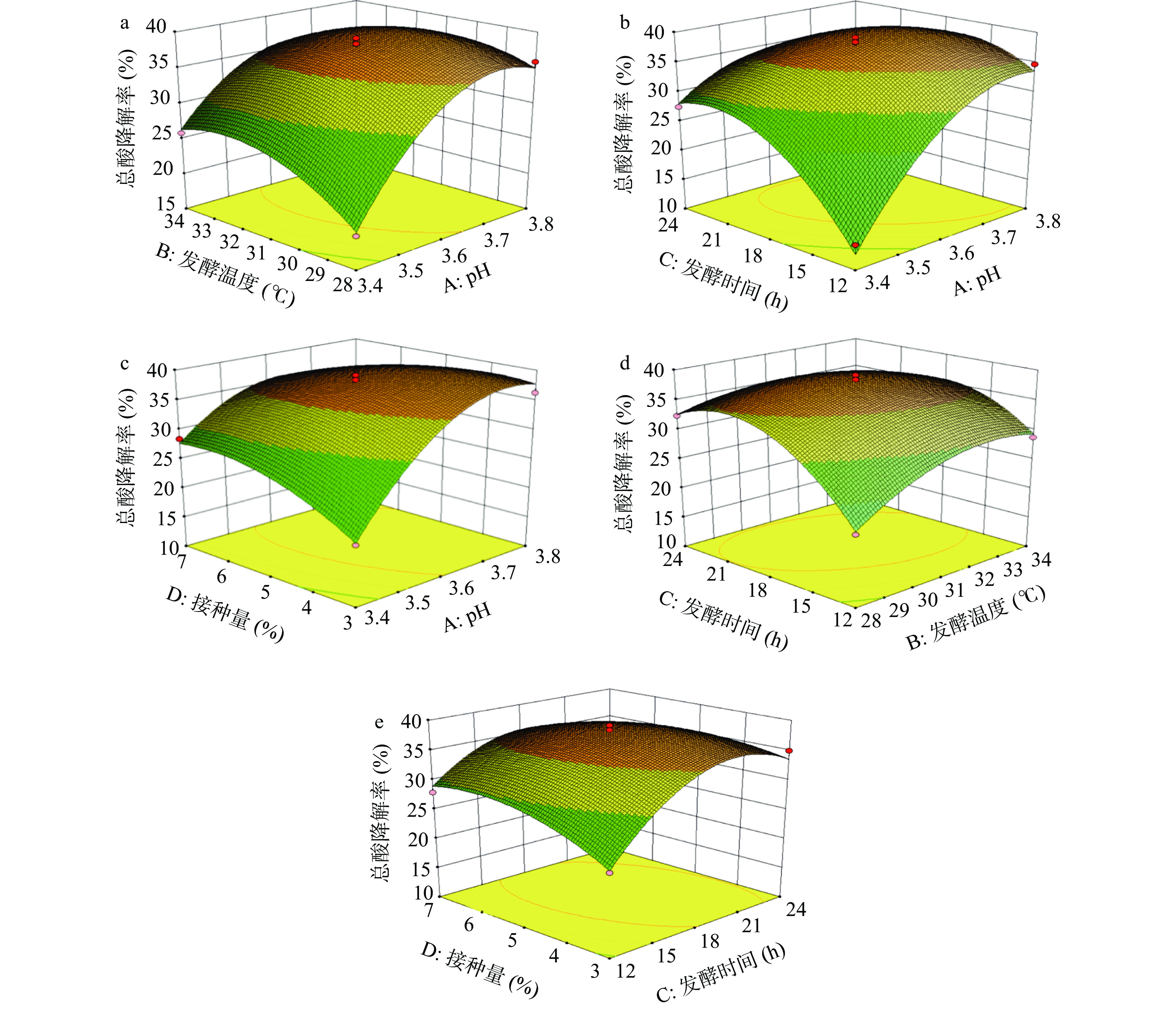
表 5 回归模型方差分析结果Table 5. Variance analysis results of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1101.52 14 78.68 68.03 < 0.0001 ** A-初始pH 325.63 1 325.63 281.55 < 0.0001 ** B-温度 11.08 1 11.08 9.58 0.0079 ** C-时间 77.27 1 77.27 66.81 < 0.0001 ** D-接种量 1.18 1 1.18 1.02 0.3287 AB 20.66 1 20.66 17.86 0.0008 ** AC 114.17 1 114.17 98.72 < 0.0001 ** AD 49.77 1 49.77 43.04 < 0.0001 ** BC 30.36 1 30.36 26.25 0.0002 ** BD 2.59 1 2.59 2.24 0.1566 CD 22.37 1 22.37 19.34 0.0006 ** A2 246.00 1 246.00 212.70 < 0.0001 ** B2 78.37 1 78.37 67.76 < 0.0001 ** C2 264.30 1 264.30 228.53 < 0.0001 ** D2 48.99 1 48.99 42.36 < 0.0001 ** 残差 16.19 14 1.16 失拟项 14.54 10 1.45 3.51 0.1187 纯误差 1.66 4 0.41 注:**差异极显著,P<0.01;*差异显著,P<0.05。 2.6.2 数学模型及响应面分析
响应曲面坡度越陡峭、等高线越密集以及形状呈现椭圆形或马鞍形都表明该因素变化或两因素间的交互作用越显著[24]。由图5和表5可知,模型中A、B、C、AB、AC、AD、BC、CD、A2、B2、C2、D2对Y影响极显著(P<0.01)。在所有交互项中,AC交互作用对响应值的影响最强,表明初始pH与发酵时间的交互作用对沙棘汁总酸降解率的影响最为显著,由图5b可知,随着初始pH和发酵时间的增加,沙棘汁总酸降解率先增加后趋于平缓,且发酵时间曲面的坡度与初始pH相比较为平滑,说明初始pH影响大于发酵时间。图5d呈现出发酵时间和发酵温度之间显著的交互作用,其中发酵时间曲面陡于发酵温度,说明发酵时间的影响程度大于发酵温度,与方差分析结果一致。
2.6.3 响应面优化结果及验证
以沙棘汁总酸降解率的最大化为目标,预测得到的优选发酵条件为:初始pH3.68,发酵温度30.54 ℃,发酵时间18.21 h,接种量4.79%。在此条件下,回归方程模型对沙棘汁总酸降解率的预测值为39.33%。考虑实际操作的便利性,将发酵参数调整为:初始pH3.7,发酵温度31 ℃,发酵时间18 h,接种量5%,在上述条件下进行3次平行实验,验证得到沙棘汁总酸降解率为38.51%±0.64%,相对误差为2.08%,说明模型可靠。
2.6.4 沙棘汁发酵过程中主要理化指标的变化
由表6可知,在发酵到18 h时,除还原糖外,黄酮、多酚、总酸、pH和TSS含量与发酵前均具有显著性差异(P<0.05)。多酚与黄酮含量在发酵过程中都呈现出先上升后下降趋势,在经过18 h的发酵后达到最大值,分别比发酵前增加了44.74%和22.22%。乳酸菌在发酵过程中产生大量水解酶,使沙棘细胞壁被破坏,与木质素结合在一起的黄酮被释放[25],使黄酮含量上升。多酚类物质增多,可能是在发酵后产生了糖苷酶和酚酯酶,能水解结合的酚类化合物形成游离酚,使总酚含量增加[26]。
表 6 沙棘汁发酵过程中主要理化指标的变化Table 6. Changes of main physicochemical indexes of sea buckthorn juice during fermentation理化指标 发酵时间(h) 0 6 12 18 24 30 黄酮(mg/mL) 0.523±0.071a 0.583±0.044ab 0.583±0.022ab 0.757±0.098c 0.736±0.141bc 0.589±0.071ab 多酚(mg/mL) 0.810±0.049a 0.832±0.061a 0.855±0.106ab 0.990±0.012c 0.966±0.053c 0.958±0.015bc 总酸(g/L) 8.49±0.06d 7.45±0.12c 6.58±0.09b 5.22±0.19a 5.33±0.053a 5.40±0.08a pH 3.71±0.03a 3.76±0.02b 3.80±0.01bc 3.85±0.06c 3.84±0.03c 3.83±0.03c TSS(%) 6.90±0.100a 5.85±0.05b 5.40±0.01c 5.50±0.10c 5.45±0.25c 5.40±0.25c 还原糖(mg/mL) 9.720±0.270a 9.845±0.054a 9.897±0.329a 9.903±0.769a 9.724±0.708a 9.618±0.695a 表 7 沙棘汁发酵过程中有机酸的动态变化Table 7. Dynamic changes of organic acids in sea buckthorn juice during fermentation类别(mg/mL) 发酵时间(h) 0 6 12 18 24 30 苹果酸 6.234±0.200d 2.693±0.205c 0.843±0.057b 0.337±0.145a 0.498±0.191a 0.365±0.073a 奎宁酸 9.869±0.179b 8.595±0.175a 9.971±0.359b 9.854±0.432b 9.503±0.177b 9.553±0.137b 抗坏血酸 0.115±0.009a 0.110±0.023a 0.107±0.018a 0.108±0.024a 0.105±0.021a 0.100±0.024a 乳酸 1.033±0.210a 2.313±0.198b 5.960±0.195c 10.372±0.618e 9.411±0.223d 10.319±0.735e 酒石酸 1.503±0.068ab 1.523±0.072ab 1.655±0.128b 1.437±0.120a 1.558±0.109ab 1.465±0.126ab 草酸 0.177±0.024a 0.163±0.015a 0.185±0011a 0.168±0.011a 0.165±0.005a 0.172±0.009a 柠檬酸 0.437±0.037a 0.440±0.077a 0.355±0.037a 0.421±0.051a 0.400±0.079a 0.398±0.043a 表 8 发酵沙棘汁组分与抗氧化能力相关性分析Table 8. Correlation analysis between components and antioxidant capacity of fermented sea buckthorn juice项目 抗氧化活性 DPPH自由基清除率 ABTS+自由基清除率 FRAP 黄酮 0.749 0.850* 0.965** 多酚 0.801 0.872* 0.916* 苹果酸 −0.918** −0.845* −0.808 奎宁酸 −0.030 0.437 0.177 抗坏血酸 0.791 0.565 0.537 乳酸 0.845* 0.904* 0.875* 酒石酸 0.107 −0.054 −0.169 草酸 0.279 0.518 0.560 柠檬酸 −0.486 −0.495 −0.257 注:**差异极显著,P<0.01;*差异显著,P<0.05。 发酵过程中总酸含量呈现出下降趋势,由初始的8.49 g/L下降至18 h时的5.22 g/L,下降了38.52%,这与有机酸可作为基质被乳酸菌分解来增加生物量有关[27]。沙棘汁pH由未发酵时的3.71增加至发酵18 h的3.85。TSS发酵18 h后下降了20.29%。另外,还原糖含量没有显著变化,这可能是因为在较低的pH下,利用糖发酵生成乳酸的过程就会明显减少[26]。这与Tkacz等[28]和Tiitinen等[29-29]使用酒酒球菌或者植物乳杆菌发酵沙棘汁脱酸不会导致糖浓度差异(P>0.05)的研究结果相同。
2.6.5 沙棘汁发酵过程中有机酸的变化
酒酒球菌与短乳杆菌发酵沙棘汁,改变了其有机酸的含量,发酵过程中沙棘汁中有机酸的变化见表7。发酵前有机酸以苹果酸和奎宁酸为主,分别为6.234±0.200和9.869±0.179 mg/mL,其次为柠檬酸、酒石酸、抗坏血酸、乳酸和草酸。发酵18 h后有机酸比例和含量发生了明显变化,以乳酸和奎宁酸为主,含量分别为10.372±0.618和9.854±0.432 mg/mL。在发酵时间为0~18 h的范围内,沙棘汁中苹果酸含量快速降低,在发酵时间至18 h时苹果酸含量降低了94.59%,乳酸含量增加了904.07%。奎宁酸、抗坏血酸、酒石酸、草酸和柠檬酸含量在发酵前后没有显著变化(P>0.05)。
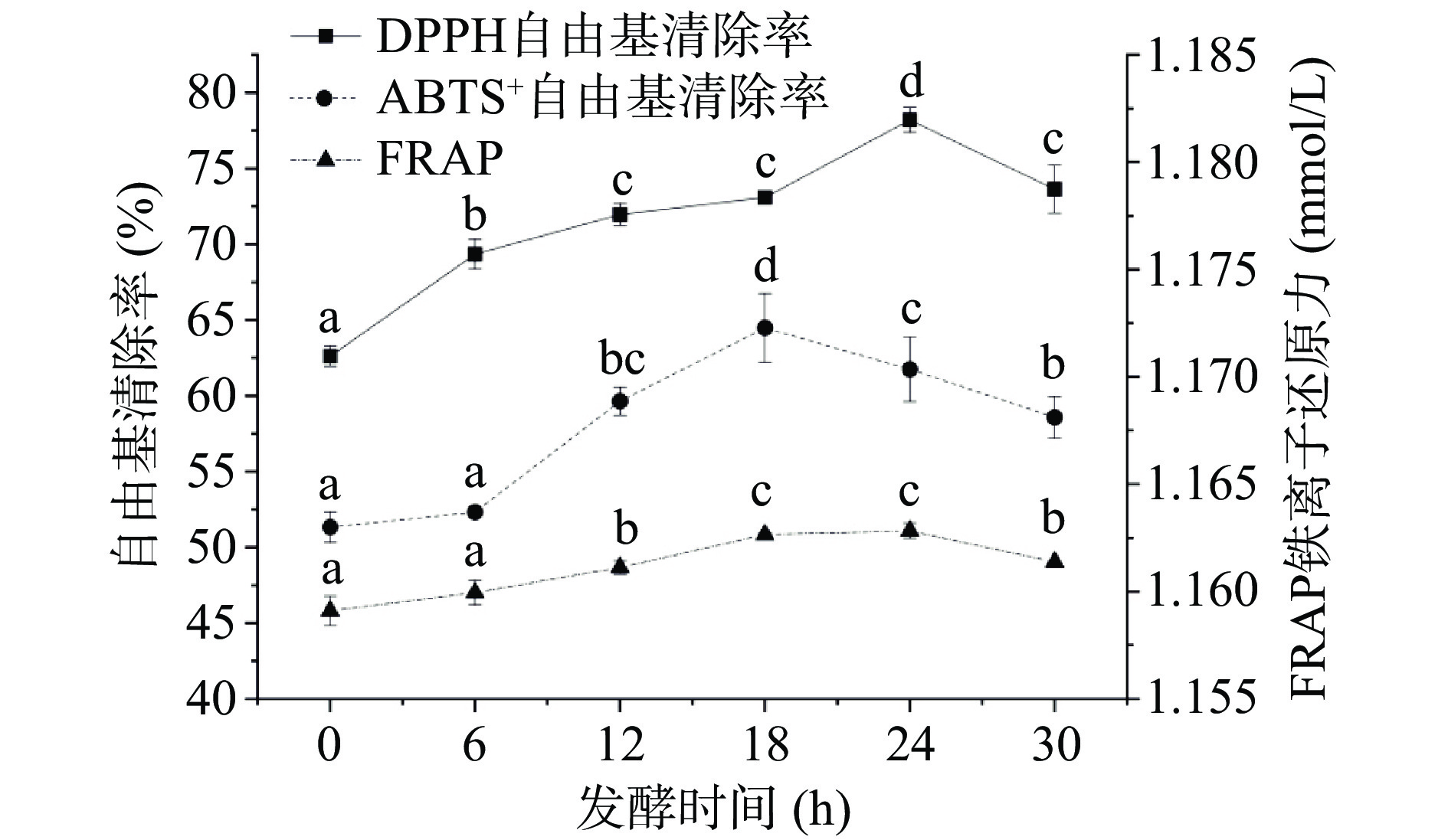
2.7 沙棘汁发酵过程中抗氧化活性的变化
由图6可以看出,DPPH、ABTS+自由基清除率与FRAP总体呈现先上升后降低趋势。在0~24 h时,DPPH自由基清除率由最初62.61%上升至78.20%,ABTS+自由基清除能力在发酵18 h时达到最大值,为64.48%,较发酵之前提高了20.38%,对FRAP来说,发酵时间为18~24 h是发酵的较佳时期,其维持在1.1626 mmol/L左右。由此可以看出,沙棘汁通过乳酸发酵可以不同程度提高DPPH和ABTS+自由基的清除率以及FRAP,这可能因为乳酸菌在发酵过程中产生的β-葡萄糖苷酶能将酚糖苷水解为相应的苷元,使它们具有更多的自由基清除特性[30-31],但是发酵过程中沙棘汁抗氧化活性均显著(P<0.05)低于阳性对照组(0.4 mg/mL维生素C的DPPH、ABTS+自由基清除率与FRAP分别为90.27%、89.54%、2.393 mmol/L);在发酵至24 h后,沙棘汁抗氧化活性整体呈下降趋势,这可能是因为抗氧化化合物的降解和氧化造成的[32]。
由表8可以看出,发酵后沙棘汁中黄酮、多酚与ABTS+自由基清除率和FRAP显著正相关(P<0.05),乳酸与DPPH自由基清除率、ABTS+自由基清除率和FRAP均呈显著正相关(P<0.05),苹果酸与DPPH和ABTS+自由基清除率均呈显著负相关(P<0.05)。说明通过复合乳酸菌发酵沙棘汁,不仅可以达到降酸的效果,还可以显著提高其抗氧化能力。
3. 结论
通过响应面试验设计优化复合乳酸菌发酵沙棘汁优选工艺为酒酒球菌:短乳杆菌比例为1:1、初始pH3.7、发酵温度31 ℃、发酵时间18 h、接种量5%,发酵后沙棘汁总酸降解率为38.52%。在上述条件发酵后沙棘汁的黄酮、多酚含量增加,pH上升,总酸和TSS含量下降,还原糖变化不显著;复合乳酸菌发酵改变了沙棘汁有机酸含量,其中苹果酸降解率达94.59%,乳酸含量增加了904.07%,奎宁酸、抗坏血酸、酒石酸、草酸和柠檬酸含量变化不显著(P>0.05);沙棘发酵汁对DPPH和ABTS+自由基清除率及亚铁离子还原力分别为78.20%、64.48%和1.1626 mmol/L,表明复合乳酸菌发酵沙棘汁,不仅可以降低其酸度,改善沙棘汁酸涩的口感,还能显著提高其抗氧化活性。今后还需继续研究复合乳酸菌发酵对该果汁风味物质的影响,以有效增强沙棘汁的品质,为沙棘新型功能性食品的开发与高值化利用提供依据。
-
表 1 Box-Behnken试验设计因素及水平
Table 1 Factors and levels used in Box-Behnken design
水平 A初始pH B发酵温度(℃) C发酵时间(h) D接种量(%) −1 3.4 28 12 3 0 3.6 31 18 5 1 3.8 34 24 7 表 2 有机酸标准曲线
Table 2 Organic acid standard curve
有机酸 回归方程 相关系数 线性范围(mg/L) 苹果酸 y=1337.8x+23.25 1.0000 10~4000 奎宁酸 y=1065.9x−11.21 0.9999 6~4000 乳酸 y=951.28x−29.87 0.9995 4~3000 柠檬酸 y=1783.9x+2.73 1.0000 25~3000 抗坏血酸 y=11731x+32.82 0.9999 2~1000 草酸 y=18749x−61.272 0.9993 2~1000 酒石酸 y=3191.7x+28.73 0.9990 1~1000 表 3 乳酸菌配比对沙棘汁总酸降解率的影响
Table 3 Effect of lactobacillus ratio on total acid degradation rate of sea buckthorn juice
乳酸菌
配比总酸降解率(%) 6 h 12 h 18 h 24 h 30 h 1:0 11.57±0.08a 16.98±0.55b 25.42±0.84d 22.56±0.27c 21.75±1.12c 2:1 13.31±1.83a 23.73±1.26b 28.51±0.15c 28.05±0.35c 27.95±0.50c 1:1 12.81±1.12a 23.04±0.98b 29.70±0.28d 28.30±0.43cd 27.34±0.21c 1:2 12.31±1.12a 23.14±1.12b 28.90±0.01c 28.35±0.21c 28.65±0.21c 0:1 13.21±1.12a 22.24±1.26b 27.31±1.54c 27.21±0.56c 26.40±0.69c 注:同行字母不同表示差异显著(P<0.05);表6~表8同。 表 4 沙棘汁降酸工艺的响应面试验设计与结果
Table 4 Response surface experiment design and results of reducing acid process of sea buckthorn juice
实验号 A初始pH B发酵温度(℃) C发酵时间(h) D接种量(%) Y总酸降解率(%) 1 3.4 28 18 5 19.53 2 3.8 28 18 5 35.95 3 3.4 34 18 5 26.00 4 3.8 34 18 5 33.33 5 3.6 31 12 3 23.45 6 3.6 31 24 3 35.03 7 3.6 31 12 7 28.11 8 3.6 31 24 7 30.23 9 3.4 31 18 3 19.90 10 3.8 31 18 3 36.27 11 3.4 31 18 7 28.62 12 3.8 31 18 7 30.88 13 3.6 28 12 5 21.61 14 3.6 34 12 5 28.95 15 3.6 28 24 5 32.49 16 3.6 34 24 5 28.81 17 3.4 31 12 5 14.05 18 3.8 31 12 5 34.80 19 3.4 31 24 5 27.74 20 3.8 31 24 5 27.12 21 3.6 28 18 3 30.29 22 3.6 34 18 3 33.91 23 3.6 28 18 7 32.19 24 3.6 34 18 7 32.59 25 3.6 31 18 5 38.37 26 3.6 31 18 5 39.11 27 3.6 31 18 5 38.35 28 3.6 31 18 5 37.41 29 3.6 31 18 5 37.81 表 5 回归模型方差分析结果
Table 5 Variance analysis results of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 1101.52 14 78.68 68.03 < 0.0001 ** A-初始pH 325.63 1 325.63 281.55 < 0.0001 ** B-温度 11.08 1 11.08 9.58 0.0079 ** C-时间 77.27 1 77.27 66.81 < 0.0001 ** D-接种量 1.18 1 1.18 1.02 0.3287 AB 20.66 1 20.66 17.86 0.0008 ** AC 114.17 1 114.17 98.72 < 0.0001 ** AD 49.77 1 49.77 43.04 < 0.0001 ** BC 30.36 1 30.36 26.25 0.0002 ** BD 2.59 1 2.59 2.24 0.1566 CD 22.37 1 22.37 19.34 0.0006 ** A2 246.00 1 246.00 212.70 < 0.0001 ** B2 78.37 1 78.37 67.76 < 0.0001 ** C2 264.30 1 264.30 228.53 < 0.0001 ** D2 48.99 1 48.99 42.36 < 0.0001 ** 残差 16.19 14 1.16 失拟项 14.54 10 1.45 3.51 0.1187 纯误差 1.66 4 0.41 注:**差异极显著,P<0.01;*差异显著,P<0.05。 表 6 沙棘汁发酵过程中主要理化指标的变化
Table 6 Changes of main physicochemical indexes of sea buckthorn juice during fermentation
理化指标 发酵时间(h) 0 6 12 18 24 30 黄酮(mg/mL) 0.523±0.071a 0.583±0.044ab 0.583±0.022ab 0.757±0.098c 0.736±0.141bc 0.589±0.071ab 多酚(mg/mL) 0.810±0.049a 0.832±0.061a 0.855±0.106ab 0.990±0.012c 0.966±0.053c 0.958±0.015bc 总酸(g/L) 8.49±0.06d 7.45±0.12c 6.58±0.09b 5.22±0.19a 5.33±0.053a 5.40±0.08a pH 3.71±0.03a 3.76±0.02b 3.80±0.01bc 3.85±0.06c 3.84±0.03c 3.83±0.03c TSS(%) 6.90±0.100a 5.85±0.05b 5.40±0.01c 5.50±0.10c 5.45±0.25c 5.40±0.25c 还原糖(mg/mL) 9.720±0.270a 9.845±0.054a 9.897±0.329a 9.903±0.769a 9.724±0.708a 9.618±0.695a 表 7 沙棘汁发酵过程中有机酸的动态变化
Table 7 Dynamic changes of organic acids in sea buckthorn juice during fermentation
类别(mg/mL) 发酵时间(h) 0 6 12 18 24 30 苹果酸 6.234±0.200d 2.693±0.205c 0.843±0.057b 0.337±0.145a 0.498±0.191a 0.365±0.073a 奎宁酸 9.869±0.179b 8.595±0.175a 9.971±0.359b 9.854±0.432b 9.503±0.177b 9.553±0.137b 抗坏血酸 0.115±0.009a 0.110±0.023a 0.107±0.018a 0.108±0.024a 0.105±0.021a 0.100±0.024a 乳酸 1.033±0.210a 2.313±0.198b 5.960±0.195c 10.372±0.618e 9.411±0.223d 10.319±0.735e 酒石酸 1.503±0.068ab 1.523±0.072ab 1.655±0.128b 1.437±0.120a 1.558±0.109ab 1.465±0.126ab 草酸 0.177±0.024a 0.163±0.015a 0.185±0011a 0.168±0.011a 0.165±0.005a 0.172±0.009a 柠檬酸 0.437±0.037a 0.440±0.077a 0.355±0.037a 0.421±0.051a 0.400±0.079a 0.398±0.043a 表 8 发酵沙棘汁组分与抗氧化能力相关性分析
Table 8 Correlation analysis between components and antioxidant capacity of fermented sea buckthorn juice
项目 抗氧化活性 DPPH自由基清除率 ABTS+自由基清除率 FRAP 黄酮 0.749 0.850* 0.965** 多酚 0.801 0.872* 0.916* 苹果酸 −0.918** −0.845* −0.808 奎宁酸 −0.030 0.437 0.177 抗坏血酸 0.791 0.565 0.537 乳酸 0.845* 0.904* 0.875* 酒石酸 0.107 −0.054 −0.169 草酸 0.279 0.518 0.560 柠檬酸 −0.486 −0.495 −0.257 注:**差异极显著,P<0.01;*差异显著,P<0.05。 -
[1] DABROWSKI G, CZAPLICKI S, SZUSTAK M, et al. Composition of flesh lipids and oleosome yield optimization of selected sea buckthorn (Hippophae rhamnoides L.) cultivars grown in Poland[J]. Food Chemistry,2022,369:130921. doi: 10.1016/j.foodchem.2021.130921
[2] 卢薇, 费建军, 沈晓梅, 等. 五种果汁的酚类组成及其抗氧化、抗肿瘤细胞增殖活性研究[J]. 食品工业科技,2022,43(6):365−371. [LU W, FEI J J, SHEN X M, et al. Phenolic profiles, antioxidant and antiproliferative activities towards tumor cells of five fruit juices[J]. Science and Technology of Food Industry,2022,43(6):365−371. doi: 10.13386/j.issn1002-0306.2021070043 LU W, FEI J J, SHEN X M, et al. Phenolic profiles, antioxidant and antiproliferative activities towards tumor cells of five fruit juices[J]. Science and Technology of Food Industry, 2022, 43(6): 365-371. doi: 10.13386/j.issn1002-0306.2021070043
[3] 李维妮, 张宇翔, 魏建平, 等. 益生菌发酵苹果汁工艺优化及有机酸的变化[J]. 食品科学,2017,38(22):80−87. [LI W N, ZHANG Y X, WEI J P, et al. Optimization of fermentation of apple juice by probiotics and organic acids evolution during fermentation[J]. Food Science,2017,38(22):80−87. doi: 10.7506/spkx1002-6630-201722013 LI W N, ZHANG Y X, WEI J P, et al. Optimization of fermentation of apple juice by probiotics and organic acids evolution during fermentation[J]. Food Science, 2017, 38(22): 80-87. doi: 10.7506/spkx1002-6630-201722013
[4] 张晟, 张雅娜, 马丽媛, 等. 北五味子汁苹果酸-乳酸发酵工艺优化及其抗氧化性研究[J]. 中国酿造,2021,40(1):93−97. [ZHANG S, ZHANG Y L, MA L Y, et al. Malolactic fermentation process optimization of Schisandra chinensis juice and its antioxidant activity[J]. China Brewing,2021,40(1):93−97. doi: 10.11882/j.issn.0254-5071.2021.01.018 ZHANG S, ZHANG Y L, MA L Y, et al. Malolactic fermentation process optimization of Schisandra chinensis juice and its antioxidant activity[J]. China Brewing, 2021, 40(1): 93-97. doi: 10.11882/j.issn.0254-5071.2021.01.018
[5] ENGLEZOS V, CACHON D C, RANTSIOU K, et al. Effect of mixed species alcoholic fermentation on growth and malolactic activity of lactic acid bacteria[J]. Applied Microbiology and Biotechnology,2019,103(18):7687−7702. doi: 10.1007/s00253-019-10064-1
[6] 杨琦, 谢纯良, 周映君, 等. 益生菌发酵蓝莓的体外抗氧化活性分析[J]. 食品与发酵工业,2022,48(9):112−116. [YANG Q, XIE C L, ZHOU Y J, et al. Antioxidant activity in vitro of probiotics fermented blueberry drink[J]. Food and Fermentation Industries,2022,48(9):112−116. YANG Q, XIE C L, ZHOU Y J, et al. Antioxidant activity in vitro of probiotics fermented blueberry drink[J]. Food and Fermentation Industries, 2022, 48(9): 112-116.
[7] 邵睿, 张倩, 宋炜钰, 等. 紫外诱变法选育酒酒球菌乙醇胁迫耐受菌株及其发酵性能研究[J]. 中国酿造,2022,41(7):71−75. [SHAO R, ZHANG Q, SONG W Y, et al. Study on screening of alcohol stress tolerant strain of Oenococcus oeni by UV mutagenesis and its fermentation performance[J]. China Brewing,2022,41(7):71−75. doi: 10.11882/j.issn.0254-5071.2022.07.013 SHAO R, ZHANG Q, SONG W Y, et al. Study on screening of alcohol stress tolerant strain of Oenococcus oeni by UV mutagenesis and its fermentation performance[J]. China Brewing, 2022, 41(7): 71-75. doi: 10.11882/j.issn.0254-5071.2022.07.013
[8] 桂青, 王秀全, 黄坚雄, 等. 不同干燥方式对五指毛桃品质的影响[J/OL]. 食品工业科技: 1−14 [2022-09-17]. doi: 10.13386/j.issn1002-0306.2022050189 GUI Q, WANG X Q, HUANG J X, et al. Study on quality differences of Ficus hirta vahl. dried by vary processes[J/OL]. Science and Technology of Food Industry: 1−14[2022-09-17]. doi: 10.13386/j.issn1002-0306.2022050189.
[9] 詹梦涛, 娄水珠, 刘仙花, 等. 3, 5-二硝基水杨酸法测定液体糖中总糖含量[J]. 云南民族大学学报(自然科学版),2020,29(4):317−321. [ZHAN M T, LOU S Z, LIU X H, et al. Determination of total sugar in liquid sugar by 3, 5-dinitrosalicylic acid method[J]. Journal of Yunnan Minzu University (Natural Sciences Edition),2020,29(4):317−321. ZHAN M T, LOU S Z, LIU X H, et al. Determination of total sugar in liquid sugar by 3, 5-dinitrosalicylic acid method[J]. Journal of Yunnan Minzu University (Natural Sciences Edition), 2020, 29(4): 317-321.
[10] 樊秋元, 朱丹, 牛广财, 等. 黑加仑酵素有机酸分析及其体外抗氧化性能研究[J]. 中国酿造,2019,38(5):159−163. [FAN Q Y, ZHU D, NIU G C, et al. Analysis of organic acid and in vitro antioxidant activity of blackcurrant Jiaosu[J]. China Brewing,2019,38(5):159−163. doi: 10.11882/j.issn.0254-5071.2019.05.031 FAN Q Y, ZHU D, NIU G C, et al. Analysis of organic acid and in vitro antioxidant activity of blackcurrant Jiaosu[J]. China Brewing, 2019, 38(5): 159-163. doi: 10.11882/j.issn.0254-5071.2019.05.031
[11] 张琪, 朱丹, 牛广财, 等. 沙棘果酒发酵动力学及其抗氧化活性[J]. 食品与发酵工业,2019,45(15):53−58. [ZHANG Q, ZHU D, NIU G C, et al. Fermentation kinetics and antioxidant activity of sea buckthorn wine[J]. Food and Fermentation Industries,2019,45(15):53−58. ZHANG Q, ZHU D, NIU G C, et al. Fermentation kinetics and antioxidant activity of sea buckthorn wine[J]. Food and Fermentation Industries, 2019, 45(15): 53-58.
[12] 张璇. 青刺果酚类物质组成及其生物活性研究[D]. 昆明: 昆明理工大学, 2019. ZHANG X. Study on the composition and biological activity of phenols from Prinsepia utilis Royle[D]. Kunming: Kunming University of Science and Technology, 2019.
[13] 倪俊, 靖恒烨, 高玉婷, 等. 滇西北地区鱼腥草抗氧化活性研究[J]. 化学与生物工程,2022,39(7):26−31. [NI J, JING H H, GAO Y T, et al. Antioxidant activity of Houttuynia cordata Thunb. in northwest Yunnan[J]. Chemistry & Bioengineering,2022,39(7):26−31. doi: 10.3969/j.issn.1672-5425.2022.07.006 NI J, JING H H, GAO Y T, et al. Antioxidant activity of Houttuynia cordata Thunb. in northwest Yunnan[J]. Chemistry & Bioengineering, 2022, 39(7): 26-31. doi: 10.3969/j.issn.1672-5425.2022.07.006
[14] 李维妮, 郭春锋, 张宇翔, 等. 气相色谱-质谱法分析乳酸菌发酵苹果汁香气成分[J]. 食品科学,2017,38(4):146−154. [LI W N, GUO C F, ZHANG Y X, et al. GC-MS analysis of aroma components of apple juice fermented with lactic acid bacteria[J]. Food Science,2017,38(4):146−154. doi: 10.7506/spkx1002-6630-201704024 LI W N, GUO C F, ZHANG Y X, et al. GC-MS analysis of aroma components of apple juice fermented with lactic acid bacteria[J]. Food Science, 2017, 38(4): 146-154. doi: 10.7506/spkx1002-6630-201704024
[15] LOBEDA K, JIN Q, WU J, et al. Lactic acid production from food waste hydrolysate by Lactobacillus pentosus: Focus on nitrogen supplementation, initial sugar concentration, pH, and fed-batch fermentation[J]. Journal of Food Science,2022,87:3071−3083. doi: 10.1111/1750-3841.16205
[16] 李维新. 优良MLF乳酸菌选育及其产酶特性研究与应用[D]. 福州: 福建农林大学, 2012. LI W X. Superior MLF lactic acid bacteria selective breeding and enzyme production characteristics research and application[D]. Fuzhou: Fujian Agriculture and Forestry University, 2012.
[17] 韩诚武, 高鹏飞, 丁玉萍. 山葡萄酒苹果酸—乳酸发酵工艺优化[J]. 食品与机械,2018,34(7):200−203. [HAN C W, GAO P F, DING Y P. Optimization of malolactic fermentation process condition of northeast China V. amurensis wines[J]. Food and Machinery,2018,34(7):200−203. HAN C W, GAO P F, DING Y P. Optimization of malolactic fermentation process condition of northeast China V. amurensis wines[J]. Food and Machinery, 2018, 34(7): 200-203.
[18] 郑婕. 复合果蔬汁发酵工艺及胃肠消化特性研究[D]. 太原: 山西大学, 2020. ZHENG J. Study on fermentation technology and digestive characteristics of compound fruit and vegetable juice[D]. Taiyuan: Shanxi University, 2020.
[19] 赵红玉, 李华, 刘龙祥, 等. 酒酒球菌胁迫适应性机制的研究进展[J]. 中国食品学报,2019,19(7):292−299. [ZHAO H Y, LI H, LIU L X, et al. Research progress on stress adaptation mechanism of Oenococcus oeni[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(7):292−299. doi: 10.16429/j.1009-7848.2019.07.037 ZHAO H Y, LI H, LIU L X, et al. Research progress on stress adaptation mechanism of Oenococcus oeni[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(7): 292-299. doi: 10.16429/j.1009-7848.2019.07.037
[20] 孙天利, 程楚怡, 杨涔, 等. 山芹菜金翠香梨混合果醋酿造工艺的研究[J]. 中国调味品,2022,47(9):101−105. [SUN T L, CHENG C Y, YANG C, et al. Study on the brewing technology of Spuriopim pinella brachycarpa-Jincuixiang pear vinegar[J]. China Condiment,2022,47(9):101−105. doi: 10.3969/j.issn.1000-9973.2022.09.020 SUN T L, CHENG C Y, YANG C, et al. Study on the brewing technology of Spuriopim pinella brachycarpa-Jincuixiang pear vinegar[J]. China Condiment, 2022, 47(9): 101-105. doi: 10.3969/j.issn.1000-9973.2022.09.020
[21] HADINIA N, DOVOM M R E, YAVARMANESH M. The effect of fermentation conditions (temperature, salt concentration, and pH) with lactobacillus strains for producing short chain fatty acids[J]. LWT,2022,165:1−11.
[22] SELMA M V, FERNANDEZ P S, VALERO M, et al. Control of Enterobacter aerogenes by high-intensity, pulsed electric fields in horchata, a Spanish low-acid vegetable beverage[J]. Food Microbiology,2003,20(1):105−110. doi: 10.1016/S0740-0020(02)00082-5
[23] 辛宇, 邱智东, 伍法杰, 等. 灵芝菌生物发酵北五味子果汁降酸工艺优化及其护肝作用[J]. 食品工业科技,2020,41(2):177−182,194. [XIN Y, QIU Z D, WU F J, et al. Optimizing the fermentation process of Ganoderma lucidum to deacidify fresh Schisandra chinesis juice and its liver protection effects[J]. Science and Technology of Food Industry,2020,41(2):177−182,194. XIN Y, QIU Z D, WU F J, et al. Optimizing the fermentation process of Ganoderma lucidum to deacidify fresh Schisandra chinesis juice and its liver protection effects[J]. Science and Technology of Food Industry, 2020, 41(2): 177-182, 194.
[24] 魏晴, 陈代凤, 覃亚雪, 等. 大果木姜子黄酮的提取工艺优化及抗氧化活性研究[J]. 中国饲料,2022(13):52−57,65. [WEI Q, CHEN D F, TAN Y X, et al. Optimization of extraction process and antioxidant activity of flavonoids from Litsea pungens hemsl[J]. China Feed,2022(13):52−57,65. WEI Q, CHEN D F, TAN Y X, et al. Optimization of extraction process and antioxidant activity of flavonoids from Litsea pungens hemsl[J]. China Feed, 2022(13): 52-57, 65.
[25] 宋爱伟, 毕红, 陈亚军, 等. 苹果青枣酵素发酵过程中生物学特性和抗氧化活性研究[J]. 合肥师范学院学报,2021,39(6):25−29. [SONG A W, BI H, CHEN Y J, et al. Study on the biological characteristics and antioxidant activity of apple green jujube during enzymatic fermentation[J]. Journal of Hefei Normal University,2021,39(6):25−29. doi: 10.3969/j.issn.1674-2273.2021.06.008 SONG A W, BI H, CHEN Y J, et al. Study on the biological characteristics and antioxidant activity of apple green jujube during enzymatic fermentation[J]. Journal of Hefei Normal University, 2021, 39(6): 25-29. doi: 10.3969/j.issn.1674-2273.2021.06.008
[26] RODRIGUEZ H, CURIEL J A, LANDETE J M, et al. Food phenolics and lactic acid bacteria[J]. International Journal of Food Microbiology,2009,132(2-3):79−90. doi: 10.1016/j.ijfoodmicro.2009.03.025
[27] 张春晖, 李华. 苹果酸—乳酸发酵能量产生机理[J]. 生物工程进展,2001(5):72−74. [ZHANG C H, LI H. Mechanism for energy derivation from malolactic fermentation[J]. Progress in Biotechnology,2001(5):72−74. doi: 10.3969/j.issn.1671-8135.2001.05.008 ZHANG C H, LI H. Mechanism for energy derivation from malolactic fermentation[J]. Progress in Biotechnology, 2001(5): 72-74. doi: 10.3969/j.issn.1671-8135.2001.05.008
[28] TKACZ K, CHMIELEWSKA J, TURKIEWICZ I P, et al. Dynamics of changes in organic acids, sugars and phenolic compounds and antioxidant activity of sea buckthorn and sea buckthorn-apple juices during malolactic fermentation[J]. Food Chemistry,2020,332:1−36.
[29] TIITINEN K, VAHVASELKA M, LAAKSO S, et al. Malolactic fermentation in four varieties of sea buckthorn (Hippophaë rhamnoides L.)[J]. European Food Research and Technology,2007,224(6):725−732. doi: 10.1007/s00217-006-0365-2
[30] HUR S J, LEE S Y, KIM Y C, et al. Effect of fermentation on the antioxidant activity in plant-based foods[J]. Food Chemistry,2014,160:346−356. doi: 10.1016/j.foodchem.2014.03.112
[31] RANDHIR R, VATTEM D, SHETTY K. Solid-state bioconversion of fava bean by Rhizopus oligosporus for enrichment of phenolic antioxidants and L-DOPA[J]. Innovative Food Science & Emerging Technologies,2004,5(2):235−244.
[32] KWAW E, MA Y, TCHABO W, et al. Effect of lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J]. Food Chemistry,2018,250:148−154. doi: 10.1016/j.foodchem.2018.01.009
-
期刊类型引用(2)
1. 廖茂雯,韩琛,刘玮,李艳琳,陈昌琳,袁怀瑜,周艳,李可,李华佳. 植物乳杆菌发酵蓝莓汁发酵和贮藏过程中理化指标及挥发性风味物质的变化. 食品工业科技. 2025(01): 259-273 .  本站查看
本站查看
2. 赵佳,邓明蕊,范文荣,李璇,高振峰. 黄花菜梨汁发酵过程中理化性质与风味物质变化分析. 中国酿造. 2024(11): 99-104 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:
