Indentification of Fungal Community and Changes of Metabolite in Mildew Liupao Tea
-
摘要: 为了解霉变六堡茶中真菌群落及其代谢产物的变化,利用Illumina高通量测序技术平台,对高温高湿环境仓储获得的霉变六堡茶样本(GGZ)和作为对照样本(BDL)的竹筐仓储的正常六堡茶进行真菌多样性分析,采用超高效液相色谱串联质谱(UPLC-MS/MS)对样本中的代谢物进行分析,然后对显著差异代谢物对应的通路进行代谢物集富集分析,并对差异代谢物与差异微生物进行关联分析。结果表明,霉变六堡茶丰度较高的菌为两门[Ascomycota(子囊菌门)和Basidiomycota(担子菌门)]、两属[Aspergillus(曲霉真菌属)和Wallemia(节担菌属)],BDL组丰度较高的菌主要为Ascomycota的Aspergillus和Penicillium(青霉菌属)。GGZ组与BDL组相比,A. ruber(赤曲霉)和W. sebi水平显著(P<0.05)上调,两者为导致六堡茶霉变的优势真菌种群。此外,霉变茶叶中黄酮类化合物含量较高,氨基酸代谢发生显著变化,咖啡因代谢下调。霉变六堡茶中,具有一定细胞毒性和遗传毒性的2-羟基异己酸的含量上调,与下调的Penicillium负相关。这些数据揭示了A. ruber、W. sebi以及2-羟基异己酸为六堡茶食品安全评估中的潜在风险因子,且霉变六堡茶中黄酮类化合物含量、氨基酸代谢以及咖啡因代谢的变化可能与品质变化相关。Abstract: In order to understand the changes of fungal community and metabolites in mildew Liupao tea, the fungal diversity of mildew Liupao tea samples (GGZ) and normal Liupao tea samples stored in bamboo basket (BDL) were analyzed by Illumina high-throughput sequencing technology, and ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) was used to analyze the metabolites in these samples. Further, pathway enrichment analysis was performed on the significantly differential metabolites, and the correlation between the differential metabolites and the differential microorganisms was calculated. The results showed that the most abundant fungi in mildew Liupao tea were Ascomycota and Basidiomycota in phylum level, Aspergillus and Wallemia in genus level. Aspergillus and Penicillium belonging to Ascomycota were more abundant in BDL. Two of the dominant fungi related to mildew in Liupao tea, A. Ruber and W. sebi, showed significantly (P<0.05) higher abundance in GGZ than in BDL. In addition, higher contents of flavonoids along with the changing amino acids metabolism and down-regultated caffeine metabolism was observed in mildew Liupao tea. In mildew Liupao tea, the content of 2-hydroxy-isocaproic acid with certain cytotoxicity and genotoxicity was up-regulated and negatively correlated with reduced abundance of Penicillium. These data unveiled that A. ruber, W. sebi and 2-hydroxyisocaproic acid were potential risk factors in food safety assessment of Liupao tea, and the changes of flavonoid content, amino acid metabolism and caffeine metabolism in mildew Liupao tea might be related to quality changes.
-
Keywords:
- Liupao tea /
- mildew /
- microbiome /
- metabolomic /
- Penicillium /
- 2-hydroxyisocaproic acid
-
六堡茶属于六大茶类之一的黑茶,源自于广西壮族自治区梧州市苍梧县六堡镇[1]。该茶原料选用苍梧县群体种、广西大中叶种及其分离、选育的品种、品系茶树的鲜叶。经杀青、初揉、堆闷、复揉和干燥制成毛茶,之后再经过筛选、拼配、汽蒸(或可无)、渥堆、汽蒸、压制成型(或可无)、陈化、包装等工艺加工而成[2]。六堡茶具有独特的品质特征,其干茶呈黑褐色,光润,汤色红浓似琥珀,滋味醇和甘爽,具有槟榔香气[3]。在黑茶的品质形成过程中,微生物的作用必不可少[4]。六堡茶在仓储陈化过程的后发酵过程中,茶叶内含物茶多酚、蛋白质、果胶等在水热能量催化下发生氧化、分解、缩合反应,并在曲霉属菌(Aspergillus)等菌群的微生物酶促作用下发生氧化、水解、糖解、聚合反应,形成六堡茶越陈越香的品质特征[5]。因此,六堡茶的仓储过程是其品质形成的一个重要环节。
后发酵茶常选用粗老原料,且微生物参与渥堆发酵和储存加工过程,加工储存不当极易造成茶叶真菌毒素污染[6]。我国茶园污染真菌主要为Fusarium(镰刀菌属),可代谢产生脱氧雪腐镰刀菌烯醇、伏马毒素和T-2毒素等毒素[7]。此外,茶叶生产、储存和运输环境中的微生物也是真菌污染的重要来源,研究人员在茶叶加工厂的空气、设施和土壤中分离到包括A. niger(黑曲霉)、A. flavus(黄曲霉)、A. fumigatus(烟曲霉)和F. lactis(乳酸镰刀菌)等产毒真菌[6]。此外,Erdogan等[8]发现参与后发酵茶陈醇化的青霉属在较高温度条件下可产生赭曲霉毒素A等多种真菌毒素。并且,在黑茶陈化仓储或包装好的成品黑茶的存放过程中,由于其具有多孔径的特点,易吸湿受潮,导致微生物迅速繁殖而发生霉变,产生毒素,从而产生食品安全问题[9]。陈建玲等[10]曾对广州某茶叶市场高湿条件存储的普洱茶中多种生物毒素进行调查,多个样品中黄曲霉毒素B1(aflatoxin B1)及呕吐毒素(脱氧雪腐镰刀菌烯醇,deoxynivalenol)超标。对霉变黑茶的真菌种群进行多样性分析及代谢产物变化的研究较少,胥伟等[11]利用高通量测序技术分析了黑毛茶霉变过程中的真菌多样性,发现主要真菌种群为Aspergillus,且丰度值高达98%以上,其他检出的真菌丰度值较低。这些低丰度的真菌包括Galactomyces(地霉属)、Cryptococcus(隐球菌属)、Ogataea(甲醇诱导型酵母属)、Pichia(毕赤酵母属)、Debaryomyces(德巴利酵母属)。目前,关于霉变的六堡茶微生物及代谢物的相关研究未见报道。梁剑锋等[12]对不同年份、不同企业生产的10批次六堡茶进行了真菌多样性分析及真菌毒素残留量的测定,发现主要中真菌以Aspergillus、Penicillium(青霉菌属)为主,并尚未检测到黄曲霉毒素等常见茶叶毒素真菌代谢毒素残留。对六堡茶的微生物研究主要集中在渥堆、陈化过程以及成品茶微生物多样性分析。渥堆的六堡茶中被发现存在大量的霉菌、酵母、细菌,而陈化过程中的六堡茶中,检测到Blastobotrys、Penicillium、Aspergillus、Eurotium(散囊菌属)、Coprinellus(小鬼伞属)、Cystolepiota(囊小伞属)、Cymnoascus、Rasmsonia(蓝状菌属)以及Theirlavia,在陈化初期优势菌属为Aspergillus和Eurotium[13-14]。成品六堡茶中微生物多样性研究相对较多,但来自不同茶企的样品微生物差异较大,在一些报道中Aspergillus与Eurotium被认为是成品茶的优势菌属,而文献[15-17]利用高通量测序发现Blastobotrys是六堡茶的优势真菌。
为了解黑茶六堡茶的霉变机理,本研究通过微生物组及代谢组分析,研究霉变六堡茶中真菌群落及其代谢产物的变化,为揭示导致霉变六堡茶风味劣变的原因提供理论依据,并为六堡茶仓储中的品质检验及安全评估提供依据。
1. 材料与方法
1.1 材料与仪器
茶叶(优级茶) 成品茶,广西梧州纯好茶业有限公司;ITS5-1737F和ITS2-2043R(真菌ITS的PCR的引物)、Phusion® High-Fidelity PCR Master Mix with GC Buffer New England Biolabs公司;NEBNext® Ultra™ IIDNA Library Prep Kit试剂盒 QIAGEN公司。
Agilent 2100生物分析仪 Agilent Technologies;Qubit 2.0荧光光度计 Invitrogen公司; MM 400研磨仪 Retsch公司,色谱仪器为UPLC-ESI-MS/MS系统(UPLC,SHIMADZU Nexera X2;MS,Applied Biosystems 6500 Q TRAP) AB SCIEX。
1.2 实验方法
1.2.1 六堡茶样品处理
称取茶叶样品盛于培养皿(培养皿开口,每个培养皿15 g 茶样),分5层,每层15份放置于恒温恒湿箱,霉变样本(GGZ)采用恒温恒湿培养方法模拟高温条件下六堡茶仓储进行霉促培养(温度25 ℃,相对湿度RH 90%)[11]。对照样本(BDL)采用竹筐仓储(温度20~25 ℃、相对湿度RH 70%±5%)。对霉促样品进行观察,7 d左右肉眼可观察到茶叶表面有霉菌菌丝体生长,体式显微镜镜检有霉菌菌丝存在,17 d后试验茶样霉变率100%。此时,对霉变样本进行分层取样并迅速置于无菌袋中混合均匀密封保存(样品设3组重复,编号分别为:GGZ1、2、3),−20 ℃冻存。同时,对照样本取上层、中层、下层样品混合并迅速置于无菌袋中密封保存(样品设3组重复,编号分别为:BDL1、2、3)。分别进行内转录间区(Internal Transcribed Spacer,ITS)扩增子测序和代谢组学检测。
1.2.2 六堡茶样感官审评
聘请3位具有国家职业技能评茶员(一级)资质的专业人员组成审评小组,霉变茶样和对照茶样取样方法同1.2.1,要求茶样随机编号。样品制备员根据《GB/T 23776-2018 茶叶感官审评方法》取茶样3 g,150 mL沸水加盖浸泡2 min,审评汤色后进行第二次冲泡,时间为5 min,审评香气。评审小组根据《GB/T 23776-2018 茶叶感官审评方法》对茶样外形、汤色、香气进行审评,最终根据《GB/T14487-2017 茶叶感官审评术语》对霉变茶样和对照茶样的外形、汤色和香气给出全面描述。
1.2.3 ITS扩增子测序及分析
对于高通量扩增子测序,使用通用引物对ITS5-1737F/ITS2-2043R进行真菌ITS基因的PCR扩增,并使用NEBNext® Ultra™ IIDNA Library Prep Kit建库试剂盒进行文库构建和定量[18],使用NovaSeq6000进行上机测序。
使用FLASH(V1.2.11, http://ccb.jhu.edu/software/FLASH/)软件[19]、Usearch软件[20-21]进行数据质控,使用QIIME2软件中的DADA2模块[22]和classify-sklearn模块[23-24]并基于UNITE v8.2数据库分析获得ASVs丰度表和物种信息,并计算各样本的observed_otus、shannon、simpson等α多样性指数、Unifrac距离[25-26]。使用R软件中的ade4和ggplot2包来进行主坐标分析(PCoA,Principal Co-ordinates Analysis)[27]。使用LEfSe (LDA Effect Size)[28]和MetaStat方法[29]完成组间差异物种分析,其中LEfSe默认设置LDA score阈值为4、MetaStat进行差异性检验并将P值小于0.05的物种定义为组间显著差异性物种。
1.2.4 代谢组测序及分析
使用超高效液相色谱串联质谱(Ultra Performance Liquid Chromatography- Tandem mass spectrometry,UPLC-MS/MS)对茶叶样本中的代谢物进行定性定量。对样品进行真空冷冻干燥,用研磨仪在30 Hz下研磨1.5 min至粉末状,并取50 mg冻干粉溶解于1.2 mL 70%甲醇提取液中,每30 min涡旋30 s,共6次。以12000 r/min离心3 min后,过滤提取物(针头过滤器SCAA-104)使用UPLC-MS/MS分析。
使用UPLC-ESI-MS/MS系统(UPLC,SHIMADZU Nexera X2;MS,Applied Biosystems 6500 Q TRAP)。液相条件主要包括:谱柱:Agilent SB-C18 1.8 µm,2.1 mm×100 mm;流动相:A相为超纯水(0.1%的甲酸溶液),B相为乙腈(0.1%的甲酸);洗脱梯度:0~9.00 min内B相比例从5%线性增加到95%,并维持1 min,10.00~11.10 min,B相比例降为5%,并以5%平衡至14 min;流速0.35 mL/min;柱温40 ℃;进样量2 μL。质谱条件:电喷雾离子源(electrospray ionization,ESI)温度500 ℃;离子喷雾电压(IS)5500 V(正离子模式)/−4500 V(负离子模式);离子源气体I(GSI),气体II(GSII)和气帘气(CUR)分别设置为50、60和25 psi,碰撞诱导电离参数设置为高。在QQQ和LIT模式下分别用10和100 μmol/L聚丙二醇溶液进行仪器调谐和质量校准。QQQ扫描使用MRM模式,并将碰撞气体(氮气)设置为中等。通过进一步的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)优化,完成了各个MRM离子对的DP和CE。根据每个时期内洗脱的代谢物,在每个时期监测一组特定的MRM离子对。
基于自建数据库MWDB(metware database)和Analyst 1.6.3软件分析质谱数据,使用R包MetaboAnalystR v 1.0.1[30]从正交偏最小二乘法判别分析(OPLS-DA,Orthogonal Partial Least Squares-Discriminant Analysis)[31-32]识别差异代谢物。基于KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(http://www.kegg.jp/kegg/),对显著差异代谢物对应的通路进行代谢物集富集分析(MSEA,metabolite sets enrichment analysis)[33]。
1.2.5 组学关联分析
提取VIP最大的前20个差异代谢物与差异微生物进行关联分析[34],其中Spearman相关系数使用R软件的cor函数计算得到,使用R软件的WGCNA包的corPvalueStudent 函数对计算的相关性进行显著性检验,并使用R软件的corrplot包绘制相关性热图。差异微生物和代谢物的相关性|r|≥0.8且相关系数显著性检验的P<0.05定义为显著相关,并使用R软件的circlize包绘制相关性和弦图。
1.3 数据处理
对ITS扩增子测序和代谢组测序,GGZ组和BDL组各3个生物学重复。通过R统计函数prcomp进行无监督PCA(主成分分析)和OPLS-DA(正交偏最小二乘判别分析)[35],采用R软件包ComplexHeatmap v 2.8.0绘制热图。通过OPLS-DA结果中的变量重要性投影VIP值(Variable Importance in Projection,VIP)和Log2FC绝对值筛选组间显著差异的代谢物(VIP≥1且|log2FC|≥ 1.0)。KEGG通路差异丰度得分(DA Score,Differential Abundance Score)计算方法为:差异丰度得分=(该通路上调差异代谢物个数−该通路下调差异代谢物个数)/ 注释到该通路的所有代谢物个数。
2. 结果与分析
2.1 六堡茶感官审评
对茶样进行感官审评:正常茶叶样本干燥度较高,外观均整紧实,呈褐色;而霉变后的茶叶样本外观条索松散、呈棉柔感,可见大量灰白色霉点(图1)。冲泡后,正常茶叶样品汤色红明亮(图2),香气纯正,滋味醇正,叶底黄褐;霉变茶叶样品汤色红褐,表面有明显的悬浮物(图2),香闷显霉味,叶底黑褐色。感官审评结果表明霉变六堡茶无法维持六堡茶原有的“红浓陈醇”的特点,从本试验中真菌多样性分析和代谢组学分析结果也可以证明霉变六堡茶中真菌种类、含量、茶叶中内含物质均发生了变化,这些因素的综合作用导致霉变的六堡茶品质发生了明显改变。
2.2 霉变六堡茶微生物组成变化
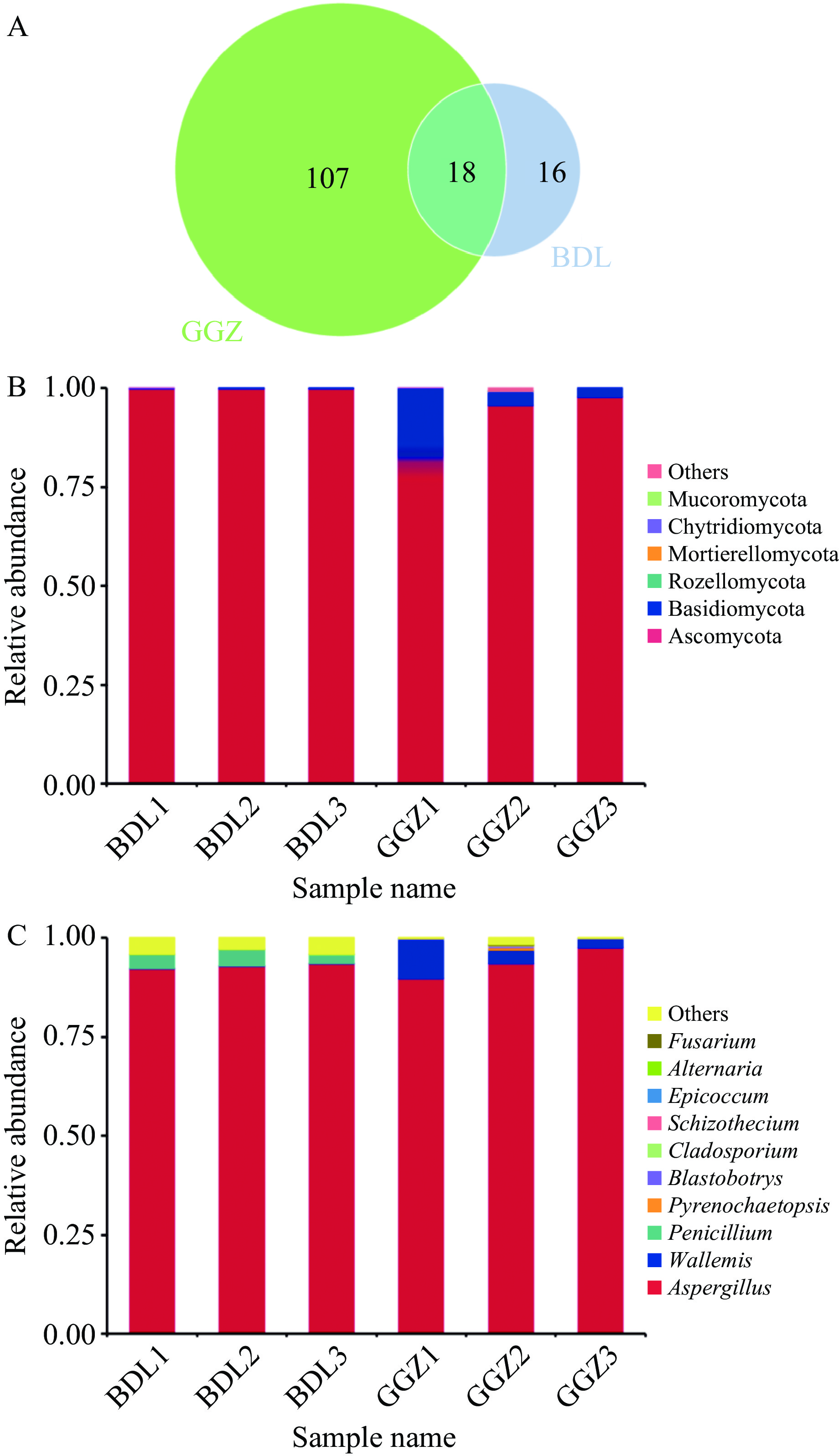
ITS扩增子测序深度达到平均双端测序读段数81385/样,其中Effective Tags比例在67%以上,平均约为68288/样(表1)。GGZ组和BDL组各检出125和34个ASVs,共有的ASVs数量为18(图3A)。GGZ组相对丰度较高的门为Ascomycota(子囊菌门,94.46%)和Basidiomycota(担子菌门,5.26%),而BDL组相对丰度较高的门主要为Ascomycota(99.95%)(图3B)。在属水平上,GGZ组主要由Aspergillus(93.59%)和Wallemia(节担菌属,5.23%)组成,而BDL组则主要包括Aspergillus(92.88%)和Penicillium(3.32%)(图3C)。
表 1 测序数据统计Table 1. Statistics of sequencing data样本名 序列数 Effective
Tags数目Effective Tags
碱基数(nt)Q20比例
(%)Q30比例
(%)有效序列
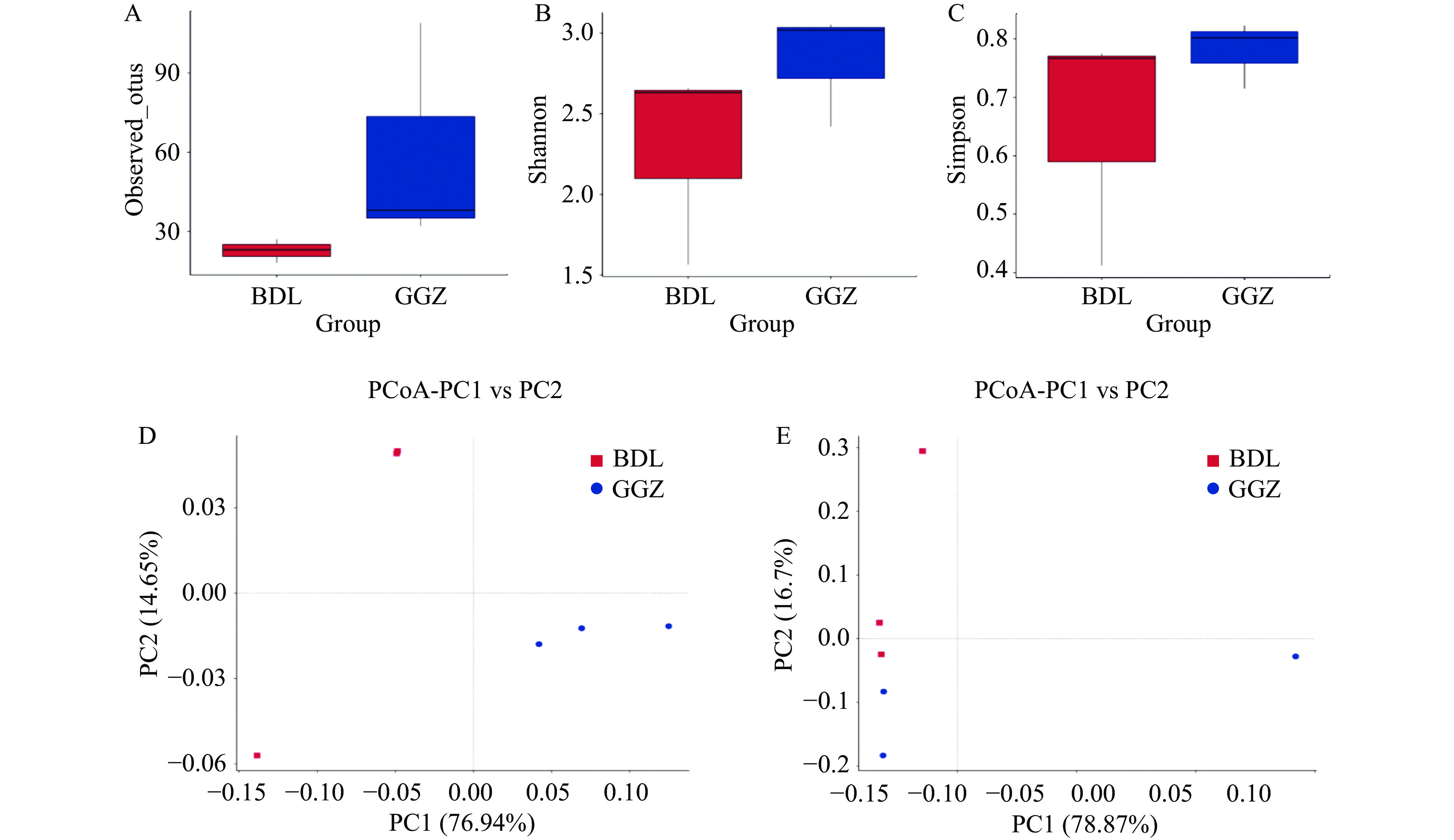
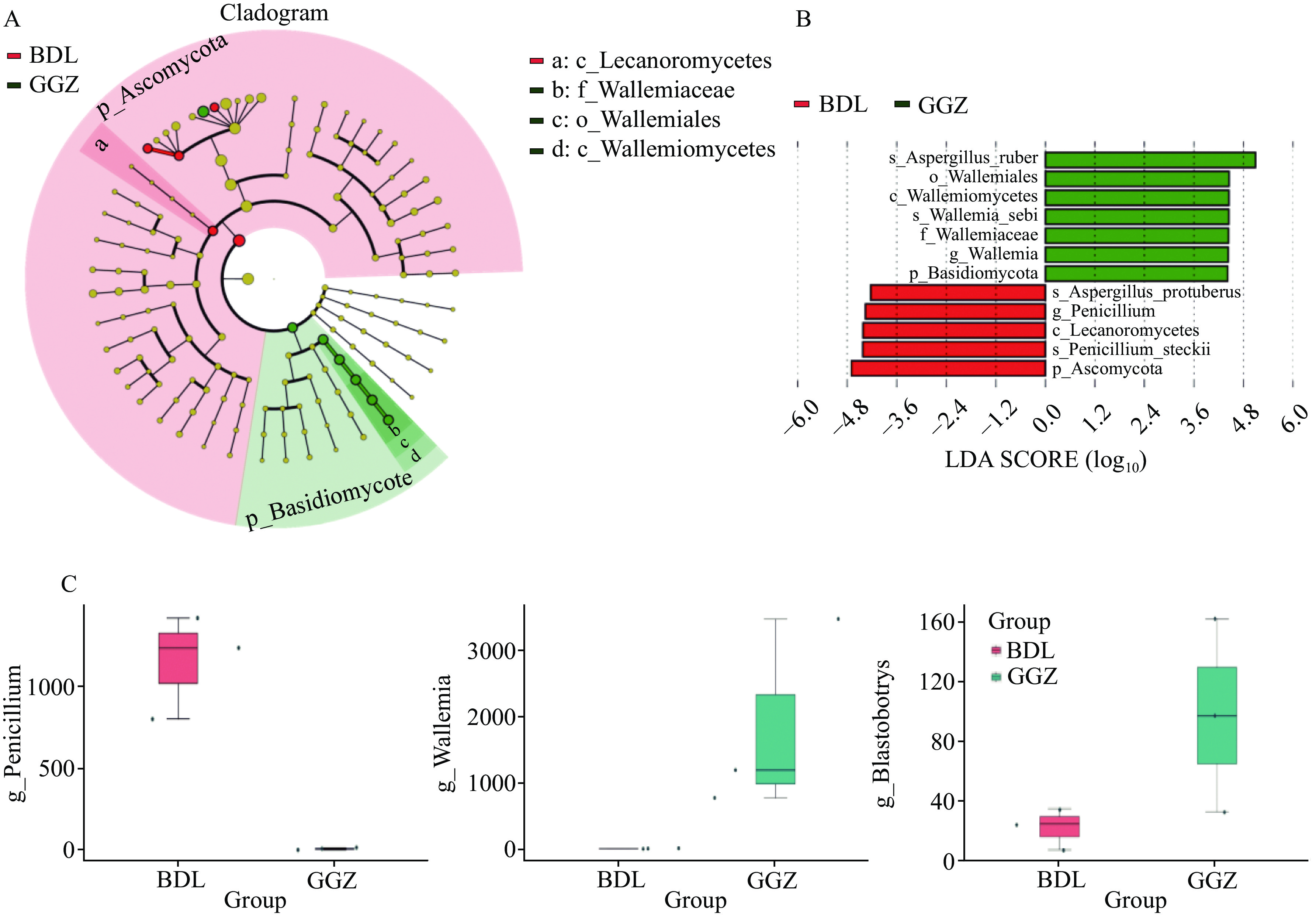
比例(%)BDL1 73249 49236 12790918 98.62 94.84 67.22 BDL2 84511 74081 19338308 98.56 94.61 87.66 BDL3 83043 58574 15039251 98.71 95.08 70.53 GGZ1 85663 81297 20549689 98.79 95.28 94.9 GGZ2 81092 76721 19431216 98.56 94.71 94.61 GGZ3 80754 69818 17432872 99 96.12 86.46 通过对两组样本的α多样性进行分析,结果表明GGZ组的observed_otus(图4A)、shannon(图4B)和simpson(图4C)指数在整体水平上都比BDL组高。进一步利用PCoA分析对两组样本的微生物群落构成进行降维,表明样本组内的样本距离较近,即物种组成结构相似,而组间群落差异则比较大(图4D~图4E)。另外,通过LEfSe分析识别了两组之间的差异物种,其中GGZ组在Basidiomycota、Wallemiomycetes(节担菌纲)、Wallemiales(节担菌目)、Wallemiaceae(节担菌科)、Wallemia以及A. ruber(赤曲霉)和Wallemia sebi种水平显著(P<0.05)高于BDL组,而在Ascomycota、Lecanoromycetes
(茶渍纲)、Penicillium以及P. steckii(歧皱青霉)和A. protuberus(疣梗曲霉)等水平显著(P<0.05)低于BDL组(图5A~图5B)。进一步使用MetaStat进行属水平上两个样本组之间的显著差异性物种分析,识别了三个显著差异的菌属,分别为在GGZ霉变样本组中下调的Penicillium和上调的Wallemia和Blastobotrys(图5C)。 2.3 霉变六堡茶代谢组学分析结果
通过UPLC-MS/MS代谢组分析,在GGZ和BDL两组样本中共检测到1207个代谢物。通过样品之间的相关性分析,发现组内生物学重复样品之间的皮尔逊相关系数(Pearson's Correlation Coefficient)≥0.89,高于组间样本相关性(0.59~0.74),这表明了代谢组数据的可靠性(图6A)。同时,PCA(图6B)和OPLS-DA(图6C)结果展示了各组之间代谢组分离趋势,提示样本组间的总体代谢物差异高于组内样本间的变异度大小。
差异代谢物分析结果表明,大部分黄酮类化合物(Flavonoids)、酚酸类化合物(Phenolic acids)、脂类(Lipids)、氨基酸及衍生物(Amino acids and derivatives)、有机酸(Organic acids)、木酚素和香豆素类化合物(Lignans and Coumarins)、单宁(Tannins)以及萜类化合物(Terpenoids)在GGZ组样本中显著高于BDL组,而核苷酸及衍生物(Nucleotides and derivatives)则在BDL组样本中显著高于GGZ组(图7A)。
![]() 图 7 差异代谢物和代谢通路富集分析注:A.对代谢物定量数据进行UV(unit variance scaling)处理后绘制的差异代谢物热图。红色代表高含量,绿色代表低含量;B.KEGG通路差异丰度得分(Differential Abundance Score,DA Score)图。线段端点的圆点大小表示该通路中差异代谢物的个数,线段和圆点颜色反映P-value大小,越接近红色表示P-value越小,越接近紫色表示P-value越大。Figure 7. Enrichment analysis of differential metabolites and metabolic pathways
图 7 差异代谢物和代谢通路富集分析注:A.对代谢物定量数据进行UV(unit variance scaling)处理后绘制的差异代谢物热图。红色代表高含量,绿色代表低含量;B.KEGG通路差异丰度得分(Differential Abundance Score,DA Score)图。线段端点的圆点大小表示该通路中差异代谢物的个数,线段和圆点颜色反映P-value大小,越接近红色表示P-value越小,越接近紫色表示P-value越大。Figure 7. Enrichment analysis of differential metabolites and metabolic pathways进一步通过对KEGG通路进行MSEA分析并计算其DA Score,发现苯丙氨酸代谢(Phenylalanine metabolism)、芥子油苷生物合成(Glucosinolate biosynthesis)、2−氧代羧酸代谢(2−Oxocarboxylic acid metabolism)、托烷、哌啶和吡啶生物碱生物合成(Tropane, piperidine and pyridine alkaloid biosynthesis)、苯丙氨酸、酪氨酸和色氨酸生物合成(Phenylalanine, tyrosine and tryptophan biosynthesis)、氨基酸生物合成(Biosynthesis of amino acids)、黄酮和黄酮醇生物合成(Flavone and flavonol biosynthesis)、乙醛酸和二羧酸代谢(Glyoxylate and dicarboxylate metabolism)、氧化磷酸化(Oxidative phosphorylation)、缬氨酸、亮氨酸和异亮氨酸降解(Valine, leucine and isoleucine degradation)、氰基氨基酸代谢(Cyanoamino acid metabolism)、氨酰基-tRNA生物合成(Aminoacyl−tRNA biosynthesis)、半乳糖代谢(Galactose metabolism)、光合作用(Photosynthesis)、丙酮酸代谢(Pyruvate metabolism)、三羧酸循环(Citrate cycle (TCA cycle))和酪氨酸代谢(Tyrosine metabolism)等通路显著(P<0.05) 上调,而咖啡因代谢(Caffeine metabolism)和嘌呤代谢(Purine metabolism)则显著(P<0.05) 下调(图7B)。
2.4 差异菌群与代谢变化之间的关系
差异菌属与VIP最大的前20个差异代谢物联合分析表明,在六堡茶中与菌属Penicillium显著负相关的差异代谢物包括mws0341(2-羟基异己酸)和mws0885(2,4-二羟基苯甲酸),而与Wallemia和Blastobotrys属呈显著正相关的差异代谢物则包括代谢物Hmgp002327(3-氨基-2-萘甲酸)、MWS1900(十一烷二酸)和Zmbp002538(1-Methoxy-indole-3-acetamide*,1-甲氧基-吲哚-3-乙酰胺*)等(图8A)。进一步构建了这3个菌属与差异代谢物的相关性和弦图(图8B),图中可见菌属Penicillium与大多数差异代谢物均呈负相关,而Wallemia和Blastobotrys属与大多数差异代谢物均呈正相关,表明这些代谢物可能是由于霉变过程中Penicillium减少而Wallemia和Blastobotrys增加所产生的。
3. 讨论与结论
试验结果表明,无论是霉变组还是对照组,相对丰度较高的门均包括Ascomycota。以往的研究中,六堡茶渥堆、陈化过程及成品中的微生物中的主要优势菌属Aspergillus、Eurotium,及其他被发现的优势菌属Penicillium等,均属于Ascomycota[17]。这些微生物可能源自茶叶原料、生产环境及储存环境等。
与BDL组不同的是,在GGZ组中,Basidiomycota丰度较高。进一步在属水平上细分,GGZ组中存在的Basidiomycota丰度较高的为Wallemia,且丰度显著高于BDL组的为W. sebi。Wallemia已被认为是人类肠道菌群中微量的具有潜在功能意义的共生真菌[36]。其常见于家庭灰尘中,并与食物变质有关[37]。W. sebi常在木材、干草、纺织品等环境中被发现,是最耐干的真菌之一。W. sebi的耐干特性可导致脱水的食物发霉,并且它被发现能引起花粉热症状,包括咳嗽、打喷嚏、眼睛发痒流泪、鼻子发痒以及鼻窦受压[38-39]。此外,尽管GGZ组与BDL组中,Aspergillus丰度均较高,但不同菌种的丰度存在差异。Aspergillus分布广泛,并且耐干,能够在最低的湿度水平上开始生长,并促进不太喜欢干燥的霉菌的入侵[40]。GGZ组种中丰度显著(P<0.05)高于BDL组的A. ruber,在咖啡豆、麦芽粉、茶叶以及土壤中均有发现。据报道,A. ruber可产生的代谢物包括茶叶中常见毒素黄曲霉毒素B1,蒽酮类化合物大黄素,大黄素甲醚,以及大黄素-大黄素甲醚型二蒽酮化合物[41-42]。尽管大黄素型蒽酮类化合物因具有泻下、利尿等作用而作为药物使用,但也被报道具有潜在的肝肾毒性风险、遗传毒性风险以及致癌性[43-45]。因此,尽管在霉变样本中并未检出可产生贮存的发酵茶中常见的黄曲霉毒素的A. flavus(黄曲霉)等菌种,但A. ruber可产生黄曲霉毒素B1及其他具有潜在毒性风险的代谢物,从而带来潜在的食品安全风险。后发酵茶若加工储存不当极易造成茶叶真菌毒素污染,且耐干的A. ruber与W. sebi可能在六堡茶吸湿较少的霉变初期发挥重要作用,引发茶叶的进一步霉变[6,38-40]。相比于对照组,霉变茶叶更易受到环境中产毒真菌的污染,具有潜在的食品安全风险,因此在六堡茶存储过程中需要加强周围环境中微生物污染的防控。
GGZ组中显著(P<0.05)上调的Blastobotrys属也在以往六堡茶微生物研究中多有发现,但尚没有关于该属的健康影响或毒性的资料,过敏原性也尚未被研究。GGZ组中显著下调的Penicillium,在六堡茶渥堆、陈化及成品各类样品中均有检测到,并且P. jiangxiense(江西青霉)及P. griseofulvum(灰黄青霉)被认为对六堡茶陈化具有重要作用,Penicillium的下调可能不利于六堡茶的陈化过程,进而影响茶叶的品质[46]。
在茶叶品质成分方面,以茶多酚、黄酮类为主的涩味物质,由咖啡因、儿茶素、花青素为主体的苦味物质,以及由游离氨基酸及部分络合物为主体的鲜味等是形成茶叶风味的重要物质[47]。GGZ组样本中大部分黄酮类化合物显著(P<0.05)高于BDL组,黄酮和黄酮醇生物合成通路上调,可引起霉变茶叶中涩味加重。霉变茶叶的鲜味可能受到氨基酸代谢变化的影响,GGZ组样本氨基酸合成通路上调的同时,缬氨酸、亮氨酸和异亮氨酸降解通路也有所上调,但鲜味受到具体影响有待进一步探究。霉变茶叶咖啡因代谢的下调可能引起茶叶苦味的改变。这些变化可能综合作用引起霉变茶叶冲泡后滋味改变。
代谢物中,GGZ组中与下调的Penicillium负相关的2-羟基异己酸,在医疗中被用作一种备用的局部抗菌剂,但其在达到10 mg/mL可产生一定细胞毒性及基因毒性[48],因此其在霉变六堡茶中上调可能带来健康风险。与Penicillium显著(P<0.05)负相关的2,4-二羟基苯甲酸,与Wallemia和Blastobotrys属呈显著(P<0.05)正相关的位于前列的差异代谢物3-氨基-2-萘甲酸、十一烷二酸和1-甲氧基-吲哚-3-乙酰胺,这些代谢物的相关研究极少,尚没有关于其毒性及对食品品质影响的报道,有待进一步深入研究这些代谢物对六堡茶品质及食品安全的影响。
综上,本研究发现赤曲霉和W. sebi为导致六堡茶霉变的优势真菌种群,并且可能带来潜在的食品安全风险;霉变六堡茶的代谢物变化可能影响茶叶的涩味、鲜味及苦味。此外,与微生物变化相关的代谢物可能对六堡茶品质及食品安全带来不利的影响,但这仍有待进一步验证。这些数据揭示了引发六堡茶霉变的潜在机理,为仓储中的六堡茶检验及安全评估提供了理论依据,并为六堡茶品质及食品安全的相关研究提供了新的方向。
-
图 7 差异代谢物和代谢通路富集分析
注:A.对代谢物定量数据进行UV(unit variance scaling)处理后绘制的差异代谢物热图。红色代表高含量,绿色代表低含量;B.KEGG通路差异丰度得分(Differential Abundance Score,DA Score)图。线段端点的圆点大小表示该通路中差异代谢物的个数,线段和圆点颜色反映P-value大小,越接近红色表示P-value越小,越接近紫色表示P-value越大。
Figure 7. Enrichment analysis of differential metabolites and metabolic pathways
表 1 测序数据统计
Table 1 Statistics of sequencing data
样本名 序列数 Effective
Tags数目Effective Tags
碱基数(nt)Q20比例
(%)Q30比例
(%)有效序列
比例(%)BDL1 73249 49236 12790918 98.62 94.84 67.22 BDL2 84511 74081 19338308 98.56 94.61 87.66 BDL3 83043 58574 15039251 98.71 95.08 70.53 GGZ1 85663 81297 20549689 98.79 95.28 94.9 GGZ2 81092 76721 19431216 98.56 94.71 94.61 GGZ3 80754 69818 17432872 99 96.12 86.46 -
[1] 石荣强, 温立香, 曾玉凤, 等. 六堡茶品质研究进展[J]. 中国茶叶加工,2020(2):43−47. [SHI R, WEN L, CENG Y, et al. Research progress on quality of Liupao tea[J]. China Tea Processing,2020(2):43−47. [2] 全国茶叶标准化技术委员会. GB/T 32719.4-2016黑茶. 第4部分: 六堡茶[S]. 北京: 中国标准出版社, 2016 National Tea Standardization Technical Committee. GB/T 32719.4-2016 Dark tea. Part 4: Liupu tea [S]. Beijing: Standards Press of China, 2016.
[3] 马士成, 杨麦. 广西地理标志产品六堡茶[M]. 北京: 中国工商出版社, 2019: 17−19 MA S, YANG M. Guangxi geographical indication product Liubao tea[M]. Beijing: China Industry and Commerce Press, 2019: 17−19.
[4] ZHU M Z, LI N, ZHOU F, et al. Microbial bioconversion of the chemical components in dark tea[J]. Food Chemistry,2020:312.
[5] 谢雨, 文兆明, 杜超年, 等. 略论六堡茶后发酵工艺[J]. 广西农学报,2015,30(3):41−42,46. [XIE Y, WEN Z, DU C, et al. Discussion on post-fermentation process of Liupu tea[J]. Journal of Guangxi Agriculture,2015,30(3):41−42,46. [6] SEDOVA I, KISELEVA M, TUTLYAN V. Mycotoxins in tea: Occurrence, methods of determination and risk evaluation[J]. Toxins,2018,10(11):444−462. doi: 10.3390/toxins10110444
[7] 李静榕, 毛世红, 覃观凤, 等. 茶叶中真菌毒素风险评估及防控研究进展[J]. 食品安全质量检测学报,2022,13(19):6354−6360. [LI J, MAO S, QIN G, et al. Research progress in risk assessment and prevention control of mycotoxins in tea[J]. Journal of Food Safety and Quality,2022,13(19):6354−6360. [8] ERDOGAN A, SERT S. Mycotoxin-forming ability of two Penicillium roqueforti strains in blue moldy tulum cheese ripened at various temperatures[J]. J Food Prot,2004,67(3):533. doi: 10.4315/0362-028X-67.3.533
[9] 胥伟, 赵仁亮, 姜依何, 等. 湖南黑毛茶等温吸湿模型建立及霉变安全性研究[J]. 食品科学,2018,39(7):27−32. [XU W, ZHAO R, JIANG Y, et al. Modeling moisture absorption isotherms of hunan raw dark tea and evaluating its mildew degree[J]. Food Science,2018,39(7):27−32. doi: 10.7506/spkx1002-6630-201807005 [10] 陈建玲, 李文学, 杨光宇, 等. 广州某茶叶市场普洱茶中多种生物毒素污染现状调查[J]. 癌变畸变突变,2011,23(1):68−71. [CHEN J, LI W, YANG G, et al. Biological contamination of Puer tea in a Guangzhou tea market[J]. Carcinogenesis, Teratogenesis & Mutagenesi,2011,23(1):68−71. [11] 胥伟, 姜依何, 吴丹, 等. 高通量测序研究霉变黑毛茶的真菌多样性[J]. 茶叶科学,2017,37(5):483−492. [XU W, JIANG Y, WU D, et al. RNA sequencing analysis of fungi community diversity in mildew raw dark tea[J]. Journal of Tea Science,2017,37(5):483−492. doi: 10.3969/j.issn.1000-369X.2017.05.007 [12] 梁剑锋, 李亚, 宾月景, 等. 梧州六堡茶中真菌多样性分析及真菌毒素残留量的测定[J]. 食品研究与开发,2022,43(15):195−200. [LIANG J, LI Y, BIN Y, et al. Fungal diversity and mycotoxin residues in Wuzhou Liupao tea[J]. Food Research and Development,2022,43(15):195−200. [13] 杨娟, 陈欣怡, 丁子元, 等. 六堡茶真菌多样性分析和优势真菌的分离筛选[J]. 茶叶通讯,2022,49(3):353−362. [YANG J, CHEN X, DING Z, et al. Diversity analysis and screening of dominant fungi in Liupao tea[J]. Journal of Tea Communication,2022,49(3):353−362. [14] 陈庆金, 黄丽, 滕建文, 等. 基于Miseq测序分析六堡茶陈化初期真菌多样性[J]. 食品科技,2015,40(8):67−71. [CHEN Q, HUANG L, TENG J, et al. Fungal community of Liupao tea during the early aging process by high-throughput sequencing technologies with Miseq[J]. Food Science and Technology,2015,40(8):67−71. [15] 陈然, 郝彬秀, 田海霞, 等. 六堡茶真菌分布浅析及金花菌筛选鉴定[J]. 食品科技,2016,41(4):19−23. [CHEN R, HAO B, TIAN H, et al. Distribution of fungal strains and molecular identification of Eurotium cristatum in Liupao tea[J]. Food Science and Technology,2016,41(4):19−23. doi: 10.13684/j.cnki.spkj.2016.04.004 [16] 杨雅焯, 汪迎, 李辉, 等. 广西六堡茶和重庆沱茶的微生物多样性分析[J]. 茶叶学报,2019,60(3):93−98. [YANG Y, WANG Y, LI H, et al. Microbial diversity of guangxi Liubao and Chongqing bowl teas[J]. Acta Tea Sinica,2019,60(3):93−98. [17] 杜金杰, 刘晓纯, 吴新慧, 等. 六堡茶微生物多样性研究进展[J]. 广东茶业,2021(4):2−8. [DU J, LIU X, WU X, et al. Research progress on microbial diversity of Liubao tea[J]. Guangdong Tea,2021(4):2−8. [18] XUE F, LIU T. DNA sequence and community structure diversity of multi-year soil fungi in Grape of Xinjiang[J]. Scientific Reports,2021,11(1):16367. doi: 10.1038/s41598-021-95854-2
[19] MAGOČ T, SALZBERG S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics,2011,27(21):2957−2963. doi: 10.1093/bioinformatics/btr507
[20] HAAS B J, GEVERS D, EARL A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research,2011,21(3):494−504. doi: 10.1101/gr.112730.110
[21] MIAO S, ZHAO C, ZHU J, et al. Dietary soybean meal affects intestinal homoeostasis by altering the microbiota, morphology and inflammatory cytokine gene expression in northern snakehead[J]. Scientific Reports,2018,8(1):113. doi: 10.1038/s41598-017-18430-7
[22] CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al. DADA2: High-resolution sample inference from Illumina amplicon data[J]. Nature Methods,2016,13(7):581. doi: 10.1038/nmeth.3869
[23] BOKULICH N A, KAEHLER B D, RIDEOUT J R, et al. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2's q2-feature-classifier plugin[J]. Microbiome,2018,6(1):90. doi: 10.1186/s40168-018-0470-z
[24] BOLYEN E, RIDEOUT J R, DILLON M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology,2019,37(8):852−857. doi: 10.1038/s41587-019-0209-9
[25] LOZUPONE C, LLADSER M E, KNIGHTS D, et al. UniFrac: an effective distance metric for microbial community comparison[J]. The ISME Journal,2011,5(2):169−172. doi: 10.1038/ismej.2010.133
[26] HARRISON K, CURTIN C. Microbial composition of scoby starter cultures used by commercial kombucha brewers in North America[J]. Microorganisms,2021,9(5):1060. doi: 10.3390/microorganisms9051060
[27] MINCHIN P R. An evaluation of the relative robustness of techniques for ecological ordination[J]. Vegetatio,1987,69(1/3):89−107.
[28] SEGATA N, IZARD J, WALDRON L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology,2011,12(6):R60. doi: 10.1186/gb-2011-12-6-r60
[29] WHITE J R, NAGARAJAN N, POP M. Statistical methods for detecting differentially abundant features in clinical metagenomic samples[J]. PLoS Computational Biology,2009,5(4):e1000352. doi: 10.1371/journal.pcbi.1000352
[30] CHONG J, XIA J. MetaboAnalystR: An R package for flexible and reproducible analysis of metabolomics data[J]. Bioinformatics,2018,34(24):4313−4314. doi: 10.1093/bioinformatics/bty528
[31] THÉVENOT E A, ROUX A, XU Y, et al. Analysis of the human adult urinary metabolome variations with age, body mass index, and gender by implementing a comprehensive workflow for univariate and opls statistical analyses[J]. Journal of Proteome Research,2015,14(8):3322−3335. doi: 10.1021/acs.jproteome.5b00354
[32] ZHOU Y, SHAO L, ZHU J, et al. Comparative analysis of tuberous root metabolites between cultivated and wild varieties of Rehmannia glutinosa by widely targeted metabolomics[J]. Scientific Reports,2021,11(1):11460. doi: 10.1038/s41598-021-90961-6
[33] CHEN Y, HUANG R, DING J, et al. Multiple myeloma acquires resistance to EGFR inhibitor via induction of pentose phosphate pathway[J]. Scientific Reports,2015,5:9925. doi: 10.1038/srep09925
[34] LU K, ABO R P, SCHLIEPER K A, et al. Arsenic exposure perturbs the gut microbiome and its metabolic profile in mice: An integrated metagenomics and metabolomics analysis[J]. Environmental Health Perspectives,2014,122(3):284−291. doi: 10.1289/ehp.1307429
[35] JOLLIFFE I T. Principal component analysis[J]. Journal of Marketing Research,1986,87(100):513.
[36] LIGUORI G, LAMAS B, RICHARD M L, et al. Fungal dysbiosis in mucosa-associated microbiota of crohn's disease patients[J]. Journal of Crohn's and Colitis,2016,10(3):296−305. doi: 10.1093/ecco-jcc/jjv209
[37] CEVASCO M. 1.11-Microbial eukaryotic diversity and function within the human gut microbiota[J]. Comprehensive Gut Microbiota,2022:127−142.
[38] ZALAR P, SYBREN DE, HOOG G, et al. Taxonomy and phylogeny of the xerophilic genus Wallemia (Wallemiomycetes and Wallemiales, cl. et ord. nov.)[J]. Antonie Van Leeuwenhoek,2005,87(4):311−328. doi: 10.1007/s10482-004-6783-x
[39] ZAJC J, GUNDE-CIMERMAN N. The genus Wallemia—from contamination of food to health threat[J]. Microorganisms,2018,6(2):46. doi: 10.3390/microorganisms6020046
[40] KOZAKIEWICZ Z. Aspergillus species on stored products[J]. Mycological Papers,1989,161(3).
[41] LEITAO J, LE BARS J, BAILLY JR. Production of aflatoxin B1 by Aspergillus ruber THOM and CHURCH[J]. Mycopathologia,1989,108(2):135−138. doi: 10.1007/BF00436064
[42] CHEN AJ, HUBKA V, FRISVAD JC, et al. Polyphasic taxonomy of Aspergillus section Aspergillus (formerly Eurotium), and its occurrence in indoor environments and food[J]. Studies in Mycology,2017,88:37−135. doi: 10.1016/j.simyco.2017.07.001
[43] 宋琬晨, 郭婉霜, 郑伟娟. 大黄素型蒽醌类化合物肝肾毒性的分子机制研究[J]. 药物生物技术,2020,27(2):149−153. [SONG W, GUO W, ZHENG W. Study on the molecular mechanism of hepatorenal toxicity of emodin-type anthraquinone compounds[J]. Pharmaceutical Biotechnology,2020,27(2):149−153. [44] 萧惠来. 欧洲药品管理局(EMA)对大黄药用的评估报告及有关启示[J]. 药物评价研究,2021,44(1):45−55. [XIAO H. EMA assessment report on medical rhubarb and its enlightenment[J]. Drug Evaluation Research,2021,44(1):45−55. [45] 汪祺, 杨建波, 文海若, 等. 大黄素-大黄素甲醚型二蒽酮化合物安全性研究[J]. 中国现代中药,2022,24(8):1425−1430. [WANG Q, YANG J, WEN R, et al. Safety of emodin-emodin physcion dianthrones[J]. Modern Chinese Medicine,2022,24(8):1425−1430. doi: 10.13313/j.issn.1673-4890.20220317004 [46] 欧惠算, 邓旭铭, 张灵枝, 等. 汽蒸前后六堡茶中优势微生物的分离鉴定[J]. 广东农业科学,2017,44(2):129−135,193. [OU H, DENG X, ZHANG L, et al. Isolation and identification of dominant microorganisms of Liupao tea before and after steaming[J]. Guangdong Agricultural Sciences,2017,44(2):129−135,193. [47] 王茹茹, 肖孟超, 李大祥, 等. 黑茶品质特征及其健康功效研究进展[J]. 茶叶科学,2018,38(2):113−124. [WANG R, XIAO M, LI D, et al. Recent advance on quality characteristics and health effects of dark tea[J]. Journal of Tea Science,2018,38(2):113−124. doi: 10.3969/j.issn.1000-369X.2018.02.001 [48] SELIS D, PANDE Y, SMOCZER C, et al. Cytotoxicity and genotoxicity of a new intracanal medicament, 2-hydroxyisocaproic acid-an in vitro study[J]. J Endod,2019,45(5):578−583. doi: 10.1016/j.joen.2019.01.012
-
期刊类型引用(5)
1. 董洪宇,赵程澄,任战军,谢辉,王淑辉. 基于电子鼻和GC-MS技术探究不同林麝饲料的风味特征. 中国饲料. 2025(01): 117-125 .  百度学术
百度学术
2. 屠大伟,陈小鸿,黄永强,胡霞,王烁超,刘文俊. 基于电子鼻、GC-MS结合感官评价分析丰都麻辣鸡调料风味特征. 食品与发酵工业. 2024(01): 293-301 .  百度学术
百度学术
3. 付劭杰,毕金峰,曹风,刘梦,姜溪雨,陈宇航,陈文艺,刘璇. 非浓缩还原苹果汁贮藏期颗粒稳定性与果胶结构相关性研究. 核农学报. 2024(10): 1941-1950 .  百度学术
百度学术
4. 屠大伟,翁盈秋,李青青,冯露萍,刘文俊. 火锅常用干辣椒品质及挥发性成分研究. 食品工业科技. 2023(16): 358-366 .  本站查看
本站查看
5. 张帅,吴水金,林宝妹,李海明,吴妙鸿,戴艺民. 福建6个香牙蕉品种(品系)后熟过程中挥发性风味成分的变化. 中国果树. 2023(11): 61-69+80 .  百度学术
百度学术
其他类型引用(2)






 下载:
下载:




 下载:
下载:



