Separation, Purification and Antioxidant Activity of Selenium Polysaccharide from Selenium-enriched Grapes
-
摘要: 本文以克瑞森(小粒)富硒葡萄为原料,通过提取、分离纯化得到硒多糖提取物(selenium polysaccharide,sKGP),并对其理化性质、结构特征及抗氧化活性进行了研究。采用超声波辅助酶法提取,用二乙氨基乙基交联葡聚糖凝胶A-25(DEAE-SephadexA-25)层析柱分离纯化得到高纯度硒多糖组分,通过紫外光谱、液质、傅里叶红外、扫描电镜等对其活性官能团及其结构进行鉴定,并对其抗氧化活性指标进行了分析。结果表明:sKGP硒含量为(0.642±0.038)mg/kg;纯化后sKGP-3几乎不含核酸、蛋白质等;sKGP-3由鼠李糖、木糖、阿拉伯糖、甘露糖、葡萄糖和果糖组成,摩尔比为0.172:0.743:0.718:0.082:4.540:0.093;sKGP-3具有Se=O、Se-H结构和多糖的典型特征峰;sKGP-3主要呈片状和丝状,属于非晶态。体外抗氧化活性评估表明,纯化前sKGP具有比同质量浓度多糖(grape polysaccharide,KGP)更高的抗氧化活性,sKGP的总抗氧化能力为8.499 μmol/mL,DPPH自由基、羟自由基、ABTS+自由基清除率分别为69.7%、85.8%和92.5%。Abstract: In this paper, selenium polysaccharide (sKGP) extract was obtained by extraction, separation and purification of selenium-enriched creeson grape, then its physicalchemical properties, structural characteristics and antioxidant activity were studied. The selenium polysaccharide was extracted by ultrasonic-assisted enzymatic, separated and purified by diethylaminoethyl cross-linked dextran gel chromatography column. Its active functional groups and structures were identified by UV, LC-MS, fourier IR and SEM, and the antioxidant activity indexes were also analyzed. The results showed that the content of selenium in sKGP-3 was (0.642±0.038) mg/kg, and the purified sKGP-3 contained almost no nucleic acid and protein, the sKGP-3 was composed of rhamnose, xylose, arabinose, mannose, glucose and fructose, the molar ratio was 0.172:0.743:0.718:0.082:4.540:0.093. The sKGP-3 had the structure of Se=O, Se-H and typical characteristic peaks of polysaccharides, and the shape of the sKGP-3 was mainly lamellar and filamentous, belonging to amorphous state. The evaluation of antioxidant activity in vitro showed that the sKGP had higher antioxidant activity than the polysaccharide (KGP) of the same concentration before purification, the total antioxidant capacity of sKGP was 8.499 μmol/mL, and the scavenging capacity of DPPH, hydroxyl radicals and ABTS+ radicals were 69.7%, 85.8% and 92.5%, respectively.
-
硒是人体健康必需的微量营养素,是许多抗氧化酶的辅助因子,如硒代半胱氨酸是谷胱甘肽过氧化物酶的活动中心[1],由于硒不能在人体内自行合成,只能从食物链或其他补硒途径中获得[2]。硒以无机和活性有机形式存在于生物系统中,无机硒的神经毒性是有机硒的40倍[3],有机硒(如硒多糖)具有更高的生物活性和利用率,更容易被人体胃肠道吸收,并显示出较高的剂量阈值[4],在食品和医药行业具有潜在价值,因此开发有机硒膳食补充剂对人类健康具有重要意义[5]。
多糖与纳米硒有机结合形成的硒多糖不仅将无机硒转化为有机硒,而且形成独特的硒氧键,在抗氧化、抗肿瘤以及提高免疫力等方面生物活性明显优于天然多糖和硒元素[6]。Zhu等[7]研究发现,合成的蛹虫草硒多糖(SeCSP-I)表现出比天然多糖(CSP)更强的DPPH、羟基和超氧自由基清除能力。此外,Ma等[8]研究报告称,平菇硒多糖能调节凋亡相关蛋白Bcl-2、Bax、Nrf2和cleaved caspase-3的表达水平进而诱导肿瘤细胞死亡。目前在植物或微生物中获取的天然硒多糖种类少、含量低、结构复杂[9-10],限制硒多糖深入研究与应用。大多数研究人员主要通过植物转化、硒化修饰或微生物转化的化学合成法从富硒植物中分离硒多糖[11],如卡拉胶硒化物、茶硒多糖、枸杞硒多糖、黄芪硒多糖等[12]。
克瑞森(小粒)无核葡萄,别名克里森无核,于1998年引种到新疆干旱戈壁地区,其果实具有质优味美、坐果率高、耐贮运、抗病性强等优点,深受消费者和栽培者的喜爱[13]。研究表明,由于新疆独特的气候条件和地理优势,种植的葡萄糖含量较高,而多糖是葡萄主要活性成分之一[14],通过对克瑞森叶面喷硒处理,将硒与植物多糖结合转化为有机硒,不仅能避免人体吸收无机硒所带来的毒害,而且保留了多糖的生物和药理活性,弥补多糖生物活性低的缺陷,进一步加强多糖与硒的协同作用[15]。多糖与硒的相对分子量、单糖组成和结构等对硒多糖的生物功能发挥着重要作用[16]。目前对葡萄中的硒多糖报道较少且主要将无机硒亚硒酸钠(Na2SeO3)和硒酸钠(Na2SeO4)作为外源硒肥使植物富硒,无机硒过量会对人体产生毒性效应,本试验利用低毒高效的纳米硒培养富硒葡萄,对葡萄硒多糖的结构特征和生物活性进一步研究,为硒多糖的开发和利用提供理论依据。
鉴于硒多糖益处,本工作选取克瑞森(小粒)葡萄品种,利用植物机体代谢与转化合成硒多糖,然后将硒多糖组分提取、分离纯化和结构鉴定,并评估其相关的体外抗氧化活性,开发一条安全、高效、绿色的补硒途径。
1. 材料与方法
1.1 材料与仪器
‘克瑞森’(小粒)葡萄 试验于2021年5~9月在新疆生产建设兵团第二师223团葡萄试验田进行,土壤为碱性砂壤土;选取树龄及树体生长状况一致、无病虫害且树势健壮的8年生‘克瑞森’(小粒)葡萄为试验品种;在‘克瑞森’(小粒)盛花期后25 d(6月11日小幼果期)、70 d(7月26日转色期)各喷一次浓度为0.61 L/亩叶面硒肥,对照组(CK)喷施等量清水,田间管理等同常规;叶面纳米硒植物营养剂(有效硒含量0.5%) 紫阳中地大硒科技有限公司;标准单糖、DEAE-Sephadex A-25、纤维素酶(5万U/g)、抗氧化试剂盒 北京索莱宝科技有限公司;所有药品或试剂 均为国产色谱纯、优级纯或分析纯。
BioLogic LP层析系统 广州市深华生物技术有限公司;液相色谱-质谱联用仪 美国Agilent公司;Bruker Vertex 70v傅里叶红外光谱仪 德国布鲁克公司;SU8010场发射扫描电子显微镜 日本日立科学仪器有限公司;UV-3200s紫外-可见分光光度计 上海美谱达仪器有限公司;AFS-9330氢化物发生原子荧光光谱 北京吉天仪器有限公司。
1.2 实验方法
1.2.1 葡萄硒多糖的制备
从12串果穗的上、中、下位置随机摘取350 g果实,用自来水冲洗干净,再用去离子水洗涤3遍,沥干水滴于105 ℃电热鼓风干燥箱中灭酶30 min后,降温至70 ℃烘干至恒重,将干燥的果实磨成粉过100目筛,4 ℃冰箱内密封保存备用。
硒多糖提取方法参照Wang等[6]改动。称取葡萄干粉按固:液=1:20的量浸泡在超纯水中,加入1.0%的纤维素酶(占葡萄粉干重),置于60 ℃的恒温水浴锅中酶解浸提1 h,再超声(功率100 W)提取60 min后7000 r/min离心10 min,吸取上清液,重复此操作3次,合并上清液混匀,置于旋转蒸发仪上减压浓缩(浓缩体积约为原液的1/10,温度≤50 ℃),将浓缩液与95%乙醇按体积比1:4混合,在4 ℃条件下醇沉12 h,离心(5000 r/min,10 min)弃去上清液,收集沉淀物烘干(30 ℃)得到粗硒多糖(sKGP)。粗多糖(KGP)用同样方法处理做对照。
1.2.2 葡萄硒多糖理化性质测定
采用硫酸-蒽酮比色法测定KGP和sKGP的多糖含量,以无水葡萄糖为标准品,用超纯水配制成0.01、0.02、0.04、0.06、0.08、0.10 mg/mL的系列标准溶液(A=0.44333C+0.21917,R2=0.9997)。通过考马斯亮蓝G-250比色法测定蛋白质含量,将牛血清白蛋白(BSA)配制成0.05、0.10、0.15、0.20、0.25 mg/mL的标准溶液(A=2.67431C−0.00766,R2=0.9998)。用氢化物发生原子荧光光谱法(HG-AFS)[17]测定总硒含量,将硒标准溶液配制成1、2、5、10、15、20 μg/L的质量浓度(线性回归方程为Ⅰ=169.77794C−1.04183,R2=0.9999)。
1.2.3 葡萄硒多糖分离纯化
采用壳聚糖法[18]去除KGP和sKGP中的色素:将6 g硒多糖干粉加150 mL超纯水,室温超声至完全溶解,用HCl调节样液pH为5.0,添加含5%的壳聚糖溶液30 mL(体积比5:1),在37 ℃条件下振荡1 h,离心过滤(4000 r/min,10 min);再用盐析法[19]脱除KGP和sKGP中的蛋白质:将脱色后的硒多糖溶液,用浓度为2%的NaOH调节pH至8~9,添加10% CaCl2固体粉末,在85 ℃热水中搅拌10 min,待溶液冷却后离心(4000 r/min,10 min),收集上层水相,将溶液放入透析袋(14000 Da)中流水透析48 h,再用超纯水透析24 h,以除去硒多糖溶液中的无机盐等小分子杂质,透析液浓缩、冷冻干燥。
将上述初步纯化的KGP和sKGP粉末用超纯水配制成5 mg/mL的溶液,滤膜(0.45 μm)过滤,在DEAE-Sephadex A-25(1.6 cm×30 cm)层析柱上分离纯化,上样体积10 mL,分别用超纯水、0.1、0.5、1 mol/L NaCl溶液梯度洗脱,洗脱流速1 mL/min,用自动馏分收集器逐一收集洗脱液,每管收集2 mL。将每管洗脱液用硫酸-蒽酮法跟踪监测多糖含量,一直洗脱至多糖溶液检测呈阴性为止。将同一洗脱峰的各管洗脱液合并后浓缩、透析(3500 Da)、冷冻干燥,得到各组分精制葡萄硒多糖。
脱色率、脱蛋白率和多糖保留率计算公式如下:
脱色率(%)=脱色前吸光度−脱色后吸光度脱色前吸光度×100 (1) 多糖保留率(%)=脱色后多糖含量脱色前多糖含量×100 (2) 脱蛋白率(%)=脱蛋白前吸光度−脱蛋白后吸光度脱蛋白前吸光度×100 (3) 多糖保留率(%)=脱蛋白后多糖含量脱蛋白前多糖含量×100 (4) 1.2.4 葡萄硒多糖组分结构鉴定
1.2.4.1 单糖组成分析
标准曲线的制备:参照王川丕等[20]的方法。
硒多糖水解:称取KGP-3、sKGP-3(20 mg)纯化样品,加入4 mL 2 mol/L的三氟乙酸(TFA),在密封安瓿瓶中沸水浴水解5.5 h,超声(功率100 W)30 min后,将水解产物用氮吹仪吹干,加入3 mL甲醇再吹干,重复此操作3次,以完全除去残留的TFA后定容至2 mL,涡旋2 min,过0.22 μm有机滤膜,通过超高效液相色谱-三重四极杆质谱(UPLC-MS/MS)分析。
色谱条件:色谱柱:XBridge BHE Amide(4.6×250 mm,5 μm);流动相A:超纯水-氨水溶液(0.1%氨水),流动相B:乙腈-氨水溶液(0.1%氨水);流速:0.6 mL/min;进样量:5 μL;柱温:30 ℃;运行时间:17 min;洗脱方式:梯度洗脱,程序见表1。
表 1 梯度洗脱程序Table 1. Mobile phase gradient洗脱时间(min) 流速(mL/min) 流动相A(%) 流动相B(%) 0 0.6 20 80 10 0.6 40 60 12 0.6 40 60 12.01 0.6 20 80 18 0.6 20 80 质谱条件:离子化模式:电喷雾ESI,负离子扫描;扫描模式:多反应监测MRM;离子源温度:550 ℃;离子源电压(IS):−5500 V;气帘气(CUR):35 psi;雾化气(GS1):50 psi;辅助气(GS2):50 psi;离子源温度(TEM):500 ℃;碰撞气(CAD):8 psi;选择监测离子(m/z):每种单糖分别选择1对定量离子对,2对定性离子对。单糖质谱分析参数见表2。
表 2 6种单糖的监测离子参数设定表Table 2. Setting of monitoring ion parameters of six monosaccharides单糖 保留时间(min) 监测离子对(m/z) 去簇电压(V) 碰撞气能量(eV) 鼠李糖 8.55 162.9>59.1*
162.9>89.0−77
−77−12
−20木糖 9.73 149.0>59.0*
149.0>89.1−70
−70−9
−22阿拉伯糖 9.98 149.0>59.0*
149.0>89.1−70
−70−9
−22果糖 10.62 178.9>59.1
178.9>89.0*−70
−70−13
−25甘露糖 11.14 178.9>59.1
178.9>89.0*−70
−70−13
−25葡萄糖 11.64 179.0>89.1*
179.0>71.0−70
−70−12
−22注:*表示定量离子对。 1.2.4.2 紫外光谱(UV)分析
将KGP-3、sKGP-3组分配制成0.5 mg/mL的溶液,用紫外-可见分光光度计在200~400 nm的波长范围内扫描,根据紫外扫描图初步判断样品中是否含有蛋白质、肽及核酸等[21]。
1.2.4.3 傅里叶红外光谱(FT-IR)分析
将KGP-3、sKGP-3(1 mg)与100 mg干燥的KBr粉末混合研磨,压制成薄片,通过FT-IR在4000~500 cm−1的频率范围内进行测定,观察出峰情况[22]。
1.2.4.4 扫描电镜(SEM)分析
使用场发射扫描电子显微镜观察KGP-3、sKGP-3的表面形态特征。将样品用导电胶黏附于金属铁块上,然后用离子溅射镀膜机喷镀金粉,调整加速电压为5.0 kV,在10.0 k的放大倍数下观察样品形态[23]。
1.2.5 体外抗氧化活性测定
1.2.5.1 总抗氧化能力测定
采用T-AOC试剂盒测定。将试剂1、试剂2和试剂3按照1:2:0.5的比例混合。精密吸取上述混合液900 μL,依次加入30 μL不同浓度(0.20、0.25、0.50、0.75、1.00、1.25 mg/mL)的KGP、sKGP待测液,再添加90 μL超纯水充分涡旋混匀,反应10 min后,在520 nm处测定吸光度,重复3次取均值,T-AOC标准曲线方程为y=5.8565x+0.0440,R2=0.9999。
1.2.5.2 DPPH自由基清除能力测定
参照Teng等[24]的方法进行评估,并做修改。将DPPH无水乙醇溶液(0.2 mmol/L,975 μL,现配现用)与25 μL不同浓度(1.25、1.75、2.50、3.50、4.00、4.50 mg/mL)的KGP、sKGP待测液涡旋混合均匀,于室温避光静置30 min,在515 nm处测定吸光度,以VC作为阳性对照,重复3次取均值。待测液计算公式如下:
DPPH自由基清除率(%)=(1−Ax−AyA0)×100 (5) 阳性对照计算公式如下:
DPPH自由基清除率(%)=(A0−AzA0)×100 (6) 式中:Ax是测定组(DPPH无水乙醇溶液+待测样液);Ay是对照组(无水乙醇+待测样液);A0是空白组(DPPH无水乙醇溶液+超纯水);Az是阳性对照组(DPPH无水乙醇溶液+VC溶液)。
1.2.5.3 羟自由基清除能力测定
根据Xie等[25]的方法,有一些修改。依次将150 μL硫酸亚铁(FeSO4)溶液(9 mmol/L)、300 μL水杨酸-无水乙醇溶液(9 mmol/L)的反应体系充分混匀;再加入150 μL不同浓度(1.00、1.75、2.50、3.25、4.00 mg/mL)的KGP、sKGP待测液,然后加入150 μLH2O2溶液(10 mmol/L),再与450 μL超纯水涡旋混合均匀后,37℃水浴1 h,在536 nm处测定吸光度,重复3次取均值。待测液计算公式如下:
羟自由基清除率(%)=(Ax−AyA0−Ay)×100 (7) 式中:Ax是测定组(待测样液+H2O2+超纯水);Ay是对照组(H2O2+超纯水);A0是空白组(超纯水)。
1.2.5.4 ABTS+自由基清除能力测定
如Wu等[26]所述,对ABTS+自由基清除能力进行评估,略作修改。将ABTS溶液(7.40 mmol/L)与过硫酸钾(K2S2O8)溶液(2.60 mmol/L)混匀,用磷酸盐缓冲液(PBS,pH7.4)按体积比为75:5:4的比例配制成ABTS自由基工作液(现配现用,室温避光保存,务必在30 min内使用)。向50 μL不同浓度(0.5、1.0、1.5、2.0、2.5 mg/mL)的KGP、sKGP待测液中添加100 μL95%乙醇溶液,再加入850 μL上述混合液,涡旋混匀后室温避光静置6 min,在405 nm波长处测定吸光度,以VC作为阳性对照,重复3次取均值。待测液计算公式如下:
ABTS+自由基清除率(%)=(1−Ax−AyA0)×100 (8) 阳性对照计算公式如下:
ABTS+自由基清除率(%)=(A0−AzA0)×100 (9) 式中:Ax是测定组(待测样液+95%乙醇+ABTS工作液);Ay是对照组(待测样液+PBS缓冲液);A0是空白组(超纯水+95%乙醇+ABTS工作液);Az是阳性对照组(ABTS工作液+95%乙醇+VC溶液)。
1.3 数据处理
采用DPS软件对所有试验数据进行单因素方差分析,分别设定α=0.05的显著性水平。采用LSD检验进行均值间的差异显著性分析,P<0.05表示有统计学意义,数据均以平均数±标准差(SEM)表示。所有表格均在Excel(2020)软件系统下完成,所得统计结果用Origin2018软件制图。
2. 结果与分析
2.1 硒多糖的理化性质结果分析
在1.2.1的提取条件下得到KGP、sKGP,多糖校正因子f=1.966(n=3),总糖含量分别为72.78%±1.23%和86.76%±2.41%,蛋白质含量分别为0.65%±0.49%和0.63%±1.77%,sKGP得率为6.86%,sKGP中硒含量为0.64±0.04 mg/kg,显著高于KGP(增加近100倍,P<0.05)。
2.2 硒多糖分离纯化结果分析
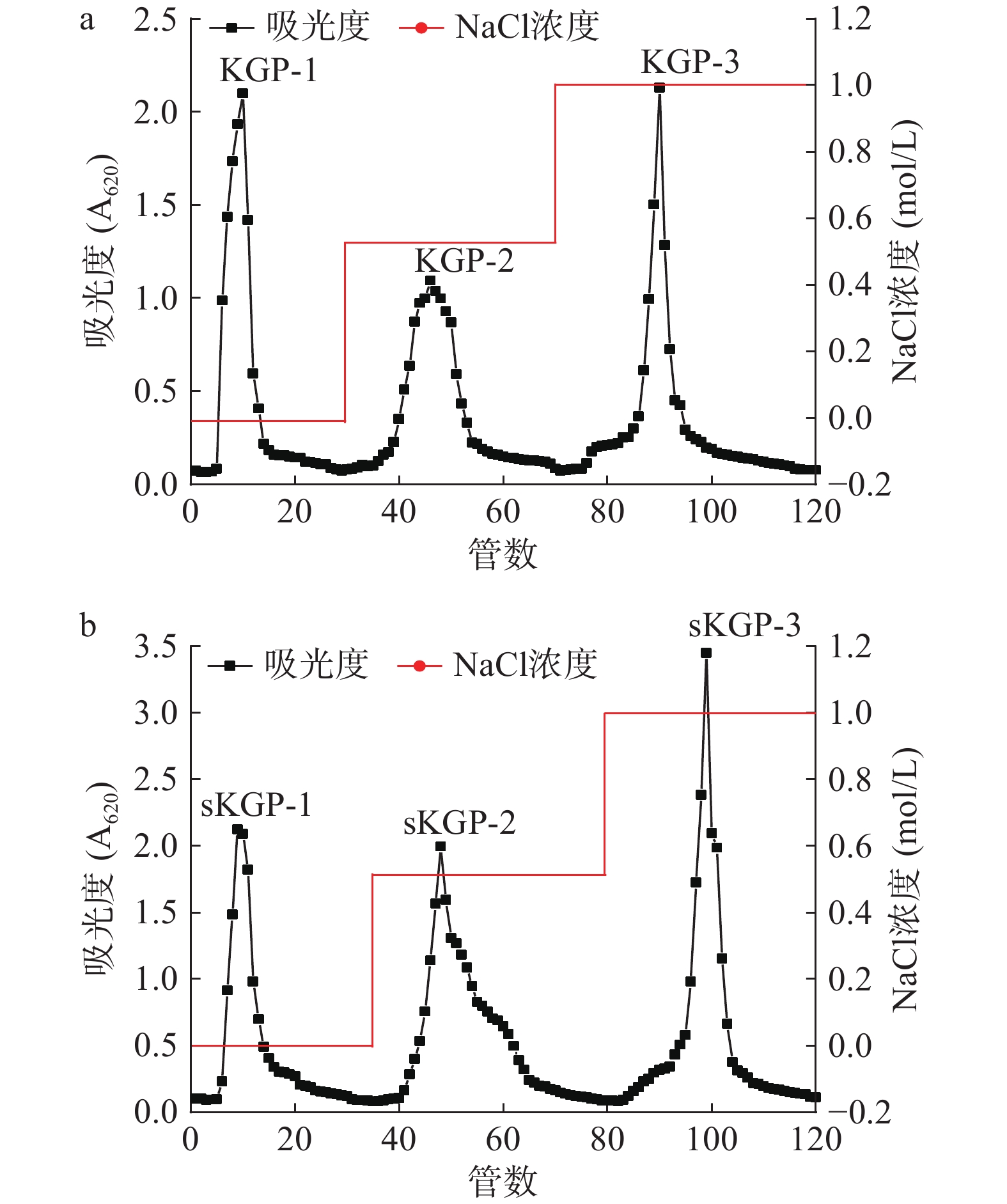
KGP、sKGP的脱色率分别为63.38%±0.89%和71.92%±0.14%,蛋白质脱除率为84.19%±0.07%和83.26%±0.26%,多糖保留率均在72%以上,郭慧静[18]的试验中,蒲公英多糖脱色率和脱蛋白率分别为75%和85.64%,且多糖损失率在20%左右,本研究与其结果相似。将初步纯化的KGP和sKGP溶液用DEAE-SephadexA-25层析柱进一步分离纯化。结果如图1所示,分别得到3个形态各异的洗脱峰。图1a中0~30管为超纯水洗脱组分,31~70管为0.5 mol/L NaCI洗脱组分,71~120管为1 mol/L NaCI洗脱组分,多糖依次命名为KGP-1、KGP-2和KGP-3;图1b中0~35管为超纯水洗脱组分,36~80管为0.5 mol/L NaCI洗脱组分,81~120管为1 mol/L NaCI洗脱组分,硒多糖依次命名为sKGP-1、sKGP-2和sKGP-3。经柱层析纯化后的葡萄硒多糖为白色粉末状。最终选取硒多糖组分中吸光度最大的一个洗脱峰(1 mol/L NaCl洗脱)sKGP-3进一步结构鉴定,多糖KGP-3做对照。
2.3 葡萄硒多糖结构分析
2.3.1 单糖组成分析
2.3.1.1 单糖MRM色谱图
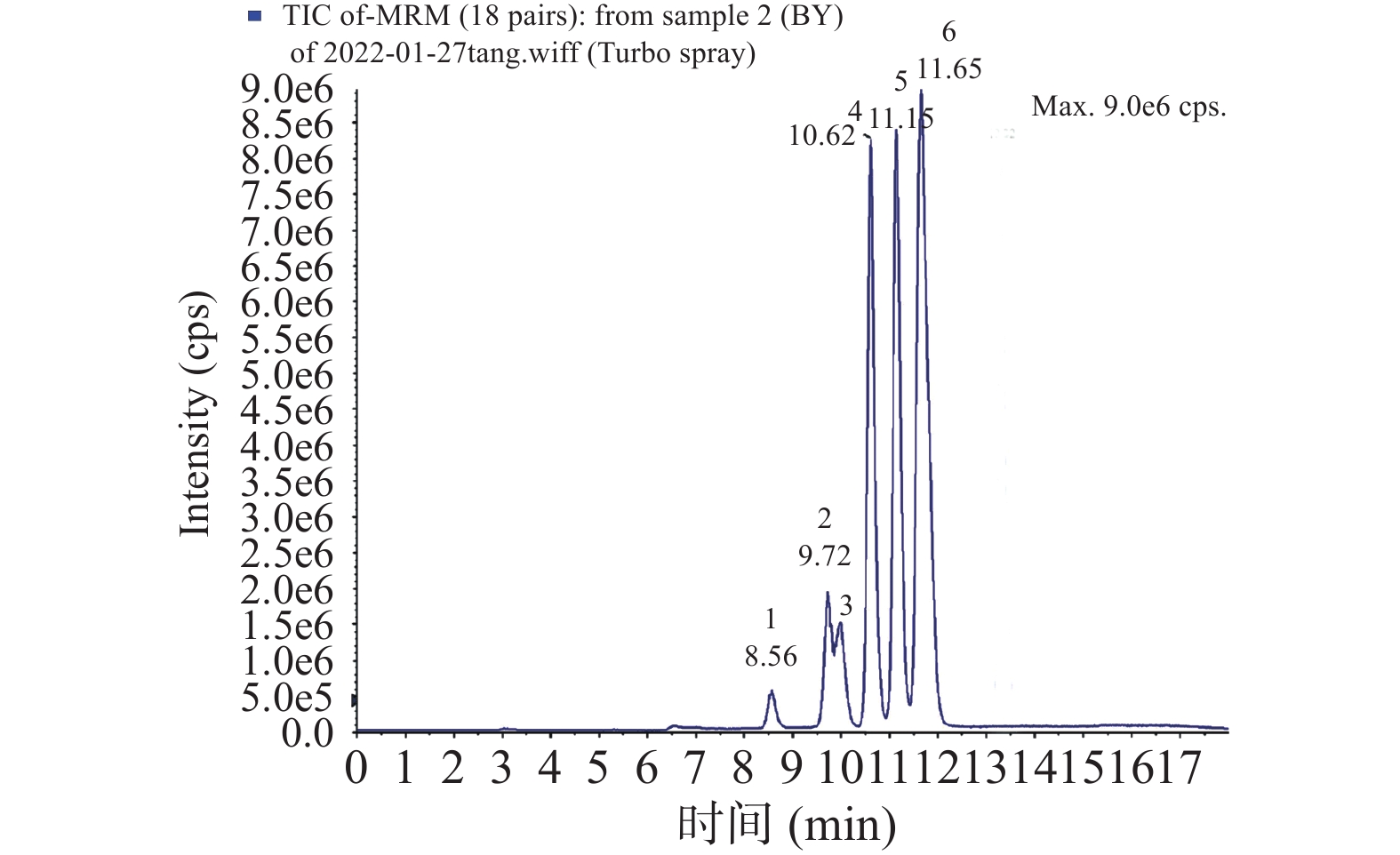
6种单糖混标MRM色谱图如图2所示。由图2看出:采用1.2.4.1节色谱条件和质谱条件,可以较好地分离葡萄中鼠李糖、果糖、甘露糖和葡萄糖等6种单糖。
2.3.1.2 硒多糖样品测定
LC-MS结果如表3所示,KGP-3和sKGP-3均为杂多糖,由鼠李糖、木糖、阿拉伯糖、甘露糖、葡萄糖和果糖组成,根据峰面积知各组分中6种单糖的摩尔比不同,KGP-3为0.183:0.732:0.687:0.095:3.669:0.114;sKGP-3为0.172:0.743:0.718:0.082:4.540:0.093。这些结果表明,硒并没有改变单糖的组成,只是影响了摩尔比,两个组分中葡萄糖含量最高,造成这些差异的原因可能是由于单糖化学结构中的极性基团不同,导致出峰时间不同。同样,据报道,富硒只影响桦褐孔菌多糖和假单胞菌PT-8胞外多糖的单糖摩尔比。sKGP的单糖组成与Lapuente等[27]发表的结果相似,发现碎葡萄和葡萄酒中单糖主要由葡萄糖、半乳糖和阿拉伯糖组成。
表 3 KGP-3、sKGP-3组分中单糖的测定结果(n=3)Table 3. Determination results of monosaccharides in selenium polysaccharide components (n=3)样品 组分 单糖 峰面积比 分子量 摩尔分数 单糖(摩尔比) KGP-3 1 mol/L 鼠李糖 0.348 164.16 0.0021 0.183 木糖 1.016 150.13 0.0068 0.732 阿拉伯糖 2.846 150.13 0.0190 0.687 甘露糖 0.232 180.16 0.0013 0.095 葡萄糖 49.556 180.16 0.2751 3.669 果糖 0.021 180.16 0.0001 0.114 sKGP-3 1 mol/L 鼠李糖 0.326 164.16 0.0020 0.172 木糖 1.031 150.13 0.0069 0.743 阿拉伯糖 2.972 150.13 0.0198 0.718 甘露糖 0.199 180.16 0.0011 0.082 葡萄糖 61.315 180.16 0.3403 4.540 果糖 0.017 180.16 0.0001 0.093 2.3.2 UV分析
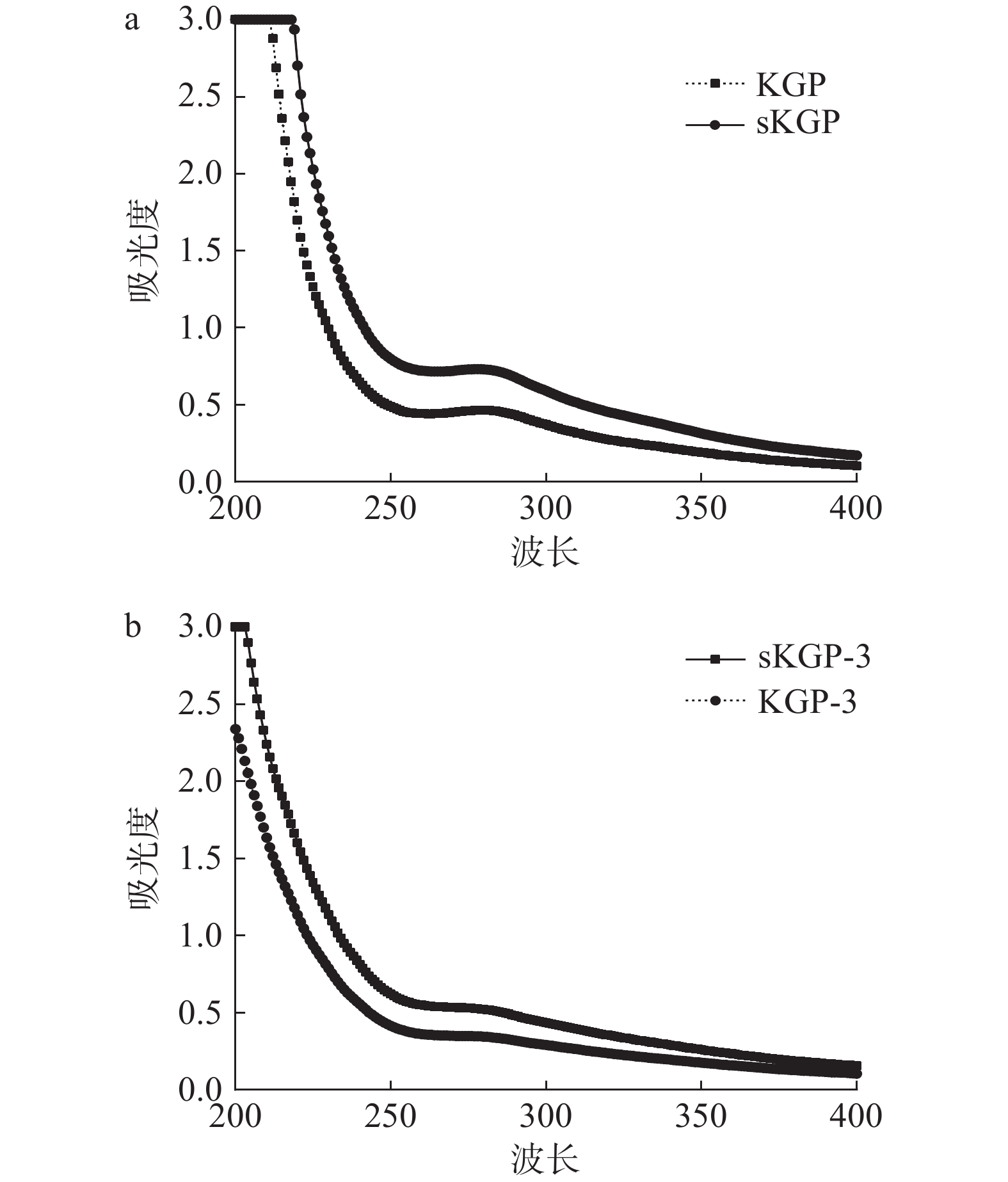
糖无紫外吸收峰,而在提取多糖过程中经常会混有蛋白质(280 nm)、肽(214~220 nm)、核酸(260 nm)、无机盐、色素和小分子物质等杂质,这将影响多糖的测定,其中,蛋白质影响最大。结果如图3所示,纯化前KGP和sKGP在260 nm处无吸收峰,证明提取的粗硒多糖中不含核酸,在280 nm处有明显的吸收峰,证明有蛋白质存在;纯化后由图3b可知,sKGP-3在280 nm出现较小的峰,表明该组分可能由于杂质的影响而出现吸收峰,均未见核酸特征吸收峰,Liu等[28]报道富硒枸杞LBP1的紫外-可见光谱在200~400 nm之间几乎没有吸收峰,说明LBP1不含蛋白质和核酸,Gao等[21]也有相同分析结果。
2.3.3 FT-IR分析
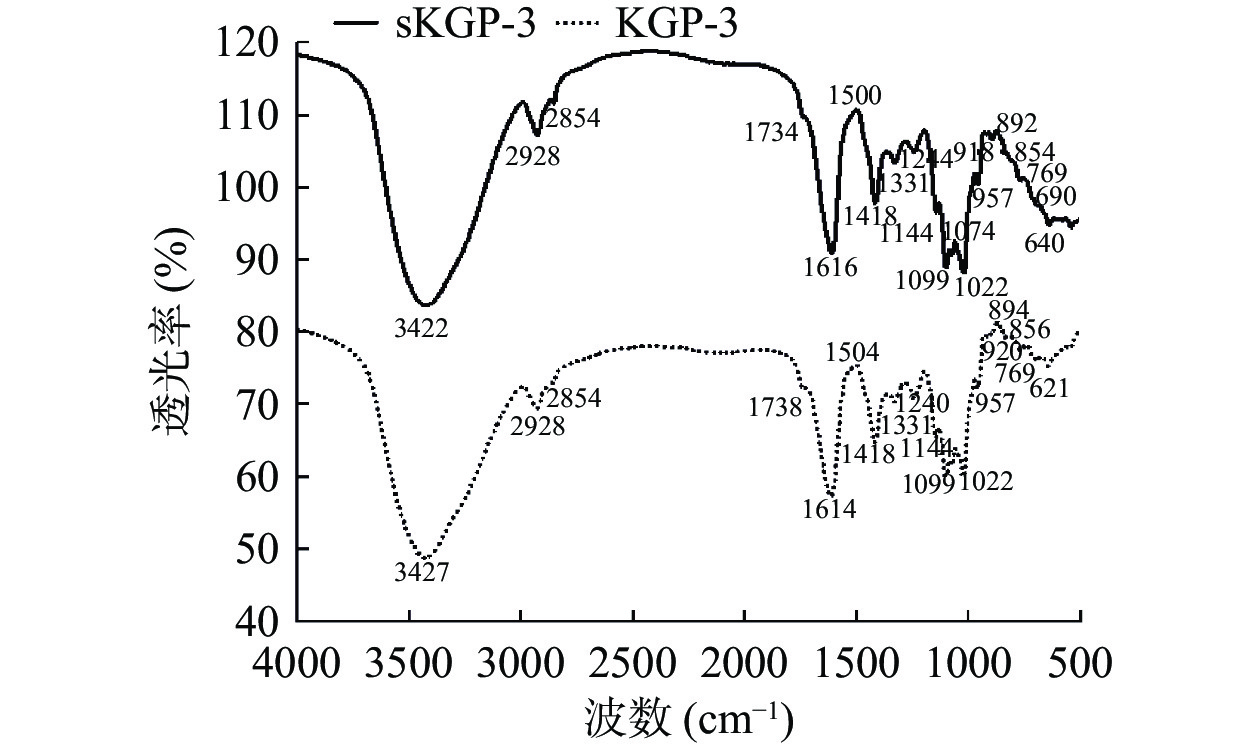
KGP-3和sKGP-3的FT-IR结果如图4所示。由图4可知在波数3422 cm−1处有强吸收峰且峰形较宽,是由糖类分子内O-H键的伸缩振动引起的;2928和1418 cm−1处的峰可归因于亚甲基(-CH2-)中的C-H键振动;1734 cm−1处羧基的吸收峰表明sKGP-3中可能含有糖醛酸,该硒多糖为酸性多糖;图中均无1541 cm−1吸收峰,说明它们不含有蛋白质,这与紫外光谱分析结果一致;此外,在1144、1099、1074、1022 cm−1处的四个吸收峰表明存在吡喃糖苷,据此可初步判断该化合物为吡喃类多糖,这在Chen等[22]的研究中得到进一步证明;1099、1074、1022和957 cm−1处的强吸收峰显示两个样品含有大量的葡萄糖和半乳糖,这与单糖组成分析结果一致;854和892 cm−1处的吸收带归因于α-和β-型糖苷键的共存,由于β-型的吸收强度更强,因此,sKGP-3主要的残基键是β-糖苷键。基于以上分析,得出结论,sKGP-3是含有吡喃环和β-糖苷键的酸性硒多糖。与KGP-3相比,sKGP-3在500~700 cm−1之间吸收峰有明显变化,推断640 cm−1处的特征峰是由对称环Se=O或Se-H伸缩振动引起的,Luo等[29]在桑黄硒多糖中报告了相同的结果。Hou等[30]报道称1022 cm−1处的峰归因于硒酯中存在的O-Se-O键。这些结果进一步证实sKGP-3是硒多糖,硒通过Se=O键与葡萄多糖成功结合。
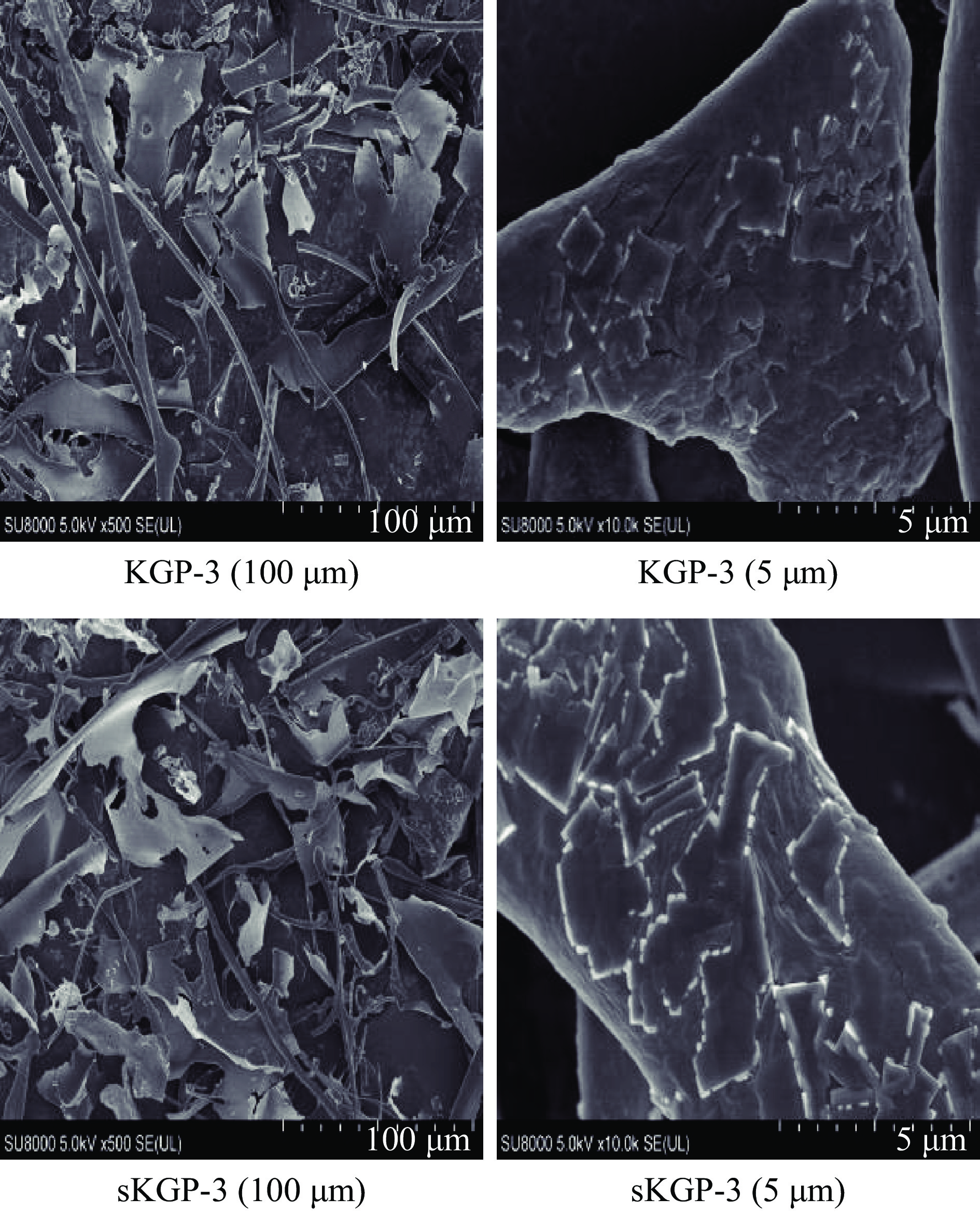
2.3.4 SEM分析
纯化前后多糖和硒多糖各组分的SEM结果如图5所示,与之前研究结果类似。从图5中看出,纯化前KGP和sKGP形貌相似,呈现大小、厚度不均一的块状,表面粗糙多孔。纯化后(图6)结果显示,多糖KGP-3在500倍数下,其结构成无规则碎片状、细丝状和颗粒状,表面光滑无孔,这一种形态解释了为什么水在冷冻干燥时很容易除去。进一步放大倍数,在放大10.0 k时发现,KGP-3结构中出现大小不一的块状,表面粗糙不平整。相比之下,硒多糖sKGP-3在放大500的宏观视野内,其结构也为不规则薄片状和细丝状,表面光滑有孔,推断其多孔结构是通过多糖分子的交联和排斥形成的,这表明硒多糖sKGP-3各个分子之间的交互影响力较大。在放大10.0 k的视野内,sKGP-3由不规则形状组成,虽与KGP-3相似都呈块状,但sKGP-3为不均匀多边形,结构还是存在一定差异。Zhu等[23]报告称纯化后ASe-TPS2和NSe-TPS2的表面大多为丝状、条状和颗粒状,也与张军耀[31]黑茶硒多糖的研究结果一致。
2.3.5 硒多糖抗氧化能力结果分析
2.3.5.1 总抗氧化能力
T-AOC检测法的原理是在酸性环境中,基于体内多种抗氧化剂如GSH和SOD能将Fe3+还原成Fe2+,后者可与三吡啶三吖嗪(TPTZ)形成稳定的络合物。从图7可以看出,样品在0.20~1.25 mg/mL浓度梯度范围内,sKGP硒多糖的总抗氧化能力始终大于KGP多糖,sKGP和KGP在0.25 mg/mL的浓度下均达到最大值,分别为8.499和3.257 μmol/mL,之后随着多糖浓度的增加总抗氧化能力不再继续增强,反而稍有所下降,可能是硒多糖对提高T-AOC能力有限,机体内氧化与抗氧化的平衡被打破。sKGP的总抗氧化活性是KGP的2.5倍左右,且在同一浓度下,二者差异显著(P<0.05),这表明硒能增加sKGP硒多糖的抗氧化活性,Liu等[32]研究表明,T-AOC活性随Se-RLFP-I和Se-RLFP-II浓度的增加呈上升趋势,在100 μg/mL浓度时T-AOC活性分别为(1.45±0.12)和(1.77±0.32) mg/mL,在本研究中,sKGP显著(P<0.05)提高总抗氧化能力,具有作为天然抗氧化剂的潜力,此外与KGP的差异可能与其硒含量有关,硒本身具有抗氧化作用,它可以在体内与抗氧化酶结合,从而提高酶的活性,达到抗氧化的目的。
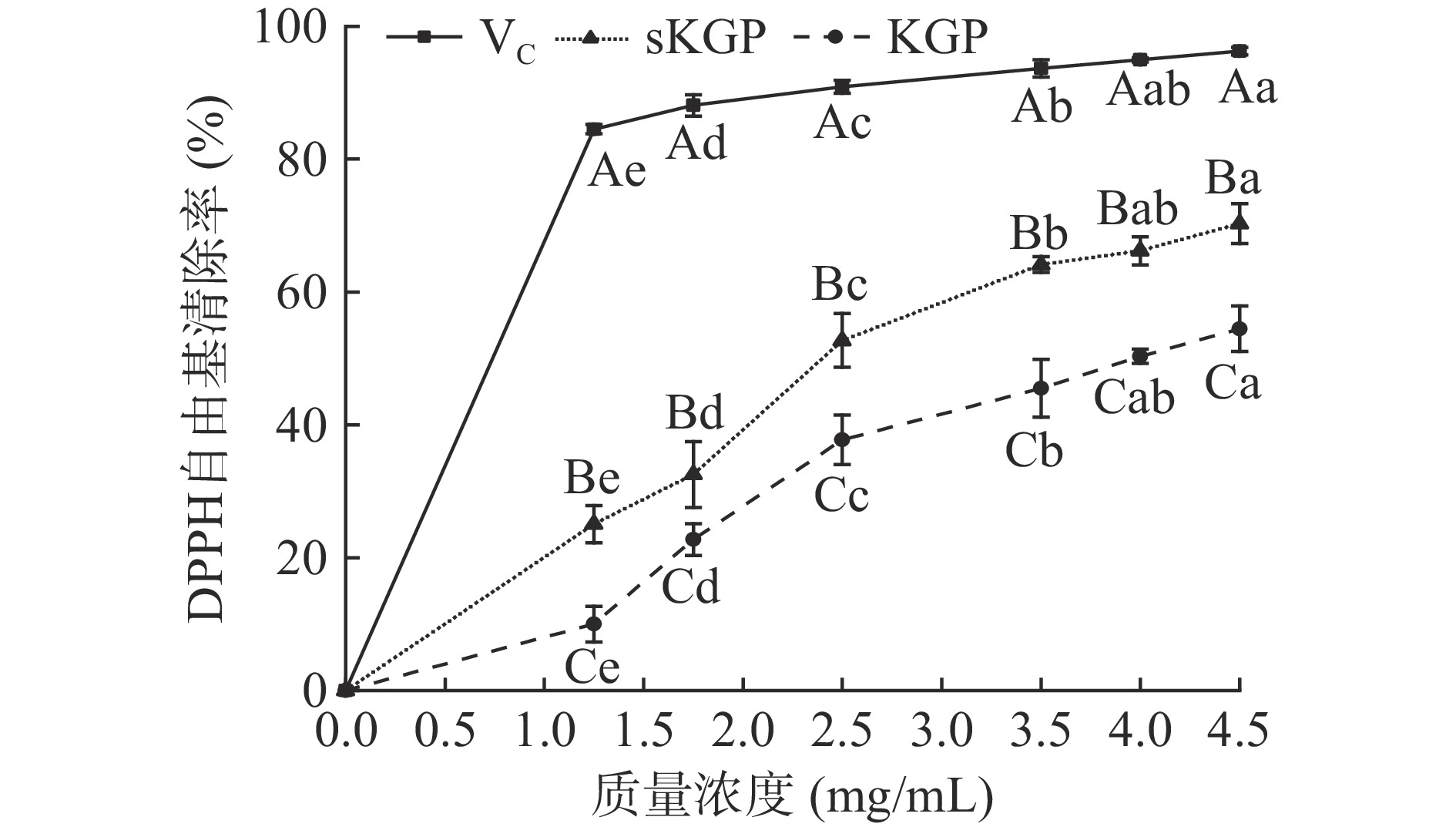
2.3.5.2 DPPH自由基清除能力
DPPH自由基清除原理是DPPH是一种稳定的单电子自由基,其醇溶液呈紫色,在515 nm处具有最大吸收,与具有抗氧化活性的氢供体反应后,紫色会因其转化为2,2-二苯基-1-苦基肼而褪色或消失,515 nm处的吸光度下降,DPPH是反应样品抗氧化能力强弱的重要指标之一。图8是KGP和sKGP清除DPPH自由基结果。从图中可以看出,KGP和sKGP在0.0~4.5 mg/mL的梯度范围内清除DPPH自由基能力随着质量浓度的增加而逐渐上升,当浓度达到4.5 mg/mL时,sKGP、KGP的清除率分别为69.7%和52.9%,sKGP是KGP的1.32倍,且呈继续增加的趋势,但均低于VC。由图可知,sKGP清除DPPH自由基能力强于KGP,同一浓度下,二者差异显著(P<0.05)。在之前的研究中,Li等[5]报道灰树花硒多糖浓度在1.0 mg/mL时清除DPPH自由基的能力为45.71%,高于灰树花多糖(33.33%),与灰树花硒多糖相比,sKGP抗氧化活性优越。抗氧化效果与多糖的供氢能力有关,在本研究中,硒在sKGP中的存在可以激发阳极区的氢供体,因此,sKGP的抗氧化作用比KGP更强。
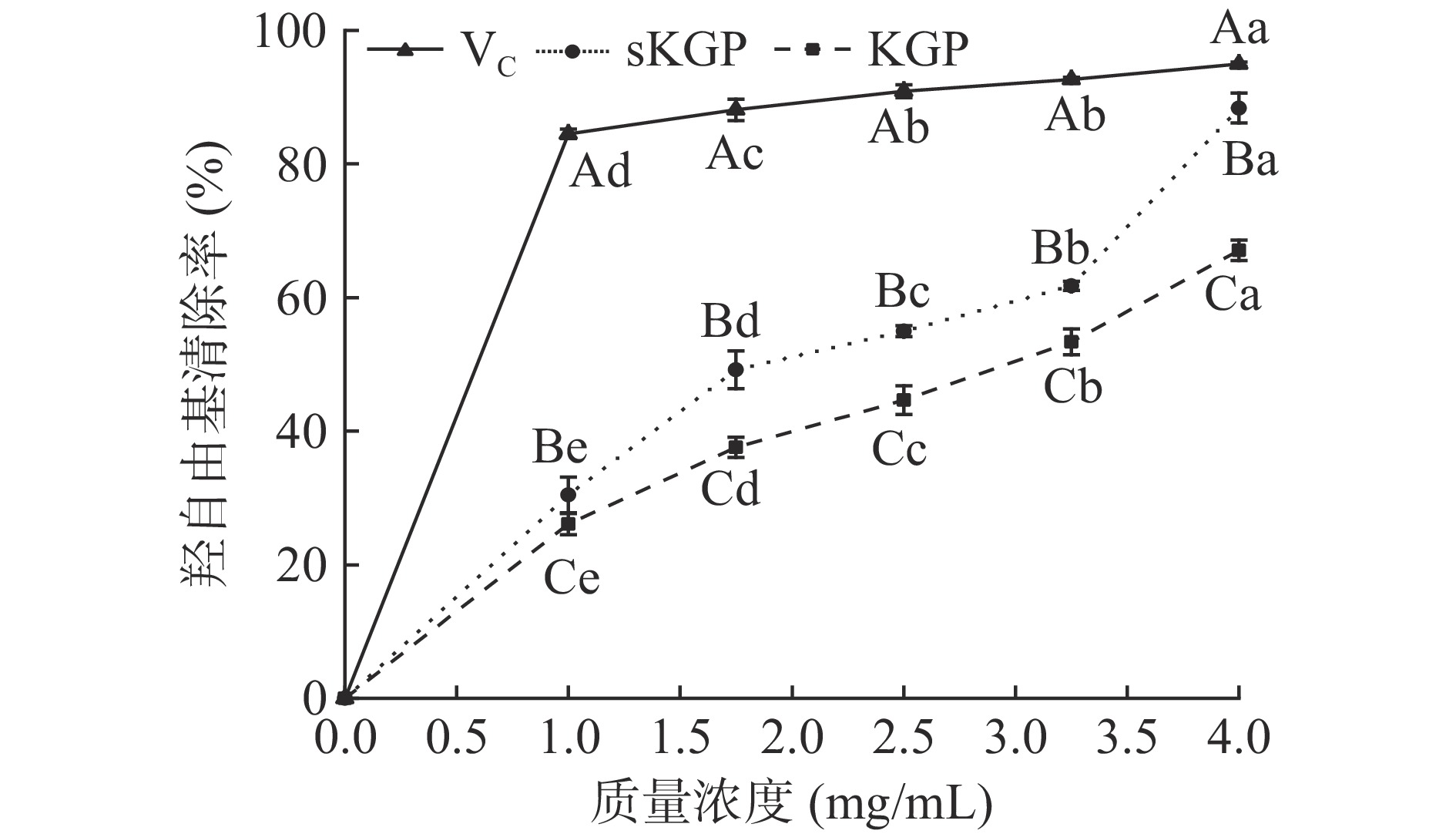
2.3.5.3 羟自由基清除能力
羟自由基清除原理是反应体系中加入H2O2和Fe2+时会发生Fenton反应产生羟自由基,当具有抗氧化活性的氢供体存在时,可以将Fe2+氧化为Fe3+,使Fe2+与邻二氮菲生成的络合物减少,536 nm处的吸光度下降。结果由图9可知,在0.0~4.0 mg/mL的浓度梯度内,KGP和sKGP提取液随着浓度的增加对羟自由基清除率也呈上升趋势,且呈现良好的剂量依赖性,不同处理水平间差异显著(P<0.05)。sKGP和KGP浓度在4.0 mg/mL时,清除率分别为85.8%和64.3%,且在高浓度下sKGP的抗氧化能力接近于VC。Dong等[33]和Wang等[2]在富硒芡实多糖和黄灵菇水溶性硒多糖中也得到了相似的抗氧化结论,他们发现硒多糖在体外对羟自由基具有更好的清除能力。与KGP相比,sKGP更强的清除能力可能与新引入的硒基(-SeH)或亚硒酸酯有关,两者都能与自由基离子(如Fe2)共轭,这是自由基链式反应所必需的,因此,反应终止,羟自由基的生成被抑制。
2.3.5.4 ABTS+自由基清除能力
ABTS+自由基清除原理是ABTS由蓝绿色显色剂过硫酸钾经氧化后预形成自由基单阳离子,在405或734 nm处有最大吸收峰。当与具有抗氧化活性的供氢体反应后被还原使蓝绿色溶液褪色。结果如图10所示,在0.0~2.5 mg/mL的浓度梯度内,KGP和sKGP具有良好的清除ABTS+自由基的能力,并且也是随着浓度的增加其清除能力增强。当sKGP和KGP质量浓度为2.5 mg/mL时,其清除能力分别为92.5%和82.7%,之后逐渐稳定,二者差异显著(P<0.05),与KGP相比,sKGP清除ABTS+自由基能力接近VC,这一结果与之前的研究结果一致。之前的研究发现,灵芝[34]、平菇[35]中的硒多糖在清除ABTS+自由基方面比天然多糖更有效,原因是硒基团可以激活异丙基碳的氢原子,增加多糖提供氢原子的能力,它们能将更多的自由基转化为稳定的产物。
3. 结论
sKGP得率为6.86%,蛋白质和多糖含量分别为0.63%±1.77%和86.76%±2.41%;脱色率、脱蛋白率为71.92%、83.26%、多糖保留率均在72%以上,总硒含量为0.624 mg/kg;UV结果显示,sKGP-3几乎不含蛋白质、核酸和肽等,LC-MS结果表明:sKGP-3均由6种单糖组成,其中葡萄糖含量最高,硒并没有改变单糖组成,FT-IR分析结果显示:sKGP-3是含有吡喃环和β-糖苷键的酸性硒多糖,SEM显示:经纯化后sKGP-3主要为片状和丝状;硒多糖sKGP可不同程度的提高DPPH、羟自由基、ABTS+自由基清除能力和总抗氧化能力,且呈现良好的剂量依赖性,抗氧化活性均大于多糖KGP。后期还需进一步比较硒化多糖和天然多糖毒性并在分子水平上详细研究硒多糖生物活性机制。
-
表 1 梯度洗脱程序
Table 1 Mobile phase gradient
洗脱时间(min) 流速(mL/min) 流动相A(%) 流动相B(%) 0 0.6 20 80 10 0.6 40 60 12 0.6 40 60 12.01 0.6 20 80 18 0.6 20 80 表 2 6种单糖的监测离子参数设定表
Table 2 Setting of monitoring ion parameters of six monosaccharides
单糖 保留时间(min) 监测离子对(m/z) 去簇电压(V) 碰撞气能量(eV) 鼠李糖 8.55 162.9>59.1*
162.9>89.0−77
−77−12
−20木糖 9.73 149.0>59.0*
149.0>89.1−70
−70−9
−22阿拉伯糖 9.98 149.0>59.0*
149.0>89.1−70
−70−9
−22果糖 10.62 178.9>59.1
178.9>89.0*−70
−70−13
−25甘露糖 11.14 178.9>59.1
178.9>89.0*−70
−70−13
−25葡萄糖 11.64 179.0>89.1*
179.0>71.0−70
−70−12
−22注:*表示定量离子对。 表 3 KGP-3、sKGP-3组分中单糖的测定结果(n=3)
Table 3 Determination results of monosaccharides in selenium polysaccharide components (n=3)
样品 组分 单糖 峰面积比 分子量 摩尔分数 单糖(摩尔比) KGP-3 1 mol/L 鼠李糖 0.348 164.16 0.0021 0.183 木糖 1.016 150.13 0.0068 0.732 阿拉伯糖 2.846 150.13 0.0190 0.687 甘露糖 0.232 180.16 0.0013 0.095 葡萄糖 49.556 180.16 0.2751 3.669 果糖 0.021 180.16 0.0001 0.114 sKGP-3 1 mol/L 鼠李糖 0.326 164.16 0.0020 0.172 木糖 1.031 150.13 0.0069 0.743 阿拉伯糖 2.972 150.13 0.0198 0.718 甘露糖 0.199 180.16 0.0011 0.082 葡萄糖 61.315 180.16 0.3403 4.540 果糖 0.017 180.16 0.0001 0.093 -
[1] GUO C H, HSIA S, CHEN P C. Distribution of selenium and oxidative stress in breast tumor-bearing mice[J]. Nutrients,2013,5(2):594−607. doi: 10.3390/nu5020594
[2] WANG L, LI X Y, WANG B B. Synthesis, characterization and antioxidant activity of selenium modified polysaccharides from Hohenbuehelia serotina[J]. International Journal of Biological Macromolecules,2018,120:1362−1368. doi: 10.1016/j.ijbiomac.2018.09.139
[3] VINCETI M, CRESPI C M, BONVICINI F, et al. The need for a reassessment of the safe upper limit of selenium in drinking water[J]. Science of the Total Environment,2013,443(15):633−642.
[4] GAO Z, ZHANG C, LIU H, et al. The characteristics and antioxidation of Oudemansiella radicata selenium polysaccharides on lipopolysaccharide-induced endo-toxemic mice[J]. International Journal of Biological Macromolecules,2018,116:753−764. doi: 10.1016/j.ijbiomac.2018.05.078
[5] LI Q, WANG W, ZHU Y, et al. Structural elucidation and antioxidant activity a novel Se-polysaccharide from Se-enriched Grifola frondosa[J]. Carbohydrate Polymers,2017,161:42−52. doi: 10.1016/j.carbpol.2016.12.041
[6] WANG L B, LI L Y, GAO J Y, et al. Characterization, antioxidant and immunomodulatory effects of selenized polysaccharides from dandelion roots[J]. Carbohydrate Polymers,2021,260:117796. doi: 10.1016/j.carbpol.2021.117796
[7] ZHU Z Y, LIU F, GAO H, et al. Synthesis, characterization and antioxidant activity of selenium polysaccharide from Cordyceps militaris[J]. International Journal of Biological Macromolecules,2016,93:1090−1099. doi: 10.1016/j.ijbiomac.2016.09.076
[8] MA L, LIU J, LIU A J, et al. Cytoprotective effect of Selenium polysaccharide from Pleurotus ostreatus against H2O2-induced oxidative stress and apoptosis in PC12 cells[J]. Arabian Journal of Chemistry,2022,15(4):103686. doi: 10.1016/j.arabjc.2022.103686
[9] LI J, SHEN B X, NIE S L, et al. A combination of selenium and polysaccharides: Promising therapeutic potential[J]. Carbohydrate Polymers,2018,206:163−173.
[10] OGRA Y, SHIMIZU M, TAKAHASHI K, et al. Biotransformation of organic selenium compounds in budding yeast, Saccharomyces cerevisiae[J]. Metallomics,2018,10(9):1257−1263. doi: 10.1039/C8MT00176F
[11] CHENG L Z, WANG Y F, HE X X, et al. Preparation, structural characterization and bioactivities of Se-containing polysaccharide: A review[J]. International Journal of Biological Macromolecules,2018,120:82−92. doi: 10.1016/j.ijbiomac.2018.07.106
[12] LIU Y, HUANG G L. Extraction and derivatisation of active polysaccharides[J]. Journal of Enzyme Inhibition Medicinal Chemistry,2019,34(1):1690−1696. doi: 10.1080/14756366.2019.1660654
[13] 钟海霞, 潘明启, 张付春, 等. 不同砧木对克瑞森葡萄果实可溶性糖含量的影响[J]. 新疆农业科学,2018,55(9):1633−1638. [ZHONG H X, PAN M Q, ZHANG F C, et al. Effect of different rootstocks on soluble sugar content of cressen grape fruit[J]. Xinjiang Agricultural Science,2018,55(9):1633−1638. [14] LIU Y, SUN Y Y, HUANG G L. Preparation and antioxidant activities of important traditional plant polysaccharides[J]. International Journal of Biological Macromolecules,2018,111:780−786. doi: 10.1016/j.ijbiomac.2018.01.086
[15] HUANG S Y, YANG W J, HUANG G L. Preparation and activities of selenium polysaccharide from plant such as Grifola frondosa[J]. Carbohydrate Polymers,2020,242:116409. doi: 10.1016/j.carbpol.2020.116409
[16] GU Y G, QIU Y, WEI X, et al. Characterization of selenium-containing polysaccharides isolated from selenium-enriched tea and its bioactivities[J]. Food Chemistry,2020,316:126371. doi: 10.1016/j.foodchem.2020.126371
[17] 中华人民共和国国家卫生健康委员会, 国家市场监督管理局. GB 5009.93-2017[S]. 北京: 中国标准出版社, 2017: 1−3 National Health Commission of the People's Republic of China, State Administration of Market Regulation. GB 5009.93-2017[S]. Beijing: China Standards Press, 2017: 1−3.
[18] 郭慧静. 蒲公英多糖的提取, 分离纯化, 鉴定及其生物活性的初步研究[D]. 石河子: 石河子大学, 2019 GUO H J. A preliminary study on the extraction, separation, purification, identification and biological activity of dandelion polysaccharide[D]. Shihezi: Shihezi University, 2019.
[19] CHENG H, HUANG G L. Extraction, characterisation and antioxidant activity of Allium sativum polysaccharide[J]. International Journal of Biological Macromolecules,2018,114:415−419. doi: 10.1016/j.ijbiomac.2018.03.156
[20] 王川丕, 诸力, 刘新, 等. 超高效液相色谱-质谱联用技术测定茶叶中8种单, 寡糖的含量[J]. 食品科学,2014,20:6. [WANG C P, ZHU L, LIU X, et al. Determination of 8 kinds of monosaccharides and oligosaccharides in tea by ultra high performance liquid chromatography-mass spectrometry[J]. Food Science,2014,20:6. [21] GAO Z, ZHANG C, TIAN C Y, et al. Characterization, antioxidation, anti-inflammation and renoprotection effects of selenized mycelia polysaccharides from Oudemansiella radicata[J]. Carbohydrate Polymers,2018,181:1224−1234. doi: 10.1016/j.carbpol.2017.12.007
[22] CHEN G J, KAN J Q. Characterization of a novel polysaccharide isolated from Rosa roxburghii Tratt fruit and assessment of its antioxidant in vitro and in vivo[J]. International Journal of Biological Macromolecules,2018,107:166−174. doi: 10.1016/j.ijbiomac.2017.08.160
[23] ZHU J X, CHEN Z Y, CHEN L, et al. Comparison and structural characterization of polysaccharides from natural and artificial Se-enriched green tea[J]. International Journal of Biological Macromolecules,2019,130:388−398. doi: 10.1016/j.ijbiomac.2019.02.102
[24] TENG C, QIN P Y, SHI Z X, et al. Structural characterization and antioxidant activity of alkali-extracted polysaccharides from quinoa[J]. Food Hydrocolloids,2020,113:106392.
[25] XIE L M, SHEN M Y, WEN P W, et al. Preparation, characterization, antioxidant activity and protective effect against cellular oxidative stress of phosphorylated polysaccharide from Cyclocarya paliurus[J]. Food and Chemical Toxicology,2021,145:111754.
[26] WU C Z, ZHAO M M, BU X Y, et al. Preparation, characterization, antioxidant and antiglycation activities of selenized polysaccharides from blackcurrant[J]. RSC Advances,2020,10(54):32616−32627. doi: 10.1039/D0RA06462A
[27] LAPUENTE L M, GUADALUPE Z, AYESTARAN B, et al. Ultrasound treatment of crushed grapes: Effect on the must and red wine polysaccharide composition[J]. Food Chemistry,2021,356(10):129669.
[28] LIU G Y, YANG X, ZHANG J X, et al. Synthesis, stability and anti-fatigue activity of selenium nanoparticles stabilized by Lycium barbarum polysaccharides[J]. International Journal of Biological Macromolecules,2021,179:418−428. doi: 10.1016/j.ijbiomac.2021.03.018
[29] LUO L J, WANG Y X, ZHANG S, et al. Preparation and characterization of selenium-rich polysaccharide from Phellinus igniarius and its effects on wound healing[J]. Carbohydrate Polymers,2021,264(6):117982.
[30] HOU R R, CHEN J, YUE C J, et al. Modification of lily polysaccharide by selenylation and the immune-enhancing activity[J]. Carbohydrate Polymers,2016,142:73−81. doi: 10.1016/j.carbpol.2016.01.032
[31] 张军耀. 富硒黑茶多糖的提取分离纯化及性质研究[D]. 上海: 上海师范大学, 2019 ZHANG J Y. Extraction, purification and properties of selenium enriched black tea polysaccharide[D]. Shanghai: Shanghai Normal University, 2019.
[32] LIU X G, LIU J, LIU C F, et al. Selenium-containing polysaccharides isolated from Rosa laevigata Michx fruits exhibit excellent anti-oxidant and neuroprotective activity in vitro[J]. International Journal of Biological Macromolecules,2022,209(PtA):1222−1233.
[33] DONG F, ZHENG H Z, JEONG W S, et al. Synthesis, characterization, and antioxidant activity in vitro of selenium-Euryale ferox Salisb. polysaccharide[J]. Applied Biological Chemistry,2021,64(1):59. doi: 10.1186/s13765-021-00631-4
[34] DONG Z, DONG G, LAI F R, et al. Purification and comparative study of bioactivities of a natural selenized polysaccharide from Ganoderma lucidum mycelia[J]. International Journal of Biological Macromolecules,2021,190(6):101−112.
[35] MA L, ZHAO Y N, YU J, et al. Characterization of Se-enriched Pleurotus ostreatus polysaccharides and their antioxidant effects in vitro[J]. International Journal of Biological Macromolecules,2018,111:421−429. doi: 10.1016/j.ijbiomac.2017.12.152
-
期刊类型引用(14)
1. 王鑫,李丹,王华,李秀萍,杨丽红,张晔,王浩. 糜子改性淀粉的理化性质及体外消化特性研究. 中国食品添加剂. 2024(03): 147-154 .  百度学术
百度学术
2. 任逸,仇丹,姚利辉,庞嘉敏,周坤,何宇鹏. 聚乳酸改性糯玉米淀粉的制备及表征. 精细化工. 2024(03): 679-686+696 .  百度学术
百度学术
3. 靳玉龙. GI值的测定方法和影响因素及低GI食品生理学功能的研究进展. 现代食品科技. 2024(03): 350-360 .  百度学术
百度学术
4. 封永婷,许美娟,赵晓冬,杨佩瑜,邹建,周彬. 反复/连续湿热制备淀粉-脂质复合物及其性质分析. 中国食品学报. 2024(05): 313-320 .  百度学术
百度学术
5. 王鑫,李丹,王华,李秀萍,杨丽红,张晔,王浩. 银杏脱支淀粉-月桂酸复合物的结构及发酵特性. 食品研究与开发. 2024(14): 72-78 .  百度学术
百度学术
6. 孟祥河,黄宝柱,聂小华,余宁翔,陆元超,季坚. 脂类乳化剂对糊化玉米淀粉消化特性与结构特征的影响. 浙江工业大学学报. 2023(04): 433-438 .  百度学术
百度学术
7. 王鼎,刘真真,李旭,李小鹏,刘磊,崔晓辉,杨璞,王冰心,谢彦周,李学军. 高直链淀粉小麦西农836淀粉理化性质及消化特性分析. 麦类作物学报. 2023(08): 998-1004 .  百度学术
百度学术
8. 杨小玲. 淀粉基复合物及其抗消化特性研究进展. 化学与粘合. 2023(05): 464-468+472 .  百度学术
百度学术
9. 牛海力,卢柏志,马朗天,赵方佳,刘小轩,岳田利. 藜麦淀粉和藜麦抗性淀粉的理化性质. 食品研究与开发. 2023(18): 45-52 .  百度学术
百度学术
10. 窦博鑫,李明玉,张煜,刘颖,张娜. 淀粉-脂肪酸复合物的研究进展. 中国调味品. 2023(12): 206-212 .  百度学术
百度学术
11. 陈燕芳,别平平,梁逸超,张子倩,王家敏,高家律. 抗性淀粉的制备及其在面制品中的应用研究进展. 现代食品. 2022(16): 69-74 .  百度学术
百度学术
12. 张昀,张康逸,赵迪,郭东旭,张国治. 糯麦淀粉-脂质复合物的结构及体外消化特性. 食品工业科技. 2022(20): 97-106 .  本站查看
本站查看
13. 孙梦,窦博鑫,贾健辉,刘颖,王子妍,张煜,张娜. 大米淀粉-甘油单棕榈酸酯复合物的制备及其老化性质研究. 食品安全质量检测学报. 2022(23): 7660-7668 .  百度学术
百度学术
14. 孙辉,邓志锦,许祯毅,范俐,童秀平,庞杰. 丁酰化淀粉在ZnCl_2溶液中解构过程的流变学特性. 食品科技. 2022(11): 213-220 .  百度学术
百度学术
其他类型引用(7)









 下载:
下载:








 下载:
下载:



