Structure and in Vitro Digestion Properties of Waxy Wheat Starch-Lipid Complexes
-
摘要: 探究饱和脂肪酸的碳链长度对糯麦A、B淀粉-脂质复合物结构及体外消化特性的影响。以糯麦A、B淀粉为主要原料,将其经过复合酶改性后,分别与月桂酸、肉豆蔻酸、棕榈酸和硬脂酸进行复合,并对复合物的复合指数(CI值)、溶解度和膨胀力、碘吸收特性、晶体结构、红外光谱和预测血糖指数(pGI值)等指标进行了考察。结果表明,随着碳链的延长(12~18),糯麦A、B淀粉-脂质复合物的CI值分别从53.66%降到了38.15%,60.35%降低为41.04%;糯麦A、B淀粉-脂质复合物的溶解度和膨胀力随着温度的升高和碳原子数的增加逐渐增大,其中糯麦A淀粉-月桂酸在90 ℃下的溶解度和膨胀力分别为1.99%和3.34 g/g,糯麦B淀粉-月桂酸在90 ℃下的溶解度和膨胀力分别为1.74%和3.18 g/g;在四种脂质复合物中,糯麦A、B淀粉与月桂酸形成的复合物的相对结晶度较高,分别为25.37%和23.50%,其在1047/1022 cm−1处的比值也较高,分别为0.993和0.989,pGI值与未复合脂质改性的糯麦淀粉相比有了较大幅度的降低,分别为从47.63降低为36.61,从48.30降低为35.49。本研究能够为淀粉-脂质复合物的结构及体外消化特性研究提供参考依据。Abstract: To explore the effect of saturated fatty acid carbon chain length on the structure and in vitro digestive properties of waxy wheat A and B starch-lipid complexes. Using waxy wheat A and B starch as the main raw materials, after being modified by compound enzymes, they were compounded with lauric acid, myristic acid, palmitic acid and stearic acid respectively, and the compound index (CI value), the solubility and swelling power, iodine absorption characteristics, crystal structure, fourier transform infrared spectroscopy and predicted glycemic index (pGI value) were investigated. The results showed that with the increasing of carbon chain (12~18), the CI values of starch-lipid complexes of waxy wheat A and B decreased from 53.66% to 38.15%, and from 60.35% to 41.04%. The solubility and swelling power of starch-lipid complexes of waxy wheat A and B increased gradually with the increasing of temperature and the number of carbon atoms. The solubility and swelling power of waxy wheat A starch-lauric acid at 90 ℃ were 1.99% and 3.34 g/g, the solubility and swelling power of waxy wheat B starch-lauric acid at 90 ℃ were 1.74% and 3.18 g/g respectively. Among the four lipid complexes, the complexes formed by waxy wheat starch A, B and lauric acid had relatively high crystallinity, reaching 25.37% and 23.50%, and their ratios at 1047/1022 cm−1 were also high, which were 0.993 and 0.989. Compared with the uncomplexed lipid-modified waxy wheat starch, the pGI values decreased significantly, from 47.63 to 36.61, and from 48.30 to 35.49 respectively. This study can provide a reference for the structure and in vitro digestion characteristics of starch-lipid complexes.
-
Keywords:
- waxy wheat /
- lipid /
- complex /
- structure /
- in vitro digestive properties
-
糯麦是一种由人工杂交培育出的小麦。它具有独特的麦香味和与众不同的加工特性,其籽粒淀粉中的支链淀粉占比很高。脂质作为人体必需的营养素之一,能够对食品的品质特性产生明显影响[1-2]。脂质通过结合淀粉分子内部的疏水空腔形成单螺旋复合物[3]。复合物的形成能够促使淀粉的品质加工特性发生转变,拓宽应用市场[4]。淀粉-脂质复合物的抗酶解能力比普通淀粉强,因而被称为RS5型抗性淀粉。它在降低消化率,抑制餐后血糖,预防结肠癌、冠心病等方面具有一定的功效[5]。
淀粉与脂质复合受诸多因素制约,其中淀粉和脂质的选择对两者复合有着最直接的影响。直、支链淀粉都能与脂质结合,但直链淀粉更容易与脂质形成复合物[6]。黄承刚等[7]选取了不同直链淀粉含量的玉米淀粉与硬脂酸复合,发现直链淀粉含量越高,复合指数越高,抗性淀粉含量越高。Wang等[8]通过实验发现,蜡质小麦淀粉与脂质反应后并未检测到复合物。Liu等[9]选用单月桂酸甘油酯与普鲁兰酶脱支后的玉米淀粉进行复合,发现改性后的玉米淀粉能够得到比原淀粉更多的V型复合物。Liu等[10-11]采用复合酶修饰淀粉结构并与月桂酸复合,认为双酶或三酶处理促进了两者反应,生成的复合物更多,抗消化性更强。脂质类型和脂肪酸的碳链长度都能够影响复合的效果[12]。脂质复合的配体脂质多为脂肪酸,少数为单甘酯。Vasiliadou等[13]认为脂肪酸的链长越短,与直链淀粉的相互作用越强。Wang等[14]发现,饱和脂肪酸链长的增加使普通小麦淀粉与脂肪酸形成复合物的络合度降低。谢新华等[15]表明,碳链更短的月桂酸较硬脂酸更容易与稻米淀粉形成复合物。Farooq等[16]发现大米淀粉-脂质复合物的形成提高了样品的抗性淀粉含量,降低了体外消化率。
本研究建立在前期实验的基础上,以糯麦A、B淀粉和不同链长的饱和脂肪酸作为实验原料。首先对糯麦A、B淀粉进行了复合酶脱支改性处理,再向淀粉乳液中分别添加月桂酸(C12)、肉豆蔻酸(C14)、棕榈酸(C16)、硬脂酸(C18)这四种常见的饱和脂肪酸,采用水浴加热的方法制备糯麦淀粉-脂质复合物。本研究的主要目的是探究链长对淀粉-饱和脂肪酸复合物的复合指数、理化性质、结构及消化特性等方面的影响,以期扩大糯麦的应用范围,开发出一款具有降血糖功能的RS5型抗性淀粉,同时为淀粉-脂质复合物的制备和研究提供数据支撑。
1. 材料与方法
1.1 材料与仪器
糯麦2号(直链淀粉含量为4.84%)、高直链玉米淀粉(直链淀粉含量为70%) 河南恒瑞淀粉科技有限公司;普鲁兰酶(1000 U/g) 上海麦克林生化科技有限公司;分支酶(660 U/mL) 丹麦诺维信公司;月桂酸(LA)、肉豆蔻酸(MA)、棕榈酸(PA) 上海源叶生物科技有限公司;硬脂酸(SA) 郑州派尼化学试剂厂;唾液淀粉酶(10 U/mg)、胃蛋白酶(3706 U/mg)、胰酶、淀粉葡糖苷酶(31.2 U/mg) 美国西格玛奥德里奇贸易有限公司;除溴化钾为光谱级外,使用的所有化学物质和试剂均为分析级。
JYL-Y20型破壁料理机 九阳股份有限公司;XMTD-702磁力搅拌油浴锅 上海恩谊科技有限公司;JJ-1精密定时电动搅拌器 常州越新仪器制造有限公司;PHS-3C型数显酸度计 杭州雷磁分析仪器厂;JW-1044R高速冷冻离心机 安徽嘉文仪器装备有限公司;FD-100S真空冷冻干燥机 北京惠诚佳仪科技有限公司;07J200标准试验筛 新乡市千振机械有限公司;XMTD-8222电热鼓风干燥箱 上海精宏实验设备有限公司;A590紫外可见分光光度计 翱艺仪器上海有限公司;尼科拉iS5型傅里叶变换红外光谱仪 美国热费雪科学公司;D8Advance型X射线衍射仪 德国布鲁克公司;NutraScan GI20体外模拟消化仪 澳大利亚NI有限公司;GM9葡萄糖分析仪 美国阿纳洛克斯仪器有限公司;YXQ-LS-75S11立式压力蒸汽灭菌锅 上海博讯医疗生物仪器股份有限公司。
1.2 实验方法
1.2.1 糯麦淀粉的提取及其A、B型淀粉的分离
糯麦淀粉的提取方法参考Zhang等[17],并稍作修改:首先将糯麦籽粒在纯水中浸泡12 h,然后用豆浆机将糯麦打成均匀细腻的浆液,用100目滤网过滤。滤液在3000 r/min下离心10 min,倒掉离心后的上清液,除去最上层的灰色杂质后加入纯水搅拌均匀,再次在3000 r/min下离心10 min并去除杂质,直至得到干净的白色沉淀物,即为糯麦淀粉。将糯麦淀粉置于45 ℃烘箱中干燥24 h至恒重,粉碎后用筛孔直径为0.15 mm的标准筛过筛,留用。
A型和B型糯麦淀粉的分离参考Zhang等[17],采用悬浮法与离心相结合的方式:向烧杯中加入一定量的糯麦淀粉和纯水混合均匀(淀粉重量:纯水体积=1:8),沉淀1 h后取上层悬浮液。按照上述方法反复进行八次左右,至上层悬浮液为澄清状态。用1600目标准筛过滤悬浮液并在3000 r/min下离心10 min,得到的沉淀即为糯麦B型淀粉。将烧杯中的剩余沉淀先以1500 r/min的低速离心10 min,倒掉上清液,加水搅匀后再在3000 r/min下离心10 min,所得沉淀即为糯麦A型淀粉。用45 ℃烘箱对糯麦A、B淀粉干燥24 h,粉碎后用筛孔直径为0.15 mm的标准筛过筛,备用。
1.2.2 糯麦淀粉改性
糯麦淀粉改性参考Guo等[18]的方法并有所更改:体系中的供体为高直链玉米淀粉,受体为糯麦淀粉,受体:供体的质量比例固定为2:1。分别称取20 g糯麦A、B淀粉于1 L烧杯,各自加入10 g高直链玉米淀粉和750 mL的纯水,搅拌均匀。向淀粉乳液中加入2 mol/L的盐酸和氢氧化钠溶液,调pH至4.5左右,沸水浴30 min后迅速冷却。向该体系中加入1.8 g普鲁兰酶,于53 ℃水浴搅拌4 h。反应完成后,沸水浴灭酶10 min。冷却后用2 mol/L的盐酸和氢氧化钠溶液调节淀粉乳的pH为6.5,加入600 μL分支酶,60 ℃水浴搅拌24 h后沸水灭酶10 min。冷却后用两倍体积的50%乙醇进行醇洗和水洗。将沉淀物冷冻干燥,粉碎后过100目筛,得到复合酶改性糯麦淀粉。将经过普鲁兰酶和分支酶协同处理的糯麦A、B改性淀粉分别命名为CEAS和CEBS。
按照糯麦淀粉:高直链玉米淀粉为2:1的比例,分别称取20 g糯麦A、B淀粉,各自与10 g高直链玉米淀粉进行均匀混合,并将糯麦A淀粉与高直链玉米淀粉的混合粉命名为NACS,将糯麦B淀粉与高直链玉米淀粉的混合粉命名为NBCS。
1.2.3 糯麦淀粉-脂质复合物的制备
复合物的制备方法参考Kang等[19]并稍作修改。具体方法如下:准确称取6 g酶处理后的糯麦A、B改性淀粉即CEAS和CEBS,分别加入94 g纯水搅拌均匀,配成6%(w/w)的淀粉乳。再分别称取0.18 g(淀粉重量的3%)月桂酸、肉豆蔻酸、棕榈酸、硬脂酸四种脂肪酸,溶于少量热乙醇中。将两者混匀后于90 ℃水浴加热并磁力搅拌30 min。反应结束后用两倍体积的50%乙醇醇洗两次,洗去未复合的脂肪酸,再水洗两次,即得到糯麦淀粉-脂质复合物。将糯麦A淀粉与月桂酸、肉豆蔻酸、棕榈酸、硬脂酸四种脂质的复合物分别命名为:ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA;将糯麦B淀粉与这四种脂质的复合物分别命名为:BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA。
称取6 g处理后的糯麦A、B改性淀粉即CEAS和CEBS,分别加入94 g纯水配成6%(w/w)的淀粉乳,不加入脂肪酸,仍在90 ℃水浴下搅拌30 min。反应结束后在3000 r/min下离心10 min,将沉淀物冷冻干燥,粉碎过筛,将得到的淀粉命名为ACS-ET和BCS-ET。
1.2.4 复合指数测定
复合指数的测定参考Sun等[20]的方法,并在此基础上进行修改:称取0.3 g糯麦淀粉-脂质复合样品(干基重)于离心管中,加入4.7 g纯水混匀。然后在121 ℃的高压灭菌锅中将样品糊化10 min。再向淀粉糊化液中加入25 mL的纯水,涡旋2 min后,以4000 r/min的转速离心15 min。先向25 mL试管中加入离心后的上清液0.5 mL,再分别加入15 mL纯水和2 mL碘溶液(2.0% KI和1.3% I2,w/v),振荡摇匀。在波长为690 nm处测定吸光度,以未复合脂肪酸的糯麦改性淀粉样品作为空白对照。CI值的计算方法见公式(1)。
复合指数(CI值)=Abs空白−Abs样品Abs空白×100% (1) 式中:Abs空白为未复合脂肪酸的糯麦改性淀粉的吸光度;Abs样品为糯麦淀粉-脂质复合物的吸光度。
1.2.5 溶解度和膨胀力测定
溶解度和膨胀力参照Li等[21]的方法测定。分别称取0.2 g两种混合淀粉、两种未复合脂质的糯麦改性淀粉以及八种糯麦淀粉-脂质复合物样品,记为m。向已称重的离心管m1中加入10 mL纯水,分别在50、60、70、80、90 ℃的恒温水浴锅中保持1 h,冷却至室温后在3000 r/min下离心20 min。将培养皿m2恒重后盛装上清液,置于105 ℃烘箱中再次烘干至恒重,记为m4。将离心管倒扣沥干水分后称重,记作m3。溶解度和膨胀力的计算方法见公式(2)和公式(3)。
溶解度(SA)=m4−m2m×100% (2) 膨胀力(SP)=m3−m1m×(1−SA) (3) 式中:m为样品重量,g;m1为空离心管重,g;m2为培养皿重量,g;m3为离心后沉淀和离心管的总重量,g;m4为烘干上清液后培养皿的重量,g。
1.2.6 碘吸收曲线测定
碘吸收曲线测定参考李蒙娜[22]的方法,并稍作修改。称取80 mg的两种混合淀粉、两种未复合脂质的糯麦改性淀粉以及8种糯麦淀粉-脂质复合物样品于离心管中,配制90%的DMSO溶液并吸取4 mL与淀粉充分混合。然后于100 ℃沸水中加热20 min。取1 mL加热后的溶液,加入40 mL纯水和5 mL碘液(1.0% KI和0.1% I2,w/v)混合均匀,最后加水定容至50 mL。将溶液置于室温平衡30 min后,使用紫外分光光度计在波长范围为400~800 nm处进行全波长扫描测定。
1.2.7 X射线衍射测定
使用X射线衍射仪研究淀粉内部的结晶特性。取少量混合淀粉、未复合脂质的糯麦改性淀粉以及糯麦淀粉-脂质复合物的样品平铺于载物台上,具体参数的设定参考Yuan等[23],并稍作修改。X射线源为Cu-Kα射线(λ=1.54056 nm),测试电压为40 kV,管电流为40 mA,步长为0.02°,衍射角2θ的范围为4°~60°,扫描速率为2°/min。相对结晶度的计算方式为结晶面积与总面积的比例乘以100。
1.2.8 傅立叶变换红外光谱测定
参考Thangavel等[24]的方法,固定淀粉和溴化钾的质量比例为1:200。分别称取两种混合淀粉、两种未复合脂质的糯麦改性淀粉以及八种糯麦淀粉-脂质复合物样品,与溴化钾充分混合后研磨10 min,然后对其进行压片处理,采用傅立叶红外光谱仪在400~4000 cm−1的光谱范围内扫描,次数为64,分辨率为4 cm−1。一组样品平行测定三次,并且计算1047/1022 cm−1的峰强度比值。
1.2.9 pGI值测定
pGI值的测定方法与Jian等[25]一致,均使用NutraScan GI20体外模拟消化系统,通过在体外环境下模拟碳水化合物的水解从而预测食物的GI值[26]。该系统能够模拟食物依次经过口腔、胃和小肠的消化过程。首先将待测样品在121 ℃糊化10 min并冷冻干燥,称取冻干后的样品约50 mg于消化管中。然后向管中加入2 mL溶于磷酸盐缓冲液(pH7.0)中的唾液淀粉酶,反应5 min;再加入5 mL溶于盐酸溶液(pH2.0)中的胃蛋白酶,消化30 min;最后依次加入5 mL氢氧化钠溶液(0.02 mol/L)、25 mL乙酸钠缓冲液(pH6.0)和5 mL溶于乙酸钠缓冲液(pH6.0)中的混酶(胰酶与淀粉葡萄糖苷酶),总消化时间为300 min。样品在此期间产生的葡萄糖含量由葡萄糖分析仪测定,再通过软件换算成对应的预测血糖指数。pGI的计算方法见公式(4)。
pGI=C×VA×100 (4) 式中:C为葡萄糖分析仪分析的葡萄糖含量,mg/mL;V为保留体积,mL;A为葡萄糖当量(碳水化合物总可用性/0.9),mg。
1.3 数据处理
结果用三次重复测定的平均值±标准偏差表示。用 SPSS 21.0和Origin 8.0对实验数据进行处理,P<0.05即为显著性差异。
2. 结果与分析
2.1 复合指数分析
复合指数又称为络合度,它能够反映淀粉分子与脂质之间紧密络合的程度。复合物的CI值越高,则意味着淀粉分子与脂肪酸的结合程度越高。图1~图2显示了不同链长的饱和脂肪酸与糯麦淀粉复合物的CI值之间的关系。从图2中可以看出,随着饱和脂肪酸中的碳原子数从12增加到18,糯麦淀粉-脂质复合物的CI值逐渐降低,这意味着络合能力的下降。这一结论与Chao等[2]、Kawai等[27]、Lu等[28]的研究结果一致。LA与糯麦A、B改性淀粉的复合效果最好,高达50%以上,SA的复合效果最差,仅在40%左右。BCS-ET与脂肪酸的复合效果好于ACS-ET,这是因为B淀粉的颗粒小于A淀粉颗粒,且具有更大的比表面积和更多的数量,容易与脂肪酸接触,故此可以结合更多的脂质[29]。此外,碳原子数量与CI值呈线性相关,R2=0.9866。这可能是因为碳链越长的脂肪酸有着更大的颗粒结构,因此随着碳链的增长,脂肪酸的空间位阻逐渐增大,亲水性和溶解性变差,无法均匀分散,从而很难进入淀粉分子内部,并与其螺旋空腔发生络合;相反,那些分子较小且有着较短链长的脂肪酸则更容易与淀粉形成脂质复合物[30]。还有一种可能性是由于ACS-ET和BCS-ET的分子量较低,脂肪酸的碳原子链长越短,形成单螺旋结构的能力较强;而较长碳链的脂肪酸可能会导致一个脂肪酸分子与多个ACS-ET或BCS-ET分子结合,形成了多个单螺旋结构[28]。
![]() 图 1 糯麦A、B淀粉-脂质复合物的复合指数注:ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA分别为糯麦A淀粉-月桂酸复合物、糯麦A淀粉-肉豆蔻酸复合物、糯麦A淀粉-棕榈酸复合物、糯麦A淀粉-硬脂酸复合物;BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA分别为糯麦B淀粉-月桂酸复合物、糯麦B淀粉-肉豆蔻酸复合物、糯麦B淀粉-棕榈酸复合物、糯麦B淀粉-硬脂酸复合物;同一指标上有不同上标字母者表示差异显著(P<0.05)。Figure 1. Composite index of starch-lipid complexes of waxy wheat A and B
图 1 糯麦A、B淀粉-脂质复合物的复合指数注:ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA分别为糯麦A淀粉-月桂酸复合物、糯麦A淀粉-肉豆蔻酸复合物、糯麦A淀粉-棕榈酸复合物、糯麦A淀粉-硬脂酸复合物;BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA分别为糯麦B淀粉-月桂酸复合物、糯麦B淀粉-肉豆蔻酸复合物、糯麦B淀粉-棕榈酸复合物、糯麦B淀粉-硬脂酸复合物;同一指标上有不同上标字母者表示差异显著(P<0.05)。Figure 1. Composite index of starch-lipid complexes of waxy wheat A and B2.2 溶解度和膨胀力分析
物理混合糯麦淀粉、改性糯麦淀粉以及脂质复合样品在不同温度下的溶解度和膨胀力分别见表1~表2。由表可知,随着温度的升高,所有样品的溶解度和膨胀力均逐渐增加。因为温度破坏了淀粉分子间的氢键,导致淀粉的吸水性增强,同时使部分可溶性淀粉逸出[31]。而ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA这四种脂质复合物与未复合脂质的样品ACS-ET相比,溶解度和膨胀力明显发生下降,且这种趋势在更高的温度下表现更为明显,这表明了脂肪酸的存在使淀粉结构更加紧密,水分不容易进入淀粉颗粒内部。脂肪酸的添加可以有效阻止直链淀粉的浸出,并延缓糊化过程,从而使膨胀力降低[32]。BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA这四种脂质复合物与未复合脂质的样品BCS-ET相比,溶解度和膨胀力也出现明显下降的趋势。此外,淀粉-脂肪酸复合物的溶解度和膨胀力与其复合指数有关[33]。ACS-ET-LA与BCS-ET-LA的溶解度和膨胀力最低,ACS-ET-SA和BCS-ET-SA的溶解度和膨胀力最高,且从LA到SA,随着碳原子数的增大,糯麦淀粉与脂肪酸的复合指数逐渐减小,而样品的溶解度和膨胀力越来越大。B淀粉-脂质复合物的CI值略高于A淀粉-脂质复合物,但B淀粉-脂质复合物的溶解度和膨胀力整体上小于A淀粉-脂质复合物,这说明B淀粉结合了较多的脂肪酸,且与脂肪酸的结合较A淀粉更加紧密,脂质的存在导致水分子难以进入,直链淀粉不容易逸出。
表 1 糯麦A、B淀粉-脂质复合物的溶解度Table 1. Solubility of waxy wheat A and B starch-lipid complexes样品 溶解度(%) 50 ℃ 60 ℃ 70 ℃ 80 ℃ 90 ℃ NACS 0.45±0.92fA 0.78±0.03fB 2.81±0.14aC 4.90±0.18aD 9.43±0.50aE ACS-ET 1.31±0.27aA 1.86±0.38aB 2.71±0.16bC 4.33±0.42bD 4.96±0.08bE ACS-ET-LA 0.67±0.15eA 0.92±0.24eB 1.13±0.32fC 1.56±0.75fD 1.99±0.46fE ACS-ET-MA 0.85±0.23dA 1.09±0.81dB 1.42±0.12eC 1.82±0.66eD 2.53±0.34eE ACS-ET-PA 1.09±0.37cA 1.43±0.02cB 2.08±0.95dC 2.71±0.36dD 3.49±0.16dE ACS-ET-SA 1.27±0.35bA 1.79±0.55bB 2.57±0.04cC 3.22±1.27cD 4.28±0.21cE NBCS 0.59±0.10fA 1.66±0.06cB 4.81±0.33aC 6.94±0.35aD 9.32±0.19aE BCS-ET 1.58±0.03aA 2.23±0.10aB 2.67±0.29cC 4.41±0.08bD 5.27±0.66bE BCS-ET-LA 0.61±0.24eA 0.84±0.04eB 1.06±0.39fC 1.37±0.13fD 1.74±0.30fE BCS-ET-MA 0.73±0.03dA 1.02±0.67dB 1.34±0.52eC 1.66±0.09eD 2.24±0.75eE BCS-ET-PA 1.01±0.65cA 1.38±0.42cB 2.16±1.06dC 2.77±0.13dD 3.61±0.90dE BCS-ET-SA 1.22±0.51bA 1.74±0.65bB 2.48±0.77bC 3.16±0.48cD 4.20±0.14cE 注:NACS为糯麦A淀粉与高直链玉米淀粉按照2:1混合的混合淀粉;ACS-ET为未与脂质复合的糯麦改性A淀粉;NBCS为糯麦B淀粉与高直链玉米淀粉按照2:1混合的混合淀粉;BCS-ET为未与脂质复合的糯麦改性B淀粉;不同大写字母表示在同行数据存在显著差异(P<0.05);不同小写字母表示同列数据有显著差异(P<0.05);表2~表3同。 表 2 糯麦A、B淀粉-脂质复合物的膨胀力Table 2. Swelling power of waxy wheat A and B starch-lipid complex样品 膨胀力(g/g) 50 ℃ 60 ℃ 70 ℃ 80 ℃ 90 ℃ NACS 2.04±0.15fA 4.36±0.08aB 11.45±0.58aC 14.49±0.24aD 21.42±1.07aE ACS-ET 3.45±0.04aA 3.69±0.22bB 4.01±0.26bC 4.13±0.26bD 4.26±0.58bE ACS-ET-LA 2.88±0.42eA 2.94±0.05fB 3.03±0.16fC 3.16±0.77fD 3.34±0.91fE ACS-ET-MA 2.94±0.51dA 3.01±0.37eB 3.17±0.24eC 3.22±0.08eD 3.41±0.25eE ACS-ET-PA 3.17±0.36cA 3.26±0.18dB 3.39±0.03dC 3.51±0.42dD 3.66±0.17dE ACS-ET-SA 3.21±0.77bA 3.33±0.02cB 3.47±0.10cC 3.60±0.31cD 3.79±0.44cE NBCS 2.24±0.38fA 4.17±0.29aB 15.31±0.70aC 23.40±0.27aD 25.08±0.32aE BCS-ET 3.26±0.19aA 3.61±0.01bB 3.45±0.12bC 3.99±1.41bD 4.07±0.48bE BCS-ET-LA 2.74±0.33eA 2.80±0.24fB 2.96±0.05fC 3.07±0.52fD 3.18±0.60fE BCS-ET-MA 2.87±0.18dA 2.97±.036eB 3.05±0.13eC 3.18±0.64eD 3.29±0.24eE BCS-ET-PA 2.95±0.04cA 3.05±0.71dB 3.11±0.22dC 3.29±0.47dD 3.47±0.03dE BCS-ET-SA 3.01±0.62bA 3.16±0.15cB 3.33±0.40cC 3.46±0.23cD 3.64±0.51cE 2.3 碘吸收曲线分析
碘比色法的原理是淀粉与碘相互作用产生颜色反应[34]。直链淀粉能够结合较多的碘分子,呈现出蓝色;而支链淀粉的分支较短,能够络合的碘分子较少,显示为紫红色[35]。直链淀粉与碘形成络合物的最大吸收峰位于600~640 nm间,而支链淀粉-碘络合物的最大吸收峰在520~560 nm[36]。图3显示了糯麦A、B淀粉-脂质复合物在400~800 nm间的碘吸收曲线。由图可知,所有淀粉样品的最大吸收峰均位于580~600 nm,这一波长范围位于直链淀粉与支链淀粉之间,这说明其中均含有直链和支链淀粉[37]。但酶处理样品ACS-ET、BCS-ET的碘吸收曲线比糯麦混合粉NACS、NBCS以及脂质复合样品ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA和BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA的吸收峰更窄更尖,这说明经过酶处理后,ACS-ET和BCS-ET的分子量分布更加集中[38]。与ACS-ET、BCS-ET相比,几种脂质复合物的吸光度值均大幅度降低,说明ACS-ET、BCS-ET中的部分直链淀粉与饱和脂肪酸进行了不同程度的复合,导致复合物与碘的结合能力降低,吸光度值减小,且这种减小的趋势随着脂肪酸碳原子数的减少而愈发明显。这说明碳原子数越长,直链淀粉与脂质结合得越不紧密。这一结论与前面得到的脂质复合物的CI值结果保持一致。
2.4 X射线衍射分析
淀粉与脂质复合物样品的X射线衍射图谱如图4所示。NACS和NBCS在2θ=15°和23°处表现出较强的衍射峰,在18°处出现主衍射双峰。糯麦淀粉的晶型为A型,高直链玉米淀粉的晶型为B型,两者经过物理混合后的样品呈现出A型的晶体结构[39]。混合淀粉经复合酶修饰后,ACS-ET与BCS-ET在2θ=17°、20°左右出现了较强的衍射峰,在26°处有一个弱的衍射峰,而在15°、18°、23°处的衍射峰消失,且峰强和峰高都有所降低。这可能是由于酶处理使淀粉的双螺旋结构打开,分子链发生重排,结晶结构遭到破坏。ACS-ET与BCS-ET与脂肪酸形成的复合物显示出V型结构的峰,在2θ=17°、20°有两个较强的衍射峰,在21.5°和26°处存在弱的特征衍射峰,这是由于形成的复合物在冷却过程中,脂肪酸的疏水基团进入了直链淀粉的螺旋腔内发生了淀粉重结晶[40]。从图中可以发现,随着碳原子数的增加,ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA和BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA的峰强度逐渐降低。这说明链长较短的脂肪酸与淀粉具有更强的分子间相互作用,从而能够降低复合物对酶消化的敏感性,提高其抗消化性。
糯麦淀粉-脂质复合物的相对结晶度如表3所示。从表3中可以看出,与NACS和NBCS相比,酶处理改变了淀粉颗粒的微晶取向,使NACS的相对结晶度从15.78%提高到了21.38%,NBCS的相对结晶度从19.04%提高到21.30%。而脂质复合物的形成使相对结晶度有了大幅度的增加,最高从21.38%提高到了25.37%。相对结晶度越高,意味着结晶区所占比例越大,分子内部排列越规律,结构更紧密有序。而当饱和脂肪酸的碳链长从12增加到16时,ACS-ET-LA、ACS-ET-MA、ACS-ET-PA和BCS-ET-LA、BCS-ET-MA、BCS-ET-PA的相对结晶度总体呈下降趋势,ACS-ET与脂肪酸复合物的相对结晶度从25.37%下降到21.53%,BCS-ET与脂肪酸复合物的相对结晶度从23.50%降低为20.49%。当链长增加至18个碳时,ACS-ET-SA和BCS-ET-SA的相对结晶度反而较ACS-ET-PA和BCS-ET-PA的略高,分别为22.31%和21.75%,但仍低于ACS-ET-LA和BCS-ET-LA。这说明,ACS-ET与BCS-ET与LA之间分子间相互作用较其他脂肪酸更强,所形成复合物的结构最为紧密,并呈现更高的有序度,能够提高淀粉的抗消化性。这与后面得到的ACS-ET-LA和BCS-ET-LA的体外消化结果一致。
表 3 糯麦A、B淀粉-脂质复合物的相对结晶度、1047 cm−1/1022 cm−1的比值及预测GI值Table 3. Relative crystallinity of starch-lipid complexes of waxy wheat A and B, ratio of 1047 cm−1/1022 cm−1 and predicted GI value样品 相对结晶度
(%)红外光谱1047 cm−1/
1022 cm−1处的比值预测GI值 NACS 15.78 0.936 69.98±2.27a ACS-ET 21.38 1.005 47.63±1.05b ACS-ET-LA 25.37 0.993 36.61±0.74f ACS-ET-MA 24.51 0.987 39.15±0.33e ACS-ET-PA 21.53 0.982 41.90±0.06d ACS-ET-SA 22.31 0.989 43.47±1.21c NBCS 19.04 0.970 70.19±0.58a BCS-ET 21.30 0.992 48.30±3.17b BCS-ET-LA 23.50 0.989 35.49±0.94f BCS-ET-MA 22.61 0.978 38.39±0.51e BCS-ET-PA 20.49 0.971 40.44±0.28d BCS-ET-SA 21.75 0.984 42.06±0.55c 对比糯麦A、B淀粉分别与脂质形成的复合物可以发现,四种糯麦A淀粉-脂质复合物的相对结晶度均大于同一种糯麦B淀粉-脂质复合物的相对结晶度。这种现象的出现可能与直、支链淀粉的含量有关。一般支链淀粉分子越多,适合形成双螺旋的侧链越多,导致淀粉具有较高的相对结晶度[41]。但直支比不是唯一的影响因素,淀粉分子的颗粒大小、粒度分布、短程有序性以及分子内C-6位羟基形成的氢键含量都会影响最终的相对结晶度[42-43]。
2.5 红外光谱分析
由图5可知,糯麦淀粉-脂肪酸复合物与物理混合的糯麦淀粉和复合酶改性后的糯麦淀粉相比,红外光谱上并未出现新的特征峰,这说明淀粉与脂质复合只进行了分子间的相互作用,没有发生化学反应。但不同样品的峰强、峰宽和出峰位置略有不同。糯麦混合粉NACS、NBCS和糯麦改性淀粉ACS-ET、BCS-ET及脂质复合物ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA和BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA的红外光谱均在3440、2923、1645、1157 cm−1附近出现了吸收峰。相较于ACS-ET和BCS-ET,其他样品的峰强和峰宽均有所减小。淀粉中的O-H、-CH2、CHO和C-O基团的伸缩振动分别导致了3440、2923、1645、1157 cm−1处形成了吸收峰;而在700~1100 cm−1内出现的特征峰是由D-吡喃葡萄糖羟基相连的C-O伸缩振动导致的。脂质复合样品在1703、1245 cm−1左右并未出现吸收峰,这可能是由于复合物的振动峰屏蔽了脂肪酸的振动峰[44],这与郭宏伟等[1]的研究结果一致。
表3为糯麦淀粉-脂质复合物在1047 cm−1/1022 cm−1处的比值。它代表了淀粉中有序的晶体相对无定形区的量,比值越大,淀粉的短程有序度越高[10]。ACS-ET和BCS-ET在1047 cm−1/1022 cm−1处的比值大于NACS、NBCS的比值,说明酶法改性增强了分子的短程有序性。而与脂肪酸复合后,这一比值介于NACS、NBCS和ACS-ET、BCS-ET之间,脂质复合物与糯麦混合粉相比,淀粉分子结构从无序状态向有序状态转变。对比几种脂质复合物的比值,发现ACS-ET-LA和BCS-ET-LA的比值最高,ACS-ET-PA和BCS-ET-PA的比值最低,这可能是因为LA的碳链较短,空间位阻小,更容易与脂质结合,形成更有序的结构。这一结论与样品的复合指数和晶体结构的结果一致。
糯麦A淀粉-脂质复合物在1047 cm−1/1022 cm−1处比糯麦B淀粉-脂质复合物具有更高的比率,这表明糯麦A淀粉与脂质形成的复合物的短程有序性更高,与B淀粉相比具有更高的结晶度。这与X衍射得到的结果一致。
2.6 pGI值分析
GI值能够反映食物被机体消化后生成的血糖水平,食物的GI值越低,越适合糖尿病人食用。糯麦淀粉及其脂质复合物的体外模拟消化曲线及消化过程中的GI值如图6所示。由图6可知,糯麦淀粉与高直链玉米淀粉的混合粉NACS和NBCS在各个消化阶段的GI值始终高于其他样品。而经复合酶改性后的样品ACS-ET和BCS-ET的GI值有所降低,这意味着普鲁兰酶和分支酶协同处理显著提高了糯麦A、B淀粉对消化酶的抵抗力。在此基础上,改性糯麦淀粉与不同链长的饱和脂肪酸复合后,样品在各个消化阶段的GI值有了进一步降低。这说明脂质复合物的形成能够有效减小淀粉被酶水解的程度。通过对比ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA和BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA可以发现,ACS-ET-LA和BCS-ET-LA的曲线最低,ACS-ET-PA、BCS-ET-PA和ACS-ET-SA、BCS-ET-SA的曲线较高,这说明在这四种饱和脂肪酸中,月桂酸与改性糯麦淀粉形成的复合物抗酶解性较好。当消化时间处于0~60 min时,所有样品的GI值增速都较迅速;当消化时间处于60~120 min时,除了NACS和NBCS外,样品的增速有所减缓;当消化时间在120~300 min时,所有淀粉GI值的增加十分缓慢,甚至出现持平或小幅度下跌的现象;当消化结束时ACS-ET和BCS-ET的GI值最低,NACS和NBCS的GI值最高。
糯麦A、B淀粉-脂质复合物的pGI值见表3。由表3可知,NACS和NBCS的pGI值分别为69.98和70.19,ACS-ET和BCS-ET的pGI值分别为47.63和48.30。酶处理使pGI值降低,可能是因为普鲁兰酶和分支酶使α-1,6糖苷键的数量增加,从而增强了空间位阻,提高了淀粉的抗消化性。ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA的pGI值分别为36.61、39.15、41.90和43.47;BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA的pGI值分别为35.49、38.39、40.44和42.06。从中可以看出,淀粉与脂质进行复合后,pGI值进一步降低,但是降低程度不同,pGI值最低的为ACS-ET-LA和BCS-ET-LA,分别为36.61和35.49;且随着脂肪酸碳链的增加,pGI值逐渐降低。这可能是因为碳链越长,空间位阻越大,增加了脂肪酸与淀粉复合的难度,形成的复合物较少,抗酶解性也较差。这与样品的复合指数结果保持一致。
由于糯麦B淀粉的比表面积比A淀粉要大,且B淀粉的数量更多,故而更容易与脂质复合形成较为紧密的复合物,形成的复合物的数量也会更多。脂肪酸进入BCS-ET的螺旋内部,与其牢固结合,使酶的水解作用受到阻碍,淀粉的消化速率变得更加缓慢;且复合物的存在能够增强淀粉的抗酶解性,复合物的数量越多,抗酶解性就越强。因此糯麦B淀粉-脂质复合物较糯麦A淀粉-脂质复合物的抗消化性更好。
3. 结论
本研究结果表明,在预先用普鲁兰酶和分支酶处理糯麦淀粉与高直链玉米淀粉混合粉的基础上,将改性后的糯麦淀粉分别与月桂酸(C12)、肉豆蔻酸(C14)、棕榈酸(C16)、硬脂酸(C18)这四种不同链长的饱和脂肪酸进行复合,得到的脂质复合物GI值显著降低(P<0.05),结构和理化特性也有所改变。而糯麦A、B改性淀粉分别与脂质复合后,在CI值和pGI值上有略微差异,B淀粉与这几种脂肪酸的复合效果更好。在C12~C18这一范围内,随着脂肪酸碳链的增长,糯麦改性淀粉与脂肪酸复合的效果越差,直链淀粉含量降低,相对结晶度降低,分子有序结构减弱,溶解度和膨胀力逐渐变大,这些改变促使样品的pGI值也逐渐增大,抗酶解能力大幅度降低。因此在这四种脂肪酸中,月桂酸与糯麦A、B改性淀粉形成的复合物能够显著改善糯麦淀粉的消化特性。这一发现对于糖尿病人食物的研制具有重要意义,同时能够提升糯麦的应用价值,开发出以糯麦淀粉为原料的保健产品。
-
图 1 糯麦A、B淀粉-脂质复合物的复合指数
注:ACS-ET-LA、ACS-ET-MA、ACS-ET-PA、ACS-ET-SA分别为糯麦A淀粉-月桂酸复合物、糯麦A淀粉-肉豆蔻酸复合物、糯麦A淀粉-棕榈酸复合物、糯麦A淀粉-硬脂酸复合物;BCS-ET-LA、BCS-ET-MA、BCS-ET-PA、BCS-ET-SA分别为糯麦B淀粉-月桂酸复合物、糯麦B淀粉-肉豆蔻酸复合物、糯麦B淀粉-棕榈酸复合物、糯麦B淀粉-硬脂酸复合物;同一指标上有不同上标字母者表示差异显著(P<0.05)。
Figure 1. Composite index of starch-lipid complexes of waxy wheat A and B
表 1 糯麦A、B淀粉-脂质复合物的溶解度
Table 1 Solubility of waxy wheat A and B starch-lipid complexes
样品 溶解度(%) 50 ℃ 60 ℃ 70 ℃ 80 ℃ 90 ℃ NACS 0.45±0.92fA 0.78±0.03fB 2.81±0.14aC 4.90±0.18aD 9.43±0.50aE ACS-ET 1.31±0.27aA 1.86±0.38aB 2.71±0.16bC 4.33±0.42bD 4.96±0.08bE ACS-ET-LA 0.67±0.15eA 0.92±0.24eB 1.13±0.32fC 1.56±0.75fD 1.99±0.46fE ACS-ET-MA 0.85±0.23dA 1.09±0.81dB 1.42±0.12eC 1.82±0.66eD 2.53±0.34eE ACS-ET-PA 1.09±0.37cA 1.43±0.02cB 2.08±0.95dC 2.71±0.36dD 3.49±0.16dE ACS-ET-SA 1.27±0.35bA 1.79±0.55bB 2.57±0.04cC 3.22±1.27cD 4.28±0.21cE NBCS 0.59±0.10fA 1.66±0.06cB 4.81±0.33aC 6.94±0.35aD 9.32±0.19aE BCS-ET 1.58±0.03aA 2.23±0.10aB 2.67±0.29cC 4.41±0.08bD 5.27±0.66bE BCS-ET-LA 0.61±0.24eA 0.84±0.04eB 1.06±0.39fC 1.37±0.13fD 1.74±0.30fE BCS-ET-MA 0.73±0.03dA 1.02±0.67dB 1.34±0.52eC 1.66±0.09eD 2.24±0.75eE BCS-ET-PA 1.01±0.65cA 1.38±0.42cB 2.16±1.06dC 2.77±0.13dD 3.61±0.90dE BCS-ET-SA 1.22±0.51bA 1.74±0.65bB 2.48±0.77bC 3.16±0.48cD 4.20±0.14cE 注:NACS为糯麦A淀粉与高直链玉米淀粉按照2:1混合的混合淀粉;ACS-ET为未与脂质复合的糯麦改性A淀粉;NBCS为糯麦B淀粉与高直链玉米淀粉按照2:1混合的混合淀粉;BCS-ET为未与脂质复合的糯麦改性B淀粉;不同大写字母表示在同行数据存在显著差异(P<0.05);不同小写字母表示同列数据有显著差异(P<0.05);表2~表3同。 表 2 糯麦A、B淀粉-脂质复合物的膨胀力
Table 2 Swelling power of waxy wheat A and B starch-lipid complex
样品 膨胀力(g/g) 50 ℃ 60 ℃ 70 ℃ 80 ℃ 90 ℃ NACS 2.04±0.15fA 4.36±0.08aB 11.45±0.58aC 14.49±0.24aD 21.42±1.07aE ACS-ET 3.45±0.04aA 3.69±0.22bB 4.01±0.26bC 4.13±0.26bD 4.26±0.58bE ACS-ET-LA 2.88±0.42eA 2.94±0.05fB 3.03±0.16fC 3.16±0.77fD 3.34±0.91fE ACS-ET-MA 2.94±0.51dA 3.01±0.37eB 3.17±0.24eC 3.22±0.08eD 3.41±0.25eE ACS-ET-PA 3.17±0.36cA 3.26±0.18dB 3.39±0.03dC 3.51±0.42dD 3.66±0.17dE ACS-ET-SA 3.21±0.77bA 3.33±0.02cB 3.47±0.10cC 3.60±0.31cD 3.79±0.44cE NBCS 2.24±0.38fA 4.17±0.29aB 15.31±0.70aC 23.40±0.27aD 25.08±0.32aE BCS-ET 3.26±0.19aA 3.61±0.01bB 3.45±0.12bC 3.99±1.41bD 4.07±0.48bE BCS-ET-LA 2.74±0.33eA 2.80±0.24fB 2.96±0.05fC 3.07±0.52fD 3.18±0.60fE BCS-ET-MA 2.87±0.18dA 2.97±.036eB 3.05±0.13eC 3.18±0.64eD 3.29±0.24eE BCS-ET-PA 2.95±0.04cA 3.05±0.71dB 3.11±0.22dC 3.29±0.47dD 3.47±0.03dE BCS-ET-SA 3.01±0.62bA 3.16±0.15cB 3.33±0.40cC 3.46±0.23cD 3.64±0.51cE 表 3 糯麦A、B淀粉-脂质复合物的相对结晶度、1047 cm−1/1022 cm−1的比值及预测GI值
Table 3 Relative crystallinity of starch-lipid complexes of waxy wheat A and B, ratio of 1047 cm−1/1022 cm−1 and predicted GI value
样品 相对结晶度
(%)红外光谱1047 cm−1/
1022 cm−1处的比值预测GI值 NACS 15.78 0.936 69.98±2.27a ACS-ET 21.38 1.005 47.63±1.05b ACS-ET-LA 25.37 0.993 36.61±0.74f ACS-ET-MA 24.51 0.987 39.15±0.33e ACS-ET-PA 21.53 0.982 41.90±0.06d ACS-ET-SA 22.31 0.989 43.47±1.21c NBCS 19.04 0.970 70.19±0.58a BCS-ET 21.30 0.992 48.30±3.17b BCS-ET-LA 23.50 0.989 35.49±0.94f BCS-ET-MA 22.61 0.978 38.39±0.51e BCS-ET-PA 20.49 0.971 40.44±0.28d BCS-ET-SA 21.75 0.984 42.06±0.55c -
[1] 郭宏伟, 赵城彬, 吴玉柱, 等. 红豆淀粉-脂质复合物结构及体外消化性质[J]. 食品科学,2019,40(21):21−27. [GUO Hongwei, ZHAO Chengbin, WU Yuzhu, et al. Red bean starch-lipid complex structure and in vitro digestion properties[J]. Food Science,2019,40(21):21−27. doi: 10.7506/spkx1002-6630-20181112-125 [2] CHAO, CHEN, YU, et al. Mechanisms underlying the formation of complexes between maize starch and lipids[J]. Journal of Agricultural & Food Chemistry,2018,66(1):272−278.
[3] REDDY C K, CHOI S M, LEE D J, et al. Complex formation between starch and stearic acid: Effect of enzymatic debranching for starch[J]. Food Chemistry,2018,244:136−142. doi: 10.1016/j.foodchem.2017.10.040
[4] OVERTVELDT S V, VERHAEGHE T, JOOSTEN H J, et al. A structural classification of carbohydrate epimerases: From mechanistic insights to practical applications[J]. Biotechnology Advances,2015,33(8):1814−1828. doi: 10.1016/j.biotechadv.2015.10.010
[5] HU X P, HUANG T T, MEI J Q, et al. Effects of continuous and intermittent retrogradation treatments on in vitro digestibility and structural properties of waxy wheat starch[J]. Food Chemistry,2015,174:31−36. doi: 10.1016/j.foodchem.2014.11.026
[6] 褚绍言, 孙冰华, 田潇凌, 等. 淀粉-脂质复合物的形成及其性质的研究进展[J]. 食品研究与开发,2021,42(12):206−211. [CHU Shaoyan, SUN Binghua, TIAN Xiaoling, et al. Research progress on the formation and properties of starch-lipid complexes[J]. Food Research and Development,2021,42(12):206−211. doi: 10.12161/j.issn.1005-6521.2021.12.032 [7] 黄承刚, 李津源, 徐任园, 等. 直链淀粉含量对淀粉-脂肪酸复合物形成及理化特性的影响[J/OL]. 食品工业科技: 1−12[2022-01-18]. HUANG Chenggang, LI Jinyuan, XU Renyuan, et al. Effects of amylose content on the formation and physicochemical properties of starch-fatty acid complexes[J/OL]. Food Industry Science and Technology: 1−12[2022-01-18].
[8] WANG R, LIU P F, CUI B, et al. Effects of pullulanase debranching on the properties of potato starch -lauric acid complex and potato starch-based film[J]. International Journal of Biological Macromolecules,2020,156(1):1330−1336.
[9] LIU P F, KANG X M, CUI B, et al. Effects of amylose content and enzymatic debranching on the properties of maize starch-glycerol monolaurate complexes[J]. Carbohydrate Polymers,2019,222:115000. doi: 10.1016/j.carbpol.2019.115000
[10] LIU P F, GAO W, ZHANG X L, et al. Physicochemical properties of pea starch-lauric acid complex modified by maltogenic amylase and pullulanase[J]. Carbohydrate Polymers,2020,242:116332. doi: 10.1016/j.carbpol.2020.116332
[11] LIU P F, FANGY S, ZHANG X L, et al. Effects of multienzyme treatment on the physicochemical properties of maize starch-lauric acid complex[J]. Food Hydrocolloids,2020,107:105941. doi: 10.1016/j.foodhyd.2020.105941
[12] WANG S J, CHAO C, CAI J J, et al. Starch-lipid and starch-lipid-protein complexes: A comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(3):1056−1079. doi: 10.1111/1541-4337.12550
[13] VASILLIADOU E, RAPHAELIDES S N, PAPASTERGIADIS E. Effect of heating time and temperature on partially gelatinized starch-fatty acid interactions[J]. LWT-Food Science and Technology,2015,60(2):698−707. doi: 10.1016/j.lwt.2014.10.026
[14] WANG S J, WANG J R, YU J L, et al. Effect of fatty acids on functional properties of normal wheat and waxy wheat starches: A structural basis[J]. Food Chemistry,2016,190:285−292. doi: 10.1016/j.foodchem.2015.05.086
[15] 谢新华, 孙曙光, 王娜, 等. 淀粉-脂类复合物对稻米淀粉黏滞特性的影响[J]. 中国食品学报,2013,13(8):91−95. [XIE Xinhua, SUN Shuguang, WANG Na, et al. Effects of starch-lipid complexes on the viscosity properties of rice starch[J]. Chinese Journal of Food Science,2013,13(8):91−95. [16] FAROOQ A M, DHITAL S, LI C, et al. Effects of palm oil on structural and in vitro digestion properties of cooked rice starches[J]. International Journal of Biological Macromolecules,2017,107:1080−1085.
[17] ZHANG K, ZHAO D, ZHANG X, et al. Effects of the removal of lipids and surface proteins on the physicochemical and structural properties of green wheat starches[J]. Starch‐Stärke, 2021, 73(1−2).
[18] GUO L, LI J, GUI Y, et al. Improving waxy rice starch functionality through branching enzyme and glucoamylase: Role of amylose as a viable substrate[J]. Carbohydrate Polymers,2019,230:115712.
[19] KANG X, LIU P, GAO W, et al. Preparation of starch-lipid complex by ultrasonication and its film forming capacity[J]. Food Hydrocolloids,2020,99:105340. doi: 10.1016/j.foodhyd.2019.105340
[20] SUN S, JIN Y, HONG Y, et al. Effects of fatty acids with various chain lengths and degrees of unsaturation on the structure, physicochemical properties and digestibility of maize starch-fatty acid complexes[J]. Food Hydrocolloids,2021,110:106224. doi: 10.1016/j.foodhyd.2020.106224
[21] LI X, GAO X, LU J, et al. Complex formation, physicochemical properties of different concentration of palmitic acid yam (Dioscorea pposita Thunb.) starch preparation mixtures[J]. LWT-Food Science and Technology,2019:130−137.
[22] 李蒙娜. 小麦抗性淀粉的制备及结构性质研究[D]. 合肥: 合肥工业大学, 2019. LI Mengna. Preparation and structural properties of wheat resistant starch[D]. Hefei: Hefei University of Technology, 2019.
[23] YUAN, XU D, CUI B, et al. Gelation of K-carrageenan/Konjac glucommanan compound gel: Effect of cyclodextrins[J]. Food Hydrocolloids,2019,87(FEB.):158−164.
[24] THANGAVEL K, DHIVYA K. Determination of curcumin, starch and moisture content in turmeric by Fourier transform near infrared spectroscopy (FT-NIR)[J]. Engineering in Agriculture, Environment and Food,2019,12(2):264−269. doi: 10.1016/j.eaef.2019.02.003
[25] JIAN Z A, MX A, LW B, et al. Structure and physicochemical properties of native starch and resistant starch in Chinese yam (Dioscorea opposita Thunb.)[J]. Carbohydrate Polymers,2020,237:116188. doi: 10.1016/j.carbpol.2020.116188
[26] ARGYRI K, ATHANSATOU A, BOUGA M, et al. The potential of an in vitro digestion method for predicting glycemic response of foods and meals[J]. Nutrients,2016,8(4):209. doi: 10.3390/nu8040209
[27] KAWAI K, TAKATO S, SASAKI T, et al. Complex formation, thermal properties, and in-vitro digestibility of gelatinized potato starch-fatty acid mixtures[J]. Food Hydrocolloids,2012,27(1):228−234. doi: 10.1016/j.foodhyd.2011.07.003
[28] LU H, YANG Z, YU M, et al. Characterization of complexes formed between debranched starch and fatty acids having different carbon chain lengths[J]. International Journal of Biological Macromolecules,2021,167:595−604. doi: 10.1016/j.ijbiomac.2020.11.198
[29] SABARATNAM N A, THAVA V A, RATNAJOTHI H B, et al. The susceptibility of large and small granules of waxy, normal and high-amylose genotypes of barley and corn starches toward amylolysis at sub-gelatinization temperatures[J]. Food Research International,2013,51(2):771−782. doi: 10.1016/j.foodres.2013.01.057
[30] CHEN B Y, GUO Z B, MIAO S, et al. Preparation and characterization of lotus seed starch-fatty acid complexes formed by microfluidization[J]. Journal of Food Engineering,2018,237(237):52−59.
[31] CORREIA P R, NUNES M C, BEIRAO-DA-COSTA M L. The effect of starch isolation method on physical and functional properties of Portuguese nuts starches. I. Chestnuts (Castanea sativa Mill. var. Martainha and Longal) fruits[J]. Food Hydrocolloids,2012,27(1):256−263. doi: 10.1016/j.foodhyd.2011.05.010
[32] RAPHAELIDES S N, GEORGIADIS N. Effect of fatty acids on the rheological behaviour of pea starch dispersions during heating[J]. Food Research International,2008,41(1):75−88. doi: 10.1016/j.foodres.2007.10.004
[33] KAUR K, SINGH N. Amylose-lipid complex formation during cooking of rice flour[J]. Food Chemistry,2000,71(4):511−517. doi: 10.1016/S0308-8146(00)00202-8
[34] 肖遥, 曹悦, 任顺成, 等. 多酚与玉米淀粉相互作用研究[J]. 河南工业大学学报(自然科学版),2020,41(1):45−51. [XIAO Yao, CAO Yue, REN Shuncheng, et al. Study on the interaction between polyphenols and corn starch[J]. Journal of Henan University of Technology (Natural Science Edition),2020,41(1):45−51. [35] 高金梅, 黄倩, 郭洪梅, 等. 冻融循环处理对玉米淀粉凝胶结构及颗粒理化特性的影响[J]. 现代食品科技,2017,33(2):181−189. [GAO Jinmei, HUANG Qian, GUO Hongmei, et al. Effects of freeze-thaw cycles on the gel structure and granule physicochemical properties of corn starch[J]. Modern Food Science and Technology,2017,33(2):181−189. [36] 陈平生, 黄智君, 王娟. 不同热处理方式对大蕉抗消化淀粉理化性质的影响[J]. 现代食品科技,2012,28(1):9−13. [CHEN Pingsheng, HUANG Zhijun, WANG Juan. Effects of different heat treatment methods on the physicochemical properties of plantain resistant starch[J]. Modern Food Science and Technology,2012,28(1):9−13. [37] 程冰, 张乐乐, 安艳霞, 等. 马铃薯抗性淀粉结构特征及体外消化特性的研究[J]. 食品安全质量检测学报,2021,12(17):6975−6981. [CHENG Bing, ZHANG Lele, AN Yanxia, et al. Structural characteristics and in vitro digestion characteristics of potato resistant starch[J]. Journal of Food Safety and Quality Inspection,2021,12(17):6975−6981. [38] 李光磊, 刘秀芳, 曾洁. 抗性淀粉分子结构特征研究[J]. 食品工业科技,2008(8):156−159. [LI Guanglei, LIU Xiufang, ZENG Jie. Molecular structure characteristics of resistant starch[J]. Science and Technology of Food Industry,2008(8):156−159. [39] CHEN L, TIAN Y, SU B, et al. Measurement and characterization of external oil in the fried waxy maize starch granules using ATR-FTIR and XRD[J]. Food Chemistry,2018,242(MAR.1):131−138.
[40] 褚绍言, 孙冰华, 马森, 等. 淀粉粒径对小麦淀粉-月桂酸复合物结构及消化性的影响[J]. 河南工业大学学报(自然科学版),2021,42(5):21−29. [CHU Shaoyan, SUN Binghua, MA Sen, et al. Effects of starch particle size on the structure and digestibility of wheat starch-lauric acid complexes[J]. Journal of Henan University of Technology (Natural Science Edition),2021,42(5):21−29. [41] LI W, WU G, LUO Q, et al. Effects of removal of surface proteins on physicochemical and structural properties of A- and B-starch isolated from normal and waxy wheat[J]. Journal of Food Science & Technology,2016,53(6):2673−2685.
[42] KIM H S, HUBER K C. Physicochemical properties and amylopectin fine structures of A- and B-type granules of waxy and normal soft wheat starch[J]. Journal of Cereal Science,2010,51(3):256−264. doi: 10.1016/j.jcs.2009.11.015
[43] ZHANG B, LI X, JIA L, et al. Supramolecular structure of A- and B-type granules of wheat starch[J]. Food Hydrocolloids,2013,31(1):68−73. doi: 10.1016/j.foodhyd.2012.10.006
[44] 陈海华, 王雨生, 王慧云, 等. 脂肪酸碳链长度与不饱和度对脂肪酸-普通玉米淀粉包合物体外消化性质的影响[J]. 现代食品科技,2016,32(2):19−26. [CHEN Haihua, WANG Yusheng, WANG Huiyun, et al. Effects of fatty acid carbon chain length and unsaturation on in vitro digestibility of fatty acid-common cornstarch inclusion complexes[J]. Modern Food Science and Technology,2016,32(2):19−26. -
期刊类型引用(0)
其他类型引用(1)





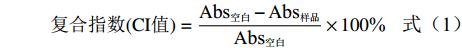
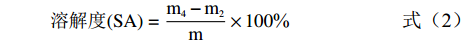
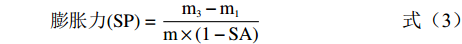


 下载:
下载:





 下载:
下载:



