Optimization of Enzymatic Hydrolysis of Jerusalem Artichoke to Produce Fructooligosaccharide Syrup and Its Function Evaluation
-
摘要: 菊芋块茎富含菊糖,是制备低聚果糖(Fructooligosaccharides,FOS)的主要原料之一,新鲜菊芋块茎直接酶法加工用于功能性糖浆的制备可以丰富菊芋综合加工的应用。本研究以新鲜菊芋块茎为原料,通过系统研究菊芋内源酶、菊粉内切酶、葡聚糖内切酶、木聚糖酶、聚半乳糖醛酸酶和单宁酶在鲜菊芋酶法加工制备低聚果糖糖浆中的作用规律和酶解效果,建立并优化了酶法制备低聚果糖糖浆的工艺。结果表明,最优酶解工艺如下:菊芋浆在50 ℃和pH5.0条件下,加入0.08 U/g单宁酶酶解4 h,再加入0.08 U/g葡聚糖内切酶、0.08 U/g木聚糖酶、0.07 U/g聚半乳糖醛酸酶和12 U/g菊糖内切酶组合酶解8 h,酶解液浓缩2倍后获得低聚果糖糖浆成品。成品中低聚果糖和单宁的含量分别为53.72和3.11 g/L,DPPH自由基清除率、羟基自由基清除率和总抗氧化能力分别为82.23%、30.47%和2.78 μmol/mL。以制备的低聚果糖糖浆为唯一碳源替代MRS培养基中的葡萄糖,植物乳杆菌、嗜热链球菌和副干酪乳杆菌的生长速率较未经酶解的菊芋原浆作为MRS培养基的唯一碳源时,分别提高了33.33%、60.47%、148.15%。本研究开发的菊芋酶法新工艺,可为菊芋的综合加工和规模化制备具有益生元功能的食品提供参考。Abstract: Jerusalem artichoke tuber (JAT) is rich in inulin and it is considered as one of the most important feedstocks for fructooligosaccharides (FOS) production. Direct enzymatic production of functional syrup from fresh JAT can benefit comprehensive processing of Jerusalem artichoke. In this study, the effects of various enzymes (endogenous hydrolases, endoinulinase, endoglucanase, xylanase, polygalacturonase and tannase) on fructooligosaccharide production from JAT were systematically studied and enzymatic process were further optimized. The optimal process was: first loading tannase (0.08 U/g) at 50 °C and pH 5 for 4 h, and then loading endoglucanase (0.1 U/g), xylanase (0.08 U/g), polygalacturonase (0.07 U/g) and endoinulinase (12 U/g) for 8 h. The FOS syrup was obtained by concentrated reaction solution for tow folds. The FOS and total polyphenols in FOS syrup reached 53.72 g/L and 3.11 g/L. The DPPH free radical scavenging rate, hydroxyl radical scavenging rate and total antioxidant capacity of FOS syrup were 82.23%, 30.47% and 2.78 μmol/mL, respectively. Replacing glucose in MRS medium with prepared fructooligosaccharide syrup as sole carbon source, the growth rates of Lactobacillus plantarum, Streptococcus thermophilus and Lactobacillus paracasei increased by 33.33%, 60.47% and 148.15%, respectively, compared with the unenzymatically hydrolyzed Jerusalem artichoke puree as the sole carbon source of MRS medium. The main results of this study provide a theoretical basis for the enzymatic production of prebiotic food from Jerusalem artichoke.
-
菊芋(Helianthus tuberosus L., Jerusalem arti-choke),又名洋姜、鬼子姜,是一种多年宿根性草本植物,具有耐寒、耐旱、耐盐碱等特点,生态适应性强[1]。一次种植可连续多年生长,种植成本低,块茎产量4~5吨/亩[2]。联合国粮农组织2020年统计数据显示,中国菊芋种植面积约1.2万公顷,占全世界菊芋总种植面积的10.5%。菊芋块茎含有丰富的果糖多聚物,其中菊糖达干物质的65%~80%[3],菊芋来源的菊糖是由呋喃型D-果糖经β (2→1)糖苷键连接而成,终端通过α(1→2)糖苷键连接一个葡萄糖,聚合度为2~60的天然果聚糖混合物[4-5],其经菊糖内切酶水解其内部的β-2,1-果糖苷键生成低聚果糖(Fructooligosaccharides,FOS),是生产低聚果糖的主要原料之一[6-8]。以菊芋来源的菊糖为原料生产的低聚果糖其聚合度通常为2~10,高于蔗糖为原料经转苷生产的低聚果糖的聚合度[9-11]。因此,菊芋来源的低聚果糖在调节血糖血脂平衡、维持胃肠道功能、促进钙吸收、降低肥胖和降低患Ⅱ-型糖尿病风险等方面具有更显著的作用[12-16]。然而,受限于生产成本和市场需求量,菊芋来源的低聚果糖加工量远低于蔗糖来源的低聚果糖加工量,现阶段需借助合理的新途径解决菊芋丰产丰收后下游加工的问题。此外,目前大部分研究基于菊芋烘干制粉提取菊糖,再经除蛋白质、果胶等杂质后酶解制备低聚果糖[17],该工艺制备菊芋粉的过程复杂、副产物较多,如何以新鲜菊芋为原料,建立高效酶解工艺,制备高营养价值的低聚果糖糖浆产品,降低生产成本、减少环境污染是目前亟待解决的问题。
为此,本文以鲜菊芋为原料,结合菊芋组成成分特点,系统研究适用于菊芋的酶解工艺,并研究来源于黑曲霉的菊糖内切酶、葡聚糖内切酶、木聚糖酶、聚半乳糖醛酸酶和单宁酶在加工制备低聚果糖糖浆中的作用规律和酶解效果,建立并优化复合酶法制备低聚果糖糖浆的新工艺,以期丰富菊芋综合加工产品的类型,推动菊芋加工产业的发展。
1. 材料与方法
1.1 材料与仪器
菊芋 选择完整、无病斑、虫蛀的新鲜菊芋块茎,购自中国河北省邯郸市果蔬食品公司;低聚果糖标准品 纯度99%,江苏锐阳生物科技有限公司;乙腈 色谱纯,国药集团化学试剂有限公司;DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除能力试剂盒 北京市索莱宝科技有限公司;羟基自由基清除和总抗氧化能力检测试剂盒 上海市生工生物工程股份有限公司;菊糖内切酶(1480 U/g)、单宁酶(147 U/g)、葡聚糖内切酶(1260 U/g)、木聚糖酶(3720 U/g)、多聚半乳糖醛酸酶(10800 U/g) 本实验室前期构建并保藏菌株,发酵制备酶液[18];MRS培养基的成分为:1%蛋白胨,1%牛肉膏,0.5%酵母粉,0.2%柠檬酸氢二铵,0.5%无水乙酸钠,0.2%磷酸氢二钾,0.005%一水合硫酸锰,0.02%七水合硫酸镁,0.1%吐温80;植物乳杆菌(Lactobacillus plantarum)YJG、嗜热链球菌(Streptococcus thermophilus)IFFI 6038、副干酪乳杆菌(Lactobacillus paracei)2001-12 三种菌均由天津科技大学生物催化与生物转化实验室保藏;其他试剂 均为国产分析纯。
Agilent 1200高效液相色谱仪Shodex RI-201示差检测器 日本Shodex公司;Prevail Carbohydrate ES 5u糖色谱柱 美国奥泰公司;ZWY-2102C恒温培养振荡器 上海智城分析仪器制造有限公司;BAO-80A精密鼓风干燥箱 施都凯仪器设备(上海)有限公司;SP-2012UV型紫外可见分光光度计 上海光谱仪器有限公司;AB204-S型电子分析天平、PHS-2C型pH计 梅特勒-托利多仪器上海公司;1-15台式高速离心机 德国Sigma公司。
1.2 实验方法
1.2.1 原料预处理
菊芋块茎用自来水清洗除去泥土和其他杂质,称重、切块,按料水比为1:2(w/w)打浆。
1.2.2 菊芋浆的组分测定
菊糖含量=总糖含量-还原糖含量(苯酚-硫酸法测总糖含量,3,5-二硝基水杨酸法测还原糖含量)[19-21]。以没食子酸为标准品,用福林酚试剂比色法测定单宁含量[22](具体操作如下:取0.2 mL浓度分别为0.2、0.4、0.6、0.8、1.0 mg/mL的没食子酸于试管中,加入0.2 mol/L的福林酚试剂0.5 mL,15%的Na2CO3溶液1.0 mL,用蒸馏水补足4 mL。避光反应20 min后,以蒸馏水代替样液进行调零,在765 nm处测其吸光值)。参考美国国家可再生能源实验室(NREL)方法,测定纤维素、半纤维素含量[23]。分光光度法测果胶含量[24]。
1.2.3 菊芋酶解用酶的选择
1.2.3.1 内源性酶对菊芋的酶解效果
为评价内源性酶对菊糖水解和低聚果糖形成的影响,取15 g菊芋浆在50 ℃下水解24 h,每2 h取样,12000 r/min离心10 min,高效液相色谱法(High performance liquid chromatography,HPLC)测定上清液中葡萄糖、果糖、蔗糖、低聚果糖的含量。
1.2.3.2 内源酶在添加菊糖内切酶条件下对菊糖水解的影响
取30 g菊芋浆用醋酸调pH为5.0,均分为两份,一份121 ℃高温灭菌10 min,冷却至50 ℃,添加15.0 U/g菊糖内切酶(根据菊芋中组分计算酶的理论添加量后加入过量酶);另一份不灭菌,直接加入等量菊糖内切酶,50 ℃酶解12 h,每隔2 h取一次样品,HPLC测定上清液中葡萄糖、果糖、蔗糖、低聚果糖的含量。
1.2.3.3 菊芋中其他组分对菊糖内切酶酶解效果的影响
为研究菊芋中单宁、果胶、纤维素、半纤维素的存在对菊糖内切酶发挥作用的影响,因此,采用酶解法先去除该组分,再加入菊糖内切酶,通过低聚果糖含量变化来确定菊芋中各组分对菊糖内切酶发挥作用的影响。具体操作如下:取60 g菊芋浆调pH为5.0,分为4份,分别加入0.2 U/g单宁酶、0.25 U/g聚半乳糖醛酸酶、0.15 U/g葡聚糖内切酶、0.15 U/g木聚糖酶(根据菊芋中组分计算酶的理论添加量后加入过量酶),50 ℃预酶解4 h,每份再加入15 U/g菊糖内切酶,50 ℃下酶解12 h,每隔2 h取一次样品,HPLC测定上清液中葡萄糖、果糖、蔗糖、低聚果糖的含量,以低聚果糖含量变化来确定菊芋中各组分对应水解酶的添加对菊糖内切酶发挥作用的影响。
1.2.3.4 酶解工艺的建立
根据1.2.3.3的结果确定影响菊糖内切酶发挥作用的物质后,进一步研究各水解酶的最优添加量(根据该组分含量计算水解该酶的理论添加量,在理论添加量的基础上进行梯度设置),具体操作如下:在菊芋浆中加入不同添加量的水解某物质的酶与15 U/g菊糖内切酶,50 ℃下酶解12 h,用HPLC测定上清液中葡萄糖、果糖、蔗糖、FOS含量,以低聚果糖含量变化来确定该酶的最优添加量。之后,将该酶和菊糖内切酶一同加入菊芋浆中,再加入不同添加量的另一种酶,研究另一种酶的最优添加量,以此类推,逐一研究各水解酶的最优添加量。具体量的设置为:单宁酶、木聚糖酶、葡聚糖内切酶添加量为0.02、0.04、0.06、0.08、0.10,聚半乳糖醛酸酶的添加量为0.01、0.03、0.05、0.07、0.09 U/g。
确定各水解酶的最优添加量后,再研究菊糖内切酶最适添加量和最适作用时间,具体操作如下:加入最优添加量的各水解酶和不同添加量的菊糖内切酶(3.0、6.0、9.0、12.0、15.0 U/g),50 ℃、pH5.0下复合酶解12 h,酶解样品用HPLC测定上清液中低聚果糖的含量,确定菊糖内切酶的最优添加量;加入最优添加量的各水解酶和最优添加量的菊糖内切酶,每隔2 h取一次样品,酶解样品用HPLC测定上清液中低聚果糖的含量,确定菊糖内切酶的最适作用时间。
1.2.4 HPLC外标法测定低聚果糖含量
1.2.4.1 样品前处理
取酶解样品于1.5 mL离心管中,12000 r/min离心10 min取上清液,按1:1(v/v)加入无水乙醇,4 ℃下静置2 h,12000 r/min离心10 min,取上清液,用0.22 μm有机微孔膜过滤,−20 ℃保存,待测。
1.2.4.2 液相色谱条件
高效液相色谱仪Shodex RI-201示差检测器;色谱柱:Prevail Carbohydrate ES 5 μm(250 mm×4.6 mm);柱温:35 ℃;进样量:20 μL;流速:1.0 mL/min;流动相:水/乙腈=35/65(v/v)。
1.2.4.3 水解率计算
以低聚果糖为标准品,对各峰进行定量测定,采用峰面积归一化法确定低聚果糖中每种物质的相对含量。用以下公式计算水解率:
水解率(%,w/w)=低聚果糖菊糖×1.1×100 式中:低聚果糖为果二糖、果三糖、蔗果三糖、果四糖、蔗果四糖、果五糖、蔗果五糖、果六糖、蔗果六糖含量的总和[9];1.1为菊糖和低聚果糖的换算系数。
1.2.5 低聚果糖糖浆的制备及其益生功能、抗氧化活性测定
1.2.5.1 低聚果糖糖浆的制备
菊芋在上述最优工艺条件下得到的菊芋水解液,经真空浓缩两倍体积后制成低聚果糖糖浆。为验证低聚果糖糖浆的益生元功能,以植物乳杆菌、嗜热链球菌、副干酪乳杆菌为评价菌,研究这三种菌以低聚果糖糖浆为碳源的生长情况(对照为未经水解的菊芋浆原液),评价低聚果糖糖浆的益生元功能。
抗氧化活性测定主要包括DPPH自由基清除能力(DRSA)、羟基自由基清除能力(HRSA)和总抗氧化能力(T-AOC),均按照文献方法进行[25-27]。对照试验为菊芋原液。
1.2.5.2 益生功能评价方法
将植物乳杆菌、嗜热链球菌、副干酪乳杆菌分别在以上述制备的低聚果糖糖浆为碳源的MRS培养基和以未经水解的菊芋浆原液为碳源的MRS培养基中,37 ℃培养12 h,每2 h取样一次,分光光度计测OD600以研究三种菌的生长情况[28]。
1.2.5.3 DPPH自由基清除能力测定
用甲醇溶液制备浓度为0.1 mmol/L的DPPH试剂,取0.1 mL样品与0.9 mL DPPH自由基溶液混合,将溶液充分混合,并在室温下暗置30 min。以抗坏血酸为标准品,测定在517 nm处吸光度下降。DPPH自由基清除率计算公式如下:
DPPH自由基清除率(%)=(A0−AiA0)×100 其中,A0为对照的吸光度,Ai为样品的吸光度。
1.2.5.4 羟基自由基清除能力测定
羟基自由基清除能力(HRSA)测定的具体方法为:取0.2 mL(10 mmol/L)的FeSO4-EDTA混合液于具塞试管中,加入0.5 mL(10 mmol/L)的脱氧核糖溶液,然后加入0.2 mL样品溶液,用pH=7.4、0.1 mol/L磷酸缓冲液定容至1.8 mL;再加入0.2 mL(10 mmol/L)H2O2,混匀后置于37 ℃恒温水浴中反应1 h,然后加入2.8%三氯乙酸溶液1 mL,1%硫代巴比妥酸(TBA)溶液1 mL,混匀后置于沸水浴中反应10 min,冷却后于520 nm处比色测定吸光值As。不加样品溶液同上操作处理,所测吸光值Ac。不加样品且不在37 ℃水浴中反应,其他处理同上,测定空白吸光值A0。羟自由基清除能力HRSA计算公式如下:
HRSA(%)=(1−As−A0Ac−A0)×100 1.2.5.5 总抗氧化活性测定
总抗氧化活性(T-AOC)测定的具体方法为:取1 mL样品与2.5 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2.5 mL 10 g/L K3Fe(CN)6混合,在50 ℃下反应30 min。之后,加入2.5 mL 100 g/L的三氯乙酸溶液终止反应,混合物1800 r/min离心10 min。最后取上清液2.5 mL,与2.5 mL超纯水和0.5 mL 1 g /L FeCl3混合。以抗坏血酸为标准品,在700 nm处测定吸光度。
1.3 数据处理
采用EasyChrom进行HPLC数据分析,采用Excel 2016进行数据统计,采用Origin 2018进行绘图分析,实验数据以平均值±标准差(Mean±SD)表示。
2. 结果与分析
2.1 菊芋浆基本组成成分
分析了菊芋浆的基本化学成分,结果见表1,主要包括菊糖、单宁和纤维素等,本研究所测得的成分为菊芋打浆后的组分含量,换算后在已有研究菊芋组分的范围内[29]。
表 1 菊芋浆中主要成分Table 1. The main components of Jerusalem artichoke pulp成分 质量百分含量(%) 菊糖 4.82 单宁 0.14 半纤维素 0.06 纤维素 0.22 果胶 0.13 2.2 菊芋酶解用酶的选择
2.2.1 内源酶对菊芋水解物低聚果糖含量的影响
由表2可知,低聚果糖的含量在24 h内由4.17 g/L增加到7.38 g/L(P<0.05),表明菊糖逐渐被水解,菊芋中存在内源性菊糖水解酶;果糖、葡萄糖和蔗糖含量逐渐增加,说明菊芋中存在水解大分子的内源酶;低聚果糖含量在逐渐增加,说明菊芋中存在的内源酶不会将低聚果糖水解。此外,內源酶水解24 h,水解率仍低于15%,说明需要添加外源性菊糖内切酶,加速菊糖的水解。
表 2 菊芋中内源性菊糖水解酶对低聚果糖得率的影响Table 2. Effect of endogenous inulin hydrolase from Jerusalem artichokeon FOS yield 时间(h) 碳水化合物含量(g/L) 水解率
(%,w/w)果糖 葡萄糖 蔗糖 低聚果糖 0 1.77±0.03a 0.04±0.02a 0.18±0.01a 4.17±0.02a − 6 2.16±0.02b 0.49±0.01b 0.32±0.01b 4.63±0.02b 9.35±0.03 12 3.37±0.03c 0.55±0.01c 0.42±0.02c 5.18±0.03c 10.45±0.03 18 3.86±0.04d 1.77±0.02d 2.82±0.04d 6.20±0.03d 12.51±0.02 24 3.94±0.02e 2.60±0.03e 3.20±0.03e 7.38±0.02e 14.89±0.03 注:数据表示三次测定的平均值±标准差。同一列数值上标不同字母表示差异显著(P<0.05)。 2.2.2 内源酶对外加菊糖内切酶水解菊糖的影响
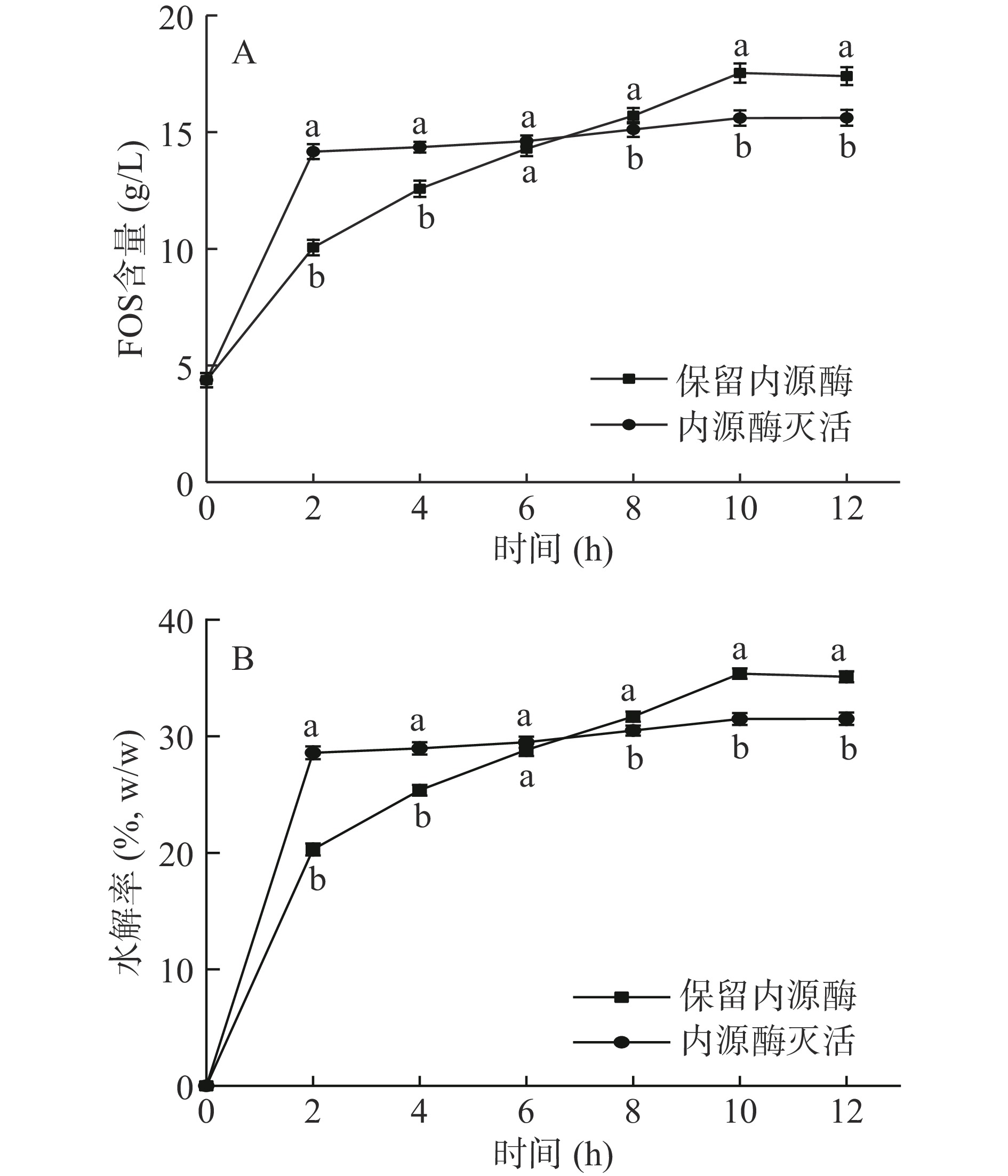
为探究菊芋中内源酶存在对菊糖内切酶发挥作用是否存在影响,研究了在保留内源酶和内源酶灭活的样本中加入菊糖内切酶后,将菊糖水解为低聚果糖的情况,结果如图1所示。由图可知,当酶促反应由内源酶和菊糖内切酶共同作用时,10 h后低聚果糖的含量最大(17.53 g/L),而单独使用菊糖内切酶时,10 h后低聚果糖含量基本保持不变(15.60 g/L)(图1A);内源酶和菊糖内切酶共同作用时,低聚果糖含量比单独使用菊糖内切酶作用高3.09 g/L,且菊糖水解率比单独使用菊糖内切酶高12.39%(P<0.05)(图1B)。说明菊芋中含有一定量的菊糖酶,且内源酶和外加的菊糖内切酶有协同作用,因此,在菊糖内切酶水解菊糖之前,不需要对内源酶进行灭活。
2.2.3 菊芋中影响菊糖内切酶发挥作用的物质
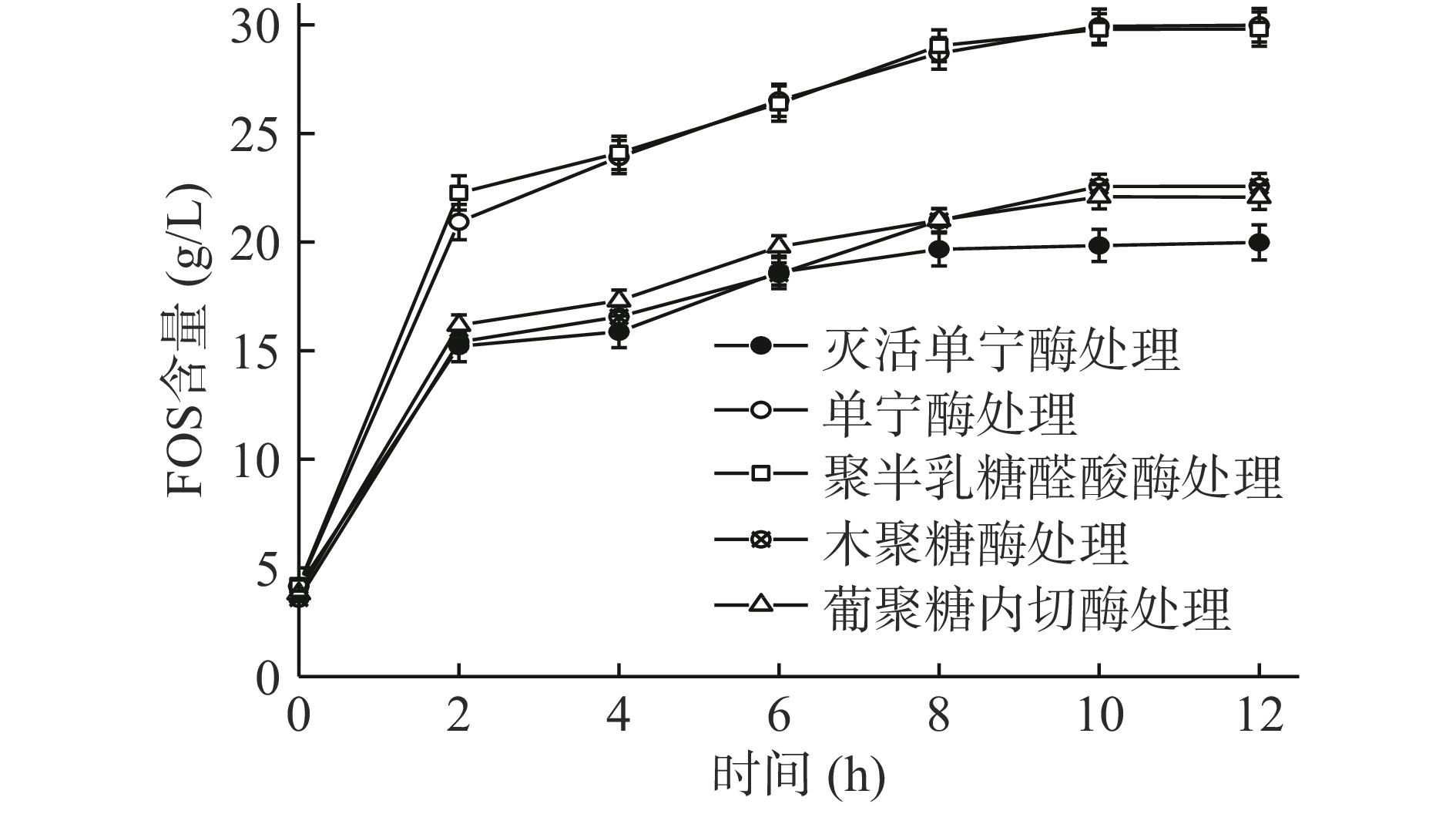
为研究单宁、果胶、纤维素、半纤维素对菊糖内切酶发挥作用的影响,通过加入各组分对应的水解酶,再加入菊糖内切酶,比较产物中低聚果糖含量评价各组分对菊糖内切酶酶解作用的影响,结果如图2所示。
单宁酶预处理使低聚果糖含量由19.98 g/L增加到29.98 g/L(P<0.05),提高50.05%。单宁含有酚羟基、羟基、羧基等多种活性官能团,它可与蛋白质进行共价交联,从而影响酶的活性[30],因此,菊芋中单宁的存在不利于菊糖内切酶发挥其水解作用,需在加入菊糖内切酶之前预先通过酶解去除单宁。
聚半乳糖醛酸酶预处理使低聚果糖含量达到29.80 g/L(P<0.05),提高49.17%。可能由于果胶的分解使菊芋中菊糖更好地释放,提高了菊糖内切酶的作用效率;研究表明,果胶的水解产物具有更高的抗氧化活性和营养价值,能澄清果汁并带来清爽口感[31],因此后续酶解工艺研究加入聚半乳糖醛酸酶。
木聚糖酶预处理使低聚果糖含量达到22.57 g/L(P<0.05),提高12.98%。有研究表明,饮料中半纤维素的水解产物可使果汁澄清,水解阻碍果汁清除物理和化学物的物质或浓缩时引起浑浊的物质,增强浆汁的稳定性[32]。可见,加入木聚糖酶对菊芋浆存在有利影响,后续酶解工艺研究考虑加入木聚糖酶。
葡聚糖内切酶预处理使低聚果糖的含量达到22.09 g/L(P<0.05),提高10.51%。在葡萄酒工业中,葡聚糖内切酶可改善酒体颜色,提高浸渍度、澄清度和过滤性,从而提高了葡萄酒的质量;在发酵产品中加入葡聚糖内切酶,能提高产品质量和产量[33]。可见,葡聚糖内切酶对浆汁类产品澄清度和质量有一定提高,后续研究考虑加入葡聚糖内切酶。
各种组分对应水解酶的添加均表现出促进菊糖内切酶作用的效果。其中,单宁酶的促进作用最为明显。考虑到其他组分对应的水解酶同样可能受到单宁存在对酶活的抑制,后续酶解工艺研究中,采用单宁酶单独预先处理菊芋浆,然后再添加其他组分对应的水解酶和菊糖内切酶进行组合酶解。
2.2.4 菊芋酶解工艺的建立与优化
为充分发挥各组分水解酶与菊糖内切酶组合酶解的效率,对各水解酶的添加量进行了逐一优化。结果如图3~图5。
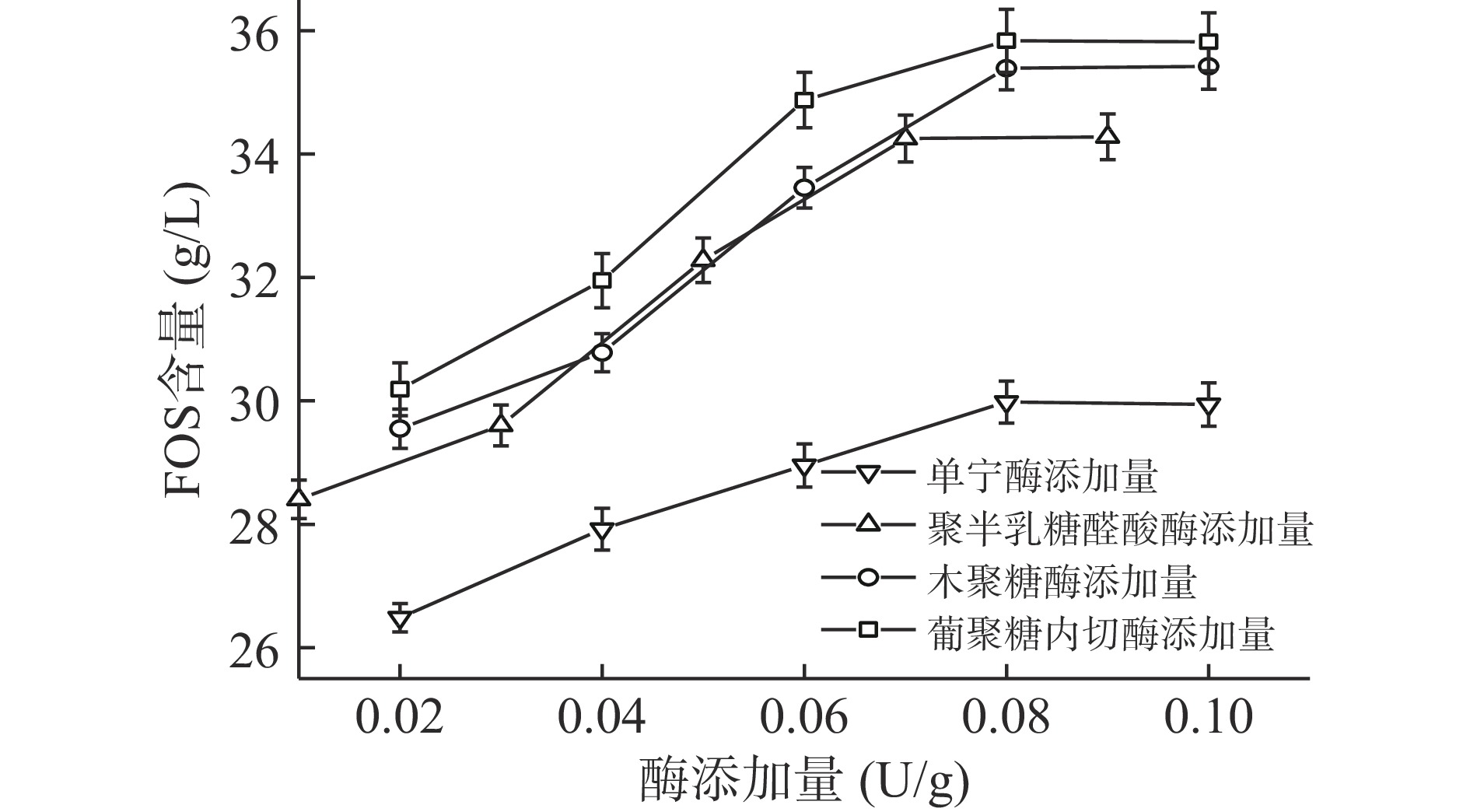
2.2.4.1 各水解酶添加量的优化
由图3可得出,当单宁酶的添加量为0.08 U/g时,低聚果糖的含量达到29.98 g/L(P<0.05),此时水解率达到60.48%,可能由于菊芋中含有影响菊糖释放的物质,导致继续增加单宁酶添加量后低聚果糖含量无明显增加。因此,后续研究中,均加入0.08 U/g单宁酶预处理4 h,再进行下一步的组合酶解。
当聚半乳糖醛酸酶的添加量为0.07 U/g时,低聚果糖的含量达到34.25 g/L(P<0.05),此时水解率达到69.10%,而随聚半乳糖醛酸酶添加量的增加低聚果糖含量无变化,可能是由于用量增加,酶蛋白使浆汁浑浊[34],影响菊糖内切酶发挥作用。因此,后续实验聚半乳糖醛酸酶添加量均采用0.07 U/g进行组合酶解。
当木聚糖酶的添加量为0.08 U/g时,低聚果糖的含量达到最大值,为35.39 g/L(P<0.05),此时水解率为71.40%,低聚果糖含量较上一步有所提高,可能是木聚糖的降解使反应体系黏度降低[32],从而促进菊糖内切酶的酶解效率。因此,后续实验木聚糖酶添加量均采用0.08 U/g进行组合酶解。
当葡聚糖内切酶的添加量为0.08 U/g时,低聚果糖的含量达到最大值,为35.83 g/L(P<0.05),此时水解率达到72.30%,低聚果糖含量进一步提高,可能是纤维素的降解,释放了细胞内的蛋白、糖等物质,使菊糖更好的释放[35],此外,葡聚糖内切酶与木聚糖酶、聚半乳糖醛酸酶结合,可改善果汁的黏度[32]。因此,后续实验聚半乳糖醛酸酶添加量均采用0.08 U/g进行组合酶解。
2.2.4.2 菊糖内切酶添加量优化
为研究菊糖内切酶的添加量,以菊芋浆为底物,添加0.08 U/g单宁酶在50 ℃、pH5.0下酶解4 h后,再加入0.07 U/g聚半乳糖醛酸酶、0.08 U/g木聚糖酶、0.08 U/g葡聚糖内切酶,取不同浓度菊糖内切酶在50 ℃、pH5.0下酶解12 h。图4表明,菊糖内切酶的用量为12.0 U/g时,低聚果糖含量达到最大值,为38.56 g/L(P<0.05),此时水解率达到77.79%,可能由于菊芋中菊糖没有全部释放,此时底物耗尽,继续增加用酶量低聚果糖含量没有明显提高。因此,后续实验聚半乳糖醛酸酶添加量均采用12.0 U/g进行组合酶解。
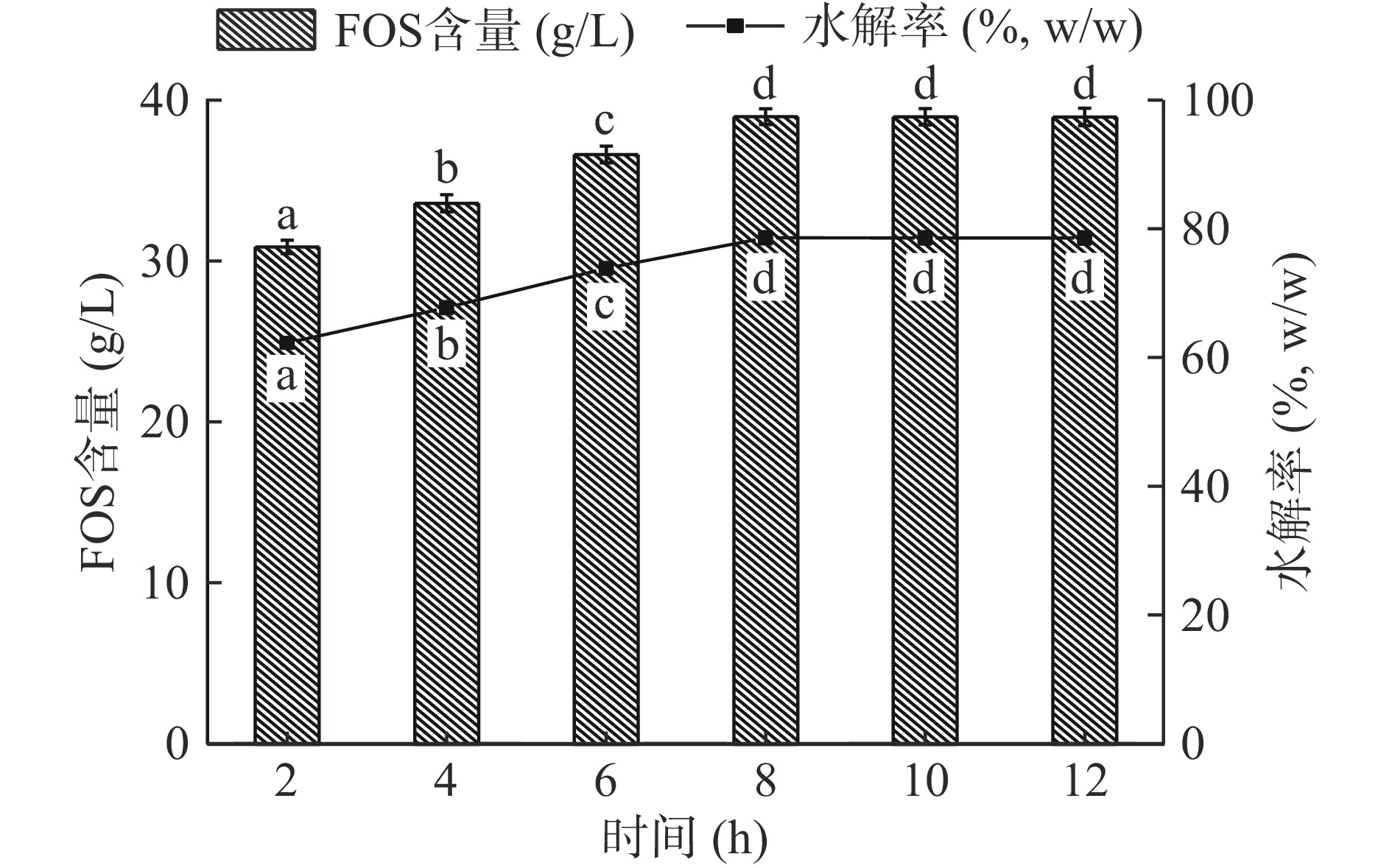
2.2.4.3 菊糖内切酶酶解时间优化
为研究菊糖内切酶酶解时间,以菊芋浆为底物,添加0.08 U/g单宁酶在50 ℃、pH 5.0下酶解4 h后,再加入0.07 U/g聚半乳糖醛酸酶、0.08 U/g木聚糖酶、0.08 U/g葡聚糖内切酶、12.0 U/g菊糖内切酶在50 ℃、pH 5.0下酶解12 h,每隔2 h取样一次,图5结果表明,随酶解时间增加,低聚果糖含量逐渐增加,当菊糖内切酶作用时间为8 h时,低聚果糖的含量达到最大值,为38.89 g/L(P<0.05),此时水解率达到78.46%,继续延长酶解时间,低聚果糖含量增幅明显减缓。因此,菊糖酶作用时间为8 h。
至此,本研究获得富含低聚果糖的菊芋水解液的最优制备工艺为:先加入0.08 U/g单宁酶,50 ℃、pH5.0的条件下酶解4 h,再加入0.07 U/g聚半乳糖醛酸酶、0.08 U/g葡聚糖内切酶、0.08 U/g木聚糖酶、12.0 U/g菊糖内切酶50 ℃酶解8 h。此时低聚果糖的含量为38.89 g/L(P<0.05),水解率达到78.46%。而李鑫等[36]以菊芋渣为原料酶解制备的短链低聚果糖质量浓度为16.06 g/L,相比之下,本研究在复合酶的作用下制备的低聚果糖含量较高。
2.2.5 酶法制备低聚果糖糖浆的功能评价
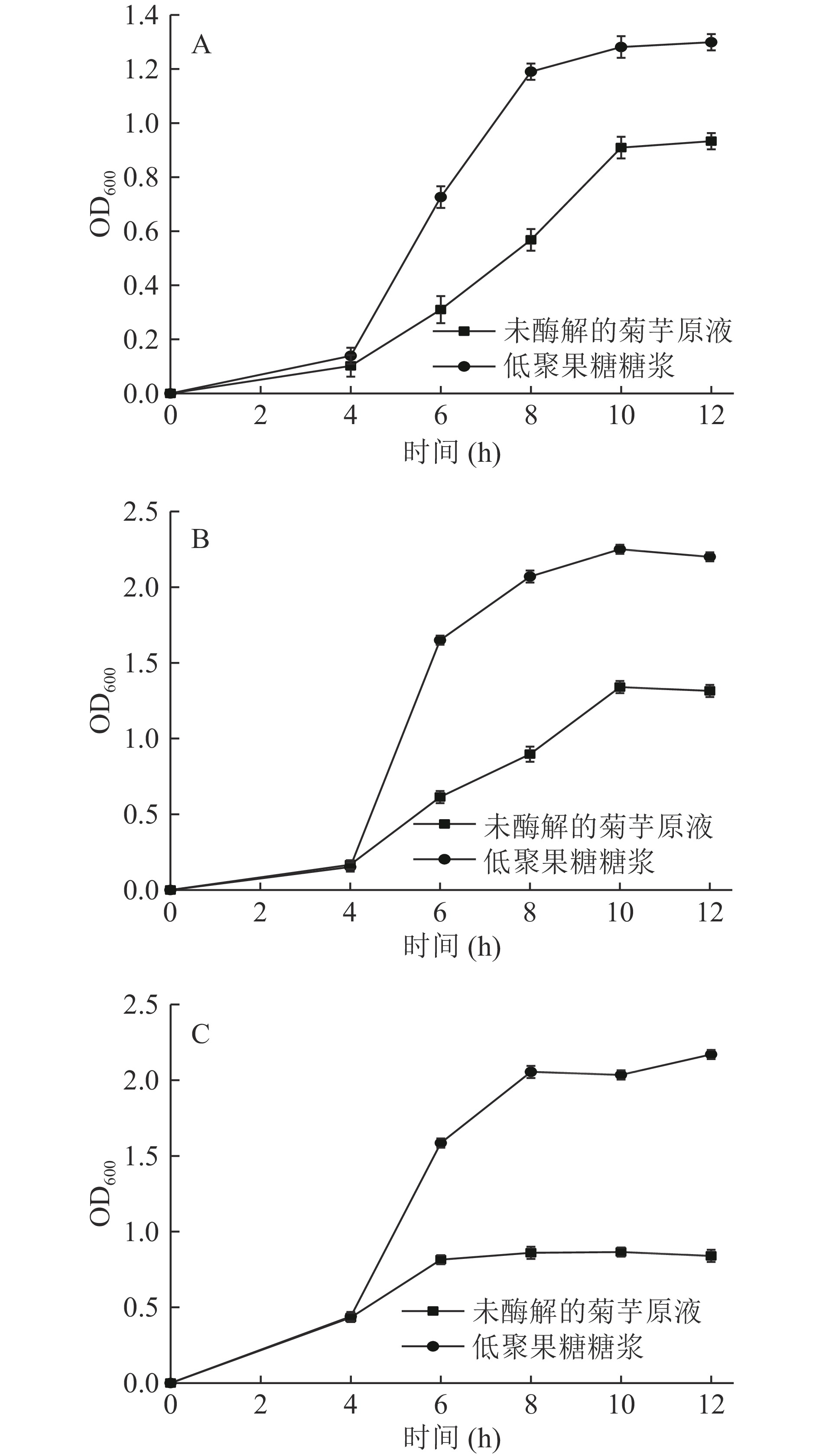
将在上述最优工艺条件下得到的菊芋水解液浓缩为低聚果糖糖浆,并研究该糖浆的益生元功能,以低聚果糖糖浆为碳源,以未酶解的菊芋原液做对照,观察植物乳杆菌(如图6A)、嗜热链球菌(如图6B)、副干酪乳杆菌(如图6C)的生长情况,由图可知,这三种菌以低聚果糖糖浆为碳源时,均有明显的增殖,且生长速率分别提高了33.33%、60.47%、148.15%,最大生物量比陈韫慧等[28]的研究相比效果较好,说明该工艺条件下的低聚果糖糖浆有利于益生菌的生长,具有益生元功能,可作为低糖高营养食品的原料。
进一步检测该糖浆组分含量及抗氧化活性,结果见表3,制备的糖浆中低聚果糖含量达到53.73 g/L,单宁和总蛋白含量都有所提高。此外,酶处理可显著提高菊芋糖浆的抗氧化活性(P<0.05),DPPH自由基清除率、羟基自由基清除率和T-AOC分别达到82.23%、30.47%和2.78 μmol/mL,与标准品维生素C相比,其抗氧化活性处于较高水平。
表 3 低聚果糖糖浆的组分含量及抗氧化活性Table 3. Composition content and antioxidant activity of oligosaccharides syrup组分含量 样品 提高倍数 低聚果糖糖浆 原菊芋浆 维生素C 低聚果糖(g/L) 53.72±2.31a 4.17±0.23b − 12.88 单宁(g/L) 3.11±0.04a 1.42±0.02b − 2.19 DPPH自由基清除率(%) 82.23±4.82a 23.28±0.96b 96.88±5.11 3.53 羟基自由基清除率(%) 30.47±1.36a 16.25±0.84b 80.26±4.17 1.88 T-AOC(μmol/mL) 2.78±0.12a 1.67±0.13b 4.02±0.16 1.66 注:数据代表三次测定的平均值±标准差。同一行数值上标不同字母表示差异显著(P<0.05)。 有研究表明,单宁酶水解单宁的水解产物(表儿茶素、表没食子儿茶素和没食子酸)比底物(表儿茶素没食子酸酯和表没食子儿茶素没食子酸酯)具有更高的抗氧化活性[37-38],可见,单宁酶对菊芋原浆的预酶解,既有助于解除单宁对菊糖内切酶的抑制作用,又有助于抗氧化物质的释放。
3. 结论
本研究以新鲜菊芋为原料,通过研究菊芋内源酶、菊粉内切酶、葡聚糖内切酶、木聚糖酶、聚半乳糖醛酸酶和单宁酶在鲜菊芋酶法加工制备制备低聚果糖糖浆中的影响,建立并优化酶法制备低聚果糖糖浆的工艺。结果表明,复合酶解得到的菊芋水解液中,低聚果糖含量达到38.89 g/L,经浓缩制备的低聚果糖糖浆中低聚果糖和单宁的含量分别为53.72和3.11 g/L,DPPH自由基清除率、羟基自由基清除率和总抗氧化能力分别为82.23%、30.47%和2.78 μmol/mL,抗氧化活性较原浆有所提高,此外,能促进益生菌生长,具有益生元功能。菊芋的这种酶处理工艺可能成为未来菊芋种植业综合加工、提升产业价值的重要方向之一。
-
表 1 菊芋浆中主要成分
Table 1 The main components of Jerusalem artichoke pulp
成分 质量百分含量(%) 菊糖 4.82 单宁 0.14 半纤维素 0.06 纤维素 0.22 果胶 0.13 表 2 菊芋中内源性菊糖水解酶对低聚果糖得率的影响
Table 2 Effect of endogenous inulin hydrolase from Jerusalem artichoke
on FOS yield 时间(h) 碳水化合物含量(g/L) 水解率
(%,w/w)果糖 葡萄糖 蔗糖 低聚果糖 0 1.77±0.03a 0.04±0.02a 0.18±0.01a 4.17±0.02a − 6 2.16±0.02b 0.49±0.01b 0.32±0.01b 4.63±0.02b 9.35±0.03 12 3.37±0.03c 0.55±0.01c 0.42±0.02c 5.18±0.03c 10.45±0.03 18 3.86±0.04d 1.77±0.02d 2.82±0.04d 6.20±0.03d 12.51±0.02 24 3.94±0.02e 2.60±0.03e 3.20±0.03e 7.38±0.02e 14.89±0.03 注:数据表示三次测定的平均值±标准差。同一列数值上标不同字母表示差异显著(P<0.05)。 表 3 低聚果糖糖浆的组分含量及抗氧化活性
Table 3 Composition content and antioxidant activity of oligosaccharides syrup
组分含量 样品 提高倍数 低聚果糖糖浆 原菊芋浆 维生素C 低聚果糖(g/L) 53.72±2.31a 4.17±0.23b − 12.88 单宁(g/L) 3.11±0.04a 1.42±0.02b − 2.19 DPPH自由基清除率(%) 82.23±4.82a 23.28±0.96b 96.88±5.11 3.53 羟基自由基清除率(%) 30.47±1.36a 16.25±0.84b 80.26±4.17 1.88 T-AOC(μmol/mL) 2.78±0.12a 1.67±0.13b 4.02±0.16 1.66 注:数据代表三次测定的平均值±标准差。同一行数值上标不同字母表示差异显著(P<0.05)。 -
[1] SMEKALOVA T N, LEBEDEVA N V, NOVIKOVA L Y. Morphological analysis of Jerusalem artichoke (Helianthus tuberosus L. ) accessions of different origin from VIR collection[J]. Proceedings of the Latvian Academy of Sciences,2019,73(6):502−512.
[2] VOLK G M, RICHARDS K. Preservation methods for Jerusalem artichoke cultivars[J]. Hortscience,2006,41(1):80−83. doi: 10.21273/HORTSCI.41.1.80
[3] TEFERRA T F. Possible actions of inulin as prebiotic polysaccharide: A review[J]. Food Frontiers,2021,2(4):407−416. doi: 10.1002/fft2.92
[4] XU Y, ZHENG Z, XU Q, et al. Efficient conversion of inulin to inulooligosaccharides through endoinulinase from Aspergillus niger[J]. Journal of Agricultural and Food Chemistry,2016,64(12):2612−2618. doi: 10.1021/acs.jafc.5b05908
[5] KRIUKOVA Y, JAKUBIAKAUGUSTYN A, ILYINSKA N, et al. Chain length distribution of inulin from dahlia tubers as influenced by the extraction method[J]. International Journal of Food Properties,2018(23):1−11.
[6] KHAN M S, AHMAD D, KHAN M A. Utilization of genes encoding osmoprotectants in transgenic plants for enhanced abiotic stress tolerance[J]. Electronic Journal of Biotechnology,2015,18(4):257−266. doi: 10.1016/j.ejbt.2015.04.002
[7] KUMAR C G, SRIPADA S, POORNACHANDRA Y. Role of materials science in food bioengineering[M]. United States: Alexandru Mihai Grumezescuy and Alina Maria Holban, 2018: 451-503.
[8] SINGH R S, SINGH R P, KENNEDY J F. Recent insights in enzymatic synthesis of fructooligosaccharides from inulin[J]. International Journal of Biological Macromolecules,2016,85:565−572. doi: 10.1016/j.ijbiomac.2016.01.026
[9] 全国食品工业标准化技术委员会. 低聚糖质量要求第2部分: 低聚果糖: GB/T23528.2-2021[S]. 北京: 中国标准出版社, 2021. [10] FLORES-MALTOS D A, MUSSATTO S I, CONTRERAS-ESQUIVEL J C, et al. Biotechnological production and application of fructooligosaccharides[J]. Critical Reviews in Biotechnology,2016,36(2):259−267. doi: 10.3109/07388551.2014.953443
[11] BEDZO O K K, VAN R E, GÖRGENS J F. Investigating the effect of different inulin-rich substrate preparations from Jerusalem artichoke (Helianthus tuberosus L.) tubers on efficient inulooligosaccharides production[J]. Preparative Biochemistry and Biotechnology,2020,51(5):440−449.
[12] MUHAMMAD A R, FARHAN S, WASEEM K, et al. Functional and nutraceutical properties of fructo-oligosaccharides derivatives: A review[J]. International Journal of Food Properties,2021,24(1):1588−1602. doi: 10.1080/10942912.2021.1986520
[13] 殷忠义, 侍立峰, 张晓鹏, 等. 低聚果糖治疗功能性便秘的临床疗效分析[J]. 中西医结合心血管病电子杂志,2020,8(11):178. [YIN Zhongyi, SHI Lifeng, ZHANG Xiaopeng, et al. Clinical analysis of fructose-oligosaccharides in the treatment of functional constipation[J]. Electronic Journal of Integrated Traditional and Western Medicine and Cardiovascular Diseases,2020,8(11):178. [14] 李海枝, 田巧基, 韩晓峰, 等. 益生元促钙吸收作用的研究进展[J]. 食品科技,2020,45(9):51−56. [LI Haizhi, TIAN Qiaoji, HAN Xiaofeng, et al. Research progress of prebiotics in promoting calcium absorption[J]. Food Science and Technology,2020,45(9):51−56. doi: 10.13684/j.cnki.spkj.2020.09.008 [15] DELZENNE N M, OLIVARES M, NEYRINCK A M, et al. Nutritional interest of dietary fiber and prebiotics in obesity: Lessons from the MyNewGut consortium[J]. Clinical Nutrition,2020,39(2):414−424. doi: 10.1016/j.clnu.2019.03.002
[16] YU R Q, YIN Y X, CAO M K, et al. Fructo-oligosaccharides lower serum lipid levels and suppress high-fat/high-sugar diet-induced inflammation by elevating serum and gut levels of short-chain fatty acids[J]. Journal of International Medical Research,2020,48(4):030006051989671.
[17] 陈兴都, 翟丹云, 陈庆安, 等. 基于菊芋低聚果糖的酶解工艺研究[J]. 食品研究与开发,2017,38(11):109−114. [CHEN Xingdu, ZHAI Danyun, CHEN Qingan, et al. Study on enzymatic hydrolysis processing of fructo-oligosaccharide from Jerusalem artichoke[J]. Food Research and Development,2017,38(11):109−114. doi: 10.3969/j.issn.1005-6521.2017.11.024 [18] 佟新新. 黑曲霉纤维素酶系的作用特征及其在蔗渣水解中的应用[D]. 天津: 天津科技大学, 2017 TONG Xinxin. Characteristics of cellulase system of Aspergillus niger and its application in hydrolysis of bagasse[D]. Tianjin: Tianjin University of Science and Technology, 2017.
[19] 袁巧云, 张建梅, 唐钰, 等. 响应面法优化新疆风味调和茶总糖的提取工艺[J]. 淮阴师范学院学报(自然科学版),2020,19(3):218−222,232. [YUAN Qiaoyun, ZHANG Jianmei, TANG Yu, et al. Optimization of extraction technique of the total sugar from Xinjiang hearbal tea by response surface methodology[J]. Journal of Huaiyin Teachers College(Natural Science Edition),2020,19(3):218−222,232. doi: 10.16119/j.cnki.issn1671-6876.2020.03.006 [20] 高文军, 李卫红, 王喜明, 等. 3, 5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量[J]. 中国药业,2020,29(9):113−116. [GAO Wenjun, LI Weihong, WANG Ximing, et al. Determination of reducing sugar and total sugar in turnip by 3, 5-dinitrosalicylic acid colorimetry[J]. China Pharmaceuticals,2020,29(9):113−116. doi: 10.3969/j.issn.1006-4931.2020.09.034 [21] 刘彬. 菊芋菊糖的制备及其降解生产低聚果糖[D]. 无锡: 江南大学, 2016 LIU Bin. Research on the production of inulin from Jerusalem artichoke and its degradation to fructooligosaccharide[D]. Wuxi: Jiangnan University, 2016.
[22] DONG T, SHI J, JIANG C, et al. A short-term carbon dioxide treatment inhibits the browning of fresh-cut burdock[J]. Postharvest Biology and Technology,2015,110:96−102. doi: 10.1016/j.postharvbio.2015.07.014
[23] SLUITER A, HAMES B, RUIZ R, et al. Determination of structural carbohydrates and lignin in biomass: NREL/TP-510-42618[R]. Golden: U. S. Department of Energy Office of Energy Efficiency and Renewable Energy, 2008.
[24] 全国果品标准化技术委员会. NY/T2016-2011水果及其制品中果胶含量的测定分光光度法[S]. 郑州: 中华人民共和国农业部, 2011 National Technical Committee for Fruit Standardization. NY/T2016-2011 Determination of pectin content in fruits and their products by spectrophotometry[S]. Zhengzhou: Ministry of Agriculture of the People's Republic of China, 2011.
[25] RAGURAMAN V, ABRAHAM L S, et al. Sulfated polysaccharide from Sargassum tenerrimum attenuates oxidative stress induced reactive oxygen species production in in vitro and in zebrafish model[J]. Carbohydrate Polymers,2018,203:441−449.
[26] CHUNG S K, OSAWA T, KAWAKISHI S. Hydroxyl radical-scavenging effects of spices and scavengers from brown mustard (Brassica nigra)[J]. Bioscience, Biotechnology, and Biochemistry,1997,61(1):118−123. doi: 10.1271/bbb.61.118
[27] AMINJAFARI A, MIROLIAEI M, ANGELOVA V T, et al. Antioxidant activity and protective role on protein glycation of synthetic aminocoumarins[J]. Electronic Journal and Biotechnology,2016,24:43−48. doi: 10.1016/j.ejbt.2016.08.004
[28] 陈韫慧, 方思璇, 陈佳琪, 等. 不同益生元对植物乳杆菌生长的影响[J]. 食品与发酵工业,2020,46(21):28−33. [CHEN Yunhui, FANG Sixuan, CHEN Jiaqi, et al. Effects of different prebiotics on the growth of Lactobacillus plantarum[J]. Food and Fermentation Industries,2020,46(21):28−33. doi: 10.13995/j.cnki.11-1802/ts.024440 [29] LUMINITA C, MONICA C, ENUTA I, et al. Valorification of Jerusalem artichoke tubers (Helianthus tuberosus) for achieving of functional ingredient with high nutritional value[J]. “Agriculture for Life, Life for Agriculture” Conference Proceedings,2018,1(1):276−283. doi: 10.2478/alife-2018-0041
[30] ADRAR N S, MADANI K, ADRAR S. Impact of the inhibition of proteins activities and the chemical aspect of polyphenols-proteins interactions[J]. Pharma Nutrition,2019,7:100142. doi: 10.1016/j.phanu.2019.100142
[31] SAGU S T, NSO E J, KARMAKAR S, et al. Optimisation of low temperature extraction of banana juice using commercial pectinase[J]. Food Chemistry,2014(151):182−190.
[32] POLOZELI M L T M, RIZZATTI A C S, MONTI R, et al. Xylanases from fungi: Properties and industrial applications[J]. Applied Microbiology and Biotechnology,2005,67(5):577−591. doi: 10.1007/s00253-005-1904-7
[33] KUHAD R. C, GUPTA R, SINGH A. Microbial cellulases and their industrial applications[J]. Enzyme Research,2011:1−10.
[34] 王志伟. 聚半乳糖醛酸酶的酶学性质及产物分析[D]. 青岛: 中国海洋大学, 2007 WANG Zhiwei. Enzymological characteristics of polygalacturonase and its products analysis[D]. Qingdao: Ocean University of China, 2007.
[35] 石润润. 内切葡聚糖酶的酶库构建和酶学特性研究[D]. 上海: 华东理工大学, 2013 SHI Runrun. Construction of endoglucanases library and characterization of enzymatic properties[D]. Shanghai: East China University of Science and Technology, 2013.
[36] 李鑫, 周瑾, 赖晨欢, 等. 菊芋渣选择性吸附天然菊粉酶催化制备短链低聚果糖[J]. 生物质化学工程,2017,51(6):33−37. [LI Xin, ZHOU Jin, LAI Chenhuan, et al. Selective adsorption of native inulinase by Jerusalem Artichoke residue and preparation of short-chain fructooligosaccharides[J]. Biomass Chemical Engineering,2017,51(6):33−37. doi: 10.3969/j.issn.1673-5854.2017.06.006 [37] CHANDINI S K, RAO L J, GOWTHAMAN M K, et al. Enzymatic treatment to improve the quality of black tea extracts[J]. Food Chemistry,2011,127(3):1039−1045. doi: 10.1016/j.foodchem.2011.01.078
[38] BAIK J H, SHIN K, PARK Y, et al. Biotransformation of catechin and extraction of active polysaccharide from green tea leaves via simultaneous treatment with tannase and pectinase[J]. Journal of the Science of Food and Agriculture,2014,95(11):2337−2344.
-
期刊类型引用(1)
1. 张雅施,李文文,宗爱珍,左兆河,郑振佳,张斌. 菊芋多糖锌的制备及其抗氧化活性评价. 食品工业科技. 2023(12): 251-259 .  本站查看
本站查看
其他类型引用(0)








 下载:
下载:

 下载:
下载:



