Research Progress on Separation, Purification, Structure Analysis and Function of Melanoidins from Plants
-
摘要: 近年来,类黑精因其抗癌、预防肥胖、调节胃肠道等生物学功能特性受到人们越来越多的关注。本文介绍了大孔树脂、超滤和层析技术在分离纯化中的应用;紫外-可见光谱、红外光谱、荧光光谱、气相色谱-质谱、原子力显微镜、核磁共振在结构鉴定中的应用;以及其细胞毒性、预防肥胖、调节肠道菌群、抗癌的功能作用。本文为后续类黑精的结构功能和安全性研究提供新思路。Abstract: In recent years, melanoidins has attracted increasing attention for its biological functions such as anti-cancer, obesity prevention and gut microbiota regulation. This paper reviews the applications of macroporous resin, ultrafiltration, and chromatographic technology in the separation and purification, the adhibition of ultraviolet-visible spectrum, infrared spectrum, fluorescence spectrum, gas chromatography-mass spectrometry, atomic force microscope, nuclear magnetic resonance, atomic force microscope in structure identification, and the function of its cell toxicity, obesity prevention and gut microbiota regulation, anti-cancer. It is expected to stimulate new ideas on the structure, function and safety of melanoidins.
-
Keywords:
- melanoidins /
- maillard reaction /
- extraction /
- separation /
- purification /
- functional properties
-
类黑精(Melanoidins)作为美拉德反应终产物,是还原糖和氨基酸经过一系列的缩合聚合反应生成的一种深色的复杂的大分子化合物[1-2]。由于受还原糖和氨基酸种类、温度、处理时间、pH等因素的影响,它的结构和形成过程还不能被准确解释[3-4]。同时,美拉德反应的发生一般会伴随着其他非酶褐变的发生,如:焦糖化反应、抗坏血酸褐变、脂质褐变等[5-6]。美拉德反应是一系列还原糖与含氮化合物的级联反应[7-8],以上因素也会加剧反应产物的不确定性[9]。现阶段研究发现的美拉德反应中间产物有:5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)、糠氨酸、双乙酰、还原酮、3-脱氧葡萄糖酮、酮亚胺、醛亚胺等,这些中间产物可以进一步与氨基化合物聚合,最终生成大分子物质类黑精。美拉德反应发生在食品加工(如:高温、油炸等)、运输以及储藏的各个环节中[10],类黑精广泛存在于人们那的日常饮食中(图1),食品安全问题成为了研究的重点[11-13]。
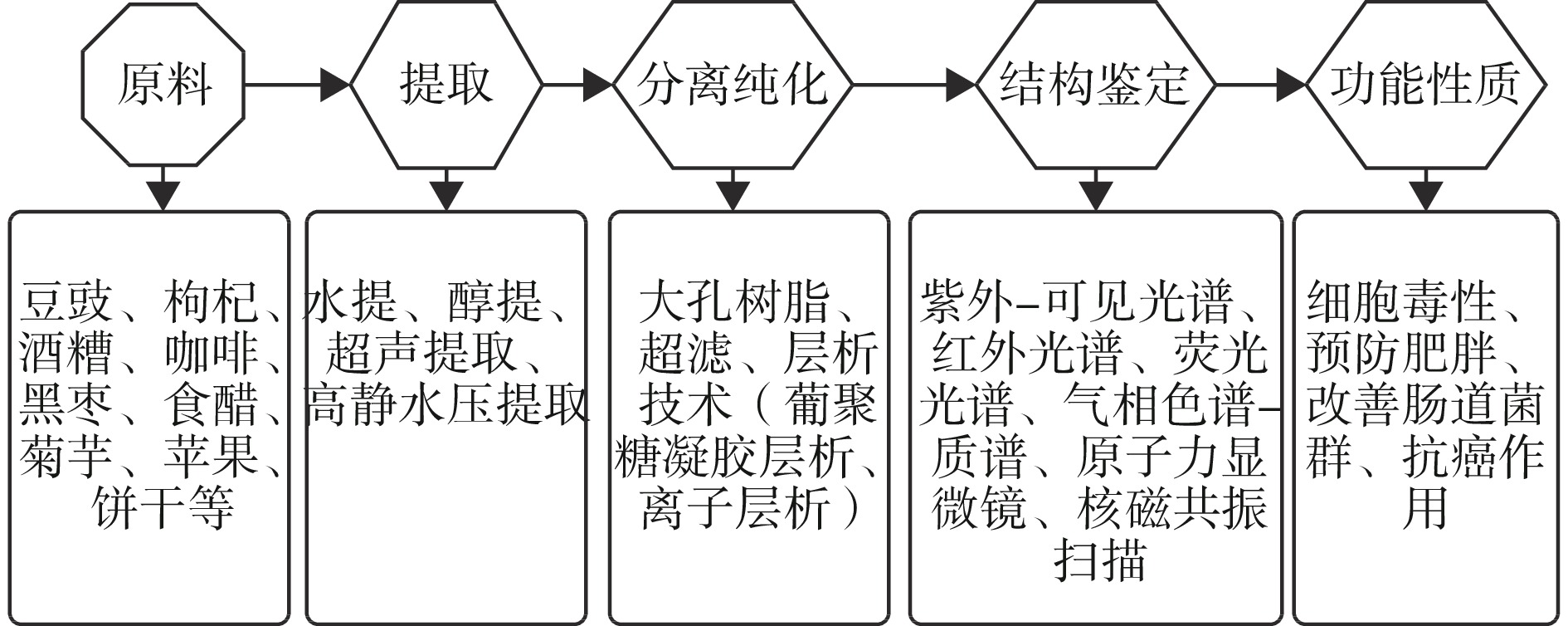
本文植物源性类黑精是指植物生长过程中产生的类黑精或者植物经过高温处理以后产生的类黑精。除了植物来源类黑精,还有动物来源类黑精——在动物的加工过程中产生的类黑精。相比较而言,植物源性类黑精具有简单易得、样本可重复性高、研究更广泛的特点。近年来,对于植物源性类黑精的功能作用研究不断深入,但是对于类黑精结构的研究还不充分。本文就植物源性类黑精展开(图2),对类黑精的分离纯化及结构分析进行综述,以期为以后类黑精分离制备及深入研究提供参考;同时对现有的植物源性类黑精功能性质研究进行综述,综合分析类黑精的安全性。
1. 类黑精分离纯化
目前,对于植物源性类黑精的分离纯化方法分为:大孔树脂、超滤、凝胶层析和离子交换层析(表1)。类黑精是一系列复杂的级联反应后期经过脱水、环化、重排、异构化、聚合等生成,所以结构还不能被人们准确的表征,这使得分离纯化也复杂化,就目前方法而言,可以通过测定420 nm或470 nm处的吸光值大小来确定类黑精的相对含量,或者是通过测定类黑精中不同分子量的组成将其成分进行区分。
表 1 植物源性类黑精分离方法Table 1. Methods for separation of melanoidins from plants分离方法 原理 优缺点 参考文献 大孔树脂 根据分子表面所受作用力不同,以及大孔树脂本身的多孔结构,使其具有筛选作用 吸附容量大、选择性好、吸附速度快、时间短;经过反复使用后,内部及表面会有杂质附着使其颜色变深、树脂破碎使得分离效果变差 [14−17] 超滤 将提取物在一定压力下通过不同分子量的滤膜,将复杂的成分按照分子量进行分离,从而获得不同分子量组分 分离速度快,效果好,取不同分子量的样品进行比较分析;不能对溶液中多糖、蛋白等物质进行分离,在功能分析时不能排除他们的干扰 [8,17−20] 葡聚糖
凝胶层析利用凝胶的孔径作用、凝胶见的空隙以及待分离物对洗剂的溶解度不同在通过凝胶柱的过程中达到分离纯化的作用 操作简单、设备简单,分离效果较好,重复性高,分离条件缓和,应用广泛;仅根据流速区分分辨率不高,分离操作较慢 [17,21] 离子交换
层析利用固定相和流动相所带电荷的不同对物质进行分离 精密度高、重复性好,操作简单、设备简单;周期较长,耗盐量大,仅依据离子电荷特性,不具有很高的选择性,普遍适用性差 [17,21] 1.1 大孔树脂
大孔树脂是一种多孔骨架结构,根据极性可分为:非极性、中等极性和极性。在类黑精纯化过程中一般使用弱极性树脂吸附,不同类型大孔树脂对不同来源植物源性类黑精吸附效果见表2。由表2可知,不同来源的植物源性类黑精具有不同的吸附特性,这可能是由于不同的美拉德反应底物以及反应条件的不同所导致。这也印证了美拉德反应的复杂性,以及处理方式对于植物源性类黑精的影响。但是,经过大孔树脂处理后的类黑精溶液都表现出更高的抗氧化活性。
表 2 大孔树脂对植物源性类黑精的吸附特性影响Table 2. Effect of macroporous resin on the adsorption properties of melanoidins from plants1.2 超滤技术
超滤是一种膜分离技术,成为研究类黑精的一个重要方法,在国内外广泛应用。王月丽[18]依次使用不同分子量截留值的滤膜对黑蒜中类黑精进行分离得到四组不同分子量的类黑精溶液,四组的分子量分别为:高分子量(>50 kDa),中等分子量(10~50 kDa;1~10 kDa),低分子量(<1 kDa),然后通过凝胶渗透色谱对四组类黑精溶液进行检测,研究发现,不同分子量的类黑精溶液具有不同的吸收峰,中、高分子量组分中会含有低分子量组分的吸收峰,同时,高分子量组分的杂峰更少,分子量分布更集中。郑佳佳[17]将类黑精分别通过3、10、30、50 kDa的滤膜,得到相应的组分。Wang等[8]分别用3.5 kDa或25 kDa滤膜过滤,得到大于3.5 kDa或25 kDa的类黑精样品。Wu等[19]将制备的黑蒜类黑精样品溶液通过50 kDa和10 kDa的滤膜,得到三个不同组分的类黑精溶液。Zhao等[20]用12 kDa的滤膜截留黑蒜类黑精提取液,保留高分子量组分备用。综上,美拉德反应是一个复杂的级联反应,通过超滤能够分析不同分子量的相对含量,有助于分析反应所处的阶段,以更好地控制产品的品质。同时,它具有操作简单,分离速度快、分离效果好等优点,方便大规模制备样品。但也应考虑到,超滤不能将样品中的其他物质进行分离,只是将样品按照滤膜孔径进行分组。
1.3 层析技术
层析法是利用不同物质理化性质的差异而建立起来的技术。在类黑精的分离中一般使用葡聚糖凝胶层析和离子交换层析或者同时使用两种分离技术。郑佳佳[17]联合使用Sephadex G-50凝胶过滤层析和DEAE-Sepharose fast flow,发现最佳上样浓度为50 mg/mL,不同的洗脱剂洗脱效果区别不大;同时,在最佳条件下,测定分离过程中多糖的含量变化,发现由于大分子量多糖与大分子量类黑精分子量相近不能实现完全分离。Xu等[21]使用DEAE-Sepharose fast flow和Superdex对分子量大于3.5 kDa的食醋类黑精进行分离,得到四个不同的组分,发现其多为美拉德反应初期产物,在290 nm具有较高吸收峰。综上,葡聚糖凝胶层析和离子交换层析可以用于类黑精的分离,但是不能排除多糖、蛋白等大分子量物质的影响。
2. 类黑精结构表征
类黑精因其复杂的结构,很难被人们研究。为了简化研究,以及制备具有可重复性的类黑精,有研究采用特定的还原糖和氨基酸来制备模型类黑精,结果表明不同条件下生成的类黑精也是不一样的[22-23]。同时,类黑精的具体结构及生成机理仍不能进行明确的表征和解释。pH是美拉德反应过程中影响反应中间体和反应速率的重要指标[24],同时反应通常在中性或弱碱性的条件下发生反应[25-26]。有研究发现,控制反应过程中pH对生成的类黑精种类及结构有影响,Kwak等[27]发现在恒定pH条件下电聚焦生成的条带数量小于缓冲溶液条件下生成的,但是恒定pH条件下生成的类黑精稳定性更好。同时,研究发现,类黑精中不只有大分子化合物,也包括一些小分子化合物[4]。紫外-可见光谱可测量类黑精的特征吸收值,类黑精的吸收值在400~500 nm之间,吸光值与浓度成正比。现有的研究中,使用光学仪器等对其进行表征,类黑精中含有羟基、羰基、羧基等官能团;含有荧光物质,具有荧光特性[28];热降解后含有呋喃、羰基化合物、吡咯等物质。同时,有研究发现,类黑精具有阴离子性[29],带负电荷[30],可与金属离子螯合[3]。类黑精具有很高的抗氧化活性,这可能与类黑精的阴离子负电性有关[22]。
2.1 紫外-可见光谱
紫外-可见光谱广泛应用于物质的定性、定量分析,在类黑精的研究中也被广泛使用。Wang等[8]测定模型类黑精200~800 nm紫外-可见吸收光谱,得到样品在275 nm和375 nm处有吸收峰。时川[31]测定红枣枣皮类黑精200~600 nm波长范围内的吸收值,结果表明其在470 nm处有最大吸收峰。王月丽[18]测定黑蒜类黑精200~700 nm内吸收波长,结果显示无明显末端吸收波长。由于类黑精是一类复杂的分子量不同的化合物,故而不能用单一的特征吸收峰来表示。也有研究引入摩尔消光系数来表征类黑精的含量,用1 mol/L的葡萄糖发生美拉德反应后的吸光度来表示类黑精浓度。研究发现:在400~500 nm内,模型类黑精颜色与葡萄糖含量成正比[32-33];现有的研究一般选用400、420、470或490 nm来表征美拉德反应末期类黑精含量[34-35]。综上,紫外-可见光谱操作简单快速,具有很高的实用价值,可以用来判断类黑精的相对含量,但是由于类黑精是一个混合物,故而不能对其进行定量判断。
2.2 傅里叶变换红外光谱
不同植物源性类黑精红外光谱表征如表3所示,红外光谱可以检测待测样品中所含有的官能团,也可以比较相同官能团的变化,从而对样品进行很好的分析。红外光谱因扫描速度快、灵敏度高等优点被广泛应用于类黑精的结构鉴定中,同时,也应考虑到类黑精是一个复杂的混合物,易受元素相互干扰和重叠峰的影响。
表 3 不同植物源性类黑精红外光谱表征Table 3. Infrared spectral characterization of different melanoidins from plants类黑精名称 官能团 参考文献 醋类黑精 C=O(1654 cm−1),-CO-NH-(1654 cm−1),-O-H(1040,1080,3400 cm−1),
C-O-C(1147 cm−1),CH2(1415,2926 cm−1),CH3(2970,2972 cm−1)[8] 咖啡类黑精 C=O(1654 cm−1),-CO-NH-(1654 cm−1),-O-H(1040,1080,3400 cm−1),
C-O-C(1147 cm−1),CH2(1415,2926 cm−1),CH3(2970,2972 cm−1)[8] 模型类黑精 O-H(3600~3200 cm−1),CH3(1379,1438,2943 cm−1),CH2(2914 cm−1),C-H(995,1458,2891~2603 cm−1),
COOH(1717 cm−1),C=O(1622 cm−1),C-O(1104~1014 cm−1),C-N(1362 cm−1),N-H,(1593 cm−1)[23] 酒糟类黑精 C=O(1651.35 cm−1),N-H(1651.35 cm−1),C-N(1402.67 cm−1),O-H(3376.30 cm−1),
C-H2(2926.24 cm−1),C-O(1042.23 cm−1),C-C(1042.23 cm−1),-C-CO-C-(565.13 cm−1)[36] 2.3 荧光光谱
荧光光谱是一种指纹鉴定技术,不同物质具有不同的荧光特性。赵林芬等[37]通过荧光矩阵光谱研究云南小粒咖啡中类黑精的荧光强度,结果发现,在10~80 ℃的温度范围内,其荧光强度与温度成反比;pH在5~10范围内,荧光强度较为稳定;避光条件下,60 min内荧光强度不发生显著变化,光照条件下,荧光强度与时间成反比;在浓度低于0.5 mg/mL时,荧光强度与浓度成正比,在浓度大于10 mg/mL时,荧光强度与浓度不相关。Zhao等[20]在激发波长375 nm,发射波长400~600 nm处检测荧光光谱,结果表明,最佳吸收波长和发射波长分别为370 nm和480 nm,这与其他类黑精荧光特性一致,进而可以推测不同来源的类黑精可能含有相同的结构单元[8]。综上,类黑精具有荧光特性,通过测定其发射出的一定波长的辐射,可以对样品中物质进行定性定量分析。荧光光谱因灵敏度高、选择性强、用样量少、方法简单等优点被广泛应用,同时,也应该考虑到容易受相互元素干扰和叠加的影响,在类黑精的检测中由于含有多种物质因此不能进行定量分析。
2.4 气相色谱-质谱分析
不同植物源性类黑精气相色谱-质谱表征如表4所示。Zhao等[20]对高静水压处理得到的黑蒜类黑精溶液进行热解-气相色谱-质谱分析,鉴定出88种热解产物,热降解后的挥发性物质主要由呋喃、羰基化合物、吡咯、吡嗪和吡啶组成。Wu等[19]用气相色谱-质谱对黑蒜样品进行分析,结果表明:从类黑精样品中共鉴定出26种挥发性化合物,其主要物质为杂环胺和含硫挥发性物质。综上,气相色谱-质谱可以根据出峰的特点对样品中所含有的物质进行定性,因其样品用量少和检测灵敏度高,广泛应用于类黑精的测定,但是,它只能对已经确定的物质进行检测,不能检测新物质,对于美拉德反应可能出现的新物质结构不能确定。
表 4 不同植物源性类黑精气相色谱-质谱表征Table 4. Gas chromatograph-mass spectrometer characterization of different melanoidins from plants类黑精名称 呋喃 吡咯 吡嗪 环烯 胺类 参考文献 黑蒜类黑精 3-甲基呋喃、2,5-二甲基呋喃、2-丙烯基呋喃、2-巯甲基呋喃、2-乙酰基呋喃、2-甲乙硫醚呋喃、2-呋喃酮、二羟基-4-羧基二氢呋喃、5-甲基-2-呋喃甲醛、2-呋喃甲醇、2-甲基苯并呋喃 1-氢-1-乙基吡咯、吡咯、1-氢-3-甲基吡
咯、2-乙酰基吡咯4-环戊烯-1,3-二酮、2-甲基-2-环戊烯、3-甲基-2-环戊烯、2-羟基-3-甲基2-环戊烯、2,3-甲基-2-环戊烯 [20,38] 黑菊芋类黑精 2,5-二甲呋喃、3-乙基呋喃、
5-羟甲基-2-氢-呋喃酮、3-甲基吡咯、2-乙基-4-甲基吡咯 2-丙二烯基环丁烯、2-丙烯基-3-环戊稀、1-甲基-2-羰基-2-环戊烯、3-甲基-1-羰基-2-环戊烯 2-吡啶酰胺、
4-硝基苯胺[39] 高温发酵苹果类黑精 2-呋喃甲醇、2,4-二甲基呋喃、2-呋喃乙酮、2(5H)-呋喃酮 1-(2-氨乙基)吡咯烷 环己烷甲醛、环戊酮、2-环戊烯-1,4-二酮、1,3-环戊二酮、甲基环戊烯酮 3-(二乙胺)-1,2-
丙二醇[40] 荞麦饼干类
黑精糠醛、呋喃甲醇 甲基吡嗪、2,6-甲基吡嗪、2,5-甲基吡嗪、2-乙基吡嗪、2,3-甲基吡嗪 α-蒎烯、β-月桂烯、1-甲基-4-(1-甲基乙烯基)环己烯、石竹烯 [41] 咖啡类黑精 4-羟基-2,5-二甲基-3(2H)呋
喃酮、(S)-5-羟甲基二氢
呋喃-2-酮2-吡咯烷酮、1-丁基-2-吡咯烷酮、2-乙酰基吡咯、5-(环己基甲基)吡咯烷-2-酮、3-氰基-4-氧代吡咯烷-1-甲酸叔丁酯N-甲基吡咯烷酮、2-乙酰基吡咯、3-乙基-4-甲基-吡咯-2,5-二酮 六氢吡咯并[1,2-A]吡嗪-1,4-二酮、3-异丁基-2,3,6,7,8,8a-六氢吡咯[1,2-a]吡 嗪-1,4-二酮、吡咯并(2,1-F)吡嗪-1,4-二酮、吡咯并(2,1-F)吡嗪-1,4-二酮、吡咯并(2,1-F)吡嗪-1,4-二酮,2,3,6,7,8,8A- 六氢-3-苄 乙基环戊烯醇酮 油酸酰胺、戊二酰亚胺、丁二酰亚胺、戊二酰亚胺、双氢麦角胺、异戊酰胺、3-苯基丙酰胺、硬脂酰胺 [42] 2.5 原子力显微镜
原子力显微镜可表征大分子的纳米结构构象,能够以更加直观的方式观察物质的表面形态。Zhao等[20,43]用原子力显微镜(AFM)对高静水压处理黑蒜类黑素的形态进行了表征,结果表明:未经处理的类黑精表面粗糙度(Ra)为0.305 nm、最大高度(Rmax)为17.5 nm、偏斜度为8.11和峰度为114;高静水压处理增加了Ra和Rmax,减少了黑色素样品的偏斜和峰度。王月丽[18]用AFM对不同分子量黑蒜类黑精形态进行表征,发现不同分子量类黑精有不同的形貌特征,有球状、棒状、环状、圆锥状等;其中中分子量在1~10 kDa多处形成明显清晰的排列,呈不规则的团聚球状结构,分子量在10~50 kDa组分在云母片表面形成网状结构,多糖链呈卷曲旋转状。原子力显微镜可以直接得到待测样品三维表面图,且不需要特殊处理,对于类黑精的研究具有很高的参考价值,但也会受探头的影响,并且有成像范围小、速度慢的局限。
2.6 核磁共振扫描
核磁共振是由原子核的自旋运动引起的,不同的原子核自旋运动的情况不同,以此能够实现对所含有的基团结构进行解析。王月丽[18]测定了黑蒜类黑精提取液核磁共振测1H和13C谱,结果表明:类黑精中含有丰富的糖类物质,糖残基异头碳含有α-型和β-型,糖环构型含有吡喃型和呋喃型。Mohsin等[40]借助核磁共振研究不同温度下生成模型类黑精的结构区别。研究发现,随着温度的升高,N-H、C-N和C-H振荡的尖锐信号容易出现不均匀展宽,可能是生成的小分子残基合并到大分子骨架的原因;碳含量随着温度的升高而增加,而氢和氧的含量则随着温度的升高而减少,失去的氢和氧的摩尔比约为2:1。Ripper等[7]利用核磁共振技术研究咖啡类黑精成分变化。研究发现,含有蛋白质和多糖,类黑精的分子量在烘焙期间先增加后减小,绿原酸可以保持完整结构通过化学键与咖啡类黑精共价键相连。Li等[28]研究发现模型类黑精在美拉德反应过程中能够转化为荧光纳米颗粒。研究发现,类黑精在热水中加热会形成荧光纳米颗粒,呋喃环的碳键断裂,释放出高碳氢比组分,如CH=CH-、-C≡C-和苯衍生物。核磁共振光谱通常用来结构解析,根据标记1H和13C所呈现的峰,对样品实现完整结构解析,现已经广泛应用于大分子物质的结构解析。但是,由于类黑精是一组复杂的化合物,不是单一的物质,因此其结构鉴定会不可避免地受杂峰的影响。
3. 类黑精功能活性
随着生活水平的不断提高,人们对于饮食健康的要求提高,相比较单一关注食品的口感,更多的关注食品的健康以及营养均衡[44-45]。类黑精因广泛存在于日常饮食中且具有其特殊的功能性质,受到人们越来越多的关注[46-48]。据估计,普通人群每天摄入大约10~12 g来自所有可能的食物来源的类黑精。现有的研究发现类黑精具有多种有益人体健康的功能性质。同时,类黑精的摄入应当控制在一定的剂量范围内,且不应过度夸大其作用,有研究发现,过量的类黑精可能有致敏、致突变、致癌的风险。下面对类黑精的细胞毒性、预防肥胖、改善肠道菌群、抗癌等功能作用进行综述。
3.1 细胞毒性
目前研究类黑精细胞毒性的细胞系有人结肠癌细胞(CaCo-2细胞),人脐静脉内皮细胞系(HUVEC细胞),LS180结肠癌细胞,小鼠单核巨噬细胞白血病细胞(RAW 264.7细胞),3 T3-L1 鼠成纤维细胞等。Noelia等[49]研究普通面包、软面包和饼干中类黑精对于CaCo-2细胞和HUVEC细胞的细胞毒性作用,研究发现:软面包中类黑精以及其模拟体外消化产物对两种细胞系均不产生毒性作用;普通面包对于HUVEC细胞的细胞毒性存在剂量关系,类黑精样品在100 µg/mL细胞毒性显著,经过体外模拟消化类黑精样品在200 µg/mL细胞毒性显著,显示细胞毒性随剂量增加;饼干中的类黑精提取物对HUVEC细胞具有细胞毒性,但其经过体外模拟消化以后细胞毒性消失。Langner等[50]研究发现,从加热的马铃薯纤维中分离的类黑精对体外培养的LS180结肠癌细胞有抗增殖作用,与马铃薯纤维提取物和高分子量类黑精相比,低分子量类黑精显示出明显更强的改变特定分子靶点的潜力。
3.2 预防肥胖
肥胖是一个主要的公共卫生问题,可导致额外的代谢综合征,如脂肪肝、血脂异常、糖尿病、高血压和动脉硬化。Wu等[51]以高脂饮食诱导的小鼠为研究对象,通过口服不同浓度的黑蒜类黑精提取液,研究类黑精对于肥胖的调节作用,研究发现:口服黑蒜类黑精提取液的小鼠体重和白色脂肪组织明显降低,且高剂量组具有更好的效果;明显缓解血脂紊乱,促进脂质代谢,增加糖耐量。Eriko等[52]从黑醋中提取一种新型寡葡聚糖-类黑精,发现其对3 T3-L1小鼠成纤维细胞成脂具有显著抑制作用。Sara等[5]研究黑蒜提取物对高脂高糖饮食诱导的雄性大鼠代谢作用影响,发现:黑蒜提取物可促进小鼠机体代谢,促进基因表达和瘦素受体mRNA水平降低,从基因层面证明黑蒜的预防肥胖,促进代谢作用。Wu等[53]研究发现,高剂量晚期糖基化产物会改变肠道菌群,不利于碳水化合物和脂质的代谢;而低剂量的晚期糖基化产物会促进代谢,阻止或者逆转早期糖尿病的进程。由此可知,一定剂量的类黑精可以达到预防小鼠肥胖的效果,类黑精对于人体是否具有预防肥胖的效果还有待进一步的科学研究。
3.3 改善肠道菌群
肠道菌群被称为是“人类的第二大脑”,“被遗忘的器官”以及“人类的第二基因组”。越来越多的研究表明,肠道菌群与人体健康息息相关。Wu等[51]通过对C57BL/6小鼠盲肠提取物的细菌进行16S rRNA基因测序,研究微生物菌群的丰富度和多样性,发现:肠道微生物环境得到改善,阿克曼氏菌科、乳酸杆菌科、埃格特菌科等增加,瘤胃菌科、弧菌科、坦纳菌科等减少。Wu等[54]通过对高脂饮食小鼠灌喂不同分子量黑蒜类黑精溶液,研究黑蒜类黑精对高脂饮食诱导的昼夜肠道菌群失调的作用,研究发现:高分子量和低分子量的类黑精均能缓解高脂饮食引起的昼夜菌群失调,并且高分子量组相较于低分子量组具有更好的效果。Perez-burillo等[55]研究不同食物来源的类黑精对肠道菌群的影响,发现:类黑精可以不被胃肠消化而成为肠道微生物发酵作用底物,增加短链脂肪酸的产生,促进双歧杆菌等有益菌的生长,释放酚类物质并促进其吸收;类黑精被认为是潜在的益生元制剂。
3.4 抗癌作用
癌症是全世界疾病死亡率上升的一个主要原因,造成严重的社会负担。Wang等[56]研究黑蒜提取液对小鼠免疫力产生的作用,发现注射黑蒜提取液的肿瘤细胞治愈率为50%,并且未治愈的肿瘤细胞大小是对照组的一半;注射黑蒜提取液的小鼠脾细胞中IFN-ɣ、TNF-α、IL-2细胞因子分泌量增加,促使自然杀伤细胞活性明显增强。Langner等[50]从烤马铃薯中分离出高分子量和低分子量的类黑精并作用于人类结肠癌细胞,发现高分子量和低分子量的类黑精提取液对结肠癌细胞均有抗增殖作用,其中低分子量组分效果优于高分子量组分。
4. 结论与展望
类黑精是美拉德反应后期一种特殊的功能分子,具有预防肥胖、改善肠道菌群、抗癌等功能性质。然而,也有研究发现过量的类黑精会有致癌作用。美拉德反应发生在我们饮食的方方面面,加热高温都会促使其反应的发生,因此随着人们饮食安全意识的不断提高,越来越重视食品安全。就目前的发现,一部分研究通过葡萄糖和特定的氨基酸反应来简化美拉德反应过程,减少不可控因素;一部分研究通过提取具体的食品中类黑精,对其结构及功能性质进行研究。类黑精广泛存在于我们日常饮食,因此对于其安全性的研究非常重要,只有了解剂量-效应的关系,才能让其更好的发挥有益作用。同时,类黑精作为美拉德反应产物,通过对它的研究,有助于美拉德反应机理的研究。在未来对于类黑精的研究,希望可以通过新的检测技术进一步解析其内部结构及功能基团和组合方式,同时,通过动物学实验研究其有害作用的剂量-效应关系,以便更好的造福人类。
-
表 1 植物源性类黑精分离方法
Table 1 Methods for separation of melanoidins from plants
分离方法 原理 优缺点 参考文献 大孔树脂 根据分子表面所受作用力不同,以及大孔树脂本身的多孔结构,使其具有筛选作用 吸附容量大、选择性好、吸附速度快、时间短;经过反复使用后,内部及表面会有杂质附着使其颜色变深、树脂破碎使得分离效果变差 [14−17] 超滤 将提取物在一定压力下通过不同分子量的滤膜,将复杂的成分按照分子量进行分离,从而获得不同分子量组分 分离速度快,效果好,取不同分子量的样品进行比较分析;不能对溶液中多糖、蛋白等物质进行分离,在功能分析时不能排除他们的干扰 [8,17−20] 葡聚糖
凝胶层析利用凝胶的孔径作用、凝胶见的空隙以及待分离物对洗剂的溶解度不同在通过凝胶柱的过程中达到分离纯化的作用 操作简单、设备简单,分离效果较好,重复性高,分离条件缓和,应用广泛;仅根据流速区分分辨率不高,分离操作较慢 [17,21] 离子交换
层析利用固定相和流动相所带电荷的不同对物质进行分离 精密度高、重复性好,操作简单、设备简单;周期较长,耗盐量大,仅依据离子电荷特性,不具有很高的选择性,普遍适用性差 [17,21] 表 2 大孔树脂对植物源性类黑精的吸附特性影响
Table 2 Effect of macroporous resin on the adsorption properties of melanoidins from plants
表 3 不同植物源性类黑精红外光谱表征
Table 3 Infrared spectral characterization of different melanoidins from plants
类黑精名称 官能团 参考文献 醋类黑精 C=O(1654 cm−1),-CO-NH-(1654 cm−1),-O-H(1040,1080,3400 cm−1),
C-O-C(1147 cm−1),CH2(1415,2926 cm−1),CH3(2970,2972 cm−1)[8] 咖啡类黑精 C=O(1654 cm−1),-CO-NH-(1654 cm−1),-O-H(1040,1080,3400 cm−1),
C-O-C(1147 cm−1),CH2(1415,2926 cm−1),CH3(2970,2972 cm−1)[8] 模型类黑精 O-H(3600~3200 cm−1),CH3(1379,1438,2943 cm−1),CH2(2914 cm−1),C-H(995,1458,2891~2603 cm−1),
COOH(1717 cm−1),C=O(1622 cm−1),C-O(1104~1014 cm−1),C-N(1362 cm−1),N-H,(1593 cm−1)[23] 酒糟类黑精 C=O(1651.35 cm−1),N-H(1651.35 cm−1),C-N(1402.67 cm−1),O-H(3376.30 cm−1),
C-H2(2926.24 cm−1),C-O(1042.23 cm−1),C-C(1042.23 cm−1),-C-CO-C-(565.13 cm−1)[36] 表 4 不同植物源性类黑精气相色谱-质谱表征
Table 4 Gas chromatograph-mass spectrometer characterization of different melanoidins from plants
类黑精名称 呋喃 吡咯 吡嗪 环烯 胺类 参考文献 黑蒜类黑精 3-甲基呋喃、2,5-二甲基呋喃、2-丙烯基呋喃、2-巯甲基呋喃、2-乙酰基呋喃、2-甲乙硫醚呋喃、2-呋喃酮、二羟基-4-羧基二氢呋喃、5-甲基-2-呋喃甲醛、2-呋喃甲醇、2-甲基苯并呋喃 1-氢-1-乙基吡咯、吡咯、1-氢-3-甲基吡
咯、2-乙酰基吡咯4-环戊烯-1,3-二酮、2-甲基-2-环戊烯、3-甲基-2-环戊烯、2-羟基-3-甲基2-环戊烯、2,3-甲基-2-环戊烯 [20,38] 黑菊芋类黑精 2,5-二甲呋喃、3-乙基呋喃、
5-羟甲基-2-氢-呋喃酮、3-甲基吡咯、2-乙基-4-甲基吡咯 2-丙二烯基环丁烯、2-丙烯基-3-环戊稀、1-甲基-2-羰基-2-环戊烯、3-甲基-1-羰基-2-环戊烯 2-吡啶酰胺、
4-硝基苯胺[39] 高温发酵苹果类黑精 2-呋喃甲醇、2,4-二甲基呋喃、2-呋喃乙酮、2(5H)-呋喃酮 1-(2-氨乙基)吡咯烷 环己烷甲醛、环戊酮、2-环戊烯-1,4-二酮、1,3-环戊二酮、甲基环戊烯酮 3-(二乙胺)-1,2-
丙二醇[40] 荞麦饼干类
黑精糠醛、呋喃甲醇 甲基吡嗪、2,6-甲基吡嗪、2,5-甲基吡嗪、2-乙基吡嗪、2,3-甲基吡嗪 α-蒎烯、β-月桂烯、1-甲基-4-(1-甲基乙烯基)环己烯、石竹烯 [41] 咖啡类黑精 4-羟基-2,5-二甲基-3(2H)呋
喃酮、(S)-5-羟甲基二氢
呋喃-2-酮2-吡咯烷酮、1-丁基-2-吡咯烷酮、2-乙酰基吡咯、5-(环己基甲基)吡咯烷-2-酮、3-氰基-4-氧代吡咯烷-1-甲酸叔丁酯N-甲基吡咯烷酮、2-乙酰基吡咯、3-乙基-4-甲基-吡咯-2,5-二酮 六氢吡咯并[1,2-A]吡嗪-1,4-二酮、3-异丁基-2,3,6,7,8,8a-六氢吡咯[1,2-a]吡 嗪-1,4-二酮、吡咯并(2,1-F)吡嗪-1,4-二酮、吡咯并(2,1-F)吡嗪-1,4-二酮、吡咯并(2,1-F)吡嗪-1,4-二酮,2,3,6,7,8,8A- 六氢-3-苄 乙基环戊烯醇酮 油酸酰胺、戊二酰亚胺、丁二酰亚胺、戊二酰亚胺、双氢麦角胺、异戊酰胺、3-苯基丙酰胺、硬脂酰胺 [42] -
[1] PAGáN J, IBARZ A, ELVIRA L, et al. Monitoring the behavior of melanoidin from a glucose/l-asparagine solution[J]. Food Research International,2012,48(2):802−7. doi: 10.1016/j.foodres.2012.06.030
[2] LIU J, GAN J, YU Y, et al. Effect of laboratory-scale decoction on the antioxidative activity of Zhenjiang aromatic vinegar: The contribution of melanoidins[J]. Journal of Functional Foods,2016,21:75−86. doi: 10.1016/j.jff.2015.11.041
[3] SHAHEEN S, SHORBAGI M, LORENZO J M, et al. Dissecting dietary melanoidins: Formation mechanisms, gut interactions and functional properties[J]. Crit Rev Food Sci Nutr,2021:1−18.
[4] CUI H, YU J, ZHAI Y, et al. Formation and fate of amadori rearrangement products in Maillard reaction[J]. Trends in Food Science & Technology,2021,115:391−408.
[5] AMOR S, GONZALEZ-HEDSTROM D, MARTIN-CARRO B, et al. Beneficial effects of an aged black garlic extract in the metabolic and vascular alterations induced by a high fat/sucrose diet in male rats [J]. Nutrients, 2019, 11(1): 153.
[6] BARTEL C, MESIAS M, MORALES F J. Investigation on the extractability of melanoidins in portioned espresso coffee[J]. Food Research International,2015,67:356−365. doi: 10.1016/j.foodres.2014.11.053
[7] RIPPER B, KAISER C R, PERRONE D. Use of NMR techniques to investigate the changes on the chemical composition of coffee melanoidins[J]. Journal of Food Composition and Analysis,2020:87.
[8] WANG Z, ZHANG Z, LI S, et al. Formation mechanisms and characterisation of the typical polymers in melanoidins from vinegar, coffee and model experiments[J]. Food Chem,2021,355:129444. doi: 10.1016/j.foodchem.2021.129444
[9] 时海波, 邹烨, 杨恒, 等. 美拉德反应产物生物活性及衍生危害物安全控制研究进展[J]. 食品工业科技,2019,40(22):325−333. [SHI H B, ZOU H, YANG H, et al. Research progress on biological activity of Maillard reaction products and safety control of derived hazards[J]. Science and Technology of Food Industry,2019,40(22):325−333. doi: 10.13386/j.issn1002-0306.2019.22.057 [10] 戚繁. 美拉德反应在食品工业中的研究进展[J]. 现代食品,2020(19):44−46. [QI F. Research progress of Maillard reaction in food industry[J]. Modern Food,2020(19):44−46. doi: 10.16736/j.cnki.cn41-1434/ts.2020.19.015 [11] ECHAVARRíA A P, PAGáN J, IBARZ A. Melanoidins formed by Maillard reaction in food and their biological activity[J]. Food Engineering Reviews,2012,4(4):203−223. doi: 10.1007/s12393-012-9057-9
[12] NOOSHKAM M, VARIDI M, VERMA D K. Functional and biological properties of Maillard conjugates and their potential application in medical and food: A review[J]. Food Res Int,2020,131:109003. doi: 10.1016/j.foodres.2020.109003
[13] LIU X, XIA B, HU L T, et al. Maillard conjugates and their potential in food and nutritional industries: A review[J]. Food Frontiers,2020,1(4):382−397. doi: 10.1002/fft2.43
[14] 何健, 黄占旺, 史杰, 等. 大孔树脂对曲霉型豆豉类黑精的精制研究[J]. 食品科学,2007(4):156−159. [HE J, HUANG Z W, SHI J, et al. Study on purification of Aspergillus-type douchi melanoidin with macro-porous resin[J]. Food Science,2007(4):156−159. doi: 10.3321/j.issn:1002-6630.2007.04.034 [15] 何健, 黄占旺, 张森旺, 等. 曲霉型豆豉类黑精的提取与精制[J]. 江西食品工业,2006(3):27−29. [HE J, HUANG Z W, ZHANG S W, et al. Study on extraction and purification ofAspergillus-type Douchi melanoidin[J]. Jiangxi Food Industry,2006(3):27−29. doi: 10.3969/j.issn.1674-2435.2006.03.009 [16] 胡云峰, 潘悦, 陈君然, 等. 枸杞熟化产物类黑精大孔吸附树脂纯化研究[J]. 食品与发酵工业,2021:1−9. [HU Y F, PAN Y, CHEN J R, et al. Purification of melanoidins from cookedLycium barbarum with macroporous resin[J]. Food and Fermentation Industries,2021:1−9. [17] 郑佳佳. 酒糟类黑精提取、纯化技术研究[D]. 泰安: 山东农业大学, 2015. ZHENG J J. Extraction and purification techniques of melanoidin from distillers' grains[D]. Taian: Shandong Agricultural University, 2015.
[18] 王月丽. 黑蒜类黑精的提取、分离及其抗氧化活性研究[D]. 天津: 天津理工大学, 2020. WANG Y L. Studies on extraction, isolationand antioxidant activities ofmelanoidins from black garlic[D]. Tianjin: Tianjin University of Technology, 2020.
[19] WU J, JIN Y, ZHANG M. Evaluation on the physicochemical and digestive properties of melanoidin from black garlic and their antioxidant activitiesin vitro[J]. Food Chem,2021,340:127934. doi: 10.1016/j.foodchem.2020.127934
[20] ZHAO Y, DING Y, WANG D, et al. Effect of high hydrostatic pressure conditions on the composition, morphology, rheology, thermal behavior, color, and stability of black garlic melanoidins[J]. Food Chem,2021,337:127790. doi: 10.1016/j.foodchem.2020.127790
[21] XU Q, TAO W, AO Z. Antioxidant activity of vinegar melanoidins[J]. Food Chemistry,2007,102(3):841−849. doi: 10.1016/j.foodchem.2006.06.013
[22] GU F-L, KIM J M, ABBAS S, et al. Structure and antioxidant activity of high molecular weight Maillard reaction products from casein–glucose[J]. Food Chemistry,2010,120(2):505−511. doi: 10.1016/j.foodchem.2009.10.044
[23] MOHSIN G F, SCHMITT F J, KANZLER C, et al. Structural characterization of melanoidin formed from d-glucose and l-alanine at different temperatures applying FTIR, NMR, EPR, and MALDI-ToF-MS[J]. Food Chem,2018,245:761−767. doi: 10.1016/j.foodchem.2017.11.115
[24] HIDALGO F J, ALAIZ M, ZAMORA R. Effect of pH and temperature on comparative nonenzymatic browning of proteins produced by oxidized lipids and carbohydrates [J]. Journal of Agricultural and Food Chemistry, 1999, 47(2):742-727.
[25] AJANDOUZ E H, PUIGSERVER A. Nonenzymatic browning reaction of essential amino acids: Effect of pH on caramelization and Maillard reaction kinetics[J]. Journal of Agricultural and Food Chemistry,1999,47(5):1786-−1793.
[26] AMES J M, ARNOLDI A, BATES L, et al. Analysis of the methanol-extractable nonvolatile Maillard reaction products of a model extrusion-cooked cereal product [J]. Journal of Agricultural and Food Chemistry, 1997, 45(4): 1256-1263.
[27] KWAK E J, LEE Y S, MURATA M, et al. Effect of pH control on the intermediates and melanoidins of nonenzymatic browning reaction[J]. LWT - Food Science and Technology,2005,38(1):1−6. doi: 10.1016/j.lwt.2003.09.011
[28] LI D, XIE Y, NA X, et al. Insights into melanoidin conversion into fluorescent nanoparticles in the Maillard reaction[J]. Food Funct,2019,10(7):4414−4422. doi: 10.1039/C9FO00383E
[29] RANI A, PAL N. Biodegradation of melanoidin from distillery effluent: Role of microbes and their potential enzymes [M]. Biodegradation of Hazardous and Special Products, 2013.
[30] WANG H-Y, QIAN H, YAO W-R. Melanoidins produced by the Maillard reaction: Structure and biological activity[J]. Food Chemistry,2011,128(3):573−584. doi: 10.1016/j.foodchem.2011.03.075
[31] 时川. 黑变红枣枣皮类黑精的提取与稳定性研究[D]. 泰安: 山东农业大学, 2019. SHI C. Study on the Extraction and stability of melanoidin from blacken jujube peel[D]. Tai'an: Shandong Agricultural University, 2019.
[32] CARLINE M. J BRANDS, BRONEK L W, MARTINUS A J S. Quantification of Melanoidin concentration in sugar−casein systems[J]. Journal of Agricultural and Food Chemistry,2002,50(5):1178−1183. doi: 10.1021/jf010789c
[33] MARTINS S I F S, VAN BOEKEL M A J S. Melanoidins extinction coefficient in the glucose/glycine Maillard reaction[J]. Food Chemistry,2003,83(1):135−142. doi: 10.1016/S0308-8146(03)00219-X
[34] KIM J S, LEE Y S. Enolization and racemization reactions of glucose and fructose on heating with amino-acid enantiomers and the formation of melanoidins as a result of the Maillard reaction[J]. Amino Acids,2009,36(3):465−474. doi: 10.1007/s00726-008-0104-z
[35] MARTINS S I F S, VAN BOEKEL M A J S. A kinetic model for the glucose/glycine Maillard reaction pathways[J]. Food Chemistry,2005,90(1-2):257−269. doi: 10.1016/j.foodchem.2004.04.006
[36] YANG S, FAN W, XU Y. Melanoidins from chinese distilled spent grain: Content, preliminary structure, antioxidant, and ace-inhibitory activities in vitro[J]. Foods, 2019, 8(10):516.
[37] 赵林芬, 王燕华, 王晓婷, 等. 云南小粒咖啡类黑精荧光矩阵光谱特征[J]. 食品工业科技,2021,42(8):36−41. [ZHAO L F, WANG Y H, WANG X T, et al. Fluorescence spectrum characteristics of melanoidins from Yunnan arabica coffee[J]. Science and Technology of Food Industry,2021,42(8):36−41. doi: 10.13386/j.issn1002-0306.2020060260 [38] 杨庆丽, 董艳, 刘玉, 等. 黑蒜加工中类黑精相关成分变化及其组成分析[J]. 中国调味品,2018,43(9):73−77. [YANG Q L, DONG Y, LIU Y, et al. Changes in the related components of melanoidin in black garlic processing and its composition analysis[J]. China Condiment,2018,43(9):73−77. doi: 10.3969/j.issn.1000-9973.2018.09.015 [39] 杨庆丽, 姬妍茹, 石杰, 等. 黑菊芋类黑精制备条件优化及组成成分分析[J]. 中国调味品,2019,44(6):172−176. [YANG Q L, JI Y R, SHI J, et al. Optimization of the preparation conditions and components analysis of melanoidins in black jerusalem artichoke[J]. China Condiment,2019,44(6):172−176. doi: 10.3969/j.issn.1000-9973.2019.06.040 [40] ZHU Z, ZHANG Y, WANG W, et al. Structural characterisation and antioxidant activity of melanoidins from high-temperature fermented apple[J]. International Journal of Food Science & Technology,2020,56(5):2471−2480.
[41] STAROWICZ M, KOUTSIDIS G, ZIELINSKI H. Determination of antioxidant capacity, phenolics and volatile maillard reaction products in rye-buckwheat biscuits supplemented with 3beta-d-rutinoside[J]. Molecules,2019,24(5):982.
[42] 刘亚玲, 谭超, 龚加顺. 云南不同地区烘焙咖啡豆主要成分分析及类黑精组成成分[J]. 食品科学,2017,38(2):176−183. [LIU Y L, TAN C, GONG J S. Main chemical composition and melanoidin composition of roasted coffee beans from different regions of Yunnan[J]. Food Science,2017,38(2):176−183. doi: 10.7506/spkx1002-6630-201702029 [43] DENG Y, JIN Y, LUO Y, et al. Impact of continuous or cycle high hydrostatic pressure on the ultrastructure and digestibility of rice starch granules[J]. Journal of Cereal Science,2014,60(2):302−310. doi: 10.1016/j.jcs.2014.06.005
[44] HE Y, YANG Z, PI J, et al. EGCG attenuates the neurotoxicity of methylglyoxal via regulating MAPK and the downstream signaling pathways and inhibiting advanced glycation end products formation [J]. Food Chemistry, 2022, 384:132358. .
[45] YAMAN M, DEMIRCI M, EDE-CINTESUN E, et al. Investigation of formation of well-known AGEs precursors in cookies using an in vitro simulated gastrointestinal digestive system [J]. Food Chem, 2021, 373(Pt A): 131451.
[46] KIM N H, KIM J Y, KIM J-M, et al. Preparation of melanoidin/TiO2 composites with improved UV screening ability and suppressed photocatalytic activity for cosmetic application[J]. Journal of Industrial and Engineering Chemistry,2020,86:186−193. doi: 10.1016/j.jiec.2020.03.002
[47] KORNILLOWICZ-KOWALSKA T, RYBCZYNSKA-TKACZYK K. Decolorization and biodegradation of melanoidin contained in beet molasses by an anamorphic strain of Bjerkandera adusta CCBAS930 and its mutants[J]. World J Microbiol Biotechnol,2020,37(1):1.
[48] TSIAKIRI E P, SOMPATZI E, VOUKIA F, et al. Biocatalytic and bioelectrolytic decolorization of simulated melanoidin wastewaters by Saccharomyces cerevisiae cells suspended and conjugated on silica and alumina [J]. Journal of Environmental Chemical Engineering, 2020, 8(5):104078.
[49] DIAZ-MORALES N, CAVIA-SAIZ M, SALAZAR G, et al. Cytotoxicity study of bakery product melanoidins on intestinal and endothelial cell lines[J]. Food Chem,2021,343:128405. doi: 10.1016/j.foodchem.2020.128405
[50] LANGNER E, NUNES F M, POZAROWSKI P, et al. Melanoidins isolated from heated potato fiber (Potex) affect human colon cancer cells growth via modulation of cell cycle and proliferation regulatory proteins[J]. Food Chem Toxicol,2013,57:246−255. doi: 10.1016/j.fct.2013.03.042
[51] WU J, LIU Y, DOU Z, et al. Black garlic melanoidins prevent obesity, reduce serum LPS levels and modulate the gut microbiota composition in high-fat diet-induced obese C57BL/6J mice[J]. Food Funct,2020,11(11):9585−9598. doi: 10.1039/D0FO02379E
[52] SUZUKI E, OTAKE S, HAMADATE N, et al. Kurozu melanoidin, a novel oligoglucan-melanoidin complex from Japanese black vinegar, suppresses adipogenesisin vitro[J]. Journal of Functional Foods,2020:72.
[53] WU Y, ZONG M, WU H, et al. Dietary advanced glycation end-products affects the progression of early diabetes by intervening in carbohydrate and lipid metabolism[J]. Mol Nutr Food Res,2022:e2200046.
[54] WU J, ZHOU X, DOU Z, et al. Different molecular weight black garlic melanoidins alleviate high fat diet induced circadian intestinal microbes dysbiosis[J]. J Agric Food Chem,2021,69(10):3069−3081. doi: 10.1021/acs.jafc.0c07723
[55] PEREZ-BURILLO S, RAJAKARUNA S, PASTORIZA S, et al. Bioactivity of food melanoidins is mediated by gut microbiota[J]. Food Chem,2020,316:126309. doi: 10.1016/j.foodchem.2020.126309
[56] WANG D, FENG Y, LIU J, et al. Black garlic (Allium sativum) extracts enhance the immune system[J]. Medicinal and Aromatic Plant Science and Biotechnology,2010,4(1):37−40.
-
期刊类型引用(4)
1. 肖婷,王静,黄学均,贺强,付彩霞,徐宁. 酱油中美拉德反应产物的研究进展. 中国调味品. 2024(03): 187-192 .  百度学术
百度学术
2. 宋娟,康三江,张海燕,曾朝珍,袁晶,慕钰文,苟丽娜. 响应面法优化黑苹果发酵工艺及其抗氧化活性评价. 中国酿造. 2024(11): 159-166 .  百度学术
百度学术
3. 彭佩瑾,闫媛,安广涛,吴驿瑶,赵玉,杨亚光,皮佳鑫,祁东利. 中药美拉德反应研究进展. 辽宁中医药大学学报. 2024(11): 121-129 .  百度学术
百度学术
4. 王燕华,王冬钰,何泽娟,施汤伟,龚加顺,谭超. 咖啡类黑精提取工艺优化及结构表征. 食品工业科技. 2023(19): 225-234 .  本站查看
本站查看
其他类型引用(1)






 下载:
下载:
 下载:
下载:



