Optimization of Response Surface for Ultrasonic Acid Extraction of Pectin from Passion Fruit Peel and Its Antioxidant Activity
-
摘要: 为了进一步实现百香果果皮(PFP)的废物利用,减少资源浪费和环境污染,本文以PFP为试材,采用超声波辅助酸法提取PFP果胶,并研究其抗氧化活性。通过考察pH、料液比、超声时间、超声功率和超声温度对PFP果胶提取得率的影响,在单因素实验基础上进行响应面优化得到最佳提取工艺,并以酸法为对照,研究超声波辅助酸法对PFP果胶清除DPPH自由基(DPPH·)、羟自由基(·OH)以及超氧阴离子自由基(
O−2 ·)能力的影响。结果表明:超声波辅助酸法提取PFP果胶最佳工艺参数为pH2.0、超声时间70 min、超声功率210 W、超声温度45 ℃,果胶提取得率为14.78%±0.21%,并且超声波辅助酸提取的PFP果胶对DPPH·、·OH及O−2 ·清除率为60.96%±1.03%、80.16%±1.78%、59.13%±2.10%,均高于酸法提取果胶。Abstract: In order to further realize the waste utilization of PFP and reduce the waste of resources and environmental pollution, PFP pectin was extracted by ultrasonic assisted acid method and its antioxidant activity was studied. By investigating the effects of pH, solid-liquid ratio, ultrasonic time, ultrasonic power and ultrasonic temperature on the extraction ratio of PFP pectin, response surface optimization was carried out on the basis of single factor test to get the best extraction process, and acid method was used as the control. The effects of ultrasonic-assisted acid method on scavenging DPPH free radical (DPPH·), hydroxyl free radical (·OH) and superoxide anion free radical (O−2 ·) of PFP pectin were studied. The results showed that: The optimal extraction parameters of PFP pectin by ultrasonic assisted acid method were pH2.0, ultrasonic time 70 min, ultrasonic power 210 W, ultrasonic temperature 45 ℃, and the yield of pectin was 14.78%±0.21%. The scavenging rates of DPPH·, ·OH andO−2 · were 60.96%±1.03%, 80.16%±1.78% and 59.13%±2.10%, which were higher than those of acid method. -
百香果(Passiflara edulia Sims.)又名巴西果、鸡蛋果,为西番莲科(Passiloraceae)、西番莲属(Passiflora)多年生常绿攀缘性藤本植物[1-2]。2018年底全国百香果总产量达到590.03 kt,较上年新增67.47%,福建省总产量达200.00 kt,较上年增长150.00%[3]。百香果汁因营养丰富[4-5]常被加工成复合果汁[6]、果醋[7]、果酒[8]等加工产品;百香果皮(PFP)占鲜果重50%~55%[9],在百香果加工中常作为废弃物丢弃[10],而PFP中富含果胶、多酚、膳食纤维等多种活性物质[11-12],因此对PFP进行有效利用可提高百香果全果利用价值。
果胶主要存在于高等植物细胞壁中,提取方法主要有酸法、酶法、微波辅助法、超声波辅助法、螯合剂法等[9, 13-14],提取方法不同果胶得率、性质差异较大,如酸法提取果胶质量好、生产成本低,但果胶得率低且会变性[9];酶法提取果胶操作简单、果胶性质稳定,但对酶纯度要求较高;微波辅助法可加速果胶溶出,但成本高且温度不易控制[15],超声-微波协同法提取时间短、提取率较高,但对设备条件要求较高,还需进一步研究。超声波的“空化作用”可使细胞破碎或崩解[16-17],促使植物细胞有效成分溶出[18],利用超声波辅助酸法提取果胶可有效中和酸法缺点,大大缩短提取时间[19],但不同物料对超声提取条件要求不同。目前,提取PFP果胶的方法有超声波辅助纯水法(12.67%[20])、超声-微波协同辅助提取法(12.14%[21])、超声波辅助酶法(3.22%[22])等,也有使用超声波辅助柠檬酸法提取PFP果胶(13.07%[23]),但多使用热干燥法干燥物料。果品热处理已被证明会降解和脱甲氧基化果胶分子,果胶降解程度随温度增加而增加[24],而非热处理则可以保留更多原果胶。
研究表明,多种植物果胶均具有抗氧化活性[25],如柑橘皮[26]、柠檬皮[27]、胡萝卜[28]等,在功能性食品及药品中的应用具有较大利用价值。因此,本文针对当地代表品种,以‘福建百香果2号’为试验对象,使用冷冻干燥法干燥PFP,以酸法为对照,采用超声辅助柠檬酸法提取PFP果胶,在单因素基础上利用响应面优化得到PFP果胶的最佳提取工艺,并在提取果胶的基础上进一步研究两种方法提取的果胶对DPPH自由基(DPPH·)、羟自由基(·OH)以及超氧阴离子自由基(
$ {\text{O}}_{2}^{-} $ ·)清除能力的差异,为解决当地品种百香果皮的资源浪费状况,为其进一步开发及综合利用提供理论依据。1. 材料与方法
1.1 材料与仪器
‘福建百香果2号’果皮 福建省漳州市华安县联众果蔬专业合作社提供,将去除海绵层的百香果外果皮洗净晾干,冷冻干燥48 h后用高速多功能粉碎机粉碎,过80目筛后保存于−40 ℃冰箱;柠檬酸、咔唑、半乳糖醛酸、水杨酸、硫酸亚铁(FeSO4)、邻苯三酚(C6H6O3) 国药集团化学试剂有限公司;羟甲基氨基甲烷(Tris)、1,1-二苯基-2-三硝基苯肼(DPPH) 生工生物工程上海股份有限公司;所有试剂均为分析纯。
LGJ-25C型真空冷冻干燥机 北京四环科学仪器厂;KQ-300DE数控超声波清洗器 昆山市超声仪器有限公司;Allegra 64R台式高速冷冻离心机 美国 BECKMAN公司;Infinite M200 Pro多功能酶标仪 瑞士Tecan集团公司。
1.2 实验方法
1.2.1 酸法提取百香果皮果胶
参考刘运花[9]的方法,并略有改动。称取5.00 g PFP粉末于150 mL柠檬酸提取液(pH2.0)中搅拌均匀,在水浴温度80 ℃条件下提取4 h,用2层200目尼龙布作为滤布抽滤2次得果胶原液,果胶原液浓缩至原体积1/3后加入1.5倍95%乙醇醇沉12 h,抽滤得粗果胶滤饼,95%乙醇洗涤2次,所得滤饼冷冻干燥48 h后即得PFP果胶。
1.2.2 超声波辅助酸法提取百香果皮果胶
参考辛明等[23]的方法,并略有改动。超声提取条件为超声温度50 ℃、超声功率180 W条件下超声70 min,其他步骤参照1.2.1。
1.2.3 果胶提取得率测定
参照黎英等[21]方法略有改动。吸取0.0、10.0、20.0、30.0、40.0、50.0、60.0、70.0、80.0、90.0 mg/L半乳糖醛酸标准溶液各1.00 mL于25 mL玻璃试管中,分别加入0.25 mL 1 g/L咔唑-乙醇溶液,产生白色絮状沉淀,不断摇动试管,快速加入5.0 mL浓硫酸,振荡摇匀,85 ℃水浴20 min,取出后放入冷水中冷却,在波长528 nm处测定吸光度,绘制标准曲线。
称取一定质量果胶粉末溶于超纯水,即为果胶样品溶液,吸取1 mL果胶样品溶液于25 mL试管中,按照标准曲线方法测定果胶样品溶液吸光度。按照公式(1)计算PFP果胶提取得率。
$$ \mathrm{果}\mathrm{胶}\mathrm{提}\mathrm{取}\mathrm{得}\mathrm{率}(\text{%})=\frac{\mathrm{C}\times \mathrm{V}\times \mathrm{N}}{\mathrm{W}\times {10}^{6}}\times 100 $$ (1) 式中:C为标准曲线计算所得半乳糖醛酸浓度,mg/L;V为果胶样品溶液总体积,mL;N为稀释倍数;W为果胶粉末质量,g。
1.2.4 单因素实验
1.2.4.1 pH对提取得率的影响
称取5.00 g PFP粉末,以pH为变量(1.5、2.0、2.5、3.0、3.5)在料液比1:30 g/mL、超声时间70 min、超声温度40 ℃、超声功率180 W条件下超声提取70 min,以PFP果胶提取得率为指标确定最佳pH。
1.2.4.2 料液对提取得率的影响
称取5.00 g PFP粉末,以最佳pH2.0在不同料液比(1:10、1:15、1:20、1:25、1:30 g/mL)条件下考察不同提取料液比对PFP果胶提取得率的影响,确定最佳料液比。
1.2.4.3 超声时间对提取得率的影响
称取5.00 g PFP粉末,以最佳料液比1:25 g/mL、pH2.0在不同超声时间(30、50、70、90、110 min)条件下考察不同提取超声时间对PFP果胶提取得率的影响,确定最佳超声时间。
1.2.4.4 超声功率对提取得率的影响
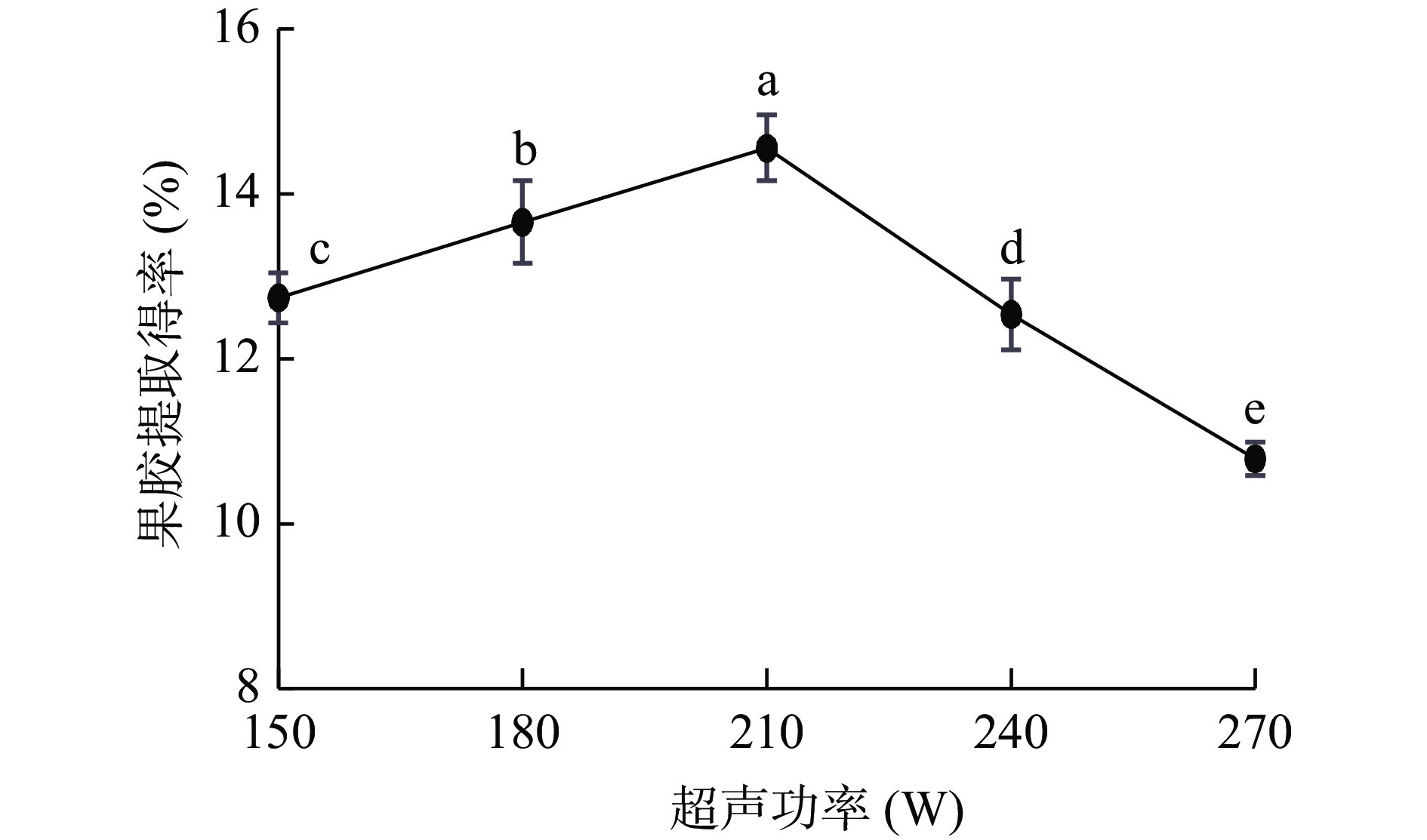
称取5.00 g PFP粉末,以最佳料液比1:25 g/mL、pH2.0、超声时间70 min在不同超功率(150、180、210、240、270 W)条件下考察不同提取超声功率对PFP果胶提取得率的影响,确定最佳超声功率。
1.2.4.5 超声温度对提取得率的影响
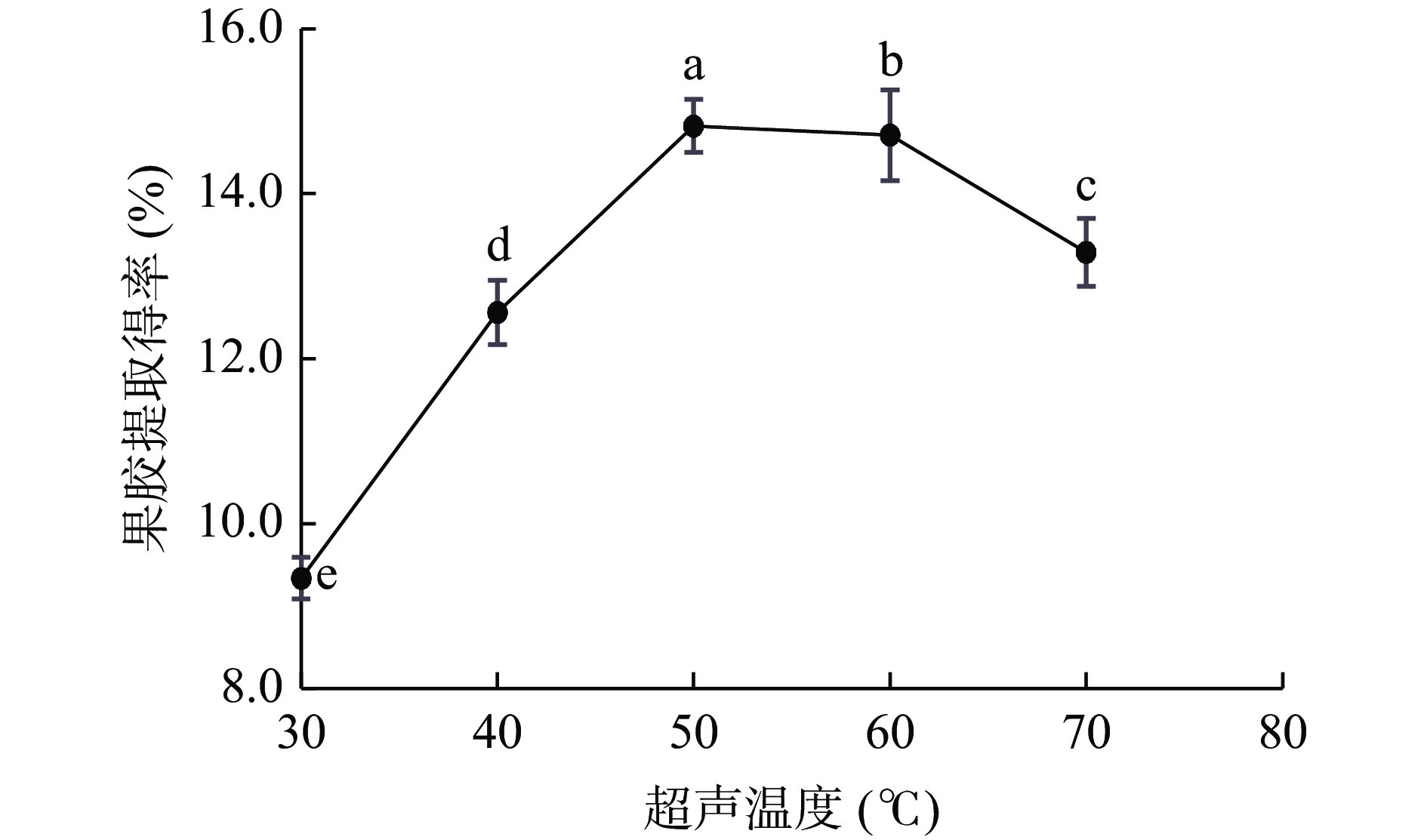
称取5.00 g PFP粉末,以最佳料液比1:25 g/mL、pH2.0、超声时间70 min、超声功率210 W在不同超声温度(30、40、50、60、70 ℃)条件下考察不同提取超声温度对PFP果胶提取得率的影响,确定最佳超声温度。
1.2.5 响应面试验设计
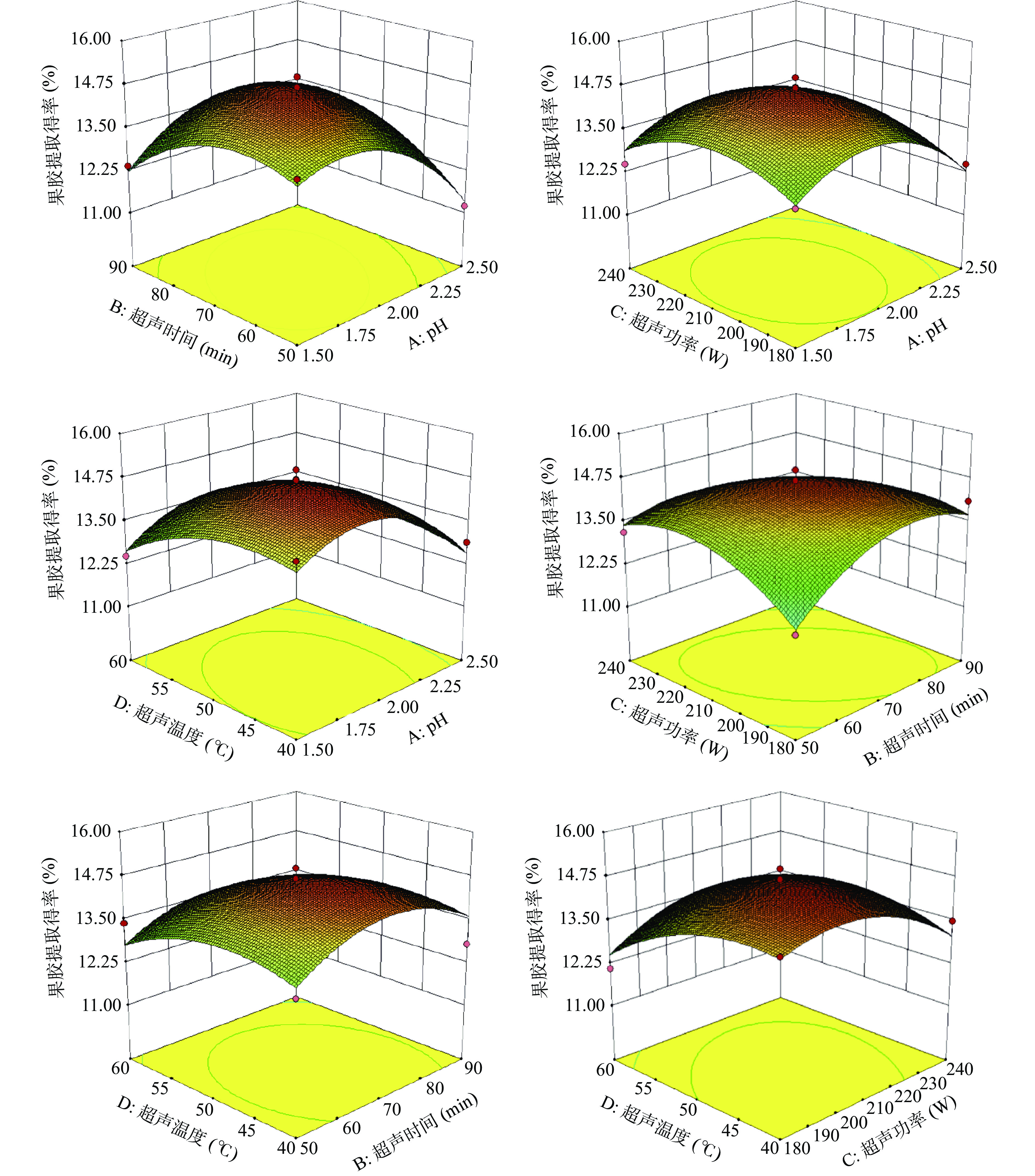
综合单因素实验结果,选择pH、超声时间、超声功率和超声温度为主要考察因素,确定如表1所示的因素和水平,采用Design-Expert 10.0软件,应用Box-Behnken原理进行4因素3水平试验(共29组),从而确定提取最优条件并进行验证试验。
表 1 响应面因素水平表Table 1. Factor and level table of response surface水平 因素 A. pH B. 超声时间(min) C. 超声功率(W) D. 超声温度(℃) −1 1.5 50 180 40 0 2.0 70 210 50 1 2.5 90 240 60 1.2.6 PFP果胶抗氧化活性的测定
1.2.6.1 DPPH·清除能力测定
参照马丽苹等[29]方法略有修改。配制0.5、1.0、1.5、2.0、2.5、3.0 mg/mLPFP果胶溶液,各取2 mL至10 mL试管,分别加入2 mL 0.2 mmol/L DPPH-甲醇溶液混合均匀,室温避光反应30 min后,在517 nm波长处测定吸光度。本底组用2 mL 95%甲醇溶液代替2 mL DPPH-甲醇溶液,空白组用2 mL超纯水代替果胶溶液;以抗坏血酸(VC)为阳性对照。按公式(2)计算PFP果胶对DPPH·清除率。
$$ \mathrm{D}\mathrm{P}\mathrm{P}\mathrm{H}\cdot\mathrm{清}\mathrm{除}\mathrm{率}\left(\text{%}\right)=\left(1-\frac{{\mathrm{A}}_{1}-{\mathrm{A}}_{2}}{{\mathrm{A}}_{0}}\right)\times 100 $$ (2) 式中:A1为测定组吸光度;A2为本底组吸光度;A0为空白组吸光度。
1.2.6.2 对·OH清除能力测定
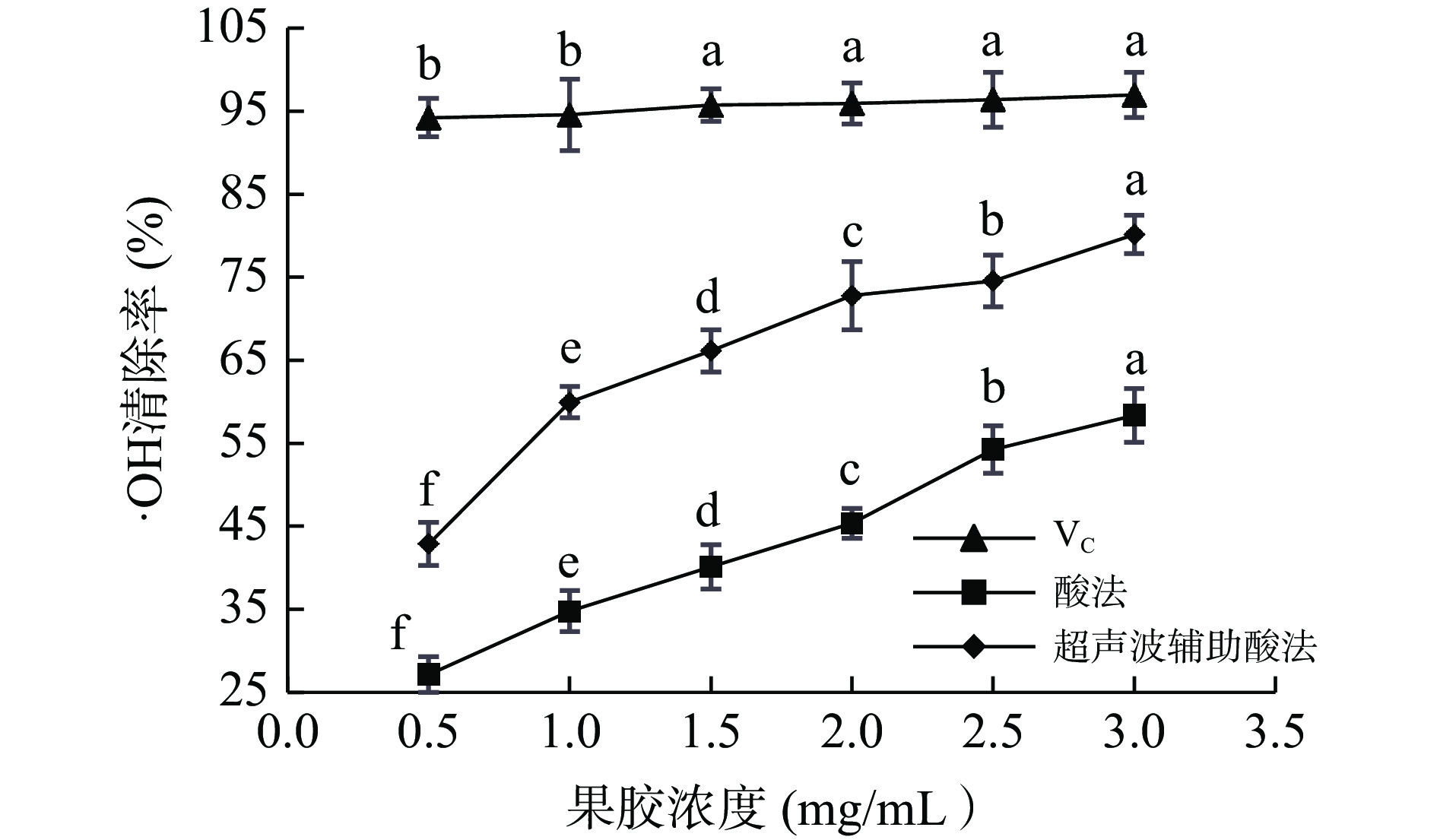
参照宋佳敏等[30]方法略有修改。配制0.5、1.0、1.5、2.0、2.5、3.0 mg/mL PFP果胶溶液,各取1 mL至10 mL试管,分别加入1.00 mL 1.8 mmol/L FeSO4 、1.0 mL 1.8 mmol/L水杨酸-乙醇溶液、1.0 mL 8.8 mmol/L H2O2,振荡试管使溶液混合均匀,37 ℃水浴30 min,在510 nm处测定吸光度;空白组用超纯水代替样品溶液;以VC为阳性对照。按公式(3)计算PFP果胶对·OH清除率。
$$\cdot\mathrm{O}\mathrm{H}\mathrm{清}\mathrm{除}\mathrm{率}(\text{%})=\frac{{\mathrm{A}}_{\mathrm{空}\mathrm{白}}-{\mathrm{A}}_{\mathrm{样}\mathrm{品}}}{{\mathrm{A}}_{\mathrm{空}\mathrm{白}}}\times 100 $$ (3) 式中:A样品为测定组吸光度;A空白为空白组吸光度。
1.2.6.3 对
$ {\text{O}}_{\text{2}}^{{-}} $ ·清除能力测定参照陈丽叶等[31]方法略有修改。配制0.5、1.0、1.5、2.0、2.5、3.0 mg/mLPFP果胶溶液,吸取1.50 mL 50 mmol/L pH8.2 Tris-HCl缓冲液与0.50 mL不同浓度果胶溶液混合,30 ℃水浴20 min取出,冷却至室温后加入1.50 mL 25 mmol/mL C6H6O3溶液,室温放置3 min后加入1 mL 8 mol/L HCl溶液结束反应,在320 nm处测定吸光度;空白组用超纯水代替样品溶液;以VC为阳性对照。按公式(4)计算PFP果胶对
$ {\text{O}}_{\text{2}}^{{-}} $ ·清除率。$$ {\mathrm{O}}_{2}^-\cdot\mathrm{清}\mathrm{除}\mathrm{率}\left(\text{%}\right)=\frac{{\mathrm{A}}_{\mathrm{j}}-{\mathrm{A}}_{\mathrm{i}}}{{\mathrm{A}}_{\mathrm{j}}}\times 100 $$ (4) 式中:Ai为测定组吸光度;Aj为空白组吸光度。
1.3 数据处理
所有实验均重复三次以上,以Excel 2019整理数据,以SPSS 26.0进行显著性分析及回归分析,以单因素方差分析(One-way ANOVA)法对所得数据进行差异显著性分析,以Design Expert 10.0进行响应面试验设计。用Origin 2019作图。
2. 结果与分析
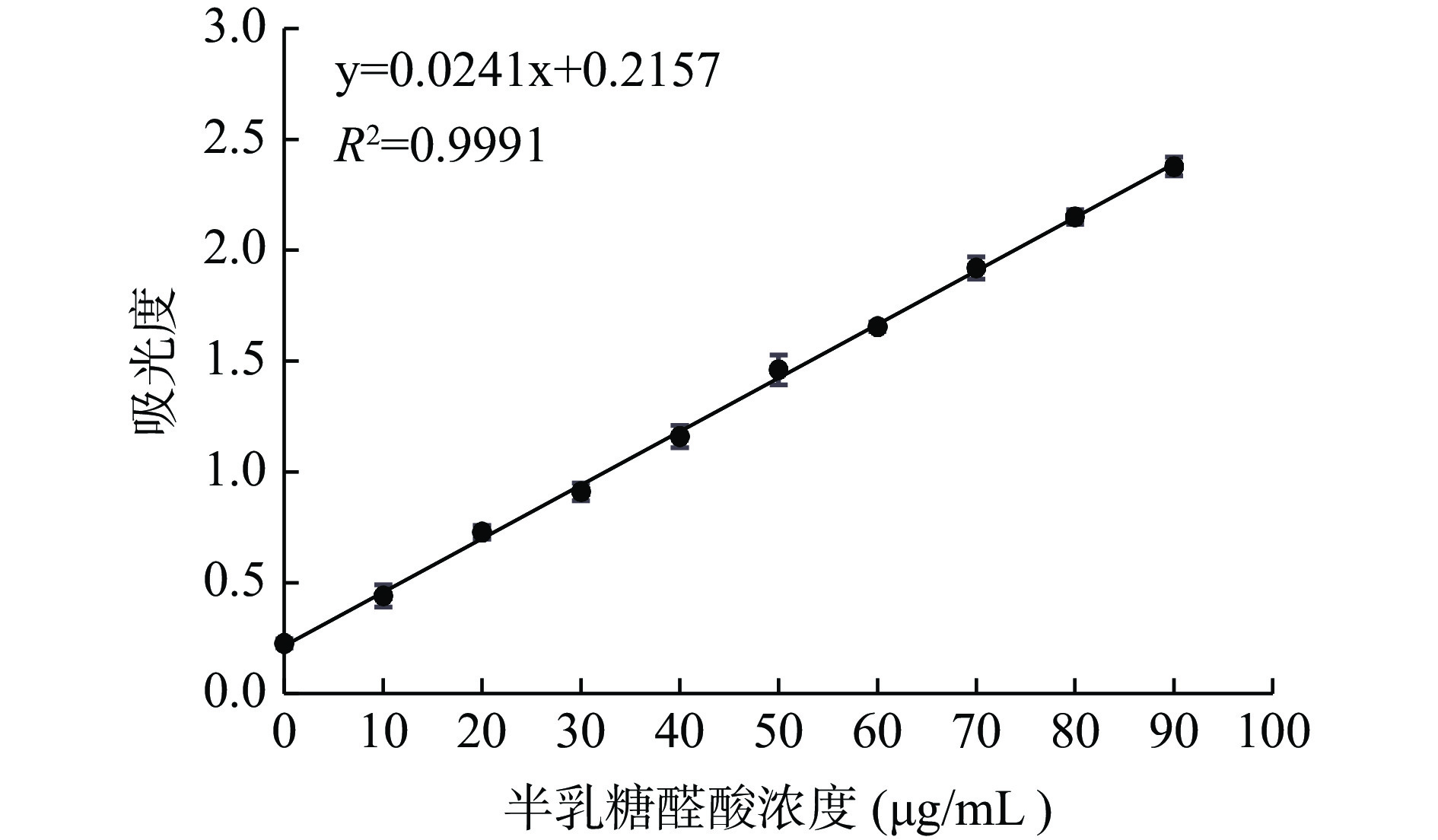
2.1 半乳糖醛酸标准曲线
如图1所示,在波长528 nm下测定吸光度,以半乳糖醛酸溶液质量浓度为横坐标,吸光度为纵坐标,得出标准曲线及其回归方程: y=0.0241x+0.2157,R²=0.9991,在0~90 μg/mL范围内线性关系良好。
2.2 单因素实验结果
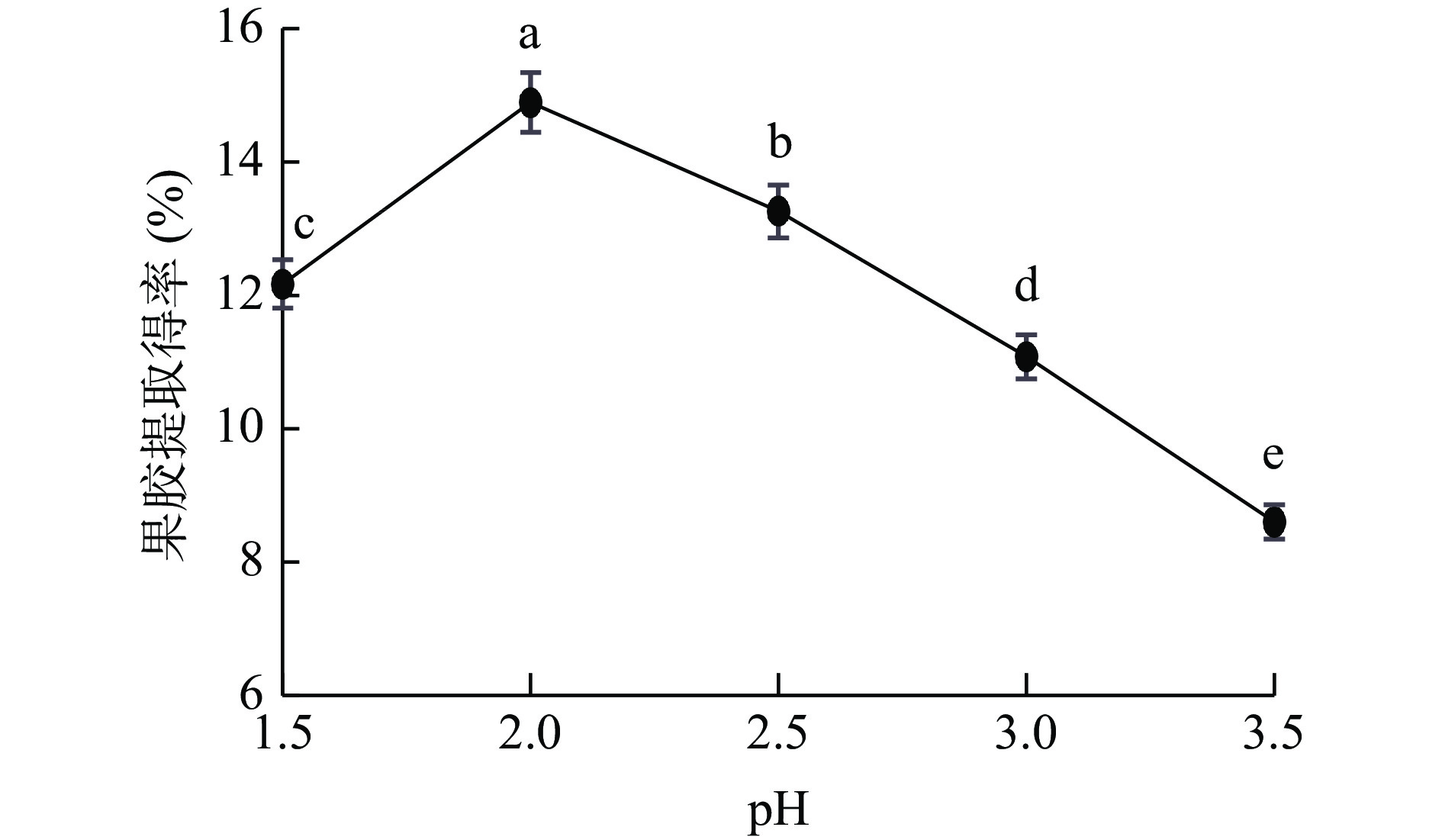
2.2.1 pH对PFP果胶提取得率的影响
如图2,PFP果胶提取得率随pH升高呈先上升后下降趋势。当pH为2.0时,果胶提取得率达最大值14.44%。当pH<2.0时,果胶提取得率随着酸性的增高而降低,这是因为样品在较强酸性溶剂的浸泡中,原果胶逐渐转化成可溶性果胶,然而较强的酸性环境又会促使果胶脱脂分解[32];当pH>2.0时,果胶提取得率随酸性降低而下降,这是因为溶剂酸性较低时,样品中原果胶转化成可溶性果胶能力也随之降低,提取效率下降[33]。
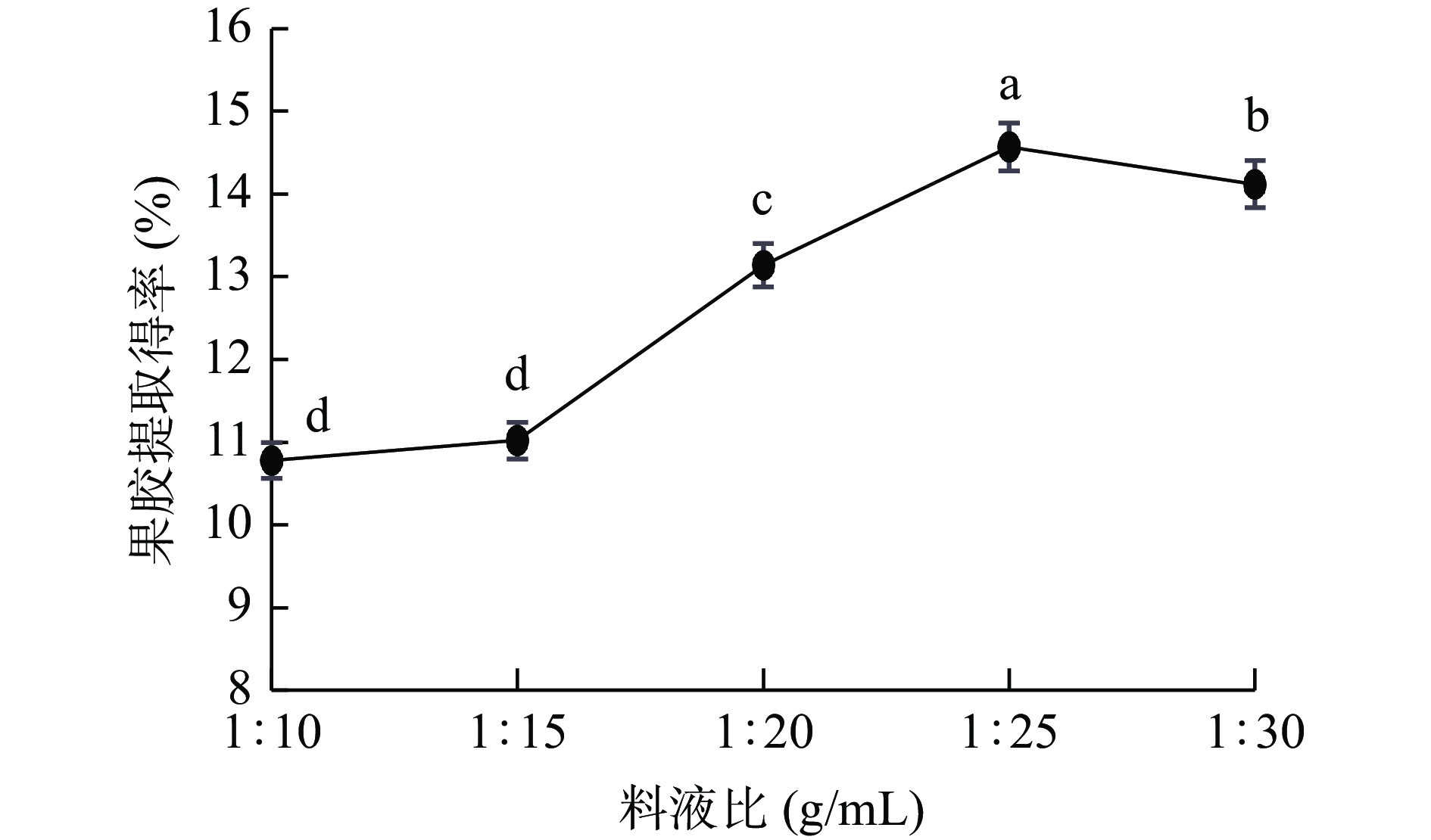
2.2.2 料液比对PFP果胶提取得率的影响
如图3,PFP果胶提取得率随料液比加大呈先上升后下降趋势,当料液比为1:25 g/mL时,提取得率达最大值14.57%,可能酸性溶液用量逐渐加大时,溶质与溶剂浓度差也随之增大,作为溶质的原果胶则更加迅速扩散溶出,果胶提取得率增高[34];当料液比>1:25 g/mL时,果胶提取得率呈下降趋势,下降了3.09%,这可能是因为果胶扩散距离拉长,扩散能力降低,且随溶剂增加,溶剂对超声波的能量消耗也随之增加,导致作为溶质的原果胶吸收能量减少,果胶提取得率下降[33-34]。
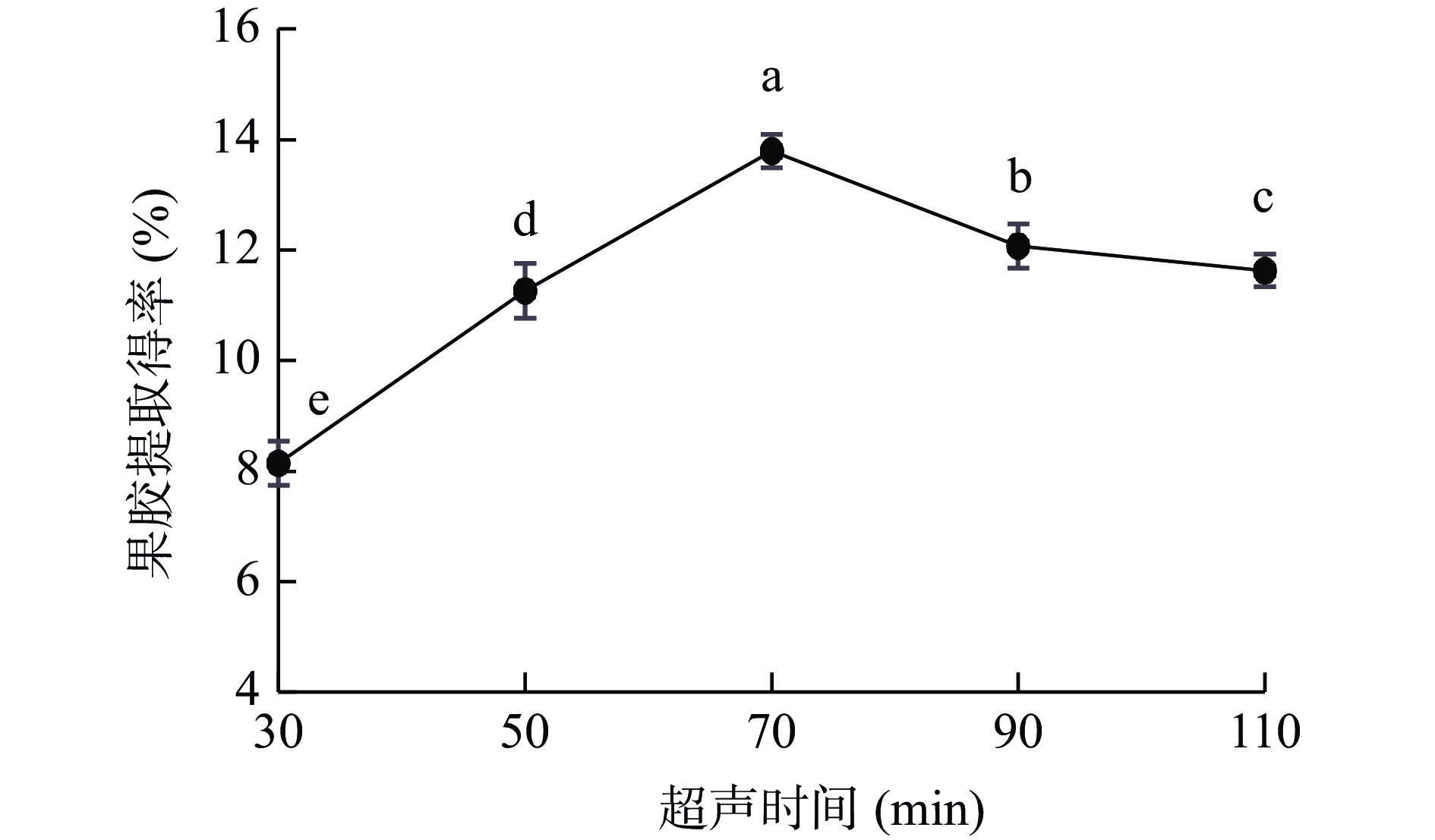
2.2.3 超声时间对PFP果胶提取得率的影响
如图4,PFP果胶提取得率随超声时间延长呈先上升后下降趋势,当超声时间70 min时,果胶提取得率达最大值13.79%。当超声时间<70 min时,随时间增加,果胶逐渐从物料组织中溶出并扩散,转变成水溶性果胶,提取得率增加[35];而超声时间过长(>70 min)会使果胶部分结构被破坏,发生降解、脱脂等,且杂质溶出率增加,导致果胶提取得率下降[36]。
2.2.4 超声功率对PFP果胶提取得率的影响
如图5,PFP果胶提取得率随超声功率增强呈先上升后下降趋势,当超声功率为210 W时,提取得率达最大值14.56%。当超声功率<210 W时,超声波“空化作用”加速了超声波对物料组织的破坏,促使果胶大分子逐渐溶出,提取得率增加[17];当超声功率>210 W时,果胶降解率随着大功率超声波作用增大而增大,溶质留在超声场中作用时间缩短,无法充分破壁,且其他杂质也会溶出,导致果胶提取得率下降[37]。
2.2.5 超声温度对PFP果胶提取得率的影响
如图6,PFP果胶提取得率随超声温度升高呈先上升后下降趋势,当超声温度为50 ℃时,提取得率达最大值14.82%。当超声温度<50 ℃时,随着温度升高会产生更高的传质速率和溶剂扩散速率,从而提高提取得率[38];当超声温度>50 ℃时,温度过高会对果胶分子结构及稳定性产生影响,使部分果胶发生降解[39],导致果胶提取得率降低。
2.3 响应面试验分析
2.3.1 响应面试验结果
运用Design Expert 10.0软件对响应值和各个因素进行二次多元回归拟合,所得二次多元回归方程为:Y=14.63−0.42A+0.03B−0.12C−0.39D+0.73AB+0.03AC+0.2AD−0.65BC−0.08BD+0.43CD−1.2A2−0.91B2−0.8C2−0.61D2,响应面分析试验设计结果如表2所示。
表 2 Box-Benhnken试验设计及结果Table 2. Design and results of Box-Benhnken test试验组 A
pHB 超声时
间(min)C 超声功
率(W)D 超声温
度(℃)果胶提取
得率(%)1 1.5 50 210 50 13.8±0.27 2 2.5 50 210 50 11.2±0.35 3 1.5 90 210 50 12.4±0.31 4 2.5 90 210 50 12.7±0.29 5 2.0 70 180 40 14.2±0.45 6 2.0 70 240 40 13.5±0.21 7 2.0 70 180 60 12.1±0.39 8 2.0 70 240 60 13.1±0.33 9 1.5 70 210 40 14.1±0.41 10 2.5 70 210 40 12.9±0.26 11 1.5 70 210 60 12.5±0.34 12 2.5 70 210 60 12.1±0.27 13 2.0 50 180 50 12.2±0.28 14 2.0 90 180 50 14.1±0.35 15 2.0 50 240 50 13.2±0.42 16 2.0 90 240 50 12.5±0.25 17 1.5 70 180 50 13.1±0.33 18 2.5 70 180 50 12.5±0.27 19 1.5 70 240 50 12.5±0.31 20 2.5 70 240 50 12.0±0.29 21 2.0 50 210 40 13.1±0.22 22 2.0 90 210 40 12.8±0.45 23 2.0 50 210 60 13.4±0.26 24 2.0 90 210 60 12.78±0.21 25 2.0 70 210 50 14.54±0.24 26 2.0 70 210 50 14.21±0.26 27 2.0 70 210 50 14.99±0.29 28 2.0 70 210 50 14.71±0.21 29 2.0 70 210 50 14.68±0.27 2.3.2 回归模型的方差分析
通过F统计量、响应面二次多项式模型的方差分析(ANOVA)检验了回归模型的显著性,见表3。失拟项通常用来描述回归模型的合适程度,考察没有在回归范围内被包含的数据点。本研究模型失拟项F值为2.93,P值为0.1558(P>0.05),表明失拟项不显著,该模型拟合度较好。A、D、AB、A2、B2、C2、D2对PFP果胶提取量影响极显著(P<0.01),一次项B、C项与交互项AC、AD、BD、CD均不显著(P>0.05)。由各因素P值可以得知各因素对PFP果胶提取得率影响顺序为A>D>C>B,即pH>超声温度>超声功率>超声时间。
表 3 回归模型方差分析表Table 3. Analysis of variance of regression model数据来源 自由度 平方和 均方 F值 P值 显著性 模型 14 23.05 1.65 8.57 0.0001 ** A 1 2.08 2.08 10.85 0.0053 ** B 1 0.012 0.012 0.063 0.806 C 1 0.16 0.16 0.85 0.372 D 1 1.78 1.78 9.26 0.0088 ** AB 1 2.1 2.1 10.95 0.0052 ** AC 1 2.50E-03 2.50E-03 0.013 0.9108 AD 1 0.16 0.16 0.83 0.3768 BC 1 1.69 1.69 8.8 0.0102 * BD 1 0.026 0.026 0.13 0.7205 CD 1 0.72 0.72 3.76 0.0729 A2 1 9.4 9.4 48.95 <0.0001 ** B2 1 5.33 5.33 27.74 0.0001 ** C2 1 4.19 4.19 21.82 0.0004 ** D2 1 2.38 2.38 12.42 0.0034 ** 残差 14 2.69 0.19 失拟 10 2.37 0.24 2.93 0.1558 净误差 4 0.32 0.081 总离差 28 25.74 注:**P<0.01为极显著;*P<0.05为显著。 2.3.3 响应面分析
各因素及其交互作用对果胶提取得率的影响可从响应面的变化得到直观反映,本试验所构建模型响应面图如图7所示。PFP果胶的提取得率随着各因素水平变化而变化,A与B曲线坡度最为陡峭,说明pH与超声时间的交互作用最为显著,其次是B与C,说明超声功率与超声时间的交互作用比其它两因素较为显著,结果与方差分析一致。
2.3.4 最佳工艺验证
通过对PFP果胶提取得率二次多项式解析,得提取PFP果胶最佳工艺条件为:pH1.90,超声时间70.54 min,超声功率204.09 W,超声温度45.78 ℃,此时PFP果胶理论提取得率为14.76%。考虑到实际操作可行性,将工艺调整为:pH2.0,超声时间70 min,超声功率210 W,超声温度45 ℃,按此工艺条件进行5组平行验证试验,得PFP果胶提取得率为14.78%±0.21%。
2.4 PFP果胶的抗氧化活性
2.4.1 对DPPH·的清除率
DPPH是一种亲脂自由基,溶于醇时会呈紫色,在517 nm处存在特殊的吸收峰[40]。当果胶样品存在抗氧化活性时,DPPH·会失去孤对电子,失去孤对电子数量越多,样品溶液褪色越明显,表明样品抗氧化能力越强,所以此现象常被用来评价抗氧化剂的抗氧化性[41]。本研究以VC为阳性对照,研究PFP中果胶对DPPH·清除能力。如图8,PFP果胶对DPPH·的清除作用在一定质量浓度范围内呈一定剂量依赖效应。在0.5~3.0 mg/mL范围内,VC对DPPH·的清除率保持在91%以上,酸法和超声波辅助酸法提取的PFP果胶对DPPH·清除率的变化均呈缓慢上升趋势,当果胶浓度为3.0 mg/mL时,对DPPH·清除率分别为46.37%±1.45%和60.96%±1.03%。结果表明PFP果胶对DPPH·具有良好的清除能力,且超声波辅助提取后清除能力得到明显增强。
2.4.2 对·OH的清除率
·OH是一种常见自由基,它从细胞膜、DNA等方面损害生物体[42]。如图9,在质量浓度0.5~3.0 mg/mL范围内,VC对·OH清除率稳定保持在90%以上;酸法和超声波辅助酸法提取的PFP果胶对·OH清除能力均随果胶质量浓度增加而逐渐增强,当果胶质量浓度为3.0 mg/mL时,对·OH清除率分别为58.37%±1.09%和80.16%±1.78%,且在此质量浓度范围,PFP果胶对·OH清除效果差异均显著(P<0.05)。超声波辅助酸法提取的果胶清除·OH能力作用明显高于酸法,这与Torkamani等[19]的研究结果一致。
2.4.3 对
$ {\text{O}}_{\text{2}}^{{-}} $ ·的清除率$ {\text{O}}_{\text{2}}^{{-}} $ ·是生物体代谢过程中产生的一种自由基,它是物质自由基产生连锁反应的初始物质,与羟基结合后会产生破坏细胞DNA的产物,损害人体机能[43]。如图10,在质量浓度0.5~3.0 mg/mL范围内,VC对$ {\text{O}}_{\text{2}}^{{-}} $ ·清除率稳定保持在90%以上,酸法提取的果胶对$ {\text{O}}_{\text{2}}^{{-}} $ ·清除率则随浓度的增加整体平缓上升;超声波辅助酸法提取的果胶对$ {\text{O}}_{\text{2}}^{{-}} $ ·清除率在浓度为0.5~1.5 mg/mL时呈较陡趋势,而在1.5~3.0 mg/mL时则呈平缓上升趋势;当果胶浓度3.0 mg/mL时,酸法和超声波辅助酸法提取的果胶对$ {\text{O}}_{\text{2}}^{{-}} $ ·清除率分别为45.25%±1.22%和59.13%±2.10%。由此可见,PFP果胶对$ {\text{O}}_{\text{2}}^{{-}} $ ·具有较好的清除能力。3. 结论
本研究以‘福建百香果2号’果皮为试验原料,依据单因素实验结果进行响应面优化,得出最优提取工艺参数为pH2.0,超声时间70 min,超声功率210 W,超声温度45 ℃,按此工艺条件进行5组平行验证试验,得PFP果胶平均提取得率为14.78%±0.21%,与响应面预测值仅差0.02%,说明模型能较好预测果胶提取得率。研究发现PFP果胶具有较好的抗氧化活性,且经过超声波处理后PFP果胶的抗氧化活性明显提高,尤其是对清除·OH能力明显增强。结果表明,利用超声波辅助酸法能够提高果胶得率,并且增强了提取果胶的抗氧化活性,为百香果皮果胶的进一步开发利用提供了理论依据。但超声波增强果胶抗氧化活性的途径暂不明确,可能是超声波通过影响果胶结构、性质等途径,也可能与PFP果胶的结构、性质等有关,之后可进行深入研究。
-
表 1 响应面因素水平表
Table 1 Factor and level table of response surface
水平 因素 A. pH B. 超声时间(min) C. 超声功率(W) D. 超声温度(℃) −1 1.5 50 180 40 0 2.0 70 210 50 1 2.5 90 240 60 表 2 Box-Benhnken试验设计及结果
Table 2 Design and results of Box-Benhnken test
试验组 A
pHB 超声时
间(min)C 超声功
率(W)D 超声温
度(℃)果胶提取
得率(%)1 1.5 50 210 50 13.8±0.27 2 2.5 50 210 50 11.2±0.35 3 1.5 90 210 50 12.4±0.31 4 2.5 90 210 50 12.7±0.29 5 2.0 70 180 40 14.2±0.45 6 2.0 70 240 40 13.5±0.21 7 2.0 70 180 60 12.1±0.39 8 2.0 70 240 60 13.1±0.33 9 1.5 70 210 40 14.1±0.41 10 2.5 70 210 40 12.9±0.26 11 1.5 70 210 60 12.5±0.34 12 2.5 70 210 60 12.1±0.27 13 2.0 50 180 50 12.2±0.28 14 2.0 90 180 50 14.1±0.35 15 2.0 50 240 50 13.2±0.42 16 2.0 90 240 50 12.5±0.25 17 1.5 70 180 50 13.1±0.33 18 2.5 70 180 50 12.5±0.27 19 1.5 70 240 50 12.5±0.31 20 2.5 70 240 50 12.0±0.29 21 2.0 50 210 40 13.1±0.22 22 2.0 90 210 40 12.8±0.45 23 2.0 50 210 60 13.4±0.26 24 2.0 90 210 60 12.78±0.21 25 2.0 70 210 50 14.54±0.24 26 2.0 70 210 50 14.21±0.26 27 2.0 70 210 50 14.99±0.29 28 2.0 70 210 50 14.71±0.21 29 2.0 70 210 50 14.68±0.27 表 3 回归模型方差分析表
Table 3 Analysis of variance of regression model
数据来源 自由度 平方和 均方 F值 P值 显著性 模型 14 23.05 1.65 8.57 0.0001 ** A 1 2.08 2.08 10.85 0.0053 ** B 1 0.012 0.012 0.063 0.806 C 1 0.16 0.16 0.85 0.372 D 1 1.78 1.78 9.26 0.0088 ** AB 1 2.1 2.1 10.95 0.0052 ** AC 1 2.50E-03 2.50E-03 0.013 0.9108 AD 1 0.16 0.16 0.83 0.3768 BC 1 1.69 1.69 8.8 0.0102 * BD 1 0.026 0.026 0.13 0.7205 CD 1 0.72 0.72 3.76 0.0729 A2 1 9.4 9.4 48.95 <0.0001 ** B2 1 5.33 5.33 27.74 0.0001 ** C2 1 4.19 4.19 21.82 0.0004 ** D2 1 2.38 2.38 12.42 0.0034 ** 残差 14 2.69 0.19 失拟 10 2.37 0.24 2.93 0.1558 净误差 4 0.32 0.081 总离差 28 25.74 注:**P<0.01为极显著;*P<0.05为显著。 -
[1] 刘纯友, 殷朝敏, 黄永春, 等. 百香果皮多糖的分离纯化、结构特性及生物活性研究进展[J]. 食品工业科技,2018,39(8):335−340, 351. [LIU C Y, YIN C M, HUANG Y C, et al. Progress in extraction, separation and purification, structural characteristics and bioactivities of polysaccharides of passiflora edulis peel[J]. Science and Technology of Food Industry,2018,39(8):335−340, 351. LIU Chunyou, YIN Chaomin, HUANG Yongchun, et al. Progress in extraction, separation and purification, structural characteristics and bioactivities of polysaccharides of passiflora edulis peel [J]. Science and Technology of Food Industry, 2018, 39(8): 335-340, 351.
[2] DA SILNA J K, CAZARIN C B B, BATISTA Â G, et al. Effects of passion fruit (Passiflora edulis) byproduct intake in antioxidant status of Wistar rats tissues[J]. LWT-Food Science and Technology,2014,59(2):1213−1219. doi: 10.1016/j.lwt.2014.06.060
[3] 唐语琪, 杨其军, 冼淑颜, 等. 百香果产业支撑乡村振兴的现状与对策建议[J]. 中国农业文摘-农业工程,2021,33(3):31−32, 60. [TANG Y Q, YNG Q J, XIAN S Y, et al. Current situation and countermeasures of passion fruit industry supporting rural revitalization[J]. Chinese Agricultural Abstracts-Agricultural Engineering,2021,33(3):31−32, 60. doi: 10.3969/j.issn.1002-5103.2021.03.012 TANG Y Q, XIAN S Y, et al. Current situation and countermeasures of passion fruit industry supporting rural revitalization [J]. Chinese Agricultural Abstracts - Agricultural Engineering, 2021, 33(3): 31-32, 60. doi: 10.3969/j.issn.1002-5103.2021.03.012
[4] 龙倩倩. 西番莲果汁加工过程中香气成分变化 [D]. 广州: 华南农业大学, 2018. LONG Q Q. Changes of aroma components in processing of passionflower juice[D]. Guangzhou: South China Agricultural University, 2018.
[5] NING X, LUO Z H, CHEN Z L, et al. Fortification of set yogurt with passion fruit juice: Effects on fermentation kinetics, physicochemical properties, and functionality[J]. Journal of Dairy Science,2021,104(4):4084−4093. doi: 10.3168/jds.2020-19261
[6] ZHU X H, DUAN Z H, YANG Y X, et al. Development of passion fruit juice beverage[J]. IOP Conference Series: Earth and Environmental Science,2017,100(1):22−25.
[7] 康超, 杨玉霞, 冯珍, 等. 响应面法优化百香果醋发酵工艺及质量分析[J]. 中国酿造,2018,37(8):186−191. [KANG C, YANG Y X, FENG Z, et al. Optimization of fermentation technology for Passiflora edulis vinegar by response surface methodology and its quality analysis[J]. China Brewing,2018,37(8):186−191. doi: 10.11882/j.issn.0254-5071.2018.08.037 KANG C, YANG Y X, FENG Z, et al. Optimization of fermentation technology for Passiflora edulis vinegar by response surface methodology and its quality analysis [J]. China Brewing, 2018, 37(8): 186-191. doi: 10.11882/j.issn.0254-5071.2018.08.037
[8] 程宏桢, 蔡志鹏, 王静, 等. 基于GC-MS、GC-O和电子鼻技术评价百香果酒香气特征[J]. 食品科学,2021,42(6):256−264. [CHEN H Z, CAI Z P, WANG J, et al. Combined use of GC-MS, GC-O and electronic nose technology to evaluate the aroma characteristics of passion fruit wine[J]. Food Science,2021,42(6):256−264. doi: 10.7506/spkx1002-6630-20200319-286 CHEN H Z, CAI Z P, WANG J, et al. Combined Use of GC-MS, GC-O and electronic nose technology to evaluate the aroma characteristics of passion fruit wine [J]. Food Science, 2021, 42(6): 256-264. doi: 10.7506/spkx1002-6630-20200319-286
[9] 刘运花. 西番莲果皮中果胶的提取及性质研究 [D]. 广州: 华南农业大学, 2017. LIU Y H. Study on extraction and propertities of pectin from passiflora edulis rind[D]. Guangzhou: South China Agricultural University, 2017.
[10] 林增学. 百香果皮多糖的保健功能及生态旅游利用研究 [D]. 长沙: 中南林业科技大学, 2019. LIN Z X. Study on health care function and ecotourism utilization of passionfruit peel polysaccharide[D]. Changsha: Central South University of Forestry and Technology, 2019.
[11] LÓPEZ-VARGAS J H, FERNÁNDEZ-LÓPEZ J, PÉREZ-ÁLVAREZl J A, et al. Chemical, physico-chemical, technological, antibacterial and antioxidant properties of dietary fiber powder obtained from yellow passion fruit (Passiflora edulis var. flavicarpa ) co-products[J]. Food Research International,2013,51(2):756−763. doi: 10.1016/j.foodres.2013.01.055
[12] 朱文娴, 夏必帮, 廖红梅. 西番莲的功能活性成分及加工与综合利用研究进展[J]. 食品与机械,2018,34(12):181−184. [ZHU W X, XIA B B, LIAO H M. Research progress on functional active components, processing and comprehensive utilization of passion flower[J]. Food and Machinery,2018,34(12):181−184. ZHU W X, XIA B B, LIAO H M. Research progress on functional active components, processing and comprehensive utilization of passion flower [J]. Food and Machinery, 2018, 34(12): 181-184.
[13] 应姗姗. 火龙果皮中果胶提取及改性研究 [D]. 杭州: 浙江大学, 2014. YING S S. Study on the extraction and modification of pectin from huolong peel[D]. Hangzhou: Zhejiang University, 2014.
[14] 王文骏. 柑橘皮果胶超声辅助提取的作用机制研究 [D]. 杭州: 浙江大学, 2018. WANG W J. Mechanism of ultrasound-assisted extraction of citrus peel pectin[D]. Hangzhou: Zhejiang University, 2018.
[15] 王雨晴, 刘畅, 杨春莉, 等. 食品中果胶提取及功能性研究进展[J]. 中国调味品,2020,45(8):175−177. [WANG Y Q, LIU C, YANG C L, et al. Research progress in the extraction and function of pectin in food[J]. China Condiment,2020,45(8):175−177. doi: 10.3969/j.issn.1000-9973.2020.08.039 WANG Y Q, LIU C, YANG C L. et al. Research progress in the extraction and function of pectin in food [J]. China Condiment, 2020, 45(8): 175-177. doi: 10.3969/j.issn.1000-9973.2020.08.039
[16] 孙杨. 超声波辅助提取对绿茶提取液品质的影响 [D]. 合肥: 安徽农业大学, 2015. SUN Y. Effects of ultrasonic assisted extraction on the quality of green tea extract[D]. Hefei: Anhui Agricultural University, 2015.
[17] MENG Q R, CHEN Z H, CHEN F, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from Hemerocallis citrina and the antioxidant activity study[J]. Journal of Food Science,2021,86(7):3082−3096. doi: 10.1111/1750-3841.15806
[18] TOMA M, VINATORU M, PANIWNYK L, et al. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J]. Ultrasonics-Sonochemistry,2001,8(2):137−142. doi: 10.1016/S1350-4177(00)00033-X
[19] TORKAMANI A E, JULIANO P, AJLOUNI S, et al. Impact of ultrasound treatment on lipid oxidation of cheddar cheese whey[J]. Ultrasonics-Sonochemistry,2014,21(3):951−957. doi: 10.1016/j.ultsonch.2013.11.021
[20] OLIVEIRA C F D, GIORDANI D, LUTCKEMIER R, et al. Extraction of pectin from passion fruit peel assisted by ultrasound[J]. Food Science and Technology,2016,71:110−115.
[21] 黎英, 刘夏蕾, 林娅新, 等. 超声-微波协同提取百香果皮果胶的工艺研究[J]. 热带作物学报,2020,41(2):386−393. [LI Y, LIU X L, LIN Y X, et al. Study on ultrasonic-microwave assisted extraction of pectin from passion fruit peel[J]. Chinese Journal of Tropical Crops,2020,41(2):386−393. doi: 10.3969/j.issn.1000-2561.2020.02.025 LI Y, LIU X L, LIN Y X, et al. Study on ultrasonic - microwave assisted extraction of pectin from passion fruit peel [J]. Chinese Journal of Tropical Crops, 2020, 41(2): 386-393. doi: 10.3969/j.issn.1000-2561.2020.02.025
[22] 严汉彬, 韩珍, 徐艳, 等. 超声波辅助酶法提取百香果皮中果胶的工艺研究[J]. 中国食品添加剂,2021,32(6):7−10. [YIN H B, HAN Z, XU Y, et al. Study on ultrasonic assisted enzymatic extraction of pectin from passion fruit peel[J]. China Food Additives,2021,32(6):7−10. YIN H B, HAN Z, XU Y, et al. Study on ultrasonic assisted enzymatic extraction of pectin from passion fruit peel [J]. China Food Additives, 2021, 32(6): 7-10.
[23] 辛明, 李昌宝, 李杰民, 等. 超声辅助柠檬酸提取百香果皮高酯果胶及其理化性质分析[J]. 食品工业科技,2021,42(4):115−120. [XIN M, LI C B, LI J M, et al. Optimization of extraction technology of high methoxyl pectin from passion fruit peel by ultrasound assisted with citric acid extraction and its physicochemical properties[J]. Science and Technology of Food Industry,2021,42(4):115−120. XIN M, LI C B, LI J M, et al. Optimization of extraction technology of high methoxyl pectin from passion fruit peel by ultrasound assisted with citric acid extraction and its physicochemical properties [J]. Science and Technology of Food Industry, 2021, 42(4): 115-120.
[24] LIU J, BI J, MCCLEMENTS D J, et al. Impacts of thermal and non-thermal processing on structure and functionality of pectin in fruit- and vegetable- based products: A review[J]. Carbohydrate Polymers,2020,250:116890. doi: 10.1016/j.carbpol.2020.116890
[25] SI Q X, YONG J Z, KAN J. Antioxidant activity in vitro and in vivo of the polysaccharides from different varieties of Auricularia auricula[J]. Food & Function,2016,7(9):3868−3879.
[26] BARBOSA P D M, RUVIARO A R, MACEDO G A. Comparison of different Brazilian citrus by-products as source of natural antioxidants[J]. Food Science and Biotechnology,2018,27(5):1301−1309. doi: 10.1007/s10068-018-0383-4
[27] RAHMANI Z, KHODAIYAN F, KAZEMI M, et al. Optimization of microwave-assisted extraction and structural characterization of pectin from sweet lemon peel[J]. International Journal of Biological Macromolecules,2020,147:1107−1115. doi: 10.1016/j.ijbiomac.2019.10.079
[28] ENCALADA A M I, Pérez C D, FLORESl S K, et al. Antioxidant pectin enriched fractions obtained from discarded carrots (Daucus carota L.) by ultrasound-enzyme assisted extraction[J]. Food Chemistry,2019,289:453−460. doi: 10.1016/j.foodchem.2019.03.078
[29] 马丽苹, 焦昆鹏, 罗磊, 等. 改性苹果果胶性质及抗氧化活性[J]. 食品科学,2017,38(23):121−128. [MA L P, JIAO K P, LUO L, et al. Characterization and antioxidant activity of modified apple pectin[J]. Food Science,2017,38(23):121−128. doi: 10.7506/spkx1002-6630-201723020 MA L P, JIAO K P, LUO L, et al. Characterization and antioxidant activity of modified apple pectin [J]. Food Science, 2017, 38(23): 121-128. doi: 10.7506/spkx1002-6630-201723020
[30] 宋佳敏, 王鸿飞, 孙朦, 等. 响应面法优化金蝉花多糖提取工艺及抗氧化活性分析[J]. 食品科学,2018,39(4):275−281. [SONG J M, WANG H F, SUN M, et al. Optimization of extraction and antioxidant activity of polysaccharides from Cordyceps cicadae by response surface methodology[J]. Food Science,2018,39(4):275−281. doi: 10.7506/spkx1002-6630-201804041 SONG J M, WANG H F, SUN M, et al. Optimization of extraction and antioxidant activity of polysaccharides from Cordyceps cicadae by response surface methodology [J]. Food Science, 2018, 39(4): 275-281. doi: 10.7506/spkx1002-6630-201804041
[31] 陈丽叶, 常希光, 冯晓光, 等. 山药多糖的体外抗氧化活性研究[J]. 食品科学,2021,42(19):122−128. [CHEN L Y, CHANG X G, FENG X G, et al. In vitro antioxidant activity of Chinese yam polysaccharides[J]. Food Science,2021,42(19):122−128. doi: 10.7506/spkx1002-6630-20201107-073 CHEN L Y, CHANG X G, FENG X G, et al. In vitro antioxidant activity of Chinese yam polysaccharides [J]. Food Science, 2021, 42(19): 122-128. doi: 10.7506/spkx1002-6630-20201107-073
[32] 刘晓霞. 黄秋葵花果胶类多糖的提取工艺及其性质的研究 [D]. 杭州: 浙江大学, 2014. LIU X X. Study on extraction technology and properties of pectin polysaccharide from okra flower[D]. Hangzhou: Zhejiang University, 2014.
[33] LIEW S Q, CHIN N L, YUSOF Y A, et al. Comparison of acidic and enzymatic pectin extraction from passion fruit peels and its gel properties[J]. Journal of Food Process Engineering,2016,39(5):501−511. doi: 10.1111/jfpe.12243
[34] 宋思圆. 黄秋葵花多糖的超声提取及其结构和抗氧化活性研究 [D]. 杭州: 浙江大学, 2017. SONG S Y. Study on the structure and antioxidant activity of polysaccharides extracted by ultrasonography from sunflower flower[D]. Hangzhou: Zhejiang University, 2017.
[35] BAYAR N, FRIJI M, KAMMOUN R. Optimization of enzymatic extraction of pectin from Opuntia ficus indica cladodes after mucilage removal[J]. Food Chemistry,2018,235:275−282.
[36] VINATORU M. Ultrasonically assisted extraction (UAE) of natural products some guidelines for good practice and reporting[J]. Ultrasonics-Sonochemistry,2015,25:94−95. doi: 10.1016/j.ultsonch.2014.10.003
[37] YING Z, HAN X X, LI J R. Ultrasound-assisted extraction of polysaccharides from mulberry leaves[J]. Food Chemistry,2011,127(3):1273−1279. doi: 10.1016/j.foodchem.2011.01.083
[38] WAN P, YANG X M, CAI B N, et al. Ultrasonic extraction of polysaccharides from Laminaria japonica and their antioxidative and glycosidase inhibitory activities[J]. Oceanic and Coastal Sea Research,2015,14(4):651−662.
[39] NIE J G, CHEN D T, LU Y. Deep eutectic solvents based ultrasonic extraction of polysaccharides from edible brown seaweed Sargassum horneri[J]. Journal of Marine Science and Engineering,2020,8(6):126−170.
[40] MA L S, CHEN H X, ZHU W C, et al. Effect of different drying methods on physicochemical properties and antioxidant activities of polysaccharides extracted from mushroom Inonotus obliquus[J]. Food Research International,2013,50(2):633−640. doi: 10.1016/j.foodres.2011.05.005
[41] FAN L P, LI J W, DENG K Q, et al. Effects of drying methods on the antioxidant activities of polysaccharides extracted from Ganoderma lucidum[J]. Carbohydrate Polyme,2012,87(2):1849−1854. doi: 10.1016/j.carbpol.2011.10.018
[42] FLOEGEL A, KIM D O, CHUNG S J, et al. Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods[J]. Journal of Food Composition and Analysis,2011,24(7):1043−1048. doi: 10.1016/j.jfca.2011.01.008
[43] GONG G P, ZHAO J X, WANG C J, et al. Structural characterization and antioxidant activities of the degradation products from Porphyra haitanensis polysaccharides[J]. Process Biochemistry,2018,74:185−193. doi: 10.1016/j.procbio.2018.05.022
-
期刊类型引用(14)
1. 袁朔,李芹,王萌,赵晓燕,李成泰,朱运平. 响应面优化超声辅助酸法提取核桃雄花果胶的工艺. 食品工业. 2025(01): 8-11 .  百度学术
百度学术
2. 张兴明. 百香果果皮的综合利用研究进展. 食品工业. 2025(01): 142-147 .  百度学术
百度学术
3. 陈安,杨柳,王思雨,余邦良. 响应面法优化超声波辅助酸法提取菠萝蜜果皮果胶工艺及理化性质研究. 广东化工. 2025(05): 50-54+69 .  百度学术
百度学术
4. 吴丽丽,陈江龙,李莎. 水翁花蕾多酚的提取及其抗氧化、抑菌活性研究. 食品工业. 2024(01): 66-70 .  百度学术
百度学术
5. 王崑仑,管立军,高扬,严松,李家磊,季妮娜,李波,周野. 裂褶菌发酵西洋参工艺优化及体外抗氧化能力研究. 食品工业科技. 2024(07): 142-151 .  本站查看
本站查看
6. 黄海东,杨宁线,吴洪丽,谢霆霆,吕巩固,刘淼,张明生. 狐臭柴叶果胶的酸法提取工艺优化及其理化性质、抗氧化性和结构研究. 食品安全质量检测学报. 2024(13): 309-317 .  百度学术
百度学术
7. 周清鹭,李燕,晏和滇,卢仕修,李舷绫,张涛,杨希,杨德龙. 果胶分离提取技术研究进展. 农产品加工. 2024(21): 115-119+124 .  百度学术
百度学术
8. 刘芸,魏宗敏,陈忠铃,孙宝山,李灵犀. 辣木叶多酚的超声提取及抗氧化活性分析. 中国食品添加剂. 2023(02): 52-60 .  百度学术
百度学术
9. 郑茜,邹严俊杰,周米亚,任旭. 草酸法提取柠檬果胶工艺优化及品质评价. 食品与机械. 2023(02): 182-187 .  百度学术
百度学术
10. 宋青云,李玟君,庞子皓,肖一郎,汪海燕,李玉蝶,刘运,汪超,李玮. 花生根白藜芦醇的超声辅助提取工艺优化及分离提纯. 食品工业科技. 2023(16): 228-235 .  本站查看
本站查看
11. 李澄,黄文婧,廖强,郭振旺. Box-Behnken响应面法优化壮药三角泡中黄酮成分提取工艺及抗氧化作用研究. 中医药导报. 2022(07): 50-54 .  百度学术
百度学术
12. 杜超,刘佳慈,曹漫钰,左锋,臧延青. 赣州脐橙皮果胶的提取工艺优化及其改性前后理化性质和生物活性的研究. 食品工业科技. 2022(21): 235-244 .  本站查看
本站查看
13. 王锦秀,郑明锋,李灼坤,陈清西. 基于百香果果皮果胶的可食性薄膜制备与保鲜性能研究. 当代化工研究. 2022(24): 1-5 .  百度学术
百度学术
14. 林敏,陈妮娜. 微波辅助提取葡萄柚皮果胶的工艺优化. 食品安全导刊. 2022(33): 155-158+163 .  百度学术
百度学术
其他类型引用(9)









 下载:
下载:















 下载:
下载:





