Vortex-assisted Ionic Liquid Aqueous Two-phase Extraction of Lignans from Schisandra chinensis
-
摘要: 建立一种简单、高效、绿色的涡旋辅助离子液体双水相法萃取五味子中7种木脂素类化合物,结合高效液相色谱法对目标物进行分离和定量。研究以离子液体[C4mim]BF4为萃取剂,以MgSO4为成相盐,在涡旋辅助作用下形成双水相体系且目标物则被萃取至离子液体相中,分别对双水相体系的组成和萃取条件进行了考察和优化,并进行了方法评价。实验结果表明,当[C4mim]BF4体积为500 μL,MgSO4的用量为1.6 g,涡旋1.5 min,以3000 r/min离心10 min时,五味子中木脂素类化合物的提取量达到最大值。各目标分析物在线性范围内具有良好的线性关系(r>0.9995),日间和日内精密度分别低于3.97%和4.19%,检出限(LOD)和定量限(LOQ)分别为0.20~6.98和0.65~23.26 ng·mL−1,加标回收率在72.22%~97.19%之间。与传统提取方法相比,本法缩短了提取时间,减少了萃取剂用量,具有操作简单、省时、高效等优点,可用于木脂素类化合物的提取与检测。Abstract: A vortex-assisted ionic liquid aqueous two-phase extraction coupled with high performance liquid chromatography (HPLC) method was developed and applied to the determination of seven lignans in Schisandra chinensis. In this study, [C4mim]BF4 and MgSO4 were used as the extraction solvent and phase forming salt, respectively. With the aid of vortex (1.5 min), the target analytes were extracted into the ionic liquid phase. Then, the composition of the aqueous two-phase system and the extraction conditions were investigated. The results showed that the best extraction yield of lignans in Schisandra chinensis was achieved when the volume of [C4mim]BF4 was 500 μL, the amount of MgSO4 was 1.6 g and centrifugation condition was at 3000 r/min for 10 min. All target compounds showed a good linear relationship (r>0.9995) in the linear range. The limits of detection and quantification were 0.20~6.98 and 0.65~23.26 ng·mL−1, respectively. The intra-day and inter-day precision (RSD) were lower than 3.97% and 4.19%, respectively. The spiked sample recoveries ranged from 72.22% to 97.19%. Compared with the traditional extraction methods, the extraction time and solvent consumption of this method were reduced. It had the advantages of simple operation, time saving, high efficiency and green, which could be used for the extraction and detection of lignans.
-
五味子为木兰科植物五味子(Schisandra chinensis(Turcz.)Baill.)的干燥成熟果实[1],是一种闻名中外的中药,常用于治疗慢性咳喘、遗精、遗尿、久泻、自汗口渴及肝炎、糖尿病、高血压、失眠和肾气不足等[2-4]。据报道,五味子中的化学成分包括多糖、木脂素、氨基酸和挥发油等,其中木脂素是其主要活性成分,如五味子醇甲、五味子醇乙、五味子酯乙、五味子甲素、五味子乙素、五味子丙素等,这些成分具有抗肿瘤、肝保护和抗氧化、抗HIV等作用[5-6]。
目前,用于木脂素类化合物检测的常用方法有紫外分光光度法[7]、高效液相色谱法[8-9]、高效液相色谱-质谱联用法[10-11]、超高液相色谱法[12-13]等。其中,高效液相色谱法因其灵敏度高、分析速度快、成本低而被广泛应用于中药中木脂素类化合物的检测分析[14]。但由于中药中的基质组成非常复杂,所以在检测之前需要对样品进行前处理。常用的木脂素类化合物的前处理方法有回流法[15]、超声波提取法[16-18]、微波提取法[19-20]、超临界流体提取法[16,21]等。如王茹等[22]、裴毅等[23]、Zhu等[24]建立的方法,虽然提取量高、工艺稳定,但同时也面临着有机溶剂用量大、耗时长、设备成本高等问题。近几年,一些新的木脂素类化合物提取方法出现,如Cheng等[25]提出的粉碎组织提取法,Zhang等[26]建立的一种基质固相分散法结合高效液相色谱法,与传统方法相比,不仅提取量较高且对样品、溶剂和时间的要求降低。为了解决萃取时间长、样品用量大、设备昂贵、操作繁琐等问题,双水相体系(Aqueous two-phase system,ATPs)作为一种新型的液-液萃取技术逐渐引起人们的关注[27]。与传统的液-液萃取技术相比,其萃取原理相似,都是根据物质在两相间的分配系数的不同来进行分离。Shoushtari等[28]与Da等[29]提出的乙腈/碳水化合物双水相体系和聚乙二醇-柠檬酸双水相体系,实验结果较为满意,但前者使用了可挥发性有机溶剂,危害环境,后者虽然该体系所用试剂环保,但分相时间长。因此为了改进传统双水相的不足,研究人员开始用离子液体(ionic liquid, IL)代替传统有机溶剂。IL是由有机阳离子和无机或有机阴离子结合而成的有机熔盐[30]。基于离子液体的双水相体系解决了分相速度慢的问题,其乳液形成少,不含挥发性有机溶剂,具有分相时间短、不易乳化、稳定性高、易回收等优点,现已成功用于分离药物、蛋白质、激素和抗生素等化合物[31]。然而,到目前为止,尚未发现采用离子液体/盐双水相体系萃取五味子中的木脂素类化合物的相关报道。
因此,本研究首次建立[C4mim]BF4/MgSO4双水相体系,并用于五味子中木脂素类化合物的提取,对萃取条件进行了优化,并进行了方法学考察。为了评价本法性能,本研究将其与热回流法和超声提取法进行了比较。
1. 材料与方法
1.1 材料与仪器
五味子药材 购买于当地药房(中国,长春),粉碎后过80目筛,并于60 ℃烘箱中干燥至恒重,储存于干燥器中备用;五味子醇甲(Schizandrol A)、五味子酯甲(Schizandrol A)、五味子甲素(Schisandrin A)和五味子乙素(Schizandrin B)标准品(纯度大于99%) 上海市阿拉丁试剂有限公司;戈米辛D(Gomisin D)、五味子酚(Schisanhenol)、五味子丙素(Schisandrin)和五味子醇乙(Schizandrol B)标准品(纯度大于99%) 成都曼斯生物科技有限公司;1-乙基-3-甲基咪唑四氟硼酸盐([C2mim]BF4)、1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)、1-己基-3-甲基咪唑四氟硼酸([C6mim]BF4)、1-辛基-3-甲基咪唑四氟硼酸([C8mim]BF4) 上海成捷化学有限公司;MgSO4、K2CO3、Na2CO3、K2HPO4、KCl、NaCl 北京化工厂;甲醇(色谱级) 美国Fisher公司;其他试剂均为分析纯。
Agilent TC-C18色谱柱(250 mm×4.6 mm,5 μm)、安捷伦1100型液相色谱仪(配有二极管阵列检测器) 美国安捷伦公司;Centrifuge 5430R型高速离心机 德国艾本德股份公司;XW-80型旋涡混合器 上海青浦泸西仪器厂;KQ5200DE型数控超声波清洗器 昆山市超声仪器有限公司;FW177型中草药粉碎机 天津市泰斯特仪器有限公司。
1.2 标准溶液的配制
精确称量各标准品10 mg于10 mL容量瓶内,用适量甲醇溶解并定容至刻度,配制成浓度1000 μg·mL−1的标准储备液,于4 ℃下避光保存,其他工作液均由标准储备液经甲醇稀释得到。
1.3 萃取方法
1.3.1 离子液体/盐双水相萃取
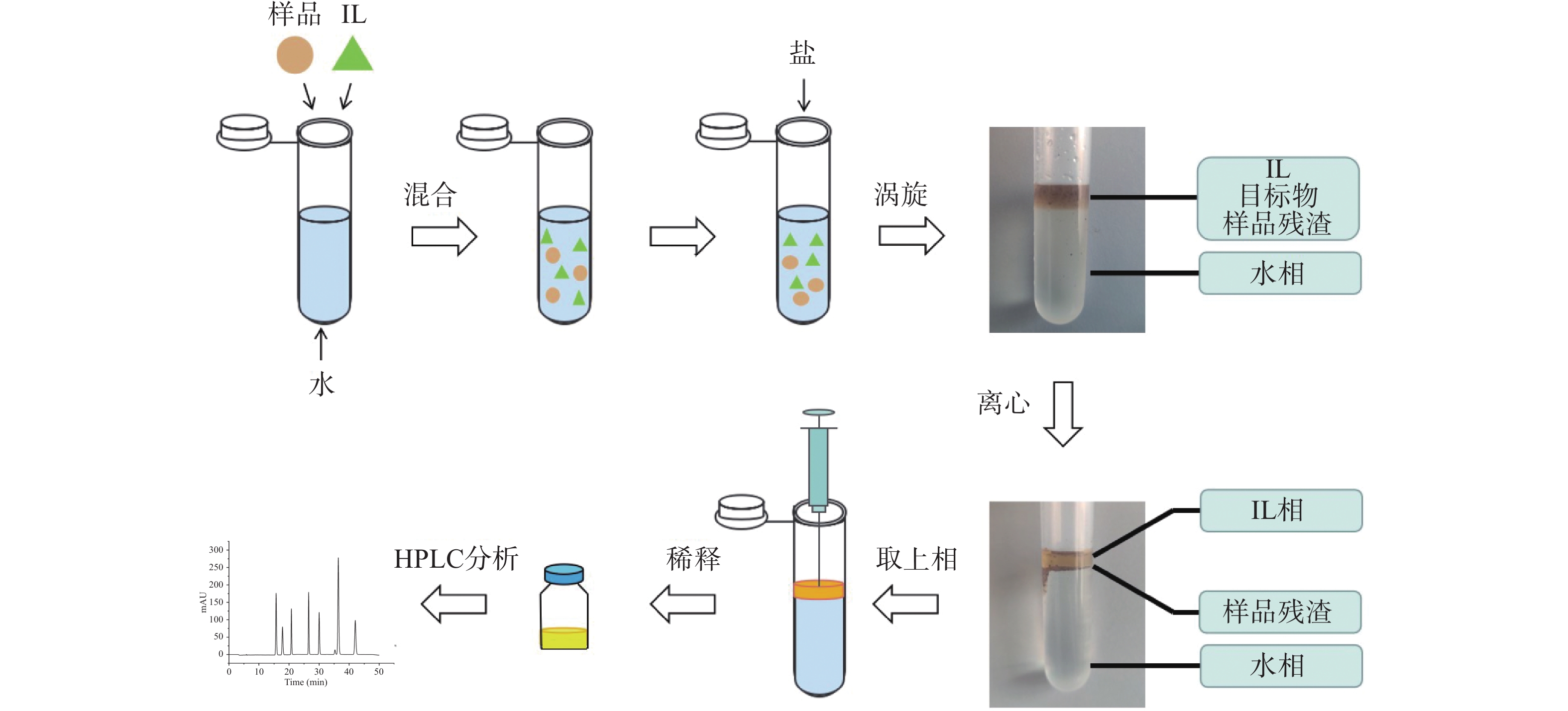
双水相萃取(Aqueous two-phase extraction,ATPE)实验流程如图1所示,精确称取10 mg五味子粉末样品于10 mL离心管中,向其加入4 mL水和500 μL的[C4mim]BF4,手动振摇30 s后加入1.6 g MgSO4,涡旋混合1.5 min后,在3000 r/min下离心10 min后,得到液-固-液三相体系。其中,上相为离子液体相,中相为五味子残渣,下相为水相。随后,将上相全部取出,用甲醇稀释至0.5 mL,过0.22 μm滤膜后进行色谱分析。
1.3.2 热回流提取法(Hot reflux extraction, HRE)
参考王茹等[23]的研究方法。精确称取0.5 g五味子样品于圆底烧瓶内,加入95%乙醇15 mL,称重,加热回流提取2 h,冷却至室温后称重,用95%乙醇补齐损失的重量,摇匀后过滤,取续滤液2 mL,减压干燥后用2 mL甲醇回溶,过0.22 μm滤膜后进行色谱分析。
1.3.3 超声波提取法(Ultrasonic extraction, UE)
根据《中国药典》(2020版)[1],精确称取0.25 g五味子样品粉末于20 mL容量瓶内,加入甲醇约18 mL,以功率200 W的超声条件超声20 min,冷却至室温后定容至刻度,摇匀过滤,取续滤液2 mL过0.22 μm滤膜后进行色谱分析。
1.4 相图的绘制
相图的绘制采用浊点滴定法[32],用数字恒温加热套保持温度为(25±2)℃,各组分浓度以质量体积比表示。操作过程如下:吸取2 mL(m1)的0.5 g·mL−1 [C4mim]BF4水溶液置于比色管中,向其逐滴滴加0.5 g·mL−1 MgSO4水溶液至体系混浊,记录加入量(m2),再逐滴滴加水至澄清,记录水的加入量(m3),直至不再出现浑浊,计算每个浊点时[C4mim]BF4和MgSO4的质量体积比浓度,分别记为w1和w2,计算如下。
准确移取2 mL(m1)的0.5 g·mL−1 [C4mim]BF4水溶液置于另一个比色管中,向其中滴加0.2 g·mL−1 Na2CO3水溶液至体系混浊,记录加入量(m2),再逐滴滴加水至澄清,记录水的加入量(m3),直至不再出现浑浊,计算每个浊点时[C4mim]BF4和Na2CO3的质量体积比浓度,分别记为w1和w2,计算如下,以w1、w2为横纵坐标作图,即得双节线图。
IL质量分数:
w1=m1m1+∑n=im2+∑n=im3(其中n=1,2,3,…,n) (1) 成相盐质量分数:
w2=∑n=im2m1+∑n=im2+∑n=im3(其中i=1,2,3,…,n) (2) 1.5 萃取条件优化
1.5.1 离子液体(IL)的种类与体积
按照1.4离子液体/盐双水相萃取法,在MgSO4的用量为1.2 g,涡旋时间为2 min,离心转速与时间为3000 r/min,10 min的前提下,考察不同体积(250~550 μL)的四种离子液体([C2mim]BF4、[C4mim]BF4、[C6mim]BF4和[C8mim]BF4)对五味子提取量的影响。
1.5.2 盐的种类与用量
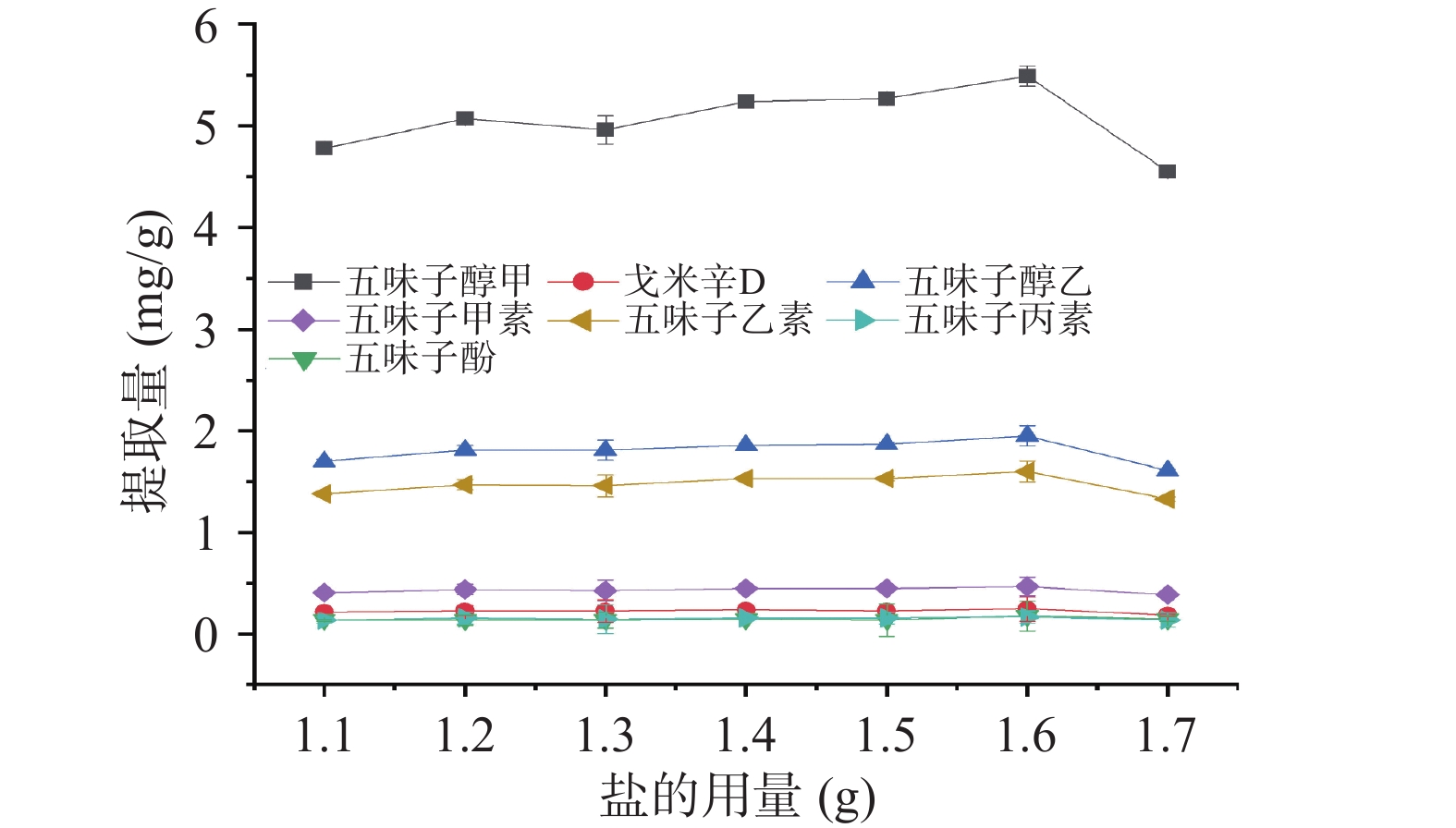
按照1.4离子液体/盐双水相萃取法,IL的种类与体积为1.5.1的最佳条件,涡旋时间为2 min,离心转速与时间为3000 r/min,10 min的前提下考察不同用量(1.1~1.7 g)的两种盐(MgSO4和Na2CO3)对五味子提取量的影响。
1.5.3 涡旋时间
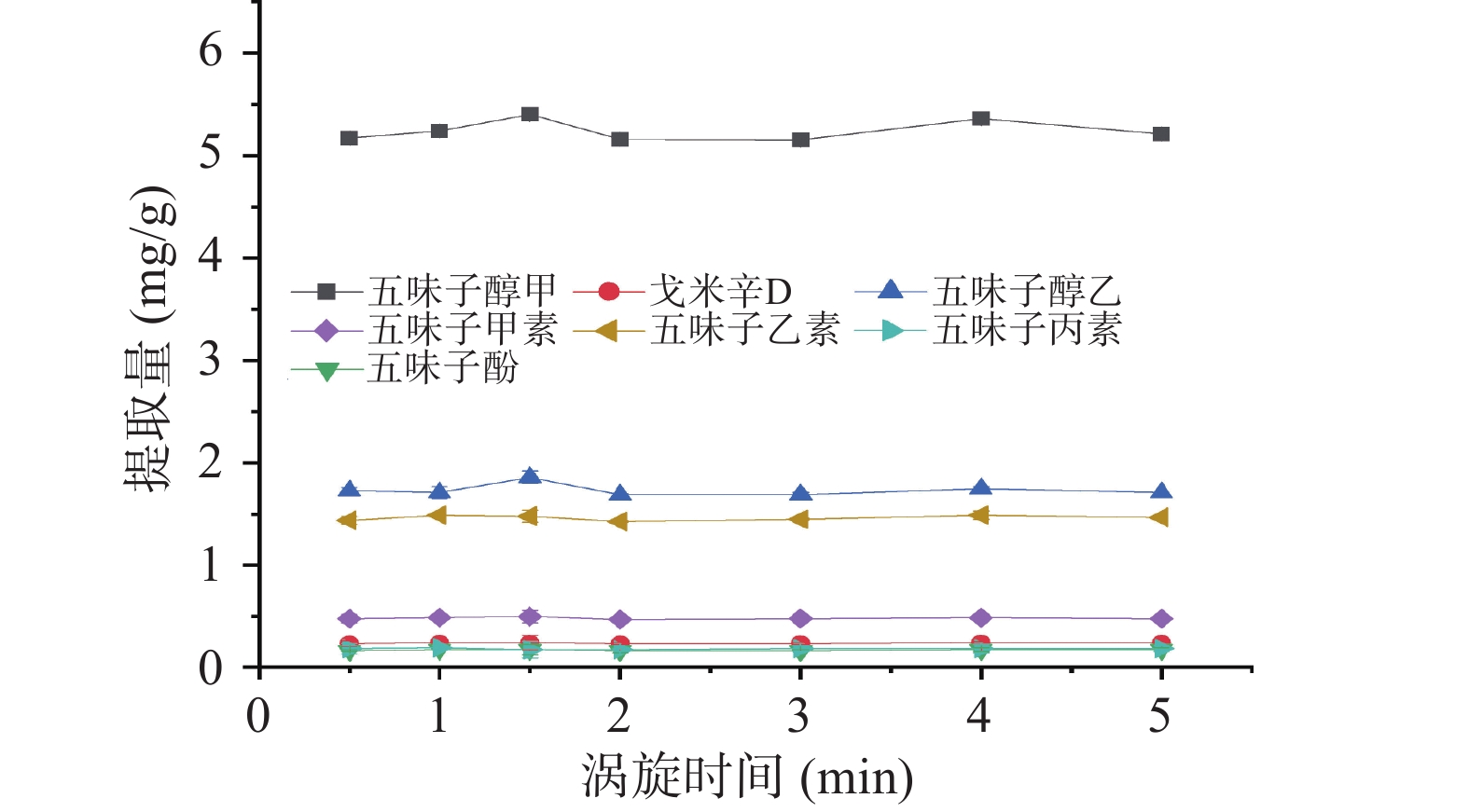
按照1.4离子液体/盐双水相萃取法,盐的种类与用量为1.5.2的最佳条件,离心转速与时间为3000 r/min,10 min的前提下考察涡旋时间(0.5~5 min)对五味子提取量的影响。
1.5.4 离心转速及时间
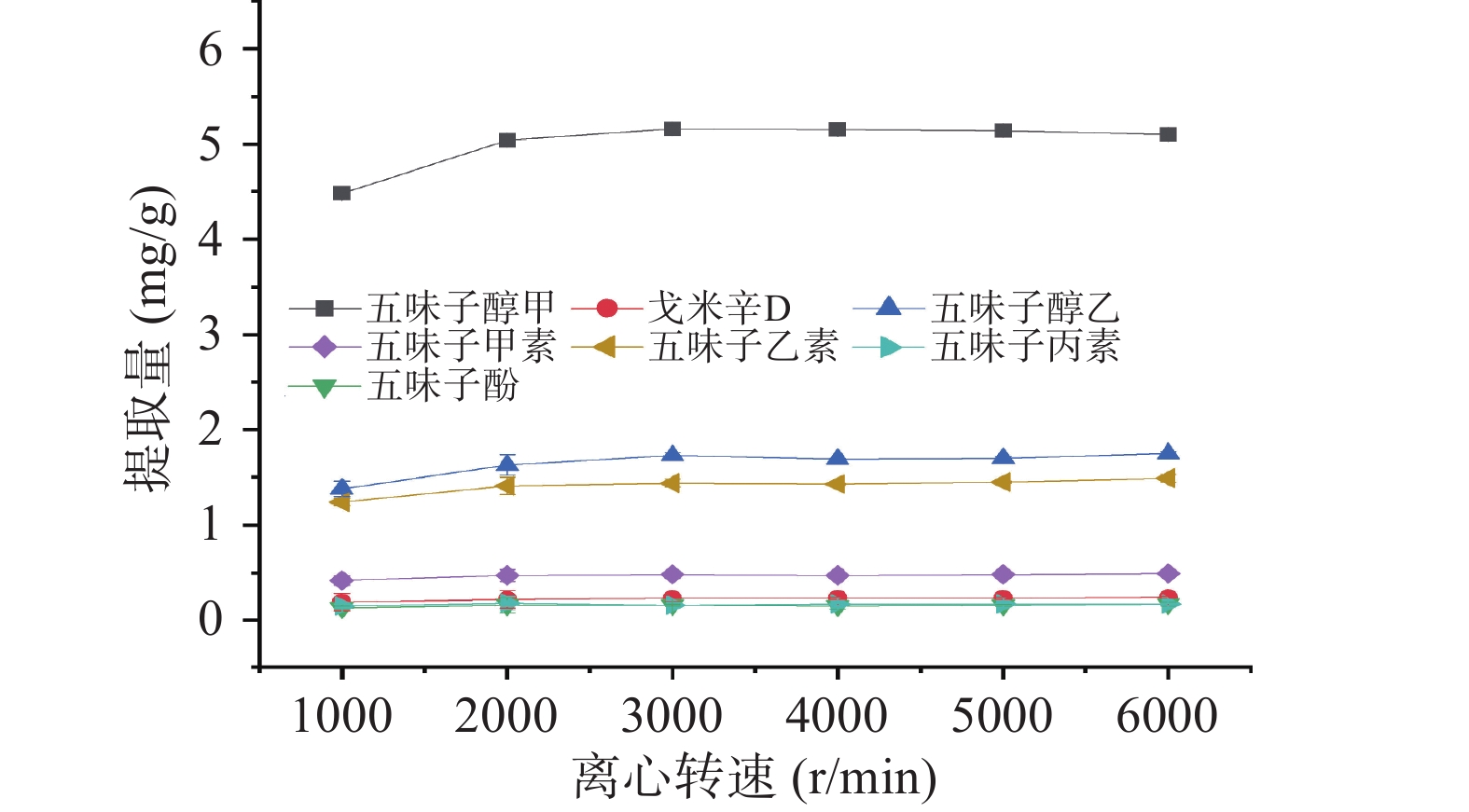
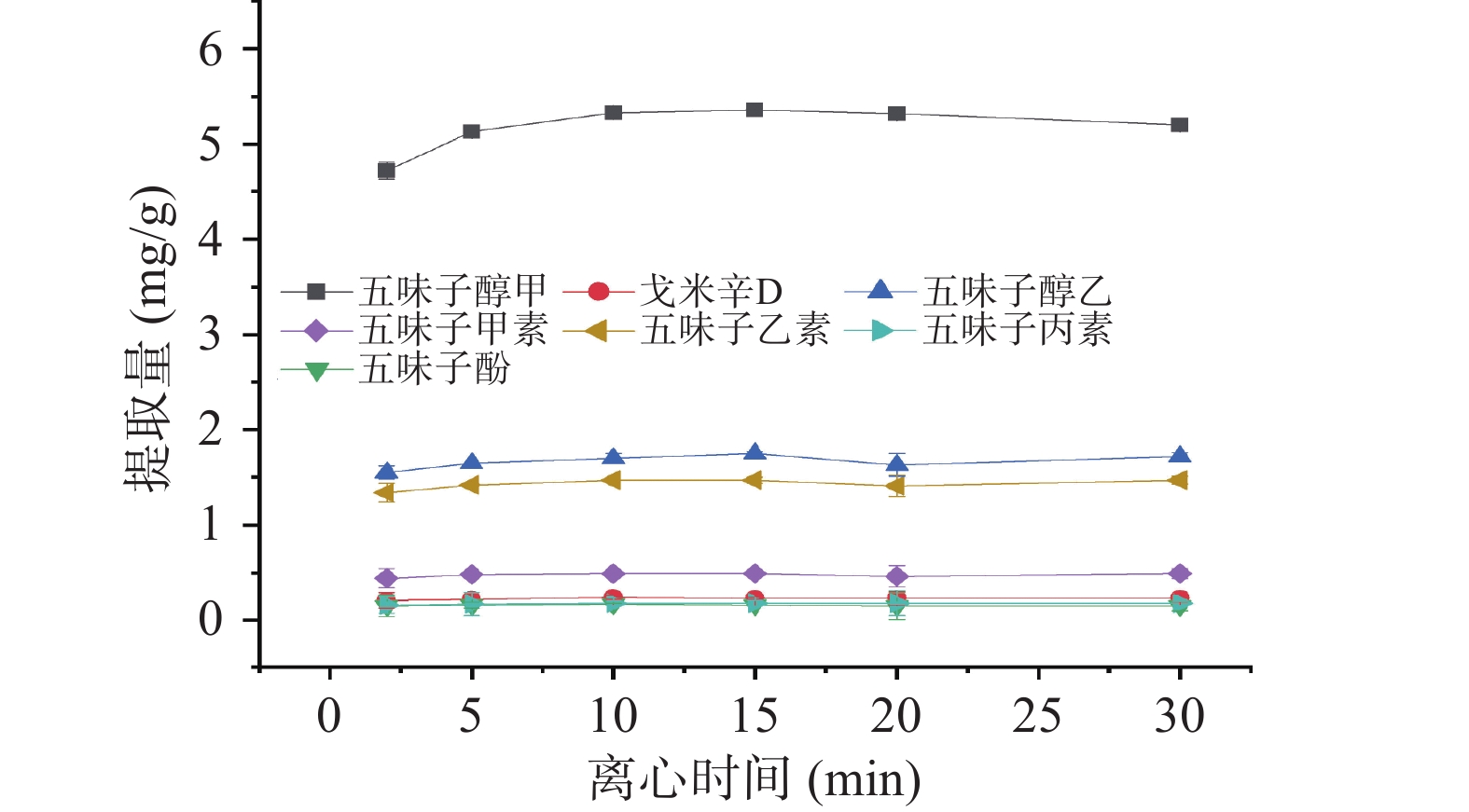
按1.3.1离子液体/盐双水相萃取法,涡旋时间为1.5.3的最佳条件下考察不同离心转速(1000~6000 r/min)和离心时间(2~30 min)对五味子提取量的影响。
1.6 色谱分析
色谱条件如下:流动相由甲醇(A)和水(B)组成,洗脱梯度条件如下所示:0~10 min,68% A;10~15 min,68%~80% A;15~40 min,80% A;40~42 min,80%~68% A;42~45 min,68% A;流动相流速为0.5 mL·min−1;进样量为10 μL;柱温为35 ℃;检测波长为254 nm。色谱柱为Agilent TC-C18色谱柱(250 mm×4.6 mm,5 μm)。
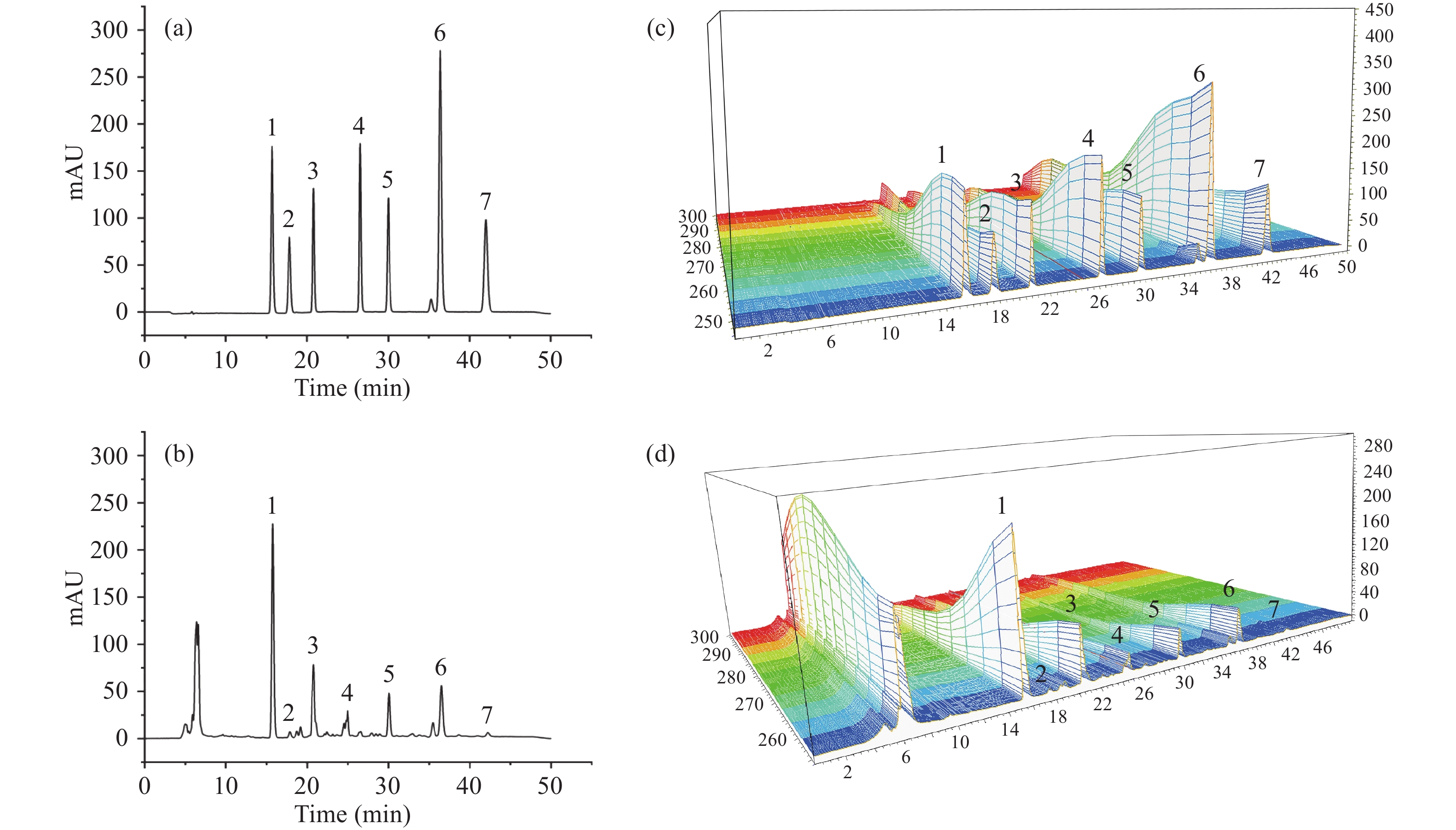
本研究以保留时间进行定性,五味子醇甲、戈米辛D、五味子醇乙、五味子酚、五味子甲素、五味子乙素、五味子丙素的保留时间分别为15.556、17.658、20.658、26.41、29.856、36.319、42.087 min。取1000 μg·mL−1的各标准储备液配制成各浓度为200、70、70、60、20、50、10 μg·mL−1的混合标准溶液,分别取1.95、3.91、7.81、15.63、31.25、62.50、125、250、500、1000 μL混合标准溶液于2 mL容量瓶内用甲醇定容至刻度,制得一系列浓度的混合标准溶液。在上述色谱条件如下进行分析,以浓度(c)为横坐标,以峰面积(A)为纵坐标绘制标准曲线。通过标准曲线对目标物进行定量。
1.7 数据处理
提取量及回收率的计算分别见公式(3)、(4)。所有实验数据均用Origin 2019软件进行统计分析。
E=C×VM (3) 式中:E为提取量,mg·g−1;C为提取物的浓度,mg·mL−1;V为提取物的体积,mL;M为样品质量,g。
R(%)=C2−C0C1×100 (4) 式中:R为回收率,%;C0为初始量,mg·g−1;C1为加标量,mg·mL−1;C2为检出量,mg·g−1。
2. 结果与分析
2.1 双水相体系相图
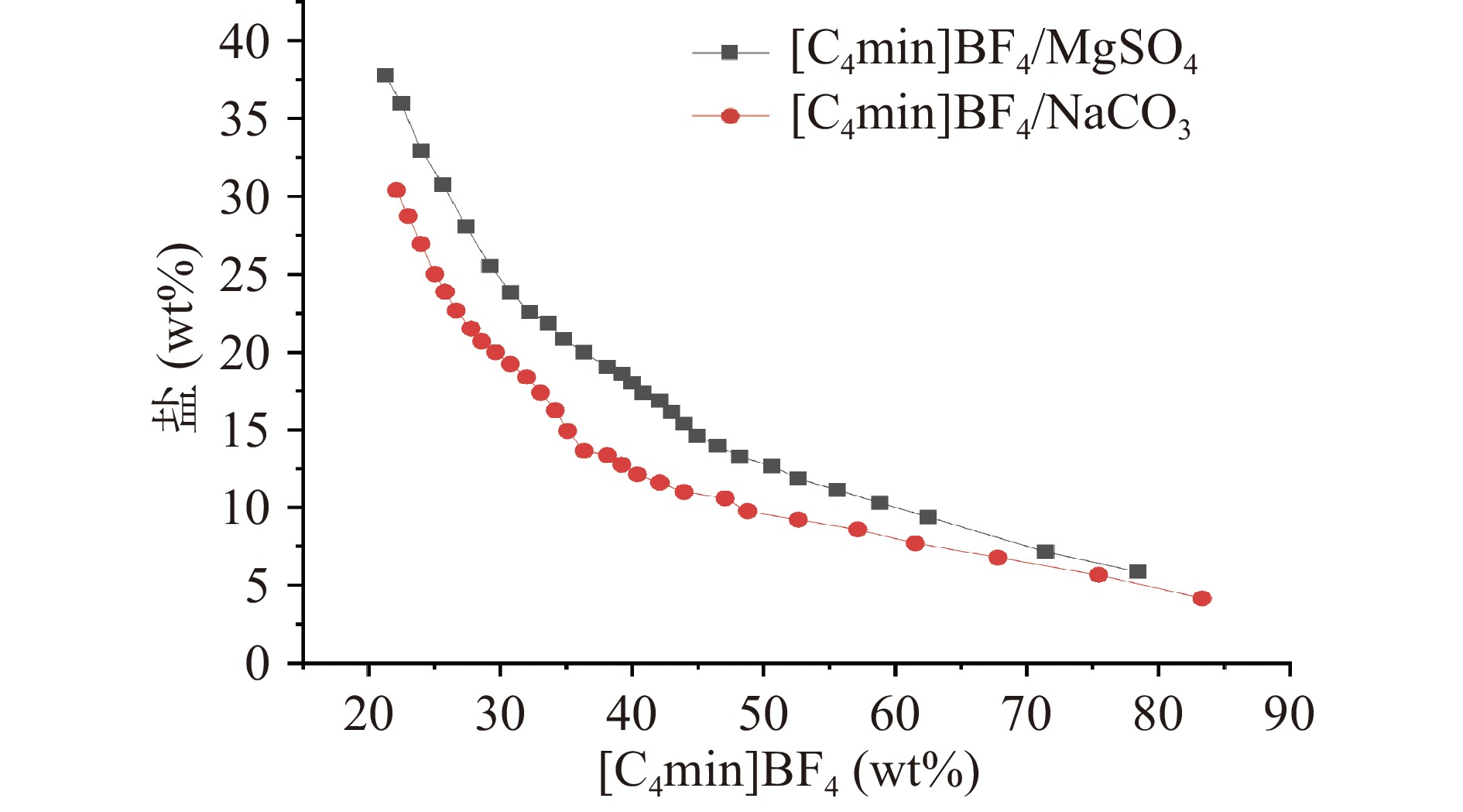
[C4mim]BF4与MgSO4和Na2CO3形成的相图如图2所示,双节线下方的区域为均匀的单相,形成双水相的两组分混合后溶液澄清,为均相区;双节线上方的区域,不同的两组分混合后体系能自动分为两相,为双水相区;双节线上的部分,溶液刚好由澄清变为混浊,为刚要分相的区域。[C4mim]BF4/MgSO4双水相的成相范围为:[C4mim]BF4 21.28%~78.43%,MgSO4 5.88%~37.70%,水15.69%~45.38%。[C4mim]BF4/Na2CO3双水相的成相范围为:[C4mim]BF4 22.10%~83.33%,Na2CO3 4.17%~30.39%,水12.50%~50.71%。
图2显示了[C4mim]BF4与MgSO4和Na2CO3体系在298 K下测定的二项式曲线,该曲线提供了有关形成双相体系的各相组分浓度的信息。从图中可以看出,向离子液体的水溶液中加入正确浓度的MgSO4或Na2CO3,形成了ATPs。众所周知,二项式曲线越接近原点,成相能力越强[33]。通过绘制[C4mim]BF4/MgSO4和[C4mim]BF4/Na2CO3的相图发现[C4mim]BF4/Na2CO3的成相能力优于前者,但试验结果表明[C4mim]BF4/MgSO4体系对木脂素类化合物的提取量更高。这表明对于双水相体系组成的选择,成相能力不是第一评价标准。
2.2 萃取条件优化
2.2.1 离子液体(IL)的种类和体积
离子液体/盐双水相由离子液体、盐和水三部分组成,在本研究中,离子液体作为萃取溶剂,其结构和理化性质对双水相成相和萃取效果有重要影响。因此,本研究考察了4种离子液体[C2mim]BF4、[C4mim]BF4、[C6mim]BF4和[C8mim]BF4对目标物回收率的影响。实验结果表明,[C2mim]BF4和[C8mim]BF4不能形成双水相体系,其主要原因是[C2mim]BF4有较强水溶性,加盐后始终为均相溶液,而[C8mim]BF4由于其较强的疏水性,加入到水溶液时不溶,直接沉于试管底部。[C4mim]BF4和[C6mim]BF4可与盐形成双水相体系,且[C4mim]BF4形成的双水相效果最好。据文献报道,离子液体咪唑环上的烷基链越长,其疏水性越强,对水的斥力越大,形成双水相的能力就越强[34-37]。虽然[C6mim]BF4疏水性强于[C4mim]BF4,疏水性增强,但黏性也更强,不利用双水相萃取。因此,本研究选用[C4mim]BF4进行后续的实验。
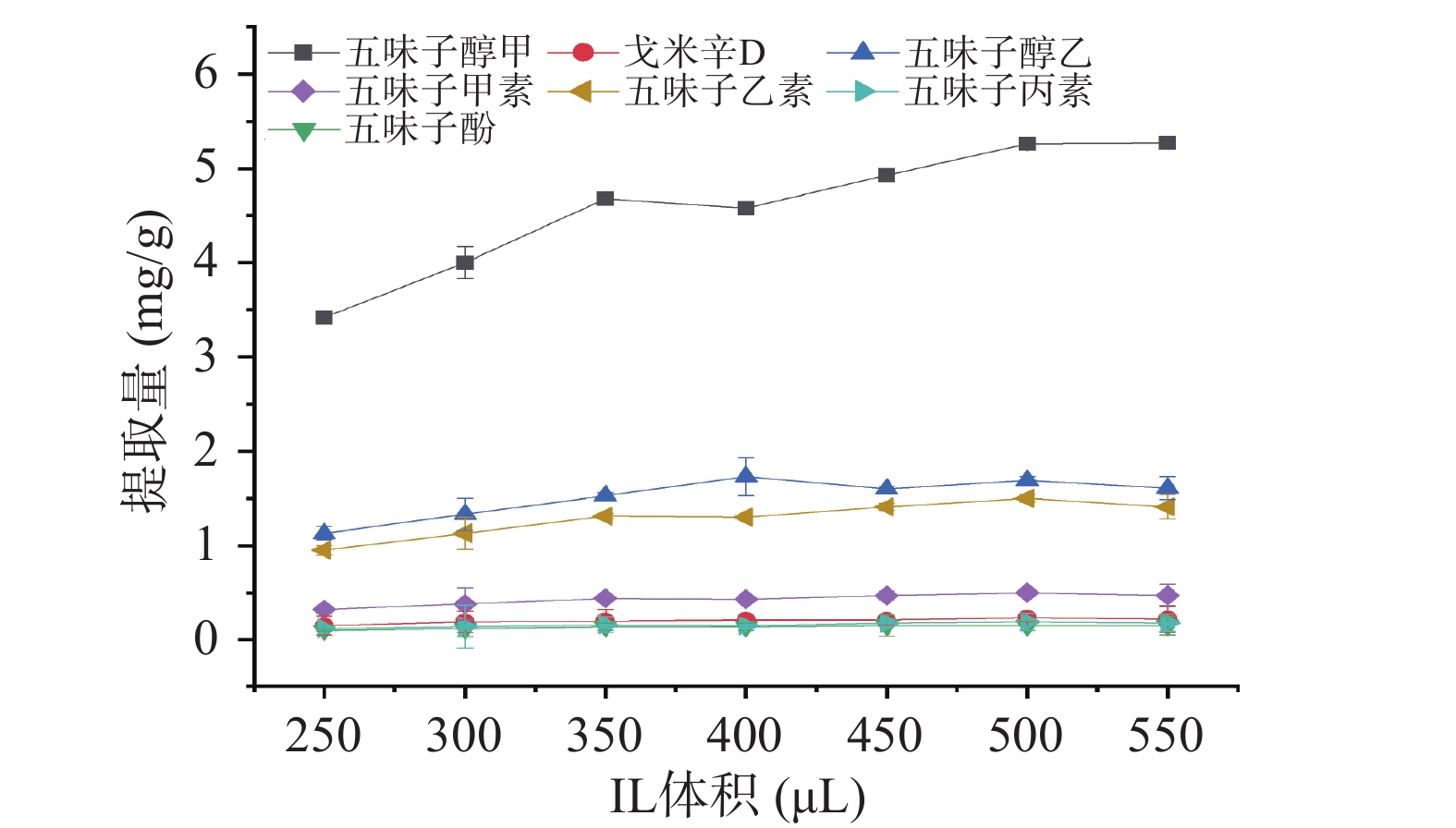
本研究考察了当水为4 mL,MgSO4用量为1.6 g时,离子液体用量(250~550 μL)对木脂素类化合物提取量的影响。如图3所示,随着离子液体用量从250 μL增加至500 μL,木脂素类化合物的提取量明显提高,五味子醇甲提取量由3.42 mg·g−1提高至5.26 mg·g−1,各化合物提取量提高近50%。然而,继续增加离子液体用量,目标物提取量几乎不变或略有下降。这可能是由于离子液体具有一定粘度,其用量增加,尽管能有效提取目标物,但同时也增加了体系的粘度,不利于传质。因此,本研究选择离子液体用量为500 μL。
2.2.2 盐的种类及用量
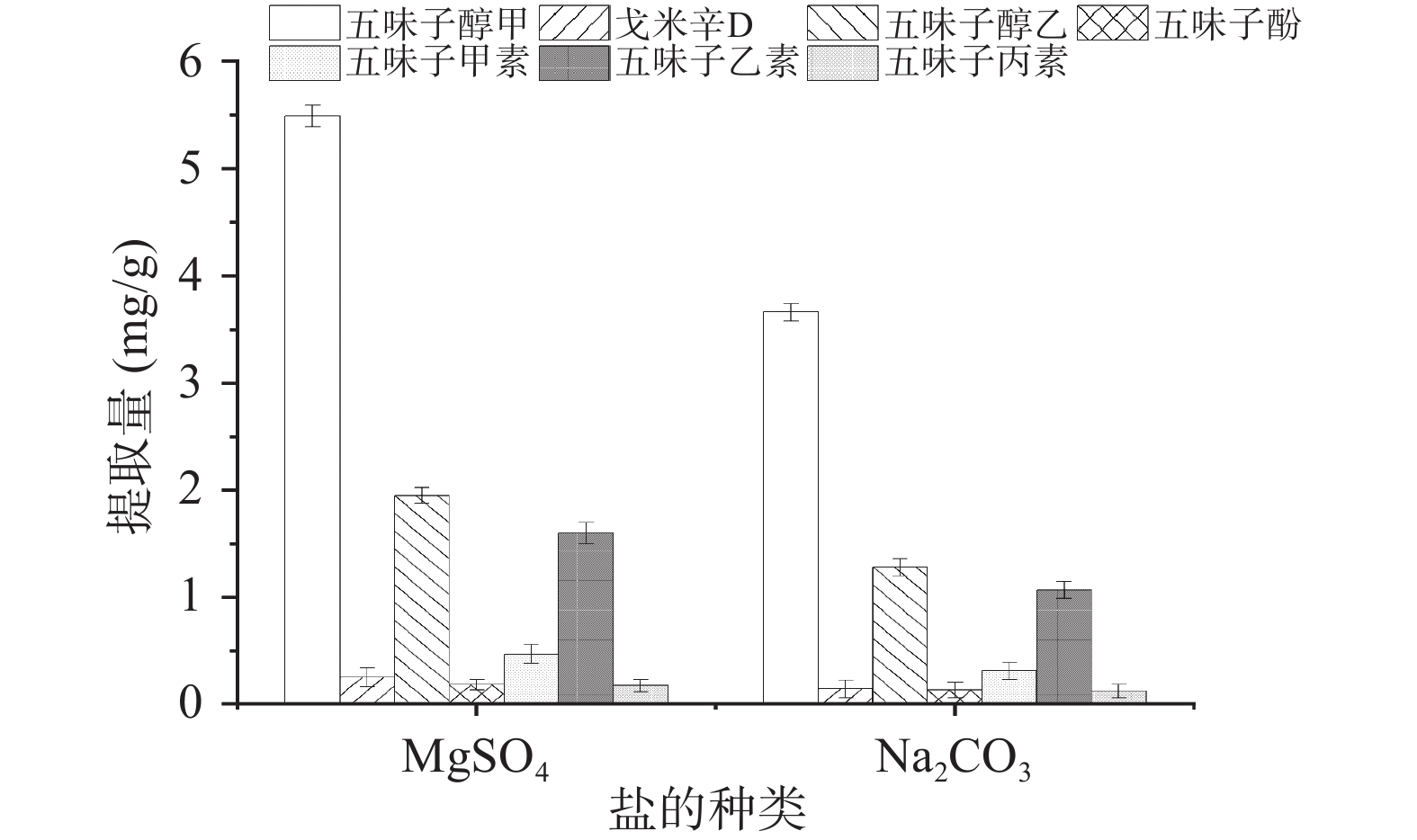
无机盐的加入会影响离子液体在双水相体系中的分布,同时也会改变目标组分的分配系数和提取效率[38]。因此,本研究考察了[C4mim]BF4分别与硫酸镁、碳酸钾、碳酸钠、磷酸氢二钾、氯化钾和氯化钠的成相效果。实验结果表明,当水为4 mL,离子液体体积为500 μL时,MgSO4和Na2CO3可以与[C4mim]BF4形成双水相,这可能是因为偏渗透性离子CO32−、SO42−与水分子的相互作用更强,有利于双水相的形成[39]。如图4所示,MgSO4所形成的双水相体系的提取量明显高于Na2CO3,这可能是因为Mg2+的原子半径更大,电荷也更高,导致了这种现象的发生[40]。因此,本研究选用MgSO4作为成相盐。
此外,本研究还考察了MgSO4用量为1.1~1.7 g时对目标物提取量的影响。如图5所示,随盐用量的增加,离子液体相体积不断增加,目标物提取量随之增加,这可能是因为随着盐用量的增加,MgSO4的盐析作用占主导地位,IL逐渐与水分离且目标物随着IL相富集到上相[41]。当MgSO4用量为1.6 g时,提取量最高,此时上相(IL相)体积为450 μL,继续增加盐的用量,目标物提取量略有下降,这可能是因为成相盐的过量使用使粘度增加,不利于目标分析物的转移[42],从而导致提取量降低。因此,本研究选择MgSO4的用量为1.6 g。
2.2.3 涡旋时间
在萃取时,涡旋可以加速乳状液的形成,增加萃取剂与目标物质的接触面积,加速传质并缩短萃取平衡时间[43]。本研究考察了涡旋时间(0.5~5 min)对五味子中木脂素类化合物提取量的影响。实验结果如图6所示,在涡旋1.5 min时提取量最高,总木脂素类化合物提取量为9.82 mg·g−1,尽管涡旋时间对目标物提取量影响较小,但如不对样品溶液进行涡旋时,[C4mim]BF4/MgSO4体系分相耗时长。然而,在对该体系进行涡旋后无需静置,即可分相。为了加速传质过程,缩短提取时间,本研究选择涡旋1.5 min作为后续实验条件。
2.2.4 离心转速及时间
离心能促进双水相体系的形成,使相与相之间的分层更加清晰,便于离子液体相的转移。因此,本研究考察了1000~5000 r·min−1范围内离心转速对目标物提取量的影响。如图7所示,随着离心转速的增加,木脂素类化合物的提取量逐渐提高,当离心转速为3000 r·min−1时,提取量达到最大值。
此外,本研究还考察了不同离心时间(2~30 min)对提取量的影响。如图8所示,在离心10 min后,双水相分层清晰且木脂素类化合物的提取量达到最大值,体系达到萃取平衡,提取量不再上升。在离心之后,目标物被富集于上相,下相为水相,中间相为五味子残渣。此时相界面清晰,便于上相全部取出。因此,本研究选择在3000 r/min,离心10 min为最佳离心条件。
2.3 方法学考察
2.3.1 线性关系、检出限、定量限和精密度
配制含有7种木脂素类化合物的一系列浓度的混合标准品溶液,以目标物质的浓度(c)为横坐标,以峰面积(A)为纵坐标绘制标准曲线。检出限(LOD)和定量限(LOQ)为信噪比(S/N)分别为3和10时仪器能检出和定量目标物质的最低浓度。日内、日间精密度以相对标准偏差(RSD)表示,在最佳实验条件下,一天内连续分析6次样品所得的目标物提取量的RSD为日内精密度;每天分析2次、连续分析3 d样品所得目标物提取量的RSD为日间精密度。实验结果如表1所示,各目标分析物在线性范围内具有良好的线性关系(r>0.9995),LOD和LOQ分别为0.20~6.98和0.65~23.26 ng·mL−1,日内精密度RSD低于3.97%,日间精密度RSD低于4.19%,方法性能满足要求。
表 1 线性回归方程、检出限(LOD)、定量限(LOQ)及精密度Table 1. Linear regression equation, LOD, LOQ and precision目标物 标准曲线 相关系数 线性范围
(μg·mL−1)LOD
(ng·mL−1)LOQ
(ng·mL−1)日内精密度
(RSD,%,n=6)日间精密度
(RSD,%,n=6)五味子醇甲 A=37.87c+20.93 0.9998 0.10~200.00 6.98 23.26 0.24 0.28 戈米辛D A=19.82c−0.62 0.9995 0.14~70.00 0.77 2.57 3.97 4.19 五味子醇乙 A=31.98c+5.17 0.9998 0.08~70.00 4.59 15.29 1.15 1.15 五味子酚 A=41.02c+0.15 0.9998 0.01~60.00 0.20 0.65 1.56 2.06 五味子甲素 A=50.61c+15.85 0.9997 0.16~20.00 0.96 3.20 2.29 2.20 五味子乙素 A=31.00c+15.85 0.9998 0.16~50.00 9.89 32.97 1.45 1.37 五味子丙素 A=30.82c+1.50 0.9996 0.31~10.00 1.90 6.33 2.89 3.04 2.3.2 加标回收率及实际样品分析
为了确定本研究的准确性和适用性,本研究分别进行了加标回收率与实际样品分析试验。加标回收率如表2所示,各目标物质的回收率为72.22%~97.19%,RSD低于3.97%,实验结果令人满意,因此本研究建立的方法可用于其他中药中木脂素类化合物的提取。
表 2 化合物的回收率Table 2. Recovery of chemical compounds目标物 初始量
(mg·g−1)添加量
(mg·g−1)检出量
(mg·g−1)回收率
(%)RSD
(%, n=6)五味子醇甲 5.33 2.67 7.92 97.19 0.24 戈米辛D 0.24 0.13 0.35 80.77 3.97 五味子醇乙 1.70 0.85 2.44 87.43 1.15 五味子酚 0.17 0.09 0.23 72.22 1.56 五味子甲素 0.49 0.25 0.72 92.00 2.29 五味子乙素 1.47 0.74 2.07 81.05 1.45 五味子丙素 0.18 0.09 0.26 84.21 2.89 本研究对7种不同产地的五味子样品进行分析,分别来自辽宁(样品1)、浙江(样品2)、黑龙江(样品3)、陕西(样品4)、甘肃(样品5)、内蒙古(样品6)和吉林(样品7)。实验结果如表3所示,所有产地北五味子样品中,各目标分析物中均以五味子醇甲的含量最高,是中药五味子的标志性成分,这与中国药典的报道相一致。从表3可以看出,五味子醇甲的含量为0.08~5.33 mg·g−1,戈米辛D的含量为0.04~0.34 mg·g−1,五味子醇乙的含量为0.07~1.98 mg·g−1,五味子酚的含量为0.12~0.91 mg·g−1,五味子甲素的含量为0.30~1.07 mg·g−1,五味子乙素的含量为0.05~1.47 mg·g−1,五味子丙素的含量为0.03~0.18 mg·g−1。各产地的五味子中木脂素类化合物的含量不同,原因可能是各地药材的生长环境、光照条件、雨水条件及采收时间均不同。东北五味子的五味子醇甲的含量明显高于其他产地,与其他文献中报道的一致,亦与中药道地药材的标准一致[44]。五味子标准溶液与样品提取物色谱图如图9所示。
表 3 实际样品分析(n=3)Table 3. Actual sample analysis(n=3)目标物 样品1 样品2 样品3 样品4 样品5 样品6 样品7 五味子醇甲(mg/g) 5.33±0.05 0.08±0.05 4.53±0.17 0.65±0.02 0.39±0.03 4.76±0.11 4.41±0.18 戈米辛D(mg/g) 0.24±0.01 0.04±0.01 0.34±0.02 0.06±0.003 0.06±0.01 0.24±0.02 0.29±0.01 五味子醇乙(mg/g) 1.70±0.08 0.07±0.02 1.96±0.08 0.34±0.00 0.42±0.00 1.84±0.127 1.98±0.08 五味子酚(mg/g) 0.17±0.00 0.33±0.004 0.14±0.01 0.28±0.008 0.91±0.03 0.22±0.01 0.12±0.01 五味子甲素(mg/g) 0.49±0.00 0.47±0.04 0.50±0.02 0.96±0.04 1.07±0.03 0.33±0.014 0.30±0.02 五味子乙素(mg/g) 1.47±0.00 0.11±0.014 0.90±0.01 0.21±0.003 0.05±0.01 0.86±0.02 0.92±0.08 五味子丙素(mg/g) 0.18±0.00 0.12±0.00 0.10±0.00 0.04±0.00 0.03±0.00 0.09±0.00 0.12±0.02 注:表中数据为平均值±标准偏差。 2.3.3 方法比较
为了评价本研究所建立的方法的实用性,将其与超声提取法、热回流法进行比较,实验结果如表4所示。与其他方法相比,本法无需过滤、浓缩等步骤,简化了操作流程。与热回流相比,本法将提取时间从120 min缩短至12 min,大大减少了实验时间,且不用加热,操作简单。综上所述,本法具有操作简单、用时短、提取量高等优点。
表 4 方法比较Table 4. Methed comparison名称 ATPE HRE UE 五味子醇甲(mg·g−1, n=3) 5.33 4.54 4.71 戈米辛D(mg·g−1, n=3) 0.24 0.29 0.37 五味子醇乙(mg·g−1, n=3) 1.70 1.65 1.72 五味子酚(mg·g−1, n=3) 0.17 0.05 0.11 五味子甲素(mg·g−1, n=3) 0.49 0.44 0.52 五味子乙素(mg·g−1, n=3) 1.47 1.36 1.51 五味子丙素(mg·g−1, n=3) 0.18 0.06 0.12 样品用量(g) 0.01 0.50 0.25 溶剂的类型 IL 乙醇 甲醇 溶剂的用量(mL) 0.5 15 18 提取时间(min) 12 120 20 3. 结论
本实验建立了一种简单、高效、绿色的涡旋辅助离子液体双水相法萃取五味子中7种木脂素类化合物,结合高效液相色谱法对目标物进行分离和定量。与其他方法相比,本法用离子液体代替传统有机溶剂作为萃取溶剂,由亲水性离子液体[C4mim]BF4和MgSO4组成双水相体系,具有绿色、分相速度快、操作简单、提取量高等优点,可尝试用于其他中药中木脂素类化合物的提取。本实验以亲水性离子液体[C4mim]BF4为萃取溶剂建立的提取方法[C4mim]BF4会残留于木脂素类中且ATPs一次萃取量过少,因此该法仅适用于木脂素类化合物的的分析与检测,不适合用于五味子提取物的制备与工业化生产。为此,在未来将致力于建立一种更加绿色、萃取量大、适合工业化生产的提取方法。
-
表 1 线性回归方程、检出限(LOD)、定量限(LOQ)及精密度
Table 1 Linear regression equation, LOD, LOQ and precision
目标物 标准曲线 相关系数 线性范围
(μg·mL−1)LOD
(ng·mL−1)LOQ
(ng·mL−1)日内精密度
(RSD,%,n=6)日间精密度
(RSD,%,n=6)五味子醇甲 A=37.87c+20.93 0.9998 0.10~200.00 6.98 23.26 0.24 0.28 戈米辛D A=19.82c−0.62 0.9995 0.14~70.00 0.77 2.57 3.97 4.19 五味子醇乙 A=31.98c+5.17 0.9998 0.08~70.00 4.59 15.29 1.15 1.15 五味子酚 A=41.02c+0.15 0.9998 0.01~60.00 0.20 0.65 1.56 2.06 五味子甲素 A=50.61c+15.85 0.9997 0.16~20.00 0.96 3.20 2.29 2.20 五味子乙素 A=31.00c+15.85 0.9998 0.16~50.00 9.89 32.97 1.45 1.37 五味子丙素 A=30.82c+1.50 0.9996 0.31~10.00 1.90 6.33 2.89 3.04 表 2 化合物的回收率
Table 2 Recovery of chemical compounds
目标物 初始量
(mg·g−1)添加量
(mg·g−1)检出量
(mg·g−1)回收率
(%)RSD
(%, n=6)五味子醇甲 5.33 2.67 7.92 97.19 0.24 戈米辛D 0.24 0.13 0.35 80.77 3.97 五味子醇乙 1.70 0.85 2.44 87.43 1.15 五味子酚 0.17 0.09 0.23 72.22 1.56 五味子甲素 0.49 0.25 0.72 92.00 2.29 五味子乙素 1.47 0.74 2.07 81.05 1.45 五味子丙素 0.18 0.09 0.26 84.21 2.89 表 3 实际样品分析(n=3)
Table 3 Actual sample analysis(n=3)
目标物 样品1 样品2 样品3 样品4 样品5 样品6 样品7 五味子醇甲(mg/g) 5.33±0.05 0.08±0.05 4.53±0.17 0.65±0.02 0.39±0.03 4.76±0.11 4.41±0.18 戈米辛D(mg/g) 0.24±0.01 0.04±0.01 0.34±0.02 0.06±0.003 0.06±0.01 0.24±0.02 0.29±0.01 五味子醇乙(mg/g) 1.70±0.08 0.07±0.02 1.96±0.08 0.34±0.00 0.42±0.00 1.84±0.127 1.98±0.08 五味子酚(mg/g) 0.17±0.00 0.33±0.004 0.14±0.01 0.28±0.008 0.91±0.03 0.22±0.01 0.12±0.01 五味子甲素(mg/g) 0.49±0.00 0.47±0.04 0.50±0.02 0.96±0.04 1.07±0.03 0.33±0.014 0.30±0.02 五味子乙素(mg/g) 1.47±0.00 0.11±0.014 0.90±0.01 0.21±0.003 0.05±0.01 0.86±0.02 0.92±0.08 五味子丙素(mg/g) 0.18±0.00 0.12±0.00 0.10±0.00 0.04±0.00 0.03±0.00 0.09±0.00 0.12±0.02 注:表中数据为平均值±标准偏差。 表 4 方法比较
Table 4 Methed comparison
名称 ATPE HRE UE 五味子醇甲(mg·g−1, n=3) 5.33 4.54 4.71 戈米辛D(mg·g−1, n=3) 0.24 0.29 0.37 五味子醇乙(mg·g−1, n=3) 1.70 1.65 1.72 五味子酚(mg·g−1, n=3) 0.17 0.05 0.11 五味子甲素(mg·g−1, n=3) 0.49 0.44 0.52 五味子乙素(mg·g−1, n=3) 1.47 1.36 1.51 五味子丙素(mg·g−1, n=3) 0.18 0.06 0.12 样品用量(g) 0.01 0.50 0.25 溶剂的类型 IL 乙醇 甲醇 溶剂的用量(mL) 0.5 15 18 提取时间(min) 12 120 20 -
[1] 中国药典委员会(编). 中华人民共和国药典[M]. 北京: 国家药典科学技术出版社, 2020. Chinese Pharmacopoeia Committee (ED). Pharmacopoeia of the People’s Republic of China[M]. Beijing: State Pharmacopoeia Science and Technology Press, 2020.
[2] LI Z J, HE X, LIU F, et al. A review of polysaccharides from Schisandra chinensis and Schisandra sphenanthera: Properties, functions and applications[J]. Carbohydrate Polymers,2018,184:178−190. doi: 10.1016/j.carbpol.2017.12.058
[3] LU Y, CHEN D F. Analysis of Schisandra chinensis and Schisandra sphenanthera[J]. Journal of Chromatography A,2008,1216(11):1980−1990.
[4] XU J B, GAO G C, YUAN M J, et al. Lignans from Schisandra chinensis ameliorate alcohol and CCl4-induced long-term liver injury and reduce hepatocellular degeneration via blocking ETBR[J]. Journal of Ethnopharmacology,2020,258:112813. doi: 10.1016/j.jep.2020.112813
[5] HE X L, CHEN J M, MU Y P, et al. The effects of inhibiting the activation of hepatic stellate cells by lignan components from the fruits of Schisandra chinensis and the mechanism of schisanhenol[J]. Journal of Natural Medicines,2020:1−12.
[6] 刘杰, 徐剑, 郭江涛. 五味子活性成分及药理作用研究进展[J]. 中国实验方剂学杂志,2019,25(11):206−215. [LIU J, XU J, GUO J T. Review of active constituents and pharmacological activities of Schisandrae chinensis fructus[J]. Chinese Journal of Experimental Traditional Medical,2019,25(11):206−215. [7] 赵一晖, 张培军, 战英, 等. 紫外分光光度法检测肝灵饮品中五味子醇甲的方法学研究[J]. 中国卫生工程学,2014,13(2):142−143,145. [ZHAO Y H, ZHANG P J, ZHAN Y, et al. Determination of schizandrin in ganling by ultraviolet spectrophotometry[J]. Chinese Journal of Public Health Engineering,2014,13(2):142−143,145. [8] 王书云, 梁宏刚, 黄健, 等. HPLC同时测定五味子中7个木脂素类化合物的含量[J]. 中国现代中药,2019,21(4):473−477. [WANG S Y, LIANG H G, HUANG J, et al. HPLC simultaneous determination of 7 major dibenzocyclooctadiene-type lignans in fruits of Schisandrae chinensis[J]. Modern Chinese Medicine,2019,21(4):473−477. [9] 窦志华, 安莉萍, 张琳, 等. HPLC测定五味子种子及果皮中的6种木脂素类成分[J]. 华西药学杂志,2016,31(2):205−207. [DOU Z H, AN L P, ZHANG L, et al. Assaying of 6 lignanoids in seed and pericarp of Schisandra chinensis[J]. West China Journal of Pharmaceutical Sciences,2016,31(2):205−207. [10] ZHOU W, SHAN J J, MENG M X. A two-step ultra-high-performance liquid chromatography-quadrupole/time of flight mass spectrometry with mass defect filtering method for rapid identification of analogues from known components of different chemical structure types in Fructus Gardeniae-Fructus Forsythiae herb pair extract and in rat’s blood[J]. Journal of Chromatography A,2018,1563:99−123. doi: 10.1016/j.chroma.2018.05.067
[11] DONG W, YU S J, DENG Y W, et al. Screening of lignan patterns in Schisandra species using ultrasonic assisted temperature switch ionic liquid microextraction followed by UPLC-MS/MS analysis[J]. Journal of Chromatography B,2016,1008:45−49. doi: 10.1016/j.jchromb.2015.11.022
[12] 邓力, 王浩兵, 严书超, 等. 超高效液相色谱法同时测定南、北五味子中的7种木脂素含量[J]. 中国医院药学杂志,2017,37(12):1158−1162,1170. [DENG L, WANG H B, YAN S C, et al. Simultaneous determination of seven lignans in Schisandra sphenanthera Rehd. et. and Schisandra chinensis (Turcz). by UPLC[J]. Chinese Journal of Hospital Pharmacy,2017,37(12):1158−1162,1170. [13] 白宏博, 冯志强, 史鑫波, 等. 超高液相色谱法同时测定北五味子中7种木脂素类化合物[J]. 天然产物研究与开发,2017,29(4):605−609. [BAI H B, FENG Z Q, SHI X B, et al. Simultaneous determination of seven lignans from Schisandrae chinensis fructus by ultra-performance liquid chromatography[J]. Natural Product Research and Development,2017,29(4):605−609. [14] ZHENG N J, XIAO H X, ZHANG Z Y, et al. Rapid and sensitive method for determining free amino acids in plant tissue by high-performance liquid chromatography with fluorescence detection[J]. Acta Geochimica,2017,36(4):680−696. doi: 10.1007/s11631-017-0244-5
[15] 袁列江, 伍平香. 响应面法优化热回流提取樟树叶中木脂素工艺[J]. 食品工业科技,2018,39(21):146−151. [YAN L J, WU P X. Optimization of hot reflux extraction process of lignans in Cinnamomum camphora leaves by response surface methodology[J]. Science and Technology of Food Industry,2018,39(21):146−151. [16] 王佳烨, 王晓丽, 王新婷, 等. 不同提取方法对五味子中木脂素成分提取量的影响[J]. 北华大学学报(自然科学版),2019,20(4):459−462. [WANG J Y, WANG X L, WANG X T, et al. Effects of different extraction methods on extraction rate of Schisandra chinensis lignans[J]. Journal of Beihua University,2019,20(4):459−462. [17] 张继丹, 李化, 柯华香, 等. 离子液体超声提取五味子木脂素的工艺研究[J]. 中国现代中药,2017,19(5):700−705. [ZHANG J D, LI H, KE H X, et al. Ionic liquid-based ultrasonic-assisted extraction of lignans from fruit of Schisandra chinensis (Turcz.) Baill[J]. Modern Chinese Medicine,2017,19(5):700−705. [18] YANG L G, YIN P P, FAN H, et al. Response surface methodology optimization of ultrasonic-assisted extraction of acer truncatum leaves for maximal phenolic yield and antioxidant activity[J]. Molecules, 2017, 22(2).
[19] 赵大伟, 王浩博, 李佳丽, 等. Box-Benhnken响应曲面法优化五味子中木脂素的微波提取工艺[J]. 吉林农业,2019(6):46−48. [ZHAO D W, WANG H B, LI J L, et al. Optimization of microwave assisted extraction of lignans from Schisandra chinensis by box benhnken response surface methodology[J]. Jinlin Agriculture,2019(6):46−48. [20] NEMES M S, ORSAT V. Evaluation of a microwave-assisted extraction method for lignan quantification in flaxseed cultivars and selected oil seeds[J]. Food Analytical Methods,2012,5(3):551−563. doi: 10.1007/s12161-011-9281-6
[21] SOVOA H, OPLETAL L, BARTLOVA M, et al. Supercritical fluid extraction of lignans and cinnamic acid from Schisandra chinensis[J]. The Journal of Supercritical Fluids,2007,42(1):88−95. doi: 10.1016/j.supflu.2007.01.008
[22] 王茹, 张琰, 程建峰, 等. 五味子活性成分提取工艺的优选[J]. 华南国防医学杂志,2005(6):4−6,47. [WANG R, ZHANG Y, CHENG J F, et al. Optimizing technology extracting active component from Schisandra chinese[J]. Military Medical Journal of South China,2005(6):4−6,47. doi: 10.3969/j.issn.1009-2595.2005.06.002 [23] 裴毅, 张玉华, 王雪莹, 等. 正交试验法优选五味子甲素和五味子乙素的超声提取工艺[J]. 国外医药(植物药分册),2007(3):111−113. [PEI Y, ZHANG Y H, WANG X Y, et al. Optimization of ultrasonic extraction technology of schisandrin A and schisandrin B by orthogonal test[J]. World Notes on Antibiotics,2007(3):111−113. [24] ZHU H Y, ZHANG L N, WANG G L, et al. Sedative and hypnotic effects of supercritical carbon dioxide fluid extraction from Schisandra chinensis in mice[J]. Journal of Food and Drug Analysis,2016,24(4):831−838. doi: 10.1016/j.jfda.2016.05.005
[25] CHENG Z Y, SONG H Y, YANG Y J, et al. Extraction of five lignans from the fruit of Schisandra chinensis[J]. Journal of Chromatographic Science,2016,54(2):246−256.
[26] ZHANG Q, ZHU W Q, GUAN H, et al. Development of a matrix solid-phase dispersion extraction combined with high-performance liquid chromatography for determination of five lignans from the Schisandra chinensis[J]. Journal of Chromatography B,2016,1011:151−157. doi: 10.1016/j.jchromb.2015.12.064
[27] JIANG B, WANG M C, WANG X J, et al. Effective separation of prolyl endopeptidase from Aspergillus niger by aqueous two-phase system and its characterization and application[J]. International Journal of Biological Macromolecules,2021,169:384−395. doi: 10.1016/j.ijbiomac.2020.12.120
[28] SHOUSHTARI B A, PAZUKI G, SHAHROUZI J R, et al. Separation of erythromycin using aqueous two-phase system based on acetonitrile and carbohydrates[J]. Fluid Phase Equilibria,2020:505.
[29] DA SILVA O S, GOMES M H G, DE OLIVEIRA R L, et al. Partitioning and extraction protease from Aspergillus tamarii URM4634 using PEG-citrate aqueous two-phase systems[J]. Biocatalysis and Agricultural Biotechnology,2017,9:168−173. doi: 10.1016/j.bcab.2016.12.012
[30] BERTHOD A, RUIZ-ÁNGEL M J, CARDA-BROCH S. Recent advances on ionic liquid uses in separation techniques[J]. Journal of Chromatography A,2018,1559:2−16. doi: 10.1016/j.chroma.2017.09.044
[31] SANKARAN R, CRUZ R A P, SHOW P L, et al. Recent advances of aqueous two-phase flotation system for the recovery of biomolecules[J]. Fluid Phase Equilibria,2019:501.
[32] 曹婧. 离子液体/盐双水相体系萃取分离葛根素研究[D]. 南昌: 南昌大学, 2010. CAO J. Study on extraction and purification of puerarin from puerariaby ionic liquid/salt aqueous two-phase system[D]. Nanchang: Nanchang University, 2010.
[33] GOGOI G, HAZARIKA S. Ionic liquid-mediated aqueous two-phase system to enhance the partitioning of lignin[J]. Canadian Journal of Chemical Engineering, 2019.
[34] 高欣, 范理波, 邓芸, 等. 不同结构的亲水性离子液体双水相萃取铜[J]. 环境化学,2020,39(12):3504−3510. [GAO X, FAN L B, DENG Y, et al. Extraction of copper using ionic liquid-based aqueous biphasic systems[J]. Environmental Chemistry,2020,39(12):3504−3510. [35] 林潇. 离子液体双水相萃取分离生物活性物质及其机理的研究[D]. 湖南: 湖南大学, 2013. LIN X. Study on the separation of bioactive substances by two-phase extraction of ionic liquid and its mechanism[D]. Hunan: Hunan University, 2013.
[36] 夏寒松, 余江, 胡雪生, 等. 离子液体相行为(Ⅱ)双水相的成相规律[J]. 化工学报,2006(9):2149−2151. [XIA H S, YU J, HU X S, et al. Phase behavior of ionic liquids (Ⅱ) aqueous two-phase[J]. CIESC Journal,2006(9):2149−2151. doi: 10.3321/j.issn:0438-1157.2006.09.026 [37] HAN J, WANG Y, YU C L, et al. Extraction and determination of chloramphenicol in feed water, milk, and honey samples using an ionic liquid/sodium citrate aqueous two-phase system coupled with high-performance liquid chromatography[J]. Analytical and Bioanalytical Chemistry,2011,399(3):1295−1304. doi: 10.1007/s00216-010-4376-2
[38] HE A, DONG B, FENG X T, et al. Extraction of bioactive ginseng saponins using aqueous two-phase systems of ionic liquids and salts[J]. Separation and Purification Technology,2018,196:270−280. doi: 10.1016/j.seppur.2017.05.041
[39] LI Z Y, PEI Y C, WANG H Y, et al. Ionic liquid-based aqueous two-phase systems and their applications in green separation processes[J]. Trends in Analytical Chemistry,2010,29(11):1336−1346. doi: 10.1016/j.trac.2010.07.014
[40] TAN Z J, LI F F, XU X L. Isolation and purification of aloe anthraquinones based on an ionic liquid/salt aqueous two-phase system[J]. Separation and Purification Technology,2012:98.
[41] WANG J L, FENG J, XU W L, et al. Ionic liquid-based salt-induced liquid-liquid extraction of polyphenols and anthraquinones in Polygonum cuspidatum[J]. Journal of Pharmaceutical and Biomedical Analysis,2019,163:95−104. doi: 10.1016/j.jpba.2018.09.050
[42] WANG X Z, LIX W, LI L J, et al. Sensitive determination of three aconitum alkaloids and their metabolites in human plasma by matrix solid-phase dispersion with vortex-assisted dispersive liquid-liquid microextraction and HPLC with diode array detection[J]. Journal of Separation Science,2016,39(10):1971−1978. doi: 10.1002/jssc.201600118
[43] ZHANG K G, LIU C, LI S Y, et al. Vortex-assisted liquid-liquid microextraction based on a hydrophobic deep eutectic solvent for the highly efficient determination of sudan I in food samples[J]. Analytical Letters,2020,53(8):1204−1217. doi: 10.1080/00032719.2019.1700422
[44] 王连芝, 付克, 顾媛媛, 等. HPLC法测定不同产地五味子中5种成分的质量比[J]. 哈尔滨商业大学学报(自然科学版),2016,32(4):415−417,420. [WANG L Z, FU K, GU Y Y, et al. Quantitative analysis of five lignans in Schisandra chinensis from different habitats by HPLC[J]. Journal of Harbin University of Commerce(Natural Sciences Edition),2016,32(4):415−417,420. -
期刊类型引用(10)
1. 袁陈婷,杨容,王立玮,景凌洁,陈璐阳,加羊卓玛,孙小祥,孙锦秀,杨欢. 基于特征多肽抗原的阿胶基原鉴定. 中成药. 2024(04): 1214-1219 .  百度学术
百度学术
2. 王晶,杨彤,芦云,王芳. 不同核酸提取方法用于检测明胶动物源性成分的比较分析. 食品科技. 2024(03): 312-319 .  百度学术
百度学术
3. 蒋洁莹,史万忠,刘瑾,元唯安,朱蕾蕾. 河蚌多糖生物活性与提取、纯化工艺研究进展. 中国药业. 2024(08): 125-128 .  百度学术
百度学术
4. 李晶峰,孙佳明,赵润怀,段金廒,万德光,吴楠,杜延佳,张辉. 动物源中药材鉴定学发展及面临的问题与挑战. 中国医院药学杂志. 2024(08): 973-978+984 .  百度学术
百度学术
5. 范小龙,朱晓玲,江丰,陈梦圆,吴婉琴,黄坤,王福燕. 高分辨质谱靶向筛查技术鉴别阿胶中杂皮源成分. 中南农业科技. 2024(07): 94-98 .  百度学术
百度学术
6. 杨帅,鲁婷婷,周祖英,迟明艳,巩仔鹏,李月婷,郑林,黄勇. 阿胶化学成分和药理作用及质量控制研究进展. 中国新药杂志. 2023(08): 806-816 .  百度学术
百度学术
7. 蒋文丽,朱晓湉,钟铭慧,谢作桦,芦玲,涂宗财,沙小梅. 阿胶制品中典型明胶特征性多肽的鉴定. 食品工业科技. 2023(12): 73-80 .  本站查看
本站查看
8. 孔浩,田汝芳,曹桂云,孟兆青. 阿胶质量安全分析研究进展. 畜牧与饲料科学. 2023(04): 109-115 .  百度学术
百度学术
9. 孙铁锋,王平,丁相龙,丁立钧,姜其宝,王金国. 细胞膜色谱技术在多肽类成分筛选的研究进展. 药学研究. 2023(11): 926-931+936 .  百度学术
百度学术
10. 付群,张玲,庞幸,刘岩,韩蓉,杨嫣骊. 苏州市工业园区市售阿胶类保健品基于PCR技术的检测结果分析. 食品安全导刊. 2023(33): 97-100 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:




 下载:
下载:
