Optimization of Extraction of Inulin from Taraxacum kok-saghyz Rodin by Response Surface Methodology and Its MALDI-TOF MS Analysis
-
摘要: 以蒲公英橡胶草根为原料,采用超声提取的方式,通过单因素实验和响应面试验探究了超声功率、提取时间、超声温度、液料比对蒲公英橡胶草菊糖提取率的影响,得到蒲公英橡胶草菊糖提取的最佳工艺为:超声功率230 W、超声时间34 min、超声温度61 ℃、液料比30:1(mL:g),菊糖提取率为20.14%±0.19%。采用氢氧化钙-磷酸法、三氯乙酸法、Sevage法进行脱蛋白纯化,得出氢氧化钙-磷酸法的效果最好,其蛋白清除率达90.78%,菊糖损失率为26.44%。将菊糖粗提液经蛋白纯化、脱色、旋蒸、醇沉及真空冷冻干燥后得到纯度为80.8%的菊糖,为白色固体粉末。经MALDI-TOF MS进行表征分析,确定其单体的分子量为162,端基的分子量和为179,能检测到的聚合度范围为2~30。此研究为蒲公英橡胶草的综合利用研究提供了理论依据。Abstract: Using Taraxacum kok-saghyz Rodin root as raw material, the effects of ultrasonic power, extraction time, ultrasonic temperature and liquid-solid ratio on the extraction rate of inulin from Taraxacum kok-saghyz Rodin root were studied based on single factor experiment and response surface experiment. The optimum extraction conditions of inulin from Taraxacum kok-saghyz Rodin root were as follows: Ultrasonic power 230 W, ultrasonic time 34 min, ultrasonic temperature 61 ℃, liquid-solid ratio 30:1 (mL:g), and the extraction rate of inulin was 20.14%±0.19%. The calcium hydroxide-phosphoric acid method, trichloroacetic acid method and Sevage method were used for protein purification, and the results showed that the calcium hydroxide-phosphoric acid method had the best effect, with a protein clearance rate of 90.78% and an inulin loss rate of 26.44%. Inulin with a purity of 80.8% was obtained after protein purification, decolorization, alcohol precipitation and vacuum freeze drying, was a white solid powder. The obtained inulin was characterized and analyzed by MALDI-TOF MS, which determined that the molecular weight of the monomer was 162, the molecular weight of the end group was 179, and the degree of polymerization can be detected in the range of 2 to 30. This study provides a theoretical basis for the comprehensive utilization of Taraxacum kok-saghyz Rodin.
-
菊糖,别名菊粉、土木香粉,是由D-呋喃果糖经β-2,1-糖苷键聚合而成的链状多糖[1],末端为葡萄糖残基, 聚合度(DP)范围为2~60, 平均在10~12左右[2]。菊糖在自然界中广泛存在,主要以储备多糖的形式存在于多种植物中[3],如雪莲果块茎、婆罗门参、大丽花、菊芋、菊苣等[4]。菊糖不仅具有独特的凝胶特性和类似脂肪的口感[5],还具有降糖降脂、预防癌症[6]、调节肠道环境、促进益生菌增殖、促进矿物质吸收[7]等多种生理功能[8-9],在食品领域主要用于生产高纯度果糖、低脂食品、膳食纤维、糕点和甜食面团的品质改良剂等[10]。
橡胶草,又名俄罗斯蒲公英,为菊科蒲公英属大角蒲公英组多年生草本植物[11],橡胶草不仅可以合成天然橡胶,还可以合成大量的碳水化合物菊糖[12],主要储存在韧皮部附近的根细胞液泡中[13]。目前国内外关于蒲公英橡胶草的研究主要集中在橡胶的提取、定量、结构表征等方面[14-15],对于蒲公英橡胶草中菊糖的提取及结构表征的研究未见报道。工业上多采用热水浸提法从菊芋、菊苣中提取菊糖[16-17],关于蒲公英橡胶草菊糖的提取优化研究较少,其分子质量及聚合度分布等研究也有待进一步深入。本研究拟对蒲公英橡胶草菊糖的提取及分离纯化工艺进行研究,为蒲公英橡胶草的综合开发利用提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
蒲公英橡胶草 市售;考马斯亮蓝G-250 北京科华经纬科技有限公司;3,5-二硝基水杨酸 国药集团化学试剂有限公司;氢氧化钠 北京化工厂;无水亚硫酸钠 天津市光复科技发展有限公司;浓硫酸、苯酚、四水酒石酸钾钠、乙醇 均为分析纯。
Autoflex speed MALDI-TOF 布鲁克(北京)科技有限公司;KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;BT-25S型电子天平 赛多利斯科学仪器(北京)有限公司;SIGMA-3K15型离心机 北京五洲东方科技发展有限公司;DZF-150型真空干燥箱 郑州长城科工贸有限公司;NanoDrop 2000C分光光度计 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 菊糖提取工艺
蒲公英橡胶草根→洗净→烘干→粉碎→超声提取→离心→除蛋白→抽滤→脱色→旋蒸浓缩→醇沉(4~5次)→冷冻干燥→菊糖成品[18]。
将蒲公英橡胶草根洗净后60 ℃烘干粉碎,取一定量的蒲公英橡胶草粉末于50 mL离心管中,加入一定量的去离子水,在一定的温度、时间及功率下进行超声提取,随后在8000 r/min条件下离心5 min,取上清液进行纯化(纯化方法的选择见1.2.6),纯化后采用抽滤的方式除去沉淀,将所得的滤液采用大孔吸附树脂进行脱色,控制流速为1 mL/min,收集流出液并定容后取样在420 nm处测吸光度并计算其脱色效果[19]。将脱色后的菊糖提取液于60 ℃旋蒸浓缩至微量,然后加入4倍体积无水乙醇,于4 ℃冰箱静置20 min后离心(8000 r/min,10 min),沉淀留存,将上清液再次进行浓缩和醇沉[20],反复沉淀4~5次直至无沉淀产生。将所得沉淀物在−20 ℃预冻12 h后,冷冻干燥约3 h得白色固体粉末状菊糖成品。
1.2.2 菊糖单因素实验
采用控制变量法,分别探究超声功率、液料比、超声温度、超声时间对菊糖提取率的影响[21]。
1.2.2.1 超声功率对菊糖提取率的影响
选取温度:60 ℃[22],时间:20 min,液料比:20:1 mL/g,分别在功率:120、180、240、300 W进行超声提取,8000 r/min离心5 min后取上清液进行菊糖含量测定,探究超声功率与菊糖提取率的关系。
1.2.2.2 液料比对菊糖提取率的影响
选取温度:60 ℃,时间:20 min,功率:240 W,分别在液料比:10:1、20:1、30:1、40:1、50:1、60:1 mL/g进行超声提取,8000 r/min离心5 min后取上清液进行菊糖含量测定,探究液料比与菊糖提取率的关系。
1.2.2.3 超声温度对菊糖提取率的影响
选取时间:20 min,功率:240 W,液料比:20:1 mL/g,分别在温度:40、50、60、70、75 ℃进行超声提取,8000 r/min离心5 min后取上清液进行菊糖含量测定,探究超声温度与菊糖提取率的关系。
1.2.2.4 超声时间对菊糖提取率的影响
选取超声温度:60 ℃,功率:240 W,液料比:20:1 mL/g,分别在超声时间:10、20、30、40、50、60 min进行超声提取,8000 r/min离心5 min后取上清液进行菊糖含量测定,探究超声时间与菊糖提取率的关系。
1.2.3 响应面优化试验
根据单因素实验,分别以液料比(A)、超声功率(B)、超声温度(C)、超声时间(D)为考察因素,设计了四因素三水平的响应面优化试验,全部试验共计29组,其中设置为5组中心点重复实验,用以估计试验误差,设计结果见表1。
表 1 响应面试验设计因素水平表Table 1. Factors and levels table of response surface experiment水平 A
液料比(mL/g)B
超声功率(W)C
超声温度(℃)D
超声时间(min)−1 20:1 180 50 20 0 30:1 240 60 30 1 40:1 300 70 40 1.2.4 菊糖提取率及含量的测定
采用苯酚硫酸法在490 nm波长处测定吸光度[23],代入总糖标准曲线(回归方程y=7.1083x−0.0253,R2=0.9987)计算出总糖含量;采用DNS法在540 nm波长处测定吸光度[24],代入还原糖标准曲线(回归方程y=1.4987x−0.0451,R2=0.9988)计算出还原糖含量;分别利用公式(1)和(2)计算出菊糖提取率和菊糖含量[16]。
菊糖提取率(%)=样品中菊糖含量样品质量×100 (1) 菊糖含量=总糖含量−还原糖含量 (2) 1.2.5 蛋白质含量的测定
采用考马斯亮蓝法,以牛血清白蛋白溶液为标准,以牛血清白蛋白溶液浓度为横坐标,以吸光度为纵坐标,在595 nm处测定吸光度[25],绘制标准曲线(y=5.1325x+0.1027,R2=0.9983),根据标曲计算出菊糖提取液中蛋白质含量,根据公式(3)计算出菊糖损失率,根据公式(4)计算蛋白质清除率。
菊糖损失率(%)=纯化前菊糖含量−纯化后菊糖含量纯化前菊糖含量×100 (3) 蛋白质清除率(%)=纯化前蛋白质含量−纯化后蛋白质含量纯化前蛋白质含量×100 (4) 1.2.6 菊糖纯化方法的选择
1.2.6.1 氢氧化钙-磷酸法
工业上常用氢氧化钙-磷酸法[26]进行纯化,取一定量的菊糖粗提液,加入质量分数为10%的Ca(OH)2溶液,使溶液pH为12[27],在80 ℃下,边加热边搅拌20 min,再用20% H3PO4溶液调节pH为6,保温10 min后,4000 r/min离心5 min,取上清液进行测量。
1.2.6.2 三氯乙酸法
取一定量的菊糖粗提液,加入12.5 mL 9%的三氯乙酸,搅拌20 min后,静置30 min[28],待溶液不再浑浊后,5000 r/min离心20 min,取上清液进行测量。
1.2.6.3 Sevage法
Sevage试剂的配制:氯仿:正丁醇=4:1[29]。
取一定量的菊糖粗提液,按Sevage试剂:样液=1:5的比例加入Sevage试剂,剧烈摇晃25 min后离心去掉下层和乳白色的中间层,继续对上清液进行处理,重复上述步骤5次,弃去沉淀后取上清液测量蛋白质含量及菊糖含量。
1.2.7 MALDI-TOF MS表征
采用WANG等[26]的方法,将菊糖成品溶于0.01 mol/L氯化钾水溶液混合制成样品,以DHB作为基质,基质用乙醇和水混合液(乙醇:水=1:1)配制成10 mg/mL,再将基质和样品按1:1的比例混合进行MALDI-MS分析,在线性模式和反射模式下进行采集。
1.3 数据处理
实验数据的测定均设置3个平行实验,利用Origin 2017进行数据绘制,利用IBM SPSS Statistics 20对数据进行显著性差异分析,利用Design Expert 10.0.7软件进行响应面设计与分析。
2. 结果与分析
2.1 蒲公英橡胶草菊糖的提取
2.1.1 蒲公英橡胶草菊糖提取单因素实验
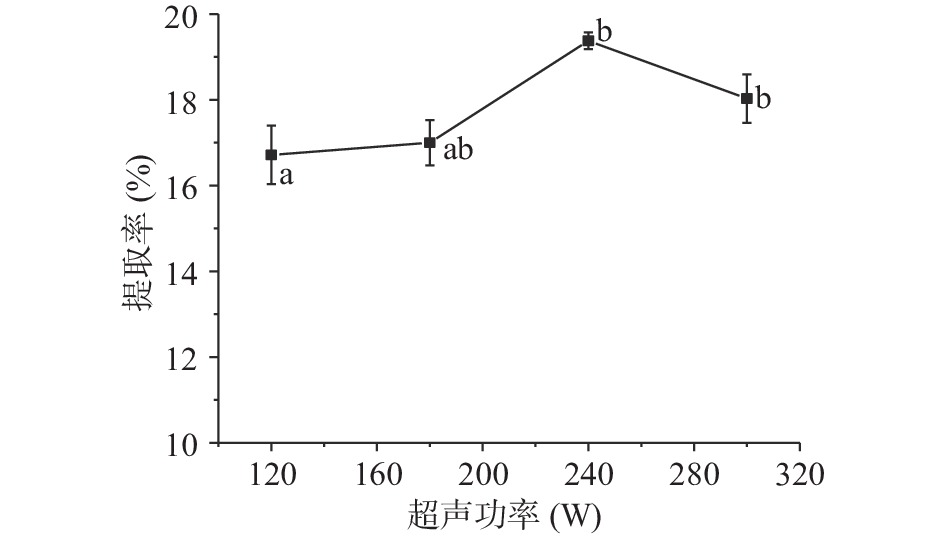
2.1.1.1 超声功率对菊糖提取率的影响
由图1可知,随着超声功率的增加,菊糖提取率先上升后下降,功率从180 W增加到240 W时,菊糖提取率显著增加(P<0.05),增加功率到300 W时提取率降低。原因是空化作用会随着超声功率的增强而增强,剪切效果也得到了增加,从而导致菊糖分子链的断裂,使得菊糖提取率呈下降趋势[20]。
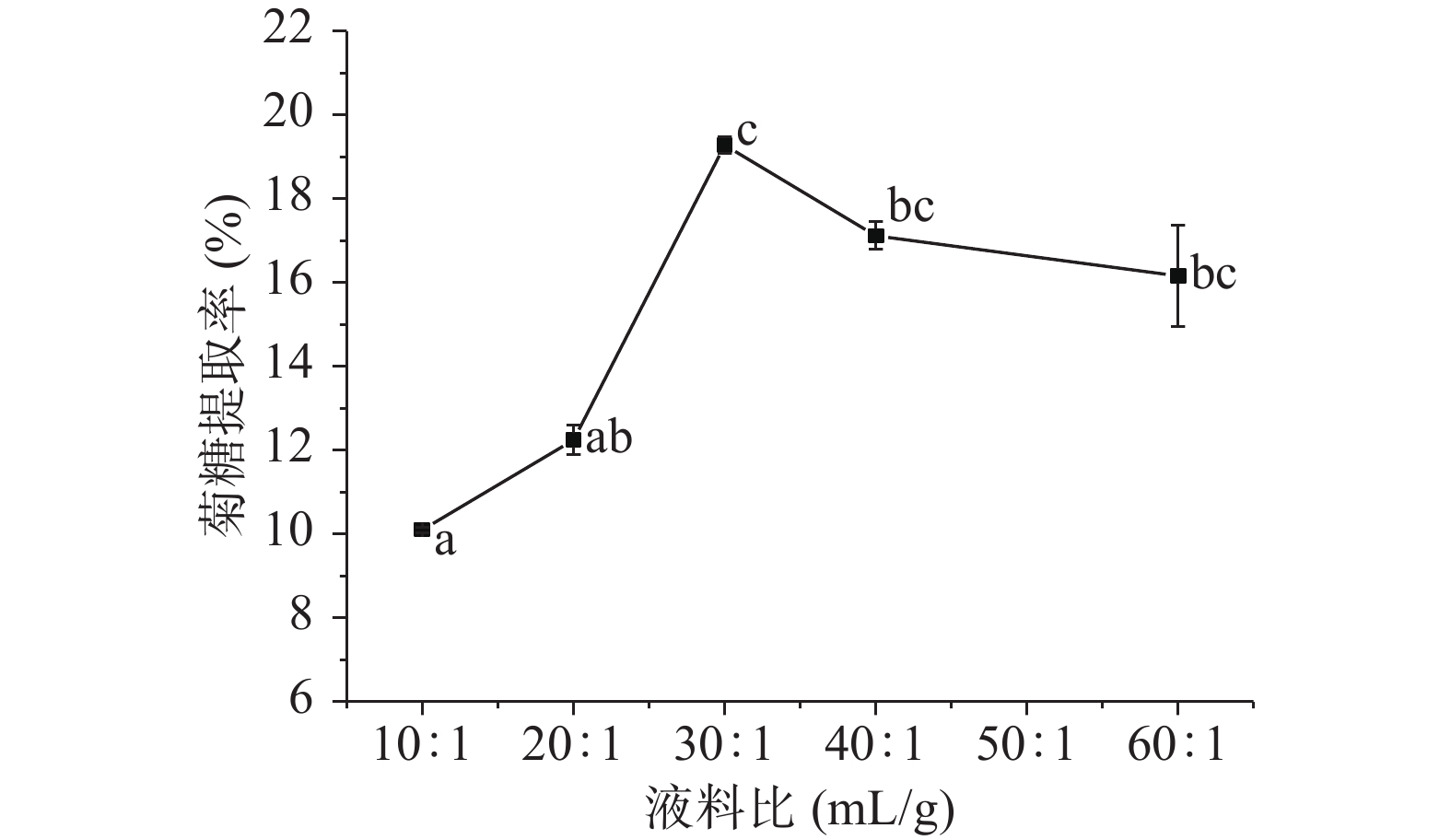
2.1.1.2 液料比对菊糖提取率的影响
由图2可知, 在10:1~30:1 mL/g的范围内,菊糖提取率随液料比的增加而显著增加(P<0.05),但液料比大于30:1 mL/g后,菊糖提取率随液料比的减小缓慢降低。原因是液料比较小时,由于溶剂不够,蒲公英橡胶草中的菊糖不能充分溶出,而液料比过大时,菊糖溶出则需要消耗更多时间和能量,因此菊糖提取率呈下降趋势[20]。
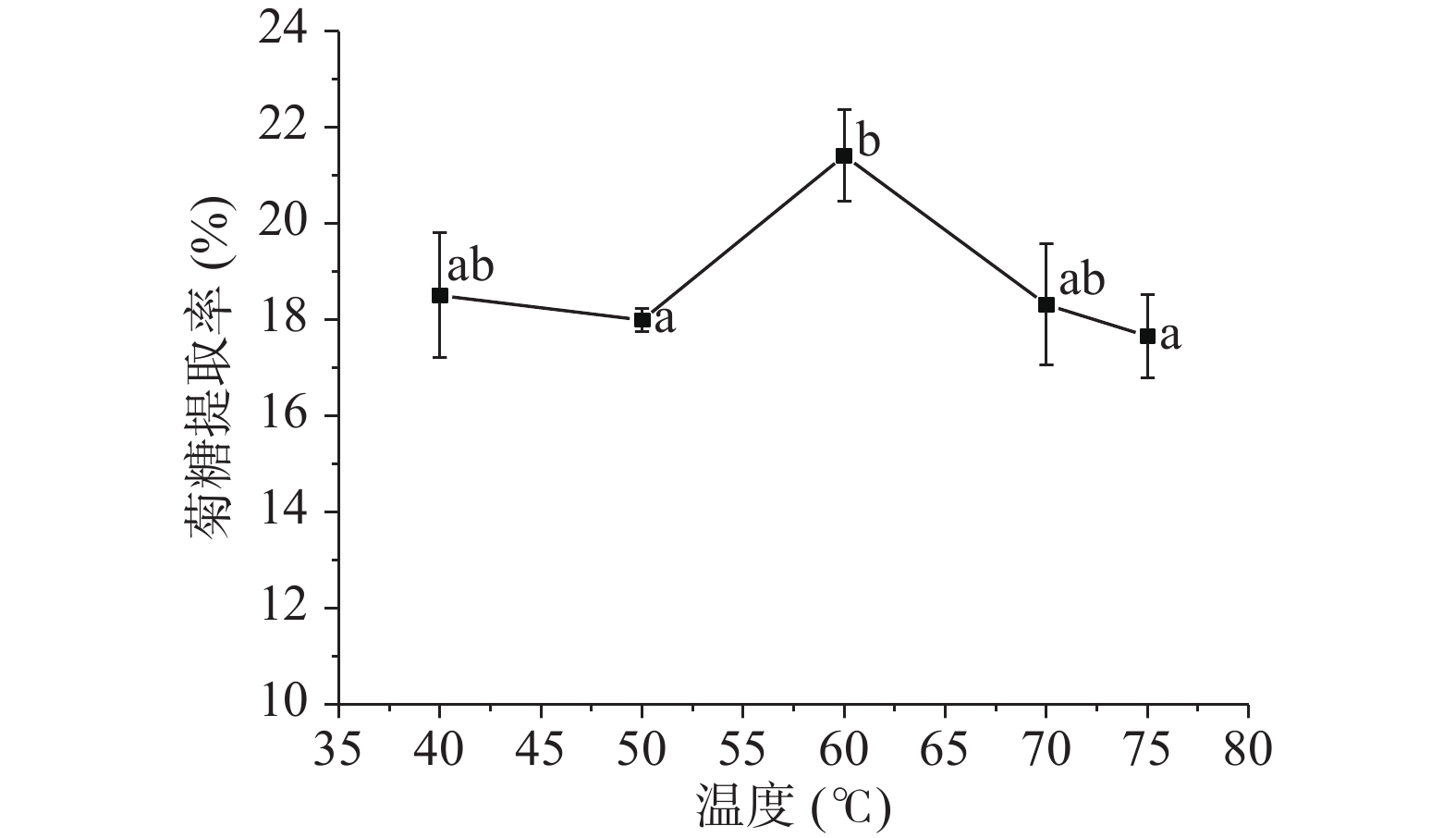
2.1.1.3 超声温度对菊糖提取率的影响
由图3可知,菊糖提取率随温度的增加呈先上升后下降的趋势,在50~60℃时,菊糖提取率显著升高(P<0.05),增加温度到75℃时,菊糖提取率显著降低(P<0.05)。原因是随着温度的增加,样品中的菊糖开始溶出,但温度达到一定值时,菊糖已充分溶出,同时高温会使菊糖发生分解,从而导致菊糖提取率的降低[30]。
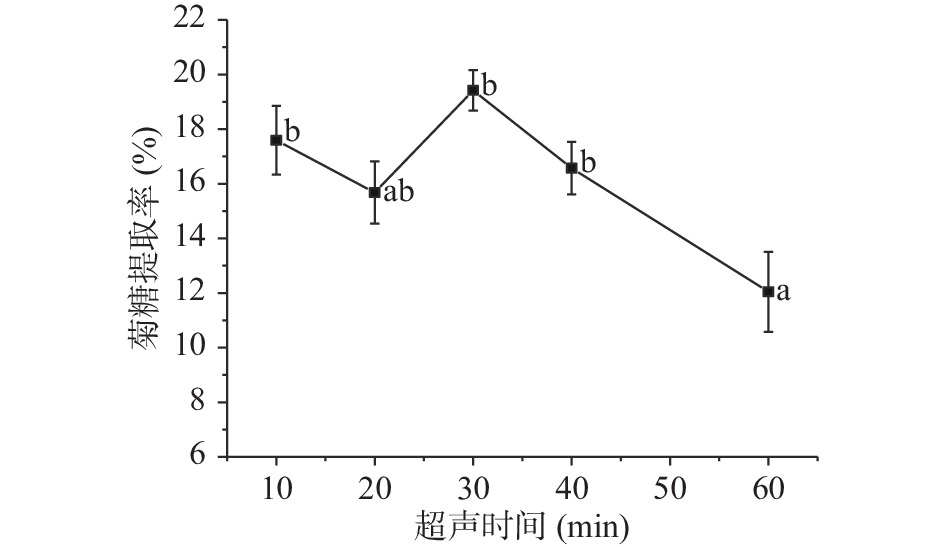
2.1.1.4 超声时间的影响
由图4可知,在10~30 min时,随着超声时间的增加,菊糖提取率也逐渐升高,超声时间为30 min时,菊糖提取率达到最大,可能是因为超声时间不足时,菊糖未能充分溶出,但时间达到60 min时,提取率显著下降(P<0.05),可能是由于提取时间过长,导致菊糖发生了分解,使菊糖的提取率降低[31]。
2.1.2 响应面试验结果
2.1.2.1 Box-Behnken实验设计与结果
利用Design Expert 10对蒲公英橡胶草中菊糖提取率进行响应面设计,响应面设计及结果见表2。其中1~20为析因实验,21~25为5个中心实验[32]。
表 2 响应面设计及结果Table 2. Design and results of response surface experiment试验号 液料比
(A)超声功率
(B)超声温度
(C)超声时间
(D)提取率
(%)1 −1 −1 0 0 17.59 2 1 −1 0 0 16.68 3 −1 1 0 0 16.64 4 1 1 0 0 17.81 5 0 0 −1 −1 15.5 6 0 0 1 −1 13.38 7 0 0 −1 1 15.35 8 0 0 1 1 18.38 9 −1 0 0 −1 16.52 10 1 0 0 −1 16.77 11 −1 0 0 1 18.72 12 1 0 0 1 18.12 13 0 −1 −1 0 15.1 14 0 1 −1 0 15.41 15 0 −1 1 0 15.55 16 0 1 1 0 12.89 17 −1 0 −1 0 16.91 18 1 0 −1 0 16.21 19 −1 0 1 0 14.39 20 1 0 1 0 16.52 21 0 −1 0 −1 17.8 22 0 1 0 −1 18.01 23 0 −1 0 1 18.65 24 0 1 0 1 16.61 25 0 0 0 0 21.18 26 0 0 0 0 19.96 27 0 0 0 0 19.87 28 0 0 0 0 19.91 29 0 0 0 0 19.46 对表2中数据进行回归分析,得到回归方程:菊糖提取率=−1.29+1.37×10−3A+2.94×10−3B+0.037C+2.06×10−3D+8.67×10−6AB+7.08×10−5AC−2.13×10−5AD−1.24×10−5BC−9.38×10−6BD+1.29×10−4CD−1.16×10−4A2−4.65×10−6B2−3.32×10−4C2−1.04×10−4D2。对实验结果进行方差分析,结果见表3。
表 3 模型方差分析Table 3. Variance analysis of the model方差
来源平方和 自由度 均方 F P 显著性 模型 0.01 14 7.21×10−4 9.33 < 0.0001 显著 A-液料比 8.98×10−6 1 8.98×10−6 0.12 0.7382 B-超声功率 1.33×10−3 1 1.33×10−3 17.19 0.001 C-超声温度 4.34×10−3 1 4.34×10−3 56.08 < 0.0001 D-超声时间 2.04×10−5 1 2.04×10−5 0.26 0.6153 AB 1.08×10−4 1 1.08×10−4 1.4 0.2565 AC 2.00×10−4 1 2.00×10−4 2.59 0.1298 AD 1.81×10−5 1 1.81×10−5 0.23 0.6363 BC 2.21×10−4 1 2.21×10−4 2.85 0.1133 BD 1.27×10−4 1 1.27×10−4 1.64 0.2215 CD 6.63×10−4 1 6.63×10−4 8.58 0.011 A2 8.69×10−4 1 8.69×10−4 11.25 0.0047 B2 1.82×10−3 1 1.82×10−3 23.55 0.0003 C2 7.15×10−3 1 7.15×10−3 92.43 < 0.0001 D2 7.03×10−4 1 7.03×10−4 9.1 0.0092 残差 1.08×10−3 14 7.73×10−5 失拟项 9.14×10−4 10 9.14×10−5 2.17 0.2363 不显著 纯误差 1.68×10−4 4 4.20×10−5 总误差 0.011 28 由表3可知,模型的F值为9.33,P<0.0001,模型极显著,失拟项误差不显著(P=0.2363>0.05),说明模型对响应值拟合良好。模型决定系数R2=0.9032,R2Adj=0.8063,说明该模型拟合度良好。通过表中F值的大小可以得出各因素对蒲公英橡胶草菊糖提取率影响的大小为:C(超声温度)>B(超声功率)>D(超声时间)>A(液料比)。
2.1.2.2 提取工艺的响应面优化与分析
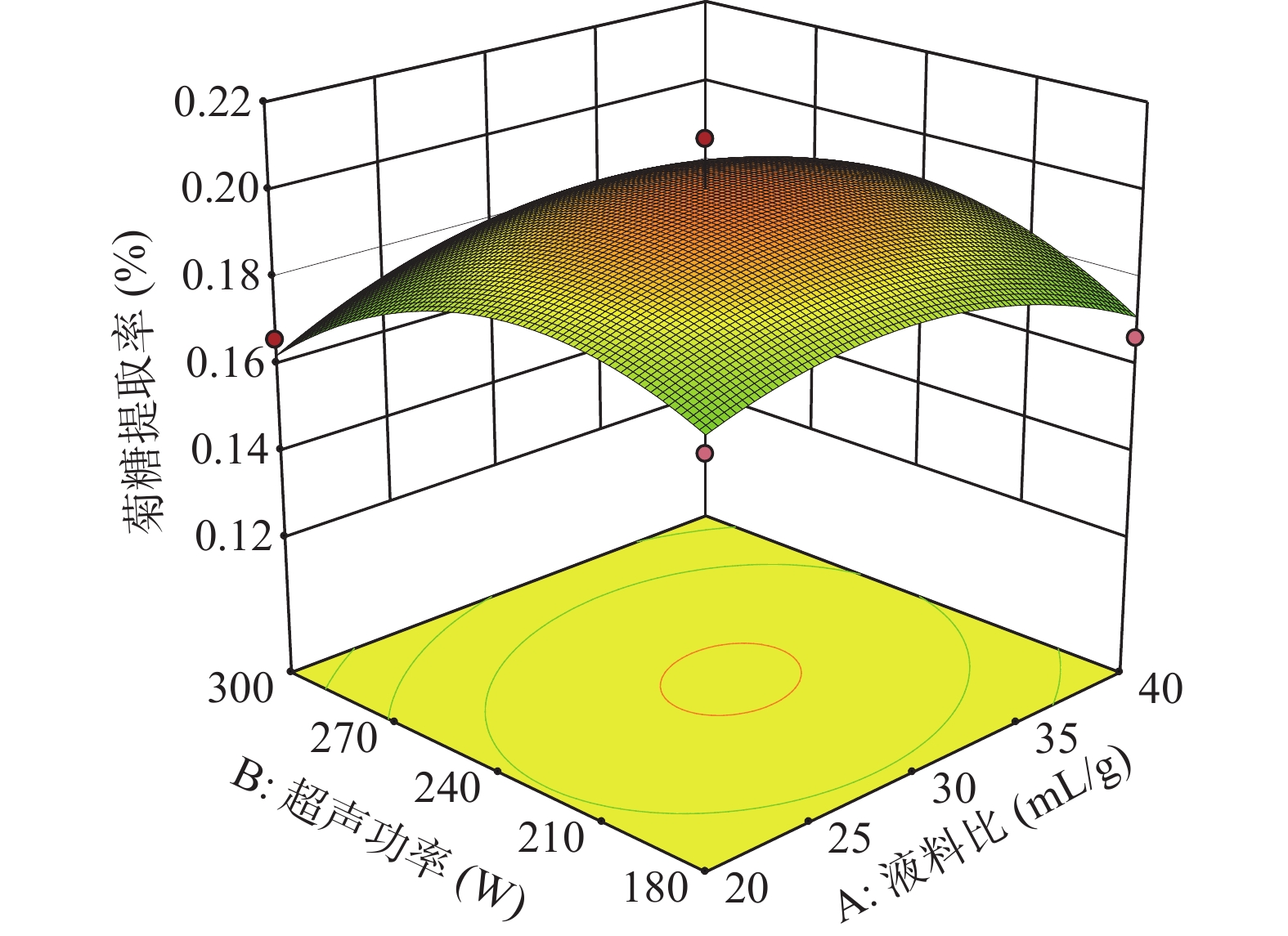
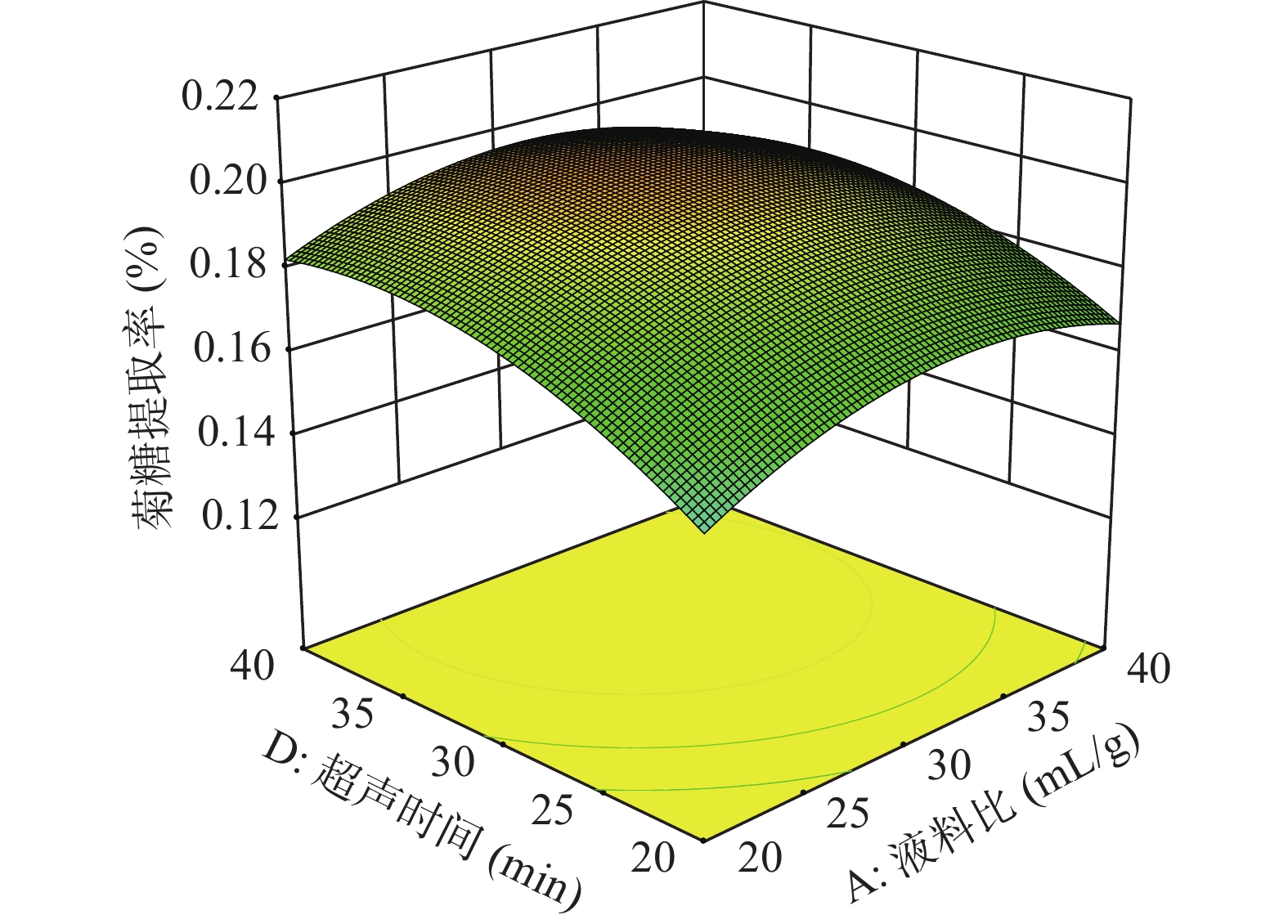
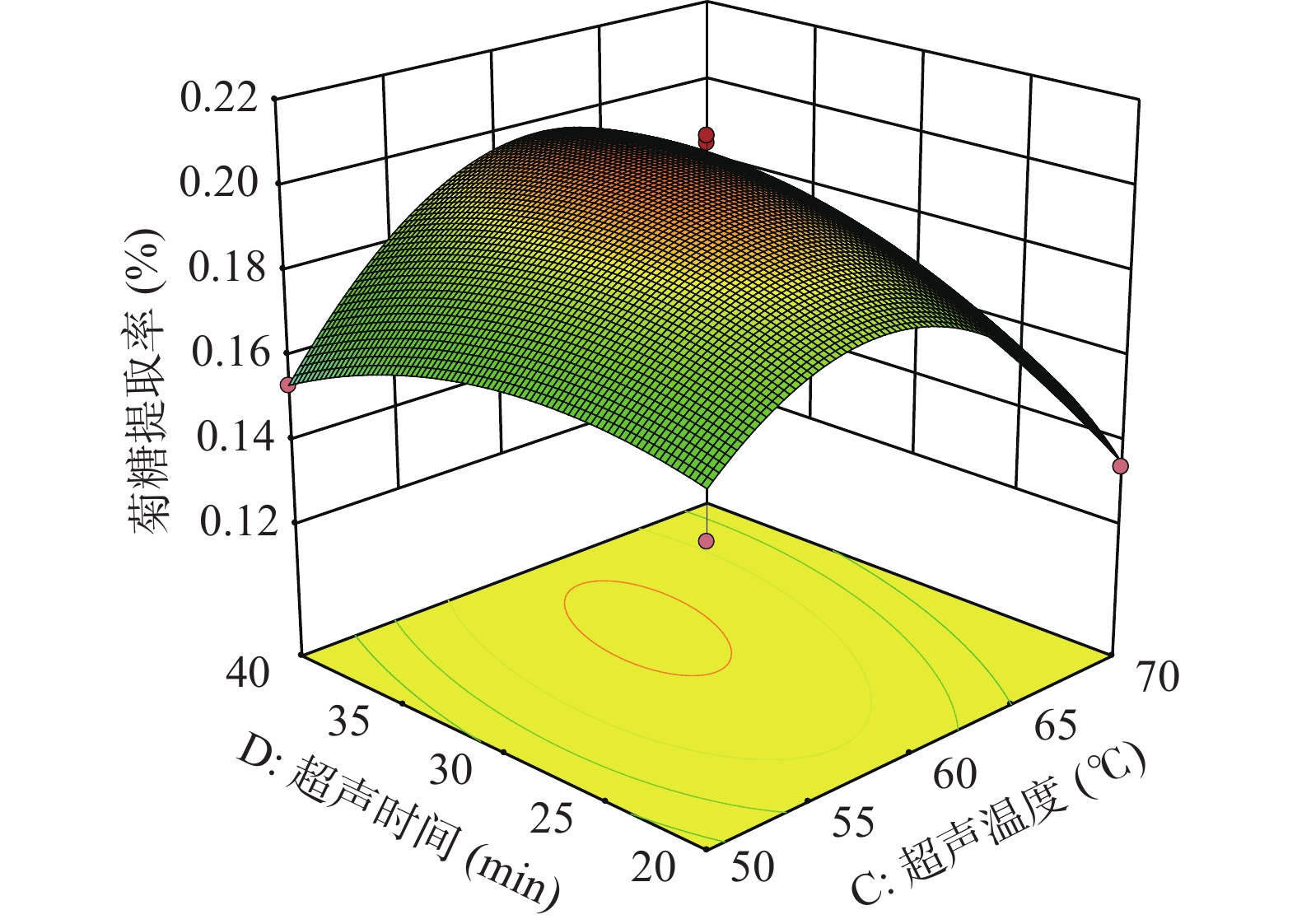
以提取率的回归方程为依据,获得了菊糖提取的响应面图和等高线图,通过控制其中两个因素不变,探究另外两个交互因素与提取率之间的关系。
分析图5~图10,可看出超声功率、液料比、超声温度与超声时间四因素间的响应曲面均为凸面且曲面均较为陡峭,说明四因素之间的交互作用对菊糖提取率的影响明显。
2.1.2.3 提取参数优化与验证实验
通过Design Expert10软件对数据进一步分析,得到模型的最优参数为液料比(mL/g)=29.87:1,超声功率229.25 W,提取温度60.54 ℃,提取时间33.98 min,在此条件参数下,模型预测提取率为20.23%。为了实验操作方便,将上述所得条件参数修正为液料比=30:1(mL/g)、功率:230 W、温度:61 ℃、时间:34 min。在此条件下进行三次验证实验,得到实际提取率为20.14%±0.19%,与理论预测值非常接近,说明优化后结果可靠。
2.2 蒲公英橡胶草菊糖的纯化
采用三种方法脱蛋白的结果见表4,根据蛋白清除率及菊糖损失率进行比较分析,发现氢氧化钙-磷酸法为最佳纯化方法。
表 4 菊糖脱蛋白所用的方法比较Table 4. Comparative study on methods of deproteinization of inulin方法 氢氧化钙-磷酸法 三氯乙酸法 Sevage法 蛋白清除率(%) 90.78 94.63 62.6 菊糖损失率(%) 26.44 50.15 14.58 2.3 菊糖产品
将纯化后的提取液通过大孔树脂清除色素后[33],检测计算得出:脱色率:66.65%,菊糖损失率:16.83%,蛋白清除率:59.27%。将脱蛋白后的菊糖提取液经大孔吸附树脂脱色、旋蒸浓缩后醇沉5次,再经过冷冻干燥得到白色固体粉末状菊糖成品(图11)。经检测,成品中菊糖含量为80.8%。
2.4 MALDI-TOF MS表征结果
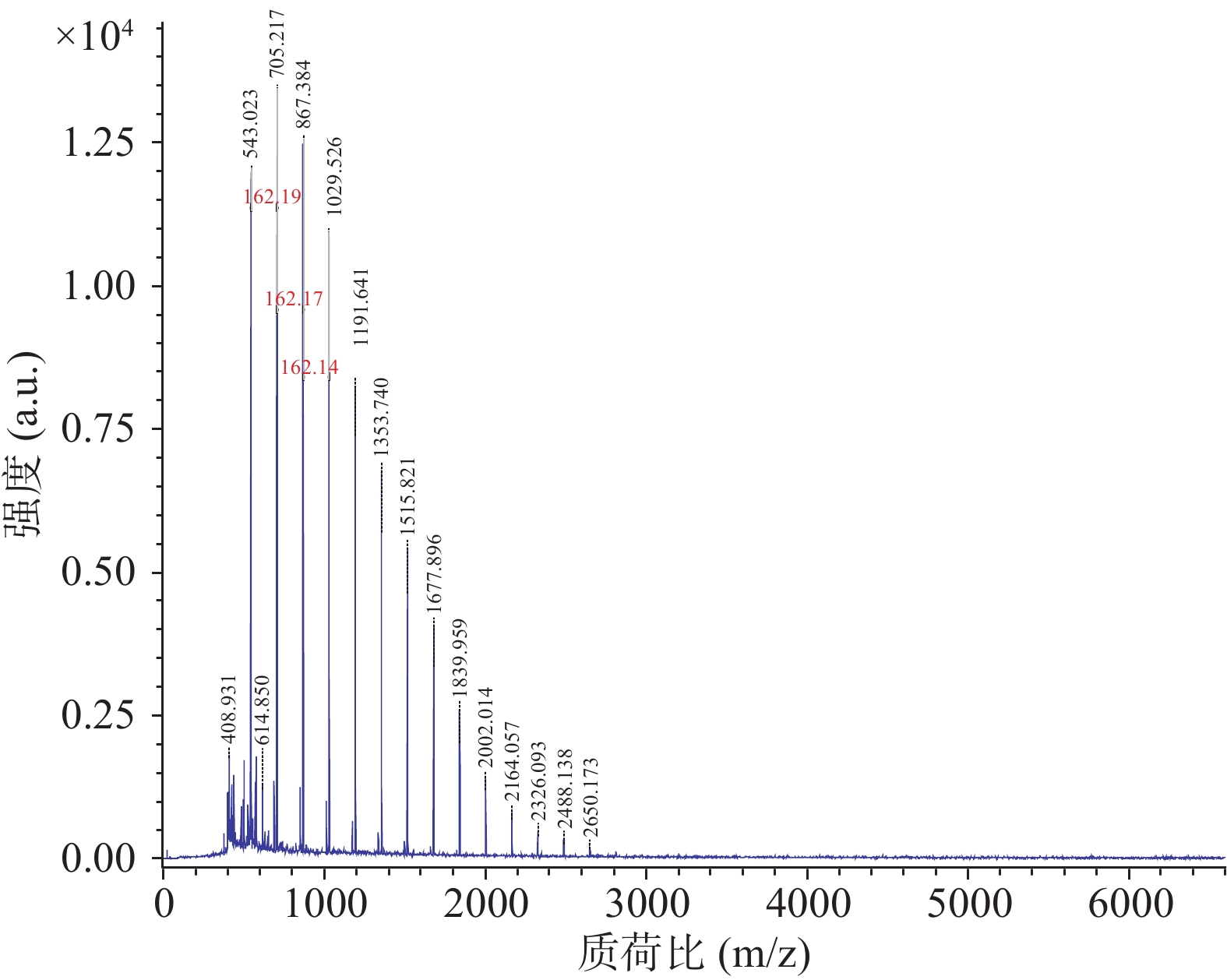
分别对菊糖样品进行了反射模式和线性模式采集,并对反射模式下的两个分子量为1029和867的聚糖进行二级图谱分析,见图12~图15,在所设条件下,可以检测到聚合度范围为2~30,初步确定单体的分子量为162,为一个果糖脱去一分子水的分子量,端基的分子量和为179,与菊糖分子结构信息相吻合[34],如需进一步确定其结构组成及聚合度,需要对菊糖进行不同聚合度分离处理。
3. 结论
以蒲公英橡胶草干根为菊糖提取原材料,采用超声波法对蒲公英橡胶草根菊糖进行提取;不仅分析了蒲公英橡胶草菊糖的提取、提纯等工艺过程,还讨论分析了超声功率、超声时间、超声温度和液料比对菊糖提取率的影响。基于单因素实验的结果,进行了响应面试验,得到菊糖提取的最佳工艺条件:液料比(mL/g)=30:1、功率:230 W、温度:61℃、时间:34 min,在此条件下,模型预测的菊糖提取率为20.23%,实际菊糖提取率为20.14%±0.19%,与预测值相比,相对误差仅为0.45%,说明优化结果可靠。经超声提取后的菊糖粗提液里面还含有大量杂质,需经纯化除去,因此,本研究分别采用了三氯乙酸法、Sevage法、氢氧化钙-磷酸法对菊糖粗提液进行纯化。根据纯化后溶液的菊糖损失率及蛋白清除率进行比较,发现氢氧化钙-磷酸法是最佳的纯化方法,其蛋白清除率可达90.78%,菊糖损失率为26.44%。提取的成品中菊糖含量达80.8%,经MALDI-TOF MS进行分析,其杂质较少,在所设条件下,单体的分子量为162,端基的分子量和为179,聚合度在2~30。
本研究为蒲公英橡胶草的进一步综合利用提供理论依据,为天然高分子聚合物相对分子质量的测定提供参考,并为菊糖进一步的结构分析奠定了基础,具有一定的指导价值和实践意义。
-
表 1 响应面试验设计因素水平表
Table 1 Factors and levels table of response surface experiment
水平 A
液料比(mL/g)B
超声功率(W)C
超声温度(℃)D
超声时间(min)−1 20:1 180 50 20 0 30:1 240 60 30 1 40:1 300 70 40 表 2 响应面设计及结果
Table 2 Design and results of response surface experiment
试验号 液料比
(A)超声功率
(B)超声温度
(C)超声时间
(D)提取率
(%)1 −1 −1 0 0 17.59 2 1 −1 0 0 16.68 3 −1 1 0 0 16.64 4 1 1 0 0 17.81 5 0 0 −1 −1 15.5 6 0 0 1 −1 13.38 7 0 0 −1 1 15.35 8 0 0 1 1 18.38 9 −1 0 0 −1 16.52 10 1 0 0 −1 16.77 11 −1 0 0 1 18.72 12 1 0 0 1 18.12 13 0 −1 −1 0 15.1 14 0 1 −1 0 15.41 15 0 −1 1 0 15.55 16 0 1 1 0 12.89 17 −1 0 −1 0 16.91 18 1 0 −1 0 16.21 19 −1 0 1 0 14.39 20 1 0 1 0 16.52 21 0 −1 0 −1 17.8 22 0 1 0 −1 18.01 23 0 −1 0 1 18.65 24 0 1 0 1 16.61 25 0 0 0 0 21.18 26 0 0 0 0 19.96 27 0 0 0 0 19.87 28 0 0 0 0 19.91 29 0 0 0 0 19.46 表 3 模型方差分析
Table 3 Variance analysis of the model
方差
来源平方和 自由度 均方 F P 显著性 模型 0.01 14 7.21×10−4 9.33 < 0.0001 显著 A-液料比 8.98×10−6 1 8.98×10−6 0.12 0.7382 B-超声功率 1.33×10−3 1 1.33×10−3 17.19 0.001 C-超声温度 4.34×10−3 1 4.34×10−3 56.08 < 0.0001 D-超声时间 2.04×10−5 1 2.04×10−5 0.26 0.6153 AB 1.08×10−4 1 1.08×10−4 1.4 0.2565 AC 2.00×10−4 1 2.00×10−4 2.59 0.1298 AD 1.81×10−5 1 1.81×10−5 0.23 0.6363 BC 2.21×10−4 1 2.21×10−4 2.85 0.1133 BD 1.27×10−4 1 1.27×10−4 1.64 0.2215 CD 6.63×10−4 1 6.63×10−4 8.58 0.011 A2 8.69×10−4 1 8.69×10−4 11.25 0.0047 B2 1.82×10−3 1 1.82×10−3 23.55 0.0003 C2 7.15×10−3 1 7.15×10−3 92.43 < 0.0001 D2 7.03×10−4 1 7.03×10−4 9.1 0.0092 残差 1.08×10−3 14 7.73×10−5 失拟项 9.14×10−4 10 9.14×10−5 2.17 0.2363 不显著 纯误差 1.68×10−4 4 4.20×10−5 总误差 0.011 28 表 4 菊糖脱蛋白所用的方法比较
Table 4 Comparative study on methods of deproteinization of inulin
方法 氢氧化钙-磷酸法 三氯乙酸法 Sevage法 蛋白清除率(%) 90.78 94.63 62.6 菊糖损失率(%) 26.44 50.15 14.58 -
[1] 于纯淼, 于栋华, 刘晓艳, 等. 牛蒡菊糖的研究进展[J]. 食品研究与开发,2010,31(21):272−275. [YU C M, YU D H, LIU X Y, et al. Research progress of inulin from Arctium lappa L. tubers[J]. Food Research and Development,2010,31(21):272−275. YU C M, YU D H, LIU X Y, et al. Research progress of inulin from Arctium lappa L. tubers[J]. Food Research and Development, 2010, 31(21): 272-275. ]
[2] 熊政委, 罗倩倩, 惠俊敏, 等. 菊糖在油脂类食品中的应用及其抗氧化性的研究进展[J]. 食品工业科技,2019,40(15):318−321. [XIONG Z W, LUO Q Q, HUI J M, et al. Research progress of the application of inulin in fat food and its antioxidant activity[J]. Science and Technology of Food Industry,2019,40(15):318−321. XIONG Z W, LUO Q Q, HUI J M, et al. Research progress of the application of inulin in fat food and its antioxidant activity[J]. Science and Technology of Food Industry, 2019, 40(15): 318-321. ]
[3] 商婷婷, 张敏杰, 李天凤, 等. 高等植物中菊糖的研究进展[J]. 海峡药学,2019,31(11):1−5. [SHANG T T, ZHANG M J, LI T F, et al. Advances on research and biological activity of inulin-type fructan in higher plants[J]. Strait Pharmaceutical Journal,2019,31(11):1−5. doi: 10.3969/j.issn.1006-3765.2019.11.001 SHANG T T, ZHANG M J, LI T F, et al. Advances on research and biological activity of inulin-type fructan in higher plants[J]. Strait Pharmaceutical Journal, 2019, 31(11): 1-5. ] doi: 10.3969/j.issn.1006-3765.2019.11.001
[4] 李琬聪. 菊芋中不同聚合度天然菊糖的分离纯化及生物活性研究[D]. 烟台: 中国科学院烟台海岸带研究所, 2015: 4−5. LI W C. Separation, purification and bioactivity of natural inulin withdifferent degrees of polymerization in Jerusalem artichoke[D]. YanTai: Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, 2015: 4−5.
[5] ZHU Z, HE J, LIU G, et al. Recent insights for the green recovery of inulin from plant food materials using non-conventional extraction technologies: A review[J]. Innovative Food ence Emerging Technologies,2016,33:1−9. doi: 10.1016/j.ifset.2015.12.023
[6] SINGH J, RIVENSON A, TOMITA M, et al. Bifidobacterium longum, a lactic acid-producing intestinal bacterium inhibits colon cancer and modulates the intermediate biomarkers of colon carcinogenesis[J]. Carcinogenesis,1997,18:1371−1377. doi: 10.1093/carcin/18.7.1371
[7] BUDDINGTON K K, DONAHOO J B, BUDDINGTON R K. Dietary oligofructose and inulin protect mice from enteric and systemic pathogens and tumor inducers[J]. Journal of Nutrition,2002,132(3):472−477. doi: 10.1093/jn/132.3.472
[8] 张泽生, 刘亚萍, 李雨蒙, 等. 菊粉的研究与开发[J]. 中国食品添加剂,2017(10):183−188. [ZHANG Z S, LIU Y P, LI Y M, et al. The research and development of Inulin[J]. China Food Additives,2017(10):183−188. doi: 10.3969/j.issn.1006-2513.2017.10.025 ZHANG Z S, LIU Y P, LI Y M, et al. The research and development of Inulin [J]. China Food Additives, 2017 (10): 183-188. ] doi: 10.3969/j.issn.1006-2513.2017.10.025
[9] WAN X, GUO H, LIANG Y, et al. The physiological functions and pharmaceutical applications of inulin: A review[J]. Carbohydr Polym,2020,246:116589. doi: 10.1016/j.carbpol.2020.116589
[10] 王友法, 曾斯杰, 宋小平, 等. 菊糖提取工艺及其应用研究进展[J]. 中国调味品,2019,44(6):199−203. [WANG Y F, ZENG S J, SONG X P, et al. Research progress of inulin extraction technology and its application[J]. China Condiment,2019,44(6):199−203. WANG Y F, ZENG S J, SONG X P, et al. Research progress of inulin extraction technology and its application [J]. China Condiment, 2019, 44(6): 199-203. ]
[11] 李苗, 郑国保, 朱金霞, 等. 橡胶草资源利用及其天然橡胶合成分子机理研究进展[J]. 分子植物育种印刷版,2018,16(10):3423−3429. [LI M, ZHENG G B, ZHU J X, et al. Research advances on taraxacum kok-saghyz resource utilization and molecular mechanismof natural rubber synthesis[J]. Molecular Plant Breeding,2018,16(10):3423−3429. LI M, ZHENG B G, ZHU J X, et al. Research advances on taraxacum kok-saghyz resource utilization and molecular mechanismof natural rubber synthesis [J]. Molecular Plant Breeding, 2018, 16(10): 3423-3429. ]
[12] RAMIREZ-CADAVID DAVID A, CORNISH K, MICHEL F C. Taraxacum kok-saghyz(TK): Compositional analysis of a feedstock for natural rubber and other bioproducts[J]. Industrial Crops and Products,2017,107:624−640. doi: 10.1016/j.indcrop.2017.05.043
[13] 崔树阳, 张继川, 张立群, 等. 蒲公英橡胶产业的研究现状与未来展望[J]. 中国农学通报,2020,36(10):33−38. [CUI S Y, ZHANG J C, ZHANG L Q, et al. Research status and future prospect of Taraxacum kok-saghyz(TKS) rubber industry[J]. Chinese Agricultural Science Bulletin,2020,36(10):33−38. doi: 10.11924/j.issn.1000-6850.casb18120080 CUI S Y, ZHANG J C, ZHANG L Q, et al. Research status and future prospect of taraxacum kok-saghyz ( TKS ) rubber industry [J]. Chinese Agricultural Science Bulletin, 2020, 36(10): 33-38. ] doi: 10.11924/j.issn.1000-6850.casb18120080
[14] ZHANG N, GUO T Y, MA X, et al. Rational rubber extraction and simultaneous determination of rubber content and molecular weight distribution in taraxacum kok-saghyz rodin by size-exclusion chromatography[J]. Chromatographia,2019,82(10):1459−1466. doi: 10.1007/s10337-019-03773-2
[15] RAMIREZ-CADAVID D A, CORNISH K, HATHWAIK U, et al. Development of novel processes for the aqueous extraction of natural rubber fromTaraxacum kok-saghyz(TK)[J]. Journal of Chemical Technology & Biotechnology,2019,94(8):2452−2464.
[16] WEI L, WANG J, ZHENG X, et al. Studies on the extracting technical conditions of inulin from Jerusalem artichoke tubers[J]. Journal of Food Engineering,2007,79(3):1087−1093. doi: 10.1016/j.jfoodeng.2006.03.028
[17] EL-KHOLY W M, AAMER R A, ALI A N A. Utilization of inulin extracted from chicory(Cichorium intybus L.) roots to improve the properties of low-fat synbiotic yoghurt[J]. Annals of Agricultural Sciences,2020,65(1):59−67. doi: 10.1016/j.aoas.2020.02.002
[18] 范三红, 李静, 王亚云, 等. 超声波辅助复合酶提取菊糖工艺优化[J]. 食品科学,2015,36(4):23−28. [FAN S H, LI J, WANG Y Y, et al. Optimization of ultrasonic-assisted enzymatic extraction of inulin by response surface methodology[J]. Food Science,2015,36(4):23−28. doi: 10.7506/spkx1002-6630-201504005 FAN S H, LI J, WANG Y Y, et al. Optimization of Ultrasonic-assisted Enzymatic Extraction of Inulin by Response Surface Methodology [J]. Food Science, 2015, 36(4): 23-28. ] doi: 10.7506/spkx1002-6630-201504005
[19] 戚克进, 程贤阳, 郝肖, 等. 大孔树脂对低聚半乳糖的脱色研究[J]. 中国食品添加剂,2017(8):122−126. [QI K J, CHENG X Y, HE X, et al. Study on decoloration of the galacto-oligosaccharides mixture by macroporous resin[J]. China Food Additives,2017(8):122−126. doi: 10.3969/j.issn.1006-2513.2017.08.014 QI K J, CHENG X Y, HE X, et al. Study on decoloration of the galacto-oligosaccharides mixture by macroporous resin [J]. China Food Additives, 2017 (8): 122-126. ] doi: 10.3969/j.issn.1006-2513.2017.08.014
[20] 刘燕, 陈小银, 杨丽丽, 等. 响应面优化菊芋菊糖的提取工艺研究[J]. 植物研究,2016,36(4):627−633. [LIU Y, CHEN X Y, YANG L L, et al. Extraction process optimization of inulin from Helianthus tuberosus L. by response surface methodology[J]. Bulletin of Botanical Research,2016,36(4):627−633. doi: 10.7525/j.issn.1673-5102.2016.04.020 LIU Y, CHEN X Y, YANG L L, et al. Extraction process optimization of inulin from Helianthus tuberosus L by response surface methodology [J]. Bulletin of Botanical Research, 2016, 36(4): 627-633. ] doi: 10.7525/j.issn.1673-5102.2016.04.020
[21] RAMALKSHMI S T K. Microwave-assisted extraction of inulin from chicory roots using response surface methodology [J]. 2015, 5(1): 1−6.
[22] ZARROUG Y O, ABDELKARIM A, DORRA S T, et al. Biochemical characterization of tunisian Cichorium intybus L. roots and optimization of ultrasonic inulin extraction[J]. Mediterranean Journal of Chemistry,2016,6(1):674−685. doi: 10.13171/mjc61/01611042220-zarroug
[23] 仝瑛. 菊芋菊糖的提取纯化、抗氧化活性及菊糖复合饮料工艺研究[D]. 西安: 西北大学, 2010: 16−27. TONG Y. Study on extraction purification and antioxidation of inulin of Jerusalem artichoke and the processing technology of inulinompound drink[D]. Xi'an: Northwest University, 2010: 16−27.
[24] 赵琳静, 李洪森, 陈婷婷, 等. 菊芋菊糖含量的测定[J]. 化工生产与技术,2010,17(4):43−45. [ZHAO L J, LI H S, CHEN T T, et al. Determination of inulin in Jerusalem artichoke[J]. Chemical Production and Technology,2010,17(4):43−45. doi: 10.3969/j.issn.1006-6829.2010.04.0014 ZHAO L J, LI H S, CHEN T T, et al. Determination of inulin in Jerusalem artichoke [J]. Chemical Production and Technology, 2010, 17(4): 43-45. ] doi: 10.3969/j.issn.1006-6829.2010.04.0014
[25] 黄婉玉, 曹炜, 李菁, 等. 考马斯亮蓝法测定果汁中蛋白质的含量[J]. 食品与发酵工业,2009,35(5):160−162. [HUANG W Y, CAO W, LI J, et al. Determination of protein content in juice by coomassie brilliant blue[J]. Food and Fermentation Industries,2009,35(5):160−162. HUANG W Y, CAO W, LI J, et al. Determination of protein content in juice by coomassie brilliant blue [J]. Food and Fermentation Industries, 2009, 35(5): 160-162. ]
[26] WANG X L, ZHANG C, OUYANG P. The possibility of separating saccharides from a NaCl solution by using nanofiltration in diafiltration mode[J]. Journal of Membrane Science,2002,204(1-2):271−281. doi: 10.1016/S0376-7388(02)00050-9
[27] 张忠华. 菊芋多糖的提取、分离、纯化及分析研究[D]. 长春: 吉林大学, 2015: 28−36. ZHANG Z H. Jerusalem artichoke extract polysaccharides, separation, purification and analysis[D]. Changchun: Jilin University, 2015: 28−36.
[28] 冯艳波. 阿拉尔骏枣多糖的提取及其生物活性研究[D]. 阿拉尔: 塔里木大学, 2014: 20−33. FENG Y B. Study on the extraction and biological activity of polysaccharides of Alar Zizyphus jujuba Mill. cv. junzao[D]. Alar: Tarim University, 2014: 20−33.
[29] 李丹. 苯酚-硫酸法测定食品总糖方法的应用和改进[J]. 中国卫生检验杂志,2003,13(4):506−506. [LI D. Application and improvement of phenol sulfuric acid method for determination of total sugar in food[J]. Chinese Journal of Health Laboratory Technology,2003,13(4):506−506. doi: 10.3969/j.issn.1004-8685.2003.04.070 LI D. Application and improvement of phenol sulfuric acid method for determination of total sugar in food [J]. Chinese Journal of Health Laboratory Technology, 2003, 13(4): 506-506. ] doi: 10.3969/j.issn.1004-8685.2003.04.070
[30] 徐孝梁. 牛蒡根有效成分工业化提取技术研究及牛蒡饮料的制备[D]. 济南: 齐鲁工业大学, 2015: 14−34. XU X L. Research on thetechnologies in industrial extraction of active ingredients in burdock root and the preparation of burdock beverage[D]. Jinan: Qilu University of Technology, 2015: 14−34.
[31] 张静, 温暖, 刘阳洋, 等. 蒲公英根多糖提取及蒲公英多糖饮料的研制[J]. 农产品加工,2018(1):13−17. [ZHANG J, WEN N, LIU Y Y, et al. Extraction of polysaccharide from the dandelion root and development of its beverage[J]. Farm Products Processing,2018(1):13−17. ZHANG J, WEN N, LIU Y Y, et al. Extraction of polysaccharide from the dandelion root and development of its beverage [J]. Farm Products Processing, 2018(1): 13-17. ]
[32] 王鑫斌, 董玉玮, 张文静, 等. 牛蒡-芦笋茶加工工艺对菊糖提取率影响的研究[J]. 科技风,2020(19):182−183,186. [WANG X B, DONG Y W, ZHANG W J, et al. Effect of processing technology of burdock-asparagus tea on extraction rate of inulin[J]. Technology Wind,2020(19):182−183,186. [WANG X B, DONG Y W, ZHANG W J, et al. Effect of processing technology of burdock asparagus tea on extraction rate of inulin [J]. Technology Wind, 2020(19): 182-183, 186.
[33] 李丹丹, 金征宇. 牛蒡菊糖脱色工艺的研究[J]. 农业工程学报,2007(8):241−244. [LI D D, JIN Z Y. De-coloration technology of burdock oligosaccharide[J]. Transactions of the Chinese Society of Agricultural Engineering,2007(8):241−244. doi: 10.3321/j.issn:1002-6819.2007.08.044 [LI D D, JIN Z Y. De-coloration technology of burdock oligosaccharide [J]. Transactions of the Chinese Society of Agricultural Engineering, 2007(8): 241-244. doi: 10.3321/j.issn:1002-6819.2007.08.044
[34] LI J, ZHANG X, CAO L, et al. Three inulin-type fructans from Codonopsis pilosula(Franch.) Nannf. roots and their prebiotic activity on Bifidobacterium longum[J]. J Molecules,2018,23(12):3123. doi: 10.3390/molecules23123123
-
期刊类型引用(8)
1. 张娜,刘丽,李璐,吕京京,董益阳. 青胶蒲公英根多酚超声辅助提取工艺优化及其体外抗氧化、降糖活性. 食品工业科技. 2024(17): 200-208 .  本站查看
本站查看
2. 石爱文,姚佳靖,王庆,张玉珊,王雷,边帅杰,刘莉,齐滨. 蒲公英化学成分和药理作用研究进展及其质量标志物预测分析. 中华中医药学刊. 2024(09): 38-45+259 .  百度学术
百度学术
3. 刘书伟,沈梦霞,王燕,张田田,武天明. 海绵Hyrtios erectus抗氧化产物超声提取工艺优化及其抗氧化活性分析. 食品工业科技. 2023(09): 236-243 .  本站查看
本站查看
4. 夏娇艳,刘兵帅,杨起航,何欢,李鸿彬,谢全亮. 菊糖特性及提取工艺的研究进展. 食品科技. 2023(05): 178-184 .  百度学术
百度学术
5. 赵丽明,郭煦遥,毛英民,赵大庆,黄宝泰,李佳奇,刘莉,齐滨. 响应面法优化西洋参果多糖的提取工艺及其体外抗氧化活性. 食品工业科技. 2023(13): 160-166 .  本站查看
本站查看
6. 刘佳维,张雪茹,罗付禹,王宣,才玉婷. 平贝母多糖的提取工艺及其体外抗氧化活性研究. 食品工业. 2023(08): 39-44 .  百度学术
百度学术
7. 梁晶,何星璐,萨日那,韩佳欢,周围,耿丽晶. 发酵紫薯冻干粉的研制及其在低糖低脂奶片中的应用. 保鲜与加工. 2022(06): 44-52 .  百度学术
百度学术
8. 杨庆丽,张正海,魏连会,李国巍,姬妍茹. 菊芋中5-羟甲基糠醛形成动力学分析. 食品工业. 2022(09): 22-24 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:











 下载:
下载:



