Optimization of Extraction Process and Antioxidant Activity of Polysaccharide from Panax quinquefolium Fruit by Response Surface Methodology
-
摘要: 目的:对西洋参果实中的多糖进行提取,结合响应面法对提取工艺进行优化,并对西洋参果多糖是否具有体外抗氧化活性进行研究。方法:本研究以新鲜的西洋参果实为原料,采用了水提醇沉法提取其中的多糖。用单因素实验以及响应面法对提取工艺进行了优化。从DPPH自由基清除率、羟基自由基清除率以及还原能力三个方面进行果多糖的体外抗氧化活性研究。结果:最佳工艺参数为:提取时间为2.5 h,乙醇浓度为80%,料液比为1:16 g/mL,此时的多糖得率为29.47%±0.65%,与模型预测值相当。在以下三方面考察了西洋参果多糖的体外抗氧化活性:多糖浓度为3.4 mg/mL时,其DPPH自由基清除率达75.14%±0.65%,IC50值为0.71 mg/mL;多糖浓度为3.4 mg/mL时,其羟基自由基的清除率可达71.82%±1.43%,IC50值为0.87 mg/mL;多糖的浓度为1.0 mg/mL时,其总还原力达到了0.730,并且其体外抗氧化能力随西洋参果多糖浓度的增加而增强。结论:抗氧化活性的实验结果说明了西洋参果多糖具有较好的抗氧化活性。本研究可以为西洋参果多糖进一步开发利用奠定理论基础,确保中药资源能够被充分利用。Abstract: Objective: For the extraction of polysaccharides from American ginseng fruits, the extraction process was optimized in combination with response surface methodology, and to investigate whether polysaccharides from American ginseng fruits had antioxidant activity in vitro. Methods: In this study, polysaccharides were extracted from fresh American ginseng fruits by water extraction and alcohol precipitation method. The extraction process was optimized using single factor tests as well as response surface methodology. In vitro antioxidant activity studies of polysaccharides from American ginseng fruits were conducted from three aspects: DPPH radical scavenging rate, hydroxyl radical scavenging rate as well as reducing power. Results: The optimal process parameters were as follows: the extraction time was 2.5 h, the concentration of ethanol was 80%, the feed to liquid ratio of 1:16 g/mL, and the measured average value of polysaccharide yield was 29.47%±0.65%, which was comparable to the model predicted value. In vitro antioxidant activities of polysaccharides from American ginseng fruits were examined in the following three aspects. When the concentration of polysaccharides was 3.4 mg/mL, the DPPH radical scavenging rate was 75.14%±0.65%, and IC50 value was 0.71 mg/mL. When the concentration of polysaccharide was 3.4 mg/mL, the scavenging rate against hydroxyl radicals could reach 71.82%±1.43%, and IC50 value was 0.87 mg/mL. When the concentration of polysaccharides was 1.0 mg/mL, the total reducing power reached 0.730, and its in vitro antioxidant capacity was enhanced with increasing concentrations of polysaccharides from American ginseng fruits. Conclusion: The experimental results of antioxidant activities illustrated that polysaccharides from American ginseng fruits had better antioxidant activities. This study may provide a theoretical basis for further development and utilization of polysaccharides from American ginseng fruits, and ensure that traditional Chinese medicine resources can be fully utilized.
-
西洋参(Panax quinquefolium L.)为五加科人参属植物,是多年生的草本植物,别名为花旗参、西洋人参、美国人参[1-2]。原产自于加拿大和美国。在二十世纪七十年代时,西洋参被引入了我国的东三省以及山东等地区,从此人们接受并开始使用西洋参[3]。中医理论认为,西洋参具有补气不伤阴的功效[4-5]。因而近些年来西洋参在保健食品应用方面深受大众喜爱。大量研究表明,五加科植物的人参的果实,含有皂苷、多糖等多种有效成分。西洋参同为五加科人参属植物,其果实的研究并不广泛。西洋参果为西洋参 (Panax quinquefolium L.)的成熟果实,在8月份果实呈鲜红色。西洋参的果实含有多种成分,如皂苷类、氨基酸、无机物、糖类、蛋白质、肽类、类脂、有机酸和酚类等[6-7],其主要的化学成分为人参皂苷。并且西洋参果实部位含有的皂苷是其根茎中所没有的,这表明西洋参果自身具有值得研究的药用特性。同时多糖在西洋参果中的含量也十分丰富[8],现代研究表明了西洋参果多糖能够显著降低ob/ob小鼠的空腹血糖水平,还可以增加小鼠对葡萄糖的耐受性,并且具有明显的降血糖活性[9]。但是由于现在的中药材市场中对于西洋参果实的需求并不常见,所以导致了在种植采摘过程中大多只取西洋参根部,丢弃其花、叶、果实等部位,这使得中药资源遭到了浪费[10]。
现在的研究报道中多为西洋参多糖的提取工艺研究[11-13],而有关西洋参果多糖提取工艺的研究却寥寥无几。目前的研究中李珊珊等[14]曾用水提醇沉法粗提出了西洋参果总多糖,而运用响应面法优化西洋参果多糖提取工艺及其体外抗氧化活性方面的研究更少。因此本研究以传统的水提醇沉的方法提取西洋参果多糖,利用响应面法优化试验建立多元回归方程,来考察在提取多糖过程中各种因素与得率之间的相关关系,从而得到最佳的提取条件。采用改进了的苯酚硫酸法来进行多糖含量的测定,并对所提取的西洋参果多糖进行体外抗氧化性的研究,目的是为西洋参果多糖的进一步开发和利用奠定理论基础,以此确保中药资源能够充分利用。
1. 材料与方法
1.1 材料与仪器
西洋参果 吉林省白山市西洋参种植基地2021年8月份采收,经长春中医药大学吉林省人参科学研究院中药化学教研室鉴定为西洋参的成熟果实;DPPH、三羟甲基氨基甲烷(Tris)、Griess试剂、水溶性VC、邻氮二菲 Sigma公司;正己烷、无水乙醇(分析纯)、5%苯酚溶液、无水葡萄糖 北京化工厂。
ELx800型酶联免疫检测仪 瑞士TECAN公司;Al204电子天平 Mettler公司;KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;YXQ-lS-30-SII高压灭菌锅 上海博迅实业有限公司;UV-2550紫外-可见分光光度计 日本岛津公司;Gentrifuge 5804R离心机 德国Eppendorf公司。
1.2 实验方法
1.2.1 西洋参果多糖的提取
参照李珊珊等[14]的方法来提取西洋参果多糖:取新鲜的西洋参果实1 kg,除去其中的种子,在得到的西洋参果肉中加入8 L的蒸馏水,将其置于100 ℃的沸水中提取4 h,离心(4500 r/min,10 min)后过滤,留下滤液,将沉淀重复上述步骤提取两次。合并滤液,将其置于60 ℃ 水浴中浓缩至1 L,后冷却至室温。在浓缩液中加入4 L的浓度为80%的乙醇后静置5 h,再离心(4500 r/min,10 min),收集离心后得到的沉淀,向沉淀中加入适量的蒸馏水,待其充分溶解后,再重复上述醇沉的步骤2次。最后得到的沉淀用蒸馏水复溶后冷冻干燥,即得到西洋参果总多糖。多糖得率计算公式如下:
1.2.2 单因素实验
在查阅文献和前期预实验的基础上,选择三个对提取结果影响较大的因素作为参考项:提取时间、水提醇沉时的乙醇浓度和溶剂提取时的料液比。通过进行单因素考察实验,来优化提取西洋参果多糖的工艺。在提取时间2 h,乙醇浓度80%,料液比1:15 g/mL条件下,考察提取时间(1、2、3、4、5 h)、乙醇浓度(75%、80%、85%、90%、95%)、料液比(1:5、1:10、1:15、1:20、1:25 g/mL)对西洋参果多糖得率的影响。
1.2.3 提取工艺的响应面试验
采用Design Expert 10.0.3软件进行三因素三水平的Box-Behnken试验设计[15-18],根据单因素实验的结果,以提取时间(A)、乙醇浓度(B)、料液比(C)为自变量,对西洋参果多糖的提取工艺进行优化。表1为试验因素水平表。
表 1 试验因素水平表Table 1. Table of experimental factor levels水平 因素 A提取时间(h) B乙醇浓度(%) C料液比(g/mL) −1 1 75 1:10 0 2 80 1:15 1 3 85 1:20 1.2.4 多糖含量的测定
1.2.4.1 样品前处理
取西洋参果多糖50 mg,加入2 mL的蒸馏水,充分振摇,使其溶解,再继续定容至100 mL,从其中准确量取2.0 mL放入15 mL的离心管中,继续向离心管中加入8.0 mL无水乙醇,将其混匀,再将离心管放于4 ℃冰箱中,静置过夜。将离心管取出放入离心机中,转速为4000 r/min、温度为24 ℃条件下离心5 min,弃去上清液,上述操作反复4次。用水溶解洗涤后的残渣,定容于10 mL容量瓶中,用于测定粗多糖的纯度。
1.2.4.2 粗多糖含量测定
采用苯酚-硫酸分光光度测定法测定粗多糖[19-20]。葡萄糖标准曲线的绘制:取20.00 mg干燥无水葡萄糖作为对照品,置于200 mL 的容量瓶中,加入2 mL的去离子水溶解对照品粉末,稀释至刻度线,振荡摇匀,得到的即为葡萄糖标准溶液(0.1 mg/mL)。取25.0 mL的比色管,分别量取葡萄糖标准品溶液0.0、0.1、0.2、0.4、0.6、0.8、1.0 mL,添加去离子水至2.0 mL,再加入1.0 mL的5%苯酚溶液,用涡旋混合器混匀10 s。再加入浓硫酸10.0 mL,混匀,时间为35 s。后置于沸水浴中2 min,待自然冷却至21 ℃时,用紫外-可见分光光度计检测样品在485 nm处的吸光度,每个样品平行测定3次。横坐标为葡萄糖浓度,纵坐标为吸光度,以此绘制出葡萄糖标准曲线。
曲线方程为:y=0.0145x+0.0105,R2=0.9996。
取适量前处理后得到的样品溶液,加蒸馏水至2.0 mL,待混匀后加入1.0 mL的5 %苯酚溶液,涡旋混合器混匀10 s。加入浓硫酸10.0 mL[21],涡旋混合器混匀35 s。置于沸水浴中2 min,再冷却至21 ℃,用紫外-可见分光光度计在485 nm波长处检测吸光度,计算样品中的多糖含量。
1.2.5 西洋参果多糖体外抗氧化能力测定
1.2.5.1 西洋参果多糖清除DPPH自由基能力测定
参照文献[22]中的方法来测定DPPH自由基清除率:称量一定质量的西洋参多糖样品以及水溶性VC,分别配制成0.1、0.2、0.5、0.8、1.7、3.4 mg/mL的样品溶液,备用。准确吸取1 mL样品于试管中,其中再加入4.5 mL 0.1 mmol/L的DPPH溶液,充分振荡摇匀,以上操作结束后,在避光的条件下使该溶液反应30 min,然后在波长515 nm下测定其吸光度,用无水乙醇调零。以水溶性VC溶液(0.1、0.2、0.5、0.8、1.7、3.4 mg/mL)作为阳性对照组进行同样的操作。
样品对DPPH自由基的清除作用按以下公式计算:
式中:A,A0分别代表样品和空白的吸光度。
1.2.5.2 西洋参果多糖清除羟基自由基能力测定
参照胡晓等[23]的方法来测定羟基自由基的清除率。取0.3 mL 5 mol/L邻氮二菲的无水乙醇溶液,加入pH7.4的0.2 mL 0.15 mol/L的磷酸盐缓冲液以及0.3 mL 0.75 mol/L的FeSO4溶液,分别加入质量浓度为0.1、0.2、0.5、0.8、1.7、3.4 mg/mL的多糖溶液混匀,加入0.2 mL体积分数为0.1%的H2O2溶液摇匀,37 ℃水浴条件下加热60 min,在510 nm处测定吸光度As;以去离子水和H2O2溶液代替样品重复上述操作,在510 nm处测定吸光度Ab;以去离子水代替样品重复上述操作,在510 nm波长处测定吸光度A0。以水溶性VC溶液(0.1、0.2、0.5、0.8、1.7、3.4 mg/mL)作为阳性对照进行同样的操作。
羟基自由基清除率按以下公式计算:
1.2.5.3 西洋参果多糖总还原能力的测定
采用韩东[24]的方法来测定还原力:取5支洁净的试管,分别依次加入1.00 mL 的 0.2、0.4、0.6、0.8、1.0 mg/mL多糖溶液、2.50 mL的0.9 %铁氰化钾溶液、2.50 mL的pH为7.4的磷酸缓冲溶液,混匀后置于60 ℃水浴中恒温反应20 min。冷却至室温,继续向反应体系中加入3.0 mL的10 %三氯乙酸溶液,再将混合溶液置于离心机中,设置转速为4500 r/min,离心5 min,取上清液,弃去离心管中沉淀,向上清液中加入1.00 mL的1.0 %三氯化铁溶液,25 ℃下反应5 min,在719 nm 波长下测定体系吸光度Sa。固定上述试验流程及相应条件,用纯水代替铁氰化钾溶液作为对照体系,测定对照吸光度Sb;以纯水取代多糖待测液作为空白体系,测定空白吸光度S0,以水溶性VC溶液(0.2、0.4、0.6、0.8、1.0 mg/mL)作为阳性对照进行同样操作。
按照公式计算总还原力(总还原力与吸光度成正比):
1.3 数据处理
上述实验均重复了三次。根据Box-Behnken的试验设计原理,实验数据采用Design Expert 10.0.3进行分析处理。其他实验数据通过SPSS进行处理和回归分析。
2. 结果与分析
2.1 单因素实验结果
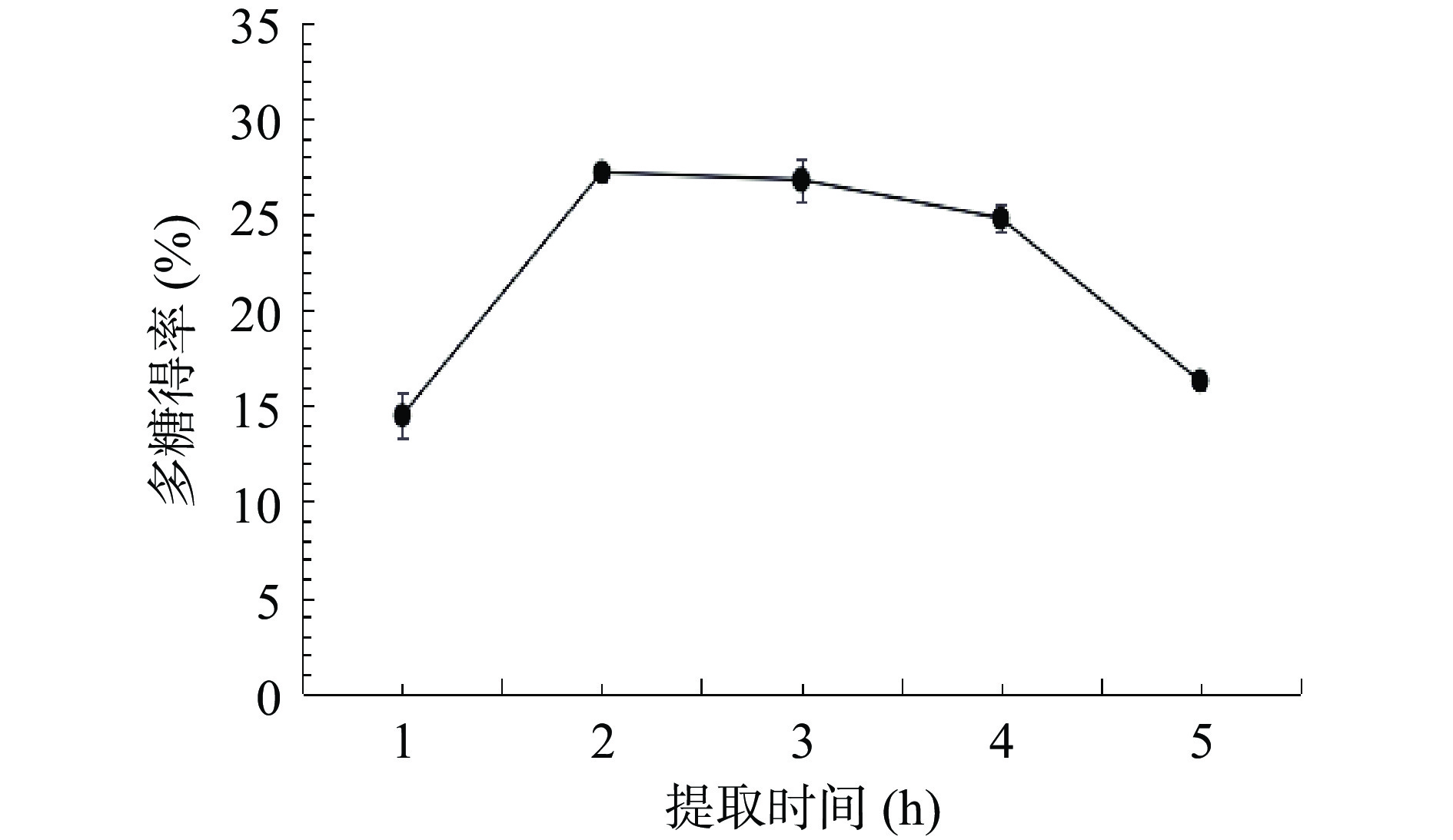
2.1.1 提取时间对多糖得率的影响
由图1可知,随着提取时间从1 h增加到2 h,多糖的得率也明显增加。2 h时得率到达最高值。之后随着提取时间增加,得率开始降低,2~4 h时缓慢下降,4~5 h时下降速度加快。结果与万茜淋等[25]人研究报道的响应面法优化人参花多糖的提取工艺的结果类似,这可能是由于在2 h内多糖会随着时间的增长逐渐被提取出来,2 h时到达高峰,但长时间的煎煮可能会造成多糖水解、杂质溶出增多,多糖与其他化合物发生反应等情况而使多糖得率下降。因此从节约能源及得率方面考虑,选择1、2、3 h三个水平来进行响应面试验。
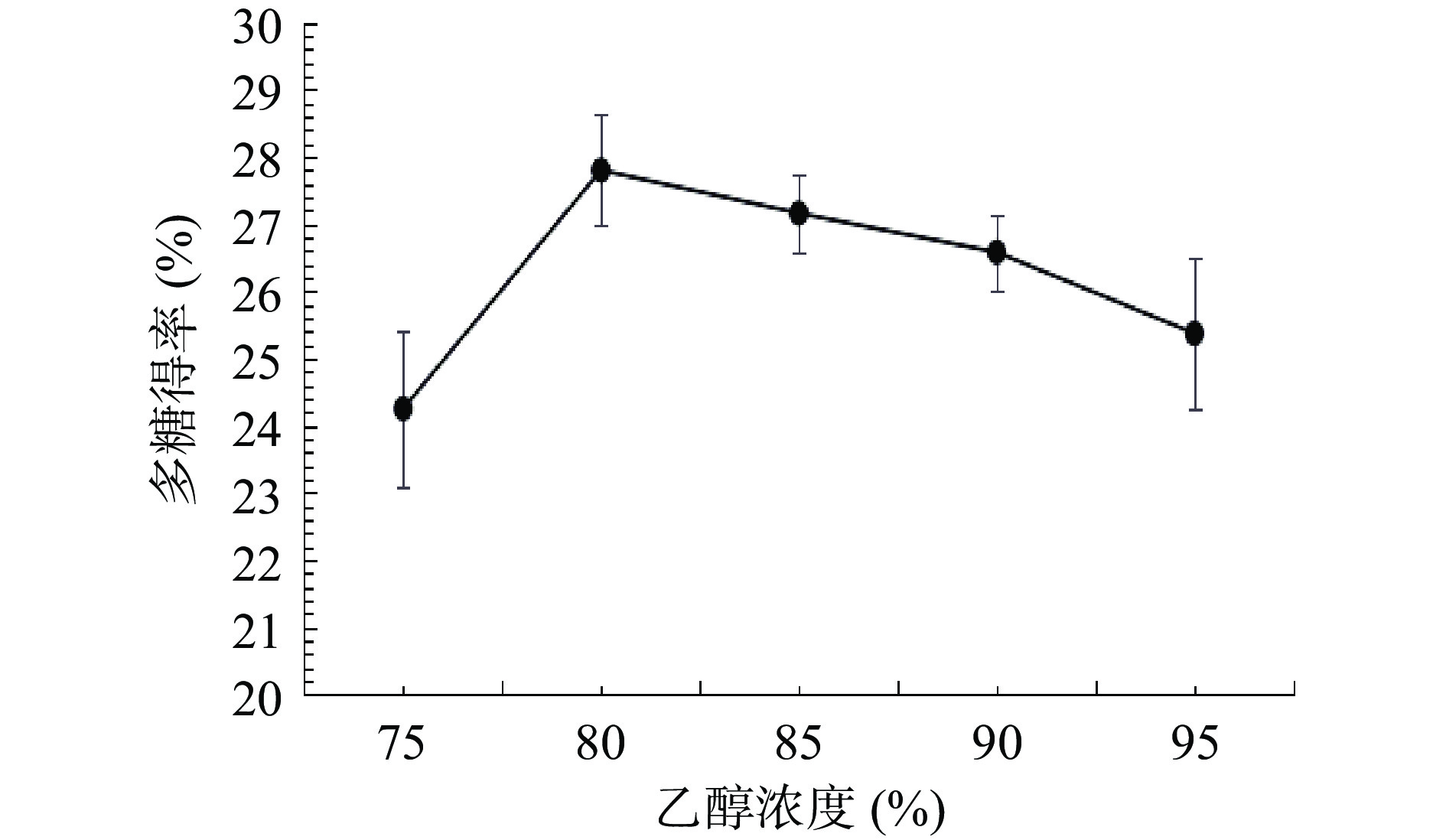
2.1.2 乙醇浓度对多糖得率的影响
由图2可知,随着乙醇浓度从75%增加到80%,多糖的得率明显增加。浓度为80%时得率达到最高值。之后随着乙醇浓度的继续增加,得率呈下降趋势。这结果与刘佳妮等[21]对丹参药渣多糖提取工艺的研究报道结果类似,这可能是因为随着浓度的增加会利于多糖的提取,但当超过80%后,溶剂极性降低,会造成杂质的溶出增多,影响了多糖的提取,从而降低了多糖的相对含量。因此,综合考虑后,选择75%、80%、85%的乙醇浓度作为响应面试验的三个水平。
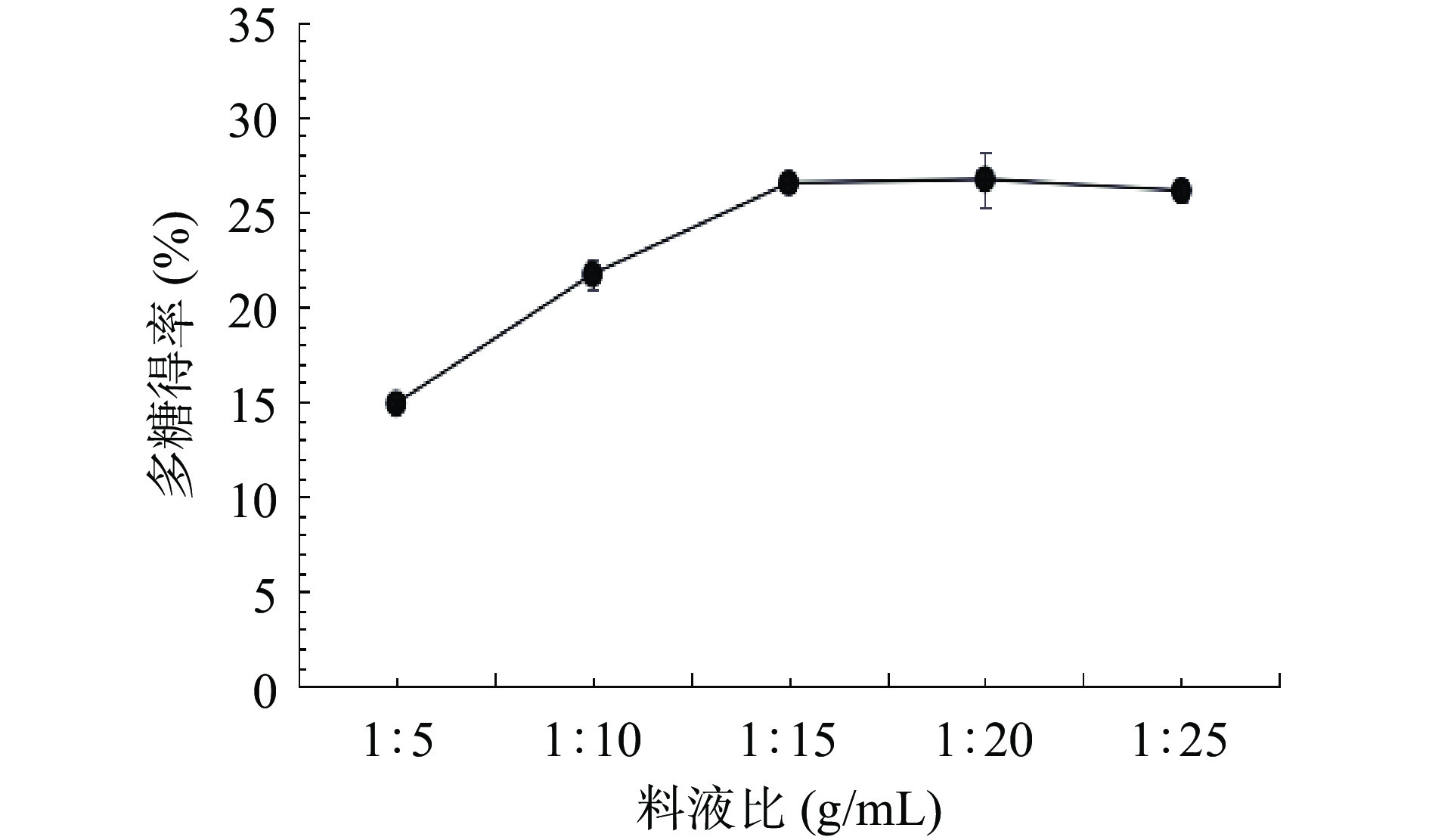
2.1.3 料液比对多糖得率的影响
由图3可知,随着料液比的增大,多糖的得率呈逐渐增大的趋势,并且在1:5~1:15区间内,多糖得率增大的幅度比较大,1:15~1:25区间内,曲线变得平缓,表明多糖得率基本没有增加,甚至有少许的下降。这结果与陈军辉等[26]的研究报道西洋参多糖提取新工艺研究的结果类似,这可能是因为料液比越大,提取的越彻底,但在料液比超过1:15后,得率并没有太大的改变,但过大的料液比会增加浓缩的工作量、试剂用量以及成本。综合以上考虑,选择1:10、1:15、1:20 g/mL三个水平来进行响应面试验。
2.2 响应面法优化西洋参果多糖提取工艺试验结果
2.2.1 试验设计方案及结果
在Box-Behnken试验设计原理基础上,设计了三因素三水平的响应面分析试验。根据设计出的试验方案中的不同试验条件进行实验,每组平行做三次,以三次实验结果的平均值作为实验结果填入表中。得到的设计方案及结果如表2所示。
表 2 Box-Behnken试验设计方案及结果Table 2. Design and test results of Box-Behnken test试验号 提取时间 乙醇浓度 料液比 西洋参果多糖得率(%) 1 1 1 0 25.43±0.63 2 0 0 0 27.54±0.93 3 0 1 1 26.72±0.80 4 1 0 −1 26.65±0.57 5 1 0 1 26.28±0.40 6 0 −1 1 24.83±1.72 7 0 0 0 27.75±0.63 8 0 −1 −1 22.03±1.17 9 −1 0 −1 14.64±1.91 10 0 1 −1 23.45±0.86 11 1 −1 0 24.83±0.90 12 0 0 0 28.75±0.59 13 −1 0 1 15.24±0.84 14 0 0 0 28.62±0.75 15 0 0 0 27.58±1.07 16 −1 1 0 15.15±0.40 17 −1 −1 0 14.35±0.63 2.2.2 回归模型的建立及分析
运用Design-Expert 10.0.3软件,对表2进行拟合,以多糖得率作为响应值,得到的二次多项回归方程为:多糖得率=28.02+5.49A+0.59B+0.80C−0.050AB−0.23AC+0.12BC−5.84A2−2.28B2−1.51C2。响应面分析试验结果见表3。
表 3 回归模型方差分析Table 3. Variance analysis of response surface quadratic regression方差来源 平方和 自由度 均方 F值 P值 模型 437.07 9 48.56 51.00 <0.0001** A-提取时间 240.90 1 240.90 252.99 <0.0001** B-乙醇浓度 2.76 1 2.76 2.90 0.1324 C-料液比 5.12 1 5.12 5.38 0.0535 AB 1.21 1 1.21 0.011 0.9213 AC 0.20 1 0.20 0.21 0.6587 BC 0.063 1 0.063 0.066 0.8052 A2 143.36 1 143.36 150.55 <0.0001** B2 21.98 1 21.98 23.09 0.0020** C2 9.60 1 9.60 10.08 0.0156* 残差 6.67 7 0.95 失拟项 5.32 3 1.77 5.26 0.0713 纯误差 1.35 4 0.34 总离差 443.74 16 注:**表示差异极显著P<0.01,*表示差异显著P<0.05。 由表3可以看出,三个因素对于得率的影响程度大小的顺序为:提取时间>料液比>乙醇浓度。模型的均方差的P值为<0.0001,这说明了该回归模型极显著;失拟项P值为0.0713>0.05,说明了失拟项不显著;模型的决定系数R2=0.9850,调整决定系数R2adj=0.9657,说明了实验模型拟合度高,拟合充分,误差小,可靠性高。这表明了该模型可以用于西洋参果多糖提取工艺的优化。此外,提取时间(A)的一次项(A)、二次项(A2)及乙醇浓度(B)的二次项(B2)都极为显著(P<0.01),料液比(C)的二次项(C2)显著(P<0.05)。
2.2.3 响应面优化分析
各因素交互作用的显著与否可以从响应面曲线的陡峭程度反映出来,响应面曲线越陡峭,越显著。通过Design-Expert 10.0.3软件分析得到的各因素对西洋参果多糖得率的影响,由响应曲面表示,结果如图4所示。
图4a可知提取时间的陡峭度大于乙醇浓度的陡峭度,可以说明提取时间对多糖得率的影响大于乙醇浓度对多糖提取率的影响。图4b中可知,提取时间的陡峭度大于料液比的陡峭度,可以说明提取时间对多糖得率的影响大于料液比。从图4c可知,乙醇浓度和料液比的陡峭程度接近,可以说明两者对于多糖得率的影响基本相同。因此,各因素对于西洋参果多糖得率影响顺序依次为:提取时间>料液比>乙醇浓度,各因素交互作用对于西洋参果多糖得率影响顺序依次为: AC>BC>AB。
2.2.4 最佳工艺的预测和验证
通过Design-Expert 10.0.3软件预测得到提取西洋参果多糖的最佳工艺为:提取时间2.47 h,乙醇浓度80.65%,料液比为1:16.18 g/mL,该条件下通过模型预测的最高多糖得率为29.53%±1.73%。为了便于实验,将西洋参果多糖的提取工艺调整为:提取时间2.5 h,乙醇浓度80%,料液比为1:16 g/mL,在此实验条件的基础上进行三次工艺验证实验,得到的多糖得率平均值为29.47%±0.65%。说明本次实验所做模型可以较好地反映西洋参果多糖的提取过程,可以认为本次实验通过响应曲面法得到的各项提取工艺的优化参数准确可靠,可用于指导实际生产和实验过程。
2.3 西洋参果多糖的体外抗氧化活性
2.3.1 DPPH自由基清除能力
如图5所示,西洋参果多糖在清除DPPH自由基方面具有一定作用。随着果多糖浓度的增加,对DPPH自由基的清除率增加。当西洋参果多糖的浓度在0~1.7 mg/mL 范围内时,其清除率会大幅度增加,当浓度超过1.7 mg/mL时,清除率的增长趋势变缓,当浓度为3.4 mg/mL时,其DPPH自由基清除率达到最高,为75.14%±0.65%,IC50值为0.71 mg/mL。但与VC相比效果欠佳。
2.3.2 羟基自由基清除能力
羟基是生命体中最具氧化性能的自由基,如不能及时清除,会对机体的腑脏器官产生极大的破坏[27]。如图6所示,西洋参果多糖在清除羟基自由基这方面也有较好的效果,当西洋参果多糖的浓度在0~3.4 mg/mL范围内时,清除率随浓度增加逐渐增强。样品浓度低于1.7 mg/mL时清除率是大幅度增加的,超过1.7 mg/mL后增加的幅度变得缓慢,当多糖浓度为3.4 mg/mL 时,西洋参果多糖对羟基自由基的清除率可达到71.82%±1.43%,IC50值为0.87 mg/mL。但与VC 的清除能力相比效果欠佳。
2.3.3 总还原能力
多糖分子中含有苷羟基,一定条件下可异变为羰基结构,因而具有一定的还原性[28]。如图7所示,西洋参果多糖是具有比较理想的总还原能力的。当多糖浓度在0~1.0 mg/mL范围内时,随着浓度的增加,西洋参果多糖的总还原力会随之增强,当多糖浓度为1.0 mg/mL时,其总还原力可以达到0.730。与VC组相比,其还原能力虽低于VC,但相差不多。
3. 结论
本研究在单因素考察的基础上,采用了响应面法来优化西洋参果多糖的提取工艺,得到的方差分析结果表明,影响西洋参果多糖得率因素的主次顺序为:提取时间>料液比>乙醇浓度。通过响应面法得到的最优提取工艺为:提取时间2.5 h,乙醇浓度80%,料液比为1:16 g/mL,同时在最优工艺的实验条件基础上进行了三次验证实验,最后得到多糖得率的平均值为29.47%±0.65%。
西洋参果多糖对DPPH自由基、羟基自由基的清除率最高值分别为75.14%±0.65%、71.82%±1.43%,总还原能力可以达到0.730,这些实验结果表明,西洋参果多糖具有较好的体外抗氧化活性。而本次研究得到的最佳提取工艺以及体外抗氧化实验结果为西洋参果多糖的后续研究和应用提供了相应的理论依据。
-
表 1 试验因素水平表
Table 1 Table of experimental factor levels
水平 因素 A提取时间(h) B乙醇浓度(%) C料液比(g/mL) −1 1 75 1:10 0 2 80 1:15 1 3 85 1:20 表 2 Box-Behnken试验设计方案及结果
Table 2 Design and test results of Box-Behnken test
试验号 提取时间 乙醇浓度 料液比 西洋参果多糖得率(%) 1 1 1 0 25.43±0.63 2 0 0 0 27.54±0.93 3 0 1 1 26.72±0.80 4 1 0 −1 26.65±0.57 5 1 0 1 26.28±0.40 6 0 −1 1 24.83±1.72 7 0 0 0 27.75±0.63 8 0 −1 −1 22.03±1.17 9 −1 0 −1 14.64±1.91 10 0 1 −1 23.45±0.86 11 1 −1 0 24.83±0.90 12 0 0 0 28.75±0.59 13 −1 0 1 15.24±0.84 14 0 0 0 28.62±0.75 15 0 0 0 27.58±1.07 16 −1 1 0 15.15±0.40 17 −1 −1 0 14.35±0.63 表 3 回归模型方差分析
Table 3 Variance analysis of response surface quadratic regression
方差来源 平方和 自由度 均方 F值 P值 模型 437.07 9 48.56 51.00 <0.0001** A-提取时间 240.90 1 240.90 252.99 <0.0001** B-乙醇浓度 2.76 1 2.76 2.90 0.1324 C-料液比 5.12 1 5.12 5.38 0.0535 AB 1.21 1 1.21 0.011 0.9213 AC 0.20 1 0.20 0.21 0.6587 BC 0.063 1 0.063 0.066 0.8052 A2 143.36 1 143.36 150.55 <0.0001** B2 21.98 1 21.98 23.09 0.0020** C2 9.60 1 9.60 10.08 0.0156* 残差 6.67 7 0.95 失拟项 5.32 3 1.77 5.26 0.0713 纯误差 1.35 4 0.34 总离差 443.74 16 注:**表示差异极显著P<0.01,*表示差异显著P<0.05。 -
[1] LIU Chengzhi, CHEN Weiwang, MEI Xia, et al. Dendrobium officinale Kimura et Migo and American ginseng mixture: A Chinese herbal formulation for gut microbiota modulation[J]. Chinese Journal of Natural Medicines,2020,18(6):446−459. doi: 10.1016/S1875-5364(20)30052-2
[2] 王秋, 刘莉, 何慧楠, 等. 不同生长年限西洋参不同部位氨基酸含量比较研究[J]. 中华中医药杂志,2017,32(8):3692−3695. [WANG Qiu, LIU Li, HE Huinan, et al. Comparative study of amino acid content of American ginseng[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2017,32(8):3692−3695. WANG Qiu, LIU Li, HE Huinan, et al. Comparative study of amino acid content of American ginseng[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(8): 3692-3695.
[3] QI Junshan, MA Liguo, ZHANG Bo, et al. First report of root and crown rot of American ginseng caused by Pythium spinosum in China[J]. Plant Disease, 2020.
[4] DENNIE VC A, FCIC. Study on north American ginseng[J]. Focus on Alternative and Complementary Therapies,2006,11(2):178. doi: 10.1211/fact.11.2.0079
[5] 邓沂. 夏季清补, 了解一下西洋参[J]. 中医健康养生,2021,7(6):39−41. [DENG Qi. Summer cleaning, learn about American ginseng[J]. TCM Healthy Life-Nurturing,2021,7(6):39−41. DENG Qi. Summer cleaning, learn about American ginseng[J]. TCM Healthy Life-Nurturing, 2021, 7(6): 39-41.
[6] 李乐, 余慧, 付书正, 等. 西洋参果化学成分及其生物活性研究进展[J]. 中南药学,2021,19(5):931−936. [LI Le, YU Hui, FU Zhengshu, et al. Research progress on chemical constituents and biological activities of American ginseng fruit[J]. Central South Pharmacy,2021,19(5):931−936. LI Le, YU Hui, FU Zhengshu, et al. Research progress on chemical constituents and biological activities of American ginseng fruit[J]. Central South Pharmacy, 2021, 19(5): 931-936.
[7] LIU Lu, XU Furong, WANG Yuanzhong. Traditional uses, chemical diversity and biological activities of Panax L. (Araliaceae): A review[J]. Journal of Ethnopharmacology,2020,263:112792. doi: 10.1016/j.jep.2020.112792
[8] 钟运香, 袁娇, 刘丰惠, 等. 西洋参化学成分、药理作用及质量控制研究进展[J]. 中国中医药现代远程教育,2020,18(7):130−133. [ZHONG Yunxiang, YUAN Jiao, LIU Huifeng, et al. Research progress on chemical constituents, pharmacological effects and quality control of American ginseng[J]. Chinese Medicine Modern Distance Education of China,2020,18(7):130−133. doi: 10.3969/j.issn.1672-2779.2020.07.053 ZHONG Yunxiang, YUAN Jiao, LIU Huifeng, et al. Research progress on chemical constituents, pharmacological effects and quality control of American ginseng[J]. Chinese Medicine Modern Distance Education of China, 2020, 18(7): 130-133. doi: 10.3969/j.issn.1672-2779.2020.07.053
[9] XIE J T, WANG C Z, NI M, et al. American ginseng berry juice intake reduces blood glucose and body weight in ob/ob mice[J]. Journal of Food Science,2007,72(8):S590−S594. doi: 10.1111/j.1750-3841.2007.00481.x
[10] 毛英民, 于文杰, 李佳奇, 等. HPLC 结合化学计量法对西洋参不同部位中人参皂苷的差异分析[J]. 中华中医药学刊,2023,41(1):8. [MAO Yingmin, YU Wenjie, LI Jiaqi, et al. Difference analysis of ginsenosides in different parts of American ginseng by HPLC combined with chemometrics[J]. Chinese Archives of Traditional Chinese Medicine,2023,41(1):8. MAO Yingmin, YU Wenjie, LI Jiaqi, et al. Difference analysis of ginsenosides in different parts of American ginseng by HPLC combined with chemometrics[J]. Chinese Archives of Traditional Chinese Medicine, 2023, 41(1): 8.
[11] 曾俊. 西洋参多糖的提取分离、结构表征及抗氧化活性研究[D]. 哈尔滨: 哈尔滨工业大学, 2022. ZENG Jun. Study on extraction, separation, structure characterization and antioxidant activity of polysaccharides from American ginseng[D]. Harbin: Harbin Institute of Technology, 2022.
[12] 贾琦琦. 西洋参多糖提取、性质及口服液制备[D]. 泰安: 山东农业大学, 2021. JIA Qiqi. Extraction, properties and oral liquid preparation of American ginseng polysaccharide[D]. Taian: Shandong Agricultural University, 2021.
[13] ZHOU Rongrong, HUANG Jiahua, HE Dan, et al. Green and efficient extraction of polysaccharide and ginsenoside from American ginseng (Panax quinquefolius L.) by deep eutectic solvent extraction and aqueous two-phase system[J]. Molecules,2022,27(10):3132. doi: 10.3390/molecules27103132
[14] 李珊珊, 祁玉丽, 曲迪, 等. 西洋参果多糖的纯化及DPPH自由基清除活性研究[J]. 特产研究,2019,41(1):1−4. [LI Shanshan, QI Yuli, QU Di, et al. Study on purification and DPPH free radical scavenging activity of polysaccharide from American ginseng fruit[J]. Special Wild Economic Animal and Plant Research,2019,41(1):1−4. doi: 10.16720/j.cnki.tcyj.2019.01.001 LI Shanshan, QI Yuli, QU Di, et al. Study on purification and DPPH free radical scavenging activity of polysaccharide from american ginseng fruit[J]. Special Wild Economic Animal and Plant Research, 2019, 41(1): 1-4. doi: 10.16720/j.cnki.tcyj.2019.01.001
[15] 李思齐, 余学英, 何芳. Box-Behnken效应面法优化粗榧叶总黄酮提取工艺及其体外活性研究[J]. 中国现代中药,2018,21(1):1270−1275. [LI Siqi, YU Xueying, HE Fang. Optimization of extraction process and in vitro activity of total flavonoids from Torreya grandis leaves by Box-Behnken response surface method[J]. Modern Chinese Medicine,2018,21(1):1270−1275. doi: 10.13313/j.issn.1673-4890.20200920002 LI Siqi, YU Xueying, HE Fang. Optimization of extraction process and in vitro activity of total flavonoids from Torreya grandis leaves by Box-Behnken response surface method[J]. Modern Chinese Medicine, 2018, 21(1): 1270-1275. doi: 10.13313/j.issn.1673-4890.20200920002
[16] YANG Chengjung, LIN Mei, CHEN Jahau. A multi-disciplinary optimization approach to eco-friendly design using the response surface method[J]. Applied Sciences,2022,6(12):3002.
[17] 王雪飞, 张华, 王振宇. 响应面法优化黄柏花粉多糖的脱蛋白工艺及其抗氧化活性[J]. 食品工业,2018,39(4):7−12. [WANG Xuefei, ZHANG Hua, WANG Zhenyu. Optimization of deproteinization process of Phellodendron pollen polysaccharide by response surface methodology and its antioxidant activity[J]. The Food Industry,2018,39(4):7−12. WANG Xuefei, ZHANG Hua, WANG Zhenyu. Optimization of deproteinization process of Phellodendron pollen polysaccharide by response surface methodology and its antioxidant activity[J]. The Food Industry, 2018, 39(4): 7-12.
[18] 陈江艳, 王维滔, 董益阳, 等. 响应面优化蒲公英橡胶草菊糖提取工艺及其MALDI-TOF MS分析[J]. 食品工业科技,2022,43(1):205−212. [CHEN Jiangyan, WANG Weitao, DONG Yiyang, et al. Response surface optimization of dandelion rubber grass inulin extraction process and MALDI-TOF MS analysis[J]. Science and Technology of Food Industry,2022,43(1):205−212. CHEN Jiangyan, WANG Weitao, DONG Yiyang, et al. Response surface optimization of dandelion rubber grass inulin extraction process and MALDI-TOF MS analysis[J]. Science and Technology of Food Industry, 2022, 43(1): 205-212.
[19] 李英娜, 潘美彤, 苑广信, 等. 响应面法优化复方北冬虫夏草颗粒多糖提取工艺的研究[J]. 食品研究与开发,2020,41(2):61−66. [LI Yingna, PAN Meitong, YAUN Guangxin, et al. Study on optimization of extraction process of polysaccharide from compound north cordyceps granules by response surface methodology[J]. Food Research and Development,2020,41(2):61−66. doi: 10.12161/j.issn.1005-6521.2020.02.011 LI Yingna, PAN Meitong, YAUN Guangxin, et al. Study on optimization of extraction process of polysaccharide from compound north cordyceps granules by response surface methodology[J]. Food Research and Development, 2020, 41(2): 61-66. doi: 10.12161/j.issn.1005-6521.2020.02.011
[20] 蔡群虎, 刘石磊, 袁敏惠, 等. 三七多糖含量测定方法比较[J]. 云南中医中药杂志,2020,41(8):59−62. [CAI Qunhu, LIU Shilei, YUAN Minhui, et al. Comparison of determination methods of polysaccharide content in Panax notoginseng[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Medica,2020,41(8):59−62. doi: 10.3969/j.issn.1007-2349.2020.08.020 CAI Qunhu, LIU Shilei, YUAN Minhui, et al. Comparison of determination methods of polysaccharide content in Panax notoginseng[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 2020, 41(8): 59-62. doi: 10.3969/j.issn.1007-2349.2020.08.020
[21] 刘佳妮, 王硕, 白米雪, 等. 响应面法优化丹参药渣多糖提取工艺及其抗氧化活性研究[J]. 时珍国医国药,2017,28(2):454−457. [LIU Jiani, WANG Shuo, BAI Mixue, et al. Optimization of extraction process of polysaccharide from salvia root residue by response surface methodology and its antioxidant activity[J]. Lishizhen Medicine and Materia Medica Research,2017,28(2):454−457. LIU Jiani, WANG Shuo, BAI Mixue, et al. Optimization of extraction process of polysaccharide from salvia root residue by response surface methodology and its antioxidant activity[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(2): 454-457.
[22] SHEN S G, JIA S R, WU Y K, et al. Effect of culture conditions on the physicochemical properties and antioxidant activities of polysaccharides from Nostoc flagelliforme[J]. Carbohydrate Polymers,2018,198:426−433. doi: 10.1016/j.carbpol.2018.06.111
[23] 胡晓, 于娇, 陈胜军, 等. 末水坛紫菜蛋白源抗氧化肽的制备、分离纯化与体外抗氧化活性[J]. 食品科学,2020,41(16):37−44. [HU Xiao, YU Jiao, CHEN Shengjun, et al. Preparation, purification and antioxidant activity in vitro of antioxidant peptides from Porphyra haitanensis protein[J]. Food Science,2020,41(16):37−44. doi: 10.7506/spkx1002-6630-20190822-231 HU Xiao, YU Jiao, CHEN Shengjun, et al. Preparation, purification and antioxidant activity in vitro of antioxidant peptides from Porphyra haitanensis protein[J]. Food Science, 2020, 41(16): 37-44. doi: 10.7506/spkx1002-6630-20190822-231
[24] 韩东. 黑果腺肋花楸多糖提取纯化与体外抗氧化活性研究[D]. 天津: 天津商业大学, 2022. HAN Dong. Purification and antioxidant activity in vitro of polysaccharides from Aronia melanocarpa[D]. Tianjin: Tianjin University of Commerce, 2022.
[25] 万茜淋, 焦丽丽, 马林, 等. 响应面法优化人参花多糖的提取工艺[J]. 长春理工大学学报(自然科学版),2015,38(6):154−158, 132. [WAN Qianlin, JIAO Lili, MA Lin, et al. Optimization of polysaccharides from flowers of Panax ginseng C. A. Meyer using response surface methodology[J]. Journal of Changchun University of Science and Technology(Natural Science Edition),2015,38(6):154−158, 132. doi: 10.3969/j.issn.1672-9870.2015.06.036 WAN Qianlin, JIAO Lili, MA Lin, et al. Optimization of polysaccharides from flowers of panax ginseng C. A. Meyer using response surface methodology[J]. Journal of Changchun University of Science and Technology(Natural Science Edition), 2015, 38(6): 154-158, 132. doi: 10.3969/j.issn.1672-9870.2015.06.036
[26] 陈军辉, 谢明勇, 易秀琴, 等. 西洋参多糖提取新工艺研究[J]. 时珍国医国药,2005(10):977−979. [CHEN Junhui, XIE Mingyong, YI Xiuqin, et al. Study on new technological process for extraction of polysaccharide from Panax quinquef olium L[J]. Lishizhen Medicine and Materia Medica Research,2005(10):977−979. doi: 10.3969/j.issn.1008-0805.2005.10.032 CHEN Junhui, XIE Mingyong, YI Xiuqin, et al. Study on new technological process for extraction of polysaccharide from Panax quinquef olium L[J]. Lishizhen Medicine and Materia Medica Research, 2005, (10): 977-979. doi: 10.3969/j.issn.1008-0805.2005.10.032
[27] 王蔚新, 张俊, 占剑峰, 等. 福白菊胎菊与朵菊粗多糖体外抗氧化活性分析[J]. 黄冈师范学院学报,2020,40(6):9−13. [WANG Weixin, ZHANG Jun, ZHAN Jianfeng, et al. Analysis of antioxidant activity in vitro of Fubaiju fetal chrysanthemum and chrysanthemum crude polysaccharide[J]. Journal of Huanggang Normal University,2020,40(6):9−13. doi: 10.3969/j.issn.2096-7020.2020.06.02 WANG Weixin, ZHANG Jun, ZHAN Jianfeng, et al. Analysis of antioxidant activity in vitro of Fubaiju fetal chrysanthemum and chrysanthemum crude polysaccharide[J]. Journal of Huanggang Normal University, 2020, 40(6): 9-13. doi: 10.3969/j.issn.2096-7020.2020.06.02
[28] 李珊, 梁俭, 冯彬, 等. 响应面法优化超声波辅助提取山竹果皮多糖的工艺及其体外抗氧活性研究[J]. 食品研究与开发,2020,41(10):103−110. [LI Shan, LIANG Jian, FENG Bin, et al. Response surface methodology promoted ultrasound-assisted extraction of polysaccharides from mangosteen peels and evaluation of antioxidant activity in vitro[J]. Food Research and Development,2020,41(10):103−110. doi: 10.12161/j.issn.1005-6521.2020.10.018 LI Shan, LIANG Jian, FENG Bin, et al. Response surface methodology promoted ultrasound-assisted extraction of polysaccharides from mangosteen peels and evaluation of antioxidant activity in vitro[J]. Food Research and Development, 2020, 41(10): 103-110. doi: 10.12161/j.issn.1005-6521.2020.10.018
-
期刊类型引用(9)
1. 蒋子旋,宋佳,陈世茂,谢涛,薛羽,杨青山. 桑黄的活性成分与药理作用研究进展. 安徽中医药大学学报. 2025(01): 109-112 .  百度学术
百度学术
2. 刘燕,罗扬,李刘敏,毛琪琪,肖茜,刘成国,张博宁,周辉. 胶状鳞伞菌多糖的理化性质及其体外生物学活性. 食品研究与开发. 2025(02): 49-56 .  百度学术
百度学术
3. 王庆琳,陈渝珂,陆瑶,王芳,李小平,高岳. 桑黄属种源、活性成分及生物活性的研究进展. 江苏农业科学. 2025(03): 1-8 .  百度学术
百度学术
4. 张思瑶,余盛武,魏玉莲. 东亚木层孔菌与两种野生桑黄的活性成分及其抗氧化活性比较. 菌物学报. 2024(02): 74-89 .  百度学术
百度学术
5. 张宏岐,朱烈琴,曾亚妮,崔敏,周莹霞,杜娟. 忍冬木层孔菌多糖的提取工艺优化及其体外抗氧化活性研究. 天然产物研究与开发. 2024(04): 581-588+668 .  百度学术
百度学术
6. 李婉茹,何峰. 不同产地桑树桑黄的总黄酮量和部分金属元素含量的比较. 新农民. 2024(10): 56-58 .  百度学术
百度学术
7. 郝哲,张彦飞,史建国,李佳奇,李红,李惠霞,思瑞琳,惠景豪. 设施条件对人工栽培桑黄生长的影响. 中国食用菌. 2024(04): 44-47+53 .  百度学术
百度学术
8. 张越,方锦,姚亮,王雷,王妍妍,彭代银,陈卫东. 桑黄药材的历史沿革与变迁. 中华中医药杂志. 2024(11): 5713-5718 .  百度学术
百度学术
9. 耿涛,周庆祥,韦红显,卢芙萍,武华周,娄德钊,王树昌. 桑黄水提物中小分子化合物对小鼠肝癌细胞Hepa 1-6的抑制活性分析. 热带作物学报. 2024(12): 2697-2708 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载:







 下载:
下载:



