Effect of Arabinogalactan on Intestinal Alkaline Phosphatase, Bacterial Endotoxin and Serum Cytokines in Type 2 Diabetic Rats
-
摘要: 本实验以低剂量腹腔注射链脲佐菌素(30 mg/kg)建立糖尿病大鼠模型,建模成功后,连续给予大鼠灌胃阿拉伯半乳聚糖(Arabinogalactan, AG)水溶液(100 mg/kg、500 mg/kg),测定大鼠体质量及血糖变化、粪便中肠道碱性磷酸酶(IAP)的活力及细菌内毒素中脂多糖(LPS)的浓度变化,并通过MSD多因子方法检测肠道中细胞因子浓度的变化。结果表明,与模型组大鼠相比,AG剂量组空腹血糖浓度显著降低(P<0.05),IAP活力显著增加(P<0.05),LPS浓度显著降低(P<0.05),且肠道中促炎因子白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、γ干扰素(IFN-γ)、白细胞介素-1(IL-1β)、生长调节致癌基因α(KC/GRO)的浓度显著减少(P<0.05),而抗炎因子白介素-4(IL-4)、白介素-5(IL-5)、白介素-10(IL-10)、白介素-13(IL-13)的浓度显著增加(P<0.05)。因此,可以证明AG能够提高IAP活力,降低LPS浓度,调控大鼠细胞因子,进而对2型糖尿病大鼠模型在免疫方面具有一定改善作用。Abstract: In the experiment, a low-dose intraperitoneal injection of streptozotocin (30 mg/kg) was used to establish a diabetic rat model. After the modeling being successful, the mice were continuously administered arabinogalactan aqueous solution (100 mg/kg·d, 500 mg/kg·d), and the changes in rat body mass and blood sugar were determined. Also, the activity of intestinal alkaline phosphatase (IAP) in feces and the changes in bacterial endotoxin lipopolysaccharide (LPS) concentration, and the serum cytokine concentration changes by MSD multi-factor method were detected. The results showed that compared with the model group and the positive control group, the fasting blood glucose concentration of the arabinogalactan polysaccharide dose group was significantly reduced (P<0.05), and the IAP activity was significantly increased (P<0.05). Besides, the LPS concentration was significantly reduced (P<0.05), and the concentration of Interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), interferon-γ (IFN-γ), interleukin-1 (IL-1β) and growth-regulating oncogene α (KC/GRO) was significantly reduced in the intestine (P<0.05), while the concentration of the anti-inflammatory factors such as interleukin-4 (IL-4), interleukin-5 (IL-5), interleukin-10 (IL-10) and interleukin-13 (IL-13) increased significantly (P<0.05). Therefore, it can be proved that arabinogalactan can improve the activity of IAP, reduce the concentration of LPS, and regulate rat cytokines. Furthermore, arabinogalactan has a certain improvement effect on the immunity of type 2 diabetic rat model.
-
Keywords:
- inflammation /
- diabetes /
- arabinogalactan /
- intestinal alkaline phosphatase /
- lipopolysaccharide
-
在我国2型糖尿病(Type 2 Diabetes Mellitus, T2DM)发病率呈现逐年递增趋势[1],目前糖尿病的治疗方法主要包括口服抗糖尿病药物和注射胰岛素。然而,连续使用这些药物会导致胰岛素抵抗和副作用。因此,有效、无毒和负担得起的药物是糖尿病患者需求迫切。近年研究表明,糖尿病特征之一就是炎性反应,这与脂多糖(lipopolysaccharide, LPS)增多有关[2]。大量LPS进入血液循环后诱发细胞因子释放,进而引起炎症失衡,导致胰岛素抵抗(IR)和最终诱发2型糖尿病,现已证明此作用为“代谢性内毒素血症”[3]。由于LPS是肠道碱性磷酸酶(Intestinal Alkaline Phosphatase, IAP)的底物,因此,IAP可以通过对革兰氏阴性菌产生内毒素进行去磷酸化作用来保护细胞[4],从而降低炎症发生。此外,Bates等[5]探究了肠道炎症中LPS和IAP的动态平衡反馈机制,发现LPS经IAP去磷酸化后便不能有效刺激TKR4受体;此外,当炎症和细菌跨粘膜通道增加后,细胞内IAP可阻止NFkB途径的两个关键蛋白磷酸化,达到阻止NFkB转位到细胞核的目的。因此,IAP与LPS呈负相关且对炎症反应具有保护作用。
近年来,阿拉伯半乳聚糖(Arabinogalactan,AG)的免疫调节活性研究广泛,作为新型食品被熟知。阿拉伯半乳聚糖是一类中性多糖,由阿拉伯糖和半乳糖组成[6],主侧链分别是半乳聚糖和阿拉伯糖。AG在自然界中分布广泛,主要存在于植物性食物中,在落叶松木质部中存在含量高达25%[7-8]。除此之外,2002年6月,美国食品药品监督局通过将AG作为食品添加剂广泛应用到饮料和日常食品中,使其作为膳食补充,具有广阔的前景。有研究表明,AG具有抗炎、调节肠道、调节机体免疫功能、调节内分泌系统等作用。Yang等研究从稻壳中提取的AG能够有效地降低结肠癌CT26小鼠模型的肿瘤重量和体积,并且显著上调脾脏细胞毒性和natural killer(NK)细胞数量,说明AG能够增强NK细胞的活化能力从而具有抗肿瘤作用[9]。Wu等研究了从榕果壳中提取的AG具有免疫调节活性,能够促进NO的产生、吞噬活性以及白介素等细胞因子的分泌,且不产生明显的细胞毒性[10];WANG等探究从山茶叶中分离出水溶性AG名为7WA,通过上调GLP-1R、PKA、PDX-1、INS-1、INS-2、GLUT2和GCK的mRNA转录以及PDX-1蛋白的表达,通过cAMP-PKA途径促进RIN-5F细胞胰岛素的分泌[11],说明AG具有促进胰岛素分泌的功能;Naik等研究了黑豆中AG对小鼠急性损伤模型保肝作用研究,结果表明通过提升血清中IAP活性来提高肝脏抗氧化性来保护肝组织[12]。因此,我们推测AG可能通过提升IAP活性抵抗T2DM。
综上,AG具有调节机体肠道、机体和抗炎等活性,但是否具有缓解2型糖尿病潜力及作用机制尚不清楚。因此,本试验以T2DM大鼠为模型,通过灌胃AG,检测大鼠体质量变化和血糖浓度变化,探究AG通过对IAP活力和LPS浓度的影响,进而调控细胞因子水平[白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、γ干扰素(IFN-γ)、白细胞介素-1(IL-1β)、生长调节致癌基因α(KC/GRO)、白介素-4(IL-4)、白介素-5(IL-5)、白介素-10(IL-10)、白介素-13(IL-13)]的变化,为AG在功能性食品开发利用、营养调配和疾病治疗等领域提供参考。
1. 材料和方法
1.1 材料与仪器
SPF级别SD雄性大鼠(150 ± 20 g,合格证:No.1103241911038497) 北京斯贝福生物有限公司;阿拉伯半乳聚糖 纯度99%,河北丰味生物科技公司;链脲佐菌素(STZ) 美国Sigma公司;P0321碱性磷酸酶试剂盒型号 碧云天生物技术有限责任公司;EC80545S内毒素检测试剂盒 厦门试剂生物科技责任有限公司;K15059D Proinflammatory Panel 2 (rat) Kits Meso Scale Diagnostics LLC公司;AIN-93M标准饲料(NMF,总热能3601 kcal/kg,10%的能量为脂肪和14.1%的能量为蛋白质) 中国营养动物饲料高科技有限公司;高糖高脂饲料(1.5%胆固醇、0.25%胆酸钠、10%猪油、5%蔗糖、83.25%标准饲料) 中国营养动物饲料高科技有限公司
HERAEUS Multifuge X3R离心机 赛默飞世尔科技(中国)有限公司;1300 MESO® QuickPlex SQ 120 Meso Scale Diagnostics MULTI-ARRAY和MULTI-SPOT®微孔板 LLC公司;1300 MESO® QuickPlex SQ 120 Meso Scale Diagnostics读板机 LLC公司;I14698I血糖测定仪 强生医疗器械有限公司
1.2 实验方法
1.2.1 实验动物分组及干预
将大鼠饲养于动物笼中,并保持50% ± 15%湿度,22±2 ℃温度和昼夜12 h条件下单笼饲养。所有试验程序遵循动物伦理委员会试验动物护理和使用指南(第8版),ISBN-10:0-309-15396-4[13]。将大鼠分成4组(n=10)并投喂标准饮食及高糖高脂饲料。第1组正常对照组:未经处理,每日给予标准饲料饲喂并灌胃20 mL/kg超纯水;第2组模型组:喂饲高糖高脂饲料并灌胃20 mL/kg超纯水;第3组AG低剂量组:喂饲高糖高脂饲料并灌胃20 mL/kg AG剂量为100 mg/(kg·d)溶剂;第4组AG高剂量组:喂饲高糖高脂饲料并灌胃20 mL/kg AG剂量为500 mg/(kg·d)溶剂。依据文献报道[14],Groman等人探究AG对小鼠急性毒性试验,研究表明经口服给予SD大鼠20 g/kg的AG后未出现中毒及死亡现象。此外,此团队还进行为期90 d的毒性试验,通过静脉注射给予大鼠500 mg/kg的AG后并未造成任何不良影响。因此本实验剂量选取为100和500 mg/kg。试验期间大鼠自由采食和饮水,每天早上八点定时灌胃,在建模成功后第4周牺牲并进行各指标检测。
在14 d适应性喂养后,开始建立2型糖尿病大鼠模型。除正常对照组外,其余组均高糖高脂饲料喂养3周。将模型组和AG剂量组给予30 mg/kg STZ腹腔注射(禁食12 h),续喂养高糖高脂饲料;注射后第3 d和第7 d(禁食12 h),检测空腹血糖值,选取空腹血糖值≥11.1 mmol/L的大鼠为造模成功的大鼠,以大鼠空腹血糖值≥11.1 mmol/L为依据建立模型[15-16]。在对STZ粉剂进行计算时,以30 mg/kg为计量标准,溶解于新鲜的柠檬酸钠缓冲液中(0.1 mol/L柠檬酸钠缓冲液,pH4.3)。为保证其特性,应现用现配,并避光保存。
1.2.2 小肠组织和粪便采集及制备
肠液在禁食8 h后通过腹部注射20%乌拉坦按4 mL/kg剂量对大鼠麻醉,随后颈部脱臼处死大鼠,将处死后大鼠固定在超净工作台上进行解剖。将小肠按近胃部幽门处2~3 cm开始剪取一段肠道组织,所需组织经过在滤纸上吸取表面水分和污垢后称量,称取0.2 g组织样本。将称量好的0.2 g小肠组织放入呈有5 mL预冷的PBS溶液的组织匀浆器中,使用组织匀浆器将组织粉碎完全,立即装入15 mL离心管中、于2000×g离心10 min,吸取上清液,置于1.5 mL EP管中,−20 ℃冷冻保存。
试验开始后采取2粒大鼠粪便于EP管中放在−20 ℃储存。用于检测粪便中碱性磷酸酶和细菌内毒素含量。
1.2.3 大鼠体重和血糖检测
开始条件喂养后,每周进行尾静脉采血用血糖仪测定空腹血糖(Fasting blood glucose,FBG),并称量体重。
1.2.4 细菌内毒素测定
取少量粪便,加入一定比例细菌内毒素检验用水(本试验1:10),迅速3000×g离心1 min收集上清液,OD值为545 nm,利用试管定量显色基质法检测细菌内毒素浓度[17]。
1.2.5 碱性磷酸酶测定
取1 mg粪便,加入50 μL PBS溶液进行稀释,用旋涡法制备粪便匀浆悬液,10000×g离心20 min收集含AP上清液,并根据碱性磷酸酶试剂盒说明书测定AP活性(此时AP活性为IAP活性)。
1.2.6 细胞因子含量检测
利用MSD电化学发光(ECLA)检测技术,以SULFO‐TAGTM标记物。在MULTI-ARRAY和MULTI-SPOT®微孔板电极表面通电后,电化学作用激发SULFO-TAGTM标记物发出强光,检测细胞因子含量。将待测肠液进行4 ℃ 3000×g离心5 min,取1 mL上清液到标准品中,充分振荡,室温放置15~20 min。配制检测抗体稀释液,吸取每种因子的检测抗体60 μL,并用稀释液补足至3 mL。配制1×PBS(0.05%吐温−20)清洗液待用。配制2×读板液。加入150 μL Blocker H溶液,并用封口膜封上,室温孵育1 h后加入50 μL待测液,并用封口膜封上,室温振荡2 h。加入配制好的25 μL检测抗体,并用封口膜封上,室温振荡2 h加入150 μL溶液,上机检测。
1.3 数据分析
本研究通过Excel、Graphpad Prism8、IBM SPSS Statistics 20对数据进行整理分析。试验数据均表示为平均值±标准误差(Mean±SEM),P<0.05认为差异具有统计学意义,即差异显著,P<0.01即极显著差异。
2. 结果与分析
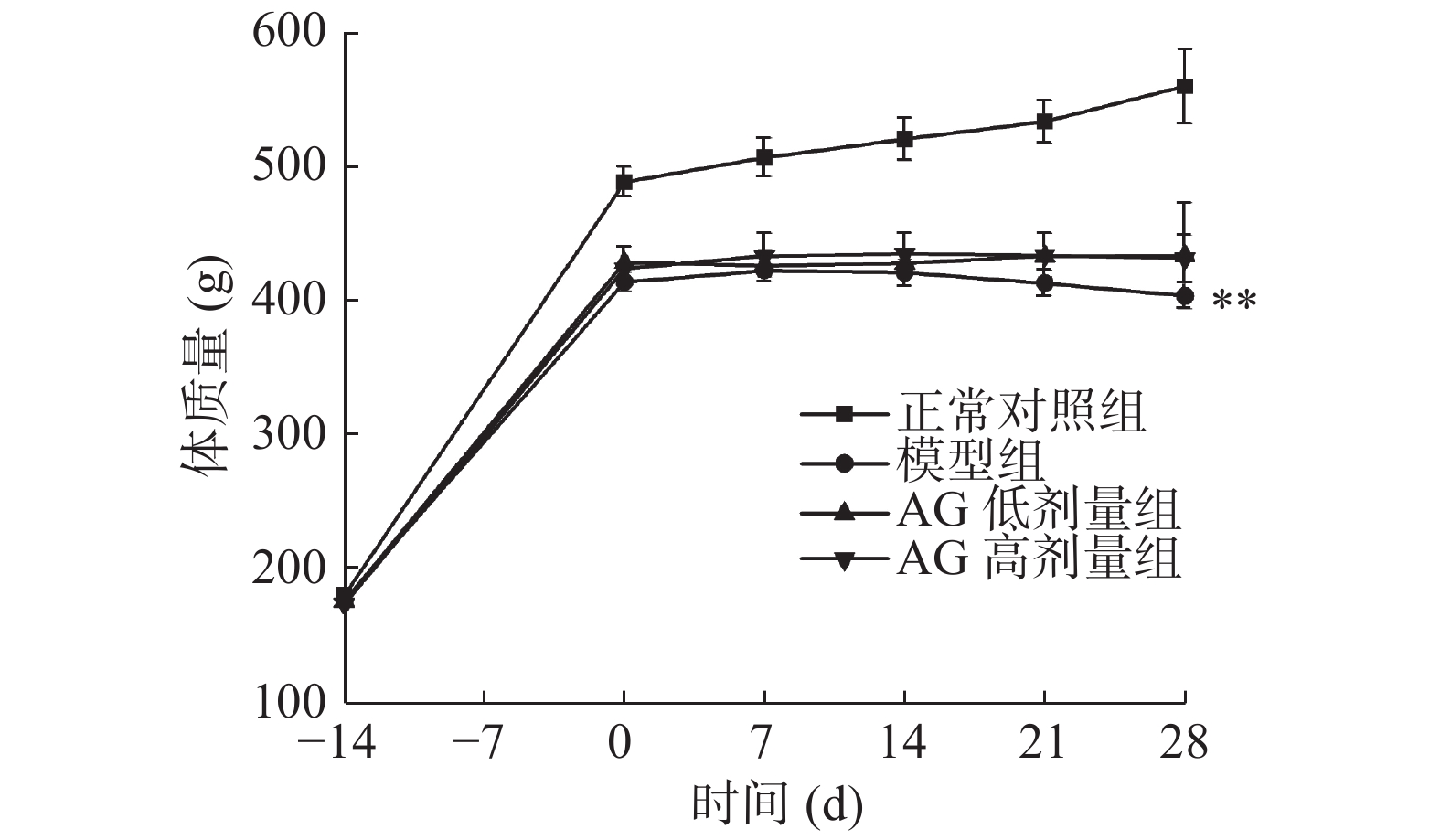
2.1 大鼠体质量变化
如图1所示,在适应性喂养结束后开始建模。建模成功后,与正常对照组相比,模型组大鼠体重显著下降(P<0.05);与模型组相比,AG剂量组大鼠体重无显著差异(P>0.05)。
在整个过程中,正常对照组大鼠活动正常,精神状态良好,色泽光亮。与正常对照组相比,模型组大鼠不活泼、颓废,脏乱,精神状态不好,毛色不光泽。在经过灌胃AG后,剂量组大鼠精神好转,反应敏感度加大,颓废状态有所改善,活动加多,说明AG缓解了T2DM带来影响。上述结果表明,正常对照组大鼠体重明显高于模型组和AG剂量组,正常对照组大鼠通过正常饮食后体重有所增加,AG剂量组相对平稳,而模型组在通过高糖高脂饲料喂养后,体重出现下降趋势,原因可能是高剂量STZ与高热量饮食联合[18],导致胰岛β细胞发生坏死,并致胰岛素分泌发生不足,进而使体内糖代谢絮乱,发生胰岛素抵抗(IR),大鼠使用体内脂肪和蛋白质提供能量[19]。
2.2 大鼠血糖变化
如表1所示,经适应性喂养后进行建模,在7和14 d时,与正常对照组相比,模型组有极显著差异(P<0.01);与模型组相比,AG剂量组均无显著差异(P>0.05)。在21 d时,与正常对照组相比,模型组有极显著差异(P<0.01);与模型组相比,AG低剂量组无显著差异(P>0.05),AG高剂量组有显著差异(P<0.05)。在28 d时,与正常对照组相比,模型组极显著上升(P<0.01);与模型组相比,AG剂量组均显著降低(P<0.05)。
表 1 AG对2型糖尿病大鼠空腹血糖的影响(ˉx±s , n=10)Table 1. Effect of arabinogalactan on fasting blood glucose in type 2 diabetic rats (ˉx±s , n=10)组别 血糖含量(mmol/L) 0 d 7 d 14 d 21 d 28 d 正常对照组 5.6800±0.1302 5.8000±0.1441 5.3000±0.8280 6.2000±0.7010c 5.6000±0.5940 模型组 5.9000±0.3106 16.2000±0.7219** 15.0000±2.5700** 15.6000±1.7380** 16.1000±1.7040** AG低剂量组 5.6733±0.1512 16.9000±0.7967 15.7000±1.5220 14.3000±2.5200 12.5000±1.5540# AG高剂量组 5.7500±0.2552 16.5000±3.1240 14.5000±2.7750 13.4000±2.5290# 11.2000±1.7100# 注:*表示与正常对照组相比,P<0.05;**表示与正常对照组相比,P<0.01;#表示与模型组相比,P<0.05;##表示与模型组相比,P<0.01;表2同。 空腹血糖是诊断T2DM最重要标准,血糖高低标志着T2DM病情改善情况。有研究表明,AG主要通过促进胰岛素分泌和抑制糖降解酶活性,从而通过促进体内糖的利用和减少淀粉、双糖的分解多方面作用的结果而达到降血糖的目的[20]。本试验研究结果表明,相比于模型组,AG使T2DM大鼠降糖效果明显,说明AG对T2DM大鼠有辅助降糖作用。
2.3 粪便中LPS浓度变化
如表2所示,与正常对照组相比,模型组LPS浓度显著上升(P<0.05);与模型组相比,AG剂量组LPS显著降低(P<0.05)。在IAP方面,与正常对照组比,模型组极显著降低(P<0.01);与模型组相比,AG剂量组均极显著升高(P<0.01)。
表 2 AG对2型糖尿病大鼠粪便中IAP和LPS影响(ˉx±s , n=10)Table 2. Effect of arabinogalactan powder on IAP and IAP in fecal of type 2 diabetic rats (ˉx±s , n=10)组别 LPS(EU/mL) IAP活性(U) 正常对照组 3.664±0.201 87.550±0.387 模型组 7.813±0.4364* 31.367±0.469** AG低剂量组 2.270±0.081# 94.668±1.807## AG高剂量组 2.321±0.0329# 95.707±0.388## 为进一步揭示AG对T2DM作用机制,本试验建立了T2DM大鼠模型。T2DM主要体现胰岛素抵抗及胰岛素分泌不足。炎症与IR联系密切,被认为是导致IR发生的根源,已有研究表明,肠道慢性炎症在T2DM发生和发展中发挥重要作用,肠道粘膜免疫发生絮乱,就会引起肠道炎症发生[21]。IAP是一种肠道刷状边界酶,其仅在近端小肠绒毛相关肠细胞中表达,可以作为肠道粘膜防御因子,维持肠道内环境稳定,保护宿主免受肠道炎症损伤,IAP可以降解LPS,降低其毒性,其原因为IAP使LPS脱磷酸,失去破坏性,从而解毒[22]。肠道存在大量革兰氏阴性菌,其细胞壁主要成分是LPS,当肠道中LPS浓度过高时,会破坏肠道粘膜免疫系统,诱发肠道炎症发生。有证据表明,T2DM有利于内毒素(特别是LPS)在肠屏障中易位,导致血液中内毒素浓度轻微升高[23]。有研究表明正常人粪便IAP活性要比T2DM人活性高,粪便中IAP每降低25 U,糖尿病风险增加35%。总的来说,高水平IAP对于T2DM有保护作用[24]。由鼠高脂肪饮食诱导代谢综合征和T2DM,已被证明可以通过口服内源性或者外源性(牛)IAP进行治疗或预防[25]。本研究数据中表明,AG可以减少T2DM大鼠粪便中LPS浓度,AG剂量组与模型组相比差异降低(P<0.05)。AG在增加T2DM大鼠粪便IAP活性同时降低LPS浓度。与Lallès J P等[26]研究结果相似,肠道中IAP和LPS存在负相关,当肠腔中IAP浓度增加时,对LPS作用增加,LPS所带毒性就得到减少,浓度降低,LPS引起肠道炎症就会减轻,因此T2DM大鼠症状会有所改善。
2.4 肠液中细胞因子含量测定
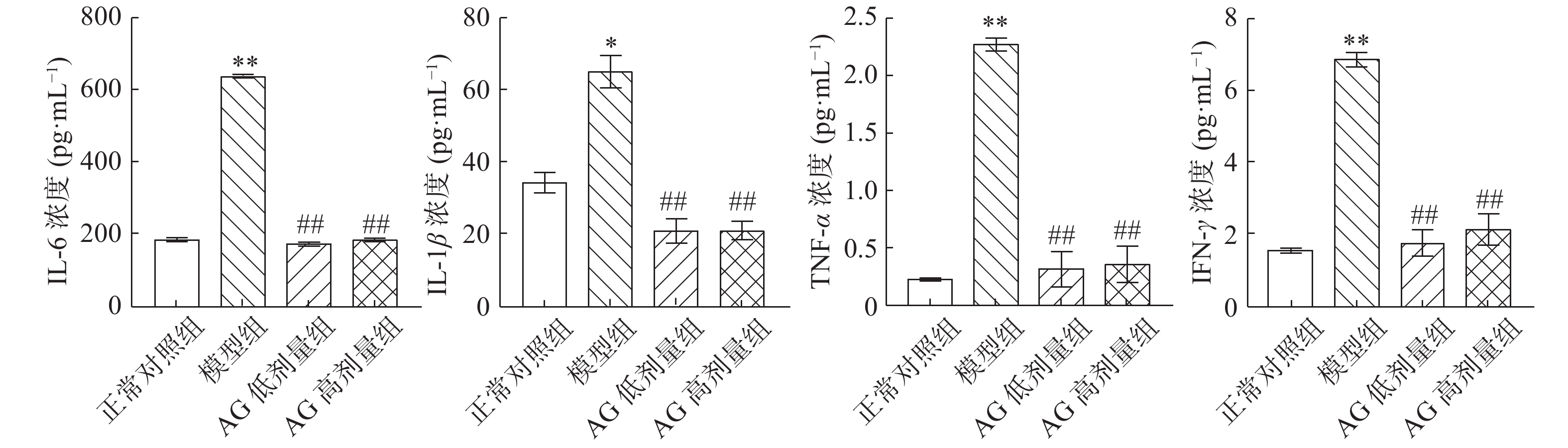
2.4.1 促炎因子含量变化
如图2所示,与正常对照组相比,模型组IL-6、TNF-α和IFN-γ均极显著升高(P<0.01),IL-1β显著升高(P<0.05);与模型组相比,AG剂量组IL-6、IL-1β、TNF-α和IFN-γ均极显著降低(P<0.01)。
肠道粘膜免疫与T2DM发生关系密切,细胞因子在肠道粘膜免疫中发挥重要作用,当免疫系统被激活时,免疫细胞会分泌多种细胞因子,作为免疫应答及炎症效应因子,诱导炎症发生。由紧密连接(Tight junction,TJ)相连的肠上皮细胞,可以阻止病毒微生物侵入到肠道中,当TJ蛋白(ZO-1、Occludin等)遭到破坏,导致通透性增加,使免疫细胞模式识别受体与肠道微生物及其代谢产物中的病原相关分子模式结合,免疫细胞被激活使其分泌炎症因子,如IL-6、TNF-α、IFN-γ等,这些促炎因子在胰岛素靶细胞作为转导信号的炎症介质,使胰岛素受体底物-1(IRS-1)中丝氨酸磷酸化,因此酪氨酸磷酸化受到抑制,胰岛素信号传播受到阻碍,产生IR[27]。IL-6分泌过多,调节其他细胞因子分泌,会加快激活杀伤T细胞,胰岛β细胞凋亡速度加快;有研究表明T2DM高血糖可以促进TNF-α浓度升高,过多加速胰岛细胞破坏;高脂喂养的小鼠中肠道中IL-6分泌增加,TNF-α表达升高[28];IL-1β可以作为炎症反应调节因子,在炎症中发挥中心作用,增加肠道通透性[29]。Mehdi Tabarsa[30]在口香糖中提取阿拉伯半乳聚糖(FGP)通过在RAW264.7细胞中表达包括NO、TNF-α、IL-1β、IL-6和IL-12,NK-92细胞中表达TNF-α、IFN-γ、颗粒酶B、穿孔素、NKG2D和FasL等多种炎症介质来激活NF-κB和MAPKs免疫细胞产生促炎反应。Yang等[31]首次研究了来自台湾白背天牛的II型阿拉伯半乳聚糖(AGAF),表明AGAF通过IFN-γ通过自分泌效应产生和增强细胞毒性等多种因素机制诱导IFN-γ表达伴随着NK细胞中JAK2/STAT3信号的细胞毒性激活。Saman Bahramzadeh[32]在通过NF-κB和通过TLR4和TLR2受体启动的MAPKs信号通路介导巨噬细胞的诱导,证明阿拉伯半乳聚糖能有效地刺激RAW264.7小鼠巨噬细胞释放大量的包括NO、TNF-α、IL-1β和IL-6促炎介质。与前人在细胞实验结果不同,本动物试验结果表示,AG剂量组与模型组IL-6、TNF-α和IFN-γ相比出现极显著差异(P<0.01),IL-1β有显著差异(P<0.05),其可能原因为AG刺激促炎因子受到胰岛素抵抗以后分泌速度减慢,导致胰岛素细胞凋亡速度降低,因此能够证明,AG可降低相关炎症因子浓度,从而缓解炎症,进而缓解T2DM。
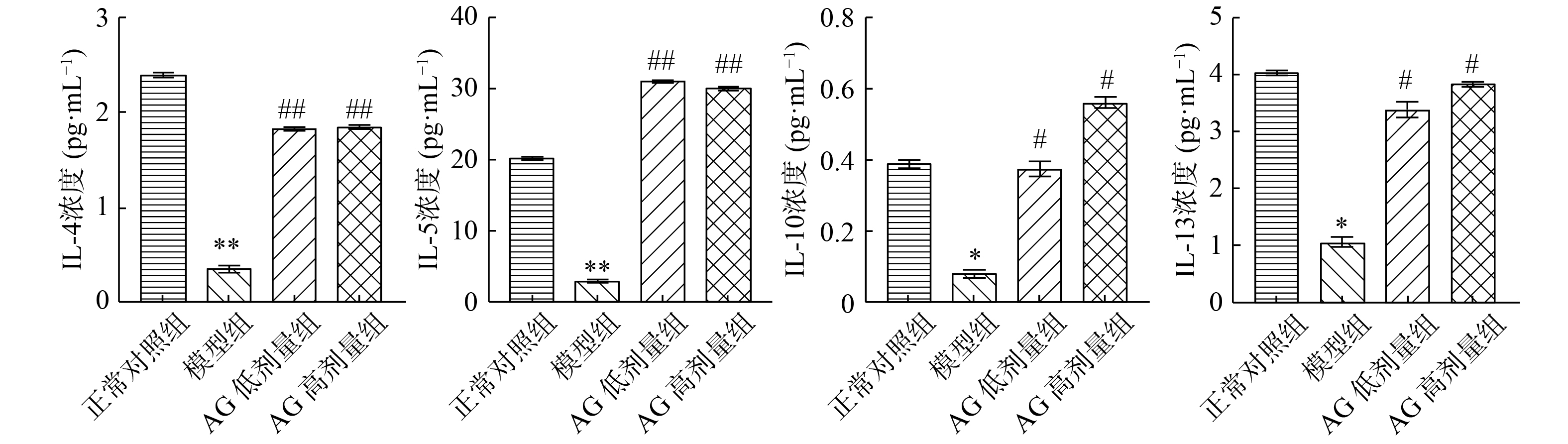
2.4.2 抗炎因子含量变化
如图3所示,与正常对照组相比,模型组IL-4和IL-5极显著下降(P<0.01),IL-10和IL-13均显著下降(P<0.05);与模型组相比,AG剂量组IL-4和IL-5极显著上升(P<0.01),IL-10和IL-13均显著上升(P<0.05)。
IL-4典型抗炎因子,在Th2细胞中都具有代表性细胞因子,可以抑制炎症因子分泌,包括IL-6、TNF-α等,IL-5同IL-4一样在Th2细胞中发挥重要作用,可以缓解由嗜酸性粒细胞诱导炎症效应,Th2细胞属于抗炎细胞,起到重要抗炎作用,可以使Th1介导炎症受阻[33];IL-10是免疫调节因子,可以终止炎症发生;IL-10属于抗炎因子,可以控制炎性反应发生,机体组织糖、脂肪代谢可以被IL-10调节,起到T2DM发生预防作用。IL-13可以使巨噬细胞活化受到抑制,减少炎性因子分泌,可以同时抑制炎症介质产生,又可以使B细胞增殖加快及分泌抗体,起到抗炎因子作用[34]。William [35]研究结核分枝杆菌阿拉伯半乳聚糖中发现,受体诱导抗炎因子IL-10的分泌,产生抗炎因子IL-4和IL-13,抑制IL-12并降低其氧化反应的激活,起到抑制炎症的效果;Yang[36]研究多糖对糖尿病肾病大鼠肾损伤的保健作用中发现,多糖可能通过阻断TGF-β1/Smad信号通路,促进T细胞分化,提高抗炎因子IL-4、IL-10水平,抑制炎症反应,从而减轻DN大鼠肾脏的损伤程度。
本次实验结果表明,AG剂量组与模型组相比大鼠肠液IL-4和IL-5极显著上升(P<0.01),IL-10和IL-13均显著上升(P<0.05)。其可能原因是AG刺激抗炎因子,使其表达量增加,从而抑制促炎因子的表达量,并升高抗炎因子浓度,缓解炎症反应,因此,试验结果表明AG具有促进肠道上皮屏障损伤修复作用,尤其是对肠道粘膜免疫作用,进而缓解T2DM。
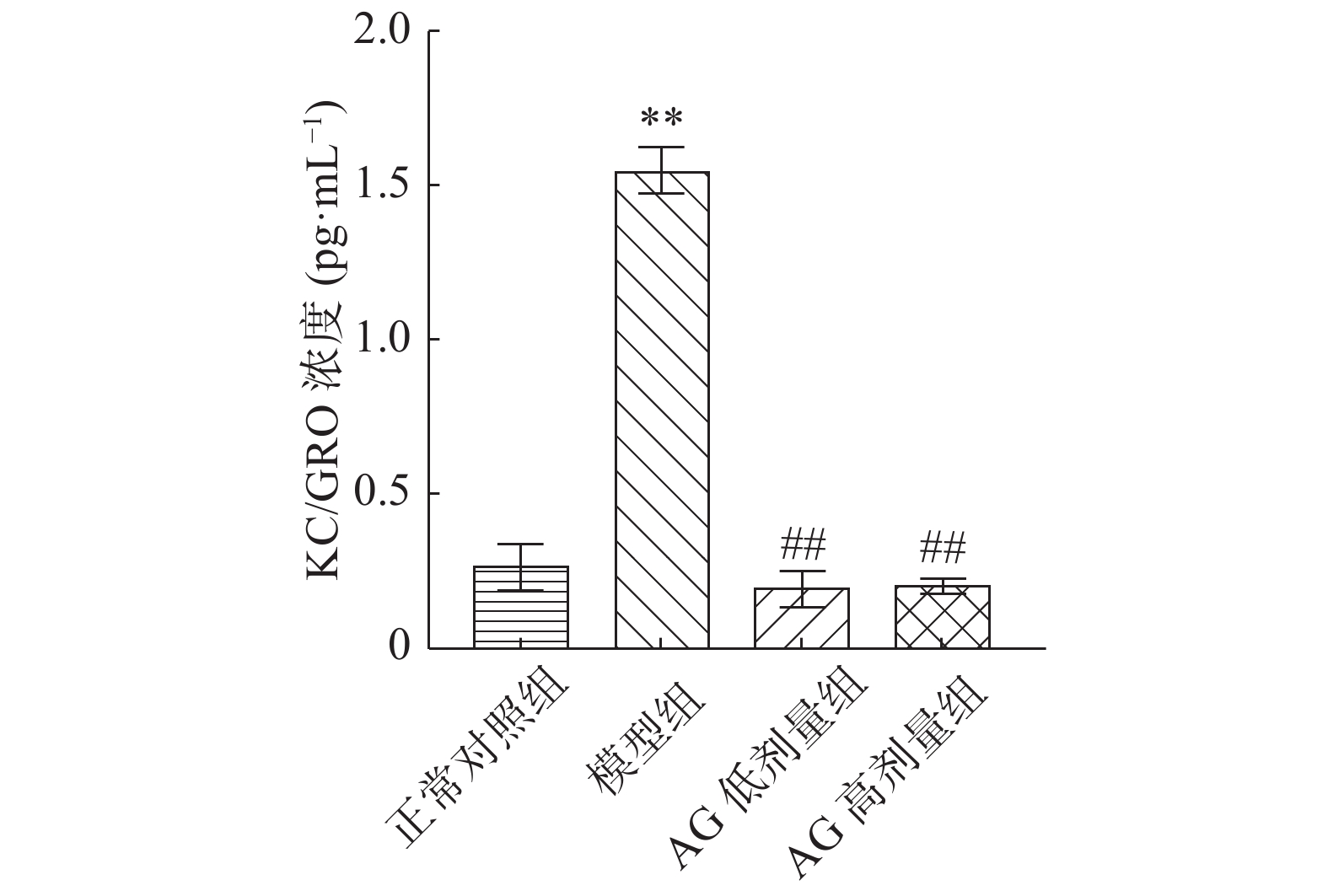
2.4.3 白细胞介素KC/GRO含量变化
如图4表示,与正常对照组相比,模型组KC/GRO浓度极显著升高(P<0.01);与模型组相比,AG剂量组KC/GRO浓度均极显著降低(P<0.01)。
KC/GRO是趋化因子中的一种,推测其表达与细胞生长有关,与受体结合后可促进炎症反应[29]。总体来说,由于摄入高脂肪食物会导致肠道中LPS的释放,破坏肠道粘膜从而刺激炎症因子的释放[37],然而,目前还没有对趋化因子的数据支撑。因此,本试验结果表明AG能够有效降低糖尿病大鼠肠液中KC/GRO,进而降低促炎因子。其可能的原因是AG降低LPS及炎症因子的浓度从而减少GRO的表达,进而有效改善T2DM。
3. 结论
本研究通过糖尿病模型大鼠实验研究发现,AG可以维持血糖稳定,提高肠道中IAP活力,有效降低LPS浓度,调控大鼠肠道中炎症因子(IL-6、TNF-α、IFN-γ、IL-1β、IL-4、IL-5、IL-10及IL-13)和KC/GRO水平,因此AG能够有效改善T2DM。其作用机制可能是通过调节肠道中IAP活力刺激LPS浓度的变化来调控炎症因子来实现的,未来需要进一步研究含有AG成分的物质能否调控参与改善机体炎症及血糖代谢,缓解T2DM的发展。
-
表 1 AG对2型糖尿病大鼠空腹血糖的影响(
ˉx±s , n=10)Table 1 Effect of arabinogalactan on fasting blood glucose in type 2 diabetic rats (
ˉx±s , n=10)组别 血糖含量(mmol/L) 0 d 7 d 14 d 21 d 28 d 正常对照组 5.6800±0.1302 5.8000±0.1441 5.3000±0.8280 6.2000±0.7010c 5.6000±0.5940 模型组 5.9000±0.3106 16.2000±0.7219** 15.0000±2.5700** 15.6000±1.7380** 16.1000±1.7040** AG低剂量组 5.6733±0.1512 16.9000±0.7967 15.7000±1.5220 14.3000±2.5200 12.5000±1.5540# AG高剂量组 5.7500±0.2552 16.5000±3.1240 14.5000±2.7750 13.4000±2.5290# 11.2000±1.7100# 注:*表示与正常对照组相比,P<0.05;**表示与正常对照组相比,P<0.01;#表示与模型组相比,P<0.05;##表示与模型组相比,P<0.01;表2同。 表 2 AG对2型糖尿病大鼠粪便中IAP和LPS影响(
ˉx±s , n=10)Table 2 Effect of arabinogalactan powder on IAP and IAP in fecal of type 2 diabetic rats (
ˉx±s , n=10)组别 LPS(EU/mL) IAP活性(U) 正常对照组 3.664±0.201 87.550±0.387 模型组 7.813±0.4364* 31.367±0.469** AG低剂量组 2.270±0.081# 94.668±1.807## AG高剂量组 2.321±0.0329# 95.707±0.388## -
[1] Shoelson S E, Lee J, Goldfine A B. Review series inflammation and insulin resistance[J]. Clin Invest,2006,116(7):1793−1801. doi: 10.1172/JCI29069
[2] 杨喜艳, 卢放根. 肠源性脂多糖的研究进展[J]. 临床与病理杂志,2013,33(5):416−423. doi: 10.3969/j.issn.1673-2588.2013.05.012 [3] 魏伊秋, 李满, 余佳. 慢性炎症与胰岛素抵抗机制关系的研究进展[J]. 临床与病理杂志,2019,39(3):640−645. doi: 10.3978/j.issn.2095-6959.2019.03.030 [4] 李筠. 内毒素在肝衰竭形成中的作用及中医药治疗[J]. 传染病信息,2010,23(5):260−262. doi: 10.3969/j.issn.1007-8134.2010.05.002 [5] Bates J M, Akerlund J, Mittge E, et al. Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota[J]. Cell Host Microbe,2007,2(6):371−382. doi: 10.1016/j.chom.2007.10.010
[6] 中华人民共和国商业部土产废品局等编. 中国经济植物志[M]. 北京: 科学出版社, 2012. [7] Kelly G S. Larch arabinogalactan: Clinical relevance of a novel immune-enhancing polysaccharide[J]. Alternative Medicine Review A Journal of Clinical Therapeutic,1999,4(2):96.
[8] Udani J. Immunomodulatory effects of resist aid™: A randomized, double-blind, placebo-controlled, multidose study[J]. Journal of the American College of Nutrition,2013,32:331−338. doi: 10.1080/07315724.2013.839907
[9] Yang L C, Lai C Y, Hsieh C C, et al. Natural killer cell-mediated anticancer effects of an arabinogalactan derived from rice hull in CT26 colon cancer-bearing mice[J]. Int J Biol Macromol,2019,124:368−376. doi: 10.1016/j.ijbiomac.2018.11.200
[10] Wu J, Xu Y, Zhu B, et al. Characterization of an arabinogalactan from the fruit hulls of Ficus pumila Linn. and its immunomodulatory effect[J]. Journal of Functional Foods,2020,73:104091. doi: 10.1016/j.jff.2020.104091
[11] Wang H, Shi S, Bao B, et al. Structure characterization of an arabinogalactan from green tea and its anti-diabetic effect[J]. Carbohydrate Polymers,2015,124:98−108. doi: 10.1016/j.carbpol.2015.01.070
[12] Naik S R, Panda V S. Antioxidant and hepatoprotective effects of Ginkgo biloba phytosomes in carbon tetrachloride-induced liver injury in rodents[J]. Liver International,2010,27(3):393−399.
[13] 牛雅杰. 紫锥菊提取物抗胰岛素抵抗作用及功能饮料的研制[D]. 杨凌: 西北农林科技大学, 2017. [14] 金祖汉, 王香英, 毛培江, 等. 治疗糖尿病高频中药的降血糖作用研究[J]. 中国现代应用药学,2009,26(4):267−270. [15] 李璐, 王永香, 王秀海, 等. 地龙及其复方治疗糖尿病肾病的机制研究进展[J]. 中国实验方剂学杂志,2017,23(7):227−234. [16] Broocks A, Ahrendt U, Sommer M. ACE-inhibitor suppresses the apoptosis induced by endoplasmic reticulum stress in renal tubular in experimental diabetic rats[J]. Exp Clin Endocrinol Diabetes,2009,117(7):336−344. doi: 10.1055/s-0028-1112148
[17] 彭燕, 张玲莉, 王宗春. 显色基质法检测乳酸左氧氟沙星氯化钠注射液细菌内毒素含量[J]. 中国药师,2013,16(10):1597−1599. doi: 10.3969/j.issn.1008-049X.2013.10.064 [18] Reed M J, Meszaros K, Entes L J , et al. A new rat model of type 2 diabetes: The fat-fed, streptozotocin-treated rat[J]. Metabolism-clinical Experimental,2000,49(11):1390−1394.
[19] Zhou L, Hu Y, Li C, et al. Levo-corydalmine alleviates vincristine-induced neuropathic pain in mice by inhibiting an NF-kappa B-dependent CXCL1/CXCR2 signaling pathway[J]. Neuropharmacology,2018,135:34−47. doi: 10.1016/j.neuropharm.2018.03.004
[20] 张莹芳. 糖尿病治疗药物的现状及进展[J]. 海峡药学,2006(2):7−11. doi: 10.3969/j.issn.1006-3765.2006.02.004 [21] Abbas A, Aster J, Kumar V. Robbins basic pathology, 9th Ed[M]. hiladelphia, Pennsylvania USA: Saunders; 2012.
[22] Fawley J, Gourlay D. Intestinal alkaline phosphatase: A summary of its role in clinical disease[J]. Journal of Surgical Research,2016,202(1):225−234. doi: 10.1016/j.jss.2015.12.008
[23] Jean-Paul L. Intestinal alkaline phosphatase: Novel functions and protective effects[J]. Nutrition Reviews,2014(2):82−94.
[24] Lu Y C, Yeh W C, Ohashi P S. LPS/TLR4 signal transduction pathway[J]. J Cytokine,2008,42(2):1−151.
[25] Kaliannan K, Hamarneh S R, Economopoulos K P, et al. Intestinal alkaline phosphatase prevents metabolic syndrome in mice[J]. Proceedings of the National Academy of Sciences,2013,110(17):7003−7008. doi: 10.1073/pnas.1220180110
[26] Lallès J P. Intestinal alkaline phosphatase: Multiple biological roles in maintenance of intestinal homeostasis and modulation by diet[J]. Nutr Rev,2010,68(6):323−332. doi: 10.1111/j.1753-4887.2010.00292.x
[27] 李晓晶, 刘瑾, 隋在云. 黄芪和山药配伍微粉对糖尿病肾病大鼠的保护作用[J]. 时珍国医国药,2014(1):46−48. [28] 李阳. 黄连、生地及其配伍对胰岛素抵抗脂肪细胞TNF-α、IL-1β与IL-6分泌及mRNA表达的影响[D]. 武汉: 华中科技大学, 2013. [29] 戴红, 李娜, 陈欣怡, 等. 玉液汤及其拆方对糖尿病大鼠炎性因子IL-1β、IL-6、TNF-α影响的实验研究[J]. 时珍国医国药,2015,26(1):59−62. [30] Tabarsa M, Dabaghian E H, You S, et al. Inducing inflammatory response in RAW264.7 and NK-92 cells by an arabinogalactan isolated from Ferula gummosa via NF-κB and MAPK signaling pathways[J]. Carbohydrate Polymers,2020,241:116358. doi: 10.1016/j.carbpol.2020.116358
[31] Yang L-C, Lai C-Y, Lin W-C. Natural killer cell-mediated cytotoxicity is increased by a type II arabinogalactan from Anoectochilus formosanus[J]. Carbohydrate Polymers,2017,155:466−474. doi: 10.1016/j.carbpol.2016.08.086
[32] Bahramzadeh S, Tabarsa M, You S, et al. An arabinogalactan isolated from Boswellia carterii: Purification, structural elucidation and macrophage stimulation via NF-κB and MAPK pathways[J]. Journal of Functional Foods,2019,52:450−458. doi: 10.1016/j.jff.2018.11.025
[33] 常柏, 李巧芬, 李春深, 等. 抵挡汤早期干预对2型糖尿病大鼠血清IL-4、IL-13水平及主动脉TNF-α mRNA表达的影响[J]. 四川中医,2013,31(3):48−50. [34] 赵进东, 倪英群, 陆瑞敏, 等. 基于肠道菌群探讨中医药防治糖尿病研究进展[J]. 安徽中医药大学学报,2018,37(5):89−92. doi: 10.3969/j.issn.2095-7246.2018.05.025 [35] William H, Dhouib, Rabeb, et al. The presence of a galactosamine substituent on the arabinogalactan of mycobacterium tuberculosis abrogates full maturation of human peripheral blood monocyte-derived dendritic cells and increases secretion of IL-10[J]. Tuberculosis,2015,95(4):476−489. doi: 10.1016/j.tube.2015.04.002
[36] Yang J, Dong H, Wang Y, et al. Cordyceps cicadae polysaccharides ameliorated renal interstitial fibrosis in diabetic nephropathy rats by repressing inflammation and modulating gut microbiota dysbiosis[J]. International Journal of Biological Macromolecules,2020,163:442−456. doi: 10.1016/j.ijbiomac.2020.06.153
[37] 章常华, 马广强, 邓永兵, 等. 葛根芩连汤对KK-Ay糖尿病小鼠血浆中LPS、TNF-α、IL-6及肠道菌群的影响[J]. 中草药,2017,48(8):1611−1616. -
期刊类型引用(10)
1. 周涛,聂艳丽,李翠萍,王大玮. 云南澳洲坚果果实内含物测定及多样性分析. 种子. 2025(01): 31-38 .  百度学术
百度学术
2. 曾丽琴,陈雅茹,刘淑集,张玉苍,陈晓婷,苏永昌,罗联钰,刘智禹. 沙丁鱼鱼鳞胶原蛋白肽的制备及其抗氧化活性研究. 食品安全质量检测学报. 2024(03): 214-224 .  百度学术
百度学术
3. 付镓榕,马尚玄,魏元苗,徐文婷,郭刚军,贺熙勇. 澳洲坚果抗氧化肽的分离纯化及肽段鉴定. 食品工业科技. 2024(06): 91-99 .  本站查看
本站查看
4. 袁高阳,秦心睿,聂晓兵,金文芳,杨玉玉,刘诗菡,范宝磊,苗潇磊. 基于熵权TOPSIS模型对白芨多糖脱蛋白体系的评价研究. 食品工业科技. 2024(07): 76-85 .  本站查看
本站查看
5. 徐文婷,付镓榕,马尚玄,魏元苗,杨悦雪,黄克昌,郭刚军,贺熙勇. 不同包装和贮藏温度的澳洲坚果果仁贮藏品质及货架期预测. 食品科学. 2024(16): 232-243 .  百度学术
百度学术
6. 焦婷,朱北平,郭文亮,焦健,韩善明,房桂干,谢章红. 3种木质纤维原料热水抽出物抗氧化性的研究. 中国造纸学报. 2024(03): 63-70 .  百度学术
百度学术
7. 赵艺科,吴桐,孙孟琪,万茜淋,张哲,杨洪梅. 高分辨液相色谱-串联质谱法分析冻干西洋参抗氧化多肽. 质谱学报. 2024(06): 851-860 .  百度学术
百度学术
8. 常茹菲,葛运兵,杨晓丽,张红星,谢远红. 酶解法制备澳洲坚果蛋白肽工艺优化研究. 中国粮油学报. 2024(10): 102-108 .  百度学术
百度学术
9. 赵一萌,索晓雄,刘彩霞,杜晨晖,闫艳,裴香萍. 不同分子质量酸枣仁多肽制备及功能特性研究. 食品与发酵工业. 2024(24): 91-96 .  百度学术
百度学术
10. 洪燕婷,颜阿娜,汪少芸,蔡茜茜. 马鲛鱼骨抗氧化肽的酶解工艺及性质研究. 青海大学学报. 2024(06): 58-66+82 .  百度学术
百度学术
其他类型引用(2)







 下载:
下载:










 下载:
下载:



