Separation, Purification and Identification of Antioxidant Peptides Derived from Macadamia integrifolia
-
摘要: 为研究澳洲坚果抗氧化肽的抗氧化活性和氨基酸组成,以复配蛋白酶水解澳洲坚果粕制备粗多肽,利用超滤、大孔树脂纯化技术制备了抗氧化活性最佳的分子量小于1000 Da的多肽,采用Sephadex G-15凝胶对其分离并评价各组分对DPPH、羟基、ABTS+自由基的清除能力与还原能力,筛选出抗氧化活性最强组分,利用液相色谱-串联质谱技术(liquid chromatography and tandem mass spectrometry,LC-MS/MS)进行鉴定并分析。结果表明,葡聚糖凝胶柱层析分离出G1、G2、G3组分,其中G3具有最佳的抗氧化活性,其羟基自由基清除能力半抑制浓度(half maximal inhibitory concentration,IC50)6.18 mg/mL与还原能力IC50 2.19 mg/mL优于谷胱甘肽,DPPH自由基清除能力IC50 0.50 mg/mL,ABTS+自由基清除能力IC50 0.02 mg/mL;通过液相色谱-串联质谱鉴定G3含有46个肽段,肽段长度均小于10个氨基酸,匹配得分大于200分的9条肽段分子量为631~920 Da,均无毒性;筛选获得高抗氧化活性肽HLLPK、KEFFP、KEFFPA,其分子量 分别为606.84、666.83、737.92 Da。本研究初步揭示了澳洲坚果抗氧化肽组成,深化了澳洲坚果抗氧化肽的研究,为澳洲坚果抗氧化肽的开发利用提供了理论参考。Abstract: To research the antioxidant activity and amino acid composition of antioxidant peptides from Macadamia integrifolia, the Macadamia integrifolia polypeptides were prepared by complex protease enzymatic hydrolysis, the constituents with optimal antioxidant activity (molecular weight less than 1000 Da) were obtained by macroporous resin and dialysis technology. The polypeptides were separated by Sephadex G-15 gel, and the scavenging and reducing ability of 1,1-diphenyl-2-picrylhydrazyl (DPPH), hydroxyl and 2,2’-azino-bis (3-ethylbenzothiazoline-6-sulfonate) radicals (ABTS+) of each component were evaluated. The optimal antioxidant components were separated and identified and analyzed by liquid chromatography and tandem mass spectrometry (LC-MS/MS). The results showed that, the G1, G2 and G3 were isolated by dextran gel column chromatography, G3 had the strongest antioxidant activity, its scavenging and reducing capacity of hydroxyl radicals was superior to glutathione with half maximal inhibitory concentration (IC50) of 6.18 mg/mL and 2.19 mg/mL, respectively. The half maximal inhibitory concentration (IC50) of scavenging capacity of DPPH and ABTS+ was 0.50 and 0.02 mg/mL, respectively. G3 was identified by liquid chromatography tandem mass spectrometry to contain 46 peptides, the length of each peptide was less than 10 amino acids. The molecular weights of the 9 peptides with matching scores more than 200 were 631~920 Da, and with no toxicity. The screened peptides with high antioxidant activity were HLLPK, KEFFP and KEFFPA, the molecular weights of them were 606.84, 666.83 and 737.92 Da, respectively. This research preliminarily revealed the antioxidant peptides composition of macadamia nut, deepened the research of antioxidant peptide of Macadamia integrifolia, and would provide a theoretical reference for the development and utilization of antioxidant peptide of Macadamia integrifolia.
-
澳洲坚果(Macadamia integrifolia)为山龙眼科、澳洲坚果属的常绿乔木果树,原产于澳大利亚昆士兰东南部和新南威尔士东北部沿岸的亚热带雨林地区,别称夏威夷果、澳洲核桃等,是一种珍贵的可食用干果,被誉为“干果皇后”、“世界坚果之王”,具有很高的经济价值[1]。近年来,澳洲坚果产业发展迅猛,2020年末我国澳洲坚果种植面积为26.61万hm2,云南省澳洲坚果种植面积为23.53万hm2,产量(壳果,含水量10%)为7.50万t[2]。澳洲坚果果仁蛋白质丰富,含量达8%~20%[3],总氨基酸含量平均为81.82 mg/g,种类齐全,共富含17种氨基酸,其中包括7种人体必需氨基酸[4],对其进行深加工制备功能性多肽能有效提高其利用率及经济价值[5]。
蛋白质在蛋白酶的作用下分解成多肽,氨基酸的组成和肽序列会影响其生物活性,从而赋予其降血压、抗氧化和抑菌等不同的生物活性[6−8]。目前,利用生物酶法制备澳洲坚果多肽,研究其抑菌活性、抗氧化活性的研究已有一些报道[8−9],但对澳洲坚果抗氧化肽的分离纯化,结构鉴定相关研究未见报道。利用葡聚糖凝胶可以将多肽根据分子量的大小进行分离,且具有分离条件温和、对样品活性影响较小、可再生等特点,广泛应用在蛋白质水解物的分离中[10],LC-MS/MS技术能准确定量定性分析复杂混合物,在多肽结构鉴定中应用广泛[11]。课题组前期对制备澳洲坚果抗氧化肽的蛋白酶进行了筛选,采用超滤对抗氧化肽进行分级并用大孔树脂进行除杂,筛选得到分子量小于1000 Da的组分具有最佳的抗氧化活性[12]。本研究采用葡聚糖凝胶柱层析的方法对分子量小于1000 Da的澳洲坚果抗氧化肽进行分离纯化处理,通过测定DPPH、羟基、ABTS+自由基清除能力与还原能力评价各级纯化肽的抗氧化能力;将抗氧化活性最强的组分采用LC-MS/MS进行鉴定,得到多肽的氨基酸系列,进行抗氧化活性、安全性、水溶性分析,为澳洲坚果的开发利用及澳洲坚果抗氧化肽的深度研究提供数据支撑。
1. 材料与方法
1.1 材料与仪器
液压压榨澳洲坚果粕 西双版纳云垦澳洲坚果科技开发有限公司;复配蛋白酶(20万U/g) 南宁东恒华道生物科技有限责任公司;DA201-C大孔树脂 郑州和成新材料科技有限公司;Sephadex G-15葡聚糖凝胶 合肥博美生物科技有限公司;还原型谷胱甘肽 上海金穗生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2’-联氮-双(3-乙基-苯并噻唑-6-磺酸)二胺盐(ABTS+)、甲酸(质谱级)、碳酸氢铵(质谱级)、二硫苏糖醇、碘乙酰胺 美国Sigma公司;乙腈 美国Thermo公司;氢氧化钠、三氯乙酸、无水乙醇等 分析纯,国药集团化学试剂有限公司。
Easy-nLC 1200纳升级超高效液相色谱仪、电喷雾组合型离子阱Orbitrap质谱仪 美国Thermo公司;Acclaim PepMap RPLC C18色谱柱(1.9 μm,100Å 德国Dr.Maisch GmbH;RV10型旋转蒸发仪 艾卡仪器设备有限公司;真空离心浓缩仪 德国Eppendorf公司;Microfuge 22R型低温高速离心机 美国Beckman Coulter公司;ME204E型电子分析天平、FiveEasy型pH计 梅特勒-托利多仪器有限公司;UV754N型紫外可见分光光度计 上海精风仪器有限公司;TGL-16C型离心机 上海安亭科学仪器厂;TD5A-WS型台式离心机 湖南湘仪实验室仪器开发有限公司;DBS-160型部分收集器 上海嘉鹏科技有限公司;BPH-9042型恒温培养箱 上海一恒科学仪器有限公司;玻璃层析柱(φ1.0 cm×60 cm) 北京瑞达恒辉科技发展有限公司。
1.2 实验方法
1.2.1 澳洲坚果多肽的制备
参照课题组前期试验制备分子量小于1000 Da的澳洲坚果抗氧化肽,将液压压榨的澳洲坚果果粕进行粉碎过60目筛(孔径0.25 mm),果粕粉与去离子水按照1:10比例混合,沸水浴10 min后冷却至55 ℃,加酶量1000 U/g,酶解pH7.5,55 ℃酶解3 h后沸水浴15 min灭酶,冷却至室温后4000 r/min离心20 min,取上清液调pH至4.6(澳洲坚果蛋白等电点)静置30 min,4000 r/min离心10 min,取上清液调pH至7.0,过1000 Da超滤膜,将分子量小于1000 Da的多肽液用DA201-C大孔树脂除杂(上样流速1 mL/min、上样浓度15 mg/mL,上样体积200 mL;水洗脱流速2 mL/min,水洗脱体积400 mL;400 mL 75%乙醇解吸,流速为2 mL/min),得到分子量小于1000 Da的澳洲坚果多肽,备用。
1.2.2 葡聚糖凝胶Sephadex G-15分离纯化
将1.2.1中制备的澳洲坚果抗氧化肽进行葡聚糖凝胶分离纯化。参照姚轶俊等[13]的实验方法,采取自然沉降法装柱,用蒸馏水平衡后上样,上样浓度为15 mg/mL,上样量为2 mL,洗脱流速为0.3 mL/min,用蒸馏水进行洗脱,3 mL收集为一管,在280 nm波长处检测吸光度,分别收集各洗脱峰,测定各洗脱峰的抗氧化活性。
1.2.3 多肽浓度的测定
采用双缩脲法进行测定,参照郭刚军等[14]的方法进行实验,以标准酪蛋白为标样制作标准曲线,得出吸光值为纵坐标(Y),酪蛋白质量浓度为横坐标(X)的回归方程为Y=0.0461X+0.0053(R2=0.9995)。
将多肽液与等体积10%的三氯乙酸(TCA)混合,静置30 min,在4000 r/min下离心20 min,以除去不溶性的蛋白质和长肽链,取1 mL上清液,加4 mL双缩脲试剂,混匀后在室温下放置30 min,540 nm处测定吸光值(A),按照公式计算多肽浓度。
多肽浓度(mg/mL)=A−0.00530.0461 式中:A为吸光值(1 mL上清液+4 mL双缩脲)。
1.2.4 澳洲坚果多肽的抗氧化活性测定
参照前期试验方法[12]测定谷胱甘肽和不同浓度多肽液的DPPH、羟基、ABTS+自由基清除能力与还原能力,计算得出回归方程及相关系数r(r值越接近1,相关性越好),利用回归方程计算半抑制浓度(half maximal inhibitory concentration,IC50),即清除率达到50%时对应的样品浓度,IC50越小,抗氧化能力越强。
1.2.5 抗氧化肽鉴定与分析
将1.2.4选出的最优组分进行LC-MS/MS鉴定。色谱条件:50 μm×15 cm自制柱,填充反相Acclaim PepMap RPLC C18(1.9 μm,100Å);装样量:5 μL;流动相:A:0.1%甲酸水溶液;B:乙腈中0.1%甲酸;总流量:600 nL/min;LC线性梯度:4%~8% B 2 min,8%~28% B 43 min,28%~40% B 10 min,40%~95% B 1 min,95%~95% B 10 min。质谱条件:采用电喷雾-组合型离子阱Orbitrap质谱仪喷淋电压:2.2 kV,毛细管温度:270 ℃。
利用Byonic对原始MS文件进行分析,基于Uniprot_Bos_taurus数据库(https://www.uniprot.org)进行蛋白质和肽段鉴定及定量分析。参照Lafarga等[15]的预测方法,采用ToxinPred (https://webs.iiitd.edu.in/raghava/toxinpred/design.php)预测毒性;采用Innovagen (http://www.innovagen.com/proteomics-tools)预测水溶性。
1.3 数据处理
所有实验重复三次,结果用平均值±标准差(mean±SD)表示。采用Microsoft Excel 2019进行数据录入、处理与计算回归方程;采用SPSS 27.0统计软件进行数据分析,组间差异用多重比较分析(LSD)、单因素方差分析(One-way ANOVA)进行处理,P<0.05表示差异显著;用皮尔森法(Pearson’s)进行相关性分析,P<0.01为极显著性相关。使用Origin 2021对进行作图。
2. 结果与分析
2.1 澳洲坚果多肽的葡聚糖凝胶分离纯化
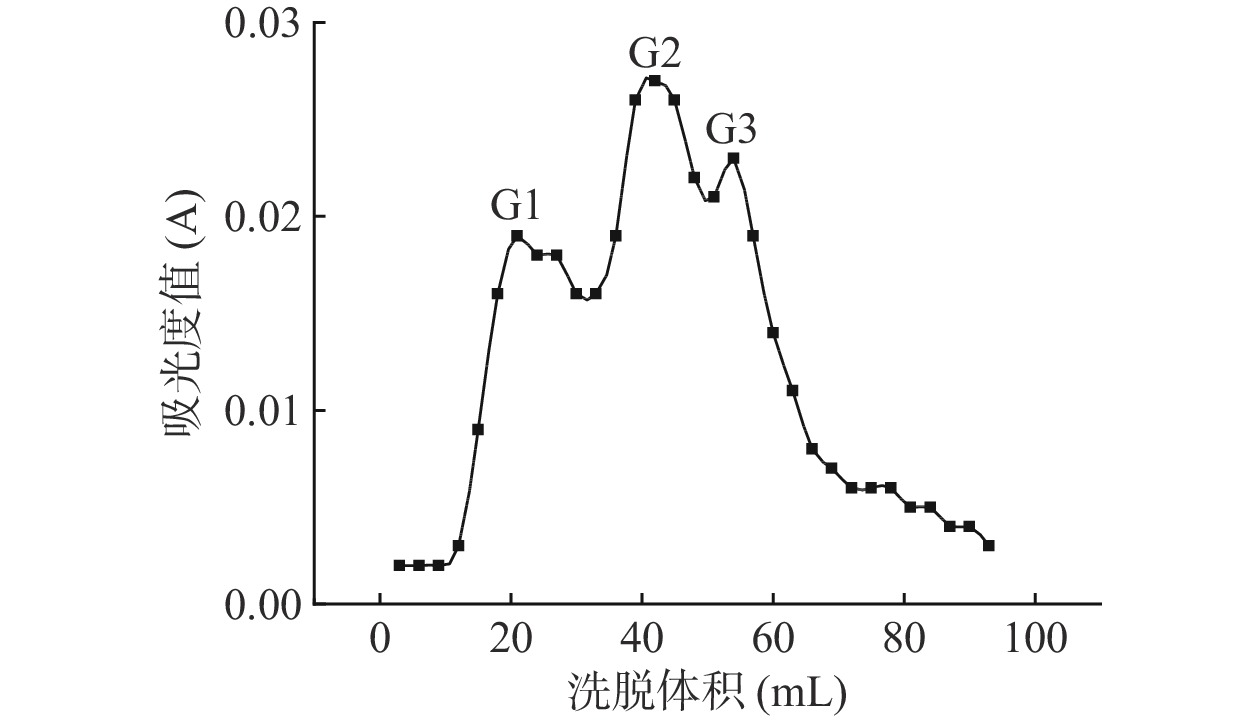
超滤只是一个压力驱动的膜分离过程,很难分离出分子量精确的多肽,进一步采用葡聚糖凝胶分离进行纯化,可以获得更精确的组分[16]。葡聚糖凝胶柱根据分子量大小对多肽进行分离,在蛋白质水解物的分离中应用广泛[9]。分子量小于1000 Da的澳洲坚果抗氧化肽经Sephadex G-15凝胶柱分离出3个分子量大小不同的组分,结果如图1所示,标记为G1、G2、G3。在葡聚糖凝胶分离纯化中分子量大的组分在凝胶柱中保留时间短,分子量小在凝胶柱中保留时间长[17],由图1可知G1分子量最大,G3分子量最小。
2.2 澳洲坚果多肽组分抗氧化活性
葡聚糖凝胶是利用分子筛原理,可以根据截留分子量的大小不同对物质分离,且分离条件温和,对样品活性影响较小并且可重复利用,被广泛应用于活性物质的分离,尤其是蛋白和多肽的分离[12,18]。利用多重抗氧化评估体系(DPPH、ABTS+、羟基自由基清除率、还原能力)对不同分子量大小的三个澳洲坚果多肽组分进行抗氧化活性研究,以谷胱甘肽溶液作为对照,结果如图2~图5所示,并分析各组分抗氧化活性回归方程及IC50值,结果如表1~表4所示。
表 1 澳洲坚果多肽不同组分对DPPH自由基清除能力的回归方程分析Table 1. Analysis by regression equation of different components of macadamia nut polypeptides on DPPH radical scavenging ability样品 回归方程 IC50(mg/mL) r G1 y=15.41lnx+30.05 3.65 0.9768 G2 y=12.66lnx+29.06 5.23 0.9699 G3 y=25.06lnx+67.53 0.50 0.9981 谷胱甘肽 y=12.07lnx+102.31 0.01 0.9597 表 4 澳洲坚果多肽不同组分还原能力的回归方程分析Table 4. Regression equation analysis of different components of macadamia nut polypeptides on reducing power样品 回归方程 IC50(mg/mL) r G1 y=0.2849lnx−0.0955 8.09 0.9806 G2 y−0.2473lnx−0.0331 8.63 0.9787 G3 y=0.7795lnx−0.1104 2.19 0.9832 谷胱甘肽 y=0.3812lnx−0.0606 4.35 0.9869 2.2.1 不同组分澳洲坚果多肽对DPPH自由基的清除作用
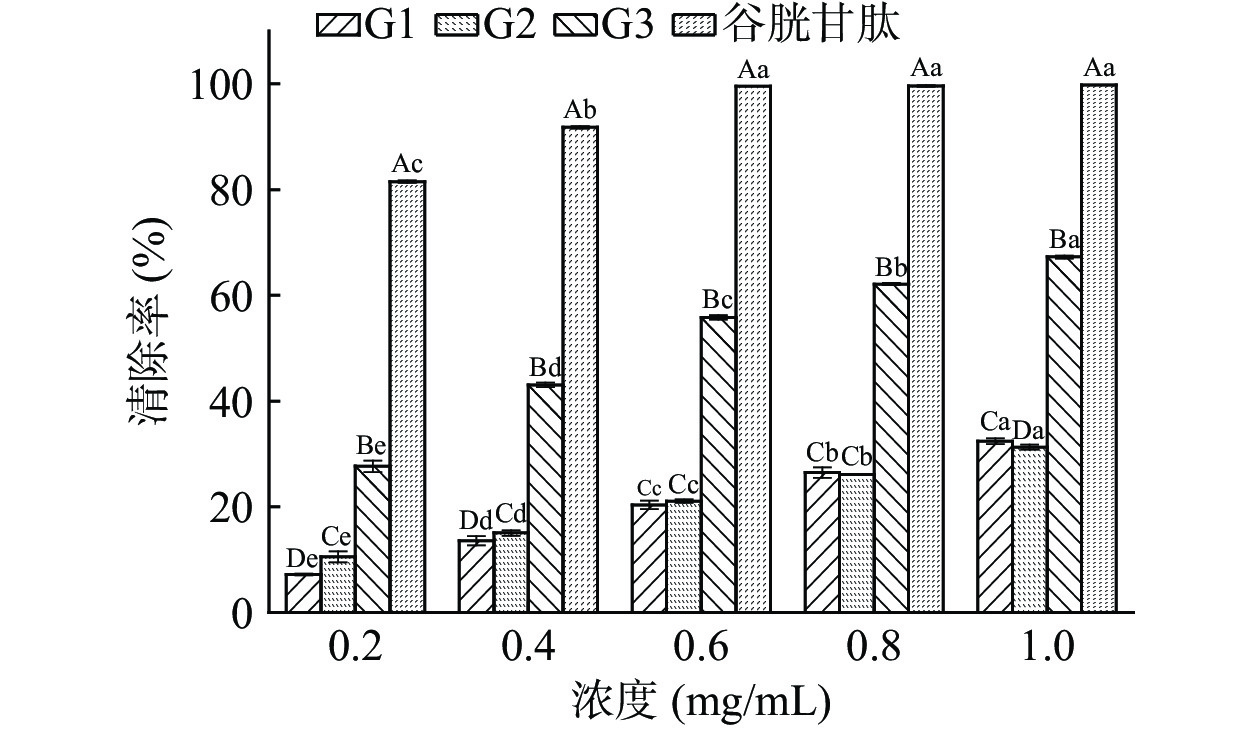
DPPH自由基清除率广泛应用于研究物质的体外抗氧化活性[19−20]。由图2及表1可见,3个澳洲坚果多肽组分及谷胱甘肽对DPPH自由基均有清除作用,且清除率随着样品浓度的增加而增强,有较好的量-效关系。在相同浓度下,G3的清除能力显著(P<0.05)优于G1、G2,且均低于谷胱甘肽。在浓度0.2 mg/mL时,G3的清除率最优为27.67%±1.08%,其后依次为G2(10.55%±1.04%)、G1(7.20%±0.14%)。随着浓度的增加,各组分的清除率增加速率不同,当浓度达到0.6、0.8 mg/mL时,G1、G2的清除率无显著性差异(P>0.05),当浓度达到1.0 mg/mL时,G3的清除率最优为67.27%±0.28%,其次为G1(32.43%±0.56%)、G2(31.26%±0.48%)。从评价样品对DPPH自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对DPPH自由基清除能力大小顺序为:谷胱甘肽(IC50 0.01 mg/mL)>G3(IC50 0.50 mg/mL)>G1(IC50 3.65 mg/mL)>G2(IC50 5.23 mg/mL),不同多肽组分对DPPH自由基的清除能力不同。参考图1中的出峰位置,G3出峰位置靠后,多肽的分子量小,这与不同分子量的核桃、红花籽、绿豆多肽的抗氧化活性研究结果相同,分子量较小的多肽抗氧化活性显著高于分子量较大的多肽[21−23]。在本研究中,G1对DPPH自由基的清除能力优于G2,可能是G1具有较多电子致密的侧链基团,疏水性较强,更易于与DPPH自由基结合,有助于提高其抗氧化活性,这与齐希光等[24]发现黑籽瓜种子中高分子量多肽具有电子致密的侧链基团和较高的疏水性,更易于与DPPH自由基结合的结果相符。
2.2.2 不同组分澳洲坚果多肽对羟基自由基的清除作用
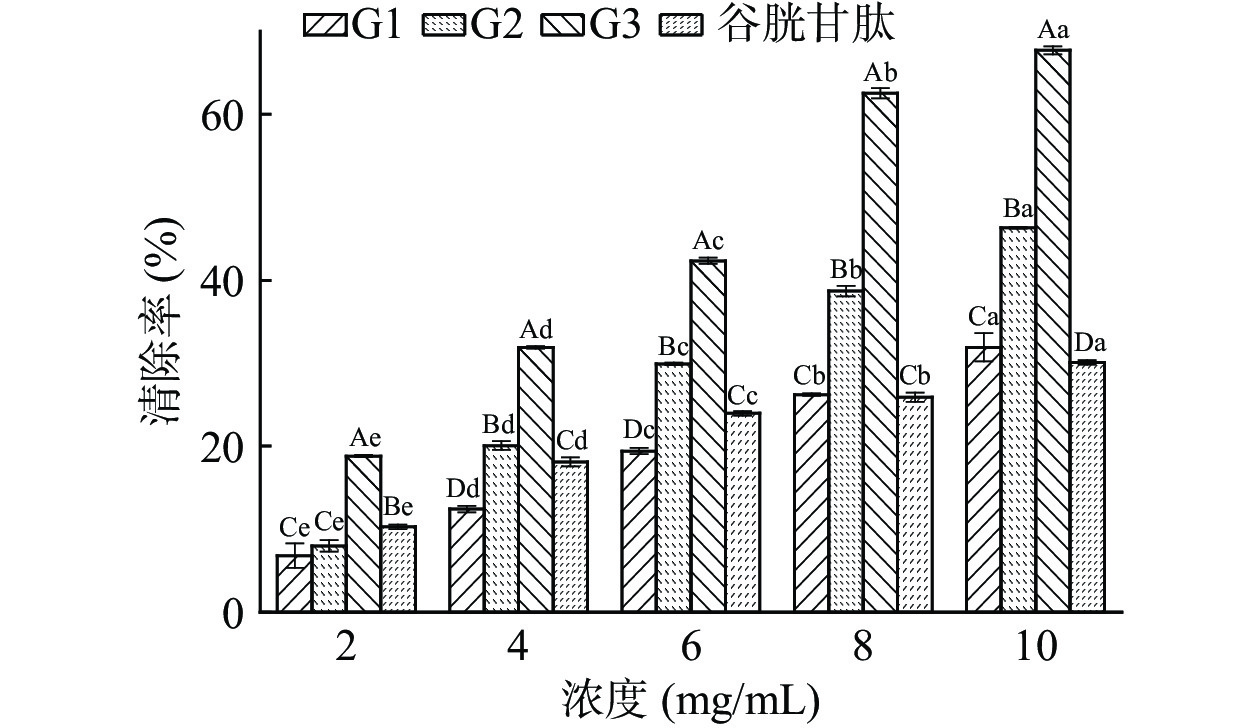
羟基自由基是广泛存在于生物体内的一种自由基,是氧自由基中最活泼的自由基,羟基自由基会引起生物体损伤,羟基自由基清除率是反映物质抗氧化作用的重要指标[25]。从图3及表2可以看出,3个澳洲坚果多肽组分及谷胱甘肽对羟基自由基有较强的清除能力,且清除率与其浓度呈正相关。G3对羟基自由基的清除率最大,在浓度2.0 mg/mL时,G3的清除率最优为18.82%±0.14%,G1、G2的清除率较低分别为6.79%±1.47%、7.99%±0.69%,且两者之间无显著性差异(P>0.05)。随着浓度的增加,清除率的增加速率大小顺序为G3、G2、G1、谷胱甘肽。当浓度达到10.0 mg/mL,3个组分的清除率均高于谷胱甘肽且具有显著性差异(P<0.05),G3的清除率最优为67.71%±0.48%。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对羟基自由基清除能力大小顺序为:G3(IC50 6.18 mg/mL)>G2(IC50 12.92 mg/mL)>G1(IC50 37.77 mg/mL)>谷胱甘肽(IC50 54.78 mg/mL),不同多肽组分对羟基自由基的清除能力不同,可能是因为G3分子量较小可阻断自由基链式反应,促使自由基转化成更加稳定的物质,表现出更好的羟基自由基清除能力[26]。
表 2 澳洲坚果多肽不同组分对羟基自由基清除能力的回归方程分析Table 2. Regression equation analysis of different components of macadamia nut polypeptides on hydroxyl radical scavenging ability样品 回归方程 IC50(mg/mL) r G1 y=15.47lnx−6.18 37.77 0.9706 G2 y=23.56lnx−10.29 12.92 0.9897 G3 y=31.24lnx−6.91 6.18 0.9671 谷胱甘肽 y=12.04lnx+1.80 54.78 0.9964 2.2.3 不同组分澳洲坚果多肽对ABTS+自由基的清除作用
ABTS+自由基清除率广泛运用于体外抗氧化活性的评价,该方法具有操作简便、反应迅速、灵敏度高等特点[27−28]。由图4及表3可见,3个澳洲坚果多肽组分及谷胱甘肽对ABTS+自由基的清除能力均随样品质量浓度的增加而增大。不同组分对ABTS+的清除率具有显著性差异(P<0.05),G3、谷胱甘肽的清除率高于G1、G2。浓度为0.2、0.4 mg/mL时,3个多肽组分的清除率均低于谷胱甘肽。随着浓度的增加,清除率的增加速率大小顺序为G1、G2、G3、谷胱甘肽。当浓度达到0.6 mg/mL时,G3的清除率为94.35±0.08%,高于谷胱甘肽的清除率91.37%±0.08%;当浓度达到1.0 mg/mL时,G3的清除率为94.27%±0.00%与谷胱甘肽94.56%±0.41%无显著性差异(P>0.05),优于其它评价样品,G1与G2的清除率分别为89.55%±0.70%、84.57%±0.17%,两者之间差异性显著(P<0.05)。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对ABTS+自由基清除能力大小顺序为:谷胱甘肽(IC50 0.00003 mg/mL)>G3(IC50 0.02 mg/mL)>G1(IC50 0.31 mg/mL)>G2(IC50 0.36 mg/mL),G3对ABTS+自由基的清除能力最强,可能是分子量小的多肽的亲水性较好,而ABTS+自由基是一种亲水性自由基,小分子肽更易与ABTS+自由基发生反应,从而表现出更好的ABTS+自由基清除能力,这与油茶饼粕多肽分子量较小的组分抗氧化活性更强的研究结果相同[29]。G1的清除能力优于G2,这可能是受到氨基酸序列与组成的影响[30]。
表 3 澳洲坚果多肽不同组分对ABTS+自由基清除能力的回归方程分析Table 3. Regression equation analysis of different components of macadamia nut polypeptides on ABTS+ radical scavenging ability样品 回归方程 IC50(mg/mL) r G1 y=34.89lnx+90.49 0.31 0.9983 G2 y=33.98lnx+85.03 0.36 0.9972 G3 y=12.16lnx+96.80 0.02 0.9573 谷胱甘肽 y=4.27lnx+94.21 0.00003 0.9861 2.2.4 不同组分澳洲坚果多肽还原能力分析
还原能力是指物质提供电子的能力,吸光值越大还原能力越强[31]。从图5及表4可以看出,不同分子量的澳洲坚果多肽及谷胱甘肽均具有还原能力,还原能力与浓度呈正相关。G3组分的还原能力优于G1、G2及谷胱甘肽。在浓度2.0 mg/mL时,G3的还原能力为0.493±0.00,优于其它评价样品,G1还原能力最弱为0.130±0.02。随着浓度的增加,还原能力的增加速率大小顺序为G3、谷胱甘肽、G1、G2。当浓度达到10.0 mg/mL时,G3的还原能力最优为1.701±0.04,G1、G2的还原能力分别为0.581±0.01、0.548±0.00,两者之间无显著性差异(P>0.05)。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽还原能力大小顺序为:G3(IC50 2.19 mg/mL)>谷胱甘肽(IC50 4.35 mg/mL)>G1(IC50 8.09 mg/mL)>G2(IC50 8.63 mg/mL),澳洲坚果蛋白结构中具有还原能力较强的基团,经过酶解被分散到低相对分子量的多肽中,经超滤、葡聚糖凝胶分离后,分子量低的肽段被富集,肽段越短使具有较多电子的基团暴露越充分,因而使G3表现出最强的还原能力,这与松仁、核桃等植物蛋白的研究结果相同[17,21]。
2.3 澳洲坚果多肽组分与抗氧化活性相关性分析
用皮尔森法(Pearson’s)对不同澳洲坚果多肽组分与抗氧化活性指标的IC50值进行相关性分析。结果如表5所示,澳洲坚果多肽不同组分与羟基自由基清除能力(r=0.953,P<0.01)、还原能力(r=0.823,P<0.01)之间存在极显著相关,与ABTS+自由基清除能力(r=0.796,P<0.01)之间存在显著相关,与DPPH自由基清除能力(r=0.651,P>0.05)无显著性相关。结合2.2中的分析可知分子量最小的G3组分抗氧化活性最好,多肽的抗氧化活性受其分子量的影响,这可能是分子量小的多肽空间位阻较小,活性基团(巯基、酚羟基)暴露更充分,能更好的与自由基发生反应,表现出更好的抗氧化活性[21−22]。
表 5 澳洲坚果多肽组分与抗氧化活性的相关性分析Table 5. Correlation analysis between antioxidant activities and polypeptide components of macadamia nutDPPH自由基 羟基自由基 ABTS+自由基 还原能力 多肽组分 r=0.651 r=0.935** r=0.796* r=0.823** 注:*表示相关性显著(0.01<P<0.05);**表示相关性极显著(P<0.01)。 葡聚糖凝胶柱层析分离得到的3个组分对DPPH、ABTS+、羟基自由基清除率、还原能力均随浓度的增加而增强,在相同浓度条件下G3组分的抗氧化活性最强,且G3组分的羟基自由基清除率、还原能力均高于同浓度的谷胱甘肽溶液。各项抗氧化评估指标的IC50值均为G3组分最优,且ABTS+、羟基自由基清除率及还原能力的IC50值优于谷胱甘肽。以上结果表明纯化肽具有更好的清除自由基的能力和还原力,抗氧化活性G3>G2>G1。肽的抗氧化活性与其分子量之间存在相关性,其活性可能随着肽分子量的降低而增加,而抗氧化肽的自由基清除作用可能与氨基酸的组成和序列有关[32]。因此,选择G3组分进行多肽结构鉴定研究。
2.4 抗氧化肽的鉴定
采用LC-MS/MS法检测G3分子量以鉴定氨基酸的序列,扫描的范围为300~1800 Da,总离子流色谱图见图6。质谱采集的raw文件,经过软件Byonic数据库检索,得到46条肽段,这些肽段长度均小于10个氨基酸,按匹配值得分高于200分的9条肽段进行分析,结果如表6所示,得分代表着该肽段的可信度,相对丰度值代表着该肽段在被分析组分中的含量。自然界中,某些多肽具有毒性并且会致死,如鹅膏毒肽类、微囊藻肽类、蝎毒肽类等[33]。因此,有必要对澳洲坚果蛋白源的抗氧化肽进行安全性评估,结果如表6所示,基于氨基酸序列预测9个肽段无毒性,安全性较高,可进行肽的人工合成,进行细胞或者动物实验,研究其在食品、医药等行业的应用。
表 6 G3组分的肽序列分析Table 6. Peptide sequence analysis of G3 the polypeptide component峰号 肽序列 保留时间(min) 得分 来源蛋白 分子量(Da) 等电点 净电荷 疏水性氨基酸占比(%) 毒性预测 水溶性预测 相对丰度 1 HLLPK 10.4878 279.4 A0A096X878_MACIN 606.84 9.88 2 60.00 无毒性 良好 1.02×107 2 HYLDNPR 14.6341 271.3 11S1_MACIN 914.08 7.54 2 28.57 无毒性 良好 2.36×108 3 KEFFP 38.5282 265.8 AMP23_MACIN 666.83 6.65 2 60.00 无毒性 良好 1.08×107 4 KEFFPA 35.9445 263.9 AMP23_MACIN 737.92 6.65 2 66.67 无毒性 良好 6.10×106 5 SWIIN 48.7829 255.0 I6PA72_9MAGN 631.80 3.44 2 60.00 无毒性 难溶 5.14×106 6 HFP 15.9426 239.2 A0A096X8E0_MACIN 399.48 7.56 2 66.67 无毒性 难溶 1.30×108 7 SIFFPGPR 48.7674 227.2 AMP23_MACIN 920.18 10.57 2 62.50 无毒性 难溶 1.11×107 8 YFDER 19.8593 219.8 AMP23_MACIN 728.81 3.93 2 20.00 无毒性 良好 2.67×107 9 YLDNPR 15.8512 216.9 11S1_MACIN 776.92 6.36 2 33.33 无毒性 良好 4.22×107 大量研究表明,多肽的氨基酸序列、分子量和疏水性对其抗氧化活性影响巨大[34],疏水性氨基酸在反应体系中的提高肽段在脂质体系中的溶解度,加强肽段与脂溶性自由基如DPPH自由基的相互作用[35]。Ma等[36]认为含有2~10个氨基酸的寡肽比其他大多数多肽或者蛋白质具有更高抗氧化潜力,刘辉等[37]发现的大多数抗氧化活性的多肽分子量低于6000 Da,含有2~20个氨基酸。本研究鉴定的活性肽分子量较低(631~920 Da),由3~7个氨基酸残基组成,这与论文报道的研究结果一致。
Agrawal等[35]从珍珠粟蛋白水解物分离出的较好抗氧化活性的多肽SDRDLLGPNNQYLPK,认为该肽具有抗氧化能力与肽序列中含有的疏水性氨基酸Gly,Leu和Pro有关。Ranathunga等[38]发现,星康吉鳗蛋白水解物中纯化的抗氧化肽由55%的疏水残基组成肽中的疏水性氨基酸对其抗氧化作用有很大贡献。由表6可见有6条肽段的疏水性氨基酸占比达到60%以上,说明HLLPK、KEFFP、KEFFPA、SWIIN、HFP、SIFFPGPR肽段赋予了G3组分较好的抗氧化活性。经预测各多肽的水溶性不同,其中SWIIN、HFP、SIFFPGPR难溶于水,水溶性好的HLLPK、KEFFP、KEFFPA肽段更利于进行抗氧化剂、保健品等的开发利用,其二级质谱图如图7所示。
多肽的N端以酸性氨基酸残基为主,C末端为碱性氨基酸残基[39]。Trp含有氨基,His含有咪唑环,Tyr、Phe含有酚羟基,Met、Cys含有巯基,这些带有特征基团的氨基酸残基存在于肽段中时,能有效增强其自由基清除活性[40]。肽结构中的疏水性氨基酸也与其抗氧化活性密切相关。Met具有金属螯合能力,Pro、Leu可提供质子用于中和活性自由基[41]。相同的疏水性氨基酸同时出现(如Ala-Ala,Leu-Leu和Pro-Pro 等)能赋予较强的自由基清除活性[35]。以上分析结果表明HLLPK、KEFFP、KEFFPA肽段疏水性氨基酸占比高,氨基酸数量、结构及分子量符合抗氧化多肽的特征,且具备较好的水溶性有利于产品的开发与应用。
3. 结论
分子量小于1000 Da的澳洲坚果多肽经Sephadex G-15凝胶柱分离,得到G1、G2、G3三个组分,其中G3组分的抗氧化活性最强,DPPH、羟基、ABTS+自由基清除能力及还原能力的IC50值分别为0.5、6.18、0.02、2.19 mg/mL。G3组分经LC-MS/MS鉴定、分析,得到3种澳洲坚果抗氧化肽序列为HLLPK、KEFFP、KEFFPA,其分子量分别为606.84、666.83、737.92 Da,疏水性氨基酸占比分别为60%、60%、66.67%。本研究结果可以为澳洲坚果抗氧化肽的人工合成、细胞及动物实验提供参考和依据,以期筛选获得功能活性较强的抗氧化肽,研究其作为天然抗氧化剂在食品、药品或化妆品中的应用。
-
表 1 澳洲坚果多肽不同组分对DPPH自由基清除能力的回归方程分析
Table 1 Analysis by regression equation of different components of macadamia nut polypeptides on DPPH radical scavenging ability
样品 回归方程 IC50(mg/mL) r G1 y=15.41lnx+30.05 3.65 0.9768 G2 y=12.66lnx+29.06 5.23 0.9699 G3 y=25.06lnx+67.53 0.50 0.9981 谷胱甘肽 y=12.07lnx+102.31 0.01 0.9597 表 4 澳洲坚果多肽不同组分还原能力的回归方程分析
Table 4 Regression equation analysis of different components of macadamia nut polypeptides on reducing power
样品 回归方程 IC50(mg/mL) r G1 y=0.2849lnx−0.0955 8.09 0.9806 G2 y−0.2473lnx−0.0331 8.63 0.9787 G3 y=0.7795lnx−0.1104 2.19 0.9832 谷胱甘肽 y=0.3812lnx−0.0606 4.35 0.9869 表 2 澳洲坚果多肽不同组分对羟基自由基清除能力的回归方程分析
Table 2 Regression equation analysis of different components of macadamia nut polypeptides on hydroxyl radical scavenging ability
样品 回归方程 IC50(mg/mL) r G1 y=15.47lnx−6.18 37.77 0.9706 G2 y=23.56lnx−10.29 12.92 0.9897 G3 y=31.24lnx−6.91 6.18 0.9671 谷胱甘肽 y=12.04lnx+1.80 54.78 0.9964 表 3 澳洲坚果多肽不同组分对ABTS+自由基清除能力的回归方程分析
Table 3 Regression equation analysis of different components of macadamia nut polypeptides on ABTS+ radical scavenging ability
样品 回归方程 IC50(mg/mL) r G1 y=34.89lnx+90.49 0.31 0.9983 G2 y=33.98lnx+85.03 0.36 0.9972 G3 y=12.16lnx+96.80 0.02 0.9573 谷胱甘肽 y=4.27lnx+94.21 0.00003 0.9861 表 5 澳洲坚果多肽组分与抗氧化活性的相关性分析
Table 5 Correlation analysis between antioxidant activities and polypeptide components of macadamia nut
DPPH自由基 羟基自由基 ABTS+自由基 还原能力 多肽组分 r=0.651 r=0.935** r=0.796* r=0.823** 注:*表示相关性显著(0.01<P<0.05);**表示相关性极显著(P<0.01)。 表 6 G3组分的肽序列分析
Table 6 Peptide sequence analysis of G3 the polypeptide component
峰号 肽序列 保留时间(min) 得分 来源蛋白 分子量(Da) 等电点 净电荷 疏水性氨基酸占比(%) 毒性预测 水溶性预测 相对丰度 1 HLLPK 10.4878 279.4 A0A096X878_MACIN 606.84 9.88 2 60.00 无毒性 良好 1.02×107 2 HYLDNPR 14.6341 271.3 11S1_MACIN 914.08 7.54 2 28.57 无毒性 良好 2.36×108 3 KEFFP 38.5282 265.8 AMP23_MACIN 666.83 6.65 2 60.00 无毒性 良好 1.08×107 4 KEFFPA 35.9445 263.9 AMP23_MACIN 737.92 6.65 2 66.67 无毒性 良好 6.10×106 5 SWIIN 48.7829 255.0 I6PA72_9MAGN 631.80 3.44 2 60.00 无毒性 难溶 5.14×106 6 HFP 15.9426 239.2 A0A096X8E0_MACIN 399.48 7.56 2 66.67 无毒性 难溶 1.30×108 7 SIFFPGPR 48.7674 227.2 AMP23_MACIN 920.18 10.57 2 62.50 无毒性 难溶 1.11×107 8 YFDER 19.8593 219.8 AMP23_MACIN 728.81 3.93 2 20.00 无毒性 良好 2.67×107 9 YLDNPR 15.8512 216.9 11S1_MACIN 776.92 6.36 2 33.33 无毒性 良好 4.22×107 -
[1] 施彬, 聂艳丽, 贺熙勇. 澳洲坚果丰产栽培管理技术[M]. 昆明:云南科技出版社. 2016. [SHI B, NIE Y L, HE X Y. Cultivation and management techniques of macadamia nut [M]. Kunming:Yunnan Science and Technology Press. 2016.] SHI B, NIE Y L, HE X Y. Cultivation and management techniques of macadamia nut [M]. Kunming: Yunnan Science and Technology Press. 2016.
[2] 贺熙勇, 聂艳丽, 吴霞云, 等. 云南澳洲坚果产业高质量发展的建议[J]. 中国南方果树,2022,51(4):205−210. [HE X Y, NIE Y L, WU X, et al. Suggestions of macadamia industry for high-quality development in Yunnan Province[J]. South China Fruits,2022,51(4):205−210.] HE X Y, NIE Y L, WU X, et al . Suggestions of macadamia industry for high-quality development in Yunnan Province[J]. South China Fruits,2022 ,51 (4 ):205 −210 .[3] MARO L A C, PIO R, PENONI E D S, et al. Chemical characterization and fatty acids profile in macadamia walnut cultivars[J]. Ciência Rural,2012,42(12):2166−2171.
[4] 杜丽清, 曾辉, 邹明宏, 等. 澳洲坚果果仁氨基酸含量的差异性分析[J]. 经济林研究,2008,26(4):49−52. [DU L Q, ZENG H, ZOU M H, et al. Differences analysis of amino acid contents in macadamia kernel[J]. Non-wood Forest Research,2008,26(4):49−52.] doi: 10.3969/j.issn.1003-8981.2008.04.011 DU L Q, ZENG H, ZOU M H, et al . Differences analysis of amino acid contents in macadamia kernel[J]. Non-wood Forest Research,2008 ,26 (4 ):49 −52 . doi: 10.3969/j.issn.1003-8981.2008.04.011[5] 郭刚军, 邹建云, 胡小静, 等. 液压压榨澳洲坚果粕酶解制备多肽工艺优化[J]. 食品科学, 2016, 37(17):173−178. [GUO G J, ZOU J Y, HU X J, et al. Optimizing the preparation of crude peptides from hydraulic macadamia nut meal by enzymatic hydrolysis[J]. Food Science, 2016, 37(17):173−148.] GUO G J, ZOU J Y, HU X J, et al. Optimizing the preparation of crude peptides from hydraulic macadamia nut meal by enzymatic hydrolysis[J]. Food Science, 2016, 37(17): 173−148.
[6] ZHANG S H, LUO L, SUN X Y, et al. Bioactive peptides:A promising alternative to chemical preservatives for food preservation[J]. Journal of Agricultural and Food Chemistry,2021,69(42):12369−12384. doi: 10.1021/acs.jafc.1c04020
[7] HOJAHMAT M, WALI A, YANHUA G, et al. Antioxidant peptides from protein hydrolysate of bovine serum colostrum[J]. Chemistry of Natural Compounds,2022,58(4):721−725. doi: 10.1007/s10600-022-03776-w
[8] 马尚玄, 郭刚军, 黄克昌, 等. 不同分子量澳洲坚果多肽氨基酸组成与抑菌活性[J]. 食品工业科技,2021,42(7):83−88. [MA S X, GUO G J, HAUNG K C, et al. Amino acid compositions and antibacterial activities of different molecular weight macadamia nut polypeptides[J]. Science and Technology of Food Industry,2021,42(7):83−88.] MA S X, GUO G J, HAUNG K C, et al . Amino acid compositions and antibacterial activities of different molecular weight macadamia nut polypeptides[J]. Science and Technology of Food Industry,2021 ,42 (7 ):83 −88 .[9] 杜丽清, 帅希祥, 涂行浩, 等. 澳洲坚果蛋白肽制备工艺及抗氧化活性研究[J]. 热带农业工程,2016,40(Z1):1−6. [DU L Q, SHUAI X X, TU X H, et al. Analysis on the preparation technology of protein peptide and antioxidant activity of macadamia nut[J]. Tropical Agricultural Engineering,2016,40(Z1):1−6.] DU L Q, SHUAI X X, TU X H, et al . Analysis on the preparation technology of protein peptide and antioxidant activity of macadamia nut[J]. Tropical Agricultural Engineering,2016 ,40 (Z1 ):1 −6 .[10] MOAYEDI A, MORA L, ARISTOY M C, et al. Peptidomic analysis of antioxidant and ACE-inhibitory peptides obtained from tomato waste proteins fermented using Bacillus subtilis[J]. Food Chemistry,2018,250:180−187. doi: 10.1016/j.foodchem.2018.01.033
[11] 刘云姣. 南极磷虾中含氟多肽的分离纯化及其结构研究[D]. 上海:上海海洋大学, 2019. [LIU Y J. Isolation, purification and structural research of fluorinated peptides from antarctic krill(Euphausia superba)[D]. Shanghai:Shanghai Ocean University, 2019.] LIU Y J. Isolation, purification and structural research of fluorinated peptides from antarctic krill(Euphausia superba)[D]. Shanghai: Shanghai Ocean University, 2019.
[12] 付镓榕, 胡小静, 马尚玄, 等. 不同分子量澳洲坚果多肽制备工艺与抗氧化活性[J]. 食品工业科技,2023,44(20):414−421. [FU J R, HU X J, MA S X, et al. Preparation technology and antioxidant activities of different molecular weight macadamia nut polypeptides[J]. Science and Technology of Food Industry,2023,44(20):414−421.] FU J R, HU X J, MA S X, et al . Preparation technology and antioxidant activities of different molecular weight macadamia nut polypeptides[J]. Science and Technology of Food Industry,2023 ,44 (20 ):414 −421 .[13] 姚轶俊, 袁强, 鞠兴荣, 等. 菜籽蛋白水解物的分离纯化及抗肿瘤活性研究[J]. 中国粮油学报,2019,34(7):47−53. [YAO Y J, YUAN Q, JU X R, et al. Separation and purification of rapeseed protein hydrolysate and the effect on antitumor activity[J]. Journal of the Chinese Cereals and Oils Association,2019,34(7):47−53.] doi: 10.3969/j.issn.1003-0174.2019.07.009 YAO Y J, YUAN Q, JU X R, et al . Separation and purification of rapeseed protein hydrolysate and the effect on antitumor activity[J]. Journal of the Chinese Cereals and Oils Association,2019 ,34 (7 ):47 −53 . doi: 10.3969/j.issn.1003-0174.2019.07.009[14] 郭刚军, 胡小静, 马尚玄, 等. 液压压榨澳洲坚果粕蛋白质提取工艺优化及其组成分析与功能性质[J]. 食品科学,2017,38(18):266−271. [GUO G J, HU X J, MA S X, et al. Extraction, composition analysis and functional properties of protein isolate from hydraulic expeller-pressed macadamia nut meal[J]. Food Science,2017,38(18):266−271.] doi: 10.7506/spkx1002-6630-201718041 GUO G J, HU X J, MA S X, et al . Extraction, composition analysis and functional properties of protein isolate from hydraulic expeller-pressed macadamia nut meal[J]. Food Science,2017 ,38 (18 ):266 −271 . doi: 10.7506/spkx1002-6630-201718041[15] LAFARGA T, WILM M, WYNNE K, et al. Bioactive hydrolysates from bovine blood globulins:Generation, characterisation, and in silico prediction of toxicity and allergenicity[J]. Journal of Functional Foods,2016,24:142−155. doi: 10.1016/j.jff.2016.03.031
[16] 蒋希希, 裴斐, 赵立艳, 等. 草菇鲜味肽的分离鉴定及呈味特性分析[J]. 食品科学,2022,43(12):235−242. [JIANG X X, PEI F, ZHAO L Y, et al. Separation, identification and taste characteristics of umami peptides from straw mushroom[J]. Food Science,2022,43(12):235−242.] JIANG X X, PEI F, ZHAO L Y, et al . Separation, identification and taste characteristics of umami peptides from straw mushroom[J]. Food Science,2022 ,43 (12 ):235 −242 .[17] 卢红妍, 杨行, 方丽, 等. 松仁清蛋白抗氧化肽的分离纯化及结构鉴定[J]. 食品科学,2019,40(24):40−45. [LU H Y, YANG H, FANG L, et al. Isolation, purification and structural identification of antioxidant peptides derived from enzymatic hydrolysis of pine nut kernel ( Pinus koraiensis Sieb. et Zucc.) albumin[J]. Food Science,2019,40(24):40−45.] doi: 10.7506/spkx1002-6630-20181114-164 LU H Y, YANG H, FANG L, et al . Isolation, purification and structural identification of antioxidant peptides derived from enzymatic hydrolysis of pine nut kernel (Pinus koraiensis Sieb. et Zucc.) albumin[J]. Food Science,2019 ,40 (24 ):40 −45 . doi: 10.7506/spkx1002-6630-20181114-164[18] JI N, SUN C X, ZHAO Y X, et al. Purification and identification of antioxidant peptides from peanut protein isolate hydrolysates using UHR-Q-TOF mass spectrometer[J]. Food Chemistry,2014,161:148−154. doi: 10.1016/j.foodchem.2014.04.010
[19] NAEIMI A F, ALIZADEH M. Antioxidant properties of the flavonoid fisetin:An updated review of in vivo and in vitro studies[J]. Trends in Food Science & Technology,2017,70:34−44.
[20] 李明杨, 刘帅光, 卢梦娇, 等. 不同抗氧化剂体外抗氧化活性及其对肉品氧化稳定性的影响[J]. 食品科学,2022,43(1):67−75. [LI M Y, LIU S G, LU M J, et al. Comparison of antioxidant activity in vitro of antioxidants used in heat-processed meat products and their effects on oxidation[J]. Food Science,2022,43(1):67−75.] LI M Y, LIU S G, LU M J, et al . Comparison of antioxidant activity in vitro of antioxidants used in heat-processed meat products and their effects on oxidation[J]. Food Science,2022 ,43 (1 ):67 −75 .[21] 谢翠品, 敬思群, 刘帅, 等. 核桃蛋白酶解物分离纯化及体外抗氧化活性研究[J]. 食品科技,2013,38(3):67−70. [XIE C P, JING S Q, LIU S, et al. Purification and in vitro antioxidative activity of walnut protein hydrolysate[J]. Food Science and Technology,2013,38(3):67−70.] XIE C P, JING S Q, LIU S, et al . Purification and in vitro antioxidative activity of walnut protein hydrolysate[J]. Food Science and Technology,2013 ,38 (3 ):67 −70 .[22] 刘晓艺, 周玉岩, 过利敏, 等. 不同分子量红花籽抗氧化肽稳定性研究[J]. 食品工业科技,2022,43(13):94−102. [LIU X Y, ZHOU Y Y, GUO L M, et al. Study on the stability of antioxidant peptides from safflower seeds with different molecular weight[J]. Science and Technology of Food Industry,2022,43(13):94−102.] LIU X Y, ZHOU Y Y, GUO L M, et al . Study on the stability of antioxidant peptides from safflower seeds with different molecular weight[J]. Science and Technology of Food Industry,2022 ,43 (13 ):94 −102 .[23] 夏吉安, 黄凯, 李森, 等. 绿豆抗氧化肽的酶法制备及其抗氧化活性[J]. 食品与生物技术学报,2020,39(10):40−47. [XIA J A, HUANG K, LI S, et al. Enzymatic preparation of mung bean antioxidant peptides and antioxidant activity investigation[J]. Journal of Food Science and Biotechnology,2020,39(10):40−47.] doi: 10.3969/j.issn.1673-1689.2020.10.006 XIA J A, HUANG K, LI S, et al . Enzymatic preparation of mung bean antioxidant peptides and antioxidant activity investigation[J]. Journal of Food Science and Biotechnology,2020 ,39 (10 ):40 −47 . doi: 10.3969/j.issn.1673-1689.2020.10.006[24] 齐希光, 陆晓婷, 张晖, 等. 不同分子量黑籽瓜种子多肽抗氧化能力的研究[J]. 食品工业科技,2016,37(9):74−80. [Q X G, LU X T, ZHANG H, et al. Study on the in vitro antioxidant capacity of different molecular weight polypeptides of black seed- watermelon seeds[J]. Science and Technology of Food Industry,2016,37(9):74−80.] Q X G, LU X T, ZHANG H, et al . Study on the in vitro antioxidant capacity of different molecular weight polypeptides of black seed- watermelon seeds[J]. Science and Technology of Food Industry,2016 ,37 (9 ):74 −80 .[25] 张雯雯, 张艳妮, 杨丽荣, 等. 4种天然物质抗氧化能力的研究[J]. 食品研究与开发,2022,43(2):43−50. [ZHANG W W, ZHANG Y N, YANG L R, et al. Study of the antioxidant capacities of four natural substances[J]. Food Research and Development,2022,43(2):43−50.] ZHANG W W, ZHANG Y N, YANG L R, et al . Study of the antioxidant capacities of four natural substances[J]. Food Research and Development,2022 ,43 (2 ):43 −50 .[26] LIU J B, YAN J, JIN Y, et al. Purification and identification of novel antioxidant peptides from egg white protein and their antioxidant activities[J]. Food Chemistry,2015,175:258−266. doi: 10.1016/j.foodchem.2014.11.142
[27] HE H J, HUANG N, CAO R J, et al. Structures, antioxidation mechanism, and antioxidation test of the common natural antioxidants in plants[J]. Biophysics,2015,3(1):25−47. doi: 10.12677/BIPHY.2015.31004
[28] KIM D O, LEE K W, LEE H J, et al. Vitamin C equivalent antioxidant capacity (VCEAC) of phenolic phytochemicals[J]. Journal of Agricultural and Food Chemistry,2002,50(13):3713−3717. doi: 10.1021/jf020071c
[29] 杨洁茹, 刘海波, 李晴, 等. 油茶饼粕中多肽的分离纯化及抗氧化研究[J]. 粮食与食品工业,2022,29(5):4−9. [YANG J R, LIU H B, LI Q, et al. Separation and purification of polypeptides and antioxidant studies in camellia oleifera cake meal[J]. Cereal & Food Industry,2022,29(5):4−9.] doi: 10.3969/j.issn.1672-5026.2022.05.002 YANG J R, LIU H B, LI Q, et al . Separation and purification of polypeptides and antioxidant studies in camellia oleifera cake meal[J]. Cereal & Food Industry,2022 ,29 (5 ):4 −9 . doi: 10.3969/j.issn.1672-5026.2022.05.002[30] 范三红, 贾槐旺, 李兰, 等. 紫苏籽粕蛋白源抗氧化肽的纯化、结构鉴定及体外抗氧化活性[J]. 中国粮油学报,2022,37(3):79−87. [FAN S H, JIA H W, LI L, et al. Purification and structural identification of antioxidant peptide from perilla seed meal protein and antioxidant activity in vitro[J]. Journal of the Chinese Cereals and Oils Association,2022,37(3):79−87.] FAN S H, JIA H W, LI L, et al . Purification and structural identification of antioxidant peptide from perilla seed meal protein and antioxidant activity in vitro[J]. Journal of the Chinese Cereals and Oils Association,2022 ,37 (3 ):79 −87 .[31] 马天颖, 蔡俊. 植物乳杆菌发酵马齿苋陈皮工艺优化及发酵液抗氧化活性分析[J]. 食品研究与开发, 2023, 44(8):143−148. [MA T Y, CAI J. Optimization of fermentation process of Portulaca oleracea L. and Citri reticulatae pericarpium by lactobacillus plantarum and antioxidant activity of fermentation broth[J]. Food Research and Development, 2023, 44(8):143−148.] MA T Y, CAI J. Optimization of fermentation process of Portulaca oleracea L. and Citri reticulatae pericarpium by lactobacillus plantarum and antioxidant activity of fermentation broth[J]. Food Research and Development, 2023, 44(8): 143−148.
[32] NGO D H, RYU B M, KIM S K. Active peptides from skate( Okamejei kenojei)skin gelatin diminish angiotensin-I converting enzyme activity and intracellular free radical-mediated oxidation[J]. Food Chemistry,2014,143:246−255. doi: 10.1016/j.foodchem.2013.07.067
[33] 曹锫沛, 张朝凤, 许翔鸿, 等. 天然产物中毒性多肽的研究进展[J]. 药学与临床研究,2012,20(3):245−249. [CAO P P, ZHANG C F, XU X H, et al. Advances of research on toxic natural polypeptides[J]. Pharmaceutical and Clinical Research,2012,20(3):245−249.] CAO P P, ZHANG C F, XU X H, et al . Advances of research on toxic natural polypeptides[J]. Pharmaceutical and Clinical Research,2012 ,20 (3 ):245 −249 .[34] YANG J, HUANG J C, DONG X L, et al. Purification and identification of antioxidant peptides from duck plasma proteins[J]. Food Chemistry,2020,319:126534. doi: 10.1016/j.foodchem.2020.126534
[35] AGRAWAL H, JOSHI R, GUPTA M. Isolation, purification and characterization of antioxidative peptide of pearl millet ( Pennisetum glaucum) protein hydrolysate[J]. Food Chemistry,2016,204:365−372. doi: 10.1016/j.foodchem.2016.02.127
[36] MA Y Y, XIONG Y L, ZHAI J J, et al. Fractionation and evaluation of radical scavenging peptides from in vitro digests of buckwheat protein[J]. Food Chemistry,2010,118(3):582−588. doi: 10.1016/j.foodchem.2009.05.024
[37] 刘辉, 童星. 大豆水解蛋白中抗氧化肽的研究进展[J]. 中国调味品,2021,46(1):191−195. [LIU H, TONG X. Research progress of antioxidant peptides in hydrolyzed soybean protein[J]. China Condiment,2021,46(1):191−195.] doi: 10.3969/j.issn.1000-9973.2021.01.040 LIU H, TONG X . Research progress of antioxidant peptides in hydrolyzed soybean protein[J]. China Condiment,2021 ,46 (1 ):191 −195 . doi: 10.3969/j.issn.1000-9973.2021.01.040[38] RANATHUNGA S, RAJAPAKSE N, KIM S K. Purification and characterization of antioxidative peptide derived from muscle of Conger eel ( Conger myriaster)[J]. European Food Research and Technology,2006,222:310−315. doi: 10.1007/s00217-005-0079-x
[39] 芦鑫, 李若昀, 张丽霞, 等. 芝麻抗氧化肽分离纯化与结构鉴定的研究[J]. 中国粮油学报,2019,34(3):45−52,60. [LU X, LI R Y, ZHANG L X, et al. Separation, purification and structure identification of antioxidant peptides derived from sesame protein[J]. Journal of the Chinese Cereals and Oils Association,2019,34(3):45−52,60.] LU X, LI R Y, ZHANG L X, et al . Separation, purification and structure identification of antioxidant peptides derived from sesame protein[J]. Journal of the Chinese Cereals and Oils Association,2019 ,34 (3 ):45 −52,60 .[40] WANG M, LI C, LI H Y, et al. In vitro and in silico antioxidant activity of novel peptides prepared from Paeonia ostii ‘Feng Dan’ hydrolysate[J]. Antioxidants,2019,8(10):433−447. doi: 10.3390/antiox8100433
[41] FAN J, HE J T, ZHUANG Y L, et al. Purification and identification of antioxidant peptides from enzymatic hydrolysates of tilapia ( Oreochromis niloticus) frame protein[J]. Molecules,2012,17(11):12836−12850. doi: 10.3390/molecules171112836
-
期刊类型引用(5)
1. 王宇晴,徐晓涵,朱明慧,张俊杰,高学玲,陈琪. 茶叶渣抗氧化肽的分离纯化、鉴定及其活性测定. 食品科学. 2025(05): 142-150 .  百度学术
百度学术
2. 陈玮玮,赵祥珊,罗扬,金娜,张秋燕,辛明秀. 澳洲坚果蜂蜜中酵母菌的分离、鉴定及生长特性研究. 中国酿造. 2024(08): 184-189 .  百度学术
百度学术
3. 邓梅,梅强根,谢星,卢菲艳,王舒,张露,涂宗财. 七种大宗淡水鱼酶解物抗氧化活性比较及其肽组成鉴定. 食品与发酵工业. 2024(16): 110-117 .  百度学术
百度学术
4. 谭龙斌,张倩,于志鹏,郭恒文,赵文竹. 罗非鱼皮胶原蛋白肽结构鉴定及抗氧化机制研究. 食品安全质量检测学报. 2024(18): 190-198 .  百度学术
百度学术
5. 杞廷美,彭静娜,张月江,林奇,包媛媛,张新永. 核桃粕抗氧化肽的制备及对核桃油氧化稳定性的研究. 中国粮油学报. 2024(12): 139-147 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:




 下载:
下载:



