Analysis of Volatile Aroma Components of Navel Orange Wine Produced by Mixed Fermentation of Non Saccharomyces cerevisiae and Saccharomyces cerevisiae Based on GC-IMS
-
摘要: 为了探究不同非酿酒酵母对混菌发酵脐橙酒的增香效果,采用气相-离子迁移谱(GC-IMS)测定果酒酵母和有孢汉逊酵母及戴尔有孢圆酵母混合发酵脐橙酒的挥发性香气成分。结果显示,脐橙酒共鉴定出49种挥发性化合物,非酿酒酵母戴尔有孢圆酵母PL09+果酒酵母DV10发酵酒的3-甲基-1-丁醇、4-甲基-1-戊醇、1-戊烯-3-酮、异丁酸乙酯含量较高,赋予发酵酒突出的苹果、柑橘和桑椹果香;非酿酒酵母有孢汉逊酵母JW14+果酒酵母DV10和非酿酒酵母有孢汉逊酵母DY5+果酒酵母DV10发酵酒的3-羟基-2-丁酮,4-甲基-2-戊酮、丁醛、乙酸乙酯、丙酸乙酯等醛酮类和酯类含量较高,奶油香味、菠萝香等果香浓郁。混菌发酵能新增单菌发酵所没有的挥发性香气成分,有孢汉逊酵母JW14+果酒酵母DV10和有孢汉逊酵母DY5+果酒酵母DV10样品独有的3-羟基-2-丁酮、辛醇、1-戊烯-3-醇和4-甲基-2-戊酮等,戴尔有孢圆酵母PL09+果酒酵母DV10独有的3-甲基丁醛。PCA分析显示有孢汉逊酵母DY5+果酒酵母DV10与有孢汉逊酵母JW14+果酒酵母DV10差异较小,两者与戴尔有孢圆酵母PL09+果酒酵母DV10差异大,且均与果酒酵母DV10单菌发酵差异明显,证明非酿酒酵母能起到增香作用且其种类不同增香效果有差异。感官评价表明有孢汉逊酵母JW14+果酒酵母DV10评分最高。综上所述,添加非酿酒酵母发酵脐橙酒能有效增强脐橙酒的风味特征,有孢汉逊酵母JW14+果酒酵母DV10发酵脐橙酒整体较优,风味更复杂。该研究可为今后非酿酒酵母和酿酒酵母混合发酵脐橙酒提供参考依据。Abstract: To investigate the aroma-enhancing effect of different non-Saccharomyces cerevisiae on mixed fermentation of navel orange wine, the volatile aroma components of mixed fermentation of navel orange wine with different yeasts were determined by gas phase ion transfer spectroscopy (GC-IMS). The results showed that 49 volatile compounds were identified in navel orange wine. Torulaspora delbrueckii PL09+Saccharomyces cerevisiae DV10 fermentation wine contained high contents of 3-methyl-1-butanol, 4-methyl-1-pentanol, 1-penten-3-one and ethyl isobutyrate, with prominent aromas of apple, citrus and mulberry fruit. Hanseniaspora JW14+Saccharomyces cerevisiae DV10 and Hanseniaspora DY5+Saccharomyces cerevisiae DV10 fermented wines had high contents of aldehydes, ketones, and esters such as 3-hydroxy-2-butanone, 4-methyl-2-pentanone, butyraldehyde, ethyl acetate, and ethyl propionate, with aromas of cream, pineapple, and other fruit flavours. The mixed bacterial fermentation was able to add new volatile aroma components that were not present in the monobacterial fermentation. 3-hydroxy-2-butanone, octanol, 1-penten-3-ol, and 4-methylpentan-2-one were the unique aroma components in samples Hanseniaspora JW14+Saccharomyces cerevisiae DV10 and Hanseniaspora DY5+Saccharomyces cerevisiae DV10. 3-methyl butyraldehyde was the unique aroma component in sample Torulaspora delbrueckii PL09+Saccharomyces cerevisiae DV10. PCA analysis showed that Hanseniaspora DY5+Saccharomyces cerevisiae DV10 differed less from Hanseniaspora JW14+Saccharomyces cerevisiae DV10, both of them differed from Torulaspora delbrueckii PL09+Saccharomyces cerevisiae DV10 and all significantly differed from Saccharomyces cerevisiae DV10 monoculture fermentation, demonstrating that non-Saccharomyces cerevisiae could contribute to aroma enhancement and that there were differences in the aroma enhancement effect between their species. Sensory evaluation showed that Hanseniaspora JW14+Saccharomyces cerevisiae DV10 had the highest score. To sum up, the addition of non-Saccharomyces cerevisiae to ferment navel orange wine could effectively enhance the flavor characteristics of navel orange wine. Hanseniaspora JW14+Saccharomyces cerevisiae DV10 fermented navel orange wine was better overall, and the flavor was more complex. This study could provide reference for the future fermentation of navel orange wine with non-Saccharomyces cerevisiae and Saccharomyces cerevisiae.
-
我国是柑橘类水果种植面积和产量第一的大国,脐橙是在我国柑橘产量中占据较大比重的一种。脐橙富含维生素、氨基酸、类胡萝卜素等营养成分,有着较高的食用价值和药用价值[1]。近年来脐橙的深度开发得到越来越多学者的重视[2]。已有的脐橙开发方向以鲜食和橙汁加工为主,存在利用率和附加值低的问题[3]。脐橙酒是以脐橙为原料,保留脐橙的功能成分并增加风味,采用商业酿酒酵母发酵而成,发酵过程可控、产品质量较稳定。以脐橙果汁为原料酿造的脐橙果酒,因其低醇、口感清爽及醇厚柔和而深受消费者喜爱[4]。果酒的研究主要有发酵工艺研究、香气成分检测等方面,但目前脐橙酒加工使用单一的商业酿酒酵母发酵,存在风味寡淡、香气特征不明显等问题。
非酿酒酵母属主要包括有孢圆酵母属(Torulaspora)、有孢汉逊酵母属(Hanseniaspora)、假丝酵母属(Candida)、接合酵母属(Zygosaccharomyces)、毕赤酵母属(Pichial)等[5]。非酿酒酵母的有益特性引起了研究者们的广泛关注,尽管非酿酒酵母发酵能力低,但却能对最终产品的香气成分起到很大的贡献[6]。非酿酒酵母具有降低乙醇浓度,影响果酒营养成分,改善果酒稳定性及澄清度,改变果酒风味特征和香气的作用[7-10]。
当前研究热点是使用非酿酒酵母来塑造葡萄酒及各类果酒的感官特征,非酿酒酵母属菌株通过产生所需的代谢物或与酿酒酵母相互作用来增加酒品的香气。由于非酿酒酵母对乙醇的耐受性较差,通常用于与酿酒酵母混合发酵,增加酒体香气,同时实现完全酒精发酵[11-12]。刘晓柱等[13]将筛自刺梨酒的葡萄汁有孢汉逊酵母参与混菌发酵,能够增加发酵果酒中挥发性酸性物质,新增了单菌发酵没有的脂肪风味。曾朝珍等[14]发现在异常汉逊酵母与酿酒酵母混菌发酵时,能产生比单菌发酵更多的醇类、酯类香气成分的种类和含量。戴尔有孢圆酵母对SO2、乙醇都有一定的耐受性,可以增加乳酸和高级醇的含量[15]。因此选取商业戴尔有孢圆酵母戴尔有孢圆酵母PL09与前期实验室自筛的两株有孢汉逊酵母属酵母有孢汉逊酵母DY5、JW14[16]进行混菌发酵研究。
GC-IMS是一种结合了气相色谱法和离子迁移率谱的检测技术[17]。该技术克服了离子迁移率谱分辨率差的缺点,通过气相色谱预分离后的离子迁移率谱,利用电场中离子迁移率的差异来分析样品的组成,具有响应速度快、灵敏度高、操作方便、成本低、分离效率高等特点[18]。近年来,GC-IMS联用技术被广泛应用于各种食品样品中挥发性成分的评价[19]。
为了探究不同非酿酒酵母与酿酒酵母混菌发酵对脐橙酒品质的影响,本实验考察混菌发酵对脐橙酒的理化指标的影响,使用GC-IMS、指纹图谱结合主成分分析研究混菌发酵对脐橙酒挥发性香气成分的影响,并结合感官品质评价,筛选最优的混菌发酵方式,应用于高品质脐橙酒加工。
1. 材料与方法
1.1 材料与仪器
崀丰脐橙 产自邵阳市新宁县;2株野生有孢汉逊酵母:JW14、DY5 实验室前期自筛;商业非酿酒酵母 戴尔有孢圆酵母PL09,丹麦科汉森公司;果酒酵母DV10 法国LALLEMAND公司;YPD液体培养基、YPD固体培养基 青岛高科技工业园海博生物公司;福林-酚试剂 美国Sigma公司。
血球计数板 上海市求精生化试剂仪器有限公司;0-40、40-70、70-100酒精计 河北省武强县华鸥仪器仪表厂;FlavourSpec风味分析仪 山东海能科学公司;K6302手动锥形榨汁机 余姚市菲儿浦电器有限公司;ColorQuestXE型全自动色度分析仪 美国HunterLab公司;Acquity超高效液相色谱仪 美国Waters公司;7890A-5975C型GC-MS联用仪 美国Agilent公司;PHS-3C型pH计 上海仪电科学仪器股份公司;SW-CJ-1B型超净工作台 苏州净化设备有限公司;LX-B100 L型高压蒸汽灭菌锅 合肥华泰公司;HWS型恒温培养箱 宁波江南仪器厂;UV-1800型紫外可见分光光度计 岛津仪器(苏州)有限公司;PAL-BX/ACID手持式糖度仪 日本爱拓公司。
1.2 实验方法
1.2.1 菌种活化
在无菌条件下,取-80 ℃磁珠保存的有孢汉逊酵母JW14、有孢汉逊酵母DY5酵母,解冻后在YPD固体培养基划线培养。活化2次后用血球计数板计数,挑选菌落特征明显、长势合适的酵母菌株转接到YPD液体培养基中,25 ℃、150 r/min振荡培养24 h,6000 r/min离心10 min,加无菌水混合后离心洗涤2次,收集菌体,4 ℃冷藏备用。商业酵母果酒酵母DV10、戴尔有孢圆酵母PL09参照说明书进行活化。
1.2.2 脐橙酒发酵工艺
脐橙清洗后切半榨汁,5000 r/min离心10 min后取上清液,添加适量白砂糖至预设酒度10%Vol,以H2SO3的形式添加30 mg/kg SO2,分装入250 mL发酵容器灭菌。采取顺序发酵,在分别接入6×107 CFU/mL非酿酒酵母戴尔有孢圆酵母PL09、有孢汉逊酵母DY5和有孢汉逊酵母JW14 48 h后,接入1×107 CFU/mL果酒酵母DV10。使用1×107 CFU/mL接种的单酿酒酵母发酵作为对照。发酵温度为20 ℃,在20 ℃条件下恒温发酵,采用CO2失重法监测发酵状态主发酵结束后,将酒样品在4 ℃、3000 r/min条件下离心10 min后,取上清液于−30 ℃待测。
1.2.3 理化指标检测
澄清度:采用分光光度计测定发酵液在波长680 nm下的透光率[20];可溶性固形物含量:采用手持式糖度仪测定;酒精度:采用酒精计参照《食品安全国家标准 酒中乙醇浓度的测定》[21]测定;色度:采用色差仪测定[22];总酸:采用GB/T12456-2021《食品安全国家标准 食品中总酸的测定》[23]测定,以柠檬酸计;总糖:3,5-二硝基水杨酸比色法测定[24-25];总酚:福林-肖卡法[26-27]测定。
1.2.4 挥发性香气物质成分分析
气相色谱条件(GC):0~2 min:漂移气150 mL/min,载气2 mL/min;2~20 min:漂移气150 mL/min,载气由2 mL/min提升至100 mL/min;20~50 min:漂移气l50 mL/min,载气100 mL/min。
气相离子迁移谱(IMS)检测条件:分析时间50 min;色谱柱MXT-WAX(30 m,1 μm,0.53 mm);柱温:60 ℃;载气/漂移气:N2;IMS温度:45 ℃;采用自动顶空进样,进样体积为100 μL;孵育时间:15 min;孵育温度:60 ℃;进样针温度:85 ℃;孵化转速:500 r/min。
1.2.5 感官评价
脐橙酒由10名专业人员组成感官评定小组进行品评。将样品(20 mL)倒入酒杯中,并按随机顺序呈现。在测试期间提供饮用水冲洗口感。对色泽(20分),果香(20分),酒香(20分),滋味(20分)和典型性(20分)参考文献[28]制定的感官评价表1进行评定。
表 1 脐橙酒感官评价标准Table 1. The sensory evaluation criteria for navel orange wine项目 分值(分) 品评标准 色泽 18~20 色彩饱满,浅橙色,有光泽 14~17 有脐橙酒应有的浅橙色 8~13 与浅橙色略有不符,颜色暗沉 1~7 颜色暗沉 果香 18~20 果香浓郁优雅,香气协调 14~17 果香良好,较为和谐 8~13 果香不足 1~7 无异香,但不悦人 酒香 18~20 酒香浓郁优雅,香气协调 14~17 酒香良好,较为和谐 8~13 酒香不足 1~7 无异香,但不悦人 滋味 18~20 酒体丰满醇厚,无明显苦味 14~17 酒体柔顺,甜酸适度,有微苦味但能接受 8~13 酒体不协调,酸味明显,口感寡淡 1~7 有明显的苦味、酸味或其他缺陷 典型性 18~20 典型优良,酒体突出 14~17 典型明确,风格较佳 8~13 典型性较一般 1~7 典型性不明显 1.3 数据处理
使用分析软件VOCaly查看分析谱图和数据的定性,应用NIST数据库和IMS数据库对物质进行定性分析,应用Reporter插件直接对比样品间的谱图差异,应用Gallery Plot插件进行指纹图谱对比,应用Dynamic PCA插件进行动态主成分分析,SPSS 26.0对样品(n=3)进行数据分析,Origin 2018软件绘图。
2. 结果与分析
2.1 发酵脐橙酒理化指标分析
由表2可知,相较于单酿酒酵母发酵组,非酿酒酵母和酿酒酵母共发酵组有较高的总酸含量和较好的澄清度。各发酵组的总酸含量差异显著(P<0.05),其中有孢汉逊酵母DY5+果酒酵母DV10总酸含量最高为9.51 g/L,果酒酵母DV10总酸含量最低为7.29 g/L。总酚含量差异显著(P<0.05),其中有孢汉逊酵母DY5+果酒酵母DV10总酚含量最高为289.17 mg/L,戴尔有孢圆酵母PL09+果酒酵母DV10总酚含量最低为270.17 mg/L。澄清度差异较大,混合发酵澄清度普遍高于单菌发酵,其中有孢汉逊酵母JW14+果酒酵母DV10澄清度显著高于其他发酵组(P<0.05)。pH也存在显著差异(P<0.05),其中戴尔有孢圆酵母PL09+果酒酵母DV10的pH值最高为4.19,有孢汉逊酵母JW14+果酒酵母DV10的pH值最低为3.99。各发酵组都具有较低的残糖量,无显著性差异(P>0.05)。此外,除戴尔有孢圆酵母PL09(10.43%vol)参与的混菌发酵外,其余混菌发酵中的酒精度与纯酿酒酵母发酵(10.17%vol)的差异不显著,这可能与戴尔有孢圆酵母比有孢汉逊酵母酵母的产乙醇能力更强有关[29]。
表 2 不同菌种发酵脐橙酒的理化指标Table 2. Physical and chemical indexes of navel orange wine fermented by different strains发酵方式 总酸(g/L) 总酚(mg/L) 酒精度
(%vol)总糖(%) 澄清度(%T) pH 果酒酵母DV10 7.29±0.05d 271.53±1.59c 10.17±0.12b 0.20±0.01 57.37±0.08c 4.10±0.02b 有孢汉逊酵母JW14+果酒酵母DV10 8.77±0.16b 283.61±3.51b 10.17±0.12b 0.22±0.01 73.17±0.83a 3.99±0.02d 有孢汉逊酵母DY5+果酒酵母DV10 9.51±0.05a 289.17±0.91a 10.27±0.12ab 0.22±0.01 63.58±0.55b 4.07±0.01c 戴尔有孢圆酵母PL09+果酒酵母DV10 8.47±0.17c 270.17±2.14c 10.43±0.12a 0.20±0.02 58.63±1.42c 4.19±0.01a 注:同列小写字母不同表示差异显著(P<0.05)。 2.2 脐橙酒挥发性香气成分分析
2.2.1 挥发性化合物气相离子迁移谱图分析
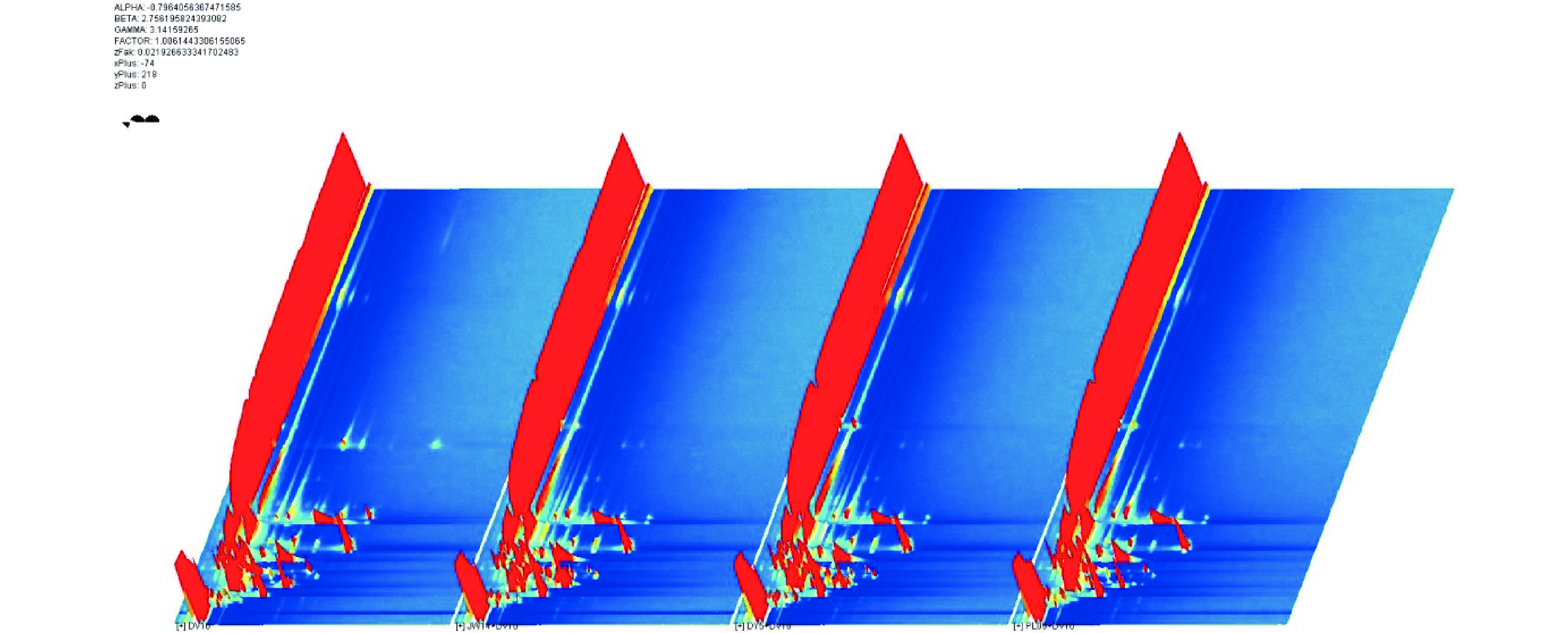
使用气相色谱-离子迁移谱对不同发酵组中挥发性化合物进行分析,得到气相-离子迁移三维谱图,如图1所示。x轴表示离子迁移时间,y轴表示气相色谱保持时间,z轴表示样品中各挥发性组分的峰值强度,从左到右依次为果酒酵母DV10、有孢汉逊酵母JW14+果酒酵母DV10、有孢汉逊酵母DY5+果酒酵母DV10、戴尔有孢圆酵母PL09+果酒酵母DV10。从图上可以看出,混菌发酵与单酿酒酵母发酵样品的化合物种类存在明显差异,信号强度也存在差异,挥发性化合物峰值强度更大。
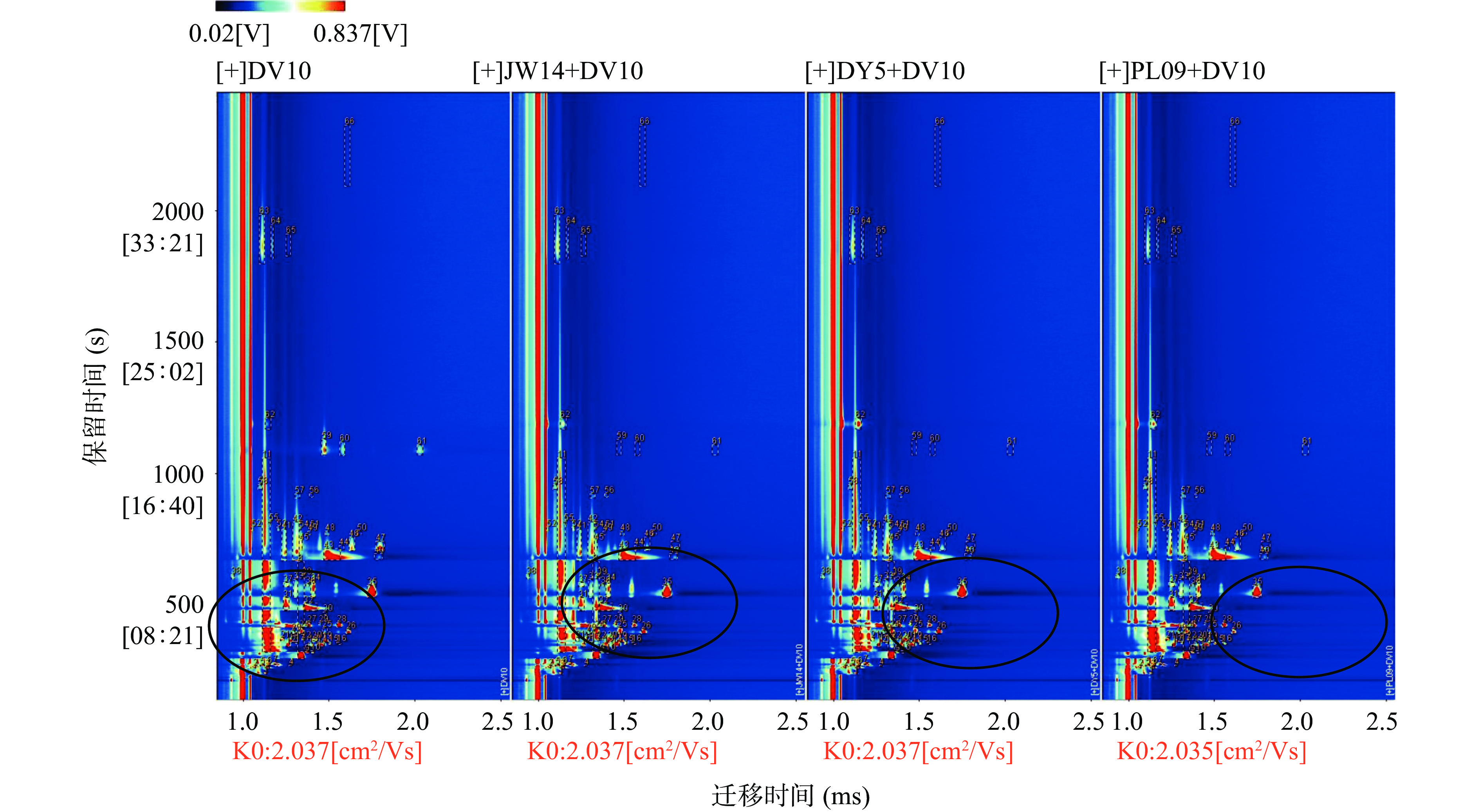
为了更好地区分不同菌种混合发酵脐橙酒中存在的挥发性成分,采用GC-IMS方法获取全局IMS信息。GC-IMS分析得到的二维俯视图如图2所示。x轴和y轴分别代表离子相对漂移时间和气相色谱的保留时间,全图背景为蓝色,横坐标1.0处的红色垂线为RIP峰,即归一化处理后的离子反应峰。RIP峰两侧的每一点都代表一种风味物质,不同的颜色表示信号强度,颜色越深表示强度越大,高浓度挥发物用红色表示,低浓度挥发物用白色表示。一种化合物可能产生多个信号或点(单体或二聚体),这取决于其浓度、半衰期和性质[30]。某些单一化合物由于浓度不同可能产生多种信号,是由于所分析的离子与中性分子(如二聚体或三聚体)之间形成加合物,在通过漂移区时将观察到单一化合物的多个信号。
样品中的有机挥发性化合物(VOCs)以信号的形式显示,挥发物信号大多出现在漂移时间为1.0~2.0 ms和保留时间100~2000 s的区域,GC-IMS有效分离了挥发性化合物的信号峰,共鉴定出59种挥发性化合物。以单一酿酒酵母发酵脐橙酒为对照,混菌发酵组的红色区域变大、颜色变深,说明相对于单一酿酒酵母发酵,混菌发酵会产生独特的香气物质,也能不同程度使挥发性化合物含量增加,改善风味。三个不同发酵组之间信号强度也有差异,表明参与发酵的非酿酒酵母品种对发酵酒香气影响较大。
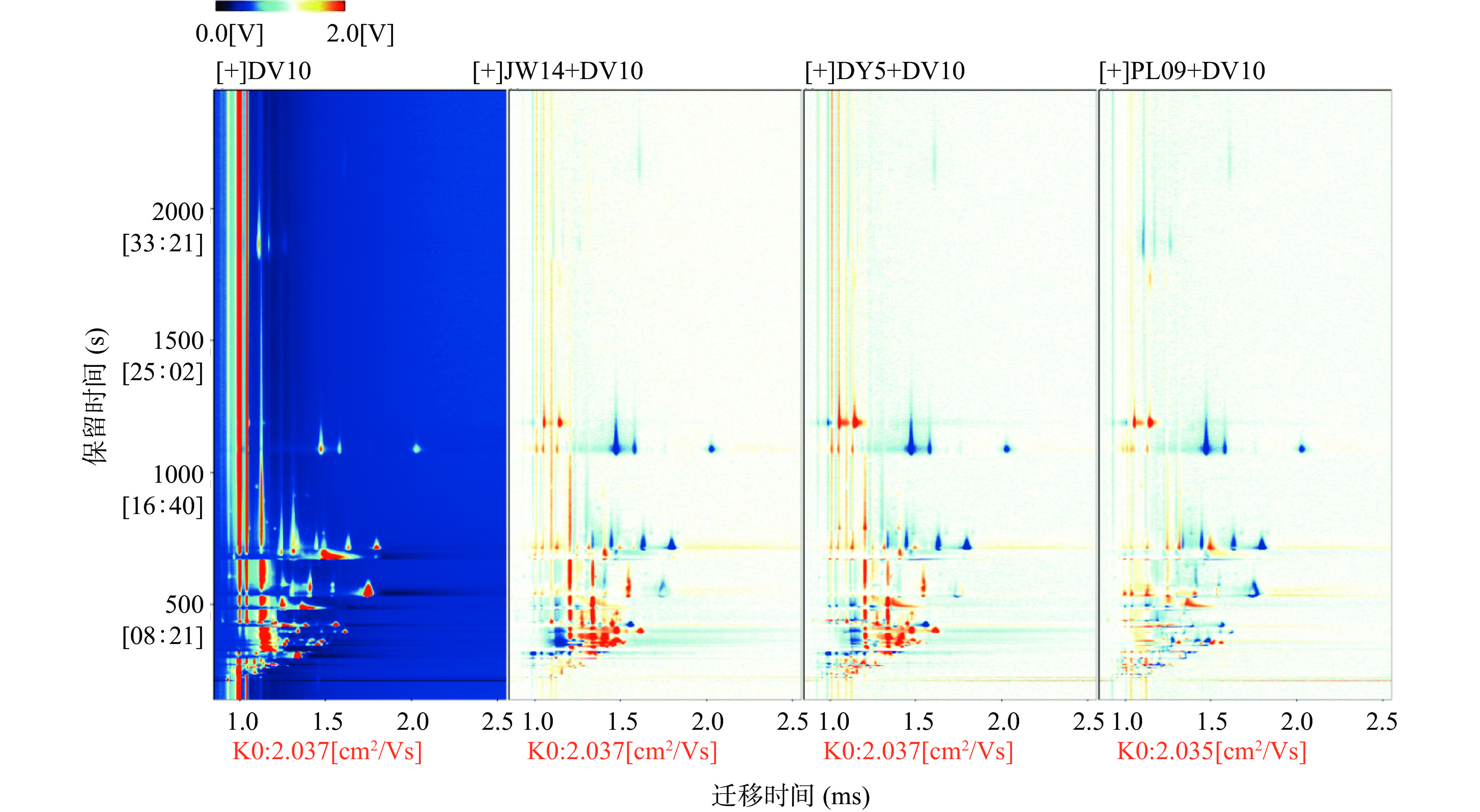
图3是差异对比图,用于比较单一酿酒酵母发酵脐橙酒和非酿酒酵母混菌发酵脐橙酒样品之间的挥发性成分差异[31]。选择单一酿酒酵母发酵的脐橙酒作为参考,其余样品的光谱扣除参考。其中红点表示挥发性成分的含量高于参考值,而蓝点表示挥发性成分的含量低于参考值。由差异对比图可知,一些挥发性成分的含量因添加非酿酒酵母进行发酵增加,而另一些则降低,这说明,脐橙酒的挥发性指纹在不同非酿酒酵母辅助发酵的情况下发生了变化,非酿酒酵母对脐橙酒的不同挥发性成分产生了不同程度的影响。正是这些挥发性成分的动态变化,形成了脐橙酒的风味特征。
2.2.2 挥发性化合物定性分析
利用GC-IMS中漂移时间和保留指数进行定性分析,结果如表3所示,从谱库中共鉴定出59种挥发性化合物(不含二聚体和三聚体为49种),通过名称、保留指数、保留时间和迁移时间对化合物进行描述。化合物名称后的M表示其为物质的单体,D表示其为二聚体,T表示其为三聚体。结果显示,脐橙酒中挥发性化合物有11种醇类、7种醛类、1种萜烯类、25种酯类、10种酮类、1种醚类和4种酸类。含有单体和二聚体的物质有4种,分别是:乙酸丙酯、2-甲基-1-丙醇、1-戊烯-3-醇和丙醛。含有单体、二聚体和三聚体的物质有8种,分别是:丙酸乙酯、乙酸异丁酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、3-甲基-1-丁醇、3-羟基-2-丁酮和丙酸。
表 3 不同酵母混合发酵脐橙酒挥发性成分定性结果Table 3. Qualitative results of volatile components in navel orange wine fermented by different yeasts类别 化合物 中文名称 保留指数 保留时间(s) 迁移时间(ms) 酯 Methyl acetate 醋酸甲酯 843.2 274.595 1.19207 Ethyl acetate 乙酸乙酯 892.4 302.412 1.335 Ethyl propanoate M 丙酸乙酯M 965.7 349.226 1.26463 Ethyl propanoate D 丙酸乙酯D 966.7 349.905 1.39658 Ethyl propanoate T 丙酸乙酯 966.2 349.566 1.45485 Isobutyl formate 甲酸异丁酯 972.5 353.869 1.50676 Ethyl isobutyrate 异丁酸乙酯 975.3 355.878 1.56175 Propyl acetate M 乙酸丙酯 984.7 362.796 1.27673 Propyl acetate D 乙酸丙酯 984.4 362.457 1.48564 Isobutyl acetate M 乙酸异丁酯 1014.8 399.433 1.3394 Isobutyl acetate D 乙酸异丁酯D 1015.8 400.79 1.47794 Isobutyl acetate T 乙酸异丁酯T 1014.2 398.755 1.61428 Isoamyl acetate M 乙酸异戊酯M 1110.6 548.436 1.30704 Isoamyl acetate D 乙酸异戊酯D 1111.7 550.487 1.41127 Isoamyl acetate T 乙酸异戊酯T 1107.9 543.31 1.74958 Propyl butanoate 丁酸丙酯 1126 578.31 1.25497 Ethyl hexanoate M 己酸乙酯M 1203.8 718.237 1.33874 Ethyl hexanoate D 己酸乙酯D 1203.3 717.397 1.63637 Ethyl hexanoate T 己酸乙酯T 1204.3 719.076 1.79982 Hexyl acetate 乙酸己酯 1234.1 771.696 1.38913 Propyl hexanoate 己酸丙酯 1304.1 914.82 1.39564 Ethyl octanoate M 辛酸乙酯M 1375.2 1087.807 1.47361 Ethyl octanoate D 辛酸乙酯D 1375.2 1087.807 1.58542 Ethyl octanoate T 辛酸乙酯T 1375.2 1087.807 2.03056 Ethyl decanoate 癸酸乙酯 1657.9 2166.533 1.61077 醇 Ethanol 乙醇 952.2 340.104 1.13085 1-Propanol 1-丙醇 1032.8 423.179 1.38338 2-Methyl-1-propanol M 2-甲基-1-丙醇M 1078.6 491.02 1.24895 2-Methyl-1-propanol D 2-甲基-1-丙醇D 1078 489.995 1.36343 1-Butanol 1-丁醇 1124.2 574.887 1.37818 1-Penten-3-ol M 1-戊烯-3-醇M 1139.5 606.113 0.9418 1-Penten-3-ol D 1-戊烯-3-醇D 1139.9 606.935 1.35785 3-Methyl-1-butanol M 3-甲基-1-丁醇
M1184.3 685.825 1.24211 3-Methyl-1-butanol D 3-甲基-1-丁醇
D1184.3 685.825 1.31217 3-Methyl-1-butanol T 3-甲基-1-丁醇
T1183 683.775 1.49499 4-Methyl-1-pentanol 4-甲基-1-戊醇 1305 916.759 1.32156 醛 Propionaldehyde M 丙醛M 816.5 260.58 1.06804 Propionaldehyde D 丙醛D 819.4 262.043 1.14479 Butanal 丁醛 831.3 268.281 1.28167 3-Methylbutanal 3-甲基丁醛 921.8 320.392 1.40867 Valeraldehyde 戊醛 988.4 367.102 1.41894 Hexanal 己醛 1033.1 423.555 1.56431 Octanal 辛醛 1243.4 789.023 1.40219 酮 Propan-2-one 丙烷-2-酮 835.8 270.626 1.1166 2-Pentanone 2-戊酮 921.4 320.13 1.37737 1-Penten-3-one 1-戊烯-3-酮 975.8 356.165 1.31648 4-Methylpentan-2-one 4-甲基-2戊酮 1063 465.923 1.48014 Isovalerone 异戊酮 1181.6 681.513 1.79882 5-Methyl-3-heptanone 5-甲基-3-庚酮 1234.8 772.929 1.68005 3-Hydroxy-2-butanone
M3-羟基-2-丁酮
M1243.6 789.4 1.06016 3-Hydroxy-2-butanone
D3-羟基-2-丁酮
D1244.6 791.256 1.207 3-Hydroxy-2-butanone T 3-羟基-2-丁酮
T1243.3 788.645 1.33653 Cyclohexanone 环己酮 1255.7 813.036 1.15939 酸 Acetic acid 醋酸 1411.6 1188.821 1.1445 Propionic acid M 丙酸M 1595.8 1862.526 1.11367 Propionic acid D 丙酸D 1599.1 1877.447 1.17444 Propionic acid T 丙酸T 1597.5 1869.987 1.26483 烯萜 Alpha-Pinene α-蒎烯 1012.1 396.064 1.29553 其他 Dimethyl sulfide 二甲基硫醚 773.6 239.533 1.13377 酯是基于GC-IMS检测测出脐橙酒中的第一大类挥发性风味化合物,共25种,其中有5种二聚体和4种三聚体。酯类是水果香气的主要来源,果酒中酯类物质的组成及其含量可以调整产品的香气类型与风格。测得的乙酸己酯会带来水果香味和花香味,气味甜美,能对酒的香气贡献强烈的果香。其他成分中,辛酸乙酯可以提供果味,癸酸乙酯能提供新鲜的果香香气和类白兰地的酒香香气,乙酸异戊酯具有强烈的类香蕉味的水果香气[32]。
醇是基于GC-IMS检测测出的脐橙酒中的第二类挥发性风味化合物,共11种,其中有3种二聚体和2种三聚体。醇类组分是果酒中重要的挥发性物质,主要来自果酒发酵过程,可赋予酒特殊的香气,其中3-甲基-1-丁醇能为果酒提供愉悦的植物香气。
酮是基于GC-IMS检测测出脐橙酒中的第三大类挥发性风味化合物,共10种,其中有1种二聚体和1种三聚体。酮类呈现出奶油、甜味和果味的香气[33]。2-丁酮给脐橙酒带来一定的青辣风味[30]。
醛是基于GC-IMS检测测出脐橙酒中的第四类挥发性风味化合物,共7种,其中有1种二聚体。样品中有较为丰富的己醛,己醛能够为脐橙酒带来甜香和青草香味,3-甲基丁醛可带来桃子香味、果香味和坚果味[34]。
2.2.3 挥发性化合物指纹图谱分析
二维指纹图谱能全面、直观的分析四种脐橙酒挥发性物质组成的差异。图4中横行为各不同挥发性物质,纵列为对应挥发性化合物在不同发酵酒中的含量差异。图4中的每一行显示了一个脐橙酒样品的整个信号峰,每一列显示了相同化合物在不同葡萄样品中的信号强度,颜色由白色到红色表示浓度由低到高,代表相对含量的高低。一个值得注意的现象是某些化合物会产生两个峰信号,这是由化合物的单体(M)和二聚体(D)形式引起的[34]。
以酿酒酵母单菌发酵对照样品谱图为背景参照,三种添加非酿酒酵母菌株发酵样品谱图中均出现蓝色斑点,即与酿酒酵母单菌发酵对照样品相比,三种添加非酿酒酵母菌株发酵样品均存在一些挥发性物质减少,在有孢汉逊酵母JW14+果酒酵母DV10、有孢汉逊酵母DY5+果酒酵母DV10、戴尔有孢圆酵母PL09+果酒酵母DV10样本谱图中出现的明显的红色斑点说明与单菌发酵对照样品相比,这三种添加非酿酒酵母菌株发酵样品中新生成了一些挥发性物质,样品间差异显著。
从图4中可以看出,有孢汉逊酵母JW14+果酒酵母DV10和有孢汉逊酵母DY5+果酒酵母DV10发酵酒中斑点分布较为相似、但存在颜色深浅的变化,表明这两种发酵酒的香气种类较为相似,含量有差异。相较于单菌发酵样品,非酿酒酵母混菌发酵样品生成了新的挥发性成分,有孢汉逊酵母JW14+果酒酵母DV10和有孢汉逊酵母DY5+果酒酵母DV10样品中有3-羟基-2-丁酮(奶油香味)、辛醇(强烈的油脂气味和柑橘气息)、1-戊烯-3-醇(果香、蔬菜香以及辣根的气味)和4-甲基-2-戊酮(芳香酮气味)这些独特的香气成分,戴尔有孢圆酵母PL09+果酒酵母DV10样品独有3-甲基丁醛(香甜的水果气味)。戴尔有孢圆酵母PL09+果酒酵母DV10的3-甲基-1-丁醇、4-甲基-1-戊醇、1-戊烯-3-酮、异丁酸乙酯等相对含量高于另外三种样本,3-甲基-1-丁醇能赋予酒品苹果和柑橘香,异丁酸乙酯也带有桑葚、苹果香气,因此果香较为突出。但其乙酸异戊酯(略带香蕉香气)、乙酸甲酯(蜂蜜香)、正丙醇、环己酮、二甲基硫醚和丙醛等均低于其他发酵组,甜香稍显不足。有孢汉逊酵母JW14+果酒酵母DV10、有孢汉逊酵母DY5+果酒酵母DV10的醛酮类和酯类物质含量相对较高,尤其是3-羟基-2-丁酮,4-甲基戊烷-2-酮、丁醛、戊醛、乙酸乙酯、丙酸乙酯、乙酸异丁酯,乙酸丙酯、己酸丙酯等,使酒样有更明显的令人愉快的奶油香味、菠萝香等柔和的果香,以及微带果香的酒香。1-戊烯-3-醇、2-甲基-1-丙醇、2-戊酮、3-甲基丁醛、己醛、丁酸丙酯等则在有孢汉逊酵母DY5+果酒酵母DV10中含量较高,但有孢汉逊酵母DY5+果酒酵母DV10中醋酸含量较高,容易使酒样过酸,影响风味的协调性。
2.3 挥发性化合物的主成分分析
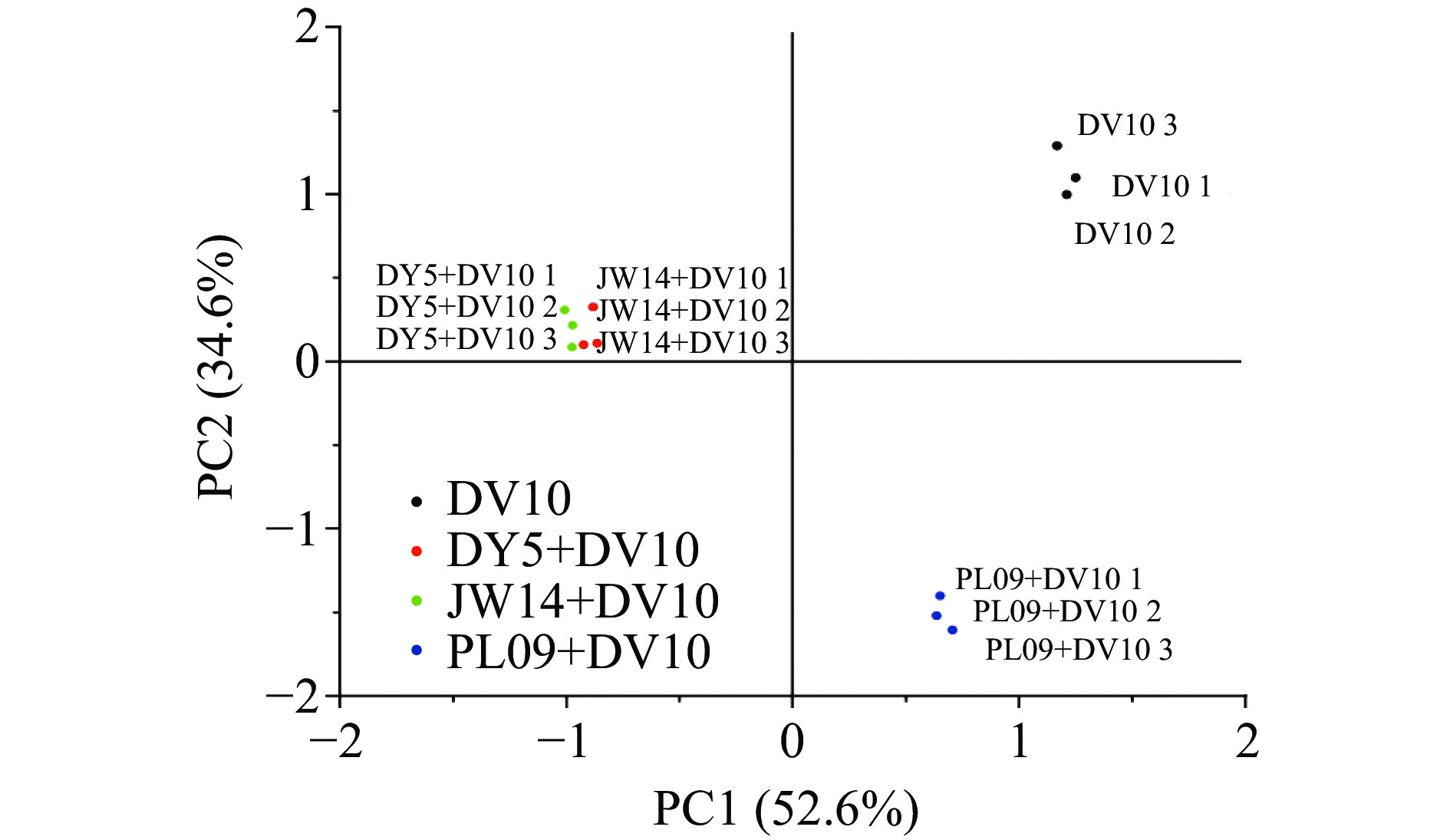
PCA是一种多元统计分析方法,它使用多个变量(如挥发性化合物的信号强度)进行线性变换,以选择几个显着变量并突出它们在样本之间的差异,具有评估样本之间的规律性和差异性的能力[35-36]。为研究不同脐橙酒香气特征的区别,本文应用主成分分析对挥发性化合物含量进行分析,结果如图5所示。前两个主成分方差贡献率之和为87.2%,其中PC1为52.6%,PC2为34.6%。基于各发酵组挥发性化合物含量的差异,PCA将4组样品进行了有效分离,可以看出酿酒酵母果酒酵母DV10单菌发酵与其他混菌发酵组位于不同象限,且距离较远,说明混菌发酵与单菌发酵对香气有较大差异,有孢汉逊酵母DY5+果酒酵母DV10与有孢汉逊酵母JW14+果酒酵母DV10距离较近,差异较小,但二者与戴尔有孢圆酵母PL09+果酒酵母DV10距离较远,差异较大,与GC-IMS的结果较为相似。出现这种差异的原因可能是有孢汉逊酵母DY5、有孢汉逊酵母JW14菌株均为有孢汉逊酵母属,而戴尔有孢圆酵母PL09为戴尔有孢圆酵母,产生这种差异的原因可能是不同非酿酒酵母菌种对发酵酒挥发性香气成分影响较大。
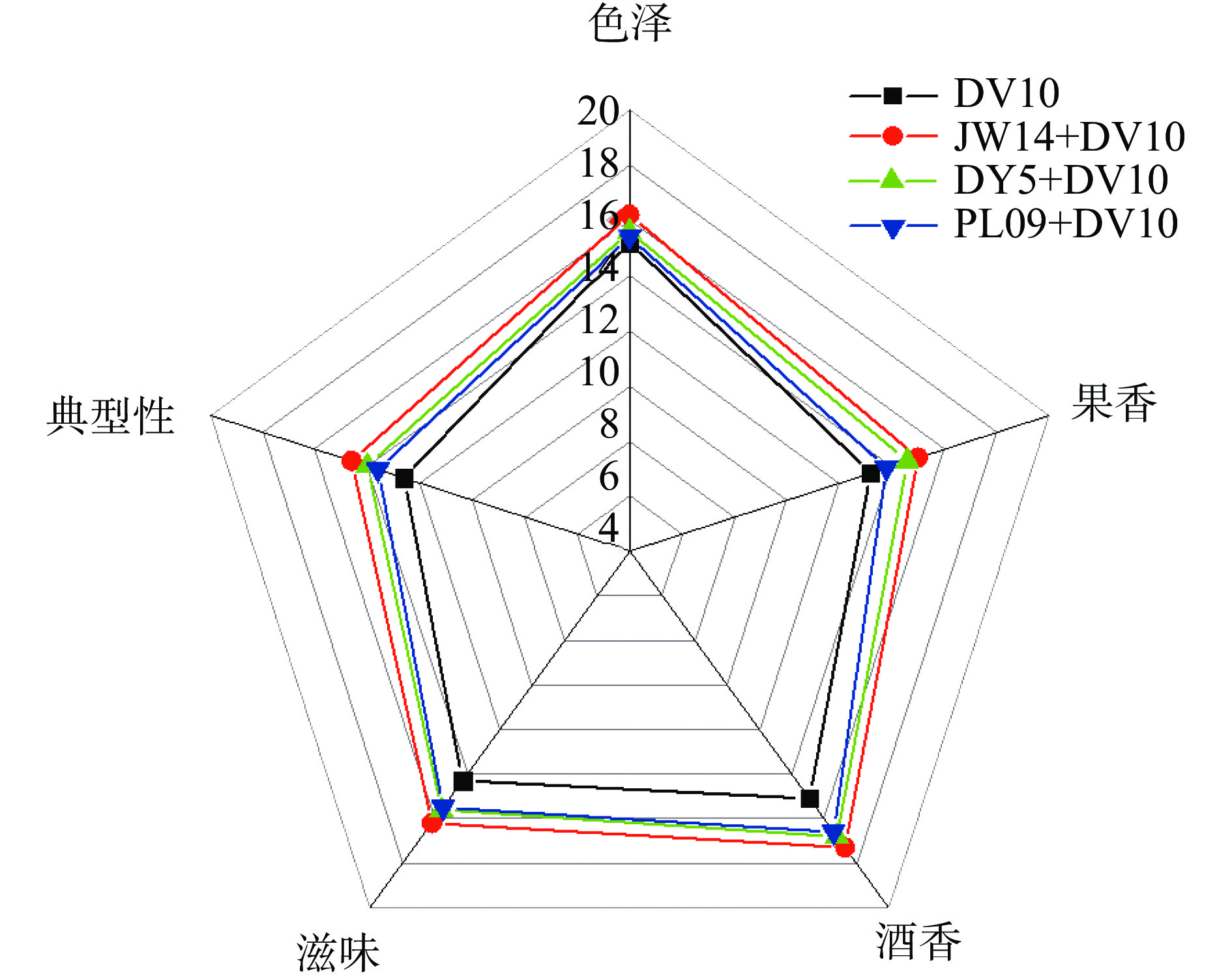
2.4 感官评价
从图6可知,果酒酵母DV10发酵样品的香气评分较其他混菌发酵样品明显更低,香气较为寡淡,与其挥发性香气物质含量较低相符。混菌发酵组香气较为浓郁,且各菌种之间差异较大。戴尔有孢圆酵母PL09+果酒酵母DV10发酵所得的酒香果香味较为浓郁,但酒香不明显。这与戴尔有孢圆酵母PL09+果酒酵母DV10中能赋予酒品果香的3-甲基-1-丁醇、异丁酸乙酯、4-甲基-1-戊醇、1-戊烯-3-酮等物质含量高于另外三种样本有关。有孢汉逊酵母JW14+果酒酵母DV10发酵的脐橙酒有最浓郁的果香和酒香,醇香怡人,整体香气评分排名第一,这与有孢汉逊酵母JW14+果酒酵母DV10醛酮类和酯类物质含量较高有关,能赋予酒样更明显的微带果香的酒香。有孢汉逊酵母DY5+果酒酵母DV10的酒香与有孢汉逊酵母JW14+果酒酵母DV10较为接近,但香气强度稍差。同时,有孢汉逊酵母DY5+果酒酵母DV10酒样微酸,风味的协调性稍差,这与其醋酸含量较高有关。果酒酵母DV10发酵的酒品略带柑橘的酸涩味,评分低于其他混菌发酵组,有孢汉逊酵母JW14+果酒酵母DV10酒体丰满醇厚,滋味最佳。各样品色泽橙黄、外观怡人。综合理化指标与挥发性香气成分评价,有孢汉逊酵母JW14+果酒酵母DV10酿造的脐橙酒澄清透亮、滋味清爽、香气浓郁、皆具柑橘果香和发酵酒香,整体感官品质较优。
3. 结论
混菌发酵对脐橙酒风味产生较大影响,相较于酿酒酵母单菌发酵,醇类物质含量较高。不同的非酿酒酵母参与混菌发酵对于风味物质种类也有不同影响。戴尔有孢圆酵母PL09+果酒酵母DV10样品中,有较高含量的3-甲基-1-丁醇、4-甲基-1-戊醇、1-戊烯-3-酮和异丁酸乙酯等物质,赋予酒样温和的水果香气。有孢汉逊酵母属的有孢汉逊酵母JW14+果酒酵母DV10和有孢汉逊酵母DY5+果酒酵母DV10样品较为相似,有较高含量的3-羟基-2-丁酮,4-甲基戊烷-2-酮、丁醛、戊醛、乙酸乙酯、丙酸乙酯、乙酸异丁酯,乙酸丙酯和己酸丙酯含量,赋予其柔和的微带果香的酒香,且相较单菌发酵样品产生了更多的醇类和酮类香气成分。PCA结果说明有孢汉逊酵母DY5+果酒酵母DV10与有孢汉逊酵母JW14+果酒酵母DV10发酵样品差异较小,但二者与戴尔有孢圆酵母PL09+果酒酵母DV10样品差异较大,造成这种差异的可能原因是有孢汉逊酵母DY5、有孢汉逊酵母JW14菌株为有孢汉逊酵母属,而戴尔有孢圆酵母PL09为戴尔有孢圆酵母,不同非酿酒酵母菌种对发酵酒挥发性香气成分影响较大。感官分析表明有孢汉逊酵母JW14+果酒酵母DV10发酵的脐橙酒果香和酒香最浓郁,醇香怡人,整体香气评分排名第一。综合理化指标、挥发性香气成分和感官评价,有孢汉逊酵母JW14+果酒酵母DV10酿造的脐橙酒整体较优,风味更复杂,有望在脐橙酒工业化生产中应用。
-
表 1 脐橙酒感官评价标准
Table 1 The sensory evaluation criteria for navel orange wine
项目 分值(分) 品评标准 色泽 18~20 色彩饱满,浅橙色,有光泽 14~17 有脐橙酒应有的浅橙色 8~13 与浅橙色略有不符,颜色暗沉 1~7 颜色暗沉 果香 18~20 果香浓郁优雅,香气协调 14~17 果香良好,较为和谐 8~13 果香不足 1~7 无异香,但不悦人 酒香 18~20 酒香浓郁优雅,香气协调 14~17 酒香良好,较为和谐 8~13 酒香不足 1~7 无异香,但不悦人 滋味 18~20 酒体丰满醇厚,无明显苦味 14~17 酒体柔顺,甜酸适度,有微苦味但能接受 8~13 酒体不协调,酸味明显,口感寡淡 1~7 有明显的苦味、酸味或其他缺陷 典型性 18~20 典型优良,酒体突出 14~17 典型明确,风格较佳 8~13 典型性较一般 1~7 典型性不明显 表 2 不同菌种发酵脐橙酒的理化指标
Table 2 Physical and chemical indexes of navel orange wine fermented by different strains
发酵方式 总酸(g/L) 总酚(mg/L) 酒精度
(%vol)总糖(%) 澄清度(%T) pH 果酒酵母DV10 7.29±0.05d 271.53±1.59c 10.17±0.12b 0.20±0.01 57.37±0.08c 4.10±0.02b 有孢汉逊酵母JW14+果酒酵母DV10 8.77±0.16b 283.61±3.51b 10.17±0.12b 0.22±0.01 73.17±0.83a 3.99±0.02d 有孢汉逊酵母DY5+果酒酵母DV10 9.51±0.05a 289.17±0.91a 10.27±0.12ab 0.22±0.01 63.58±0.55b 4.07±0.01c 戴尔有孢圆酵母PL09+果酒酵母DV10 8.47±0.17c 270.17±2.14c 10.43±0.12a 0.20±0.02 58.63±1.42c 4.19±0.01a 注:同列小写字母不同表示差异显著(P<0.05)。 表 3 不同酵母混合发酵脐橙酒挥发性成分定性结果
Table 3 Qualitative results of volatile components in navel orange wine fermented by different yeasts
类别 化合物 中文名称 保留指数 保留时间(s) 迁移时间(ms) 酯 Methyl acetate 醋酸甲酯 843.2 274.595 1.19207 Ethyl acetate 乙酸乙酯 892.4 302.412 1.335 Ethyl propanoate M 丙酸乙酯M 965.7 349.226 1.26463 Ethyl propanoate D 丙酸乙酯D 966.7 349.905 1.39658 Ethyl propanoate T 丙酸乙酯 966.2 349.566 1.45485 Isobutyl formate 甲酸异丁酯 972.5 353.869 1.50676 Ethyl isobutyrate 异丁酸乙酯 975.3 355.878 1.56175 Propyl acetate M 乙酸丙酯 984.7 362.796 1.27673 Propyl acetate D 乙酸丙酯 984.4 362.457 1.48564 Isobutyl acetate M 乙酸异丁酯 1014.8 399.433 1.3394 Isobutyl acetate D 乙酸异丁酯D 1015.8 400.79 1.47794 Isobutyl acetate T 乙酸异丁酯T 1014.2 398.755 1.61428 Isoamyl acetate M 乙酸异戊酯M 1110.6 548.436 1.30704 Isoamyl acetate D 乙酸异戊酯D 1111.7 550.487 1.41127 Isoamyl acetate T 乙酸异戊酯T 1107.9 543.31 1.74958 Propyl butanoate 丁酸丙酯 1126 578.31 1.25497 Ethyl hexanoate M 己酸乙酯M 1203.8 718.237 1.33874 Ethyl hexanoate D 己酸乙酯D 1203.3 717.397 1.63637 Ethyl hexanoate T 己酸乙酯T 1204.3 719.076 1.79982 Hexyl acetate 乙酸己酯 1234.1 771.696 1.38913 Propyl hexanoate 己酸丙酯 1304.1 914.82 1.39564 Ethyl octanoate M 辛酸乙酯M 1375.2 1087.807 1.47361 Ethyl octanoate D 辛酸乙酯D 1375.2 1087.807 1.58542 Ethyl octanoate T 辛酸乙酯T 1375.2 1087.807 2.03056 Ethyl decanoate 癸酸乙酯 1657.9 2166.533 1.61077 醇 Ethanol 乙醇 952.2 340.104 1.13085 1-Propanol 1-丙醇 1032.8 423.179 1.38338 2-Methyl-1-propanol M 2-甲基-1-丙醇M 1078.6 491.02 1.24895 2-Methyl-1-propanol D 2-甲基-1-丙醇D 1078 489.995 1.36343 1-Butanol 1-丁醇 1124.2 574.887 1.37818 1-Penten-3-ol M 1-戊烯-3-醇M 1139.5 606.113 0.9418 1-Penten-3-ol D 1-戊烯-3-醇D 1139.9 606.935 1.35785 3-Methyl-1-butanol M 3-甲基-1-丁醇
M1184.3 685.825 1.24211 3-Methyl-1-butanol D 3-甲基-1-丁醇
D1184.3 685.825 1.31217 3-Methyl-1-butanol T 3-甲基-1-丁醇
T1183 683.775 1.49499 4-Methyl-1-pentanol 4-甲基-1-戊醇 1305 916.759 1.32156 醛 Propionaldehyde M 丙醛M 816.5 260.58 1.06804 Propionaldehyde D 丙醛D 819.4 262.043 1.14479 Butanal 丁醛 831.3 268.281 1.28167 3-Methylbutanal 3-甲基丁醛 921.8 320.392 1.40867 Valeraldehyde 戊醛 988.4 367.102 1.41894 Hexanal 己醛 1033.1 423.555 1.56431 Octanal 辛醛 1243.4 789.023 1.40219 酮 Propan-2-one 丙烷-2-酮 835.8 270.626 1.1166 2-Pentanone 2-戊酮 921.4 320.13 1.37737 1-Penten-3-one 1-戊烯-3-酮 975.8 356.165 1.31648 4-Methylpentan-2-one 4-甲基-2戊酮 1063 465.923 1.48014 Isovalerone 异戊酮 1181.6 681.513 1.79882 5-Methyl-3-heptanone 5-甲基-3-庚酮 1234.8 772.929 1.68005 3-Hydroxy-2-butanone
M3-羟基-2-丁酮
M1243.6 789.4 1.06016 3-Hydroxy-2-butanone
D3-羟基-2-丁酮
D1244.6 791.256 1.207 3-Hydroxy-2-butanone T 3-羟基-2-丁酮
T1243.3 788.645 1.33653 Cyclohexanone 环己酮 1255.7 813.036 1.15939 酸 Acetic acid 醋酸 1411.6 1188.821 1.1445 Propionic acid M 丙酸M 1595.8 1862.526 1.11367 Propionic acid D 丙酸D 1599.1 1877.447 1.17444 Propionic acid T 丙酸T 1597.5 1869.987 1.26483 烯萜 Alpha-Pinene α-蒎烯 1012.1 396.064 1.29553 其他 Dimethyl sulfide 二甲基硫醚 773.6 239.533 1.13377 -
[1] NOGATA Y, SAKAMOTO K, SHIRATSUCHI H, et al. Flavonoid composition of fruit tissues of Citrus species[J]. Bioscience Biotechnology and Biochemistry,2006,70(1):178−192. doi: 10.1271/bbb.70.178
[2] 刘韬, 乔宁, 饶敏, 等. 基于顶空固相微萃取与气相色谱-质谱联用技术分析“赣南早”脐橙酒香气成分[J]. 中国食品添加剂,2017(9):205−209. [LIU T, QIAO N, RAO M, et al. Analysis of aroma components in “GanNanZao” navel orange wine by gas chromatography-mass spectrometry with headspace solid phase microextraction[J]. China Food Additives,2017(9):205−209. doi: 10.3969/j.issn.1006-2513.2017.09.025 LIU T, QIAO N, RAO M, et al. Analysis of aroma components in “GanNanZao" navel orange wine by gas chromatography-mass spectrometry with headspace solid phase microextraction[J]. China Food Additives, 2017(9): 205-209. doi: 10.3969/j.issn.1006-2513.2017.09.025
[3] 郑淑丹, 陈钢, 阙发秀, 等. 脐橙全果酒发酵工艺优化及其与脐橙果汁酒风味物质的对比分析[J]. 食品科学,2019,40(10):171−177. [ZHENG S D, CHEN G, QUE F X, et al. Optimization of fermentation process for whole navel orange wine and comparative analysis of flavor components with navel orange juice wine[J]. Food Science,2019,40(10):171−177. ZHENG S D, CHEN G, QUE F X, et al. Optimization of fermentation process for whole navel orange wine and comparative analysis of flavor components with navel orange juice wine[J]. Food Science, 2019, 40(10): 171-177.
[4] 胡小琴, 刘伟, 许弯, 等. 不同酵母对脐橙果酒品质的影响[J]. 食品工业科技,2021,42(5):1−10, 25. [HU X Q, LIU W, XU W, et al. Effect of different yeasts on the quality of navel orange wine[J]. Science and Technology of Food Industry,2021,42(5):1−10, 25. HU X Q, LIU W, XU W, et al. Effect of different yeasts on the quality of navel orange wine[J]. Science and Technology of Food Industry, 2021, 42(5): 1-10, 25.
[5] 战吉宬, 曹梦竹, 游义琳, 等. 非酿酒酵母在葡萄酒酿造中的应用[J]. 中国农业科学,2020,53(19):4057−4069. [ZHAN J C, CAO M Z, YOU Y L, et al. Research advance on the application of non-Saccharomyces in winemaking[J]. Scientia Agricultura Sinica,2020,53(19):4057−4069. ZHAN J C, CAO M Z, YOU Y L, et al. Research advance on the application of Non-Saccharomyces in winemaking[J]. Scientia Agricultura Sinica, 2020, 53(19): 4057-4069.
[6] JOLLY N P, VARELA C, PRETORIUS I S. Not your ordinary yeast: Non-Saccharomyces yeasts in wine production uncovered[J]. FEMS Yeast Research,2014,14(2):215−237. doi: 10.1111/1567-1364.12111
[7] WEI J P, ZHANG Y X, QIU Y, et al. Chemical composition, sensorial properties, and aroma-active compounds of ciders fermented with Hanseniaspora osmophila and Torulaspora quercuum in co- and sequential fermentations[J]. Food Chemistry, 2020, 306.
[8] CONTRERAS A, HIDALGO C, SCHMIDT S, et al. The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J]. International Journal of Food Microbiology,2015,205:7−15. doi: 10.1016/j.ijfoodmicro.2015.03.027
[9] LIN M M H, BOSS P K, WALKER M E, et al. Evaluation of indigenous non-Saccharomyces yeasts isolated from a South Australian vineyard for their potential as wine starter cultures[J]. International Journal of Food Microbiology, 2020, 312.
[10] BENITO S, MORATA A, PALOMERO F, et al. Formation of vinylphenolic pyranoanthocyanins by Saccharomyces cerevisiae and Pichia guillermondii in red wines produced following different fermentation strategies[J]. Food Chemistry,2011,124(1):15−23. doi: 10.1016/j.foodchem.2010.05.096
[11] MUñOZ-REDONDO J M, PUERTAS B, CANTOS-VILLAR E, et al. Impact of sequential inoculation with the non-Saccharomyces T. delbrueckii and M. pulcherrima combined with Saccharomyces cerevisiae strains on chemicals and sensory profile of rosé wines[J]. Journal of Agricultural and Food Chemistry,2021,69(5):1598−1609. doi: 10.1021/acs.jafc.0c06970
[12] VICENTE J, RUIZ J, BELDA I, et al. The genus Metschnikowia in enology[J]. Microorganisms,2020,8(7):1038. doi: 10.3390/microorganisms8071038
[13] 刘晓柱, 赵湖冰, 李银凤, 等. 一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析[J]. 食品与发酵工业,2020,46(8):97−104. [LIU X Z, ZHAO H B, LI Y F, et al. Identification and oenological properties analysis of a strain of Hanseniaspora uvarum from Rosa roxburghii[J]. Food and Fermentation Industries,2020,46(8):97−104. LIU X Z, ZHAO H B, LI Y F, et al. Identification and oenological properties analysis of a strain of Hanseniaspora uvarum from Rosa roxburghii[J]. Food and Fermentation Industries, 2020, 46(8): 97-104.
[14] 曾朝珍, 康三江, 张霁红, 等. 异常汉逊酵母与酿酒酵母混菌发酵对苹果白兰地风味物质的影响[J]. 食品工业科技,2018,39(5):250−255. [ZENG C Z, KANG S J, ZHANG J H, et al. Effect of mixed cultured of Hansenula anomala and Saccharomyces cerevisiae on flavor compounds during apple brandy fermentation[J]. Science and Technology of Food Industry,2018,39(5):250−255. ZENG C Z, KANG S J, ZHANG J H, et al. Effect of mixed cultured of Hansenula anomala and Saccharomyces cerevisiae on flavor compounds during apple brandy fermentation[J]. Science and Technology of Food Industry, 2018, 39(5): 250-255.
[15] BENITO S. The impact of Torulaspora delbrueckii yeast in winemaking[J]. Applied Microbiology and Biotechnology,2018,102(7):3081−3094. doi: 10.1007/s00253-018-8849-0
[16] 阳秀莲. 靖州杨梅酒发酵菌株筛选、鉴定及应用研究[D]. 长沙: 湖南大学, 2019. YANG X L Screening, identification and application of fermentation strain of bayberry wine in Jingzhou[D]. Changsha: Hunan University, 2019.
[17] LIU H C, XU Y J, WU J J, et al. GC-IMS and olfactometry analysis on the tea aroma of Yingde black teas harvested in different seasons[J]. Food Research International, 2021, 150.
[18] WANG S Q, CHEN H T, SUN B G. Recent progress in food flavor analysis using gas chromatography-ion mobility spectrometry (GC-IMS)[J]. Food Chemistry, 2020, 315.
[19] ZHANG K Y, ZHANG C, ZHUANG H N, et al. Characterization of volatile component changes in peas under different treatments by GC-IMS and GC-MS[J]. Journal of Food Quality, 2021, 2021.
[20] 潘训海. 脐橙果酒澄清技术[J]. 江苏农业科学,2013,41(7):245−247. [PAN X H. Clarification technology of navel orange wine[J]. Jiangsu Agricultural Sciences,2013,41(7):245−247. PAN X H. Clarification technology of navel orange wine[J]. Jiangsu Agricultural Sciences, 2013, 41(7): 245-247.
[21] 国家标准化管理委员会. GB 5009.225-2016. 食品安全国家标准 酒中乙醇浓度的测定[S]. 北京: 中国标准出版社, 2016 Standardization Administration of the People's Republic of China. GB 5009.225-2016 Determination of ethanol concentration in wine[S]. Beijing: China Standards Publishing House, 2016.
[22] 韩斯, 孟宪军, 汪艳群, 等. 不同品种蓝莓品质特性及聚类分析[J]. 食品科学,2015,36(6):140−144. [HAN S, MENG X J, WANG Y Q, et al. Quality properties and cluster analysis of different blueberry cultivars[J]. Food Science,2015,36(6):140−144. HAN S, MENG X J, WANG Y Q, et al. Quality properties and cluster analysis of different blueberry cultivars[J]. Food Science, 2015, 36(6): 140-144.
[23] 国家标准化管理委员会. GB/T 12456-2021食品安全国家标准 食品中总酸的测定[S]. 北京: 中国标准出版社, 2021 Standardization Administration of the People's Republic of China. GB/T 12456-2021 National food safety standards. Determination of total acids in foods[S]. Beijing: China Standards Publishing House, 2021.
[24] WOOD I P, ELLISTON A, RYDEN P, et al. Rapid quantification of reducing sugars in biomass hydrolysates: Improving the speed and precision of the dinitrosalicylic acid assay[J]. Biomass and Bioenergy,2012,44:117−121. doi: 10.1016/j.biombioe.2012.05.003
[25] 高文军, 李卫红, 王喜明, 等. 3, 5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量[J]. 中国药业,2020,29(9):113−116. [GAO W J, LI W H, WANG X M, et al. Determination of educing sugar and total sugar in turnip by 3, 5-dinitrosalicylic acid colorimetry[J]. China Pharmaceuticals,2020,29(9):113−116. GAO W J, LI W H, WANG X M, et al. Determination of educing sugar and total sugar in turnip by 3, 5-dinitrosalicylic acid colorimetry[J]. China Pharmaceuticals, 2020, 29(9): 113-116.
[26] CHAVAN J J, JAGTAP U B, GAIKWAD N B, et al. Total phenolics, flavonoids and antioxidant activity of Saptarangi (Salacia chinensis L.) fruit pulp[J]. Journal of Plant Biochemistry and Biotechnology,2013,22(4):409−413. doi: 10.1007/s13562-012-0169-3
[27] 李绮丽, 孙俊杰, 单杨, 等. 不同柑橘品种全果制汁适宜性分析[J]. 食品科学,2019,40(13):36−44. [LI Q L, SUN J J, SHAN Y, et al. Suitability evaluation of different citrus varieties for whole fruit juice processing[J]. Food Science,2019,40(13):36−44. LI Q L, SUN J J, SHAN Y, et al. Suitability evaluation of different citrus varieties for whole fruit juice processing[J]. Food Science, 2019, 40(13): 36-44.
[28] HU L L, WANG J, JI X A, et al. Selection of non-Saccharomyces yeasts for orange wine fermentation based on their enological traits and volatile compounds formation[J]. Journal of Food Science and Technology-Mysore,2018,55(10):4001−4012. doi: 10.1007/s13197-018-3325-5
[29] 张博钦, 方梓庄, 成池芳, 等. 5株低产乙醇的非酿酒酵母筛选及其酿造特性[J]. 食品科学,2021,42(8):114−121. [ZHANG B Q, FANG Z Z, CHENG C F, et al. Screening of five non-Saccharomyces strains with low ethanol yield and evaluation of their oenological properties[J]. Food Science,2021,42(8):114−121. ZHANG B Q, FANG Z Z, CHENG C F, et al. Screening of five Non-Saccharomyces strains with low ethanol yield and evaluation of their oenological properties[J]. Food Science, 2021, 42(8): 114-121.
[30] GARRIDO-DELGADO R, DOBAO-PRIETO M D M, ARCE L, et al. Determination of volatile compounds by GC-IMS to assign the quality of virgin olive oil[J]. Food Chemistry,2015,187:572−579. doi: 10.1016/j.foodchem.2015.04.082
[31] FREIRE R, FERNANDEZ L, MALLAFRE-MURO C, et al. Full workflows for the analysis of gas chromatography-ion mobility spectrometry in foodomics: Application to the analysis of Iberian ham aroma[J]. Sensors,2021,21(18):6156.
[32] AYESTARAN B, MARTINEZ-LAPUENTE L, GUADALUPE Z, et al. Effect of the winemaking process on the volatile composition and aromatic profile of Tempranillo Blanco wines[J]. Food Chemistry,2019,276:187−194. doi: 10.1016/j.foodchem.2018.10.013
[33] LI C, AL-DALALI S, WANG Z P, et al. Investigation of volatile flavor compounds and characterization of aroma-active compounds of water-boiled salted duck using GC-MS-O, GC-IMS, and E-nose[J]. Food Chemistry,2022,386:132728. doi: 10.1016/j.foodchem.2022.132728
[34] FENG T, SUN J Q, SONG S Q, et al. Geographical differentiation of Molixiang table grapes grown in China based on volatile compounds analysis by HS-GC-IMS coupled with PCA and sensory evaluation of the grapes[J]. Food Chemistry:X,2022,15:100423. doi: 10.1016/j.fochx.2022.100423
[35] YANG Y, WANG B, FU Y, et al. HS-GC-IMS with PCA to analyze volatile flavor compounds across different production stages of fermented soybean whey tofu[J]. Food Chemistry,2021,346:128880. doi: 10.1016/j.foodchem.2020.128880
[36] SONG J X, SHAO Y, YAN Y M, et al. Characterization of volatile profiles of three colored quinoas based on GC-IMS and PCA[J]. LWT,2021,146:111292. doi: 10.1016/j.lwt.2021.111292
-
期刊类型引用(7)
1. 王琳,李安林,熊双丽,熊得全,唐丹. 红外烤制和微波烤制猪肉品质的对比分析. 食品工业科技. 2024(08): 57-66 .  本站查看
本站查看
2. 王宇临,胡代花,王丹妮,杨旭,孔凡舒,陈小华,陈旺,冯自立. 食用菌不同部位风味物质差异及其对食品风味影响研究进展. 中国调味品. 2024(09): 200-207 .  百度学术
百度学术
3. 邓雅元,华蓉,孙达锋,游金坤,王娟,杨璐敏,代秋琼,曹燕妮. 食用菌风味成分及其检测方法研究. 中国食用菌. 2024(06): 97-103 .  百度学术
百度学术
4. 张扬,集贤,谷旭东,赵茹,张琴,朱志强. 气相色谱-离子迁移谱技术(GC-IMS)在食用菌领域的应用前景分析. 中国食用菌. 2023(06): 1-5+10 .  百度学术
百度学术
5. 何奎,贠建民,毕阳,王睿,毛永强,武淑娟. 纳米膜包装真姬菇贮藏期间挥发性风味成分变化分析. 食品科学. 2021(20): 160-166 .  百度学术
百度学术
6. 曹佳兴,许柠,汪丽萍,张国治. 挤压膨化温度对麸皮回填法制备的全麦挂面风味成分的影响. 河南工业大学学报(自然科学版). 2021(06): 71-79+133 .  百度学术
百度学术
7. 李星仪,张悦,谢永康,于贤龙,朱广飞,高振江,肖红伟,刘嫣红. 热风干燥过程相对湿度对香菇品质的影响. 农业工程学报. 2020(24): 281-291 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:

 下载:
下载:



