Protective Effects of Fucoidan Isolated from Sargassum fusiform on AAPH-induced Antioxidant Response in Zebrafish Model
-
摘要: 目的:探究羊栖菜褐藻糖胶(SFPS)对2, 2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)诱导氧化应激斑马鱼模型的保护作用。方法:通过检测SFPS对2, 2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)及1, 1-二苯基-2-苦基肼(DPPH)自由基的清除能力,来评价及验证SFPS的体外抗氧化能力,优化AAPH诱导斑马鱼氧化应激模型,并分别以三个表型指标胚胎存活率、卵黄囊大小和心跳速率以及斑马鱼体内细胞死亡率和活性氧(ROS)生成率来评价SFPS的体内抗氧化活性。结果:SFPS主要由75.30%±1.77%的总糖、21.39%±1.07%的硫酸根,1.78%±0.19%的蛋白质以及1.47%±0.02%的多酚组成,对DPPH、ABTS自由基清除的IC50值分别为0.59、0.69 mg/mL。此外,SFPS在50~200 μg/mL范围内对斑马鱼胚胎无毒性,并对AAPH诱导引起的斑马鱼氧化损伤起到保护作用,且呈剂量依赖型。其中,在最优浓度200 μg/mL显著提高斑马鱼胚胎存活率(100%,P<0.05), 显著降低心跳速率(101.37%,P<0.05)和卵黄囊大小(111.80%,P<0.05),对斑马鱼体内细胞死亡和活性氧生成的抑制率最高分别可达70.55%和50.68%。结论:SFPS具有较强的体外抗氧化作用,并对AAPH诱导氧化损伤的斑马鱼表现出优越的体内抗氧化能力及氧化损伤修复能力,这表明SFPS作为天然抗氧化剂在保健食品及化妆品领域具有广泛应用前景。Abstract: Objective: A 2,2-azobis(2-methylpropylimidazole) dihydrochloride(AAPH)-stimulated zebrafish model was studied and used for investigating the antioxidant activities of a fucoidan(SFPS) isolated from Sargassum fusiform(S. fusiform). Methods: SFPS extracted from S. fusiform and the chemical composition of SFPS were determined. The scavenging capacities of SFPS on 1-diphenyl-2-picrylhydrazyl(DPPH) and 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS) radicals were determined to evaluate its antioxidant activity in vitro. Then the AAPH-induced oxidative stress model of zebrafish was studied and optimized. Three phenotypic indexes(survival rate, yolk sac size and heartbeat rate) as well as levels of cell death and reactive oxygen species(ROS) were used to evaluate the antioxidant activity of SFPS in vivo. Results: The SFPS contained 75.30%±1.77% carbohydrates content, 21.39%±1.07% sulfate content, 1.78%±0.19% protein content and 1.47%±0.02% phenolic content. Compared with the crude polysaccharide(SFPSC), lower IC50 values of SFPS for DPPH and ABTS were determined to be 0.59 and 0.69 mg/mL, respectively. Besides, SFPS was nontoxic to zebrafish embryos in the range of 50~200 μg/mL and dose-dependently protect zebrafishfrom AAPH induced oxidative damage. At the optimal concentration of 200 μg/mL, the survival rate of zebrafish embryos was significantly increased(100%, P<0.05), the heartbeat rate and yolk sac size were significantly reduced(101.37% and 111.80%, respectively, P<0.05), and the inhibition rate of AAPH-induced cell death and ROS production in zebrafish were up to 70.55% and 50.68%, respectively. Conclusion:
SFPS would have strong antioxidant activity in vitro, and had superior antioxidant ability and oxidative damage repair ability in vivo, thus indicated that SFPS as a natural antioxidant would have a wide application prospect in the field of health food and cosmetics. -
羊栖菜是一种马尾藻属褐藻,主要分布于北太平洋北部海岸,在我国分布广泛,辽东半岛、雷州半岛以及从北部山东至南部广东的沿海海域均有分布[1-2]。羊栖菜是我国重要的经济型海藻,主要在浙江省洞头县大规模养殖,并出口日本等国家。羊栖菜口感醇厚,风味良好,富含多种营养元素与营养成分,又被称为“长寿菜”。羊栖菜入药在我国历史悠久,《神农本草经》、《本草纲目》等药典中均有记载。
羊栖菜的营养价值与药用价值与其所含的功能性多糖有密切关系,羊栖菜中总糖含量可达干重的40%,其中以褐藻胶和褐藻糖胶为两种主要的功能性多糖。褐藻胶是以β-D甘露糖醛酸(M)和α-L-古罗糖醛酸(G)通过1-4连接而成的线性多糖,虽没有特别突出的生物活性,但由于具有独特的结构性质,其作为食品添加剂和医学材料等应用广泛[3]。褐藻糖胶是主要由L-岩藻糖和硫酸基团组成的水溶性杂多糖,以其优越的生物活性得到广泛关注[4]。研究表明,羊栖菜褐藻糖胶具有免疫调节[5]、抗炎[6]、抗黑色素瘤[6]、降血糖[7]、抗衰老[8]、抗菌[9]等多种生物活性。Wang等[10]研究发现酶辅助提取法从羊栖菜中提取的褐藻糖胶在角质形成细胞(HaCaT)及斑马鱼胚胎和幼鱼均表现出显著的紫外线保护作用。Chen等[5]发现从羊栖菜中分离纯化得到的褐藻糖胶组分可以通过激活CD14/IKK/NF-κB和P38/NF-κB信号通路在RAW 264.7巨噬细胞内发挥免疫增强作用。此外,已有文献报道了提取自羊栖菜的多糖具有抗氧化作用,但大多集中于对羊栖菜总粗多糖的抗氧化活性研究[11-14],目前针对于羊栖菜褐藻糖胶抗氧化活性的报道主要集中在其体外抗氧化活性的研究[15-16],本文利用体内模型对羊栖菜褐藻糖胶的抗氧化活性进行更深入研究。
斑马鱼(Danio rerio)是一种强大的脊椎动物模型,被广泛用于各种人类疾病的研究[17-19],主要优点在于其高度发达的免疫系统,与哺乳动物的生理和形态相似性,较低的养殖成本,加之其胚胎及幼鱼的光学透明度,使其更有利于体内形态检测[20-21]。
氧化应激过程与活性氧(ROS)产生和清除的不平衡有关,正常的ROS生成可以通过细胞内源性抗氧化系统清除,环境压力、毒性等刺激细胞会造成ROS过量产生而无法清除,进而诱导细胞损伤和凋亡,诱发各种疾病[22]。2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)可诱导斑马鱼胚胎产生氧化损伤,生成过量ROS,造成大量细胞死亡[23]。斑马鱼体内的氧化应激水平可以通过检测ROS生成水平、细胞死亡率来进行评价。
本实验首先对提取自羊栖菜的褐藻糖胶进行体外抗氧化活性评价,并进一步利用优化的AAPH诱导斑马鱼氧化应激模型进行体内抗氧化活性研究,为羊栖菜褐藻糖胶在功能性食品、化妆品工业中的应用提供了一定的理论指导。
1. 材料与方法
1.1 材料与仪器
羊栖菜 2018年5月收获自浙江省洞头县;成年野生AB系斑马鱼 上海费曦生物科技有限公司;1,1-二苯基-2-苦基肼(DPPH) 上海梯希爱化成工业发展有限公司;2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 大连美仑生物技术有限公司;二甲基亚砜(DMSO) 北京索莱宝生物技术有限公司;AAPH、三卡因、吖啶橙、2,7-二氟荧光黄双乙酸盐(DCFH-DA) 美国Sigma公司;无水乙醇、氯化钠、氯化钾、氯化钙、硫酸镁、盐酸、过硫酸钾、亚甲基蓝 分析纯,上海国药集团化学试剂有限公司;
SPX-100B-Z型生化培养箱 上海博讯实业有限公司; Powerwave XS型酶标仪 美国Biotek公司;斑马鱼全自动循环养殖系统 山东中科海科技集团有限公司;SZ61体式显微镜 日本奥林巴斯;A1R HD25激光共聚焦显微镜 日本Nikon公司;FA2004B电子天平 上海天美天平仪器有限公司;FD5-2.5冷冻干燥机 北京金西盟仪器有限公司;Milli Q纯水机 默克密理博实验室设备(上海)有限公司。
1.2 实验方法
1.2.1 羊栖菜多糖的制备
羊栖菜褐藻糖胶的制备方法参考Ni等[24]和李雅静[25]的研究。新鲜羊栖菜用蒸馏水冲洗干净,经冷风干燥后,粉碎,过60目筛,保存于−20 ℃。取20 g藻粉按照1:20 g/mL料液比加入95%乙醇,40 ℃搅拌2 h以除去色素、多酚和脂质。脱脂样品用超纯水(1:30,w/v)于70 ℃水浴摇床中振荡提取12 h,经4000 r/min离心、过滤后取上清液。此后,用三倍体积乙醇沉淀得到羊栖菜粗多糖(SFPSC);或上清液加入2% CaCl2溶液沉淀,4000 r/min离心,所得上清液旋蒸浓缩,用截留分子量3.5 kDa的透析膜透析3 d,加入3倍体积无水乙醇,于4 ℃冰箱静置过夜,离心后将沉淀复溶,旋蒸至无乙醇味,冻干得到羊栖菜褐藻糖胶(SFPS)。
1.2.2 化学组成分析
总糖含量的测定参照Dubois等[26]报道的方法,并稍作修改。以岩藻糖为标准品制作标准曲线并计算总糖含量。硫酸根含量的测定参照Kawai等[27]报道,利用明胶-BaCl2比浊法,以硫酸钾为标准品制作标准曲线计算硫酸根含量。蛋白质含量的测定根据Winters等[28]报道的方法,以牛血清蛋白为标准品制作标准曲线并计算。总酚含量的测定根据Chandler等[29]报道的福林酚法,以间苯三酚为标准品制作标准曲线进行计算。
1.2.3 体外抗氧化能力测定
1.2.3.1 DPPH自由基清除能力测定
DPPH自由基清除能力参照Tierney等[30]和Li等[31]的报道进行测定,并稍作修改。将100 μL不同浓度样品溶液和100 μL乙醇或乙醇配制的DPPH工作液分别加入到96孔板中,室温下避光孵育30 min,在515 nm波长下测定吸光度值。抑制率按照下式计算。
抑制率(%)=[1−Asample−AsampleblackAcontrol−Acontrolblack]×100 (1) 式中,Asample表示样品吸光度值(样品+DPPH工作液),Asample black表示样品空白的吸光度值(样品+乙醇),Acontrol表示对照吸光度值(DPPH工作液+去离子水),Acontrol black表示对照空白(乙醇+去离子水)。
1.2.3.2 ABTS自由基清除能力测定
ABTS自由基清除能力的测定参照Frattaruolo等[32]的报道,并稍作修改,将ABTS溶液(7 mmol/L)与过硫酸钾溶液(2.45 mmol/L)混合,室温避光孵育12~16 h,使用前用去离子水稀20~30倍,734 nm波长下吸光度值为0.70±0.02,分别将各浓度样品溶液和ABTS工作液或去离子水加入96孔板,室温下避光孵育10 min,测定734 nm波长下各孔吸光度值。抑制率按照下式计算。
抑制率(%)=[1−Asample−AsampleblackAcontrol−Acontrolblack]×100 (2) 式中,Asample表示样品吸光度值(样品+ABTS工作液),Asample black表示样品空白的吸光度值(样品+去离子水),Acontrol表示对照吸光度值(ABTS工作液+去离子水),Acontrol black表示对照空白(去离子水)。
1.2.4 斑马鱼体内抗氧化活性检测
1.2.4.1 斑马鱼喂养及胚胎收集
根据文献[33],繁殖期野生斑马鱼饲养于中科海公司的半自动循环系统中,水温(26±1)℃,系统每24 h光照时长14 h、黑暗时长10 h,每日早晚以新鲜丰年虾各饲喂一次。取健康雌雄鱼自然交配,用一次性培养皿中收集斑马鱼胚胎并培养于(28.5±1)℃恒温培养箱。
1.2.4.2 斑马鱼胚胎给药
挑选正常发育至7~9 hpf(hours post fertilization)的斑马鱼胚胎,以20枚/孔转移至24孔板中,去除旧培养液,根据实验目的与设计,每孔分别加入空白胚胎培养液(10% NaCl,0.3% KCl,0.3% CaCl2,0.79% MgSO4)、胚胎培养液配制的样品溶液或AAPH诱导溶液,培养体系为2 mL培养液,每组设置三个平行对照孔,给药完成后置于(28.5±1)℃恒温培养箱中培养[23]。
1.2.4.3 AAPH氧化诱导模型优化
根据参考文献[22-23,33],对不同浓度AAPH(10、15、20、25、30 mmol/L)诱导的斑马鱼氧化应激模型进行优化。待斑马鱼胚胎发育至8~9 hpf时进行一次胚胎给药,置于(28.5±1)℃培养箱中培养,后续分别进行斑马鱼胚胎存活率、卵黄囊大小、幼鱼体内ROS生成率及细胞死亡率的检测。
1.2.4.4 SFPS毒性评价
选择一定浓度(50、100、200、400 μg/mL)SFPS进行毒性评价实验,于胚胎发育的7~8 hpf加入样品,其后置于(28.5±1)℃培养箱中培养,进行斑马鱼胚胎存活率、正常发育率、心跳速率、幼鱼体内细胞死亡率的检测。
1.2.4.5 SFPS对AAPH诱导的斑马鱼氧化应激模型的保护作用评价
根据毒性评价结果,选择SFPS无氧化毒性的浓度范围进行抗氧化活性评价实验,于胚胎发育的7~8 hpf进行胚胎给药,于恒温培养箱(28.5±1)℃中进行预孵育,1 h 后利用佳AAPH诱导浓度(20 mmol/L)进行氧化诱导。实验分为空白对照组,AAPH诱导组,AAPH诱导+SFPS组,每组设置三个平行孔,实验体系均为2 mL。空白对照组:2 mL空白胚胎培养液;AAPH诱导组:2 mL胚胎培养液配制的AAPH诱导物(终浓度20 mmol/L);AAPH诱导+SFPS组:每孔加入胚胎培养液配制的无毒性浓度范围的SFPS样品溶液1.9 mL,预孵育1 h后,加入AAPH诱导物0.1 mL(至终浓度20 mmol/L)。给药完成后,将斑马鱼胚胎转移至(28.5±1)℃培养箱中进行孵育,待后续进行胚胎存活率、心跳速率、卵黄囊大小,幼鱼体内细胞死亡率、ROS生成率的测定。
斑马鱼存活率:统计每天按时观察胚胎发育情况,及时移除死亡胚胎,最后统计发育至72 hpf时期各实验组幼鱼存活率情况[34]。
存活率(%)=72hpf存活个数胚胎总个数×100 (3) 斑马鱼正常发育率统计:斑马鱼胚胎正常发育率的统计参照文献[33]。于显微镜下观察斑马鱼发育情况,计数发育至3 dpf时期正常形态下的斑马鱼幼鱼。
幼鱼卵黄囊大小检测:卵黄囊大小的评估根据Na等[35]的报道,并稍作修改。待斑马鱼胚胎发育至30 hpf时,对胚胎进行摆位后,利用带摄像头的显微镜后进行拍照,并用ImageJ软件测量卵黄囊大小,每个胚胎计算三次取平均值。最终数据以给药组卵黄囊大小与空白对照组卵黄囊大小的比值表示。
幼鱼心跳速率测定:待斑马鱼胚胎发育至48 hpf时期并脱膜后,利用体式显微镜观察,对各组幼鱼心跳速率进行人工计数,每次计数30 s,每条幼鱼计数三次取平均值[36]。心跳速率数值以给药组心跳数与空白对照组心跳数的比值表示。
斑马鱼幼鱼体内荧光染色与分析:根据Zou等[34]的报道,并稍作修改,待斑马鱼胚胎发育至72 hpf时期,分别选择各浓度组幼鱼数条,并用相应的荧光染色试剂进行荧光染色。各组幼鱼分别用胚胎培养液稀释的吖啶橙溶液(7 μg/mL)或DCFH-DA(15 μg/mL)进行避光孵育((28.5±1)℃)。孵育完成后,用胚胎培养液冲洗幼鱼以洗去未结合的荧光试剂,重复5次。拍摄荧光图片前,用0.03%的三卡因溶液麻醉幼鱼,并将其置于激光共聚焦显微镜下捕获图片。图片荧光强度的分析用ImageJ软件进行。各组ROS生成率(%)、细胞死亡率(%)以样品组荧光强度与空白组荧光强度的比值表示。
1.3 数据处理
所有实验均重复三次,实验结果以
ˉX ±SD表示;实验数据的统计学分析利用SPSS19软件进行,通过单因素(ANOVA)分析,Turkey检验对组间差异性进行比较,P<0.05为具有显著性差异。2. 结果与分析
2.1 多糖的化学组成
SFPS基本化学组成的标准曲线方程如表1所示,以岩藻糖为标准品绘制的总糖含量标准曲线回归方程为y=3.5706x+0.0618,其中R2=0.9990,对SFPS和SFPSC进行测定,得到其总糖含量分别为75.30%±1.77%和40.41%±0.19%。利用明胶-BaCl2比浊法得到硫酸根标准曲线拟合方程为y=0.2959x+0.0331,其中R2=0.9996,计算得SFPS和SFPSC硫酸根含量分别是21.39%±1.07%和17.10%±0.42%。以BSA为标准品绘制的蛋白质标准曲线回归方程为y=4.0167x+0.2176,其中R2=0.9968,计算得SFPS和SFPSC的蛋白质含量分别为1.78%±0.19%和2.01%±0.17%。以间苯三酚为标准品绘制的多酚含量标准曲线回归方程为y=22.952x+0.0412,其中R2=0.9991,计算得SFPS和SFPSC的多酚含量分别是1.47%±0.02%和1.50%±0.09%。各物质含量数据结果如表2所示,SFPS的总糖含量比SFPSC高近一倍。综上,可以说SFPSC与SFPS都是硫酸化多糖,均含有较高的硫酸根含量。大量研究表明,海藻多糖具有优越的抗氧化活性[4,15,22,37],因此推测SFPSC与SFPS也具有一定的抗氧化潜力。
表 1 标准曲线方程Table 1. Equations of standard curves指标 标准曲线方程 R2 总糖 y=3.5706x+0.0618 0.9990 硫酸根 y=0.2959x+0.0331 0.9996 蛋白质 y=4.0167x+0.2176 0.9968 多酚 y=22.952x+0.0412 0.9991 表 2 SFPSC与SFPS的化学组成Table 2. Chemical components of SFPSC and SFPCSFPSC SFPS 总糖含量(%) 40.41±0.19 75.30±1.77 硫酸根含量(%) 17.10±0.42 21.39±1.07 蛋白质含量(%) 2.01±0.17 1.78±0.19 多酚含量(%) 1.50±0.09 1.47±0.02 2.2 体外抗氧化能力测定结果
DPPH与ABTS自由基清除法是两种有效评价和筛选活性物质抗氧化活性的方法。两种样品体外抗氧化能力测定结果如表3所示,SFPS的DPPH与ABTS自由基清除能力均明显强于SFPSC。其中,SFPS的DPPH自由基清除能力IC50值为0.59 mg/mL,远远低于提取自Sargassum fulvellum的褐藻糖胶的IC50值(6.90 mg/mL)[22],表明SFPS具有优越的体外抗氧化活性。目前,AAPH已被广泛用作自由基诱导剂用于抗氧化研究[38-39]。因此,本实验采用AAPH诱导氧化应激反应,并进一步评价SFPS在斑马鱼体内的抗氧化保护作用。
表 3 SFPSC与SFPS的自由基清除能力Table 3. Free radical scavenging activities of SFPSC and SFPS obtained from S. fusiform样品 自由基清除能力(IC50,mg/mL) DPPH ABTS SFPSC 1.22±0.02 0.93±0.01 SFPS 0.59±0.01 0.69±0.01 2.3 AAPH诱导斑马鱼氧化模型优化
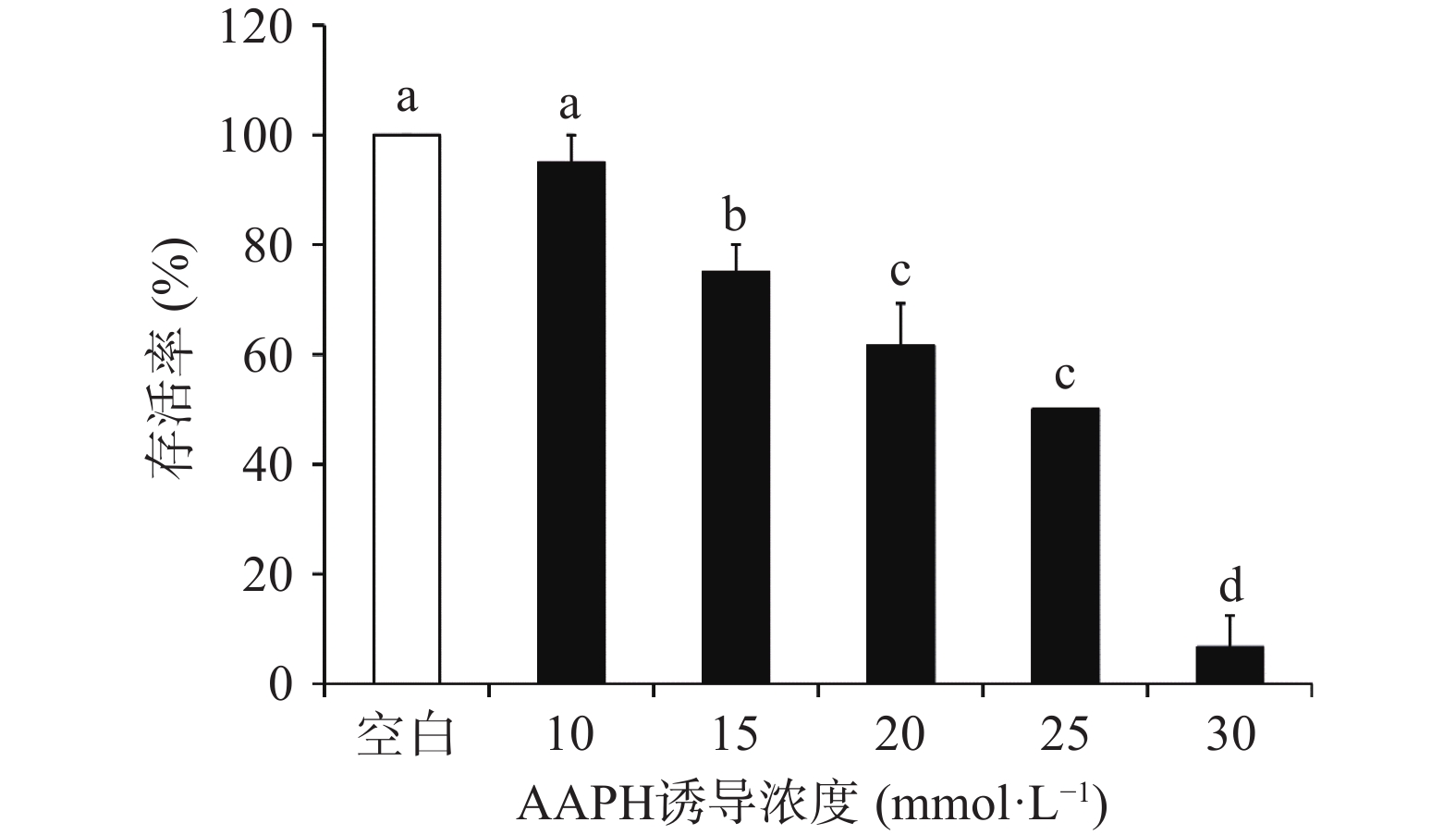
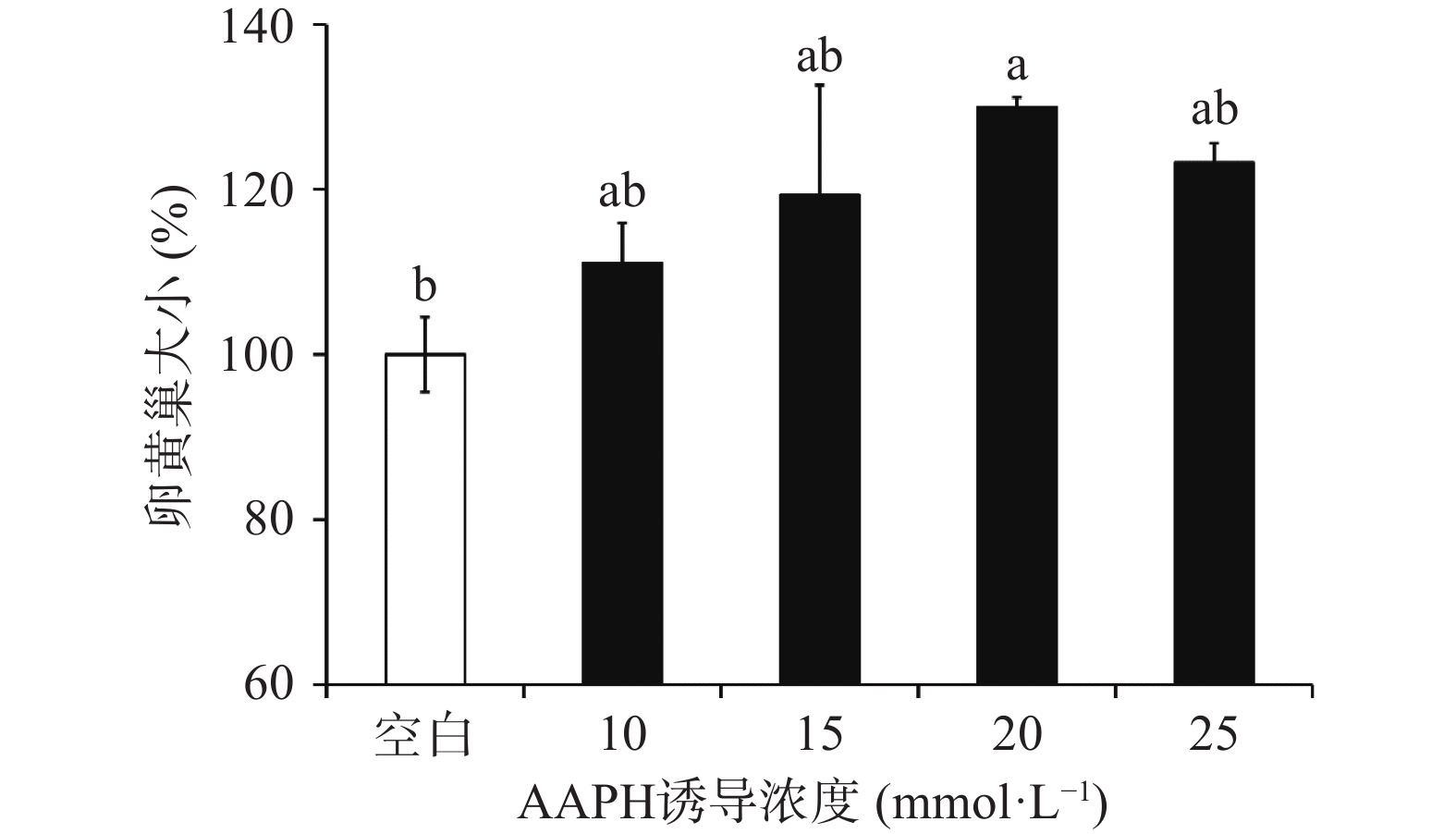
2.3.1 AAPH诱导浓度对斑马鱼胚胎存活率、卵黄囊大小的影响
如图1所示,各个实验浓度的AAPH均对胚胎存活有一定的负面影响,且胚胎存活率与AAPH浓度呈剂量依赖型降低,且经高浓度AAPH(30 mmol/L)诱导,斑马鱼胚胎存活率降低到50%以下(6.67%),不适用于进一步指标检测。而中、低浓度AAPH(10、15、20、25 mmol/L)诱导造成的存活率均大于等于50%,可以满足后续指标检测及诱导效果评价。
斑马鱼从胚胎到幼鱼时期的发育依靠卵黄囊提供营养,而不需从外界获取营养物质,因此胚胎卵黄囊大小可在一定程度上指示胚胎发育程度[40]。所选浓度对斑马鱼胚胎卵黄囊大小的影响结果如图2所示,在不同浓度AAPH诱导下,斑马鱼胚胎卵黄囊均有一定程度的肿大,其中,与对照组相比,在10、15、25 mmol/L AAPH诱导下,斑马鱼胚胎卵黄囊呈现出非显著性的肿大(111.11%、119.30%、123.25%),而在20 mmol/L诱导浓度下,斑马鱼卵黄囊显著肿大。因此初步认定20 mmol/L为最优诱导浓度。后续选择诱导效果较好的三个组(15、20、25 mmol/L)进行后续检测。
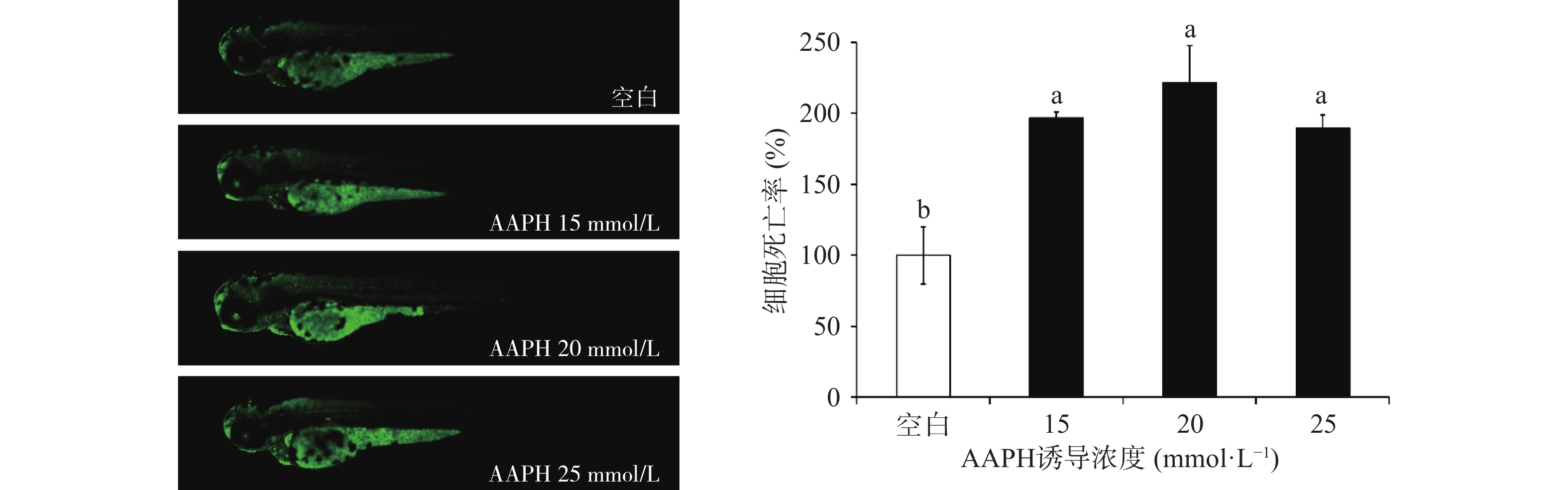
2.3.2 AAPH诱导浓度对斑马鱼幼鱼体内细胞死亡率和ROS生成率的影响
斑马鱼体内细胞死亡和ROS生成的荧光检测数据如图 3和图4所示。结果表明,三个浓度AAPH诱导均可显著提高斑马鱼体内细胞死亡水平(P<0.05),其中诱导浓度为20 mmol/L时,幼鱼体内细胞死亡率和ROS生成率分别可达221.48%和274.42%,均高于15、25 mmol/L诱导浓度下的过氧化应激水平。因此,选择20 mmol/L AAPH浓度建立斑马鱼氧化应激诱导模型进行后续活性物质的抗氧化活性评价。此造模浓度高于邹娅雪等[33]在研究中选择的浓度(15 mmol/L),但低于Kang等[23]在实验中选择的浓度(25 mmol/L)。
2.4 SFPS毒性评价
2.4.1 SFPS浓度对斑马鱼存活发育的影响
选择50~400 μg/mL浓度范围进行SPFS毒性评价,不同浓度SFPS对斑马鱼存活率的影响如图5a所示,50、100、200、400 μg/mL的SFPS均对斑马鱼胚胎无致死毒性。低浓度SFPS组(≤200 μg/mL)对斑马鱼胚胎没有致畸毒性,但是高浓度(400 μg/mL)SFPS不利于斑马鱼胚胎的正常发育,导致斑马鱼畸形发育(图5b),其正常发育率降低至91.67%(图5c)。对斑马鱼胚胎脱膜后幼鱼进行心跳速率的检测,检测结果如图 5d所示,在SFPS浓度为400 μg/mL时,与空白组相比,幼鱼心跳速率显著提高至108.26%(P<0.05),而低浓度SFPS则对斑马鱼生长发育无此负面影响。
2.4.2 SFPS浓度对斑马鱼幼鱼体内氧化应激水平的影响
如图6所示,200 μg/mL以下浓度的样品组细胞死亡率与空白组相比没有显著性差异(P>0.05),而400 μg/mL SFPS使斑马鱼幼鱼体内细胞死亡率显著升高(P<0.05)。综合以上实验结果,选择小于200 μg/mL的安全浓度进行后续抗氧化活性评价,与从Sargassum fulvellum[22]和Undaria pinnatifida[41]提取的褐藻糖胶(均为100 μg/mL)相比,可用于体内抗氧化研究的浓度范围更大,由此揭示了SFPS更优越的应用前景。
2.5 SFPS对AAPH诱导的斑马鱼氧化应激模型的保护作用评价
2.5.1 不同浓度SFPS对AAPH诱导的斑马鱼胚胎存活发育的影响
如图7a所示,与空白对照组相比,AAPH诱导组斑马鱼胚胎存活率降低至65.00%,实验结果与图1一致,而各浓度组SFPS均对AAPH导致的存活率降低有显著抑制作用(P<0.05),且抑制作用呈剂量依赖性提高。在SFPS浓度为200 μg/mL时,显著改善AAPH诱导导致的胚胎死亡(P<0.05),存活率可达100%,与空白对照组完全一致,证明SFPS对AAPH诱导的斑马鱼胚胎具有有效的保活作用。
如图7b所示,斑马鱼胚胎经AAPH诱导后发育变缓,消耗的营养物质减少,卵黄囊出现明显的非正常肿大,高达空白对照组斑马鱼的1.5倍。而经SFPS预孵育处理的实验组卵黄囊大小随浓度升高呈剂量依赖性减小,且在最高浓度200 μg/mL时与空白对照组无显著性差异。
斑马鱼幼鱼心跳速率检测结果如图7c所示,在AAPH诱导下,斑马鱼心跳速率显著升高至空白对照组的116.97%(P<0.05),而三个浓度SFPS实验组均显著抑制AAPH引起的幼鱼心跳速率升高(P<0.05),其中最优SFPS浓度为200 μg/mL,经此浓度预孵育的实验组心跳速率降低至与空白组无显著性差异(P>0.05)。实验结果表明SPFS对AAPH诱导斑马鱼模型产生的氧化损伤具有良好的保护作用。
2.5.2 不同浓度SFPS对AAPH诱导的斑马鱼幼鱼体内氧化应激水平的影响
2.5.2.1 不同浓度SFPS对AAPH诱导的斑马鱼幼鱼体内细胞死亡的影响
样品对AAPH诱导的斑马鱼体内细胞死亡率的影响结果如图8所示,根据荧光图像可以看出,AAPH诱导组荧光强度明显强于空白组荧光强度,荧光强度较强,证明经AAPH诱导,斑马鱼体内大量细胞凋亡,凋亡细胞结合荧光染料,使其发出强烈荧光。而各浓度SFPS预孵育组均显著降低了AAPH诱导产生的细胞死亡(P<0.05),且降低作用呈剂量依赖型增强,其中最高浓度200 μg/mL呈现出最强的抑制作用,与空白对照组无显著差异(P>0.05),且仅为AAPH诱导组的29.41%。Wang等[22]研究报道了从另一种马尾藻属褐藻Sargassum fulvellum中提取的岩藻聚糖硫酸酯在最优浓度下将AAPH诱导的斑马鱼体内的细胞死亡降低至55%左右,远高于SFPS的29.41%,这表明SFPS具有优越的抗氧化活性。
2.5.2.2 不同浓度SFPS对AAPH诱导的斑马鱼幼鱼体内活性氧生成率的影响
不同浓度SFPS对斑马鱼体内ROS生成率的影响结果如图9所示,AAPH的加入显著诱导斑马鱼幼鱼体内活性氧的过量生成至261.81%(P<0.05),但SFPS预孵育剂量依赖性降低ROS的生成。在50、100、200 μg/mL分别将ROS生成降低至220.08%、187.40%、129.13%。在最优浓度200 μg/mL时,与AAPH诱导组相比,活性氧生成的抑制率可达50.68%。
3. 结论与讨论
上述实验结果表明本实验提取的SFPS具有良好的体内抗氧化活性,且最优浓度为200 μg/mL,远高于Lee等[42]从另一种褐藻Ishige okamurae提取的褐藻糖胶最优浓度(6.25 μg/mL)。一定浓度范围(50~200 μg/mL)的SFPS在斑马鱼体内发挥抗氧化保护作用主要是通过直接清除AAPH诱导产生的ROS,并进一步减少细胞死亡来实现的。同样有研究表明,利用酶提法从韩国济州岛沿岸收集的Hizikia fusiforme中提取的粗多糖在H2O2诱导的斑马鱼体内同样发挥了剂量依赖性抑制活性氧生成的作用,但抑制率仅达18.50%[14],表明本实验中提取的褐藻糖胶具有良好的抗氧化活性。另外,与已报道过的其他褐藻糖胶相比[22,42],本实验中使用的SFPS抗氧化效果也更优,与这进一步印证了羊栖菜褐藻糖胶SFPS优越的的抗氧化活性。
据文献[2]报道,硫酸多糖的抗氧化活性与硫酸根含量呈正相关。本研究中褐藻糖胶SFPS是一种硫酸化多糖,硫酸根含量可达21.39%,高于其他已报道的褐藻糖胶[9,14,22],这或许是揭示本实验中SFPS表现出更强抗氧化活性的原因。
本研究首先对提取自羊栖菜的褐藻糖胶(SFPS)进行了化学组成测定,证明SFPS是一种硫酸根含量较高的硫酸化多糖,且体外自由基清除实验证明SFPS抗氧化能力与粗多糖SFPSC相比更有优势。本研究又通过不同诱导浓度优化得到20 mmol/L AAPH诱导的最优斑马鱼氧化应激模型,并首次利用该模型对样品SFPS进行了体内抗氧化活性的探究。一定浓度SFPS(50、100、200 μg/mL)剂量依赖性抑制AAPH诱导引起的胚胎死亡、卵黄囊肿大以及心跳速率过快(P<0.05),同时有效抑制了AAPH诱导导致的斑马鱼幼鱼体内细胞死亡率和ROS生成率升高(P<0.05),细胞死亡率和ROS生成率均降低至与正常组无显著差异,表现出良好的抗氧化活性。实验结果为SFPS作为天然抗氧化剂的开发利用提供了可靠的理论依据,证明SFPS具有极大的应用价值和市场前景。
-
表 1 标准曲线方程
Table 1 Equations of standard curves
指标 标准曲线方程 R2 总糖 y=3.5706x+0.0618 0.9990 硫酸根 y=0.2959x+0.0331 0.9996 蛋白质 y=4.0167x+0.2176 0.9968 多酚 y=22.952x+0.0412 0.9991 表 2 SFPSC与SFPS的化学组成
Table 2 Chemical components of SFPSC and SFPC
SFPSC SFPS 总糖含量(%) 40.41±0.19 75.30±1.77 硫酸根含量(%) 17.10±0.42 21.39±1.07 蛋白质含量(%) 2.01±0.17 1.78±0.19 多酚含量(%) 1.50±0.09 1.47±0.02 表 3 SFPSC与SFPS的自由基清除能力
Table 3 Free radical scavenging activities of SFPSC and SFPS obtained from S. fusiform
样品 自由基清除能力(IC50,mg/mL) DPPH ABTS SFPSC 1.22±0.02 0.93±0.01 SFPS 0.59±0.01 0.69±0.01 -
[1] 倪立颖, 邹娅雪, 付晓婷, 等. 利用LPS诱导胚胎期斑马鱼炎症模型研究羊栖菜多酚抗炎机制[J]. 食品工业科技,2019,40(21):279−285. [Ni Liying, Zou Yaxue, Fu Xiaoting, et al. Anti-inflammatory mechanism of phenolic compounds from Sargassum fusiforme by LPS-induced zebrafish embryo model[J]. Science and Technology of Food Industry,2019,40(21):279−285. [2] Zhang R, Zhang X, Tang Y, et al. Composition, isolation, purification and biological activities of Sargassum fusiforme polysaccharides: A review[J]. Carbohydrate Polymers,2020,228:115381. doi: 10.1016/j.carbpol.2019.115381
[3] Draget K I, Taylor C. Chemical, physical and biological properties of alginates and their biomedical implications[J]. Food Hydrocolloids,2011,25(2):251−256.
[4] Yu W, Maochen X, Qi C, et al. Biological activities of fucoidan and the factors mediating its therapeutic effects: A review of recent studies[J]. Marine Drugs,2019,3(17):183.
[5] Chen L, Chen P, Jian L, et al. Sargassum fusiforme polysaccharide SFP-F2 activates the NF-κB signaling pathway via CD14/IKK and P38 Axes in RAW264.7 Cells[J]. Marine Drugs,2018,16(8):264.
[6] Wang L, Oh J Y, Jayawardena T U, et al. Anti-inflammatory and anti-melanogenesis activities of sulfated polysaccharides isolated from Hizikia fusiforme: Short communication[J]. International Journal of Biological Macromolecules,2020,142:542−550.
[7] Cheng Y, Sibusiso L, Hou L, et al. Sargassum fusiforme fucoidan modifies the gut microbiota during alleviation of streptozotocin-induced hyperglycemia in mice[J]. International Journal of Biological Macromolecules,2019:131.
[8] 赵子慧, 徐曼, 刘阿梅, 等. 羊栖菜多糖通过激活JNK/Nrf2/ARE信号通路延缓小鼠衰老进程作用研究[J]. 中草药,2018,49(23):5600−5609. [Zhao Zihui, Xu Man, Liu Amei, et al. Effect of Sargassum fusiforme polysaccharides on activating JNK/Nrf2/ARE signaling pathway and slowing down aging process[J]. Chinese Traditional and Herbal Drugs,2018,49(23):5600−5609. doi: 10.7501/j.issn.0253-2670.2018.23.018 [9] Li Y, Chen B, Wu W, et al. Antioxidant and antimicrobial evaluation of carboxymethylated and hydroxamated degraded polysaccharides from Sargassum fusiforme[J]. International Journal of Biological Macromolecules,2018,118:1550−1557. doi: 10.1016/j.ijbiomac.2018.06.196
[10] Wang L, Oh J Y, Yang H W, et al. Protective effect of sulfated polysaccharides from a celluclast-assisted extract of Hizikia fusiforme against ultraviolet B-induced photoaging in vitro in human keratinocytes and in vivo in zebrafsh[J]. Marine Life Science & Technology,2019(1):104−111.
[11] 吴娟, 欧志荣, 李昭蓉, 等. 稀酸提取羊栖菜多糖的结构及其抗氧化特性研究[J]. 福建农业学报,2019,34(7):842−851. [Wu Juan, Ou Zhirong, Zhao Mouming. Structure and antioxidant activity of polysaccharides extracted from Sargassum fusiforme[J]. Fujian Journal of Agricultural Sciences,2019,34(7):842−851. [12] 吴利敏, 夏盛隆, 申苏建,等. L02脂肪变模型中氧化应激的发生及羊栖菜多糖的干预作用[J]. 中国现代医生,2017,34(55):17−23. [Wu Limin, Xia Shenglong, Shen sujian, et al. The occurrence of oxidative stress in L02 fatty model and the intervention of Sargassum fusiform polysaccharide[J]. China Modern Doctor,2017,34(55):17−23. [13] Wang W, Lu J, Wang C, et al. Effects of Sargassum fusiforme polysaccharides on antioxidant activities and intestinal functions in mice[J]. International Journal of Biological Macromolecules,2013,58:127−132. doi: 10.1016/j.ijbiomac.2013.03.062
[14] Wang L, Oh J Y, Kim H S, et al. Protective effect of polysaccharides from celluclast-assisted extract of Hizikiafusiforme against hydrogen peroxide-induced oxidative stress in vitro in Vero cells and in vivo in zebrafish[J]. International Journal of Biological Macromolecules,2018,112:483−489. doi: 10.1016/j.ijbiomac.2018.01.212
[15] 董乐, 董笑瀛, 王芳, 等. 羊栖菜硫酸多糖的超声辅助提取工艺优化及抗氧化活性研究[J]. 食品工业科技,2015,36(12):265−269. [Dong Le, Dong Xiaoying, Wang Fang, et al. Optimization of extraction and antioxidative activity in vitro ofsulfated polysaccharides from Sargassum fusiforme(Hary) Setch[J]. Science and Technology of Food Industry,2015,36(12):265−269. [16] Weihua J, Wenjing Z, Jing W, et al. A study of neuroprotective and antioxidant activities of heteropolysaccharides from six Sargassum species[J]. International Journal of Biological Macromolecules,2014,67:336−342. doi: 10.1016/j.ijbiomac.2014.03.031
[17] Kim E, Kang M, Lee J, et al. Protective effect of marine brown algal polyphenols against oxidative stressed zebrafish with high glucose[J]. RSC Advances,2015,5:25738−25746. doi: 10.1039/C5RA00338E
[18] Lee S, Ko C, Jee Y, et al. Anti-inflammatory effect of fucoidan extracted from Ecklonia cava in zebrafish model[J]. Carbohydrate Polymers,2013,92(1):84−89. doi: 10.1016/j.carbpol.2012.09.066
[19] Lieschke G J, Currie P D. Animal models of human disease: Zebrafish swim into view[J]. Nature Reviews Genetics,2007,8(5):353−367. doi: 10.1038/nrg2091
[20] Schoonheim P J, Chatzopoulou A, Schaaf M J M. The zebrafish as an in vivo model system for glucocorticoid resistance[J]. Steroids,2010,75(12):918−925. doi: 10.1016/j.steroids.2010.05.010
[21] Eisen J S. Zebrafish make a big splash[J]. Cell,1996,87(6):969−977. doi: 10.1016/S0092-8674(00)81792-4
[22] Wang L, Oh J Y, Hwang J, et al. In vitro and in vivo antioxidant activities of polysaccharides isolated from celluclast-assisted extract of an edible brown seaweed, Sargassum fulvellum[J]. Antioxidants,2019,8(10):493. doi: 10.3390/antiox8100493
[23] Kang M, Cha S H, Wijesinghe W A J P, et al. Protective effect of marine algae phlorotannins against AAPH-induced oxidative stress in zebrafish embryo[J]. Food Chemistry,2013,138(2−3):950−955. doi: 10.1016/j.foodchem.2012.11.005
[24] Ni Liying, Wang Lei, Fu Xiaoting, et al. In vitro and in vivo anti-inflammatory activities of a fucose-rich fucoidan isolated from Saccharina japonica[J]. International Journal of Biological Macromolecules,2020,156:717−729. doi: 10.1016/j.ijbiomac.2020.04.012
[25] 李雅静. 两品系羊栖菜(Sargassum fusiforme)的营养品质及活性成分研究[D]. 青岛: 中国海洋大学, 2018. Li Yajing. Study on nutritional quality and active components of two strands of Sargassum fusiforme[D]. Qingdao: Ocean University of China, 2018.
[26] Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. American Chemical Society,1956,3(28):350−356.
[27] Kawai Y, Seno N, Anno K. A modified method for chondrosulfatase assay[J]. Analytical Biochemistry,1969(32):314−321.
[28] Winters A L, Minchin F R. Modification of the lowry assay to measure proteins and phenols in covalently bound complexes[J]. Analytical Biochemistry,2005,346(1):43−48. doi: 10.1016/j.ab.2005.07.041
[29] Chandler S F, Dodds J H. The effect of phosphate, nitrogen and sucrose on the production of phenolics and solasodine in callus cultures of Solanum laciniatum[J]. Plant Cell Reports,1983,2(4):205−208. doi: 10.1007/BF00270105
[30] Tierney M S, Smyth T J, Rai D K, et al. Enrichment of polyphenol contents and antioxidant activities of Irish brown macroalgae using food-friendly techniques based on polarity and molecular size[J]. Food Chemistry,2013,139(1−4):753−761. doi: 10.1016/j.foodchem.2013.01.019
[31] Li Y, Fu X, Duan D, et al. Extraction and identification of phlorotannins from the brown alga, Sargassum fusiforme(Harvey) setchell[J]. Marine Drugs,2017,15(2):49. doi: 10.3390/md15020049
[32] Frattaruolo L, Carullo G, Brindisi M, et al. Antioxidant and anti-inflammatory activities of flavanones from Glycyrrhiza glabra L. (licorice) leaf phytocomplexes: Identification of licoflavanone as a modulator of nf-kb/mapk pathway[J]. Antioxidants,2019,8:186. doi: 10.3390/antiox8060186
[33] 邹娅雪, 付晓婷, 段德麟, 等. 利用斑马鱼模型研究琼胶寡糖抗氧化机制[J]. 食品工业科技,2019(4):286−298. [Zou Yaxue, Fu Xiaoting, Duan Deilin, et al. Antioxidant activities of agaro-oligosaccharides in AAPH-induced zebrafish model[J]. Science and Technology of Food Industry,2019(4):286−298. [34] Zou Y, Fu X, Liu N, et al. The synergistic anti-inflammatory activities of agaro-oligosaccharides with different degrees of polymerization[J]. Journal of Applied Phycology,2019,31(4):2547−2558. doi: 10.1007/s10811-019-1740-2
[35] Na Yi-rang, Seok Seung-hyeok, Bae Min-won, et al. Protective effects of vitamin E against 3, 3', 4, 4', 5-pentachlorobiphenyl (PCB126) induced toxicity in zebrafish embryos[J]. Ecotoxicology and Environmental Safety,2009,72(3):714−719. doi: 10.1016/j.ecoenv.2008.09.015
[36] Tae-Young C, Jin-Hwa K, Han K D, et al. Zebrafish as a new model for phenotype-based screening of melanogenic regulatory compounds[J]. Pigment cell Research,2007,20(2):120−127. doi: 10.1111/j.1600-0749.2007.00365.x
[37] Jacobsen C, Sørensen, Ann-Dorit M, et al. Source, extraction, characterization, and applications of novel antioxidants from seaweed[J]. Annual Review of Food Science and Technology,2019,10(1).
[38] Dion M Z, Wang Y J, Bregante D, et al. The use of a 2,2'-azobis(2-amidinopropane) dihydrochloride stress model as an indicator of oxidation susceptibility for monoclonal antibodies[J]. Journal of Pharmaceutical Ences,2018,107(2):550−558.
[39] Betigeri S, Thakur A, Raghavan K. Use of 2, 2′-azobis(2-amidinopropane) dihydrochloride as a reagent tool for evaluation of oxidative stability of drugs[J]. Pharmaceutical Research,2005,22(2):310−317. doi: 10.1007/s11095-004-1199-x
[40] 陈汝家, 朱俊靖, 周盛梅, 等. 斑马鱼模型在药物毒性与安全性评价中的应用[J]. 毒理学杂志,2012,26(3):224−228. [Chen Rujia, Zhu Junjing, Zhou Shengmei. Application of zebrafish model in drug toxicity and safety evaluation[J]. Journal of Toxical,2012,26(3):224−228. [41] Phull A, Majid M, Haq I, et al. In vitro and in vivo evaluation of anti-arthritic, antioxidant efficacy of fucoidan from Undaria pinnatifida (Harvey) Suringar[J]. International Journal of Biological Macromolecules,2017,97:468−480. doi: 10.1016/j.ijbiomac.2017.01.051
[42] Lee W, Kang N, Kim E, et al. Radioprotective effects of a polysaccharide purified from Lactobacillus plantarum-fermented Ishigeokamurae against oxidative stress caused by gamma ray-irradiation in zebrafish in vivo model[J]. Journal of Functional Foods,2017,28:83−89. doi: 10.1016/j.jff.2016.11.004
-
期刊类型引用(1)
1. 于心雨,胡云霄,魏琳,王舒悦,李珊珊,胡福良. 2023年国内外蜂王浆研究概况. 中国蜂业. 2024(03): 38-49 .  百度学术
百度学术
其他类型引用(0)









 下载:
下载:






 下载:
下载:
