Study on the Enrichment of Peptides in Wheat Germ by Microwave Combined with Metal Ions
-
摘要: 为高效富集麦胚多肽,采用微波联合金属离子处理麦胚,考察微波功率、微波时间、ZnSO4浓度、MnSO4浓度、CaCl2浓度对麦胚肽含量和蛋白酶活力的影响,在单因素实验的基础上通过正交试验对工艺参数进行了优化。结果表明:在微波功率400 W,微波时间10 s,ZnSO4浓度1.0 mmol/L,MnSO4浓度1.6 mmol/L,CaCl2浓度1.4 mmol/L的条件下,麦胚中的多肽含量可达228.85 mg/g,蛋白酶活力提高至2268.40 U/g。微波联合金属离子处理对麦胚中肽的富集有显著促进作用。Abstract: In order to efficiently enrich wheat germ polypeptide, microwave combined with metal ions were used to treat wheat germ, and the effects of microwave power, microwave time, ZnSO4 concentration, MnSO4 concentration, and CaCl2 concentration on wheat germ peptide content and protease activity were investigated. The process parameters were optimized by orthogonal experiment on the basis of single factor. The results showed that under the conditions of microwave power 400 W, microwave time 10 s, ZnSO4 concentration 1.0 mmol/L, MnSO4 concentration 1.6 mmol/L and CaCl2 concentration 1.4 mmol/L, the polypeptide content in wheat germ could reach 228.85 mg/g, and the protease activity increased to 2268.40 U/g. Microwave combined with metal ions can significantly promote the enrichment of peptides in wheat germ.
-
Keywords:
- wheat germ /
- metal ion /
- microwave /
- peptide content /
- protease activity
-
麦胚是面粉加工的副产品[1],含有丰富的蛋白质、脂肪、糖类、维生素、谷胱甘肽、黄酮类物质、脂多糖及甾醇等多种营养物质[2-4]。麦胚中蛋白含量高达30%左右,麦胚蛋白多为完全蛋白,含有人体必需的8种氨基酸,被认为是一种优质的植物蛋白来源[5-7]。但通常麦胚被当作饲料廉价出售,得不到合理利用。研究人员发现,麦胚水解产生多种功能肽[8],可降低胆固醇、调节血压、预防心血管疾病等[9-12]。麦胚中的肽水溶性较好、热稳定性强、耐酸碱能力强,通常可以作为抗氧化肽、降血糖肽、谷胱甘肽和血管紧张素转化酶抑制肽等功能因子被添加到食品中[13]。
国内外通常采用微生物发酵法、外源酶水解法和内源酶水解法等生物技术来富集麦胚蛋白中的肽,以实现麦胚中肽的高值化利用[10]。其中微生物发酵法制备的肽适口性较好,但可用微生物菌种较少且不适用于所有肽的制备。利用外源蛋白酶水解麦胚蛋白,产物得率较高,但生产成本高,水解产物含有多种疏水性苦味肽[12, 14, 15],影响产品的风味和口感。麦胚的主要内源蛋白酶有半胱氨酸、丝氨酸、天冬氨酸和金属蛋白酶等[5, 8]。麦胚经过孵育,内源蛋白酶被激活,麦胚蛋白被降解成可溶性蛋白、氨基酸及具有生物活性的多肽类物质,且孵育法不产生毒副作用,用于富集麦胚中的肽安全、高效。崔新明[16]采用孵育法富集麦胚多肽,发现经过孵育多肽含量显著提高,所配制的富肽麦胚营养粉感官评价较好。适度改变麦胚的孵育条件有利于提高麦胚蛋白酶活力,使生物活性物质被释放并得以富集。余南静等[17]发现孵育时加入ZnSO4、MnSO4和CaCl2等金属离子,麦胚蛋白酶活力呈显著促进效应,酶活力达到385.44 U/g,多肽含量达到49.35 mg/g。因此,将金属离子用于富集麦胚中的肽具有可行性。
微波处理能够改变蛋白酶分子的构象,改变酶的催化活性,进而加快蛋白的水解[18-21]。研究表明,在合适的微波条件下,植物种子中的淀粉酶、蛋白酶和转氨酶的酶活更高,微波辐射对极性较强的底物更有优势[22-23]。Cao等[24]采用同步升温法研究微波加热对谷氨酰胺酶(TGase)活性的影响,发现微波处理可改变它的构象及二级结构,使其分子更容易和底物结合,提高了酶的活性。Tian等[25]发现微波辅助酶解麦胚蛋白比传统的传导加热具有更高的水解度,可产生更多的生物活性物质。微波处理仍可保持麦胚的固有颜色,并提高麦胚的产品风味[26]。但微波联合金属离子富集麦胚中的肽的研究尚未报道。
本研究以未经脱脂的离体麦胚为原料,选用3种金属离子(ZnSO4、MnSO4和CaCl2)为孵育液添加物,处理麦胚微波辅助,研究不同浓度的金属离子及微波条件对麦胚蛋白酶活力和肽含量的影响。在单因素实验的基础上,通过正交试验对工艺参数进行优化,研究结果为高效利用麦胚与富集功能性肽提供了新的实验数据。
1. 材料与方法
1.1 材料与仪器
麦胚 丹阳市莲湖面粉有限公司;酪蛋白、还原型谷胱甘肽、β-巯基乙醇 分析纯,上海麦克林生化科技有限公司;L-酪氨酸、三氯乙酸、硫酸锌、硫酸锰、氯化钙、氢氧化钠、硫酸铜、酒石酸钾钠、柠檬酸、柠檬酸三钠、磷酸氢二钠、乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA) 均为分析纯,国药集团化学试剂有限公司。
ZW-bp120变频实验微波炉 芜湖众维教研仪器研发有限责任公司;U-T3紫外可见分光光度计 上海屹谱仪器制造有限公司;Eppendorf 5804/R大型高速冷冻离心机 德国艾本德股份公司;HWS-26型电热恒温水浴锅、DHG-9240A电热鼓风干燥箱 上海一恒科学仪器有限公司;PHS-25 pH计 上海仪电科学仪器股份有限公司;FSH-2B可调高速匀浆机 方科仪器(常州)有限公司;YP5001N型电子天平 上海舜宇恒平科学仪器厂。
1.2 实验方法
1.2.1 麦胚孵育
参照余南静等[17]孵育麦胚的方法。称取3 g/份麦胚,置于研钵中,按照料液比1:10加入孵育液(0.1 mol/L,pH为3.0的柠檬酸-柠檬酸钠缓冲液),在孵育液中加入适量浓度的ZnSO4、MnSO4、CaCl2。研磨成匀浆后,转移至50 mL离心管中,经微波处理后,置于49 ℃水浴锅中孵育富集6 h后得到麦胚孵育液。
1.2.2 单因素实验
针对微波功率、微波时间、ZnSO4浓度、MnSO4浓度、CaCl2浓度进行单因素实验,考察各因素对麦胚肽含量和蛋白酶活力的影响。
1.2.2.1 微波功率对麦胚肽含量和蛋白酶活力的影响
在微波时间10 s,ZnSO4浓度0.6 mmol/L,MnSO4浓度2.0 mmol/L,CaCl2浓度1.4 mmol/L条件下,研究微波功率(0、200、400、600、800、1000 W)对麦胚肽含量和蛋白酶活力的影响。
1.2.2.2 微波时间对麦胚肽含量和蛋白酶活力的影响
在微波功率600 W,ZnSO4浓度0.6 mmol/L,MnSO4浓度2.0 mmol/L,CaCl2浓度1.4 mmol/L条件下,研究微波时间(0、2、4、6、8、10、12 s)对麦胚肽含量和蛋白酶活力的影响。
1.2.2.3 ZnSO4浓度对麦胚肽含量和蛋白酶活力的影响
在微波功率600 W,微波时间10 s,MnSO4浓度2.0 mmol/L,CaCl2浓度1.4 mmol/L条件下,研究ZnSO4浓度(0、0.2、0.4、0.6、0.8、1.0、1.2 mmol/L)对麦胚肽含量和蛋白酶活力的影响。
1.2.2.4 MnSO4浓度对麦胚肽含量和蛋白酶活力的影响
在微波功率600 W,微波时间10 s,ZnSO4浓度0.6 mmol/L,CaCl2浓度1.4 mmol/L条件下,研究MnSO4浓度(0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2 mmol/L)对麦胚肽含量和蛋白酶活力的影响。
1.2.2.5 CaCl2浓度对麦胚肽含量和蛋白酶活力的影响
在微波功率600 W,微波时间10 s,ZnSO4浓度0.6 mmol/L,MnSO4浓度2.0 mmol/L条件下,研究MnSO4浓度(0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mmol/L)对麦胚肽含量和蛋白酶活力的影响。
1.2.3 正交试验
在单因素实验的基础上,以微波功率、微波时间、ZnSO4浓度、MnSO4浓度、CaCl2浓度为考察对象,麦胚肽含量及蛋白酶活力为考察指标,进行L16(45)正交试验,优化微波联合金属离子处理麦胚蛋白的工艺参数。因素与水平如表1所示。
表 1 L16(45)正交试验因素水平表Table 1. L16 (45) orthogonal test factors and levels
水平因素 A:
微波功率
(W)B:
微波时间
(s)C:ZnSO4
浓度
(mmol/L)D:MnSO4
浓度
(mmol/L)E:CaCl2
浓度
(mmol/L)1 200 6 0.4 1.6 1.2 2 400 8 0.6 1.8 1.4 3 600 10 0.8 2.0 1.6 4 800 12 1.0 2.2 1.8 1.2.4 指标测定
1.2.4.1 肽含量测定
参照鲁伟等[27]测定多肽的方法并稍作修改,取2.5 mL麦胚孵育液置于15 mL离心管中,加入2.5 mL 10%(w/v)的三氯乙酸溶液,混匀后静置10 min,4 ℃ 4000 r/min下离心15 min,将上清液转移至50 mL容量瓶中,并用5%的三氯乙酸定容。取该溶液6 mL置于另一离心管中,加入双缩脲试剂4 mL,混匀后静置10 min,4 ℃ 2000 r/min离心10 min以沉淀大分子蛋白质,540 nm处测定上清液的OD值,对照标准曲线求得样品溶液多肽浓度C(mg/mL),进而计算出麦胚样品中的肽含量。以还原型谷胱甘肽为样品制作标准曲线(y=0.0029x,R2=0.9978)。
1.2.4.2 蛋白酶活力测定
参照Harvey等[28]的测定方法,取2 mL麦胚孵育液于15 mL离心管中,加入6 mL pH为6.0,浓度为0.02 mol/L的磷酸氢二钠-柠檬酸缓冲液(5 mmol/L β-巯基乙醇及2.5 mmol/L EDTA配制而成)。冰浴静置10 min,擦干水分后在4 ℃ 4000 r/min下离心30 min,所得上清液即为蛋白酶粗提液。以20 g/L的酪蛋白溶液作为底物,1 mL底物与1 mL粗酶液在40 ℃条件下反应10 min,置于沸水中灭酶5 min,随后加入2 mL 0.4 mol/L三氯乙酸溶液,室温下静置15 min以沉淀剩余的蛋白质。4 ℃ 4000 r/min离心15 min后,取上清液于275 nm波长处测定吸光度,对照标准曲线即可求得麦胚样品中的蛋白酶活力。以酪氨酸为样品制作标准曲线(y=0.0077x,R2=0.9991)。将1 mL麦胚粗酶液催化酪蛋白每分钟产生1 μg酪氨酸定义为1个酶活力单位(U),以反应前加入三氯乙酸溶液的体系为对照。
1.3 数据处理
实验设定3组平行,结果换算成干基质量,实验数据以平均值±标准方差(
¯X ±SD)表示。采用SPSS16.0软件对实验数据进行显著性分析,统计分析采用F检验,P<0.05有显著差异,P<0.01有极显著差异。采用Origin软件进行绘图。2. 结果与分析
2.1 微波功率对麦胚肽含量和蛋白酶活力的影响
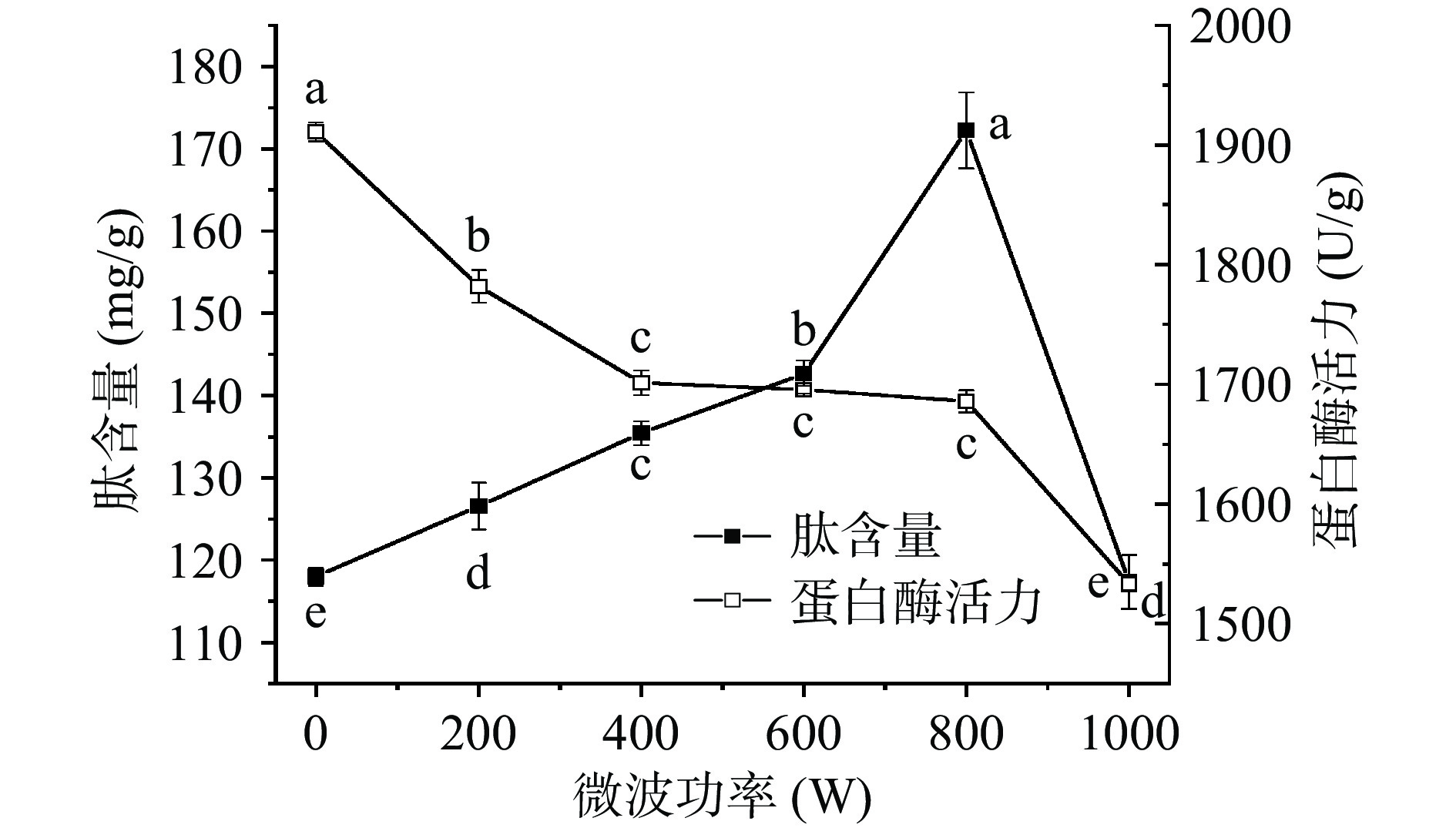
如图1可见,随着微波功率的增加,肽含量呈先上升后下降趋势,0~800 W范围内,肽含量显著上升(P<0.05),800 W时,麦胚中多肽的富集效应最好,肽含量高达172.24 mg/g,是对照的1.46倍,这是因为适当的微波处理可使麦胚蛋白质的结构变得疏松,蛋白质易于溶出形成更多的生物活性物质[12]。继续增大功率,麦胚肽含量下降,这可能是因为麦胚内外温度进一步升高,部分麦胚焦化,蛋白质疏水残基相互作用形成网络结构,使蛋白质溶解度降低,无法形成更多的多肽。0~800 W范围内,微波联合金属离子对麦胚中的肽具有富集作用。与单独使用金属离子相比,二者结合富集麦胚中的肽效果更好。
由图1可见,麦胚蛋白酶活力随微波功率的增加,整体呈下降趋势,微波200 W处理的蛋白酶活力显著低于对照(P<0.05),微波功率400~800 W处理时,蛋白酶活力变化不明显。继续增大微波功率,蛋白酶活力显著降低(P<0.05)。各处理蛋白酶活力均显著低于对照(P<0.05),说明微波处理对蛋白酶活力影响较大。
微波处理使样品内外同时受热,降低了样品中的水分,迅速升高了温度,使酶失活。本研究结果与陈昊等[29]用微波处理脲素酶的研究结果一致,电磁波产生的热效应改变了蛋白质分子结构,破坏了蛋白酶的空间结构,导致蛋白酶活力下降明显。综合实际生产成本及效益考虑,选取微波功率200、400、600、800 W作为正交试验分析的因素水平。
2.2 微波时间对麦胚肽含量和蛋白酶活力的影响
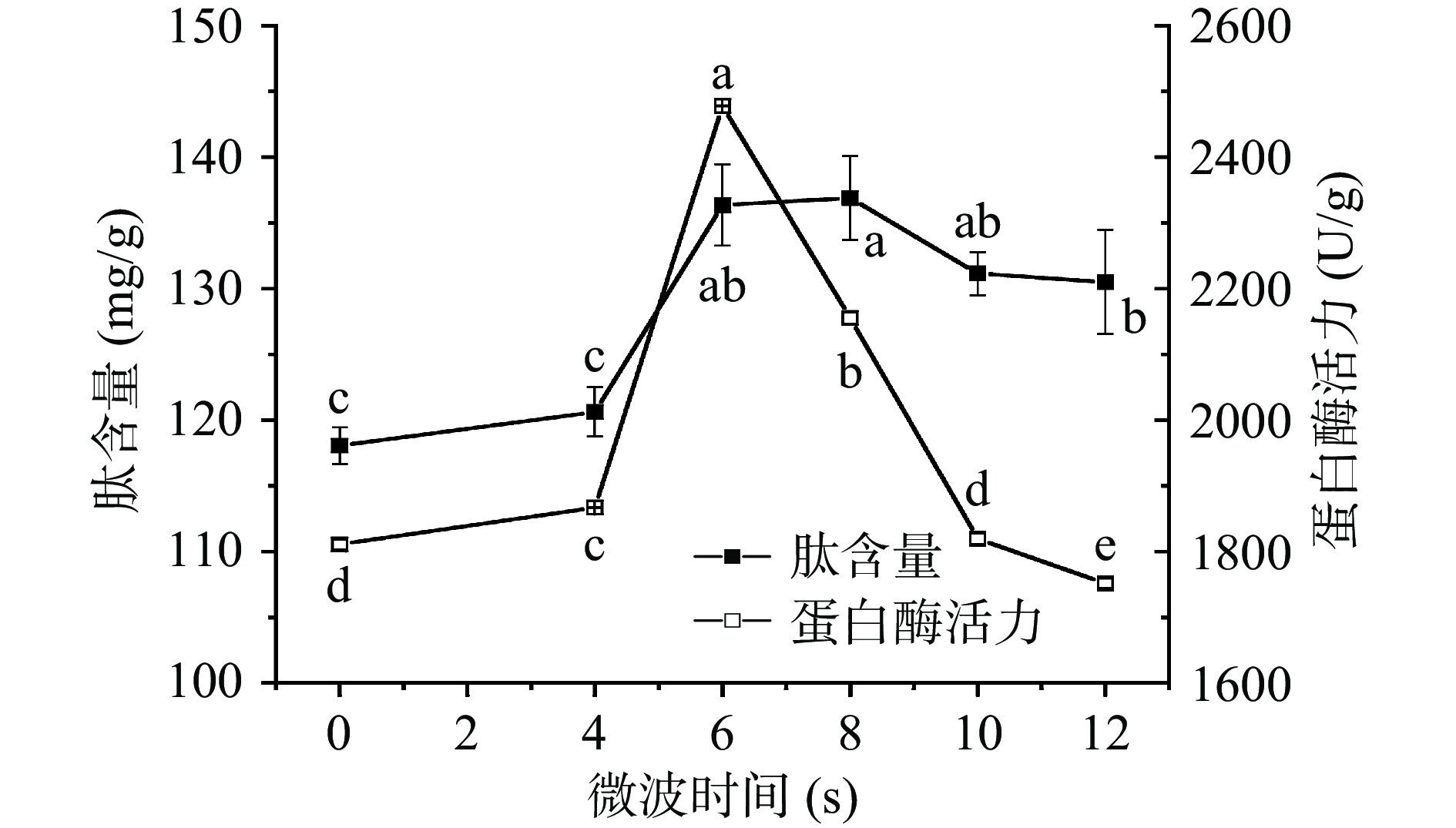
由图2可见,麦胚肽含量随着微波时间的延长呈先上升后下降趋势,微波时间0~4 s时,肽含量变化不明显,4~6 s内显著上升(P<0.05),8 s时肽含量达到最高值(136.9 mg/g)。继续延长微波处理时间至10 s,肽含量有所降低,但仍高于对照。这可能是因为短时的微波处理能显著提高蛋白质的溶解性,产生更多的多肽,而微波时间延长至10 s后麦胚内外部温度升高明显,致使蛋白质变性,影响了水解效果。
随着微波时间的延长,蛋白酶活力整体呈先上升后下降趋势,6 s时达到最大值(2477.92 U/g),继续延长微波处理时间,酶活力显著下降(P<0.05)。微波处理0~10 s范围内与对照相比,蛋白酶活力整体呈上升趋势,说明微波处理能够激活麦胚内源蛋白酶活力。微波处理12 s时相较于对照有所下降,说明蛋白质结构已经被破坏,酶失活。综合实际生产成本及效益考虑,选取微波时间6、8、10、12 s作为正交试验分析的因素水平。
2.3 ZnSO4浓度对麦胚肽含量和蛋白酶活力的影响
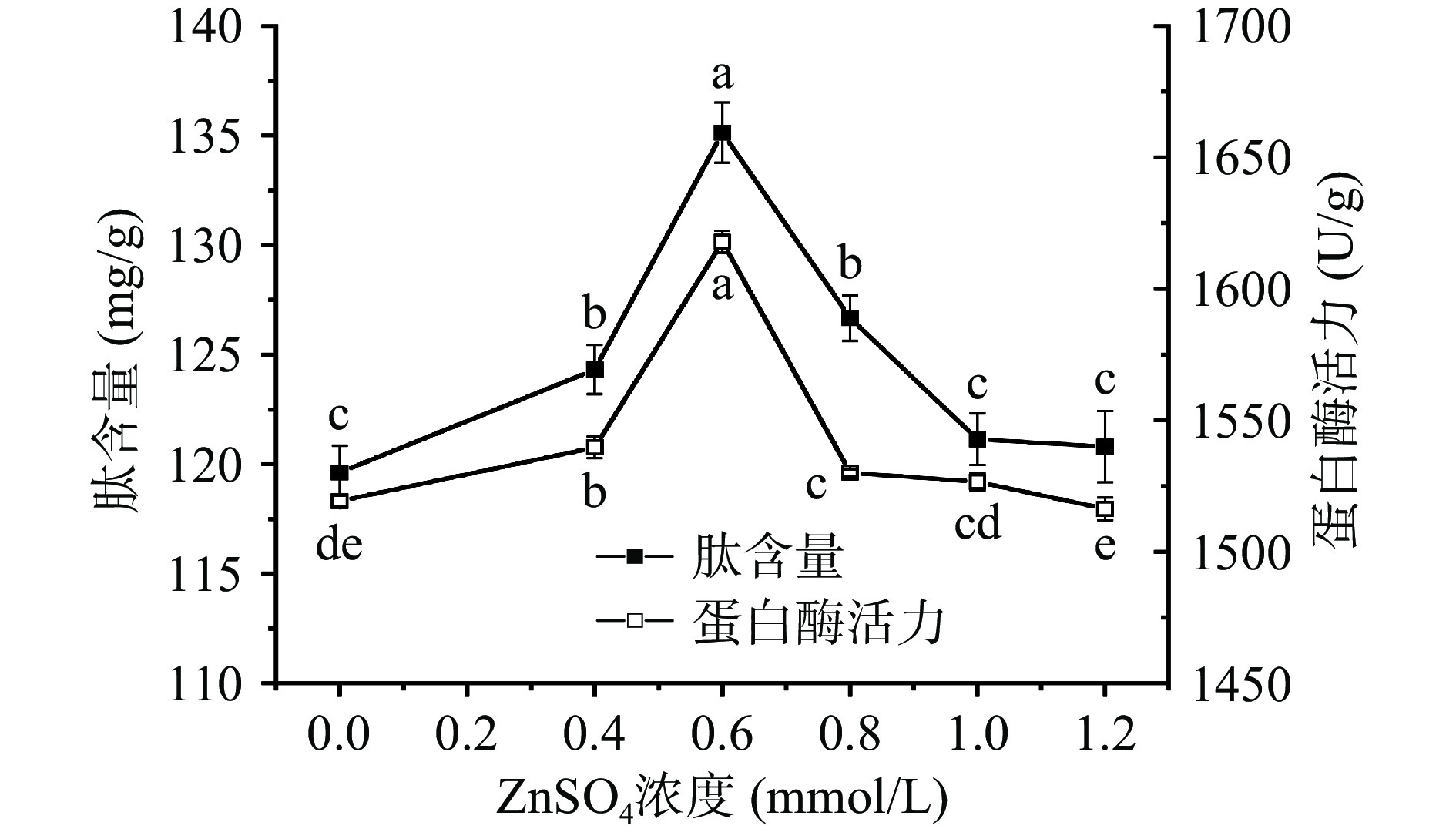
从图3可见,麦胚肽含量随着ZnSO4浓度的增加呈先上升后下降趋势,在浓度为0~0.6 mmol/L时,肽含量显著上升(P<0.05),浓度为0.6 mmol/L时,达到最大值(135.14 mg/g),继续增大ZnSO4浓度,麦胚肽含量显著下降(P<0.05)。在0.4~0.8 mmol/L范围内麦胚肽含量显著高于对照(P<0.05),说明不同的ZnSO4添加量对于富集麦胚的作用效果具有明显差异。ZnSO4浓度对麦胚内源蛋白酶活力的影响整体呈先上升后下降趋势,ZnSO4浓度在0~0.6 mmol/L时显著上升(P<0.05),0.6 mmol/L时蛋白酶活力最高(1617.92 U/g),继续增大ZnSO4浓度,麦胚蛋白酶活力显著下降(P<0.05)。表明适量的添加ZnSO4有利于激活麦胚中的蛋白酶,从而促使其活性提高。有研究表明Zn2+对于部分中性蛋白酶起激活作用,主要是因为该蛋白酶活性部位不含Zn2+,Zn2+能通过疏水键结合、离子相互作用和金属结合等方式提高中性蛋白酶的热稳定性,从而提高中性蛋白酶活性[30-31]。有研究表明,孵育可有效增强酶促反应,提高生物活性物质的含量。因此,由于麦胚中蛋白酶活性的增强,更多蛋白质被水解,表现为肽含量的增加。综合实际生产成本及效益考虑,选取ZnSO4浓度0.4、0.6、0.8、1.0 mmol/L作为正交试验分析的因素水平。
2.4 MnSO4浓度对麦胚肽含量和蛋白酶活力的影响
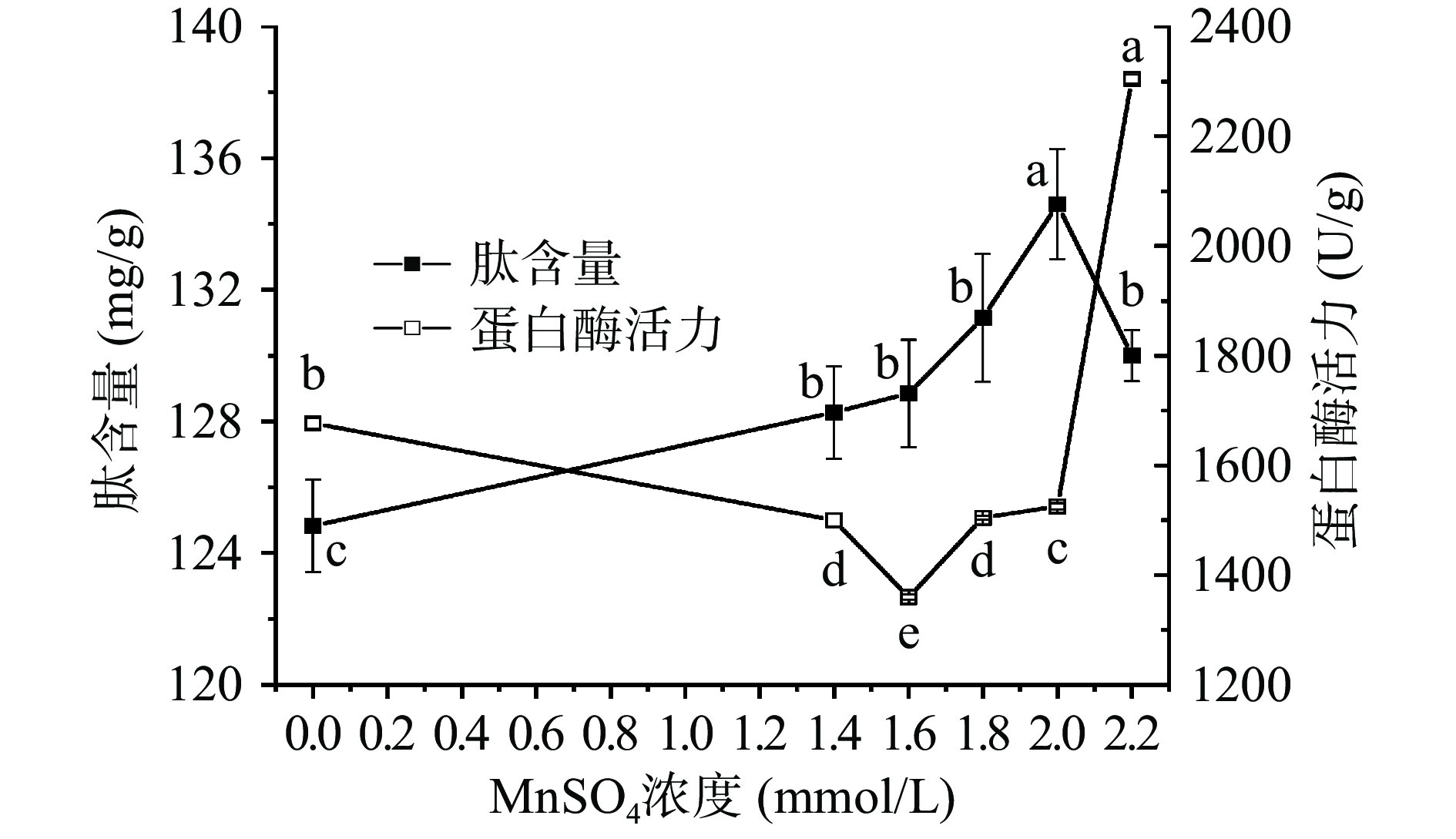
从图4可见,随着MnSO4浓度的增加,麦胚中肽含量呈现先上升后下降趋势,在MnSO4浓度为2.0 mmol/L时,多肽的富集效应达到最优,高达134.60 mg/g,是对照的1.08倍。麦胚蛋白酶活力呈现先下降后上升趋势,MnSO4浓度0~1.6 mmol/L时,蛋白酶活力呈显著下降趋势(P<0.05),在1.6 mmol/L时蛋白酶活力最低(只有1359.58 U/g)。继续增大MnSO4浓度,酶活力显著上升(P<0.05),尤其是浓度为2.2 mmol/L时,酶活力急剧上升。诸多研究表明Mn2+可激活酸性蛋白酶。Lee等[32]在米曲霉LK-101中添加1 mmol/L的Mn2+,发现其酸性蛋白酶相对酶活可高达197%。而杨润强等[33]在研究金属离子对蛋白酶活力的影响时,发现在pH为5.5和7.5时,Mn2+都表现出抑制作用。图4可以看出低浓度的MnSO4可抑制麦胚蛋白酶活力,但肽含量持续增加,高浓度可促进蛋白酶活力,但会影响肽富集效应,适量地添加MnSO4有利于生产更多的生物活性物质。综合实际生产成本及效益考虑,选取MnSO4浓度1.6、1.8、2.0、2.2 mmol/L作为正交试验分析的因素水平。
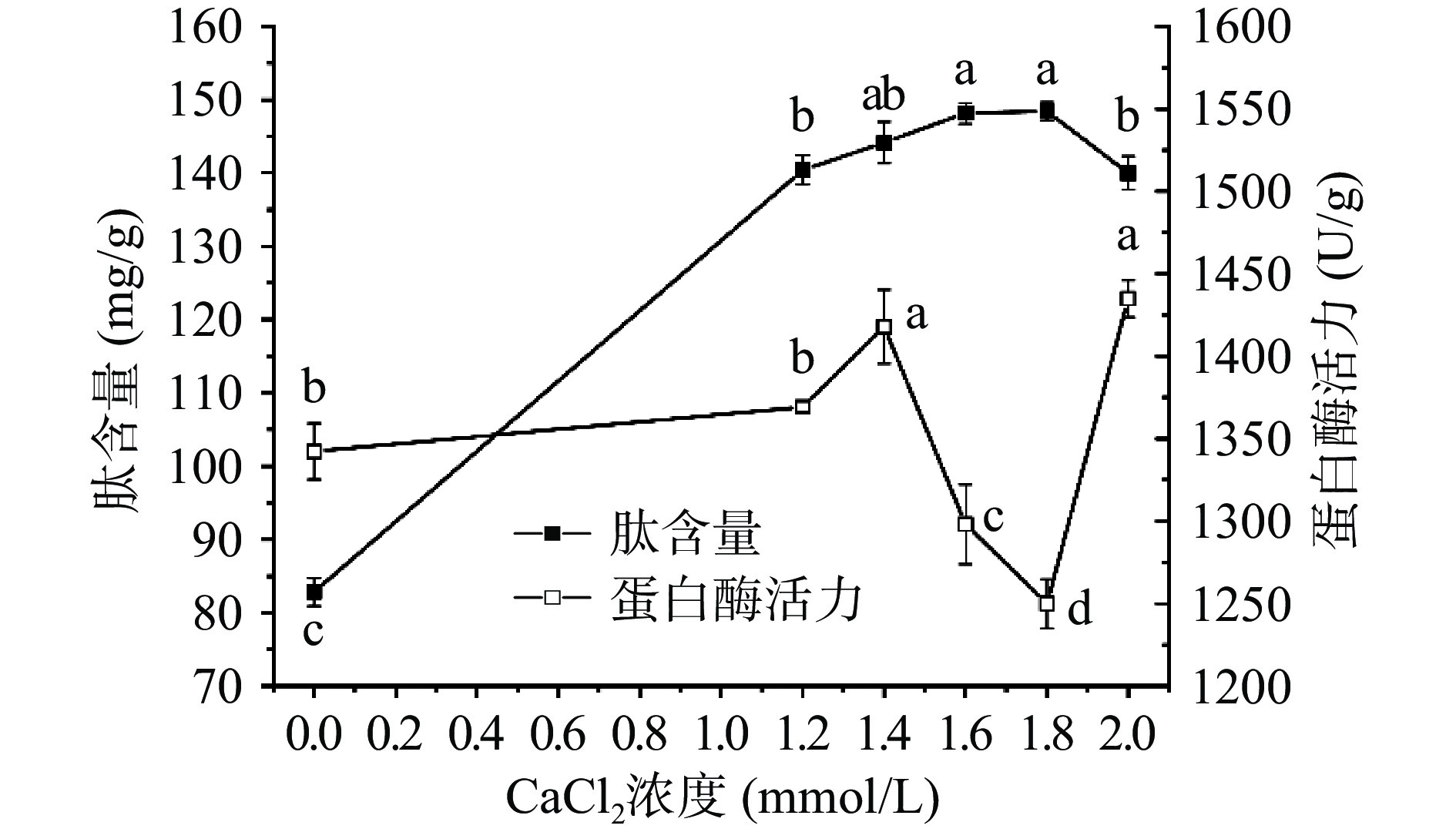
2.5 CaCl2浓度对麦胚肽含量和蛋白酶活力的影响
从图5可见,随着CaCl2浓度的增大,肽含量呈先上升后下降趋势,CaCl2浓度在0~1.8 mmol/L时,肽含量急剧上升,1.8 mmol/L时达到最高值(148.39 mg/g),随后继续增大CaCl2浓度至2.0 mmol/L,肽含量显著下降,但仍显著高于对照,说明添加CaCl2对麦胚肽富集效应有显著促进作用(P<0.05)。蛋白酶活力有CaCl2为1.4、2.0 mmol/L两个显著促进浓度,这与杨润强等[34]的研究结论Ca2+能够显著促进麦胚内源蛋白酶活力一致。蛋白酶活力在CaCl2为1.4 mmol/L之后显著下降(P<0.05),但是肽的生成仍在发生,其原因有待进一步研究。肽含量随着CaCl2浓度增加而动态累积,直到浓度为1.8 mmol/L无明显变化,达到平衡。麦胚中蛋白酶多为中性,有诸多研究表明Ca2+能有效促进中性蛋白酶活力,主要是因为中性蛋白酶往往不耐高温,Ca2+能够维持中性蛋白酶的空间构象,提高其热稳定性,从而提高蛋白酶活性[30]。综合实际生产成本及效益考虑,选取CaCl2浓度1.2、1.4、1.6、1.8 mmol/L作为正交试验分析的因素水平。
2.6 正交试验结果
从表2、表3可见,不同的影响因素对麦胚中肽的富集效应影响程度不同,其重要性依次为ZnSO4浓度>微波时间>MnSO4浓度>CaCl2浓度>微波功率。该5种因素对肽含量的影响均极显著(P<0.01)。由极差法得出最佳工艺条件为A1B3C4D1E4,经验证此组合处理时肽含量为220.56 mg/g,低于正交试验最佳表现7号处理A2B3C4D1E2时的肽含量(228.85 mg/g)。因此,7号处理为最优配方,即微波联合金属离子对麦胚中肽的富集效应影响最优的工艺参数为微波功率400 W,微波时间10 s,ZnSO4浓度1.0 mmol/L,MnSO4浓度1.6 mmol/L,CaCl2浓度1.4 mmol/L。因此,合理优化肽富集过程中这些因素的工艺参数,能够显著提高肽的富集效应。
表 2 L16(45)麦胚肽含量及蛋白酶活力正交试验的设计结果Table 2. L16 (45) design results of orthogonal test of wheat germ peptide content and protease activity试验号 因素 肽含量
(mg/g)蛋白酶活力
(U/g)微波功率
(W)微波时间
(s)ZnSO4浓度
(mmol/L)MnSO4浓度
(mmol/L)CaCl2浓度
(mmol/L)1 1 1 1 1 1 188.62±2.82 2043.29±3.92 2 1 2 2 2 2 190.92±4.05 1880.52±1.70 3 1 3 3 3 3 184.02±4.13 2021.13±5.45 4 1 4 4 4 4 216.21±4.88 1985.80±4.27 5 2 1 2 3 4 194.37±1.63 2044.68±7.96 6 2 2 1 4 3 166.78±2.05 2206.75±1.60 7 2 3 4 1 2 228.85±1.38 2268.40±3.53 8 2 4 3 2 1 170.23±2.45 1846.58±8.54 9 3 1 3 4 2 167.93±0.45 1986.49±6.12 10 3 2 4 3 1 173.68±1.72 1913.07±5.18 11 3 3 1 2 4 192.07±2.82 1998.96±8.03 12 3 4 2 1 3 195.52±1.88 1939.39±2.04 13 4 1 4 2 3 208.16±260 2031.52±4.90 14 4 2 3 1 4 171.38±2.82 1999.65±2.73 15 4 3 2 4 1 174.83±2.82 2181.82±3.75 16 4 4 1 3 2 170.23±1.86 1749.61±8.48 肽含量 ¯K1j 194.94 189.77 179.43 196.09 176.84 最优组合:A1B3C4D1E4 ¯K2j 190.06 175.69 188.91 190.35 189.48 ¯K3j 182.3 194.94 173.39 180.58 188.62 ¯K4j 181.15 188.05 206.73 181.44 193.51 蛋白酶活力 ¯K1j 1982.69 2026.50 1999.65 2062.68 1996.19 最优组合:A2B3C4D4E3 ¯K2j 2091.60 2000.00 2011.60 1939.40 1971.26 ¯K3j 1959.48 2117.58 1963.46 1932.12 2049.70 ¯K4j 1990.65 1880.35 2049.70 2090.22 2007.27 极差R1 13.79 19.25 33.34 15.51 16.67 极差R2 132.12 237.23 86.24 158.10 78.44 表 3 L16(45)肽含量正交试验方差分析Table 3. L16 (45) analysis of variance of orthogonal test for peptide content源 平方和 自由度 均方 F P值 显著性 校正模型 15407.996 15 1027.2 11.33 <0.001 ** 截距 1680524.498 1 1680524.498 18535.362 <0.001 ** 微波功率 1544.539 3 514.846 5.679 0.003 ** 微波时间 2396.704 3 798.901 8.811 <0.001 ** ZnSO4浓度 7622.621 3 2540.874 28.025 <0.001 ** MnSO4浓度 1992.421 3 664.14 7.325 0.001 ** CaCl2浓度 1851.71 3 617.237 6.808 0.001 ** 误差 2901.307 32 90.666 总计 1698833.802 48 校正的总计 18309.303 47 注:**表示差异极显著,P<0.01;*表示差异显著,P<0.05;表4同。 从表2、表4可见,不同的影响因素对麦胚内源蛋白酶活力的影响程度不同。其影响重要性为微波时间>MnSO4浓度>微波功率>ZnSO4浓度>CaCl2浓度。该5种因素对麦胚内源蛋白酶活力的影响均极显著(P<0.01)。由极差法得出最佳工艺条件为A2B3C4D4E3,经验证此条件下蛋白酶活力为2208.98 U/g,低于正交试验7号处理A2B3C4D1E2(2268.40 U/g)。因此,7号处理为最佳处理条件,即激活麦胚内源蛋白酶活力最优工艺参数为微波功率400 W,微波时间10 s,ZnSO4浓度1.0 mmol/L,MnSO4浓度1.6 mmol/L,CaCl2浓度1.4 mmol/L。
表 4 L16(45)蛋白酶活力正交试验方差分析Table 4. L16 (45) analysis of variance of orthogonal test of protease activity源 平方和 自由度 均方 F P值 显著性 校正模型 794035.273 15 52935.685 234.922 <0.001 ** 截距 193173736.4 1 193173736.4 857279.945 <0.001 ** 微波功率 123251.432 3 41083.811 182.325 <0.001 ** 微波时间 344327.235 3 114775.745 509.36 <0.001 ** ZnSO4浓度 45485.012 3 15161.671 67.286 <0.001 ** MnSO4浓度 242398.628 3 80799.543 358.578 <0.001 ** CaCl2浓度 38572.966 3 12857.655 57.061 <0.001 ** 误差 7210.666 32 225.333 总计 193974982.3 48 校正的总计 801245.939 47 3. 结论
微波功率、微波时间、ZnSO4浓度、MnSO4浓度、CaCl2浓度五个因素对麦胚内源蛋白酶活力及肽含量的影响均显著。从肽富集效应来看,其重要性依次为ZnSO4浓度>微波时间>MnSO4浓度>CaCl2浓度>微波功率。从蛋白酶活力来看,其影响重要性依次为微波时间>MnSO4浓度>微波功率>ZnSO4浓度>CaCl2浓度。经过正交优化试验得出麦胚多肽富集效应最优的工艺参数为微波功率400 W,微波时间10 s,ZnSO4浓度1.0 mmol/L,MnSO4浓度1.6 mmol/L,CaCl2浓度1.4 mmol/L。杨润强等[34]通过响应面优化得到最高的麦胚肽含量为88.46 mg/g,本实验经优化后肽含量高达228.85 mg/g,是其2.59倍,而此时蛋白酶活力为2268.40 U/g,同样为最优水平。低功率短时间的微波处理联合适当浓度的Zn2+、Mn2+、Ca2+富集麦胚中肽为麦胚资源的高值化利用提供了一个可行的方法。实验中,麦胚内源蛋白酶活力的变化趋势和肽含量的变化趋势并不完全一致,其具体原因还有待进一步研究。采用生物调控技术激活内源蛋白酶活力,是一种高效的肽富集方法。
-
表 1 L16(45)正交试验因素水平表
Table 1 L16 (45) orthogonal test factors and levels
水平因素 A:
微波功率
(W)B:
微波时间
(s)C:ZnSO4
浓度
(mmol/L)D:MnSO4
浓度
(mmol/L)E:CaCl2
浓度
(mmol/L)1 200 6 0.4 1.6 1.2 2 400 8 0.6 1.8 1.4 3 600 10 0.8 2.0 1.6 4 800 12 1.0 2.2 1.8 表 2 L16(45)麦胚肽含量及蛋白酶活力正交试验的设计结果
Table 2 L16 (45) design results of orthogonal test of wheat germ peptide content and protease activity
试验号 因素 肽含量
(mg/g)蛋白酶活力
(U/g)微波功率
(W)微波时间
(s)ZnSO4浓度
(mmol/L)MnSO4浓度
(mmol/L)CaCl2浓度
(mmol/L)1 1 1 1 1 1 188.62±2.82 2043.29±3.92 2 1 2 2 2 2 190.92±4.05 1880.52±1.70 3 1 3 3 3 3 184.02±4.13 2021.13±5.45 4 1 4 4 4 4 216.21±4.88 1985.80±4.27 5 2 1 2 3 4 194.37±1.63 2044.68±7.96 6 2 2 1 4 3 166.78±2.05 2206.75±1.60 7 2 3 4 1 2 228.85±1.38 2268.40±3.53 8 2 4 3 2 1 170.23±2.45 1846.58±8.54 9 3 1 3 4 2 167.93±0.45 1986.49±6.12 10 3 2 4 3 1 173.68±1.72 1913.07±5.18 11 3 3 1 2 4 192.07±2.82 1998.96±8.03 12 3 4 2 1 3 195.52±1.88 1939.39±2.04 13 4 1 4 2 3 208.16±260 2031.52±4.90 14 4 2 3 1 4 171.38±2.82 1999.65±2.73 15 4 3 2 4 1 174.83±2.82 2181.82±3.75 16 4 4 1 3 2 170.23±1.86 1749.61±8.48 肽含量 ¯K1j 194.94 189.77 179.43 196.09 176.84 最优组合:A1B3C4D1E4 ¯K2j 190.06 175.69 188.91 190.35 189.48 ¯K3j 182.3 194.94 173.39 180.58 188.62 ¯K4j 181.15 188.05 206.73 181.44 193.51 蛋白酶活力 ¯K1j 1982.69 2026.50 1999.65 2062.68 1996.19 最优组合:A2B3C4D4E3 ¯K2j 2091.60 2000.00 2011.60 1939.40 1971.26 ¯K3j 1959.48 2117.58 1963.46 1932.12 2049.70 ¯K4j 1990.65 1880.35 2049.70 2090.22 2007.27 极差R1 13.79 19.25 33.34 15.51 16.67 极差R2 132.12 237.23 86.24 158.10 78.44 表 3 L16(45)肽含量正交试验方差分析
Table 3 L16 (45) analysis of variance of orthogonal test for peptide content
源 平方和 自由度 均方 F P值 显著性 校正模型 15407.996 15 1027.2 11.33 <0.001 ** 截距 1680524.498 1 1680524.498 18535.362 <0.001 ** 微波功率 1544.539 3 514.846 5.679 0.003 ** 微波时间 2396.704 3 798.901 8.811 <0.001 ** ZnSO4浓度 7622.621 3 2540.874 28.025 <0.001 ** MnSO4浓度 1992.421 3 664.14 7.325 0.001 ** CaCl2浓度 1851.71 3 617.237 6.808 0.001 ** 误差 2901.307 32 90.666 总计 1698833.802 48 校正的总计 18309.303 47 注:**表示差异极显著,P<0.01;*表示差异显著,P<0.05;表4同。 表 4 L16(45)蛋白酶活力正交试验方差分析
Table 4 L16 (45) analysis of variance of orthogonal test of protease activity
源 平方和 自由度 均方 F P值 显著性 校正模型 794035.273 15 52935.685 234.922 <0.001 ** 截距 193173736.4 1 193173736.4 857279.945 <0.001 ** 微波功率 123251.432 3 41083.811 182.325 <0.001 ** 微波时间 344327.235 3 114775.745 509.36 <0.001 ** ZnSO4浓度 45485.012 3 15161.671 67.286 <0.001 ** MnSO4浓度 242398.628 3 80799.543 358.578 <0.001 ** CaCl2浓度 38572.966 3 12857.655 57.061 <0.001 ** 误差 7210.666 32 225.333 总计 193974982.3 48 校正的总计 801245.939 47 -
[1] BAYAT E, MOOSAVI-NASAB M, FAZAELI M, et al. Wheat germ fermentation with saccharomyces cerevisiae and lactobacillus plantarum: Process optimization for enhanced composition and antioxidant properties in vitro[J]. Foods,2022,11(8):1125. doi: 10.3390/foods11081125
[2] SULLIVAN B, BAILEY C. Additions and corrections-the lipids of the wheat embryo. I. the fatty acids[J]. Journal of the American Chemical Society,1936,58(3):383−390. doi: 10.1021/ja01294a001
[3] 胡莉丽. 麦胚清蛋白的酶法水解及其产物的抗氧化性研究[D]. 合肥: 合肥工业大学, 2017. HU Lili. Proteolysis of wheat germ albumin and antioxidant activity of the hydrolysate[D]. Hefei: Hefei University of Technology, 2017.
[4] BOUKID F, FOLLONI S, RANIERI R, et al. A compendium of wheat germ: Separation, stabilization and food applications[J]. Trends in Food Science & Technology,2018,78:120−133.
[5] 黄继红, 陈文静, 廖爱美, 等. 麦胚活性成分研究进展[J]. 河南工业大学学报(自然科学版),2021,42(1):114−123. [HUANG Jihong, CHEN Wenjing, LIAO Aimei, et al. Review on active components of wheat-embryo[J]. Journal of Henan University of Technology (Natural Science Edition),2021,42(1):114−123. [6] 丁媛媛, 王莉, 张新霞, 等. 麦胚多肽-钙螯合物制备工艺优化及其结构表征[J]. 食品科学,2017,38(10):215−221. [DING Yuanyuan, WANG Li, ZHANG Xinxia, et al. Optimized preparation and structural characterization of calcium-chelating polypeptides from wheat germ protein hydrolysate[J]. Food Science,2017,38(10):215−221. doi: 10.7506/spkx1002-6630-201710036 [7] DOMINIC A, ISHTIAQ A, ZAIN A, et al. Protein and peptide biopharmaceuticals: An overview[J]. Protein and Peptide Letters,2017,24(2):94−101. doi: 10.2174/0929866523666161222150444
[8] 王淑芳. 麦胚蛋白酶特性与ACE抑制肽制备及其面包研制[D]. 南京: 南京农业大学, 2015. WANG Shufang. Protease properties and ACE inhibitory peptide perparation from wheat germ and development of brend[D]. Nanjing: Nanjing Agricultural University, 2015.
[9] 林梦君, 宋晓艳, 韩江升, 等. 生物活性多肽产品开发及应用进展[J]. 山东化工,2020,49(20):42−43. [LIN Mengjun, SONG Xiaoyan, HAN Jiangsheng, et al. Research and application of bioactive peptides[J]. Shandong Chemical Industry,2020,49(20):42−43. doi: 10.3969/j.issn.1008-021X.2020.20.016 [10] ZHANG Y, HE S D, BONNEIL É, et al. Generation of antioxidative peptides from atlantic sea cucumber using alcalase versus trypsin: In vitro activity, de novo sequencing, and in silico docking for in vivo function prediction[J]. Food Chemistry,2020,306(C):125581.
[11] KARAMI Z, PEIGHAMBARDOUST S H, HESARI J, et al. Antioxidant, anticancer and ACE-inhibitory activities of bioactive peptides from wheat germ protein hydrolysates[J]. Food Bioscience,2019,32(C):100450.
[12] 李永恒, 田双起, 赵仁勇. 麦胚多肽的制备及生物活性的研究进展[J]. 食品工业,2018,39(5):266−270. [LI Yongheng, TIAN Shuangqi, ZHAO Renyong. Advances in studies on preparation and bioactivity of wheat germ peptides[J]. Food Industry,2018,39(5):266−270. [13] 张瑶, 沈海炯, 杨天一, 等. 培育条件对麦胚中蛋白酶活力及蛋白质性质的影响[J]. 食品工业科技,2022,43(11):192−199. [ZHANG Yao, SHEN Haijiong, YANG Tianyi, et al. Effect of incubation conditions on the protease activity and protein property of wheat germ[J]. Science and Technology of Food Industry,2022,43(11):192−199. doi: 10.13386/j.issn1002-0306.2021090168 [14] 朱海峰, 班玉凤, 周克仲. 大豆蛋白水解液脱苦的研究[J]. 广州食品工业科技,2004(1):32−35. [ZHU Haifeng, BAN Yufeng, ZHOU Kezhong. Study on debittering of soybean protein hydrolyzate[J]. Guangzhou Food Science and Technology,2004(1):32−35. doi: 10.3969/j.issn.1673-9078.2004.01.012 [15] 李子健, 刘秀丽, 裴乐, 等. 生物活性肽的研究进展[J]. 畜牧与饲料科学,2019,40(12):20−24. [LI Zijian, LIU Xiuli, PEI Le, etal. Research progress on bioactive peptides[J]. Animal Husbandry and Feed Science,2019,40(12):20−24. doi: 10.12160/j.issn.1672-5190.2019.12.005 [16] 崔新明. 麦胚贮藏与孵育特性及其营养粉开发研究[D]. 南京: 南京农业大学, 2012. CUI Xinming. Storage and incubation properties of wheat germ and the development of its nutritional powder[D]. Nanjing: Nanjing Agricultural University, 2012.
[17] 余南静, 杨润强, 曹晓虹, 等. 孵育液组分对麦胚蛋白酶活力与ACE抑制率的影响[J]. 中国粮油学报,2011,26(12):11−15. [YU Nanjing, YANG Runqiang, CAO Xiaohong, et al. Effect of incubation medium on protease activity and angiotensin I-converting enzyme inhibitory activity of incubated wheat germ[J]. Journal of the Chinese Cereals and Oils Association,2011,26(12):11−15. [18] 黄纪民, 李秉正, 师德强, 等. 微波技术在农产品加工领域的应用研究进展[J]. 广西科学院学报,2020,36(3):293−299. [HUANG Jimin, LI Bingzheng, SHI Deqiang, et al. Application of microwave technology in processing of agro-products: A review[J]. Journal of Guangxi Academy of Sciences,2020,36(3):293−299. [19] HU A J, CHEN X L, WANG J, et al. Effects on the structure and properties of native corn starch modified by enzymatic debranching (ED), microwave assisted esterification with citric acid (MCAE) and by the dual ED/MCAE treatment[J]. International Journal of Biological Macromolecules,2021,171:123−129. doi: 10.1016/j.ijbiomac.2021.01.012
[20] URBIZO-REYES U, MARTIN-GONZALEZ MF S, GARCIA-BRAVO J, et al. Physicochemical characteristics of chia seed (Salvia hispanica) protein hydrolysates produced using ultrasonication followed by microwave-assisted hydrolysis[J]. Food Hydrocolloids,2019,97:105187. doi: 10.1016/j.foodhyd.2019.105187
[21] MERILES S P, PENCI M C, CURET S, et al. Effect of microwave and hot air treatment on enzyme activity, oil fraction quality and antioxidant activity of wheat germ[J]. Food Chemistry,2022,386:132760. doi: 10.1016/j.foodchem.2022.132760
[22] 郑丽娜, 辛嘉英, 王艳, 等. 微波对酶催化反应的影响及其微波效应的研究进展[J]. 分子催化,2017,31(6):567−574. [ZHENG Lina, XIN Jiaying, WANG Yan, et al. Research progress on the influence of microwave on enzyme-catalyzed reactions and the microwave effect[J]. Journal of Molecular Catalysis (Chint),2017,31(6):567−574. [23] 胡蕾琪, 郭长凯, 潘志海, 等. 微波场对食品的非热效应研究进展[J]. 食品与发酵工业,2020,46(16):270−275. [HU Leiqi, GUO Changkai, PAN Zhihai, et al. Research progress of non-thermal effects of microwave fields on food[J]. Food and Fermentation Industries,2020,46(16):270−275. [24] CAO H W, FAN D M, JIAO X D, et al. Intervention of transglutaminase in surimi gel under microwave irradiation[Z]. 2018: 268: 378−385.
[25] TIAN S Q, DU K, YAN F, et al. Microwave-assisted enzymatic hydrolysis of wheat germ albumin to prepare polypeptides and influence on physical and chemical properties[J]. Food Chemistry,2022,374:131707. doi: 10.1016/j.foodchem.2021.131707
[26] ZHANG Y K, TANG N, SHI L, et al. Characterization and comparison of predominant aroma compounds in microwave-treated wheat germ and evaluation of microwave radiation on stability[J]. Journal of Cereal Science,2020,93:102942. doi: 10.1016/j.jcs.2020.102942
[27] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005(7):169−171. [LU Wei, REN Guopu, SONG Junmei. Determination of content of peptidesin protein hydrolysates[J]. Food Science,2005(7):169−171. doi: 10.3321/j.issn:1002-6630.2005.07.039 [28] HARVEY B M, OAKS A. Characteristics of an acid protease from maize endosperm[J]. Plant Physiology,1974,53(3):449−452. doi: 10.1104/pp.53.3.449
[29] 陈昊, 李婷婷, 王嘉熙, 等. 热加工对豆乳蛋白质溶解性和脲素酶活性的影响[J]. 食品工业科技,2017,38(13):90−94. [CHEN Hao, LI Tingting, WANG Jiaxi, et al. Effect of different heating process on the protein solubility and urease activity of proteins in soymilk[J]. Science and Technology of Food Industry,2017,38(13):90−94. [30] 余茜, 张国丽, 敖晓琳. 金属离子对微生物蛋白酶活性的影响及机理[J]. 中国食品学报,2019,19(4):287−294. [YU Qian, ZHANG Guoli, AO Xiaolin. Effect and mechanism of metal Ions on the activity of microbial protease[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(4):287−294. [31] ROSSMANN M G, BLOW D M. The detection of sub-units within the crystallographic asymmetric unit[J]. Acta Cryst,1962,15:24−31. doi: 10.1107/S0365110X62000067
[32] LEE S K, HWANG J Y, CHOI S H, et al. Purification and characterization of Aspergillus oryzae LK-101 salt-tolerant acid protease isolated from soybean paste[J]. Food Science and Biotechnology,2010,19(2):327−334. doi: 10.1007/s10068-010-0047-5
[33] 杨润强, 王淑芳, 顾振新. 麦胚内源蛋白酶主要特性研究[J]. 中国粮油学报,2015,30(9):1−5. [YANG Runqiang, WANG Shufang, GU Zhenxin. Main properties of wheat germ endogenous protease[J]. Journal of the Chinese Cereals and Oils Association,2015,30(9):1−5. doi: 10.3969/j.issn.1003-0174.2015.09.001 [34] 杨润强, 龚小峰, 顾振新, 等. 孵育法富集麦胚多肽工艺参数优化[J]. 食品科学,2010,31(14):22−25. [YANG Runqiang, GONG Xiaofeng, GU Zhenxin, et al. Optimization of incubation conditions for polypeptide-enriched wheat germ[J]. Food Science,2010,31(14):22−25.





 下载:
下载:

 下载:
下载:



