Biofilm Forming Ability and Influencing Factors of Vibrio vulnificus
-
摘要: 研究26株创伤弧菌(Vibrio vulnificus,Vv)产生物被膜情况及影响生物被膜形成的因素,为有效控制创伤弧菌形成生物被膜提供理论依据。本研究采用刚果红平板法、改良试管法及改良微孔板法分析25株创伤弧菌分离株及1株标准菌株形成生物被膜的能力,从中选出一株产膜能力最强的菌株,并研究不同初始菌浓度、温度及时间、pH、NaCl浓度、金属阳离子以及接触材料对其生物被膜形成的影响。结果显示,所选菌株中具有生物被膜形成能力的有25株(96.15%)。其中菌株VvK产膜能力最强,在25 ℃条件下,初始菌浓度为108 CFU/mL,含3% NaCl、pH8~9培养24 h时,生物被膜形成量最大。而添加一定浓度的金属阳离子(Cu2+、Mn2+、Ca2+、Mg2+)后,生物被膜的形成受到不同程度的抑制,其抑制能力依次降低。菌株VvK在接触亲水性表面(不锈钢和玻璃)时生物被膜形成量显著高于疏水性表面(聚苯乙烯),且在不锈钢表面形成量最大。不同创伤弧菌生物被膜形成能力具有较大的差异,且在不同培养条件下具有特定的规律,需引起重点关注。Abstract: The biofilm produced by 26 strains of Vibrio vulnificus (Vv) and the factors affecting biofilm formation were studied to provide theoretical basis for effective control of biofilm formation by Vv. In this study, Congo red plate method, improved test tube method and improved microplate method were used to analyze the ability of 25 isolated Vv strains and 1 standard strain to form biofilm, and one strain with the strongest ability to produce biofilm was selected from them. The effects of different initial bacterial concentration, temperature, culture time, pH, NaCl concentration, metal cations and contact materials on the formation of biofilm were investigated. The results showed that 25 strains (96.15%) had biofilm forming ability among the selected strains and VvK had the strongest ability to produce biofilm. At 25 ℃, the initial bacterial concentration was 108 CFU/mL, 3% NaCl and pH8~9 for 24 h, the biofilm quantity was the largest. However, the formation of biofilm was inhibited by certain concentration of metal cations (Cu2+, Mn2+, Ca2+, Mg2+) definitely, and the inhibition ability of above cations decreases in turn. When VvK contacted hydrophilic surfaces (stainless steel and glass), the amount of biofilm formation was significantly higher than hydrophobic surfaces (polystyrene), and the amount of biofilm formation on stainless steel was the largest. The biofilm forming ability of different Vv was quite different, and had specific rules under different cultivation conditions, which should be paid more attention.
-
Keywords:
- Vibrio vulnificus /
- biofilm /
- culture conditions /
- influence factor /
- film production capacity
-
创伤弧菌(Vibrio vulnificus,Vv)是一种高度致命的、机会性的人类病原体,普遍存在于海洋沿海水域[1]。感染发生在摄入生的或者未煮熟的海鲜、或伤口暴露在含有创伤弧菌的海水中[2]。创伤弧菌为革兰氏阴性嗜盐菌,可导致健康人发生严重的胃肠道疾病和原发性败血症[3]。在血清铁含量升高或免疫功能低下的个体中,原发性败血症是最致命的感染,死亡率超过了50%,与败血症的情况一样,这些潜在疾病增加了伤口感染率,伤口感染可迅速发展为大泡和坏死性筋膜炎[4-5]。感染的潜在机制尚未得到广泛研究,也没有研究表明该病原体形成的生物被膜在人类宿主定植或海洋环境中发挥重要作用,因此本文对影响该病原体形成生物被膜的因素进行初步研究,为创伤弧菌生物被膜的研究提供理论依据。
生物被膜(Biofilm,BF)可以附着在活的和非活的表面上,如肺组织、心脏瓣膜、骨骼、牙齿、聚乙烯、玻璃和各种医疗设备,一旦生物被膜形成,就很难消除[6]。生物被膜的形成被认为是微生物群落的一种选择性生存策略,以保护其免受氧自由基、消毒剂、pH变化、低营养物质和抗生素的影响[7]。生物被膜还可以促进单个细胞之间的通信(即群体感应)[8]。大多数(80%)的细菌性病原体可形成生物被膜,而生物被膜与大量严重的慢性感染病有关,开发针对生物被膜的抗生物被膜疗法是当今医学上最具挑战性的任务之一[9]。生物被膜中的病原体对人类宿主防御和抗菌治疗的清除表现出更多的抗性,因为它们受到作为扩散屏障的生物被膜基质的保护[10]。浮游细菌对抗生素的敏感性是生物被膜包裹菌的1000倍[11]。
目前,创伤弧菌生物被膜的形成在临床环境和海洋环境中很少受到关注,相关数据也较少,相反,对于创伤弧菌生物被膜的研究主要集中在生物被膜所必需的蛋白质和基因的鉴定发展上,而不是影响生物被膜形成的环境条件[12]。因此,本研究用刚果红平板法、改良试管法及改良微孔板法比较分析不同创伤弧菌形成生物被膜的能力;选出产膜能力最强的菌株,并研究其在不同的培养条件下产膜的趋势。
1. 材料与方法
1.1 材料与仪器
创伤弧菌标准菌株Vibrio vμlnificus CICC21615(VvCICC21615) 购于中国微生物菌种保藏中心,−80 ℃保藏;25株创伤弧菌菌株(Vv Y5、Vv A,Vv Bq,Vv Bs,Vv Cs,Vv Cq,Vv Ds,Vv Dq,Vv Eq,Vv Ej,Vv Es,Vv F,Vv Gq,Vv Gs,Vv Hs,Vv Hq,Vv Jq,Vv Js,VvK,VvKj,Vv hun、Vv 18s,Vv 26,Vv 52,Vv 61) 均由本实验室分离,并于−80 ℃保藏。硫柠胆蔗琼脂培养基(TCBS)、3% NaCl碱性蛋白胨水、营养肉汤、脑心浸液干粉(BHI) 上海市浦东新区疾病预防控制中心;刚果红、琼脂、NaCl、结晶紫、甲醇、95%乙醇、硫酸铜、硫酸镁、氯化锰、氯化钙 均为分析纯;Corning96孔细胞培养板、24孔细胞培养板 国药集团化学试剂(上海)有限公司;不锈钢圆片(直径14 mm)、玻璃圆片(直径14 mm) 江苏海门三和实验器材总厂。
AC2-S生物安全柜 苏净集团安泰公司;AL204电子天平 上海精密仪器有限公司;GHP-9 270隔水式恒温培养箱、THZ-300恒温培养摇床 上海一恒仪器有限公司;CORONASH-1000型酶标仪 广州济恒医药科技有限公司;pH730台式pH测试仪 德国WTW;TGL-16G高速离心机 上海安亭仪器厂。
1.2 实验方法
1.2.1 菌株活化及菌悬液制备
将−80 ℃保存管中的实验菌株转接至营养肉汤培养液中,转接活化2~3次。取一环菌液于TCBS平板上四区划线过夜培养,挑取单菌落于5 mL 3% NaCl碱性蛋白胨水培养基中37 ℃、150 r/min振荡培养18~20 h,将培养物转移至5 mL无菌离心管中,10000 r/min离心4 min,弃去上清液,用0.85%的无菌生理盐水将菌液浓度调为0.5麦氏浓度(约108 CFU/mL),备用[13]。
1.2.2 生物被膜的定性测定
1.2.2.1 刚果红平板法
刚果红平板配制:A液:称取1.2 g刚果红溶于15 mL蒸馏水中;B液:称取脑心浸液干粉(BHI)55.5 g、琼脂30 g、蔗糖75 g溶于1500 mL蒸馏水中,将pH调至中性。A、B液均经过121 ℃高压灭菌20 min,待A、B液冷却至50~60 ℃后混匀,然后倾注平皿,每个培养皿倾注20 mL左右,冷却凝固备用。
接种:取一环菌悬液划线接种至配制好的刚果红平板上,37 ℃培养24 h后,取出放室温1~3 d,观察菌落形态及变化,若菌落为黑色或暗黑色且呈晶体状则定义为PIA(多糖细胞间黏附素)阳性菌株,即产膜菌株(+),若呈现红色光滑菌落则被视为PIA阴性菌株,即不产膜菌株(−),每个实验做两个平行[14]。
1.2.2.2 改良试管法
参考Kunwar等[15]试管法,在此基础上做些改良:取2 mL 3% NaCl碱性蛋白胨水于无菌玻璃试管中(12 mm×100 mm),密封、灭菌,取20 μL制备好的菌悬液加入已灭菌培养基中,混匀,37 ℃、24 h静态培养后轻轻倒出试管中的培养液,用2% NaCl溶液清洗2~3次,晾干后加入2 mL 0.2%结晶紫染色液,染色5~10 min,移除染色液,无需清洗,倒置、室温隔夜干燥后判读结果,每个实验设2次平行,不加菌液的培养基作为空白对照。当试管内表面出现染料粘附层时,则认为测试菌株是阳性的。
1.2.3 生物被膜的定量测定
在参考Srdjan等[16]结晶紫染色法基础上进行适当改良:在无菌条件下,将菌悬液与3% NaCl碱性蛋白胨水培养液按1:9比例混匀,取200 μL分别加入96孔板中,每组重复六孔,并以无菌3% NaCl碱性蛋白胨水培养液作为空白对照,37 ℃静置培养24 h后,移除孔中的培养液,加入200 μL 2% NaCl溶液清洗3次,加入200 μL甲醇固定15 min,清空之后放进60 ℃烘箱中干燥固定30 min,加200 μL 0.2%结晶紫染色液染色30~40 min,移除染色液并用2% NaCl溶液冲洗掉未结合的染料,在60 ℃干燥条件下放置10 min,加入200 μL 95%乙醇溶解,待结晶紫完全溶解后用酶标仪测定OD570nm值,比较不同创伤弧菌菌株的成膜情况。
参照Christensen等[17]的标准可将各菌株被膜形成强弱程度按其OD值进行分类:将空白对照的平均值加上其3倍标准差定义为界定值(ODC),其中OD≤ODC为无粘附(−),ODC<OD≤2ODC为弱粘附(+),2ODC<OD≤4ODC为中等粘附(++),OD>4ODC为强粘附(+++)。
1.2.4 不同培养条件对生物被膜形成的影响
在筛选出产生物被膜创伤弧菌菌株中,挑取被膜形成能力最强的菌株进行不同培养条件下生物被膜形成情况的探索。
1.2.4.1 初始菌浓度对生物被膜形成的影响
分别配制初始浓度为108、107、106、105、104、103、102、101 CFU/mL的菌悬液,其余条件控制不变,按照1.2.3的方法进行实验,比较不同初始菌浓度对生物被膜形成的影响。
1.2.4.2 NaCl浓度对生物被膜形成的影响
分别配制不同含量(1.00%、2.00%、3.00%、4.00%、5.00%、6.00%、7.00%、8.00%、9.00%、10.00%)的NaCl碱性蛋白胨水培养液,其余条件控制不变,按照1.2.3的方法进行实验,比较不同NaCl含量对生物被膜形成的影响。
1.2.4.3 不同pH对生物被膜形成的影响
分别配制不同pH(3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00、11.00、12.00)的3% NaCl碱性蛋白胨水培养液,其余条件控制不变,按照1.2.3的方法测定,比较不同pH对生物被膜形成的影响。
1.2.4.4 培养时间及温度对生物被膜形成的影响
选择不同的培养时间(4、8、16、24、36、48、60、72 h),其余条件控制不变,按照1.3.3的方法分别在不同的温度下(4、25、37、42 ℃)测定生物被膜形成趋势的变化。
1.2.4.5 金属阳离子对生物被膜形成的影响
分别配制含不同浓度Mn2+、Cu2+、Ca2+、Mg2+(0%、0.25%、0.5%、0.75%、1%、1.25%)的3% NaCl碱性蛋白胨水培养基,其余条件控制不变,按照1.2.3的方法测定,比较不同浓度金属阳离子对生物被膜形成情况的影响。
1.2.4.6 不同接触材料对生物被膜形成的影响
将菌悬液与3% NaCl碱性蛋白胨水培养液按1:10比例混匀后,每孔1 mL加入底部放有不同材料(经灭菌处理的不锈钢圆片和玻璃圆片)的24孔板及底部自身为聚苯乙烯(PS)材料的24孔板中,每组重复六个孔,在37 ℃条件下培养24 h后,移除培养物,用2% NaCl溶液清洗3次,加入1 mL甲醇固定15 min后清空,放入60 ℃干燥箱中干燥固定30 min,加入1 mL 0.2%结晶紫染色液染色30 min,用2% NaCl溶液清洗掉未结合的染色液,60 ℃干燥10 min后,每孔加入1 mL95%乙醇,待结晶紫完全溶解后每孔吸取200 μL于96孔板中,用酶标仪测定OD570nm值[18]。
1.3 数据处理
实验数据采用SPSS23.0软件进行统计学分析,结果用平均值±标准差表示,P<0.05表明有显著性差异;采用Origin2019软件进行作图。
2. 结果与分析
2.1 创伤弧菌生物被膜形成能力的定性测定
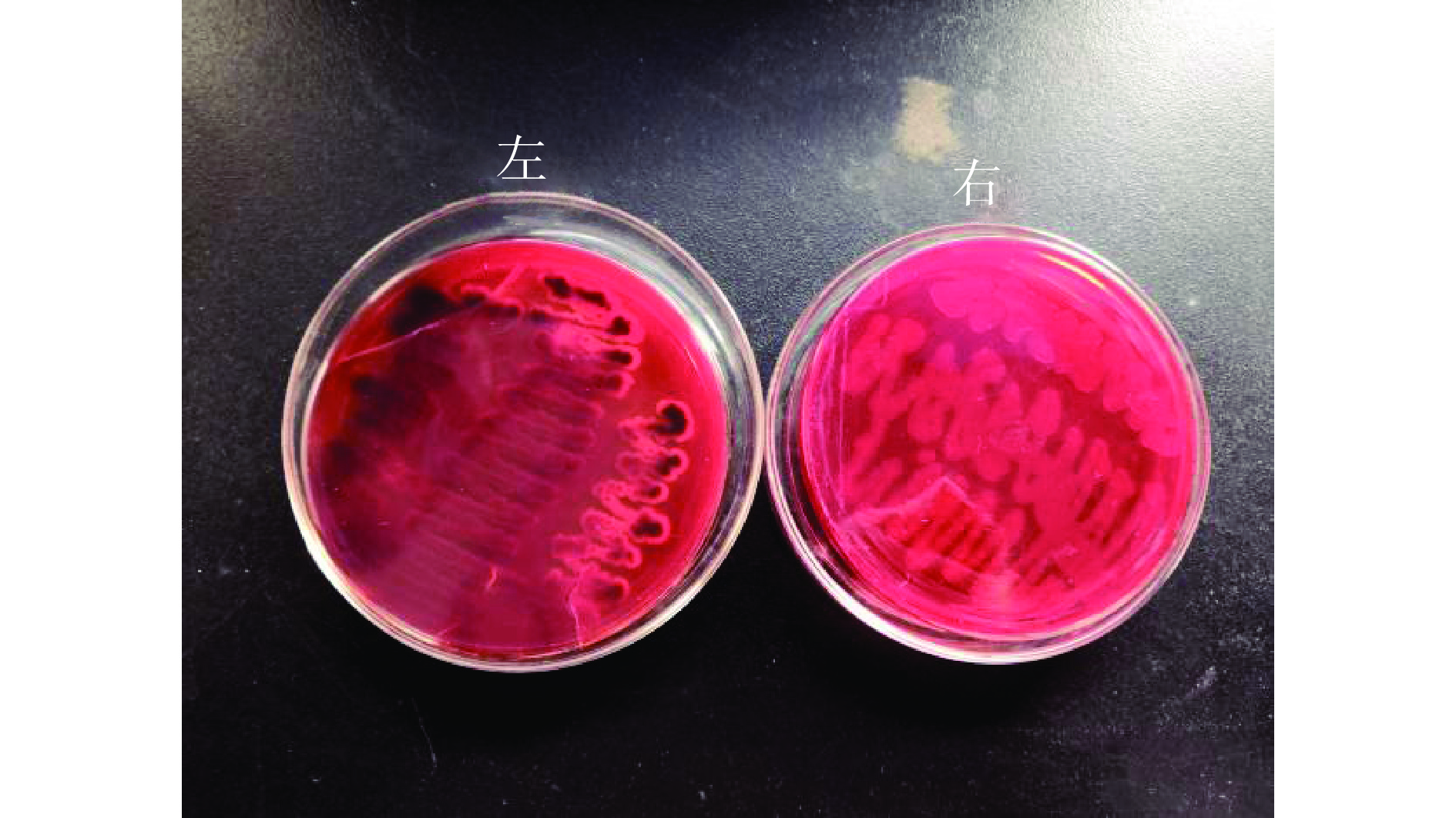
创伤弧菌细胞间粘附的主要成分是PIA(多糖细胞间黏附素),由于刚果红染料可以与多糖细胞间黏附素结合,利用这一特性来鉴定创伤弧菌生物被膜的形成情况[19]。接种在刚果红平板上的创伤弧菌菌株经37 ℃静态培养24 h,结果如图1(左)所示,菌落呈亮黑色,并且边缘有浅浅的透明圈,黑色菌落表明菌株为PIA阳性菌株(VvK),即能够形成生物被膜;图1(右)所示菌落呈现光滑的红色,则表明该菌株为PIA阴性菌株(Vv Bq),即不能够形成生物被膜。在改良试管法中,如图2所示,除空白对照组没有形成生物被膜环,其余菌株均可形成生物被膜环。经统计,刚果红平板法在25株不同菌株及1株标准菌株中,只有1株(Vv Bq)为PIA阴性菌株,其余均为PIA阳性菌株;改良试管法结果显示所有菌株均可形成生物被膜环。
由于两种定性方法出现了结果不一致的情况,因此将菌株Vv Bq再一次进行刚果红平板法和改良试管法实验,结果均显示该菌株为PIA阴性菌株。本实验对试管法进行了改良,能够提高对实验结果的判读,即结晶紫染色过程结束之后,用移液枪移除染色液,而不是直接倾倒染色液,同时等试管完全干燥后再进行判读,结果比染色后立即判读的结果要好。由于刚果红平板法和改良试管法只是定性实验,且结果容易出现假阳性或假阴性,因此,本文进一步采用改良结晶紫染色法定量测定生物被膜形成能力。
2.2 创伤弧菌生物被膜形成能力的定量测定
用改良的结晶紫染色法检测25株不同菌株及1株标准菌株形成生物被膜的能力,结果如表1所示,测定结果同刚果红平板法一致,除1株菌株(Vv Bq)不能形成生物被膜外,其余菌株均有形成生物被膜的能力,但形成生物被膜的能力因菌株而异。生物被膜形成能力的分级参考CHRISTENSEN等[17]的标准,其中强生物被膜形成能力的有9株(10.53%)如表2所示,中等强度生物被膜形成能力的有13株(50%);弱生物被膜形成能力的有3株(11.6%)。其中菌株VvK的成膜能力(OD570nm=1.877±0.035)显著高于其他菌株(P<0.05),所以后续实验均选用该菌株。
表 1 创伤弧菌生物被膜测定结果Table 1. Results of Vibrio vulnificus biofilm determination生物被膜粘附程度 测定值范围(OD570nm) 菌株数目(占比%) +++ 0.477±0.008~1.877±0.035 9(34.6%) ++ 0.322±0.032~0.466±0.018 13(50%) + 0.214±0.007~0.230±0.020 3(11.6%) − 0.088±0.009 1(3.8%) 0.088±0.009 空白对照 注:+++:强粘附,++:中等粘附,+:弱粘附,−:无粘附。 表 2 强生物被膜形成能力菌株Table 2. Strong ability of biofilm formation strains菌株名称 OD570nm值(平均值±标准差) VvK 1.877±0.035a Vv 18s 0.658±0.022b Vv 61 0.656±0.026b Vv Ds 0.572±0.005c Vv Cs 0.519±0.038d Vv Js 0.518±0.030d Vv 52 0.513±0.019d Vv Y5 0.503±0.023d Vv CICC21615 0.477±0.009d 注:不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。 2.3 VvK初始菌浓度对生物被膜形成能力的影响
由2.2的实验结果可知,菌株VvK的成膜能力显著高于其他菌株(P<0.05),因此选择该菌株来进行后续实验。如图3所示,菌株VvK的产膜能力随初始菌浓度的增加而增强,初始菌浓度为108 CFU/mL的菌悬液形成生物被膜的量明显高于其他浓度,当浓度低于107 CFU/mL时,生物被膜形成量立即降低,随着初始菌浓度的降低,菌株VvK仍可形成少量的生物被膜。VvK在较高的初始菌浓度下形成生物被膜量较明显,这与张晓婷等[20]对奇异变形杆菌(Proteus mirabilis)的研究结果相似,具有参考价值。
2.4 NaCl浓度对VvK生物被膜形成能力的影响
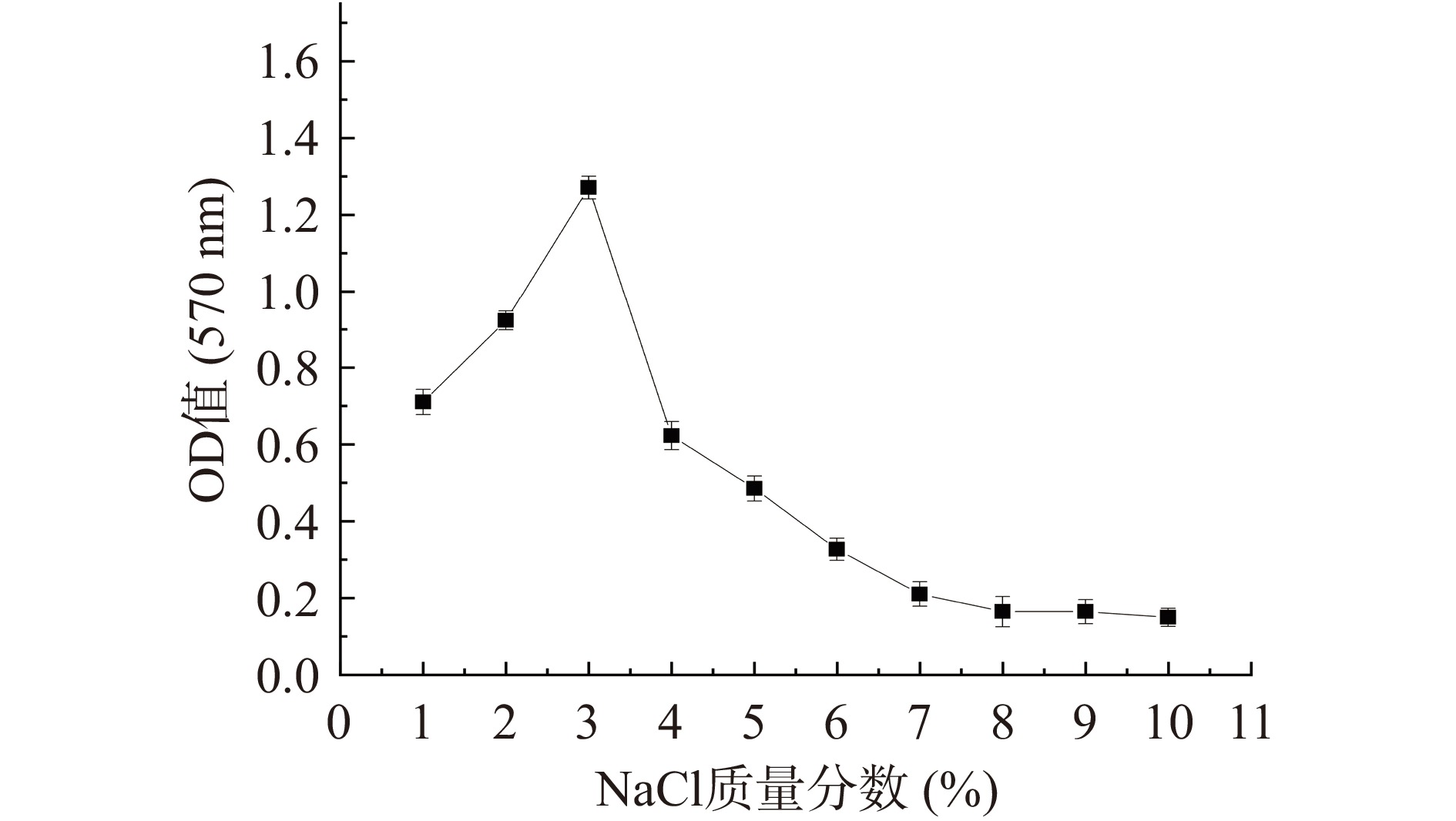
NaCl浓度对创伤弧菌生物被膜的生长有显著影响,如图4所示,NaCl浓度在1%~3%时,生物被膜的形成量随NaCl浓度的增加而逐渐增加,NaCl浓度为3%时,生物被膜的形成量达到顶峰,当NaCl浓度大于3%时,生物被膜的形成量显著降低,这有可能因为NaCl浓度的增加,抑制了创伤弧菌的生长,从而减少生物被膜的形成,NaCl浓度在7%~10%时,受到高渗透压的影响,仅能形成极少量的生物被膜。沈津宇等[21]对副溶血性弧菌(Vibrio parahaemolyticus)的研究结果表明,在3% NaCl生长条件下,菌株生物被膜生成能力最强,在低盐或高盐条件下能力明显减弱,与本实验结果相似。刘文竹等[22]对溶藻弧菌(Vibrio alginolyticus)的研究结果表明,0.5%的NaCl最适宜生物被膜的生成,该结果低于本研究结果。
2.5 不同pH对VvK生物被膜形成能力的影响
被生物被膜包裹的菌株比浮游菌株具有更强的抵抗极端pH的能力,生物被膜菌能够较好的适应极端pH环境可能与极端pH条件下酸碱和重金属结合导致膜外复合物结构发生明显变化有关[23-24]。本研究所用菌株为浮游菌,研究不同pH对生物被膜形成的影响,如图5所示,在pH3~6时,仅能形成极少量的生物被膜,当pH7~9时,具有较强的生物被膜形成能力,其中pH为8时,生物被膜形成能力最强,且pH8~9时,生物被膜形成能力无显著性差异,当pH10~12时,随着pH增加,生物被膜量逐渐减少,但总体上还是能形成一定量的生物被膜,结果进一步表明,弱碱性条件更有利于生物被膜的形成,而过酸环境中,其生长则受到抑制。这与尹清干等[25]对鳗弧菌(Vibrio anguillarum)的研究结果相似。
2.6 培养时间及温度对VvK生物被膜形成能力的影响
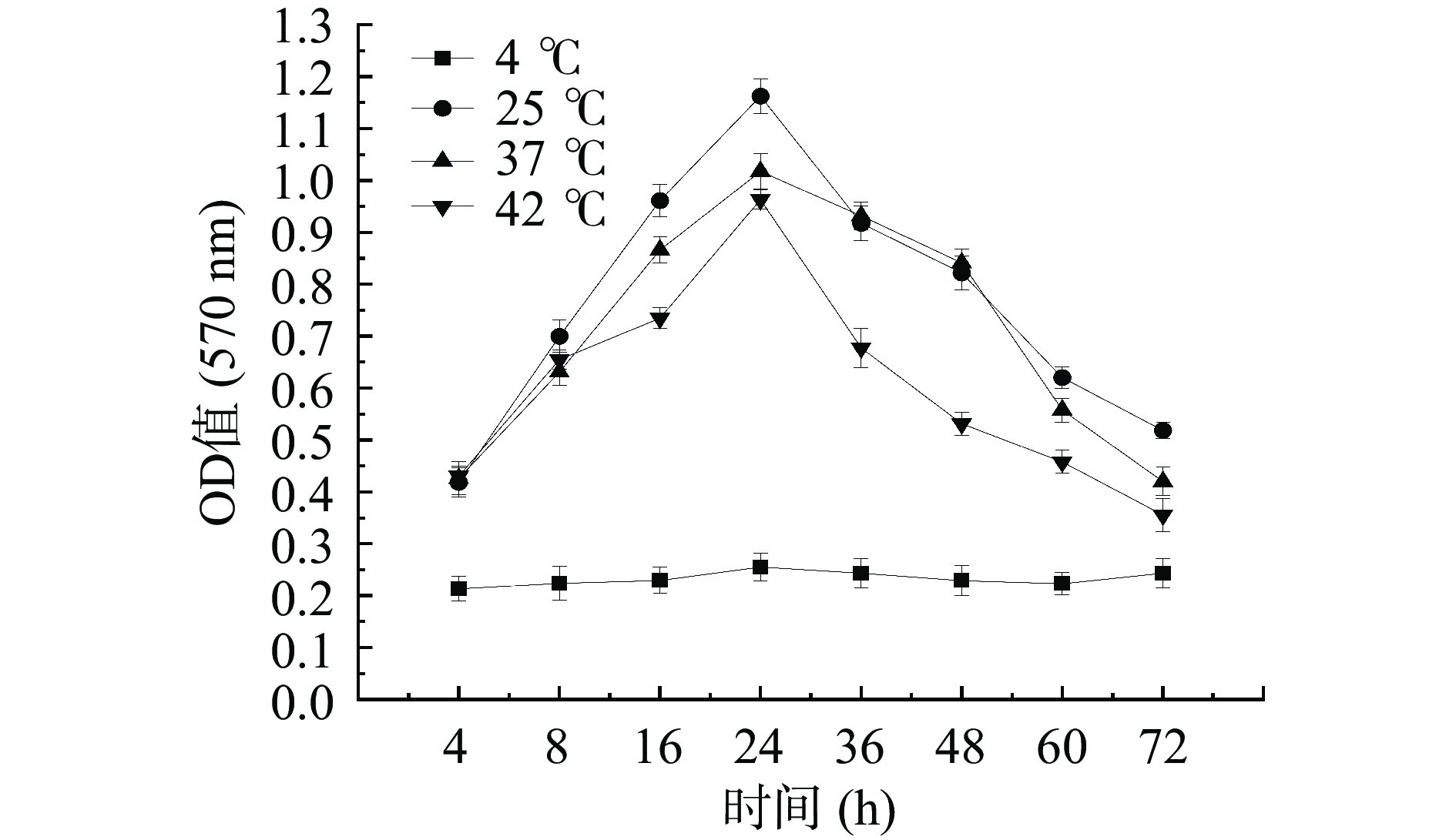
对于不同的培养温度和时间,生物被膜形成量表现出较大的变化,与其他菌株一样,温度是影响创伤弧菌生物被膜最关键的环境因素之一[26-27]。如图6所示,在25、37及42 ℃条件下,培养初期OD570nm值呈现明显的上升趋势,表明生物被膜量逐渐增加,当达到24 h时,OD570nm值最高,24 h之后,OD570nm值迅速下降,这可能与营养物质被消耗、代谢产物增加有关。其中在24 h时,25 ℃培养条件的OD570nm值最高,其次是37和42 ℃,当时间达到72 h时,仅能形成极少量的生物被膜。结果还发现,菌株VvK在4 ℃条件下几乎不形成生物被膜,且不随着时间的变化而变化。温度是影响酶活的重要因素,酶活影响细菌的生长代谢,过高或过低的温度都不利于细菌的生长,进而影响生物被膜的形成[28]。
2.7 金属阳离子对VvK生物被膜形成能力的影响
当添加不同的金属阳离子(Mn2+、Cu2+、Ca2+、Mg2+)后,生物被膜量出现不同程度降低的现象,如图7所示,当添加0.25%的Cu2+时,生物被膜的形成量迅速降低;当Mg2+的添加量在0~0.75%时,生物被膜量降低缓慢,Mg2+的添加量大于0.75%时,生物被膜量降低明显;当Mn2+的添加量达到0.75%时,仅能形成少量的生物被膜,且之后的趋势较为稳定。结果表明:四种金属阳离子均可抑制生物被膜的形成,其抑制程度由大到小依次为Cu2+>Mn2+>Ca2+>Mg2+。对于部分细菌而言,金属阳离子可以通过抑制pilV和pilW基因表达,减少菌毛的形成,使细菌的附着能力减弱,从而抑制生物被膜的形成[29]。对于流动的体系,在流体动力学的模拟下,添加金属阳离子可能会使细菌的生物被膜转向粘塑性的机械状态,导致对临界剪切应力的特征响应,从而使得生物被膜变脆弱而容易脱落[30]。
2.8 不同接触材料对VvK生物被膜形成能力的影响
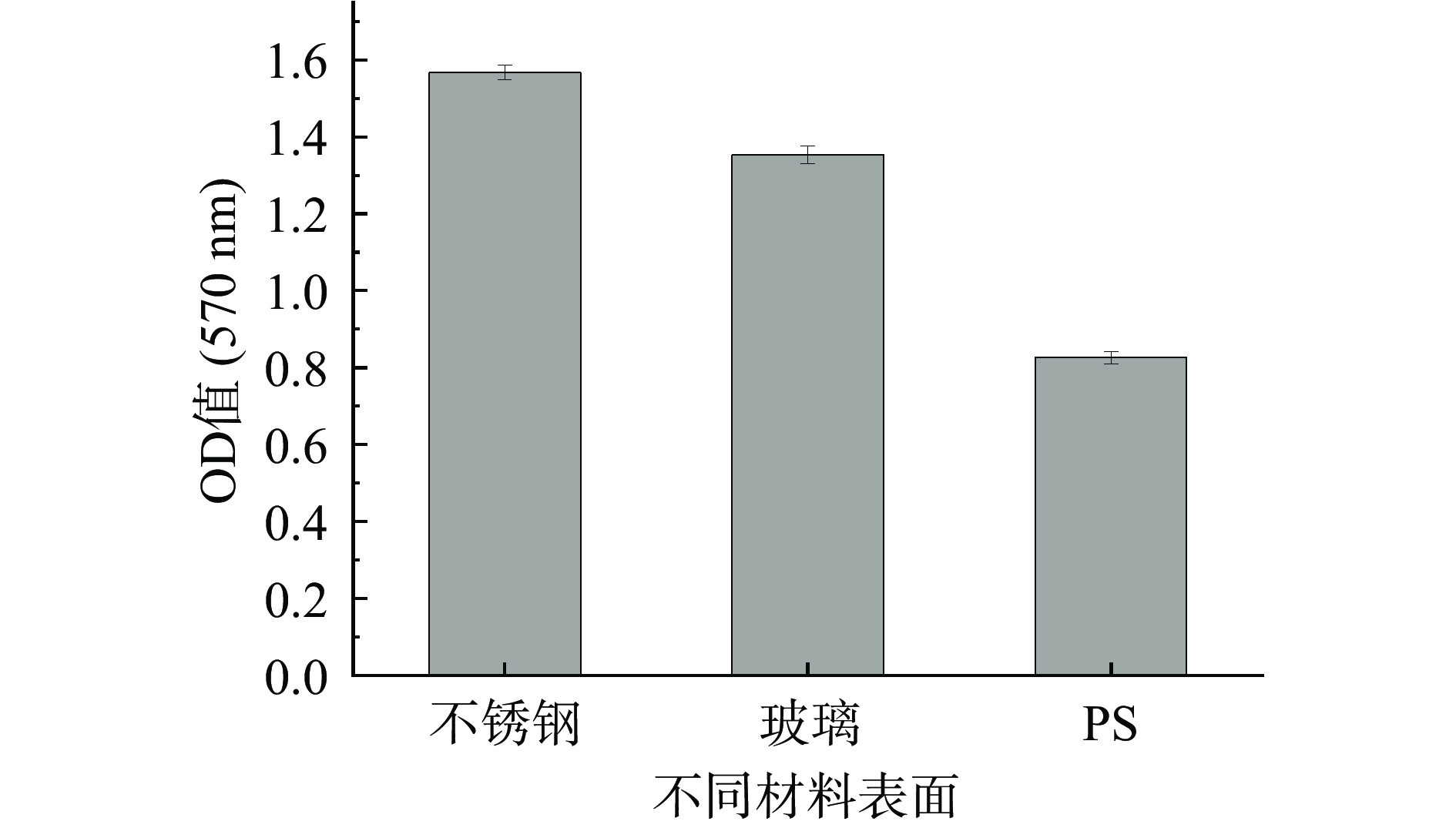
大部分细菌都可以在食品加工设备表面形成生物被膜,从而引起食品污染。熊富忠等[31]研究发现,对设备表面进行物理或化学处理可以抑制生物被膜的形成。如图8所示,创伤弧菌在不锈钢圆片、玻璃圆片及聚苯乙烯(PS)表面均可形成较明显的生物被膜,但形成生物被膜的能力不同,在不锈钢表面形成生物被膜的量最多,其次是玻璃表面,最后是聚苯乙烯表面。有研究表明,荧光假单胞菌(Pseudomonas fluorescens)在不锈钢表面形成生物被膜的能力较强[32]。本研究结果与荧光假单胞菌类似,这说明创伤弧菌有在金属加工设备表面造成污染的可能性。通常微生物表面带负电荷,较易吸附在带正电荷的材料表面,因此材料上的缝隙、光滑程度都会影响细菌的粘附[33]。
3. 结论
本文研究了创伤弧菌生物被膜形成能力及影响因素,刚果红平板法和改良试管法属定性实验,结果较易出现假阴性或假阳性,改良结晶紫染色法测定25株创伤弧菌菌株及1株标准菌株形成生物被膜OD570nm值,实验结果同刚果红平板法结果一致,并结合变异系数进行分析,可知,形成生物被膜能力最强的菌株是VvK,25株菌株在实验条件下表现出了成膜能力的差异性。
创伤弧菌生物被膜的形成受多种因素的影响,初始菌浓度、NaCl浓度、pH、温度和时间、金属阳离子以及接触材料都对菌株VvK产生生物被膜具有一定的影响。研究表明菌株VvK生成生物被膜的最佳初始菌浓度为108 CFU/mL,最适宜pH为8~9,最适NaCl浓度为3%,最佳培养温度为25 ℃,并且不锈钢材料也有助于生物被膜的形成,而金属阳离子则会抑制被膜的形成。因此,在食品贮藏和加工过程中可以结合这些条件来控制生物被膜的产生从而达到预防食品污染的目的;其次,海产品中弧菌的检出率也较高,所以在日常的饮食中尽量不食生的海鲜及其制品。然而,生物被膜的产生并不一定局限于培养条件,对于影响创伤弧菌生物被膜产生的其他因素及控制还有待进一步研究。
-
表 1 创伤弧菌生物被膜测定结果
Table 1 Results of Vibrio vulnificus biofilm determination
生物被膜粘附程度 测定值范围(OD570nm) 菌株数目(占比%) +++ 0.477±0.008~1.877±0.035 9(34.6%) ++ 0.322±0.032~0.466±0.018 13(50%) + 0.214±0.007~0.230±0.020 3(11.6%) − 0.088±0.009 1(3.8%) 0.088±0.009 空白对照 注:+++:强粘附,++:中等粘附,+:弱粘附,−:无粘附。 表 2 强生物被膜形成能力菌株
Table 2 Strong ability of biofilm formation strains
菌株名称 OD570nm值(平均值±标准差) VvK 1.877±0.035a Vv 18s 0.658±0.022b Vv 61 0.656±0.026b Vv Ds 0.572±0.005c Vv Cs 0.519±0.038d Vv Js 0.518±0.030d Vv 52 0.513±0.019d Vv Y5 0.503±0.023d Vv CICC21615 0.477±0.009d 注:不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。 -
[1] 王明义, 胡成进. 创伤弧菌致病性及其毒力因子研究进展[J]. 中国微生态学杂志,2017,29(12):1470−1473. [WANG M Y, HU C J. Research progress on the pathogenicity and virulence factors of Vibrio vulnificus[J]. Chinese Journal of Micro Ecology,2017,29(12):1470−1473. doi: 10.13381/j.cnki.cjm.201712026 [2] 黄春兰, 余洪立, 马丽梅. 创伤弧菌感染1例[J]. 中国感染与化疗杂志,2022,22(1):95−97. [HUANG C L, YU H L, MA L M. One case of Vibrio vulnificus infection[J]. Chinese Journal of Infection and Chemotherapy,2022,22(1):95−97. [3] ELBASHIR S, PARVEEN S, SCHWARZ J, et al. Seafood pathogens and information on antimicrobial resistance: A review[J]. Food Microbiology, 2018, 70: 85-93
[4] 唐旭华, 郭鹏豪, 周晖, 等. 创伤弧菌感染引起的坏死性筋膜炎2例[J]. 皮肤性病诊疗学杂志,2020,27(4):274−277. [TANG X H, GUO P H, ZHOU H, et al. Necrotizing fasciitis caused by Vibrio vulnificus infection in 2 cases[J]. Journal of Dermatology and Venereology,2020,27(4):274−277. doi: 10.3969/j.issn.1674-8468.2020.04.015 [5] JONES M K, OLIVER J D. Vibrio vulnificus: disease and pathogenesis[J]. Infection & Immunity,2009,77(5):1723−1733.
[6] LI J H, ZHAO X H. Effects of quorum sensing on the biofilm formation and viable but non-culturable state[J]. Food Research International,2020,137(7):109742.
[7] MUHSIN J, WISAL A, SAADIA A, et al. Bacterial biofilm and associated infections[J]. Journal of the Chinese Medical Association,2018,81(1):7−11. doi: 10.1016/j.jcma.2017.07.012
[8] FLEMMING H C, WINGENDER J, SZEWZYK U, et al. Biofilms: an emergent form of bacterial life[J]. Nature Reviews Microbiology,2016,14(9):563−575. doi: 10.1038/nrmicro.2016.94
[9] JOO H S, OTTO M. Molecular basis of in vivo biofilm formation by bacterial pathogens[J]. Chemistry & Biology,2012,19(12):1503−1513.
[10] SAXENA P. Biofilms: Architecture, resistance, quorum sensing and control mechanisms[J]. Indian Journal of Microbiology,2019,59(1):3−12. doi: 10.1007/s12088-018-0757-6
[11] COSTERTON J W, LEWANDOWSKI Z, CALDWELL D E, et al. Microbial biofilms.[J]. Annual Review of Microbiology,1995,49(1):711−745. doi: 10.1146/annurev.mi.49.100195.003431
[12] 蔡瑞昭, 祁少海. 创伤弧菌生物特性及临床研究进展[J]. 中华损伤与修复杂志(电子版),2020,15(6):490−494. [CAI R Z, QI S H. Biological characteristics and clinical research progress of Vibrio vulnificus[J]. Chinese Journal of Injury and Repair (electronic version),2020,15(6):490−494. [13] 吴谦. 副溶血弧菌生物菌膜形成特性及亚甲基蓝光动力灭活作用研究[D]. 广州: 暨南大学 WU Q. Study on the characteristics of biofilm formation of Vibrio parahaemolyticus and photodynamic inactivation of methylene blue[D]. Guangzhou: Jinan University.
[14] THAÍS DIAS LEMOS KAISER A, B E M P, KÁTIA REGINA NETTO DOS SANTOS C, et al. Modification of the Congo red agar method to detect biofilm production by Staphylococcus epidermidis[J]. Diagnostic Microbiology and Infectious Disease,2013,75(3):235−239. doi: 10.1016/j.diagmicrobio.2012.11.014
[15] KUNWAR A, SHRESTHA P, SHRESTHA S, et al. Detection of biofilm formation among Pseudomonas aeruginosa isolated from burn patients[J]. Burns Open,2021,5(2):125−129.
[16] STEPANOVIC S. A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J]. J Microbiol Methods,2000:40.
[17] CHRISTENSEN G D, SIMPSON W A, J J YOUNGER, et al. Adherence of coagulase-negative Staphylococci to plastic tissue culture plates: A quantitative model for the adherence of Staphylococci to medical devices[J]. Journal of Clinical Microbiology,1986,22(6):996−1006.
[18] 贾玲华, 宁喜斌, 张徐晶. 溶藻弧菌生物被膜形成能力及特性分析[J]. 食品工业科技,2015,36(20):201−205. [JIA L H, NING X B, ZHANG X J. Analysis of biofilm formation ability and characteristics of Vibrio alginolyticus[J]. Science and Technology of Food Industry,2015,36(20):201−205. [19] FEY P D, OLSON M E. Current concepts in biofilm formation of Staphylococcus epidermidis[J]. Future Microbiology,2010,5(6):917−933. doi: 10.2217/fmb.10.56
[20] 张晓婷, 邓一秒, 董冬丽, 等. 培养条件对奇异变形杆菌生物膜生长的影响[J]. 食品工业科技,2020,41(12):6. [ZHANG X T, DENG Y M, DONG D L, et al. Effect of culture conditions on the biofilm of Proteus mirabilis[J]. Science and Technology of Food Industry,2020,41(12):6. [21] 沈津宇, 倪莹, 高璐. 盐度对副溶血性弧菌生物特性的影响[J]. 现代食品,2018(6):91−94. [SHEN J Y, NI Y, GAO L. Effect of salinity on biological characteristics of Vibrio parahaemolyticus[J]. Modern Food,2018(6):91−94. [22] 刘文竹, 李红月, 范学亭, 等. 环境因素对溶藻弧菌HN08155生物膜形成的影响[J]. 海南大学学报(自然科学版),2015,33(4):365−371. [LIU W Z, LI H Y, FAN X T, et al. Effect of environmental factors on biofilm formation of Vibrio alginolyticus HN08155[J]. Journal of Hainan University (Natural Science Edition),2015,33(4):365−371. [23] YIN W, WANG Y, LIU L, et al. Biofilms: The microbial ''Protective Clothin'' in extreme environments[J]. International Journal of Molecular Sciences,2019,20(14):3423. doi: 10.3390/ijms20143423
[24] BLANCO Y, ALFONSO RIVAS L, GONZALEZ-TORIL E, et al. Environmental parameters, and not phylogeny, determine the composition of extracellular polymeric substances in microbial mats from extreme environments[J]. Science of The Total Environment, 2018, 650 ( PT.1 ( 1-834 ) ) : 384−393.
[25] 尹清干, 程俊茗, 刘腾飞, 等. 环境因子对鳗弧菌生物膜形成的影响[J]. 微生物学通报,2018,45(1):8. [YIN Q G, CHENG J M, LIU T F, et al. Effects of environmental factors on biofilm formation in Vibrio anguillus[J]. Bulletin of Microbiology,2018,45(1):8. [26] ZOU M, LIU D. Effects of carbon sources and temperature on the formation and structural characteristics of food-related Staphylococcus epidermidis biofilms[J]. Food Science and Human Wellness,2020,9(4):370−376. doi: 10.1016/j.fshw.2020.05.007
[27] ÇAM S, BRINKMEYER R. The effects of temperature, pH, and iron on biofilm formation by clinical versus environmental strains of Vibrio vulnificus[J]. Folia Microbiol,2020,65(3):557−566. doi: 10.1007/s12223-019-00761-9
[28] ZHANG B Z. Bacterial adhesion and biofilms on surfaces[J]. Progress in Natural Science,2008(9):1049−1056.
[29] TANG D, GAO Q, ZHAO Y, et al. Mg2+ reduces biofilm quantity in Acidithiobacillus ferrooxidans through inhibiting type IV pili formation[J]. FEMS Microbiology Letters,2018,365(4):fnx266.
[30] JESSE G, WILLIAM Y H, CYNTHIA G, et al. Critical shear stresses of Pseudomonas aeruginosa biofilms from dental unit waterlines studied using microfluidics and additional magnesium ions[J]. Physics of Fluids,2022,34(2):021902. doi: 10.1063/5.0076737
[31] 熊富忠, 赵小希, 廖胤皓, 等. 材料表面特征对生物膜形成的影响及其应用[J]. 微生物学通报,2018,45(1):155−165. [XIONG F Z, ZHAO X X, LIAO Y H, et al. Effect of material surface characteristics on biofilm formation and its application[J]. Bulletin of Microbiology,2018,45(1):155−165. [32] WANG H H, CAI L L, LI Y H, et al. Biofilm formation by meat-borne Pseudomonas fluorescens on stainless steel and its resistance to disinfectants[J]. Food Control,2018,91(9):397−403.
[33] 李燕杰, 苏新国, 姚玉静, 等. 不同类型表面材料对单增李斯特菌生物被膜形成的影响[J]. 郑州轻工业学院学报(自然科学版),2015,30(Z2):33−37. [LI Y J, SU X G, YAO Y J, et al. Effect of different surface materials on biofilm formation of Listeria monocytogenes[J]. Journal of Zhengzhou Institute of Light Industry (Natural Science Edition),2015,30(Z2):33−37. -
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:




 下载:
下载:



