Effect of Particle Size and Phenolics Bounded-Insoluble Dietary Fiber on the in Vitro Fermentation Properties of White Kidney Bean Skin
-
摘要: 为揭示不同粒径的白芸豆皮和含结合酚不溶性膳食纤维的体外发酵规律,本研究以白芸豆皮(WS)为原料,经过连续酶法提取得到含结合酚不溶性膳食纤维(IB),采用普通粉碎和超微粉碎方法对其进行改性,获得不同粒径分布的两组样品,利用扫描电子显微镜和激光共聚焦扫描显微镜对其微观形貌进行观察,并通过体外发酵实验和16S rRNA测序探究两组样品的酵解特性及其对肠道菌群组成丰度的影响。实验结果发现样品粒径越小,结合酚越均匀地分散于颗粒表面。WS和IB都具有慢发酵性,且其发酵速率和产酸量均随着粒径的减小而提高,菌群组成分析发现粒径越小的底物对Bacteroides丰度的促进效果也越显著,但是Lachnospira显示出了对较大粒度底物的偏好。结果表明IB可以促进Bacteroides、Bifidobacterium和Ruminococcaceae ruminococcus等有益菌的相对丰度,改善肠道微生物群的组成结构,其益生效应较相同粒径的WS更为显著。本研究可以为膳食纤维益生元效应的研究提供基础和方向,并可以指导膳食纤维的超微粉碎改性和白芸豆皮的综合利用。Abstract: To investigate the effects of particle size and phenolics bounded-insoluble dietary fiber (IB) of white kidney bean skin (WS) on in vitro fermentation profiles, the IB was extracted enzymatically, modified by ordinary and superfine grinding, followed by the preparation of different particle sizes. Their microscopic morphology was observed by scanning electron microscopy and laser confocal scanning microscopy. In vitro fermentation experiments and 16S rRNA sequencing were used to investigate the fermentation properties of the two sets of samples and their effects on the abundance of gut microbiota composition. The results showed that the bound phenolics were distributed more equally on the surface of the smaller particles. The slowed fermentation rate and short-chain fatty acid production of WS and IB increased with decreasing particle size. The smaller particle size promoted the Bacteroides and demoted the Lachnospira more significantly. The results suggested that IB could promote the beneficial bacteria such as Bacteroides, Bifidobacterium and Ruminococcaceae ruminococcus, and regulate the structure composition of the gut microbiota. The probiotic effect of IB was more significant than that of WS with the same particle size. This study provides the school of thought on the prebiotic effect of dietary fiber, guides on the modification of dietary fiber by superfine grinding, and suggests the comprehensive utilization of white kidney bean skin.
-
白芸豆(Phaseolus vulgaris Linn),生物学名为多花菜豆,富含蛋白质、多糖等多种营养成分[1]。目前对白芸豆的研究主要集中在酶抑制剂、植物凝集素等成分的提取分离及其保健功能等方面[2−3],加工过程会产生豆皮、豆渣等副产物,白芸豆皮占全豆颗粒质量的7.5%~8.0%,其细胞壁不溶性碳水化合物富含纤维素、半纤维素和木质素等膳食纤维[4],对其进行综合加工利用具有重要意义。
膳食纤维具有调节人体肠道微生物的种群丰度及肠道内环境平衡等重要作用。其中不溶性膳食纤维不仅可以促进肠道蠕动,增加排便,也能够被肠道微生物所酵解,产生短链脂肪酸(short-chain fatty acids,SCFAs),进而为肠道细胞提供营养,保护肠道健康[5],近年来已有研究报道了一些果蔬和植物中不溶性膳食纤维的大肠发酵特性[6−7]。此外,不溶性膳食纤维中通常还含有结合酚类物质,Saura-Calixto等[8]曾报道酚类等抗氧化剂可以以膳食纤维作为载体,通过氢键、疏水作用等与其联接形成结合态酚类化合物,到达结肠后经肠道菌群发酵释放并被进一步酵解转化为小分子酚类物质,在结肠内发挥其抗氧化、抗炎等生理活性,帮助保护肠道健康。
尽管不溶性膳食纤维有诸多益处,但其质地粗糙影响口感。通过微波、挤压、超微粉碎技术等方法能够有效改善其理化性质,降低界面张力和空间位阻效应,提升其口感和应用价值。超微粉碎技术现已用于姜粉、黄芪粉、麦麸膳食纤维等的改性[9−10],在粉碎的过程还会增加颗粒表面积,促进多酚等抗氧化物质的溶出释放[11]。目前已有文献报道了不同粒径膳食纤维的发酵速率及SCFAs产量等基础的发酵动力学规律[12−13],但关于粒径对不溶性膳食纤维调节肠道菌群组成丰度的影响研究仍不够充分,因此本研究以白芸豆皮(whole skin powder,WS)为原料并提取得到其中的含结合酚不溶性膳食纤维(insoluble dietary fiber-bound phenolics,IB),将两者分别经过普通粉碎和超微粉碎得到不同粒径的样品,通过体外发酵实验对比不同粒径WS和IB的体外发酵特性,并探究其对肠道菌群结构的调控作用。本文将为后续对膳食纤维益生元效应的研究提供基础和方向,并可以指导白芸豆皮的废物利用和膳食纤维相关食品保健品的产业化开发。
1. 材料与方法
1.1 材料与仪器
白芸豆皮 广州酒家集团利口福食品有限公司提供;低聚果糖 美国Ingredion公司;中温α-淀粉酶(EC号:232-565-6;活性:10000 U/g)、胃蛋白酶(EC号:232-629-3;活性:3000 U/mg)、胰酶(EC号:232-468-9;活性:4000 U/g) 上海麦克林生化科技股份有限公司;其他试剂或药品均为分析纯。
Dhg-9070(A)恒温鼓风干燥箱 上海一恒科学仪器有限公司;FW80高速粉碎机 天津市泰斯特仪器有限公司;XDW-6B实验室专用低温超微粉碎机 济南达微机械有限公司;Mastersizer 3000马尔文粒度仪 英国Malvern公司;EVO18扫描电子显微镜 德国Zeiss公司;Leica TCS SP5激光共聚焦扫描显微镜 德国Leica Microsystems公司;STA 8000同步热分析仪 美国PerkinElmer公司;BS201S 型电子分析天平 德国 Startorius公司;MR-Hei-Tec型加热型磁力搅拌器 德国Heidoiph公司;LDZh-100KBS型立式压力蒸汽灭菌锅 上海申安医疗器械公司;HYQX-II厌氧培养箱 上海跃进医疗器械有限公司;7890A GC-FID气相色谱仪 美国Agilent公司; DYY-6C型电泳仪 北京六一生物科技有限公司;2720型PCR扩增仪 美国Applied Biosystems公司;E6090型TBS-380荧光计 北京原平皓生物技术有限公司;nova seqPE250高通量测序仪 美国 Illumina公司。
1.2 实验方法
1.2.1 白芸豆皮(WS)的粉碎改性
将湿豆皮原料清洗并去除杂质后放入40 ℃鼓风干燥箱内烘干48 h,烘干后用高速粉碎机进行粉碎[10],分别过200目、40目筛得到WS-200、WS-40,另取干豆皮用超微粉碎机在振幅5.5 mm、温度0 ℃的条件下进行干法振动式超微粉碎处理,并过500目筛得到WS-500,将上述样品装进密封袋,在室温下储存于干燥器中备用。
1.2.2 含结合酚不溶性膳食纤维(IB)的提取及其粉碎改性
IB的提取参考Go等[14]的连续酶法并进行部分修改。将100.00±0.01 g WS加入装有1000 mL 85%乙醇溶液的烧杯中,在30 ℃下超声除杂40 min,重复3次,并用蒸馏水洗涤3次。向上述处理的样品中加入800 mL pH7.5的磷酸盐缓冲液(0.1 mol/L),用分散仪分散,调节pH至1.5,加入3000 U/mg的胃蛋白酶1.2 g并在40 ℃下反应1 h。将pH调节至7.5后加入4000 U的胰酶并在37 ℃下消化4 h。消化后将酶解体系加热至65 ℃处理40 min。然后加入800 mL马来酸盐缓冲液(0.1 mol/L),将pH调节至6.9,添加10000 U/g的中温α-淀粉酶30 g后在37 ℃下反应16 h。将样品在4500×g离心10 min,沉淀用蒸馏水洗涤三次,真空冷冻干燥后得到IB。按上述WS的粉碎方法将IB进行粉碎处理,得到IB-40、IB-200、IB-500,置于干燥器中备用。
1.2.3 WS和IB主要成分的分析
总淀粉含量的测定按照Megazyme K-TSTA总淀粉检测试剂盒方法;蛋白质含量的测定参考GB 5009.9-2016的凯氏定氮法;纤维素、半纤维素、木质素含量的测定参考NY/T 3494-2019方法;多酚含量的测定参考Hossain等[15]的方法并做适当修改,采用福林酚法,按没食子酸当量(mg GAE/g)测定;阿魏酸含量的测定采用高效液相色谱串联质谱法[16]。
1.2.4 样品的结构表征
1.2.4.1 粒径的测定
将样品分散于蒸馏水中,用Mastersizer 3000 马尔文粒度仪测定样品的平均粒径和比表面积,采用湿法进样,折射率为1.336[17],测定时在3000 r/min转速搅拌、80%功率超声条件下使样品在蒸馏水中保持分散均匀。
1.2.4.2 微观形貌的观察
扫描电子显微镜观察:分别取少量样品于粘有导电胶的样品台上,经过吹扫使其均匀分布,在真空状态下,使用离子溅射镀膜仪对其进行喷金,样品制备好后放入仪器内,在800×放大倍数下观察样品。加速电压为15 kV,工作距离(WD)为7.3 mm左右;激光共聚焦显微镜观察:室温下在避光的环境中观察不同样品中结合酚。其中仪器的参数设置为:在10×物镜下,使用405 Diode激光源,并将发射波长设置为440~470 nm[18]。拍摄明场和荧光场叠加视角的照片。
1.2.5 体外发酵实验
1.2.5.1 体外发酵条件
参考Wang等[6]的方法进行并作适当修改。配制碳酸-磷酸盐缓冲液,将其与实验所需的其他材料一起放入高压灭菌锅中于121 ℃下灭菌20 min。然后趁热向碳酸-磷酸盐缓冲液中加入半胱氨酸盐酸盐并通入二氧化碳去除氧气,放入厌氧箱过夜。准确称取干基50 mg的WS和IB样品于带有橡胶塞的厌氧小瓶中,低聚果糖(fructooligosaccharide,FOS)和不添加任何碳水化合物的厌氧瓶分别用作阳性和空白对照,然后与缓冲液一同转入厌氧箱。发酵所用的粪便样本取自三位年龄介于20~30岁之间、身体质量指数(body mass index,BMI)均在正常范围内(18.5 kg/m2<BMI<25 kg/m2)的健康志愿者,志愿者提前签署知情同意书。在实验当天收集新鲜粪便样品于无菌试管中并立即转移到厌氧箱中,将三名志愿者的粪便混合与碳酸盐-磷酸盐缓冲液以1:3(w/v)的比例混合,然后通过四层纱布过滤得到粪便接种物溶液。将1 mL粪便接种物溶液和4 mL碳酸-磷酸盐缓冲液分别加入厌氧瓶中,用橡皮塞和铝盖封口后置于37 ℃水浴锅中振荡培养发酵并计时。
1.2.5.2 产气量的测定
分别在发酵4、8、12、24和48 h后,从水浴锅中取出厌氧瓶,用带有刻度的注射器扎入橡胶塞,根据注射器的位移刻度量测量发酵产气量数据。随后打开橡胶塞停止厌氧微生物继续反应,然后分别收集发酵后的上清液和沉淀物并保存在−80 ℃以备后续测试。
1.2.5.3 短链脂肪酸含量的测定
解冻发酵后的上清液,利用气相色谱法[19]分析样品中短链脂肪酸的含量。将上清液在16000×g转速下离心10 min,吸取800 μL上清液与200 μL内标混合物(含50 mmol/L 4-甲基戊酸)于无菌离心管中混合均匀。通过配备有FID检测器的气相色谱仪分析短链脂肪酸的种类和含量,所用色谱柱为极性ZB-FFAP毛细管柱(30 m×0.25 mm×0.25 μm)。柱温箱初始温度设置为80 ℃,以8 ℃/min 的速度升到192 ℃,并在192 ℃下保持3 min。前进样口和前检测器的温度设置为230 ℃,以1 mL/min的恒定流速输送氮气作为载体。根据脂肪酸标准品的色谱图中各类短链脂肪酸的保留时间确定样品中短链脂肪酸的种类,再以脂肪酸标准品中4-甲基戊酸为内标与目标脂肪酸的峰面积之比为矫正因子,根据样品中各短链脂肪酸的相对峰面积进行定量。
1.2.5.4 DNA提取和测序
解冻发酵后的沉淀物,参考试剂盒QIAamp®DNA Stool Mini Kit 的使用说明,将沉淀样品在13000 r/min下离心10 min,弃去上清液,使用磷酸盐缓冲液将下层沉淀均质化,然后将其转移到盛有裂解液的管中,进行DNA提取。从沉淀样品中提取细菌总DNA,储存在−20 ℃下等待分析使用。通过分光光度计测定提取的DNA浓度,并用琼脂糖凝胶电泳鉴定其纯度。选择16S rRNA的标准细菌V3~V4区进行PCR扩增,整个反应在Thermocycler PCR系统中进行,其主要程序包括:98 ℃下预变性2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,共包含25~27个循环,最后72 ℃延伸5 min。PCR产物使用Agencourt AMPure Beads试剂盒进行纯化,其浓度通过双链DNA定量检测试剂盒测定。使用MiSeq Reagent Kit V3试剂盒进行文库构建,在Illumina MiSeq平台上机进行双端测序。
1.2.5.5 生物信息学与多元数据分析
微生物组生物信息主要通过QIIME 2 18.0版进行分析。对原始序列进行去引物、质量过滤、去噪、拼接和去嵌合体,质控后产生的每个去重的序列称为ASVs (amplicon sequence variants),基于Greengenes数据库13.8版本对扩增子序列变异(ASVs)进行注释。使用宏基因组分析仪(MEtaGenome Analyzer,MEgAN)和图形系统发育分析(graphical phylogenetic analysis,GraPhlAn)对菌群的分类学组成及丰度信息进行可视化分析。每个样品在门和属水平上的分类单元丰度结果以柱状图展现。将具有超过6000片段的ASV表示为“丰富ASV”,使用gplots R包对“丰富ASV”进行热图分析,并通过在欧氏距离上的主成分分析(principal component analysis,PCA)对不同样品微生物群落结构的变化进行可视化分析[6]。
1.3 数据处理
实验数据以重复测量的平均值±标准差表示。使用SPSS 19.0版本对数据进行统计分析。通过单因素方差分析(ANOVA)进行统计学差异分析,采用Duncan多重检测综合评价试验组之间的差异(P<0.05)。使用GraphPad Prism 7.0版本进行绘图。
2. 结果与分析
2.1 WS和IB的主要成分
WS和IB中的主要成分如表1所示。WS中的主要成分是不溶性膳食纤维,主要包括纤维素、半纤维素和木质素等[5],其中纤维素和半纤维素含量较高,分别为28.64%±2.01%和32.65%±0.93%,木质素的含量最低,仅为1.37%±1.40%。此外WS中还含有19.49%的淀粉。经过连续酶法提取得到的IB中淀粉和蛋白质的含量明显降低了(分别为4.01%和0.51%),而纤维素的纯度提高了约30.57%,说明中温α-淀粉酶、蛋白酶和胰酶有效除去了WS中的淀粉、蛋白质等杂质,提高了不溶性膳食纤维的纯度,该结果与刺梨果渣[6]的研究结果较为一致。WS中多酚物质的含量为1.848 mg GAE/g,而IB中多酚含量相对较低,为1.598 mg GAE/g,且IB中阿魏酸含量也降低了24.8 μg/g,这是由于在提取IB的过程中除去了部分游离酚类物质,造成阿魏酸等多酚含量的损失。
表 1 WS和IB的主要成分Table 1. Main components of WS and IB样品 淀粉
(%)蛋白质
(%)纤维素
(%)半纤维素
(%)木质素
(%)多酚
(mg GAE/g)阿魏酸
(μg/g)WS 19.49±1.33 2.95±0.67 28.64±2.01 32.65±0.93 1.37±1.40 1.848±0.09 228.0±11.2 IB 4.01±0.89 0.51±0.08 59.21±1.04 17.29±1.25 1.91±0.78 1.598±0.03 203.2±7.8 注:WS:白芸豆皮;IB:含结合酚不溶性膳食纤维。 2.2 膳食纤维粒径分布及比表面积
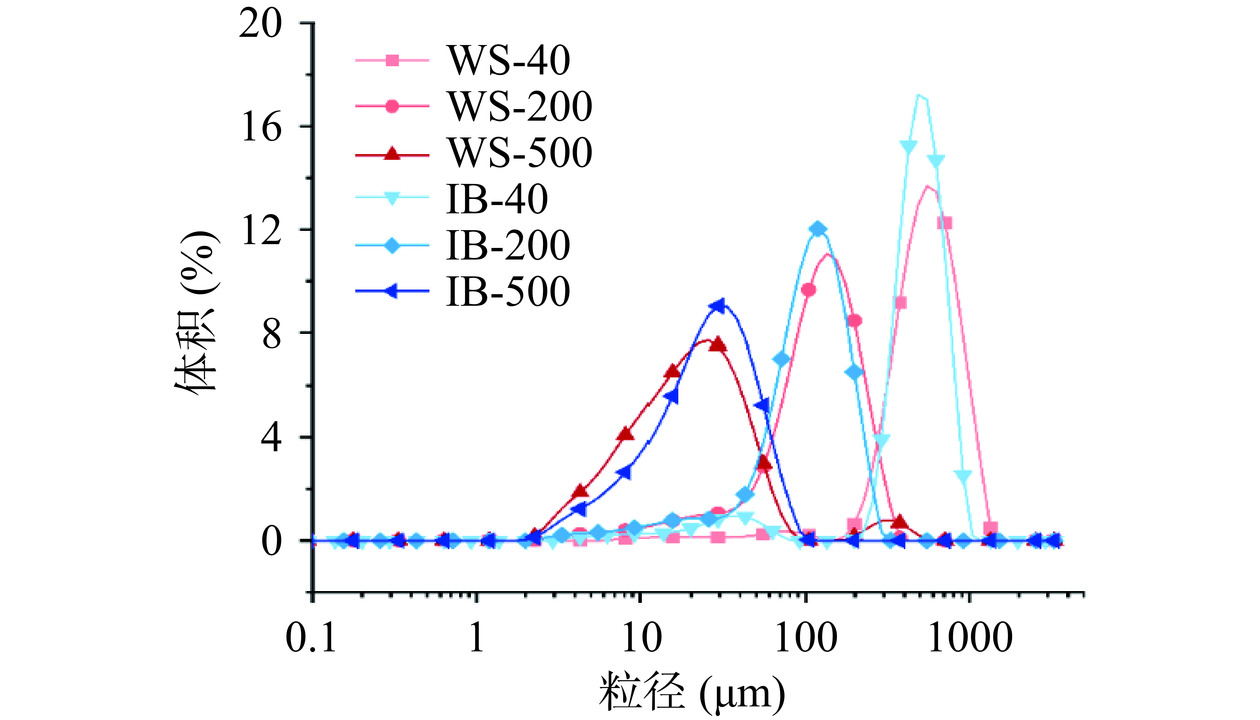
白芸豆皮及其膳食纤维的粒径分布如图1和表2所示,从图中可以出,所有样品均只有一个明显的粒径分布峰,说明样品颗粒尺寸分布较为均匀,且不同目数的样品分别在20、110、500 μm存在一个主峰,平均粒径分布差异较为明显。WS和IB的体积平均粒径经过普通粉碎后分别从575.00、480.67 μm降到127.67、111.33 μm,经过超微粉碎改性后的WS-500和IB-500则分别可以达到33.00、28.27 μm左右(表1)。相同粒径级分的WS和IB其比表面积也有所不同,WS-40的比表面积仅为18.24 m²/kg,显著低于IB-40的41.84 m²/kg(P<0.05),这是由于WS结构完整,含有淀粉等成分,而IB中大量的纤维状结构使其具有更大的比表面积[5]。随着粒径的减小,WS和IB的比表面积逐渐增大,值得注意的是WS-500的比表面积显著大于IB-500(P<0.05),这可能是由于超微粉碎过程剧烈的撞击破坏了IB的微粒结构及其内部的纤维状网状结构[20],比表面积的增大能够使其具有更好的持水性、持油性、抗氧化活性等理化性质[10]。
表 2 不同样品的粒径分布和比表面积Table 2. Particle size and specific surface area of different samples样品 D [3,2](μm) D [4,3](μm) Dx (10) (μm) Dx (50)(μm) Dx (90)(μm) SSA(m²/kg) WS-40 329.33±9.29d 575.00±6.24e 297.00±3.60d 546.00±5.29f 920.67±9.61e 18.24±0.51a WS-200 59.93±0.25b 127.67±0.58c 36.73±0.65b 121.00±0.00d 225.33±1.15c 100.12±0.38c WS-500 13.53±0.25a 33.00±4.21a 6.18±0.06a 19.87±0.45a 49.30±2.75a 442.97±7.85e IB-40 143.67±6.11c 480.67±2.52d 266.00±13.86c 486.33±0.58e 730.67±3.51d 41.84±1.81b IB-200 56.50±1.31b 111.33±0.58b 38.63±4.48b 107.00±0.00c 189.67±3.51b 106.27±2.46c IB-500 16.63±0.05a 28.27±0.06a 7.88±0.02a 25.13±0.15b 53.23±0.32a 360.60±1.57d 注:同列右肩不同的小写字母表示具有显著差异(P<0.05);D [3,2]为颗粒比表面积平均粒径;D [4,3]为颗粒体积平均粒径;Dx (10)、Dx (50)和Dx (90)值分别代表小于此粒径的颗粒体积含量占全部颗粒的10%、50%和90%;SSA为颗粒比表面积。 2.3 膳食纤维微观形貌
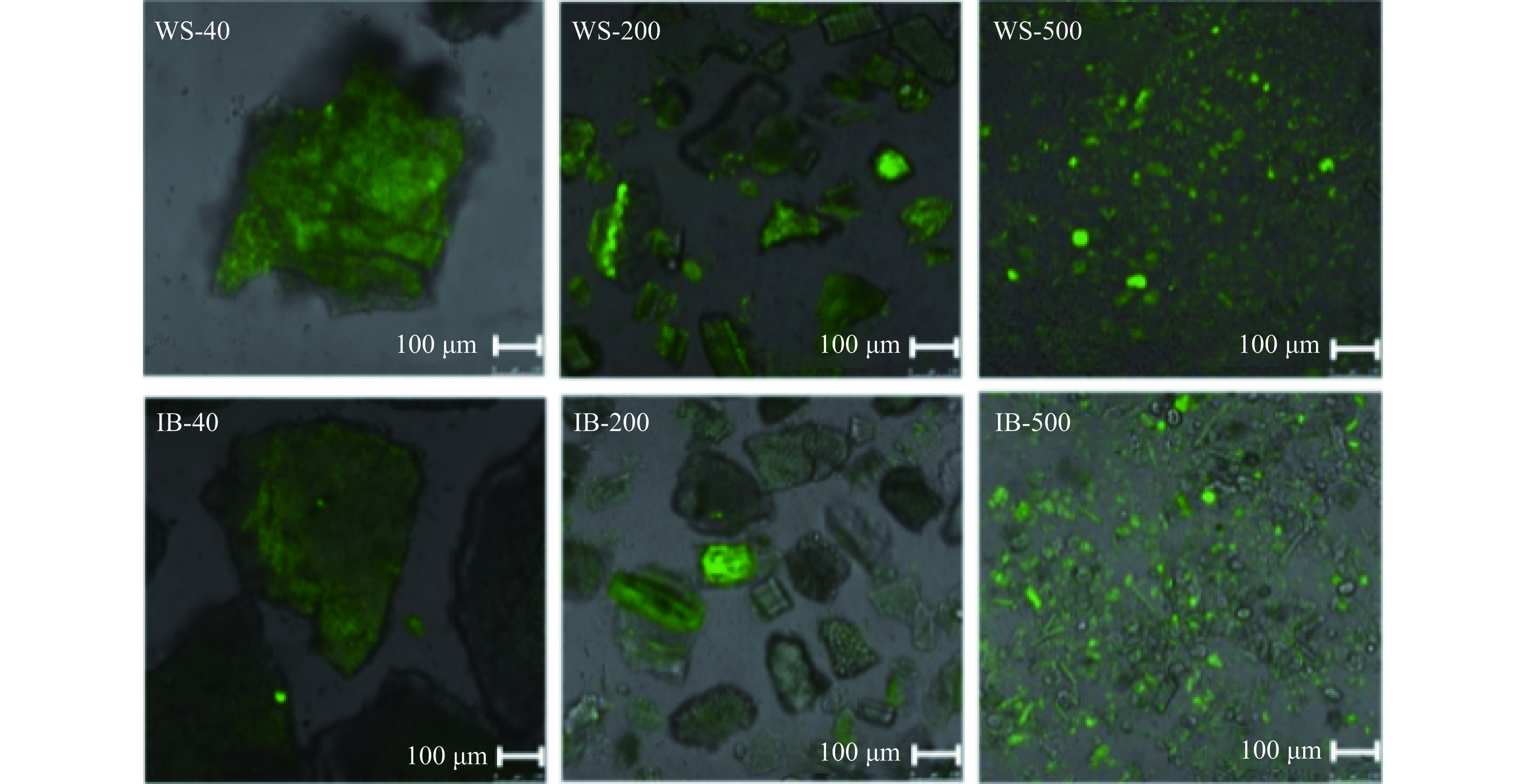
六种样品的微观形貌如图2所示。从图中可以看出,白芸豆皮(WS)的微观结构较为完整致密,还有少量块状和球形颗粒,可能是豆皮中存在的淀粉等成分。而经过连续酶法提取得到的不溶性膳食纤维(IB)中难以观察到球状的颗粒,说明连续酶法操作除去了豆皮中的淀粉、蛋白质等杂质,且IB呈海绵状网络结构,有较多明显的孔隙和通道,结构疏松,与Zhang等[21]观察到的银耳不溶性膳食纤维的形貌较为接近。随着粒径的降低,样品颗粒明显减小,WS-500有较多的片状结构,有部分黏连;而IB-500则有部分呈条形结构,与IB-40和IB-200相比发生了明显的破碎和裂解,这是由于在超微粉碎过程中的高速剪切、冲击和研磨使得样品剧烈碰撞,粒径急剧减小[22]。比表面积的增大将使其在进入结肠后提高肠道微生物对其的附着性和生物可及性,增强其可发酵特性[23]。
六种样品的激光共聚焦扫描显微图见图3,图中可观察到不同粒径大小样品中所含结合酚的存在情况。阿魏酸是结合酚中的一种重要的酚酸,广泛存在于植物中,且通常与细胞壁多糖等大分子物质相结合,在405 nm的激发波长下,阿魏酸能够自发绿色荧光[24]。从图中可以出,WS和IB两种样品中均存在一定含量的阿魏酸,IB中的荧光较WS稍弱,可能是在提取IB过程中部分游离阿魏酸被除去。随着粒径的减小,两类样品中的绿色荧光都更为明显,说明粉碎过程阿魏酸容易裸露于颗粒表面,分散更为均匀。因此,超微粉碎可以提高多酚的生物可及性,与文献报道一致,即超微粉碎处理能够破坏微粒结构,促进更多小分子活性物质的溶出[22]。
2.4 膳食纤维体外发酵产气量和发酵速率
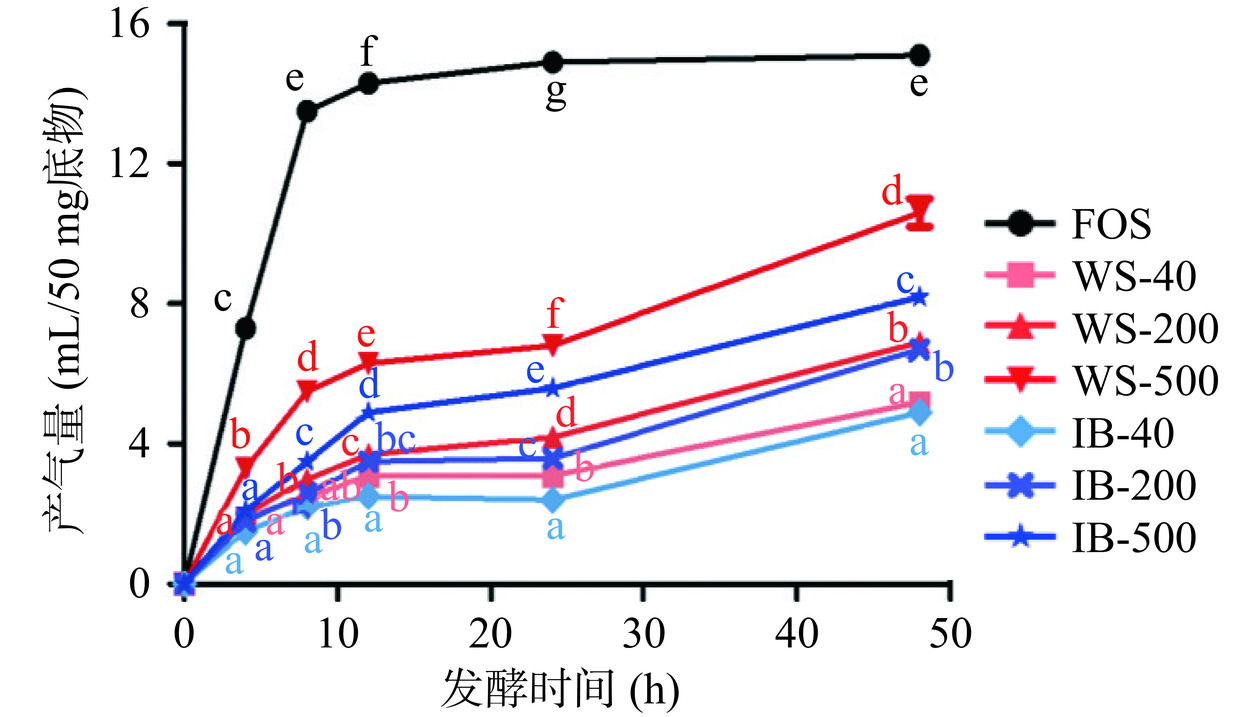
发酵过程中的产气量通常可以作为发酵速率的指标[25]。图4展示了不同粒径样品在48 h体外发酵过程中的产气量。阳性对照FOS产气量和产气速率最高,短时间迅速产生较多的气体容易引起腹胀等不适症状[19]。与FOS相比,WS和IB中主要是不溶性膳食纤维等不易被酵解的成分,故样品的产气量相对较低,发酵速率较为平缓,这种缓慢的持续性发酵使得底物能够逐渐进入远端结肠并在此提供短链脂肪酸等能量和营养物质[26]。
![]() 图 4 不同样品体外发酵48 h过程中的产气情况注:相同时间点上不同的小写字母表示具有显著差异(P<0.05);FOS:低聚果糖;图5同。Figure 4. Gas production during 48 h in vitro fecal fermentation time course
图 4 不同样品体外发酵48 h过程中的产气情况注:相同时间点上不同的小写字母表示具有显著差异(P<0.05);FOS:低聚果糖;图5同。Figure 4. Gas production during 48 h in vitro fecal fermentation time courseIB的产气量和产气速率均低于WS,即IB比未处理的WS具有更好的慢发酵特性,这是由于在WS中淀粉等其他易被酵解的组分含量较高。从粒径大小分析,WS和IB组内三个样品的产气量和产气速率均为500目>200目>40目,即粒径越大的底物发酵速率越慢,而粒径越小的底物因为具有更大的比表面积,即有更大的微生物-基质界面[13],且表面较为多孔、粗糙,更容易被肠道微生物附着和利用,发酵速率相对较快。
2.5 短链脂肪酸的组成和浓度分析
在大肠发酵过程中膳食纤维等底物会被肠道微生物发酵降解而产生乙酸、丙酸和丁酸等短链脂肪酸(SCFAs),SCFAs可以降低结肠内环境的pH,改善肠道微生物的组成结构,减少肠道粘膜的损伤,维持肠道健康[27],所以其浓度可以用来表征膳食纤维的益生元活性[7]。不同粒径样品在48 h体外发酵过程中短链脂肪酸的产量如图5所示,从图中可以看出,WS的产酸量均高于IB,两组样品随着粒径减小,产酸量提高,与产气情况一致。FOS作为阳性对照,乙酸产量始终最高,24 h和48 h时丙酸和丁酸的产量也显著高于样品组(P<0.05)。与FOS相比,前12 h内不同粒径的WS和IB在产丙酸方面都有一定优势,从图中可以看到前12 h六种样品的丙酸产量均高于FOS,该结果与之前的报道较为一致[6],这是由于丙酸主要由膳食纤维中的葡萄糖、木糖、甘露糖等发酵而来,丙酸盐能够抑制内源性胆固醇的合成,还是一种有效的肝脏糖异生底物,对代谢健康产生积极影响[28]。不同粒径IB在丁酸产量上没有明显差异,而不同粒径WS丁酸产量差异显著(P<0.05),WS-500的丁酸产量显著高于WS-200和WS-40,造成两组样品差异的原因可能与其淀粉含量有关,IB中淀粉含量较WS中低(表1),而生淀粉颗粒在发酵过程中对丁酸产量的增加具有重要贡献[19],WS粒径越小,发酵速度越快,到达发酵平台的时间越早,可以为微生物利用乙酸和乳酸交互共生提供足够的时间,从而产生更多的丁酸[13]。
2.6 肠道菌群组成丰度
通过16s rRNA基因测序,定量分析体外发酵48 h后肠道菌群分别在门水平(A)和属水平(B)上的组成丰度,结果如图6所示。从门水平上看,与空白组相比,FOS显著促进了Actinobacteria的丰度,而WS和IB则对Bacteroidetes丰度的增值效果更为明显,同时也一定程度上促进了Firmicutes的相对丰度。FOS作为阳性对照,具有公认的益生元效应,可以促进多种Actinobacteria的丰度[19]。从粒径大小的对比来看,在WS组中,随着粒径减小,Firmicutes的相对丰度也逐渐增高,这一现象在IB组中有一些差异,IB-200组Firmicutes的丰度高于IB-40,但IB-500组中Firmicutes的丰度反而有所下降,而Actinobacteria的丰度显著增加了,推测超微粉碎改性得到的IB-500比表面积更大,更适合具有粘附能力的Actinobacteria所粘附利用,从而快速生长[29]。
![]() 图 6 不同样品体外发酵48 h后肠道菌群在门水平(A)和属水平(B)上的物种组成丰度注:Blank:空白对照;FOS:低聚果糖;图7~图8同。Figure 6. Microbial community composition at the phylum level (A) and genus level (B) after 48 h in vitro fecal fermentation
图 6 不同样品体外发酵48 h后肠道菌群在门水平(A)和属水平(B)上的物种组成丰度注:Blank:空白对照;FOS:低聚果糖;图7~图8同。Figure 6. Microbial community composition at the phylum level (A) and genus level (B) after 48 h in vitro fecal fermentation在属水平上,FOS对Bifidobacterium丰度的促进尤为明显,这与之前的报道一致。Bifidobacterium 作为一种重要的肠道有益菌可以促进碳水化合物酵解转化形成乳酸和乙酸[30],这应该是FOS组具有较高的乙酸和丙酸含量的原因。与空白组相比,WS和IB均促进了Bacteroides的相对丰度,且WS的促进效果要优于IB,Bacteroides是人体肠道菌群中一类最基本的降解多糖的菌属,具有非常广泛的糖化作用,能够有效酵解部分难以消化的膳食纤维[6]。与WS相比,IB的优势显示在对Ruminococcaceae ruminococcus和Lachnospira两种菌属丰度水平的促进上,其中Ruminococcaceae ruminococcus可以发酵不溶性膳食纤维中的纤维二糖和纤维素并产生乙酸和丁酸[6]。从粒径角度分析,WS和IB两组样品对Bacteroides的促进效果均呈现出粒径越小,促进效果越好的趋势。值得注意的是,与WS-200和IB-200相比,在WS-500和IB-500组中均观察到Ruminococcaceae ruminococcus和Lachnospira相对丰度的降低,尤其是Lachnospira,这可能说明不同的菌属对于底物粒径的选择有不同的偏好[31],Lachnospira可能更偏向于利用粒径适中的底物。此外,IB-500对Bifidobacterium丰度也有一定的促进作用,且该效果明显高于IB-40和IB-200。益生菌菌株与膳食纤维的相互作用是其发挥益生效果的一个重要因素,Bifidobacterium对膳食纤维有很大的粘附力,对纤维素的粘附机制主要涉及疏水相互作用和静电相互作用[32],因此IB-500可能因其粒径较小,比表面积较大,增强了其与Bifidobacterium的粘附作用,进一步显著促进了Bifidobacterium的丰度。
2.7 ASV水平肠道菌群丰度分析
各样品在体外发酵48 h后肠道菌群中最丰富的ASVs和关键ASV(绿色显示)的组成差异在聚类热图(图7)中进行了更直观的展示。与空白组相比,FOS明显提高了ASV9013、ASV8209、ASV13871和ASV189这四个ASV的相对丰度。6个样品组的颜色区域与空白组和FOS组相比均有明显不同,表明WS和IB的酵解显著改变了肠道菌群的组成。从图中可以注意到WS和IB的发酵在降低了ASV18112、ASV21919、ASV9013、ASV542和ASV8209几个ASV的同时显著提高了unidentified Lachnospiraceae ASV168和unidentified Clostridiales ASV16610、ASV4234和ASV4936的相对丰度(P<0.05)。两组样品相比,WS还促进了Bacteroides ASV26058、ASV6075、ASV9536的相对丰度,IB则显示出对unidentified Lachnospiraceae ASV26400、Lachnospira ASV13961以及Ruminococcus ASV6393等ASV的促进。随着粒径的减小,WS和IB组中ASV168、ASV16610、ASV4234和ASV4936等几个ASV的热图颜色均越深,说明粒径越小,WS和IB对上述ASV的丰度增加越显著(P<0.05)。值得注意的是,unidentified Lachnospiraceae ASV26400和Lachnospira ASV13961两个ASV的丰度变化有所不同,WS-500和IB-500相比于WS-200和IB-200均使其相对丰度显著下降(P<0.05),这也与属水平上观察到的现象相符,这可能是由于Lachnospira中的不同种科类其对于底物颗粒大小有不同的偏好[31]。与之相反,只有WS-500和IB-500的发酵促进了Bacteroides ASV13871的相对丰度,且IB-500的促进效果更为显著(P<0.05),粒径较大的40目组和200目组均没有促进效果,前期研究表明,B. uniformis会趋向于在较小颗粒的玉米麸皮颗粒上聚集[31]。此外,只有IB-500显著提高了Bifidobacterium ASV189的相对丰度,这与属水平上IB-500显著促进Bifidobacterium相对丰度的结果一致,表明不同种属的肠道微生物对底物的粒径有不同的偏好。
2.8 肠道菌群组成结构的PCA图分析
针对上述不同样品体外发酵48 h后肠道微生物群落的差异,PCA图(图8)给出了更为直观的主成分分析结果。前两个主成分捕获了81.25%的微生物群落变异(PC1:56.98%,PC2:24.27%)。FOS与Bifidobacterium ASV9013显著相关(P<0.05),与前述分析一致。WS组和IB组相比,相同粒径下的IB对Phascolarctobacterium ASV559和Ruminocccus ASV6393的贡献均比WS更大,这可能是由于IB中的膳食纤维纯度更高,更有利于促进有益菌的生殖,即具有更好的益生效应[33]。从粒径大小分析,WS-40 与 WS-200 以及 IB-40 与 IB-200 在 PCA 图中均没有显著分离,都与ASV26400、ASV559、ASV6393有关;而WS-500和IB-500则产生了明显的分离,说明粒径的急剧减小对于微生物群落变异有显著的影响,与Yao等[13]对多种不同粒径膳食纤维(谷物、豆类、坚果、蔬菜、水果和麸皮)的研究结果一致,即不同粒径底物的发酵结果不同,且粒径对不同化学成分膳食纤维底物的发酵结果的影响也不一致。粒径接近的WS-500和IB-500就产生了不同的发酵结果,WS-500与unidentified Lachnospiraceae ASV168和unidentified Clostridiales ASV4234高度相关,而IB-500则与Bacteroides ASV13871和Bifidobacterium ASV189高度相关,具有更为显著的益生效果。其中Bacteroides不仅能够通过多糖利用位点(polysaccharide utilization loci,PULs)来编码多糖降解系统的基因簇来降解半纤维素等,还可以使用PUL机制参与与其相邻微生物Eubacterium ramulus之间的交互共生关系[34]。由于IB含有结合酚,所以当Bacteroides利用其多糖部分将葡萄糖发酵转化为丁酸的同时还能促使Eubacterium ramulus降解黄酮类化合物,这种PUL介导的种间互生过程不仅有利于肠道微生物获得所需的营养物质,对人类肠道健康也可能起到有益的作用[35]。相同粒径大小的IB较WS具有更好的、更为明确的益生元活性,促进有益菌的生殖,改善肠道菌群结构。
3. 结论
经过超微粉碎后,WS和IB的粒径急剧减小,比表面积显著增大,其中的结合酚更均匀地分散于颗粒表面。体外发酵实验证明了WS和IB都具有慢发酵性,可以产生丰富的乙酸、丁酸等短链脂肪酸,其发酵速率和产酸量均随着粒径的减小而提高,且WS的发酵速率和产酸量均高于对应粒径的IB。菌群组成分析发现粒径越小的WS和IB对Bacteroides丰度的促进效果也越显著,但是部分有益菌对底物粒度表现出不同的偏好,其中Lachnospira倾向于在较大粒径的样品组中增殖。IB中膳食纤维的纯度更高,使得相同粒径分级下IB对肠道菌群组成的正向调控作用比WS更为显著,可以促进Bacteroides、Bifidobacterium和Ruminococcaceae ruminococcus等有益菌的相对丰度。底物成分和粒径大小会共同决定发酵结果,在实际应用中应该选择膳食纤维含量更高的底物,并通过粉碎方法适当降低其粒径以获得更好的益生效应。
-
图 4 不同样品体外发酵48 h过程中的产气情况
注:相同时间点上不同的小写字母表示具有显著差异(P<0.05);FOS:低聚果糖;图5同。
Figure 4. Gas production during 48 h in vitro fecal fermentation time course
图 6 不同样品体外发酵48 h后肠道菌群在门水平(A)和属水平(B)上的物种组成丰度
注:Blank:空白对照;FOS:低聚果糖;图7~图8同。
Figure 6. Microbial community composition at the phylum level (A) and genus level (B) after 48 h in vitro fecal fermentation
表 1 WS和IB的主要成分
Table 1 Main components of WS and IB
样品 淀粉
(%)蛋白质
(%)纤维素
(%)半纤维素
(%)木质素
(%)多酚
(mg GAE/g)阿魏酸
(μg/g)WS 19.49±1.33 2.95±0.67 28.64±2.01 32.65±0.93 1.37±1.40 1.848±0.09 228.0±11.2 IB 4.01±0.89 0.51±0.08 59.21±1.04 17.29±1.25 1.91±0.78 1.598±0.03 203.2±7.8 注:WS:白芸豆皮;IB:含结合酚不溶性膳食纤维。 表 2 不同样品的粒径分布和比表面积
Table 2 Particle size and specific surface area of different samples
样品 D [3,2](μm) D [4,3](μm) Dx (10) (μm) Dx (50)(μm) Dx (90)(μm) SSA(m²/kg) WS-40 329.33±9.29d 575.00±6.24e 297.00±3.60d 546.00±5.29f 920.67±9.61e 18.24±0.51a WS-200 59.93±0.25b 127.67±0.58c 36.73±0.65b 121.00±0.00d 225.33±1.15c 100.12±0.38c WS-500 13.53±0.25a 33.00±4.21a 6.18±0.06a 19.87±0.45a 49.30±2.75a 442.97±7.85e IB-40 143.67±6.11c 480.67±2.52d 266.00±13.86c 486.33±0.58e 730.67±3.51d 41.84±1.81b IB-200 56.50±1.31b 111.33±0.58b 38.63±4.48b 107.00±0.00c 189.67±3.51b 106.27±2.46c IB-500 16.63±0.05a 28.27±0.06a 7.88±0.02a 25.13±0.15b 53.23±0.32a 360.60±1.57d 注:同列右肩不同的小写字母表示具有显著差异(P<0.05);D [3,2]为颗粒比表面积平均粒径;D [4,3]为颗粒体积平均粒径;Dx (10)、Dx (50)和Dx (90)值分别代表小于此粒径的颗粒体积含量占全部颗粒的10%、50%和90%;SSA为颗粒比表面积。 -
[1] MA Y, RANG Y, YANG R, et al. Effect of white kidney bean extracts on estimated glycemic index of different kinds of porridge[J]. LWT,2018,96:576−582.
[2] CHAN Y S, XIA L, NG T B. White kidney bean lectin exerts anti-proliferative and apoptotic effects on cancer cells[J]. International Journal of Biological Macromolecules,2016,85:335−345.
[3] MENG J, BAI Z, HUANG W, et al. Polysaccharide from white kidney bean can improve hyperglycemia and hyperlipidemia in diabetic rats[J]. Bioactive Carbohydrates and Dietary Fibre,2020,24:100222.
[4] 李晓宁, 郭咪咪, 段章群. 酸法制取大豆皮可溶性膳食纤维[J]. 中国油脂,2020,45(11):32−35,51. [LI Xiaoning, GUO Mimi, DUAN Zhangqun. Preparation of soluble dietary fiber from soybean hull by acid hydrolysis method[J]. China Oils and Fats,2020,45(11):32−35,51.] doi: 10.12166/j.zgyz.1003-7969/2020.11.007 LI Xiaoning, GUO Mimi, DUAN Zhangqun. Preparation of soluble dietary fiber from soybean hull by acid hydrolysis method[J]. China Oils and Fats, 2020, 45(11): 32−35,51. doi: 10.12166/j.zgyz.1003-7969/2020.11.007
[5] MUDGIL D, BARAK S. Composition, properties and health benefits of indigestible carbohydrate polymers as dietary fiber:A review[J]. International Journal of Biological Macromolecules,2013,61:1−6.
[6] WANG S, XIA J, DE PAEPE K, et al. Ultra-high pressure treatment controls in vitro fecal fermentation rate of insoluble dietary fiber from Rosa roxburghii Tratt pomace and induces butyrogenic shifts in microbiota composition[J]. Journal of Agricultural and Food Chemistry,2021,69(36):10638−10647.
[7] GE Q, LI H Q, ZHENG Z Y, et al. In vitro fecal fermentation characteristics of bamboo insoluble dietary fiber and its impacts on human gut microbiota[J]. Food Research International,2022,156:111173.
[8] SAURA-CALIXTO F. Dietary fiber as a carrier of dietary antioxidants:An essential physiological function[J]. Journal of Agricultural and Food Chemistry,2011,59(1):43−49.
[9] ZHAO X, YANG Z, GAI G, et al. Effect of superfine grinding on properties of ginger powder[J]. Journal of Food Engineering,2009,91(2):217−222.
[10] ZHU F, DU B, XU B. Superfine grinding improves functional properties and antioxidant capacities of bran dietary fibre from qingke (hull-less barley) grown in Qinghai-Tibet Plateau, China[J]. Journal of Cereal Science,2015,65:43−47.
[11] XIONG X, CAO X, ZENG Q, et al. Effects of heat pump drying and superfine grinding on the composition of bound phenolics, morphology and microstructure of lychee juice by-products[J]. LWT,2021,144:111206.
[12] DAY L, GOMEZ J, ØISETH S K, et al. Faster fermentation of cooked carrot cell clusters compared to cell wall fragments in vitro by porcine feces[J]. Journal of Agricultural and Food Chemistry,2012,60(12):3282−3290.
[13] YAO H, FLANAGAN B M, WILLIAMS B A, et al. Particle size of dietary fibre has diverse effects on in vitro gut fermentation rate and end-products depending on food source[J]. Food Hydrocolloids,2023,134:108096.
[14] GO I I, GARCIA-ALONSO A, SAURA-CALIXTO F. A starch hydrolysis procedure to estimate glycemic index[J]. Nutrition Research,1997,17(3):427−437.
[15] HOSSAIN M A, RAHMAN S M M. Total phenolics, flavonoids and antioxidant activity of tropical fruit pineapple[J]. Food Research International,2011,44(3):672−676.
[16] ZHU J, ZHANG B, WANG B, et al. In-vitro inhibitory effects of flavonoids in Rosa roxburghii and R. Sterilis fruits on α-glucosidase:Effect of stomach digestion on flavonoids alone and in combination with acarbose[J]. Journal of Functional Foods,2019,54:13−21.
[17] GARCIA-AMEZQUITA L E, TEJADA-ORTIGOZA V, HEREDIA-OLEA E, et al. Differences in the dietary fiber content of fruits and their by-products quantified by conventional and integrated aoac official methodologies[J]. Journal of Food Composition and Analysis,2018,67:77−85.
[18] PHAN A D T, NETZEL G, WANG D, et al. Binding of dietary polyphenols to cellulose:Structural and nutritional aspects[J]. Food Chemistry,2015,171:388−396.
[19] WANG S, ZHANG B, CHEN T, et al. Chemical cross-linking controls in vitro fecal fermentation rate of high-amylose maize starches and regulates gut microbiota composition[J]. Journal of Agricultural and Food Chemistry,2019,67(49):13728−13736.
[20] 吴振, 詹永, 李红, 等. 超微粉碎对山银花微粒结构、有效成分及其抗氧化能力的影响[J]. 食品与机械,2018,34(11):40−44. [WU Zhen, ZHAN Yong, LI Hong, et al. Effect of ultrafine grinding on particle structure, effective compositions and antioxidant activity of L. macranthoides[J]. Food and Machinery,2018,34(11):40−44.] doi: 10.13652/j.issn.1003-5788.2018.11.009 WU Zhen, ZHAN Yong, LI Hong, et al. Effect of ultrafine grinding on particle structure, effective compositions and antioxidant activity of L. macranthoides[J]. Food and Machinery, 2018, 34(11): 40−44. doi: 10.13652/j.issn.1003-5788.2018.11.009
[21] ZHANG S, XU X, CAO X, et al. The structural characteristics of dietary fibers from Tremella fuciformis and their hypolipidemic effects in mice[J]. Food Science and Human Wellness,2023,12(2):503−511.
[22] GAO W, CHEN F, WANG X, et al. Recent advances in processing food powders by using superfine grinding techniques:A review[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):2222−2255.
[23] MEHTA D, CHATURVEDI K, SIDANA A, et al. Processing treatment of atmospheric- and vacuum-cold plasma improved physical properties, glucose diffusion and fermentability of dietary fibers extracted from de-oiled rice and corn bran[J]. Bioactive Carbohydrates and Dietary Fibre,2022,28:100326.
[24] PHAN A D T, FLANAGAN B M, D'ARCY B R. et al. Binding selectivity of dietary polyphenols to different plant cell wall components:Quantification and mechanism[J]. Food Chemistry,2017,233:216−227.
[25] WANG S, DHITAL S, WANG K, et al. Side-by-side and exo-pitting degradation mechanism revealed from in vitro human fecal fermentation of granular starches[J]. Carbohydrate Polymers,2021,263:118003.
[26] WANG M, WICHIENCHOT S, HE X, et al. In vitro colonic fermentation of dietary fibers:Fermentation rate, short-chain fatty acid production and changes in microbiota[J]. Trends in Food Science & Technology,2019,88:1−9.
[27] TAN J K, MACIA L, MACKAY C R. Dietary fiber and SCFAs in the regulation of mucosal immunity[J]. Journal of Allergy and Clinical Immunology,2023,151(2):361−370.
[28] TEJADA-ORTIGOZA V, GARCIA-AMEZQUITA L E, CAMPANELLA O H, et al. Extrusion effect on in vitro fecal fermentation of fruit peels used as dietary fiber sources[J]. LWT,2022,153:112569.
[29] YU M, ARIOĞLU-TUNCIL S, XIE Z, et al. In vitro fecal fermentation profiles and microbiota responses of pulse cell wall polysaccharides:Enterotype effect[J]. Food & Function,2021,12(18):8376−8385.
[30] LU Y, PUTRA S D, LIU S Q. A novel non-dairy beverage from durian pulp fermented with selected probiotics and yeast[J]. International Journal of Food Microbiology,2018,265:1−8.
[31] THAKKAR R D, TUNCIL Y E, HAMAKER B R, et al. Maize bran particle size governs the community composition and metabolic output of human gut microbiota in in vitro fermentations[J]. Frontiers in Microbiology, 2020, 11.
[32] TANIGUCHI M, NAMBU M, KATAKURA Y, et al. Adhesion mechanisms of Bifidobacterium animalis subsp. lactis JCM 10602 to dietary fiber[J]. Bioscience of Microbiota, Food and Health,2021,40(1):59−64.
[33] MAKKI K, DEEHAN E C, WALTER J, et al. The impact of dietary fiber on gut microbiota in host health and disease[J]. Cell Host & Microbe,2018,23(6):705−715.
[34] MAHOWALD M A, REY F E, SEEDORF H, et al. Characterizing a model human gut microbiota composed of members of its two dominant bacterial phyla[J]. Proceedings of the National Academy of Sciences,2009,106(14):5859−5864.
[35] TAUZIN A S, LAVILLE E, XIAO Y, et al. Functional characterization of a gene locus from an uncultured gut bacteroides conferring xylo-oligosaccharides utilization to Escherichia coli[J]. Molecular Microbiology,2016,102(4):579−592.





 下载:
下载:





 下载:
下载:



