Effects of Coix Seed on Intestinal Flora Dextran Sulfate Sodium-induced Ulcerative Colitis in Mice
-
摘要: 目的:研究薏苡仁对葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠结肠炎症及肠道菌群的影响,探究其改善作用机制。方法:小鼠自由饮用3.5%葡聚糖硫酸钠(Dextran sulfate sodium,DSS)溶液7 d制备溃疡性结肠炎模型,同时给予小鼠灌胃薏苡仁水提物进行治疗,试验期间记录小鼠的体重变化、疾病活动指数(Disease activity index,DAI)评分、小鼠结肠长度。通过染色观察小鼠结肠组织病理学变化,检测小鼠结肠内炎症因子的水平,16S rDNA测序技术分析小鼠粪便肠道菌群变化,并通过Pearson系数对关键差异菌的相对丰度及炎症因子水平进行关联性分析。结果:与模型组比较,薏苡仁可以显著改善溃疡性结肠炎小鼠体重减轻,DAI评分升高,结肠缩短(其中CE组结肠平均长度恢复至7.27 cm),肠屏障受损及炎症因子水平升高等病理状态(P<0.05),有效调节结肠炎小鼠肠道菌群多样性变化。在门水平上,薏苡仁水提物可降低结肠炎小鼠变形菌门(Proteobacteria)相对丰度,增加拟杆菌门(Bacteroidetesa)相对丰度;在属水平上,薏苡仁水提物可以增加嗜黏蛋白阿克曼菌属(Akkermansia)和乳杆菌属(Lactobacillus)等与肠屏障修复相关菌属的相对丰度。进一步关联性分析发现薏苡仁调节的关键菌的相对丰度与炎症因子的水平高度关联。结论:薏苡仁可通过调节溃疡性结肠炎小鼠肠道菌群,降低炎症因子水平,修复结肠粘膜屏障,进而缓解结肠炎症状。Abstract: Objective: To investigate the effect of coix seed on colitis and intestinal flora in mice induced by dextran sulfate sodium (DSS) and explore its mechanism of action. Methods: UC was induced in mice by freely drinking 3.5% DSS solution for 7 d. The coix seed extractions (CE) were given to the mice by gavage for intervention. The changes in body weight, disease activity index (DAI) scores, and colon length of mice were recorded. Colonic histopathological changes were observed by staining, levels of inflammatory factors in the colon of mice were detected, and 16S rDNA sequencing technology was used to analyze changes in fecal intestinal flora of mice. Pearson correlation coefficient was used to analyze the correlation between the relative abundance of key differential bacteria and the levels of inflammatory factors. Results: Compared with the model group, CE significantly improved weight loss, prevented the increase of DAI scores, restored the colon length (the colon length of CE group restored to 7.27 cm), decreased intestinal barrier damage and levels of inflammatory factors in mice (P<0.05), CE could also effectively regulate the changes in intestinal flora diversity in mice with UC. At the phylum level, CE reduced the relative abundance of Proteobacteria and increased the relative abundance of Bacteroidetes in colitis mice. At the genus level, CE increased the relative abundance of Akkermansia and Lactobacillus, which were associated with intestinal barrier repair. Further correlation analysis revealed a strong association between the relative abundance of key bacteria regulated by CE and the levels of inflammatory factors. Conclusion: Coix seed can alleviate colitis symptoms of mice in UC by regulating the intestinal flora, reducing levels of inflammatory factors, repairing colonic mucosal barrier, and thus relieving colonic inflammation.
-
Keywords:
- coix seed /
- ulcerative colitis /
- inflammatory factors /
- intestinal flora /
- correlation analysis
-
溃疡性结肠炎(ulcerative colitis,UC)是一种反复发作的肠道慢性非特异性炎症性疾病,临床表现多为腹痛、腹泻、粘液脓血便等,病情容易反复,对于患者的生活、心理等方面都有十分严重的影响[1]。目前临床上UC治疗药物包括氨基水杨酸类药物、糖皮质激素和生物制剂等。但这些药物治疗伴随着复发率较高、毒副作用大、耐药性等问题[2]。因此,对UC治疗药物的进一步开发亟需进行。UC的发病机制复杂,研究发现其与肠屏障受损、肠道菌群失衡、免疫应答失调以及遗传等多方面有关[3]。其中,肠道菌群包含数万亿代谢活跃的微生物,是影响宿主生理的重要环境因素,参与机体多种生理病理过程。研究发现,肠道菌群失衡会导致肠道稳态被破坏,宿主体内免疫应答异常,进而引发肠粘膜损伤和炎症反应。另外,移植UC患者的肠道微生物群可能导致无菌小鼠肠道运动和屏障功能的改变[4]。以上研究表明,肠道微生物群可能是维持肠道稳态的关键介质,在UC疾病发展中起着重要调节作用。
薏苡仁(Coix lacryma-jobi L. var. mayuen (Roman.) Stapf)为一年或多年生禾本科植物薏苡的成熟种仁,我国大部分地区都有生产,是一种常见的药食两用类中药[5]。现代药理研究表明,薏苡仁具有抗肿瘤、降血糖、抗溃疡、止泻、消炎镇痛、降血脂等功效[6]。研究发现,薏苡仁水提液可以改善2,4,6-三硝基苯磺酸(2,4,6-Trinitrobenzenesulfonic acid solution,TNBS)导致的UC大鼠血清中白细胞介素6(Interleukin-6,IL-6)、白细胞介素10(Interleukin-10,IL-10)的变化,并抑制肠道免疫反应发挥抗炎作用[7]。同时,体外实验研究表明,薏苡仁提取液可以抑制体外细菌病原体(大肠杆菌、金黄色葡萄球菌和沙门氏菌属)的生长[8]。上述结果显示薏苡仁对UC具有一定的治疗作用,但其对UC肠道菌群的调节作用研究尚显不足,深入机制探讨有待展开。
葡聚糖硫酸钠(dextran sodium sulfate,DSS)可诱导制备UC小鼠模型,其诱导机制与巨噬细胞功能、肠道菌群结构、细胞因子分泌密切相关[9]。因此本研究拟通过DSS诱导的UC小鼠模型,观察薏苡仁水提物对UC小鼠疾病症状及肠道菌群的影响,探讨薏苡仁防治UC的“菌群—炎症”关联,阐明薏苡仁防治UC的可能机制,为UC防治和薏苡仁下游产品的开发提供新思路。
1. 材料与方法
1.1 材料与仪器
C57BL/6小鼠,6~8周龄,雄性,体重(22±2)g 购自河北医科大学(实验动物公共服务平台),动物许可证号SYXK(冀)2020-002,实验动物饲养于恒定温度(22±2)℃,湿度40%~60%,12 h光照/黑暗循环的环境中,动物实验遵照河北医科大学动物实验伦理委员会规定执行,动物福利伦理审查批文号为IACUC-Hebmu-P2023153;薏苡仁饮片 广东清源责任有限公司;DSS 大连美仑生物技术有限公司;肿瘤坏死因子-α(Tumor necrosis factor alpha,TNF-α)、IL-6、白细胞介素-22(Interleukin-22,IL-22)、酶联免疫吸附(Enzyme linked immunosorbent assay,ELISA)试剂盒 武汉爱博泰克生物科技有限公司;苏木精-伊红染液(Hematoxylin-eosin staining,HE)套装、阿利新蓝-过碘酸雪夫试剂染色(Alcian blue periodic acid schiff's reagent,AB-PAS)染液套装 武汉塞维尔生物科技有限公司。
TGL-20M台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;KZ-5F-3D三维冷冻研磨仪 武汉塞维尔生物科技有限公司;SB-2000型电子恒温不锈钢水浴锅 上海爱朗仪器制造有限公司;Eclipse E200型正置光学显微镜 日本尼康;京制00000246型电子天平(万分之一) 北京赛多利斯仪器系统有限公司;SC1ENTZ-10N/A实验型钟罩式冷冻干燥机 宁波新芝生物科技股份有限公司;N-1100型旋转蒸发仪 上海爱朗仪器有限公司。
1.2 实验方法
1.2.1 薏苡仁水提物的制备
取适量薏苡仁粉末(过20目筛),以1:20料液比加入蒸馏水,加热回流提取2 h,抽滤,滤渣重复提取1次,合并2次滤液,减压及冷冻干燥后得薏苡仁水提物(Coix seed extraction,CE)干粉。使用时用蒸馏水配制成CE溶液。
1.2.2 UC小鼠模型的建立及给药方案
小鼠随机分为3组,分别为正常组、模型组、CE组,每组7只。小鼠适应性喂养1周后,进行实验。除正常组外,其余组小鼠连续饮用7 d 3.5% DSS溶液。同时CE组小鼠灌胃给予CE溶液(6 mg/g,给药剂量根据《中国药典》中薏苡仁用量及基于实验动物体表面积折算法设置,小鼠与人等效剂量比值为12.3[7])干预治疗,正常组和模型组小鼠灌胃给予相同体积蒸馏水。
1.2.3 小鼠DAI评分及结肠长度测量
实验期间每日记录小鼠体重变化、粪便隐血时间及粪便性状,并参照文献[10]计算DAI评分(见表1),即DAI=(体重下降率+大便性状+便血情况)/3,以便评估UC进展程度。小鼠体重变化率=小鼠每日体重/小鼠初始体重。第8 d,腹腔注射适量戊巴比妥钠麻醉后,迅速脱颈处死。解剖后收集并记录小鼠结肠长度,留取小鼠结肠组织以待后续处理。
表 1 DAI评分标准Table 1. Scoring criteria for DAIDAI评分 体重下降率(%) 大便性状 便血情况 0 <1 正常 阴性 1 ≥1~5 软便 阴性 2 ≥5~10 软便 隐血阳性 3 ≥10~20 腹泻 隐血阳性 4 ≥20 腹泻 血便 1.2.4 小鼠结肠组织病理形态观察
取靠近直肠端约1~2 cm结肠组织,在4%多聚甲醛中固定12 h,使用乙醇脱水处理,随后进行石蜡包埋及切片(5 μm)。按照试剂盒说明书步骤进行HE及AB-PAS染色,并使用显微镜观察组织标本并记录图像。
1.2.5 小鼠结肠炎性因子水平的测定
取−80 ℃下保存的结肠组织加入1 mL磷酸盐缓冲液(PBS,0.1 mol/L,pH7.4)在4 ℃环境下均化,离心(4 ℃,10000×g,5 min)。根据ELISA试剂盒说明书测定结肠组织中TNF-α、IL-6、IL-22水平。
1.2.6 小鼠粪便内肠道菌群多样性检测
收集小鼠新鲜粪便,置于无菌管中,液氮速冻后,置于−80 ℃冰箱保存。对粪便微生物进行16S rDNA测序分析,主要步骤如下:对样本进行DNA提取与检测,用正向引物338F(5’-ACTCCTACGGGAGGCAGCA-3’)和反向引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)对V3~V4区进行PCR扩增,并基于illumina平台进行测序。使用Vsearch软件过滤和按拆分样本后,进行OTUs(Operational taxonomic units)聚类和物种注释。通过机器学习或序列比对进行物种注释分析,获得分类学信息并统计样本群落组成,筛选关键差异菌。测序相关工作由上海派森诺公司完成。
1.2.7 肠道菌群与炎症因子关联性分析
选取在门、属水平中的关键差异菌,与TNF-α、IL-6、IL-22三种炎症因子的水平进行Pearson关联性分析,P值选择为双尾,置信区间为95%。
1.3 数据处理
采用Graph Pad Prism 8.0.1作图软件进行数据分析及处理,实验数据以平均值±标准差(x±s)表示,多组样本均值采用单因素方差分析(ANOVA),两两比较采用LSD检验及Dunnett’s T3检验。P<0.05表明差异具有统计学意义。
2. 结果与分析
2.1 薏苡仁水提物对UC小鼠体重、DAI评分及结肠长度的影响
DSS的使用可以造成肠道粘膜损伤并引发肠道内的炎症反应,因此常被用来诱导结肠炎的产生[11]。实验期间小鼠体质量变化率及DAI评分变化如图1A、图1B所示,与正常组相比,模型组小鼠均出现体重减轻,食量减少,毛发失去光泽等表现。造模第4 d起,模型组小鼠出现稀便甚至血便,DAI评分逐步升高。与模型组相比,CE组小鼠的状态有所好转,体重与DAI评分均有所恢复。实验第5 d,CE组小鼠DAI评分与模型组相比具有统计学差异(P<0.01)。
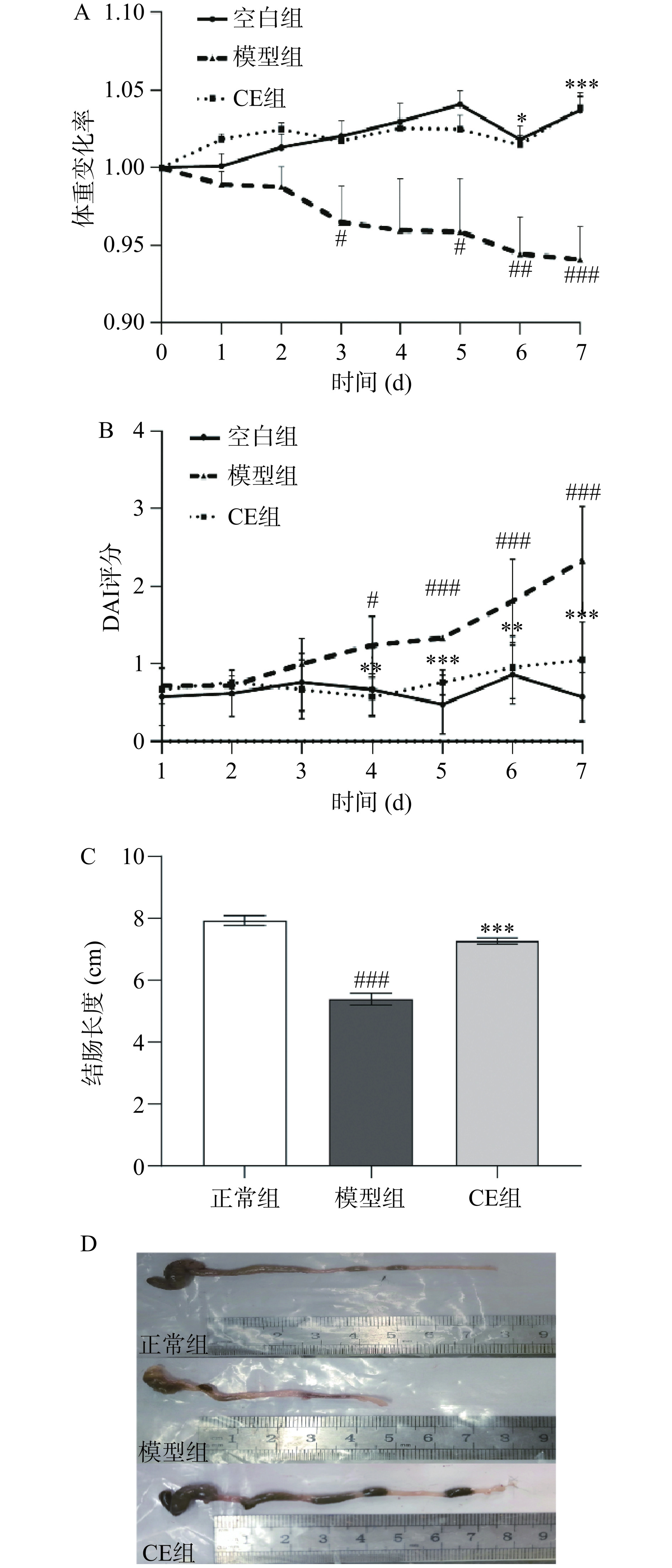
![]() 图 1 小鼠体重、DAI评分及结肠长度变化注:A为体重变化率;B为DAI评分;C为结肠长度;D为结肠组织图片;与正常组比较,##P<0.01,###P<0.005;与模型组比较,*P<0.05,**P<0.01,***P<0.005,图3同。Figure 1. Changes of body weight, DAI, and colon length in mice
图 1 小鼠体重、DAI评分及结肠长度变化注:A为体重变化率;B为DAI评分;C为结肠长度;D为结肠组织图片;与正常组比较,##P<0.01,###P<0.005;与模型组比较,*P<0.05,**P<0.01,***P<0.005,图3同。Figure 1. Changes of body weight, DAI, and colon length in mice结肠长度的变化能够反映肠道炎症的程度和肠道组织的损伤程度。由于炎症反应的存在,在结肠炎模型中结肠黏膜会出现不同程度的缩短或者变形,导致结肠长度的减小[12]。试验结束后收集并记录小鼠结肠长度进行分析,结果如图1C、图1D所示,正常组小鼠结肠平均长度为7.93 cm,与正常组相比,模型组小鼠结肠平均长度显著缩短为5.39 cm(P<0.005),而给予CE治疗后小鼠结肠平均长度恢复至7.27 cm,与模型组相比差异具有统计学意义(P<0.005)。以上数据表明CE能够一定程度改善UC小鼠的疾病状况。
2.2 薏苡仁水提物对UC小鼠结肠病理组织损伤的影响
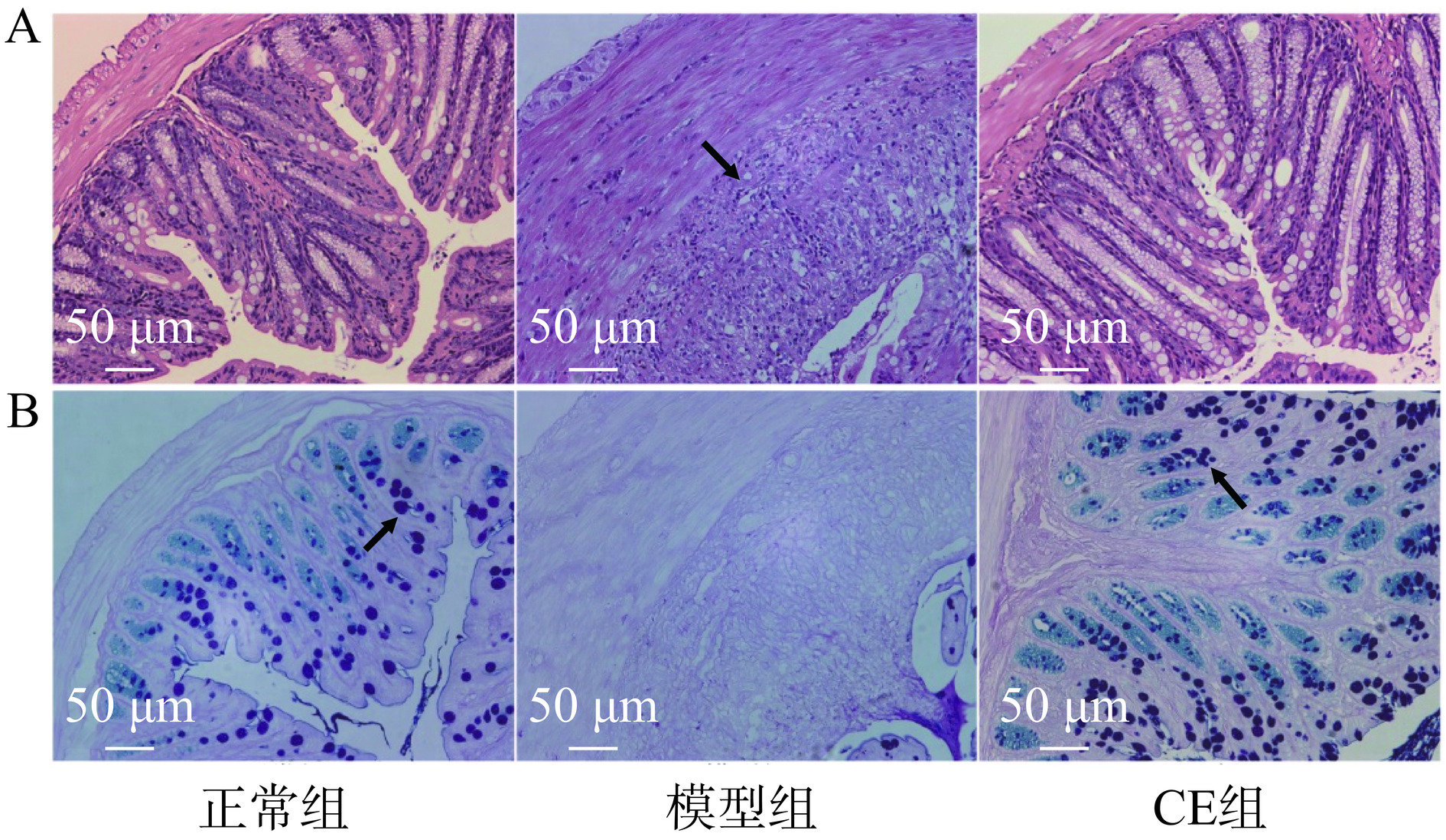
炎性细胞浸润[13],杯状细胞数量减少均是结肠炎的典型特征之一[14]。对不同组别小鼠的结肠组织切片进行HE染色,结果如图2A所示,与正常组相比,模型组小鼠结肠组织出现大面积炎性浸润,隐窝结构受损,而CE组小鼠结肠炎性浸润减少,部分隐窝结构较模型组有所恢复。AB-PAS染色结果如图2B所示,与正常组相比,模型组小鼠结肠组织中杯状细胞数量减少;与模型组相比,CE组小鼠结肠组织中杯状细胞的数量趋于正常。表明CE治疗可一定程度上改善UC小鼠的结肠病理组织损伤。
2.3 薏苡仁水提物对UC小鼠炎症因子水平的影响
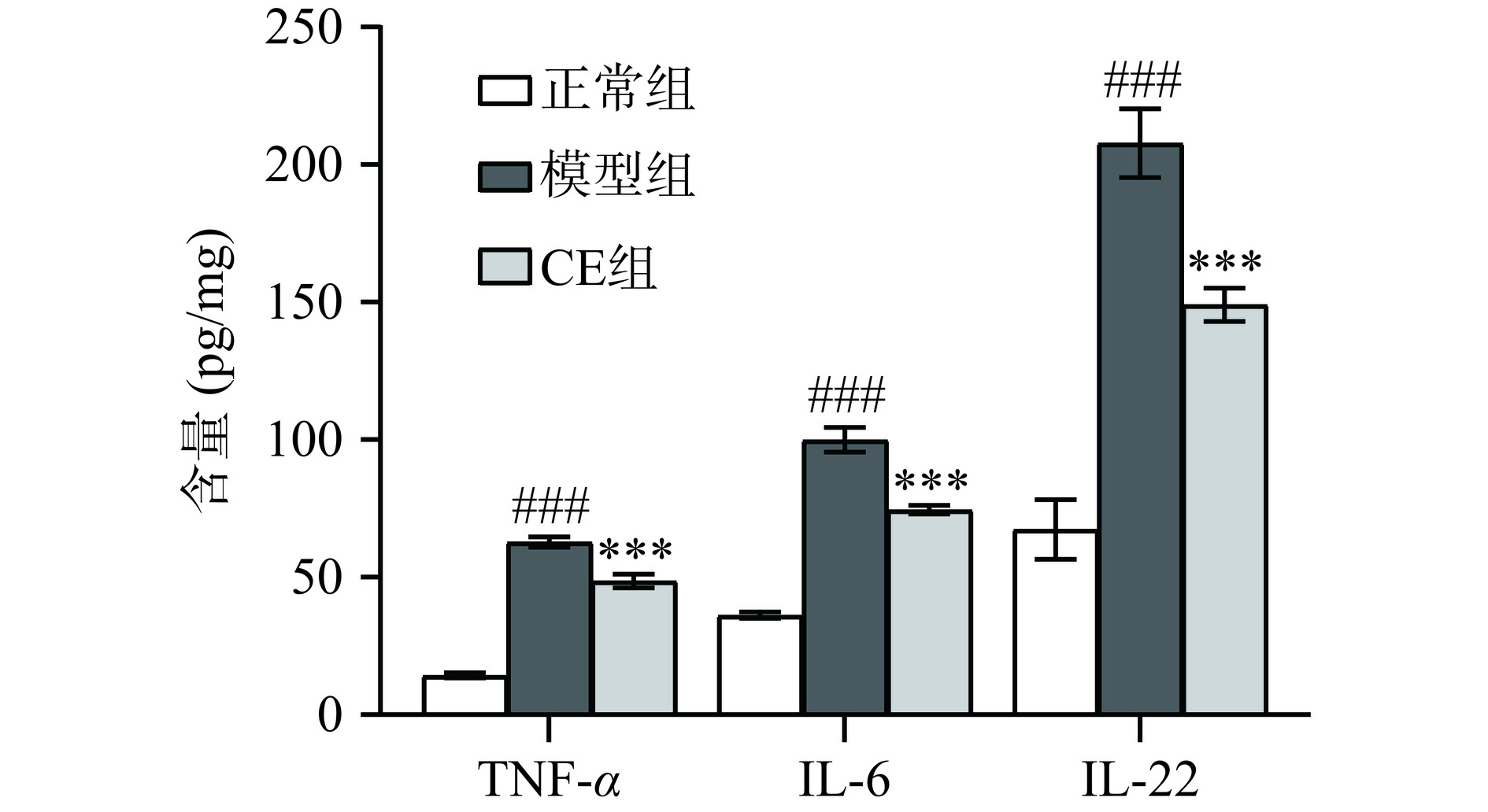
在UC疾病过程中,促炎因子TNF-α、IL-6是导致肠黏膜损害及微循环障碍的重要因素[15]。IL-22可影响肠粘膜中紧密连接蛋白的表达,调节肠上皮屏障的功能与完整性[16]。因此,进一步对小鼠结肠内炎症因子TNF-α、IL-6、IL-22的水平进行检测。结果如图3所示,与正常组相比,模型组小鼠结肠中促炎因子TNF-α、IL-6、IL-22水平显著升高,与模型组相比,CE组小鼠结肠内炎症因子水平显著降低(P<0.05)。以上结果表明CE可以显著抑制DSS造成的UC小鼠结肠内炎症因子的水平升高。
2.4 薏苡仁水提物对UC小鼠肠道菌群的影响
2.4.1 OTU聚类分析
通过ASV/OTU值绘制Venn图以研究不同组别中物种的OTU个数[17]。结果如图4所示,三组样本共产生9246个OTU,其中正常组有3961个,模型组有2623个,CE组有3854个。OTU数量可以反映微生物群落的多样性,且OUT数值越大代表微生物群落多样性越大。上述数据提示DSS处理降低了小鼠肠道菌群生物多样性,CE的治疗可以增加其肠道菌群生物多样性。其中模型组与正常组间共有的OTU有544个,正常组与CE组共有的OTU有485个,三组间共有的OTU有246个。
2.4.2 多样性分析
Alpha多样性可以反应物种丰富度和均匀度。Observed Species指数和Chao指数是常见的表征Alpha多样性的参数[18],其反映了样品中群落的丰度,指数数值越大,说明样品中物种越丰富。结果如图5A、图5B所示,模型组的Observed Species和Chao指数均低于正常组与CE治疗组,说明UC小鼠肠道菌群物种丰富度降低,而CE治疗可以一定程度恢复UC小鼠肠道菌群物种丰富度。
Beta多样性指数聚焦于不同生境间多样性的比较,也就是样本间的差异。主坐标分析(Principal coordinates analysis,PCoA)便是一种经典的非约束排序分析方法[19]。它可将样本距离矩阵投影至低维度空间展开,以样本距离为整体考虑,相比于主成分分析(Principal components analysis,PCA)更符合生态学数据特征。因此,进一步对肠道菌群测序结果进行PCoA分析,结果如图5C所示,模型组与正常组样本间的差异明显,而CE治疗可以减少模型组与正常组间的样本差异。
2.4.3 肠道菌群物种组成变化
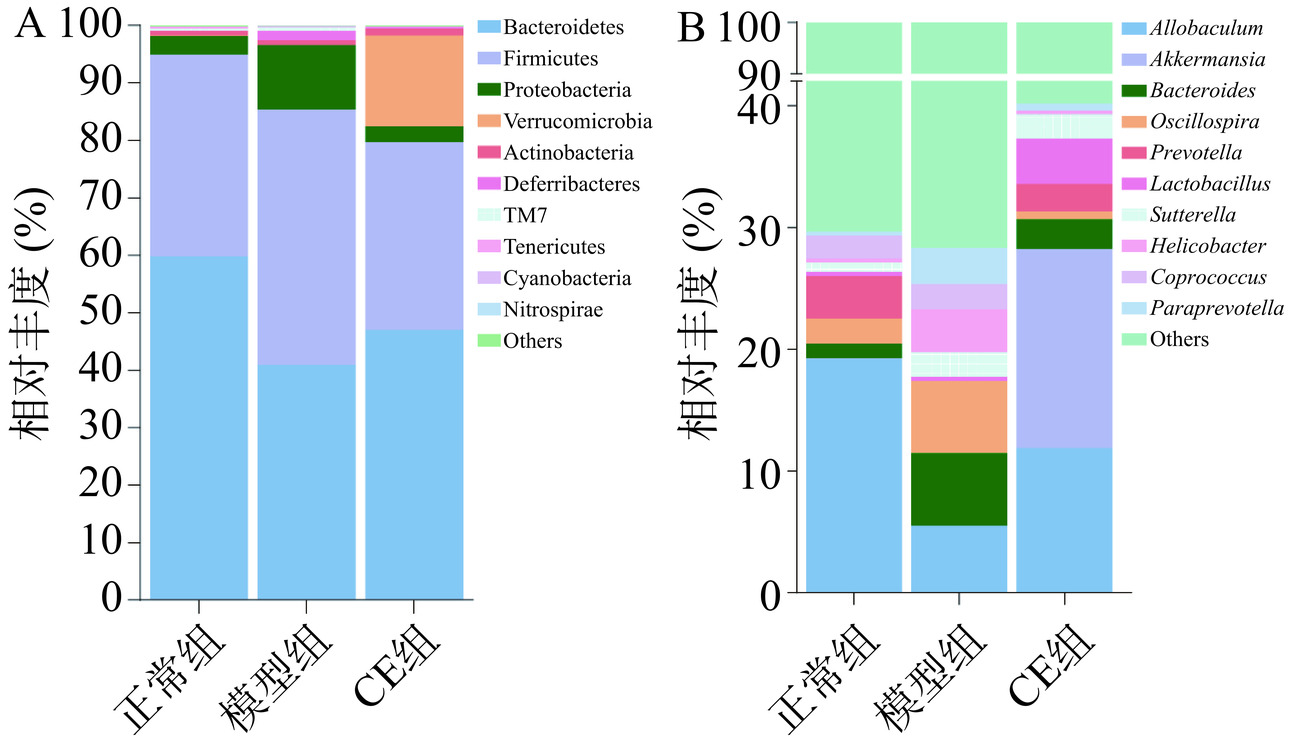
通过与数据库比对,将OTU在不同的分类等级进行分类并注释,得到物种注释柱状图。如图6所示,在门水平上,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)的相对丰度在所有样品中占绝对优势,其相对丰度之和均在80%以上。与正常组相比,模型组中Bacteroidetes相对丰度降低,Firmicutes、Proteobacteria、疣微菌门(Verrucomicrobia)等相对丰度升高。在属水平上,与正常组相比,模型组中异杆菌属(Allobaculun)、普雷沃氏菌属(Prevotella)相对丰度降低,拟杆菌属(Bacteroides)、幽门杆菌属(Helicobacter)相对丰度升高,而给予CE治疗后,以上菌门、菌属的相对丰度变化可一定程度向正常组恢复,提示CE对UC小鼠肠道菌群紊乱现象具有调节作用。
2.4.4 肠道菌群物种差异性分析
线性判别分析(Linear discriminant analysis, LDA)结果如图7所示,正常组、模型组、CE组分别有4、19、9种关键微生物类群。其中,正常组小鼠肠道菌群差异物种主要属于拟杆菌门(Prevotella、S24_7和Prevotellaceae),模型组小鼠肠道菌群差异物种主要属于厚壁菌门(Firmicutes、Clostridiales和Lachnospiraceae)、变形菌门(Proteobacteria、Desulfovibrionaceae和Helicobacteraceae),CE组中小鼠肠道菌群差异物种主要属于疣微菌门(Verrucomicrobiales和Akkermansia)和厚壁菌门(Lactobacillales、Lactobacillus和Biacilli)。
2.5 肠道菌群与炎症因子相关性分析
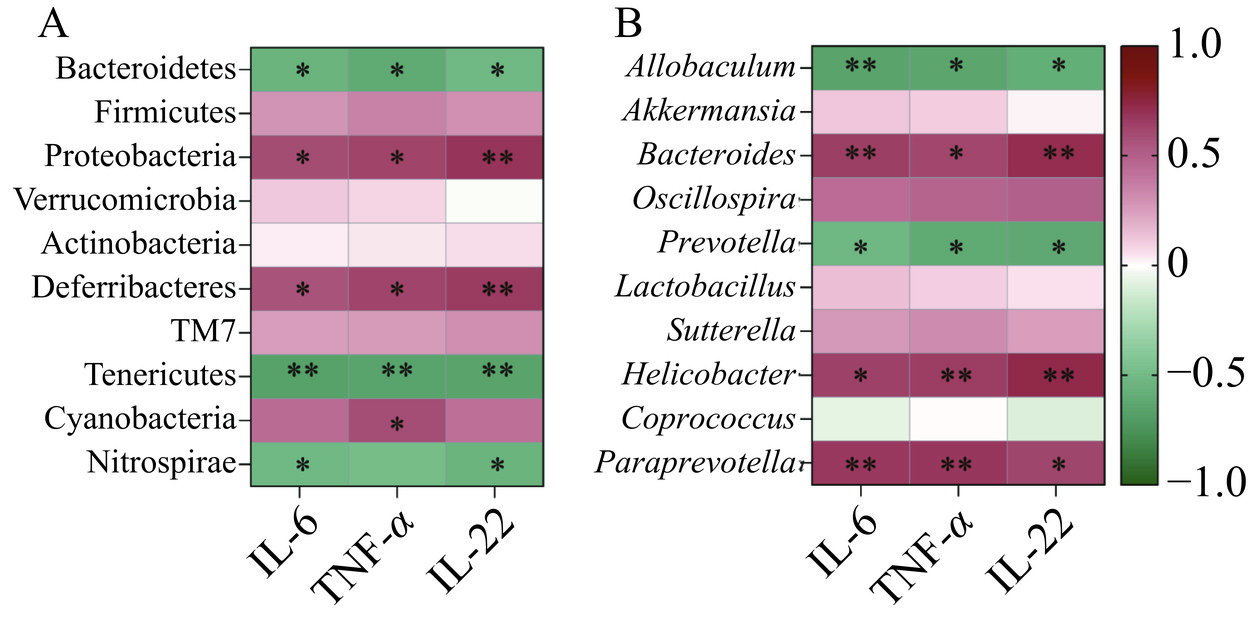
为探究CE治疗下关键差异菌与炎症因子的关联性,将关键差异菌的相对丰度与IL-6、TNF-α、IL-22三种炎症因子水平进行Pearson相关性分析,结果如图8所示。其中,Bacteroidetes、软壁菌门(Tenericutes)、Allobaculum、Prevotella与3种炎症因子均存在中高强度的负相关性,Proteobacteria、脱铁杆菌门(Deferribacteres)、Bacteroides、Helicobacter则与3种炎症因子存在中高强度的正相关性(P<0.01)。这提示我们CE调节菌群变化与肠道炎症存在相关性。
3. 讨论与结论
UC的发病机制多认为与环境、遗传因素相关,其中肠粘膜屏障功能损伤在UC疾病过程中起着至关重要的作用。中医认为UC属于肠痈的范畴[20],湿热内蕴、脉络受损乃其发生机制,因此清热祛湿、排脓止血为其有效治法。薏苡仁是重要的药食两用资源[21],为我国传统的利水渗湿药,具有健脾补肺、清热利湿、排脓除痹、止泻等功效[22],与UC中医病机对症。薏苡仁中包括脂肪酸、酯类、多糖、三萜、酚类、黄酮等成分,具有降血糖、改善肝功能、改善脾功能、抗炎等药理作用[23]。已有研究发现,薏苡仁水提物可减轻结肠炎症反应,调节机体免疫[7],并且发酵后的薏苡仁多糖在调节高温高湿导致的小鼠肠道菌群紊乱方面具有显著作用[24]。然而,薏苡仁对UC肠道菌群的影响,即其防治UC的机制仍不明确,有待进一步研究。
本研究首先通过给予小鼠3.5%DSS溶液复制UC模型,探讨CE对UC的治疗作用。研究过程中通过观察并记录小鼠的体重、DAI评分的变化判断模型复制成功。实验结果显示,模型组小鼠出现体重减轻,DAI评分升高,结肠长度缩短,肠上皮细胞坏死,炎症细胞浸润等情况,而给予CE后,小鼠的上述病理情况均有所好转,这说明CE治疗对UC小鼠症状具有改善作用,基于此,我们接下来对其作用机制作了进一步探讨。
UC患者体内会出现促炎因子和抗炎因子的比例失衡现象,高水平的促炎症介质,如细胞因子(TNF-α、IL-6)是UC的主要特征之一,可以导致慢性炎症、溃疡和结肠粘膜损伤[25]。IL-22是近年来被广泛研究的一种新型细胞因子,研究发现其在UC患者肠道黏膜中表达明显上调[26],且与肠黏膜紧密连接蛋白(Claudin-1、Occludin、ZO-1)的表达密切相关[27]。提示IL-22可以在促进肠粘膜损伤的修复和维持肠粘膜屏障的完整性中发挥作用。通过对小鼠结肠组织中TNF-α、IL-6、IL-22水平进行检测,发现CE可以显著降低UC小鼠结肠炎症因子TNF-α、IL-6、IL-22的水平,抑制结肠炎症。
深入研究小鼠粪便中肠道菌群结构的变化后发现,CE对UC小鼠的改善作用机制可能与调节肠道菌群结构相关。Bacteroidetes是人肠道中一类丰度较高的肠道菌群,约占肠道微生物总数的25%[28],其可与Treg细胞相互作用,促进抗炎因子分泌,与肠道炎症疾病的发生发展具有紧密关联。Proteobacteria中则包括多种致病菌,如幽门螺杆菌和大肠肝菌,它们的存在与肠粘膜的损伤关系密切[12]。实验结果显示UC小鼠肠道菌群门水平上Firmicutes、Proteobacteria相对丰度增多,Bacteroidetes相对丰度减少,CE治疗可以减缓这种变化趋势,提高有益菌相对丰度,降低有害菌相对丰度。
Allobaculum是一种新发现的炎症性肠病相关菌属,被认为与宿主上皮粘膜屏障密切相关[29]。Paraprevotella广泛存在于人体中,可以帮助分解蛋白质和碳水化合物食物,其亦可作为条件致病菌,引起肠道炎症、类风湿性关节炎等问题[30]。Lactobacillus是已报道的几乎天然存在于所有脊椎动物和哺乳动物肠道内的乳酸菌,有助于建立肠道微生态平衡,降低由细菌转移引起的肠道通透性损伤[31]。Akkermansia作为一种有益菌,会随着肠炎的发展而逐渐减少,补充Akkermansia或它外膜蛋白Amuc_1100能减轻DSS诱导的UC小鼠结肠炎症状态,降低肠道中的炎症水平,预防UC向肠癌的发展[32]。通过差异性分析,我们筛选出CE在属水平上可以不同程度上增加Allobaculum、Akkermansia、Lactobacillus等有益菌的丰度,降低Paraprevotella等条件致病菌的丰度,以此改善UC小鼠紊乱的肠道菌群。
为了探究CE调控UC过程中的关键差异菌群与炎症因子的关联性,将筛选得到的关键差异菌与炎症因子TNF-α、IL-6、IL-22进行关联性分析,结果显示Bacteroidetes、Proteobacteria等菌门与炎症因子存在中高强度的关联性,Allobaculum、Prevotella等菌属与三种炎症因子存在中高强度的负相关性。提示CE改善UC的机制可能与调节肠道菌群进而改善炎症反应有关。这种“菌群-炎症”关联性可能是由于肠道菌群平衡被破坏后会影响肠上皮屏障,导致肠粘膜通透性增加,进而诱发肠道免疫系统的过度反应与错误识别,促使巨噬细胞和淋巴细胞激活,释放一系列细胞因子和炎症介质,最终造成组织损伤[33]。
综上所述,CE可有效缓解UC小鼠疾病症状,降低炎症因子水平,其作用机制与肠道菌群有关。CE可调节UC小鼠肠道菌群多样性,通过改变Bacteroidetes、Proteobacteria等肠道优势菌群的组成和结构,提高有益菌丰度,降低有害菌丰度,进而修复肠粘膜损伤,降低肠道炎症。本研究结果可以为薏苡仁新品的开发及UC的治疗研究提供借鉴意义。
-
图 1 小鼠体重、DAI评分及结肠长度变化
注:A为体重变化率;B为DAI评分;C为结肠长度;D为结肠组织图片;与正常组比较,##P<0.01,###P<0.005;与模型组比较,*P<0.05,**P<0.01,***P<0.005,图3同。
Figure 1. Changes of body weight, DAI, and colon length in mice
表 1 DAI评分标准
Table 1 Scoring criteria for DAI
DAI评分 体重下降率(%) 大便性状 便血情况 0 <1 正常 阴性 1 ≥1~5 软便 阴性 2 ≥5~10 软便 隐血阳性 3 ≥10~20 腹泻 隐血阳性 4 ≥20 腹泻 血便 -
[1] 周婷婷, 仝巧云. 溃疡性结肠炎发病机制的研究进展[J]. 胃肠病学和肝病学杂志,2012,21(12):1163−1166. [ZHOU T T, TONG Q Y. Progress in understanding the pathogenesis of ulcerative colitis[J]. Chinese Journal of Gastroenterology and Hepatology,2012,21(12):1163−1166.] ZHOU T T, TONG Q Y. Progress in understanding the pathogenesis of ulcerative colitis[J]. Chinese Journal of Gastroenterology and Hepatology, 2012, 21(12): 1163−1166.
[2] DU L, HA C. Epidemiology and pathogenesis of ulcerative colitis[J]. Gastroenterology Clinics of North America,2020,49(4):643−654. doi: 10.1016/j.gtc.2020.07.005
[3] ORDAS I, ECKMANN L, TALAMINI M, et al. Ulcerative colitis[J]. Lancet,2012,380(9853):1606−1619. doi: 10.1016/S0140-6736(12)60150-0
[4] LI D, FENG Y, TIAN M, et al. Gut microbiota-derived inosine from dietary barley leaf supplementation attenuates colitis through PPARgamma signaling activation[J]. Microbiome,2021,9(1):83. doi: 10.1186/s40168-021-01028-7
[5] 刘星, 王正武. 薏仁的化学成分及其应用研究[J]. 食品与药品,2014,16(2):129−133. [LIU X, WANG Z W. Research development of chemical components in Coix Seed and its applications[J]. Food and Drug,2014,16(2):129−133.] LIU X, WANG Z W. Research development of chemical components in Coix Seed and its applications[J]. Food and Drug, 2014, 16(2): 129−133.
[6] 魏永忠, 周英, 赵丹, 等. 黔产薏苡仁油成分分析及对破骨细胞活性的影响[J]. 食品工业科技,2019,40(5):61−65. [WEI Y Z, ZHOU Y, ZHAO D, et al. Analysis of the composition of Coix Seed Oil in Guizhou and its effect on the activity of osteoclast[J]. Science and Technology of Food Industry,2019,40(5):61−65.] WEI Y Z, ZHOU Y, ZHAO D, et al. Analysis of the composition of Coix Seed Oil in Guizhou and its effect on the activity of osteoclast[J]. Science and Technology of Food Industry, 2019, 40(5): 61−65.
[7] 李彦龙, 伍春, 廖志峰, 等. 薏苡仁水提液对溃疡性结肠炎大鼠血清IL-6、IL-10的影响[J]. 辽宁中医药大学学报,2013,15(9):42−45. [LI Y L, WU C, LIAO Z F, et al. Influence of Coix Seed water extract on serum IL-6 and IL-10 of Ulcerative Colitis rats[J]. Journal of Liaoning University of TCM,2013,15(9):42−45.] LI Y L, WU C, LIAO Z F, et al. Influence of Coix Seed water extract on serum IL-6 and IL-10 of Ulcerative Colitis rats[J]. Journal of Liaoning University of TCM, 2013, 15(9): 42−45.
[8] GUO M, DING S, ZHAO C, et al. Red Ginseng and Semen Coicis can improve the structure of gut microbiota and relieve the symptoms of ulcerative colitis[J]. Journal of Ethnopharmacology,2015,162:7−13. doi: 10.1016/j.jep.2014.12.029
[9] LIU Jialing, GAO Yangyang, ZHOU Jing, et al. Changes in serum inflammatory cytokine levels and intestinal flora in a self-healing dextran sodium sulfate-induced ulcerative colitis murine model[J]. Life Sci,2020,263:118587. doi: 10.1016/j.lfs.2020.118587
[10] 马广礼, 夏晓培, 马金亮. 蒿本内酯对葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠的改善作用[J]. 食品工业科技,2024,45(4):321−327. [MA G L, XIA X P, MA J L. Improving effect of Ligustilide on dextran sodium sulfate-induced Ulcerative Colitis[J]. Science and Technology of Food Industry,2024,45(4):321−327.] MA G L, XIA X P, MA J L. Improving effect of Ligustilide on dextran sodium sulfate-induced Ulcerative Colitis[J]. Science and Technology of Food Industry, 2024, 45(4): 321−327.
[11] GUVENC M, CELLAT M, OZKAN H, et al. Protective effects of tyrosol against DSS-induced ulcerative colitis in rats[J]. Inflammation,2019,42(5):1680−1691. doi: 10.1007/s10753-019-01028-8
[12] LIU Z, JIANG Z, ZHANG Z, et al. Bacillus coagulans in combination with chitooligosaccharides regulates gut microbiota and ameliorates the DSS-induced colitis in mice[J]. Microbiology Spectrum,2022,10(4):e0064122. doi: 10.1128/spectrum.00641-22
[13] 王泽瑞, 焦艳梅, 令狐恩强. 肠道非免疫细胞及其在炎症性肠病中的作用研究进展[J]. 解放军医学杂志, 2024, 49(5):594-601. [WANG Z R, JIAO Y M, LING H E Q. Progress in study of gut non-immune cells and their role in development of inflammatory bowel disease[J]. Medical Journal of Chinese People's Liberation Army, 2024, 49(5):594-601.] WANG Z R, JIAO Y M, LING H E Q. Progress in study of gut non-immune cells and their role in development of inflammatory bowel disease[J]. Medical Journal of Chinese People's Liberation Army, 2024, 49(5): 594-601.
[14] HE X Q, LIU D, LIU H Y, et al. Prevention of ulcerative colitis in mice by sweet tea (Lithocarpus litseifolius) via the regulation of gut microbiota and butyric-acid-mediated anti-inflammatory signaling[J]. Nutrients, 2022, 14(11):2208.
[15] 张全辉, 邓永文, 周毛生, 等. 参苓白术散加减对溃疡性结肠炎患者IL-6、IL-10和TNF-α的影响[J]. 药品评价,2022,19(17):1054−1058. [ZHANG Q H, DENG Y W, ZHOU M S, et al. Effects of modified shenling baizhu powders on IL-6, IL-10 and TNF-α in Ulcerative Colitis patients[J]. Drug Evaluation,2022,19(17):1054−1058.] ZHANG Q H, DENG Y W, ZHOU M S, et al. Effects of modified shenling baizhu powders on IL-6, IL-10 and TNF-α in Ulcerative Colitis patients[J]. Drug Evaluation, 2022, 19(17): 1054−1058.
[16] ARJ A, RAZAVIZADEH M, MOHAMMADI H, et al. The correlation between the numerical status of Th22 cells and serum level of IL-22 with severity of ulcerative colitis[J]. Science and Technology of Food Industry,2018,17(1):78−84.
[17] 程晓阳, 廖明, 何全光, 等. 三叶青超微粉对酒精性肝损伤大鼠肠道菌群的调节作用[J]. 食品工业科技,2023,44(18):415−424. [CHENG X Y, LIAO M, HE Q G, et al. Effects of tetrastigma hemsleyanum superfine powder on intestinal microflora in rats with alcohol-induced liver injury[J]. Science and Technology of Food Industry,2023,44(18):415−424.] CHENG X Y, LIAO M, HE Q G, et al. Effects of tetrastigma hemsleyanum superfine powder on intestinal microflora in rats with alcohol-induced liver injury[J]. Science and Technology of Food Industry, 2023, 44(18): 415−424.
[18] 程小英, 詹扬, 周衍安, 等. 乳酸菌素对幽门螺杆菌感染性胃炎小鼠炎症和肠道菌群的影响[J]. 食品工业科技,2024,45(10):316−324. [CHENG X Y, ZHAN Y, ZHOU Y A, et al. Effect of Lacidophilin on inflammatory and intestinal microflora in mice with Helicobacter pylori induced gastritis[J]. Science and Technology of Food Industry,2024,45(10):316−324.] CHENG X Y, ZHAN Y, ZHOU Y A, et al. Effect of Lacidophilin on inflammatory and intestinal microflora in mice with Helicobacter pylori induced gastritis[J]. Science and Technology of Food Industry, 2024, 45(10): 316−324.
[19] RAMETTE A. Multivariate analyses in microbial ecology[J]. FEMS Microbiology Ecology,2007,62(2):142−160. doi: 10.1111/j.1574-6941.2007.00375.x
[20] 李军祥, 唐旭东, 王化虹, 等. 溃疡性结肠炎中医诊疗指南(2023)[J]. 中医杂志,2024,65(7):763−768. [LI J X, TANG X D, WANG H H, et al. Guidelines for the diagnosis and treatment of ulcerative colitis in traditional Chinese medicine (2023)[J]. Journal of Traditional Chinese Medicine,2024,65(7):763−768.] LI J X, TANG X D, WANG H H, et al. Guidelines for the diagnosis and treatment of ulcerative colitis in traditional Chinese medicine (2023)[J]. Journal of Traditional Chinese Medicine, 2024, 65(7): 763−768.
[21] ZENG Y, YANG J, CHEN J, et al. Actional mechanisms of active ingredients in functional food adlay for human health[J]. Molecules,2022,27(15):4808. doi: 10.3390/molecules27154808
[22] 毕天琛, 杨国宁, 马海春. 中药薏苡仁化学成分及药理活性研究进展[J]. 海峡药学,2019,31(11):52−56. [BI T C, YANG G N, MA H C. Research progress of the traditional Chinese medicine Coix Seed on the chemical compounds and pharmacological activities[J]. Strait Pharmaceutical Journal,2019,31(11):52−56.] BI T C, YANG G N, MA H C. Research progress of the traditional Chinese medicine Coix Seed on the chemical compounds and pharmacological activities[J]. Strait Pharmaceutical Journal, 2019, 31(11): 52−56.
[23] LI H, PENG L, YIN F, et al. Research on Coix seed as a food and medicinal resource, it's chemical components and their pharmacological activities:A review[J]. J Ethnopharmacol, 2024, 319(Pt 3):117309.
[24] WANG H, YIN H, ZHONG Y, et al. Polysaccharides from fermented coix seed modulates circulating nitrogen and immune function by altering gut microbiota[J]. Current Research in Food Science,2022,5:1994−2003. doi: 10.1016/j.crfs.2022.10.007
[25] JANCZYK P, PIEPER R, SMIDT H, et al. Effect of alginate and inulin on intestinal microbial ecology of weanling pigs reared under different husbandry conditions[J]. FEMS Microbiology Ecology,2010,72(1):132−142. doi: 10.1111/j.1574-6941.2009.00826.x
[26] DUMOUTIER L, LOUAHED J, RENAULD J C. Cloning and characterization of IL-10-related T cell-derived inducible factor (IL-TIF), a novel cytokine structurally related to IL-10 and inducible by IL-9[J]. Journal of Immunology,2000,164(4):1814−1819. doi: 10.4049/jimmunol.164.4.1814
[27] WANG Y, MUMM J B, HERBST R, et al. IL-22 increases permeability of intestinal epithelial tight junctions by enhancing claudin-2 expression[J]. Journal of Immunology,2017,199(9):3316−3325. doi: 10.4049/jimmunol.1700152
[28] 王晨. 肠道拟杆菌种结构组成对溃疡性结肠炎发展的影响[D]. 无锡: 江南大学, 2021. [WANG C. Effect of intestinal Bacteroides species composition on the development of Ulcerative Colitis[D]. Wuxi: Jiangnan University, 2021.] WANG C. Effect of intestinal Bacteroides species composition on the development of Ulcerative Colitis[D]. Wuxi: Jiangnan University, 2021.
[29] VAN M G H, VAN M G, JANSEN P, et al. Identification of Allobaculum mucolyticum as a novel human intestinal mucin degrader[J]. Gut Microbes,2021,13(1):1966278. doi: 10.1080/19490976.2021.1966278
[30] LEY R E. Gut microbiota in 2015:Prevotella in the gut:Choose carefully[J]. Nature Reviews Gastroenterology & Hepatology,2016,13(2):69−70.
[31] 庞洁, 周娜, 刘鹏, 等. 罗伊氏乳杆菌的益生功能[J]. 中国生物工程杂志,2011,31(5):131−137. [PANG J, ZHOU N, LIU P, et al. The probiotic properties of Lactobacillus reuteri[J]. China Biotechnology,2011,31(5):131−137.] PANG J, ZHOU N, LIU P, et al. The probiotic properties of Lactobacillus reuteri[J]. China Biotechnology, 2011, 31(5): 131−137.
[32] WANG L, TANG L, FENG Y, et al. A purified membrane protein from Akkermansia muciniphila or the pasteurised bacterium blunts colitis associated tumourigenesis by modulation of CD8(+) T cells in mice[J]. Gut,2020,69(11):1988−1997. doi: 10.1136/gutjnl-2019-320105
[33] LI S, XU K, CHENG Y, et al. The role of complex interactions between the intestinal flora and host in regulating intestinal homeostasis and inflammatory bowel disease[J]. Front Microbiology,2023,14:1188455. doi: 10.3389/fmicb.2023.1188455





 下载:
下载:



 下载:
下载:



