Inhibition Effect of Phenyllactic Acid on Foodborne Vibrio vulnificus Biofilms
-
摘要: 本文研究了苯乳酸在亚抑菌浓度条件下对创伤弧菌(Vibrio vulnificus)生物膜形成的抑制作用。首先构建创伤弧菌生物膜模型,然后利用结晶紫染色法和XTT还原法分析苯乳酸对创伤弧菌生物膜形成量和代谢活性的抑制作用,并以胞外多糖、胞外蛋白和胞外DNA为指标,评价苯乳酸对创伤弧菌胞外聚合物的影响,进一步借助光学和激光共聚焦显微镜探究苯乳酸对创伤弧菌生物膜结构的影响。结果表明:创伤弧菌生物膜的聚集期、成熟期和脱落期分别在16~32、32~56和56~72 h。苯乳酸浓度为0.5 MIC(minimum inhibitory concentration,MIC)时,对创伤弧菌成熟期生物膜抑制作用较好,对生物膜形成量、代谢活性、胞外多糖、胞外蛋白、胞外DNA的抑制率分别为51.04%、33.62%、61.97%、32.70%、52.25%,且破坏了生物膜的致密性和完整性,使细菌呈松散分布。苯乳酸可通过减少创伤弧菌生物膜胞外聚合物的形成,从而抑制其生物膜的形成。本研究可为控制水产品中创伤弧菌生物膜提供理论基础。Abstract: In this study, the inhibitory effect of phenyllactic acid (PLA) on Vibrio vulnificus biofilm formation at sub-inhibitory concentration was studied. Firstly, the biofilm model of V. vulnificus was established. Then the inhibitory effect of PLA on the formation mass and metabolic activity of V. vulnificus biofilm was analyzed using crystal violet staining method and XTT reduction assay. Using extracellular polysaccharides, extracellular proteins, and extracellular DNA as indicators, the effect of PLA on the extracellular polymers of V. vulnificus was evaluated. The effect of PLA on the structure of V. vulnificus biofilm was investigated by optical microscopy and laser confocal microscopy. The results showed that the aggregation, maturation and shedding periods of V. vulnificus biofilm were at 16~32, 32~56, and 56~72 h, respectively. PLA at 0.5 MIC inhibited the biofilm of V. vulnificus in the maturation stage better, and the inhibition rates of biofilm formation mass, metabolic activity, extracellular polysaccharides, extracellular proteins, and extracellular DNA were 51.04%, 33.62%, 61.97%, 32.70%, and 52.25%, respectively. Additionally, PLA disrupted the density and integrity of V. vulnificus biofilms, resulting in a dispersed distribution of bacteria. Therefore, PLA inhibited the biofilm formation of V. vulnificus by reducing the formation of extracellular polymers. This study provides a theoretical basis for the control of V. vulnificus biofilm in aquatic products.
-
Keywords:
- phenyllactic acid /
- Vibrio vulnificus /
- biofilms /
- inhibition
-
创伤弧菌(Vibrio vulnificus)广泛存在于海水及海产品中,是一种能在自然生态系统中形成生物膜的致病菌[1]。皮肤伤口接触创伤弧菌污染的海水或食用生的/未煮熟的蛤类等水产品易导致创伤弧菌感染,能引起机体原发性败血症、多器官炎症等[2]。致病菌形成的生物膜被认为是导致人类疾病爆发的最重要原因之一,占人类细菌感染的65%[3]。
生物膜是指在各种胁迫条件下,由细菌及自身分泌的胞外多糖、胞外蛋白及胞外DNA等胞外聚合物(Extracellular polymers,EPS)组成的一种附着于物体表面且具有三维立体结构的微生物聚集体[4−5]。生物膜的形成有助于微生物抵御外界不利环境,使微生物能够在食品中快速繁殖[6−7]。但致病菌生物膜的持续存在会引起食品腐败变质,造成食用者细菌性感染或食物中毒[4−8]。Wagner等[9]研究发现创伤弧菌可以在牡蛎的壳中定植并持续存在,也易在操作或清洗过程中转移到牡蛎肉表面形成生物膜,从而引发食用者食物中毒。因此,寻找能够有效抑制生物膜的抗菌剂,尤其是天然抗菌剂显得尤为重要。
苯乳酸(Phenyllactic acid,PLA)作为天然有机酸,对大部分的细菌、真菌等多种微生物具有广谱的抑制作用,是一种安全高效、绿色环保的生物防腐剂,在食品保鲜领域被广泛应用[10]。其可由乳酸菌在乳酸脱氢酶作用下分解苯丙酮酸产生或白地霉、丙酸菌等产生[11]。Jiang等[12]研究发现3 mg/mL的PLA可通过减少单核细胞增生李斯特菌(Listeria monocytogenes)胞外多糖和细胞外蛋白的分泌来抑制其生物膜的形成。Liu等[13]研究发现PLA能够降低粪肠球菌(Enterococcus faecalis)的游动和群集运动,使生物膜的厚度明显减少,同时下调了Ebp菌毛基因(ebpABC)和Epa多糖基因(epaABE),从而对粪肠球菌生物膜产生抑制作用。前期本课题组研究发现PLA对创伤弧菌具有较好的抑制作用,通过两倍稀释法确定其对创伤弧菌的最小抑菌浓度(minimum inhibitory concentration,MIC)为0.8 mg/mL,但PLA是否能够抑制创伤弧菌生物膜及其作用方式还不清楚。
本文应用结晶紫染色法、XTT还原法、苯酚硫酸法、分光光度法等方法分析不同浓度PLA对不同时期创伤弧菌生物膜形成量、生物膜代谢活性、胞外多糖、胞外蛋白、胞外DNA的抑制作用;进一步利用光镜和激光共聚焦显微镜(CLSM)观察PLA对创伤弧菌生物膜结构的影响。本研究以期为探究PLA抑制水产品中创伤弧菌生物膜形成的作用机制提供理论基础,防止创伤弧菌产生耐药性。
1. 材料与方法
1.1 材料与仪器
创伤弧菌(Vibrio vulnificus)VV06 分离自牡蛎,保藏于本院微生物实验室−80 ℃冰箱;苯乳酸(纯度≥98.0%) 上海皓鸿生物医药科技有限公司;2216E培养基 海博生物技术有限公司;冰醋酸、醋酸钠、Na2EDTA·2H2O 天津市博迪化工有限公司;XTT钠盐 上海易恩化学技术有限公司;甲萘醌 上海阿拉丁生化科技股份有限公司;苯酚、异戊醇 天津市大茂化学试剂厂;葡萄糖 天津市化学试剂三厂;BCA蛋白浓度测定试剂盒 碧云天生物技术;Tris-HCl 北京索莱宝科技有限公司;AO/EB荧光染色试剂盒 北京雷根生物技术有限公司;其余试剂均为分析纯。
GI54DS立式高压蒸汽灭菌锅 致微(北京)有限公司;ND-2000微量蛋白核酸浓度测定仪 美国赛默飞世尔科技公司;DL-CJ-2N超级洁净工作台 北京中西远大科技有限公司;UV2550紫外可见分光光度计 日本岛津有限公司;Imark酶标仪 美国Bio-Rad公司;HZ250LS恒温摇床培养箱 武汉瑞华仪器设备有限公司;BMM-480YS生物显微镜 上海绘统光学仪器有限公司;Leica TCS SP5激光共聚焦显微镜 上海徕卡显微系统贸易有限公司。
1.2 实验方法
1.2.1 创伤弧菌生物膜模型的构建
将创伤弧菌按体积比1%接种至2216E液体培养基,于30 ℃,150 r/min培养18 h。将活化后的创伤弧菌按体积比1%接种至2216E液体培养基中混匀,移取200 µL至96孔板中,以2216E液体培养基为空白对照,置于30 ℃培养8、16、24、32、40、48、56、64、72 h,参考孙梦桐等[14]的结晶紫染色法测定生物膜形成量。
1.2.2 苯乳酸对创伤弧菌生物膜形成量的影响
将活化后的创伤弧菌按体积比1%分别接种至含有0、0.25 MIC、0.5 MIC PLA的2216E培养基中,混匀后,分别取200 μL培养物至96孔板中,于30 ℃振荡培养24、48和72 h后,参考孙梦桐等[14]的结晶紫染色法测定各组生物膜形成量。
1.2.3 苯乳酸对创伤弧菌生物膜细菌活性的影响
参照王凤婷[15]的方法对生物膜进行处理。创伤弧菌(108 CFU/mL)按1%(v/v)分别接种至含有0、0.25 MIC、0.5 MIC PLA的2216E培养基中,混匀后各取1 mL加入到24孔板中,隔24 h更换一次培养基,于24、48、72 h对每孔生物膜中细菌总数进行测定。
1.2.4 苯乳酸对创伤弧菌生物膜代谢活性的影响
参照陈萍[16]的XTT还原法测定生物膜的代谢活性。将XTT与甲萘醌以体积比12.5:1配制成XTT工作液。创伤弧菌生物膜的培养及前处理同1.2.2,振荡培养后,用1 mL PBS缓冲液(0.1 mmol/L)洗涤生物膜3次以除去浮游细胞,然后向孔板中加入含13.5%XTT工作液的PBS溶液,并立即置于30 ℃避光孵育4 h,测定其在450 nm处的吸光度值。抑制率计算公式(1)如下:
(1) 式中,OD对照:未添加PLA对照组的OD450 nm;OD处理:0.25 MIC、0.5 MIC PLA处理组的OD450 nm。
1.2.5 苯乳酸对创伤弧菌生物膜胞外聚合物的影响
1.2.5.1 胞外多糖
根据白梅等[17]的方法并稍作修改。创伤弧菌生物膜的培养及前处理同1.2.2。培养结束后,将生物膜重悬于PBS缓冲液,70 ℃加热10 min,在4 ℃下12000 r/min离心15 min,收集上清液,0.22 μm滤器过滤得到生物膜胞外聚合物。取1 mL胞外聚合物加入0.5 mL 0.9%苯酚混匀后,加入5 mL浓硫酸,室温静置反应30 min,测定其在490 nm下的吸光度值。依据标准曲线计算各组胞外多糖含量,胞外多糖标准曲线方程为Y=0.0106X+0.0822(R2=0.9992)。抑制率计算公式(2)如下:
(2) 1.2.5.2 胞外蛋白
创伤弧菌生物膜的培养及胞外聚合物的提取同1.2.5.1。应用BCA蛋白浓度检测试剂盒测定胞外蛋白含量。在20 μL胞外聚合物中加入200 μL BCA工作液,37 ℃下反应20~30 min,测定其在562 nm下的吸光度值。依据标准曲线计算各组胞外蛋白含量,蛋白标准曲线方程为Y=0.1124X−0.0103(R2=0.9993)。抑制率按照公式(2)计算。
1.2.5.3 胞外DNA
创伤弧菌生物膜的培养及前处理同1.2.2,振荡培养后,每孔加入0.5 mL EDTA(0.5 mol/L),冰上预冷1 h后,弃去上层培养物。生物膜细胞重悬于醋酸钠缓冲液(3 mol/L),与乙醇混合,4 ℃保存过夜。在4 ℃下10000 r/min离心15 min后,收集沉淀并在室温下使乙醇蒸发。采用微量蛋白核酸浓度测定仪检测核酸含量[18]。抑制率按照公式(2)计算。
1.2.6 苯乳酸对创伤弧菌生物膜结构的影响
将活化后的创伤弧菌按体积比1%分别接种至含有0、0.25 MIC、0.5 MIC PLA的2216E培养基中,混匀后,移取1 mL培养物到含有无菌载玻片(1 cm×1 cm)的24孔板中,于30 ℃振荡培养24、48、72 h后,移除液体,用PBS缓冲液清洗载玻片2~3次。
1.2.6.1 光学显微镜
参照胡文静等[19]的方法对生物膜进行结晶紫染色。每孔添加500 μL 0.5%结晶紫溶液染色15 min后,用PBS缓冲液缓慢洗去多余结晶紫至无明显紫色,将24孔板置于干燥箱中干燥,于光学显微镜下观察各组生物膜结构。
1.2.6.2 激光共聚焦显微镜
将清洗后的载玻片用2.5%的戊二醛于4 ℃下固定30 min,用PBS缓冲液洗去残余的戊二醛后,于干燥箱中干燥。然后按照AO/EB双荧光染色试剂盒说明染色15 min,用PBS缓冲液清洗掉多余染色液后,于干燥箱中干燥30 min。每个载玻片上添加10 μL抗荧光淬灭封片剂,盖玻片封片后用激光共聚焦显微镜(CLSM)进行观察。
1.3 数据处理
试验结果均平行测定三次,结果用平均值±标准差表示,进一步采用IBM SPSS 23软件以及OriginPro 9.1软件对数据进行分析处理,并通过单因素ANOVA检验进行方差分析,P<0.05表示具有显著差异。
2. 结果与分析
2.1 创伤弧菌生物膜模型的建立
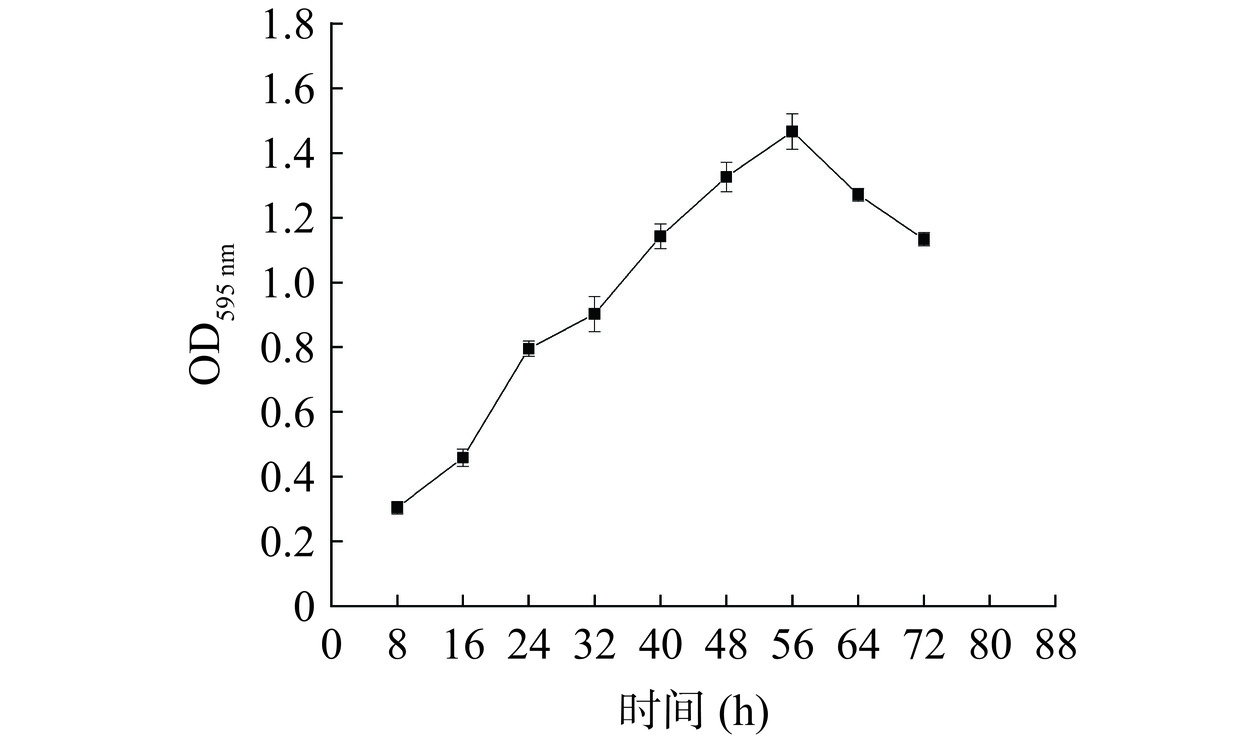
生物膜的形成主要有4个阶段,包括细菌的黏附、聚集、生物膜的成熟以及生物膜的脱落[20]。创伤弧菌生物膜形成的动态过程如图1所示,在0~56 h时创伤弧菌生物膜的形成量呈上升趋势,56~72 h时呈下降趋势。结合杜宏等[21]的生物膜形成量判断,0~16 h是细菌黏附期,该时期细菌生物膜量较少;16~32 h是细菌聚集期,该时期细菌快速生长繁殖,生物数量增加速率较快,开始聚集形成生物膜;32~56 h是生物膜成熟期,该时期细菌数持续增加,生物膜慢慢堆积,形成了致密厚实的成熟生物膜;56~72 h后是生物膜脱落期,该时期生物膜形成量逐渐下降,成熟的生物膜开始脱落,处于浮游状态。由于细菌黏附期时细菌较少,因此,后续研究分别选择处于细菌聚集期的24 h、生物膜成熟期的48 h和生物膜脱落期的72 h为处理时间。
2.2 苯乳酸对创伤弧菌生物膜形成量的抑制作用
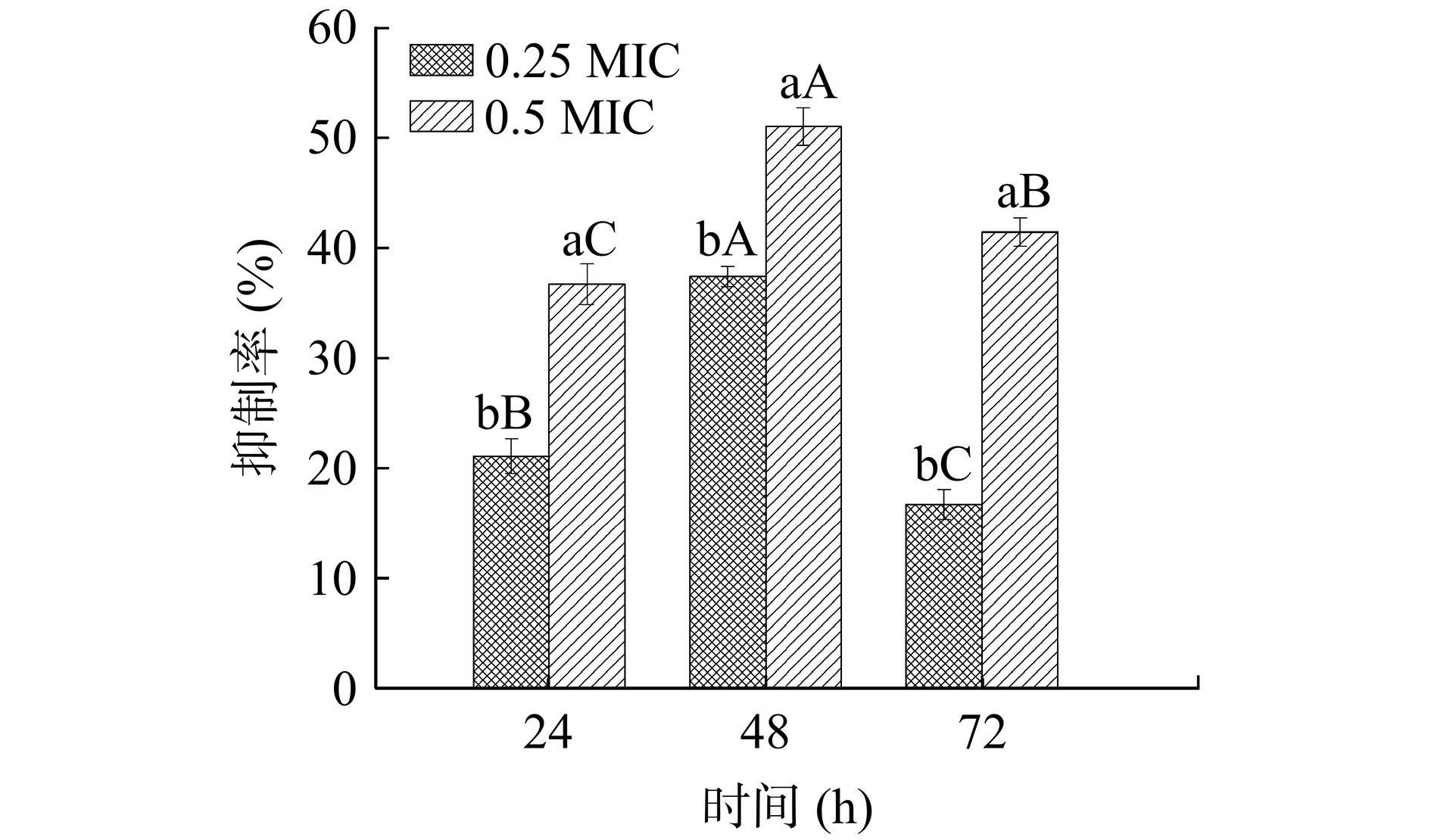
不同浓度PLA在不同时间对创伤弧菌生物膜形成量的抑制作用如图2所示,随着PLA浓度的增加,其对创伤弧菌生物膜的抑制率显著升高(P<0.05)。浓度为0.25 MIC和0.5 MIC的PLA在48 h对创伤弧菌生物膜形成量抑制率最高,达37.37%和51.04%,与24 h和72 h相比,分别提高了16.47%、14.33%和20.65%、9.62%。说明PLA能有效抑制创伤弧菌生物膜的形成量,且在48 h时抑制效果较好。姜聪一等[22]研究了PLA对单增李斯特菌生物膜形成的影响,结果表明亚抑制浓度(0.6 mg/mL)的PLA对单增李斯特菌生物膜形成量的抑制率为45.07%,本研究的结果与之相似。
2.3 苯乳酸对创伤弧菌生物膜细菌的影响
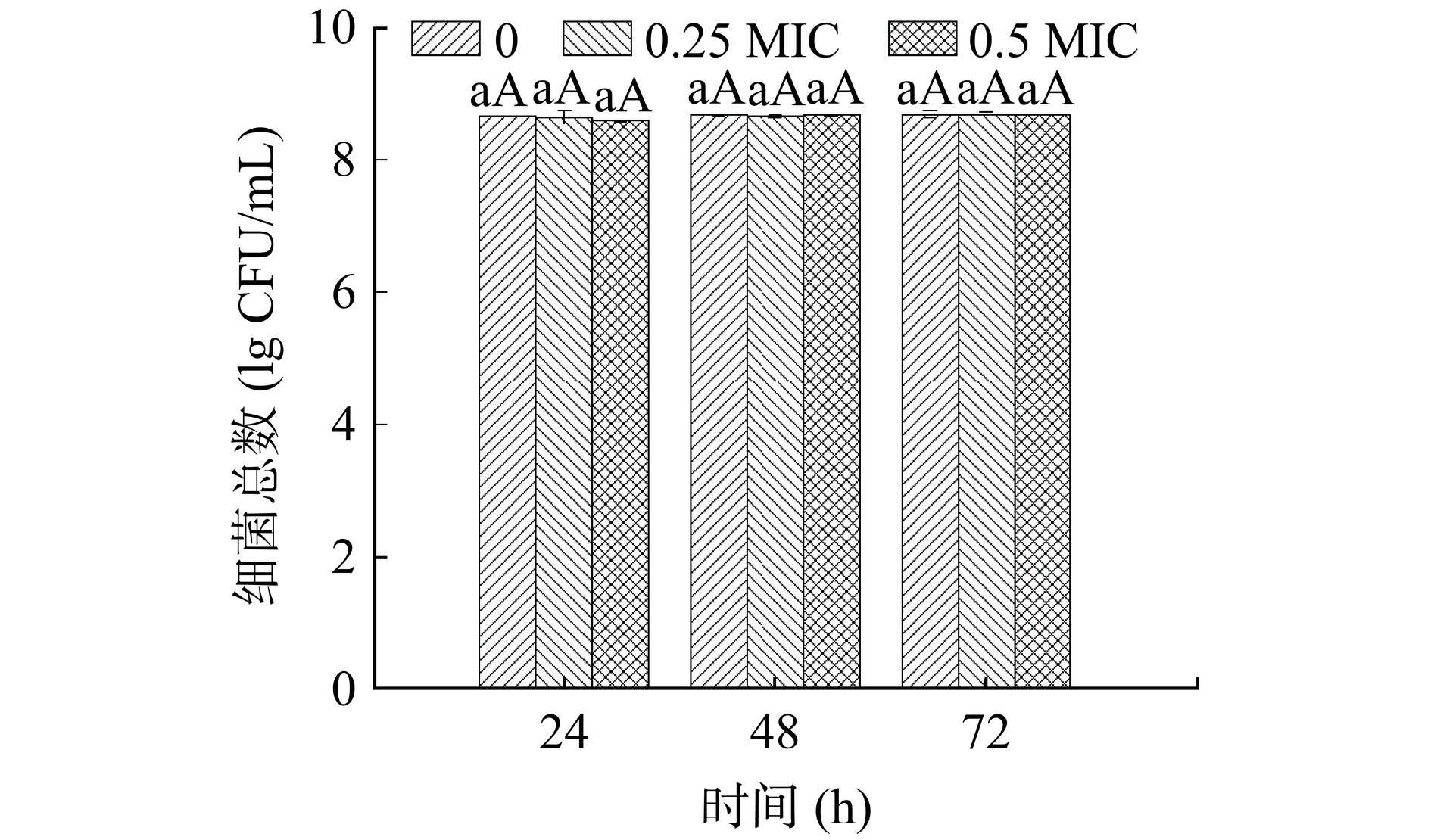
不同浓度PLA在不同时间对创伤弧菌生物膜中细菌数量的影响如图3所示,各处理组生物膜中细菌数均在108 CFU/mL。随着培养时间的增加,对照组细菌数量逐渐增加,但变化不显著。与对照组相比,相同培养时间下,不同浓度PLA处理后细菌数量变化不显著,说明亚抑制浓度的PLA对创伤弧菌生物膜细菌的数量无影响。
2.4 苯乳酸对创伤弧菌生物膜代谢活性的抑制作用
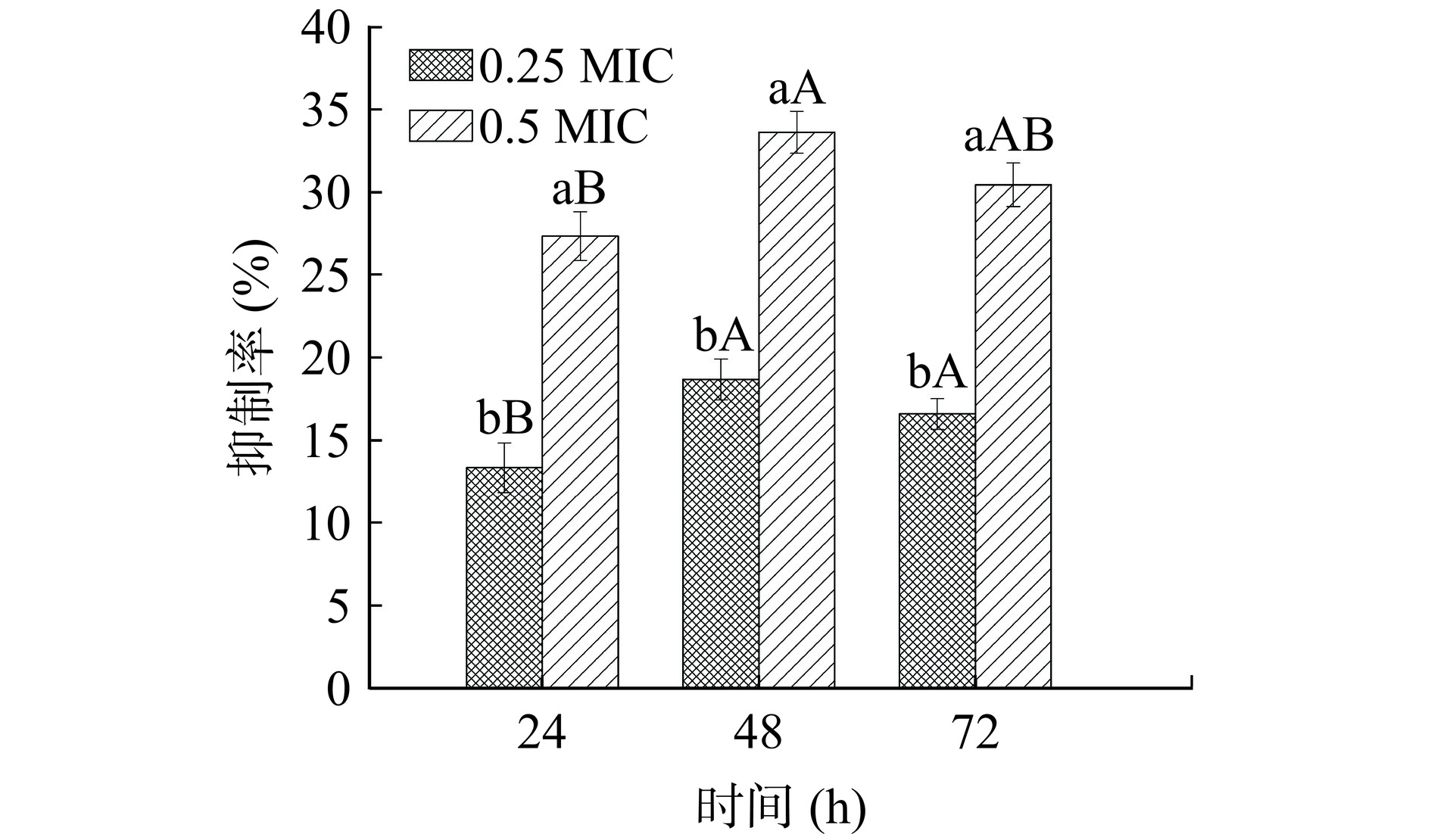
利用XTT还原法检测不同浓度PLA在不同时间对创伤弧菌生物膜代谢活性的影响,该方法通过测定活细胞将黄色的四唑盐还原为橙色水溶性的甲马唑衍生物来测量生物膜中细胞的代谢活性,其颜色深度与细胞活力成正比[23]。如图4所示,相同PLA处理不同培养时间下,PLA对创伤弧菌生物膜代谢活性的抑制率有差异。浓度0.25 MIC和0.5 MIC的PLA在48 h对创伤弧菌生物膜代谢活性抑制率相对较高,达18.68%和33.62%,与24 h和72 h相比,分别提高了5.35%、6.27%和2.09%、3.18%。说明PLA对创伤弧菌生物膜代谢活性的抑制效果随浓度增加而显著提高(P<0.05)。本研究与Jiang等[24]关于苯乳酸对福氏志贺氏菌(Shigella flexneri)的抗生物膜活性研究结果相似,与未处理组相比,浓度为4.5 mg/mL的PLA处理后,福氏志贺氏菌生物膜代谢活性下降了36.32%。
2.5 苯乳酸对创伤弧菌生物膜胞外聚合物的抑制作用
生物膜在形成并趋于成熟的过程中,被包埋在生物膜中的细菌会分泌胞外蛋白、胞外多糖、胞外DNA等胞外聚合物,导致生物膜结构更加复杂,从而增强生物膜自身对外界环境的抵抗能力[25]。
2.5.1 胞外多糖
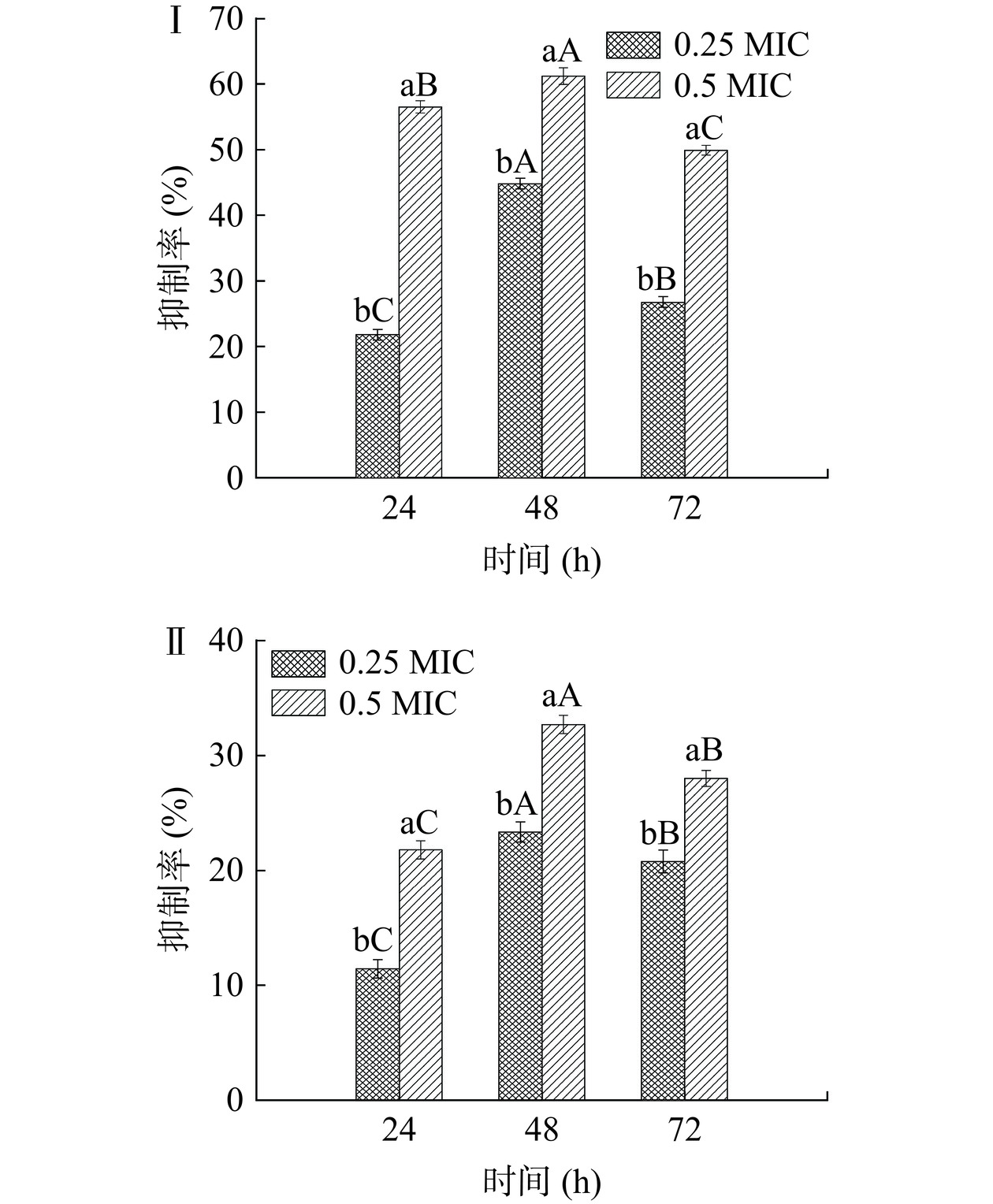
采用苯酚-硫酸法测定PLA对创伤弧菌生物膜胞外多糖含量的影响,如图5Ⅰ所示。经PLA处理后胞外多糖的含量降低,且呈现浓度依赖性。浓度0.25 MIC和0.5 MIC的PLA在48 h对胞外多糖的抑制率较高,达44.65%和61.97%,与24 h和72 h相比,分别提高了22.85%、5.45%和17.92%、12.05%。说明PLA对创伤弧菌生物膜胞外多糖具有抑制作用,且在48 h抑制作用较好。张娇娇等[26]研究发现1%苯乳酸处理使金黄色葡萄球菌生物膜胞外多糖含量降低了48.7%,本研究结果与之相似。
2.5.2 胞外蛋白
胞外蛋白在细菌生物膜的形成过程中起到重要作用,负责细胞的活动,与胞外多糖相互作用形成膜的三维结构[27]。PLA对创伤弧菌生物膜胞外蛋白含量的影响如图5Ⅱ所示,随着PLA浓度的增加细菌生物膜胞外蛋白含量减少,且呈现浓度依赖性。浓度0.25 MIC和0.5 MIC的PLA在48 h对胞外蛋白的抑制率较高,达23.35%和32.70%,与24 h和72 h相比,分别提高了11.93%、10.9%和2.57%、4.69%。说明PLA对创伤弧菌生物膜胞外蛋白具有抑制作用,且在48 h抑制作用较好。此结果与胞外多糖的结果一致,可能因为24 h是生物膜的形成初期,胞外蛋白和胞外多糖的分泌量低,48 h是生物膜的成熟期,胞外蛋白和胞外多糖分泌量增加,因此,此时的抑制效果更为明显。本研究与Jiang等[12]关于苯乳酸对单增李斯特菌生物膜的抑制作用研究相似,3 mg/mL的苯乳酸处理使单增李斯特菌胞外蛋白含量降低66.0%。
2.5.3 胞外DNA
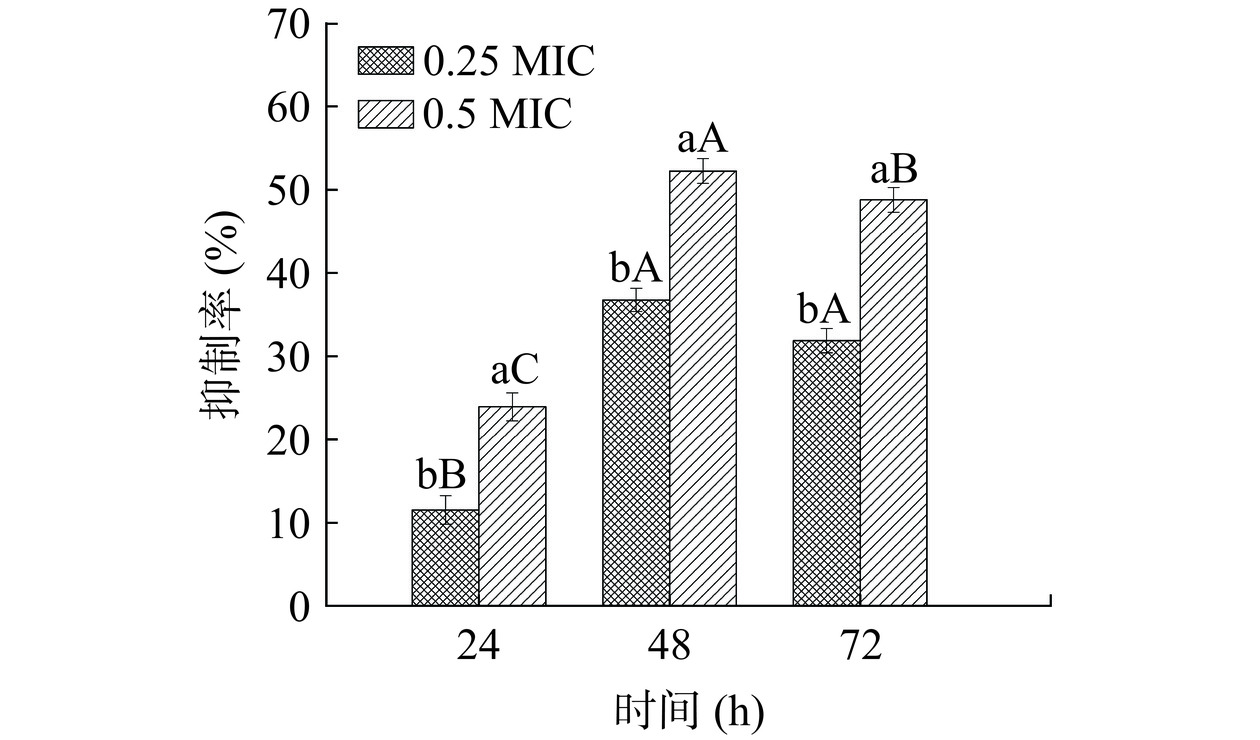
胞外DNA(extracell DNA,eDNA)也是胞外聚合物的重要组成成分之一。不同浓度PLA对创伤弧菌生物膜eDNA含量的影响如图6所示,随着PLA浓度的增加,其对eDNA的抑制率显著升高(P<0.05),且48 h抑制效果最好。浓度0.25 MIC和0.5 MIC的PLA在48 h对eDNA的抑制率显著较好(P<0.05),达36.73%和52.25%,与24 h和72 h相比,分别提高了25.22%、28.33%和4.86%、3.44%。生物膜形成前期胞外聚合物的抑制率低,可能是由于前期生物膜形成量少导致分泌的胞外聚合物少,生物膜成熟期形成的生物膜较为稳定此时分泌的胞外聚合物增加,后期可能因为成熟的生物膜脱落导致分泌的胞外聚合物减少,最终导致抑制率呈现先升高再下降的趋势[28]。
2.6 光学显微镜观察生物膜结构
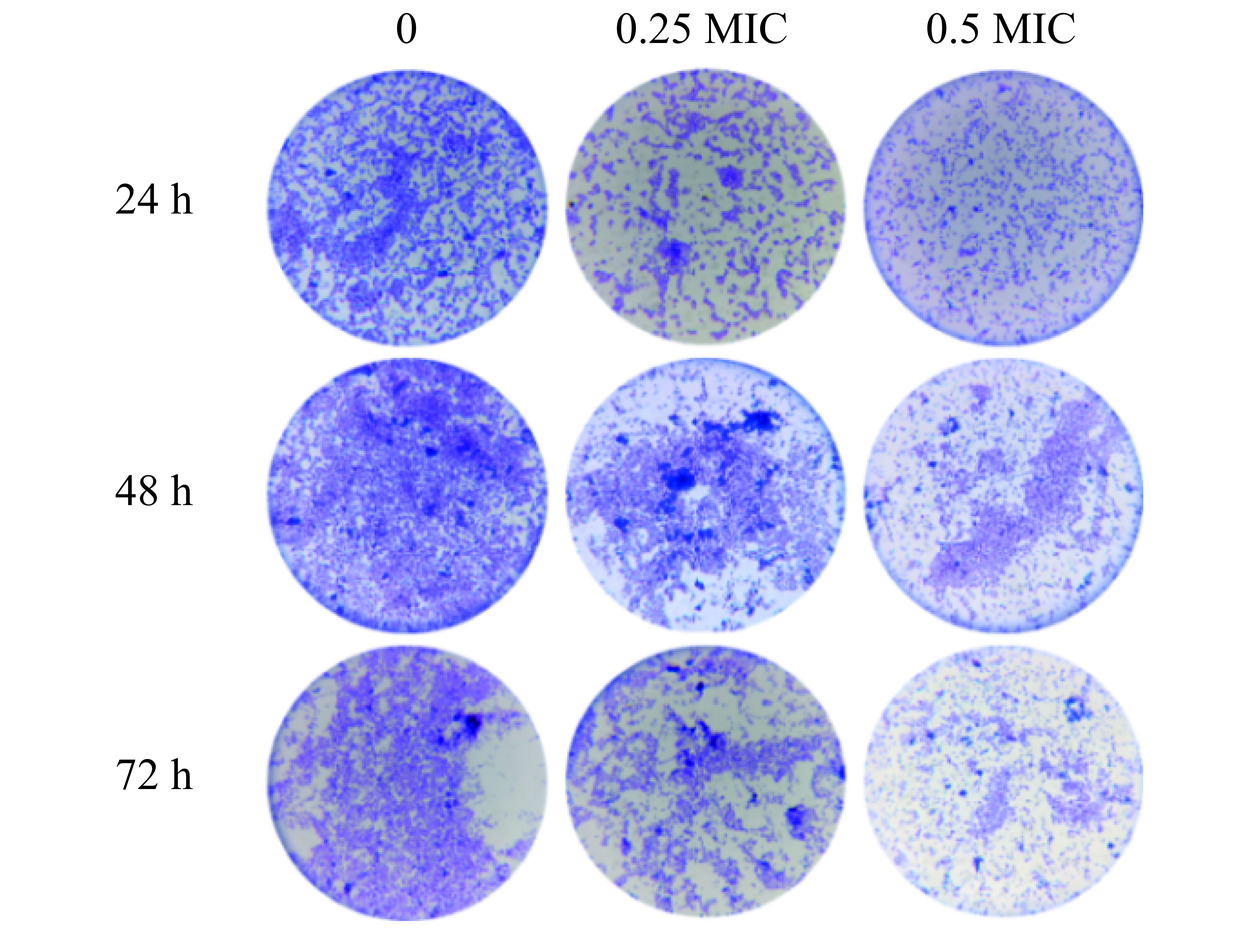
光学显微镜下不同浓度PLA在不同时间对创伤弧菌生物膜结构的影响如图7所示。对照组中菌体相互连接,聚集形成典型的生物膜结构,且48 h时形成的生物膜最密集,此时是生物膜形成的成熟期,与生物膜模型建立结果一致。在同一时间下,随着PLA浓度的增加,创伤弧菌生物膜生成量逐渐减少,且呈现浓度依赖性。PLA处理组菌体不再聚集,生物膜松散,密度明显降低,说明经PLA处理能够破坏创伤弧菌生物膜的结构。
2.7 激光共聚焦显微镜观察生物膜立体结构
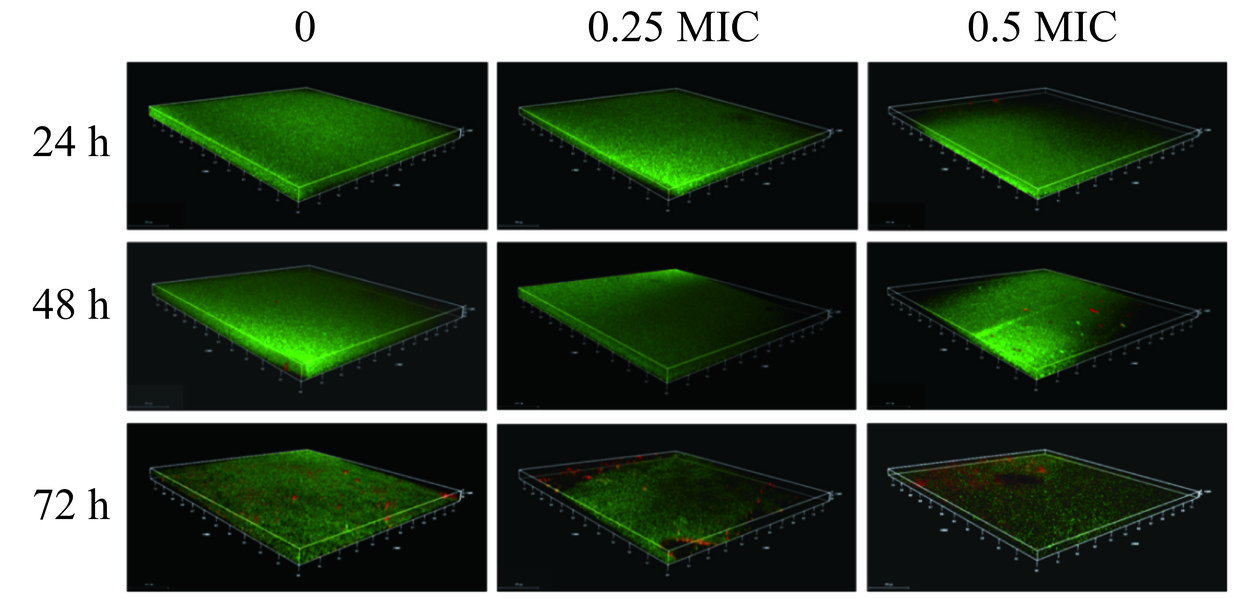
CLSM下不同浓度PLA在不同时间对创伤弧菌生物膜立体结构的影响如图8所示。对照组随着培养时间的增加生物膜的厚度先增加后减少,48 h形成的生物膜较好,72 h生物膜死菌的数量明显增加。同一时间下,随着PLA浓度的增加生物膜的完整性逐渐被破坏,且形成的生物膜不再均匀致密,开始出现死菌,说明经PLA处理能够破坏创伤弧菌生物膜结构的完整性。Liu等[29]研究了苯乳酸对单增李斯特菌生物膜结构的作用,与未处理组相比,3%苯乳酸处理破坏了生物膜的完整性,死菌数量更多,本研究与其结果相似。
3. 结论
创伤弧菌生物膜的聚集期、成熟期和脱落期分别在16~32、32~56和56~72 h。0.25 MIC和0.5 MIC苯乳酸对不同时期创伤弧菌生物膜均具有抑制作用,且呈浓度依赖性。0.5 MIC苯乳酸对培养48 h的生物膜抑制效果较好,对生物膜量、代谢活性、胞外多糖、胞外蛋白、胞外DNA的抑制率分别为51.04%、33.62%、61.97%、32.70%、52.25%。光学显微镜及CLSM观察显示PLA处理破坏了创伤弧菌生物膜的完整性,使细菌呈松散分布。本研究以期为苯乳酸作为抑菌剂控制水产品中创伤弧菌生物膜形成提供理论基础。但目前研究只是探究了PLA对生物膜表型性状的影响,还需通过转录组学和蛋白组学从基因和蛋白水平深入挖掘PLA抑制创伤弧菌生物膜形成的靶基因。
-
-
[1] 陈迪, 葛彩云, 孙玲莉, 等. 水产品中创伤弧菌的分离、鉴定及毒性研究[J]. 中国食品学报,2016,16(1):272−277. [CHEN Di, GE Caiyun, SUN Lingli, et al. Iolation, identification and toxicity study of Vibrio vulnificus in aquatic products[J]. Journal of Chinese Institute of Food Science and Technology,2016,16(1):272−277.] CHEN Di, GE Caiyun, SUN Lingli, et al. Iolation, identification and toxicity study of Vibrio vulnificus in aquatic products[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(1): 272−277.
[2] 何闪闪, 薛长湖, 李兆杰, 等. 水产品中创伤弧菌的快速检测与分离[J]. 中国食品学报,2005(3):93−97. [HE Shanshan, XUE Changhu, LI Zhaojie, et al. Rapid detection and isolation of Vibrio vulnificus in aquatic products[J]. Journal of Chinese Institute of Food Science and Technology,2005(3):93−97.] doi: 10.3969/j.issn.1009-7848.2005.03.016 HE Shanshan, XUE Changhu, LI Zhaojie, et al. Rapid detection and isolation of Vibrio vulnificus in aquatic products[J]. Journal of Chinese Institute of Food Science and Technology, 2005(3): 93−97. doi: 10.3969/j.issn.1009-7848.2005.03.016
[3] PARK H J, LEE B, JO Y, et al. Role of extracellular matrix protein CabA in resistance of Vibrio vulnificus biofilms to decontamination strategies[J]. International Journal of Food Microbiology,2016,236:123−129. doi: 10.1016/j.ijfoodmicro.2016.07.032
[4] 杨克慧, 董鹏程, 刘昀阁, 等. pmrA影响酸胁迫鼠伤寒沙门氏菌生物膜的形成能力[J]. 中国食品学报,2023,23(3):147−156. [YANG Kehui, DONG Pengcheng, LIU Yunge, et al. pmrA affects the ability of acid-stressed Salmonella typhimurium biofilm formation[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(3):147−156.] YANG Kehui, DONG Pengcheng, LIU Yunge, et al. pmrA affects the ability of acid-stressed Salmonella typhimurium biofilm formation[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(3): 147−156.
[5] O'LEARY D, MCCABE E M, MCCUSKER M P, et al. Acid environments affect biofilm formation and gene expression in isolates of Salmonella enterica Typhimurium DT104[J]. International Journal of Food Microbiology,2015,206:7−16. doi: 10.1016/j.ijfoodmicro.2015.03.030
[6] 郝歌, 黄雪娟, 米飞. 单核细胞增生李斯特菌生物膜形成机制的研究进展[J]. 卫生研究,2023,52(2):331−337. [HAO Ge, HUANG Xuejuan, MI Fei. Research progress on the biofilm formation mechanism of Listeria monocytogenes[J]. Journal of Hygiene Research,2023,52(2):331−337.] HAO Ge, HUANG Xuejuan, MI Fei. Research progress on the biofilm formation mechanism of Listeria monocytogenes[J]. Journal of Hygiene Research, 2023, 52(2): 331−337.
[7] LIU Yunge, WU Lina, HAN Jina, et al. Inhibition of biofilm formation and related gene expression of Listeria monocytogenes in response to four natural antimicrobial compounds and sodium hypochlorite[J]. Frontiers in Microbiology, 2021, 11.
[8] ZHAO X H, ZHAO F H, WANG J, et al. Biofilm formation and control strategies of foodborne pathogens:Food safety perspectives[J]. RSC Advances,2017,7(58):36670−36683. doi: 10.1039/C7RA02497E
[9] WAGNER E M, PRACSER N, THALGUTER S, et al. Identification of biofilm hotspots in a meat processing environment: Detection of spoilage bacteria in multi-species biofilms[J]. International Journal of Food Microbiology,2020,328:108668.
[10] 贾以泽, 舒泉先, 丛瑞涛, 等. 苯乳酸与DNA相互作用及其抑菌机制研究[J]. 食品与发酵工业,2024,50(5):67−75. [JIA Yize, SHU Quanxian, CONG Ruitao, et al. Interaction between phenyllactic acid and DNA and its antibacterial mechanism[J]. Food and Fermentation Industries Editorial Staff,2024,50(5):67−75.] JIA Yize, SHU Quanxian, CONG Ruitao, et al. Interaction between phenyllactic acid and DNA and its antibacterial mechanism[J]. Food and Fermentation Industries Editorial Staff, 2024, 50(5): 67−75.
[11] 孔祥丽, 马岩石, 吴昕雨, 等. 苯乳酸对具核梭杆菌的抑菌效果及机制[J]. 食品科学,2022,43(7):38−44. [KONG Xiangli, MA Yanshi, WU Xinyu, et al. Antibacterial effect and mechanism of phenyllactic acid on Fusobacterium nucleatus[J]. Food Science,2022,43(7):38−44.] doi: 10.7506/spkx1002-6630-20210401-016 KONG Xiangli, MA Yanshi, WU Xinyu, et al. Antibacterial effect and mechanism of phenyllactic acid on Fusobacterium nucleatus[J]. Food Science, 2022, 43(7): 38−44. doi: 10.7506/spkx1002-6630-20210401-016
[12] JIANG X B, JIANG C Y, YU T, et al. Phenyllactic acid application to control Listeria monocytogenes biofilms and its growth in milk and spiced beef[J]. International Journal of Food Microbiology,2022,381:109910. doi: 10.1016/j.ijfoodmicro.2022.109910
[13] LIU F, SUN Z L, WANG F T, et al. Inhibition of biofilm formation and exopolysaccharide synthesis of Enterococcus faecalis by phenyllactic acid[J]. Food Microbiology,2020,86:103344. doi: 10.1016/j.fm.2019.103344
[14] 孙梦桐, 吕欣然, 崔天琦, 等. 鱼类肠道中抑制哈维氏弧菌群体感应及生物膜形成的乳酸菌的筛选和鉴定[J]. 中国食品学报,2020,20(8):255−263. [SUN Mengtong, LÜ Xinran, CUI Tianqi, et al. Screening and identification of lactic acid bacteria that inhibit Vibrio harvey quorum sensing and biofilm formation in fish gut[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(8):255−263.] SUN Mengtong, LÜ Xinran, CUI Tianqi, et al. Screening and identification of lactic acid bacteria that inhibit Vibrio harvey quorum sensing and biofilm formation in fish gut[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(8): 255−263.
[15] 王凤婷. 苯乳酸对两株食源性腐败菌及其生物膜产生的抑制作用研究[D]. 哈尔滨:东北农业大学, 2018. [WANG Fengting. Study on the inhibitory effect of phenyllactic acid on the production of two strains of foodborne spoilage bacteria and their biofilms[D]. Harbin:Northeast Agricultural University, 2018.] WANG Fengting. Study on the inhibitory effect of phenyllactic acid on the production of two strains of foodborne spoilage bacteria and their biofilms[D]. Harbin: Northeast Agricultural University, 2018.
[16] 陈萍. 副溶血性弧菌-单增李斯特菌共培养下混合生物被膜形成及种间关系的研究[D]. 上海:上海海洋大学, 2021. [CHEN Ping. Study on the formation of mixed biofilm and its interspecific relationship under Vibrio parahaemolyticus-Listeria monocytogenes co-culture[D]. Shanghai:Shanghai Ocean University, 2021.] CHEN Ping. Study on the formation of mixed biofilm and its interspecific relationship under Vibrio parahaemolyticus-Listeria monocytogenes co-culture[D]. Shanghai: Shanghai Ocean University, 2021.
[17] 白梅, 黄天, 郭帅, 等. 益生菌干酪乳杆菌Zhang和乳双歧杆菌V9发酵乳胞外多糖含量对流变学特性、质构和稳定性的影响[J]. 中国食品学报,2021,21(4):193−202. [BAI Mei, HUANG Tian, GUO Shuai, et al. Effects of probiotic Lactobacillus casei Zhang and Bifidobacterium lactis V9 on rheological properties, texture and stability[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(4):193−202.] BAI Mei, HUANG Tian, GUO Shuai, et al. Effects of probiotic Lactobacillus casei Zhang and Bifidobacterium lactis V9 on rheological properties, texture and stability[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(4): 193−202.
[18] WANG S Y, HAN D C, SONG C, et al. Membrane biofouling retardation by zwitterionic peptide and its impact on the bacterial adhesion[J]. Environmental Science and Pollution Research,2019,26(16):16674−16681. doi: 10.1007/s11356-019-04898-5
[19] 胡文静, 刘小雪, 梁栋, 等. 肌苷对酸土脂环酸芽孢杆菌生长及生物膜形成的影响[J]. 中国食品学报,2023,23(9):242−251. [HU Wenjing, LIU Xiaoxue, LIANG Dong, et al. Effect of inosine on the growth and biofilm formation of Bacillus acidocycloliccas[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(9):242−251.] HU Wenjing, LIU Xiaoxue, LIANG Dong, et al. Effect of inosine on the growth and biofilm formation of Bacillus acidocycloliccas[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(9): 242−251.
[20] 易正凯, 谢晶. 水产品腐败菌生物膜的形成及调控机制研究进展[J]. 中国食品学报,2022,22(3):342−352. [YI Zhengkai, XIE Jing. Research progress on the formation and regulation mechanism of biofilm of spoilage bacteria in aquatic products[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(3):342−352.] YI Zhengkai, XIE Jing. Research progress on the formation and regulation mechanism of biofilm of spoilage bacteria in aquatic products[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(3): 342−352.
[21] 杜宏, 吕欣然, 崔晓玲, 等. 融合魏斯氏菌对单增李斯特菌生物膜形成的影响[J]. 食品研究与开发,2021,42(13):180−187. [DU Hong, LÜ Xinran, CUI Xiaoling, et al. Effect of fusion Weiss bacteria on biofilm formation in Listeria monocytogenes[J]. Food Research and Development,2021,42(13):180−187.] doi: 10.12161/j.issn.1005-6521.2021.13.027 DU Hong, LÜ Xinran, CUI Xiaoling, et al. Effect of fusion Weiss bacteria on biofilm formation in Listeria monocytogenes[J]. Food Research and Development, 2021, 42(13): 180−187. doi: 10.12161/j.issn.1005-6521.2021.13.027
[22] 姜聪一, 康瑞, 于涛, 等. 苯乳酸对单增李斯特菌生物被膜的影响[J]. 食品工业科技,2023,44(18):164−172. [JIANG Congyi, KANG Rui, YU Tao, et al. Effect of phenyllactic acid on the biofilm of Listeria monocytogenes[J]. Science and Technology of Food Industry,2023,44(18):164−172.] JIANG Congyi, KANG Rui, YU Tao, et al. Effect of phenyllactic acid on the biofilm of Listeria monocytogenes[J]. Science and Technology of Food Industry, 2023, 44(18): 164−172.
[23] XIE T, LIAO Z L, LEI H, et al. Antibacterial activity of food-grade chitosan against Vibrio parahaemolyticus biofilms[J]. Microbial Pathogenesis,2017,110:291−297. doi: 10.1016/j.micpath.2017.07.011
[24] JIANG Y H, YANG L Y, XIN W G, et al. Combined antibacterial and antibiofilm activity of phenyllactic acid and bacteriocin XJS01 against Shigella flexneri[J]. Food Bioscience, 2022, 45.
[25] 王艳, 顾悦, 郑砚学, 等. 外源信号分子AI-2对发酵乳杆菌TG4-1-1和乳酸片球菌11-3产胞外多糖的影响[J]. 中国食品学报,2023,23(6):18−28. [WANG Yan, GU Yue, ZHENG Yanxue, et al. Effect of exogenous signaling molecule AI-2 on exopolysaccharide production by Lactobacillus fermentum TG4-1-1 and Pediococcus lactis 11-3[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(6):18−28.] WANG Yan, GU Yue, ZHENG Yanxue, et al. Effect of exogenous signaling molecule AI-2 on exopolysaccharide production by Lactobacillus fermentum TG4-1-1 and Pediococcus lactis 11-3[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(6): 18−28.
[26] 张娇娇. 超声协同苯乳酸对冷鲜鸡肉中三种常见食源性致病菌的抑制作用研究[D]. 镇江:江苏大学, 2023. [ZHANG Jiaojiao. Study on the inhibitory effect of ultrasound combined with phenyllactic acid on three common foodborne pathogens in chilled chicken[D]. Zhenjiang:Jiangsu University, 2023.] ZHANG Jiaojiao. Study on the inhibitory effect of ultrasound combined with phenyllactic acid on three common foodborne pathogens in chilled chicken[D]. Zhenjiang: Jiangsu University, 2023.
[27] 古伟明, 马皓然, 孙建霞, 等. 姜黄素共晶光动力对副溶血性弧菌生物被膜的作用[J]. 食品与发酵工业,2022,48(20):78−84. [GU Weiming, MA Haoran, SUN Jianxia, et al. Effect of curcumin eutectic photodynamics on Vibrio parahaemolyticus biofilm[J]. Food and Fermentation Industries,2022,48(20):78−84.] GU Weiming, MA Haoran, SUN Jianxia, et al. Effect of curcumin eutectic photodynamics on Vibrio parahaemolyticus biofilm[J]. Food and Fermentation Industries, 2022, 48(20): 78−84.
[28] 李虹. 环二肽对金黄色葡萄球菌生物膜的抑制机制研究及其应用[D]. 镇江:江苏大学, 2021. [LI Hong. Study on the inhibitory mechanism of cyclic dipeptide on Staphylococcus aureus biofilm and its application[D]. Zhenjiang:Jiangsu University, 2021.] LI Hong. Study on the inhibitory mechanism of cyclic dipeptide on Staphylococcus aureus biofilm and its application[D]. Zhenjiang: Jiangsu University, 2021.
[29] LIU F, DU L H, ZHAO T, et al. Effects of phenyllactic acid as sanitizing agent for inactivation of Listeria monocytogenes biofilms[J]. Food Control, 2017, 78.





 下载:
下载:
 下载:
下载:
