Study on Extraction, Purification, Structure Characterization and Hypoglycemic Activity of the Seed Kernel Polysaccharide from Acer truncatum Bunge
-
摘要: 对元宝枫(Acer truncatum Bunge)种仁多糖进行提取纯化,探究其理化性质和降糖活性。采用水提醇沉法提取元宝枫种仁多糖,并通过响应面法优化元宝枫种仁多糖提取工艺。通过Sevage法脱蛋白和柱层析对元宝枫种仁多糖进行纯化,通过红外光谱、热重分析及离子色谱法对其进行单糖组成和结构表征,并进一步通过建立肝癌细胞胰岛素抵抗模型(IR-HepG2),考察纯化后元宝枫种仁多糖体外降糖活性。结果表明,在提取1次、液固比为30:1 mL/g、提取温度为80 ℃、提取时间为3.5 h条件下,多糖(PATM)得率为18.17%。经Sevage法脱蛋白,DEAE-DE纤维素52层析柱和SephadexG-100凝胶层析柱分离纯化,得到纯化多糖(PATM-3-1)。PATM-3-1具有多糖组分红外光谱特征峰,其单糖组成为D-半乳糖醛酸、L-阿拉伯糖、D-半乳糖、L-鼠李糖、D-葡萄糖、D-木糖、D-甘露糖、D-葡萄糖醛酸、L-岩藻糖、D-核糖和D-氨基葡萄糖。体外降糖活性实验的结果表明,PATM-3-1具有较强的α-淀粉酶抑制活性,能显著(P<0.05)提高胰岛素诱导的HepG2细胞中葡萄糖消耗量、糖原含量、己糖激酶、丙酮酸激酶含量,展现出优异的降糖活性。本研究为元宝枫种仁多糖的开发和应用提供参考和数据支撑。Abstract: Extraction and purification of polysaccharides from the seed kernel of Acer truncatum Bungeto investigate their physicochemical properties and hypoglycemic activity. In the study, the polysaccharide was obtained by water extraction and ethanol precipitation from seed kernel of Acer truncatum Bunge, and the extraction process was optimized by response surface method. The polysaccharide was purified by Sevage deproteinization and column chromatography. The composition and structure of the purified polysaccharide were characterized by infrared spectroscopy, thermogravimetric analysis and ion chromatography, and its hypoglycemic activity was further investigated by the insulin resistance model of liver cancer cell (IR-HepG2). The results showed that the yield of crude polysaccharide (PATM) was 18.17% under the conditions of extraction times 1, liquid-solid ratio 30:1 mL/g, extraction temperature 80 ℃ and extraction time 3.5 h. The purified polysaccharide (PATM-3-1) obtained by the Sevage deproteinization, DEAE-DE cellulose 52 column and SephadexG-100 gel column had the characteristic peak of infrared spectrum of polysaccharide component, and was composed of D-galacturonic acid, L-arabinose, D-galactose, L-rhamnose, D-glucose, D-xylose, D-mannose, D-glucuronic acid, L-fucose, D-ribose and D-glucosamine. The results of hypoglycemic activity experiment in vitro showed that PATM-3-1 had strong α-amylase inhibitory activity, and could significantly (P<0.05) increase the glucose consumption, glycogen content, hexokinase content and pyruvate kinase content in IR-HepG2, demonstrating excellent hypoglycemic activity. This study would provide data support for the development and application of seed kernel polysaccharide from Acer truncatum Bunge.
-
我国Ⅱ型糖尿病(T2DM)患者占总糖尿病患的90%以上,T2DM发病机制尚不明确,但人们普遍认为胰腺β细胞功能障碍和胰岛素抵抗是两个主要因素[1]。此外,氧化应激在T2DM的发病机制中发挥作用。通常用于治疗这种疾病的药物是西药,这些药物往往具有副作用大、选择有限和成本高等[2]缺陷。张培莲[3]的研究发现使用胰岛素治疗糖尿病后会出现低血糖、体重增加、水肿、脂肪组织增生以及脂肪萎缩等不良反应。植物多糖具有多种生物学功能,如改善肠道健康、增强免疫力、抗氧化、抗病毒和抗应激等[4]作用。随着人们生活水平的提高和科技的进步,植物多糖在食品[5]、医药[6]和材料等[7]领域得到了广泛应用。马宁珠等[8]发现虎杖多糖能够显著降低糖尿病大鼠的糖耐量和空腹血糖。赵凯迪等[9]发现桔梗多糖可以通过改善T2DM大鼠代谢水平和氧化应激水平起到降血糖作用。
元宝枫为槭树科槭树属的植物,因翅果形状像中国古代金锭“元宝”得以命名。2011年我国卫生部(如今的国家卫生健康委员会)发布的“关于批准元宝籽油和牡丹籽油作为新资源食品的公告”,标志着元宝枫籽油正式成为被国家承认的食用油;2015年国务院办公厅发布《关于加快木本油料产业发展的意见》(国办发[2014]68号)重点提及加快元宝枫等木本油料作物产业的综合发展。近年来,科研工作者发现元宝枫种仁中除了富含有油脂[10],还含有蛋白质[11]和多糖[12],目前关于元宝枫种仁的研究还主要集中在油脂提取和其功能性脂肪酸—神经酸的纯化等方面。而对元宝枫种仁多糖的研究,仅仅局限于对元宝枫种仁多糖的提取方面,对元宝枫种仁多糖分离纯化、单糖组成、以及生物活性等方面的研究却鲜有报道。
本实验利用水提醇沉法从元宝枫种仁中提取多糖, 并通过单因素和响应面法对元宝枫种仁多糖提取工艺进行优化。经Sevage法脱蛋白、DEAE-DE纤维素52层析柱和SephadexG-100凝胶层析柱分离纯化元宝枫种仁多糖,并对所获得多糖进行了红外光谱分析、同步热分析、单糖组成分析、α-淀粉酶抑制活性以及降血糖等活性检测,为元宝枫种仁多糖的开发和应用提供参考和数据支撑。
1. 材料与方法
1.1 材料与仪器
元宝枫种仁 购置于陕西金旺农林科技有限公司;DEAE-DE纤维素52、SephadexG-100凝胶、阿卡波糖(BR,95%)、α-淀粉酶(50 U/mg)、噻唑蓝(Thiazolyl Blue,MTT)(BR,95%)、单糖标准品 美国Sigma公司;胎牛血清(Fetal Bovine Serum,FBS) 浙江天杭生物科技有限公司;MEM培养基 美国Gibco公司;二甲基亚砜(Dimethyl Sulfoxide,DMSO) Biosharp公司;葡萄糖(Glucose,GLU)试剂盒、糖原(Glycogen,Gn)测定试剂盒、己糖激酶(Hexokinase,HK)试剂盒、丙酮酸激酶(Pyruvate Kinase,PK)试剂盒、3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS) 南京建成生物工程研究所;HepG2细胞 上海瑾元生物科技有限公司;其他试剂 均为国产分析纯。
IRAffinity-1傅里叶变换红外光谱 日本岛津公司;STA449F5同步热分析仪 德国耐驰仪器制造有限公司;Reacti-thermo氮气吹扫仪 美国Thermo公司;ICS5000+离子色谱仪 美国Thermo公司;HZQ-F全温振荡培养箱 哈尔滨东联电子技术有限公司;Infinite 200 PRO酶标仪 长沙泰肯生物技术有限公司;CYTATION5高内涵成像分析系统 美国伯腾仪器有限公司;HL-2B数显恒流泵 上海驰唐电子有限公司;UV-5500紫外分光光度计 上海元析仪器有限公司。
1.2 实验方法
1.2.1 元宝枫种仁多糖的制备工艺研究
1.2.1.1 元宝枫种仁多糖的提取
元宝枫种仁于60 ℃烘干后,粉碎过20目筛,室温存储备用。精确称取上述元宝枫种仁粉末100 g于圆底烧瓶中,加入1500 mL超纯水,用加热套回流煮沸4 h后冷却,以5000 r/min离心10 min,收集上清液,浓缩至50 mL左右,加入200 mL无水乙醇在4 ℃下醇沉12 h,在6000 r/min离心10 min,回收多糖,使用超纯水重新溶解多糖,透析72 h,冻干得元宝枫多糖。
1.2.1.2 元宝枫种仁多糖得率
计算采用苯酚-硫酸法测定多糖(PATM)的质量浓度,并按公式(1)计算,得到PATM质量分数得率。
(1) 式中:Y表示提取多糖PATM的得率,%;ρ表示多糖质量浓度,mg/mL;n表示稀释倍数;V表示多糖溶液的体积,mL;m表示样品绝干质量,mg。
1.2.2 单因素实验
采用水提醇沉法提取PATM,以多糖得率为指标,对提取各因素进行研究。
1.2.2.1 提取次数
固定提取温度80 ℃,提取时间3 h,液固比30:1 mL/g,考察提取次数(提取1、2、3次)对多糖(PATM)得率的影响。
1.2.2.2 提取温度
固定液固比30:1 mL/g,提取时间3 h,提取1次,考察不同提取温度(60、70、80、90、100 ℃)对多糖(PATM)得率的影响。
1.2.2.3 提取时间
固定液固比30:1 mL/g,提取温度80 ℃,提取1次,考察不同提取时间(1、2、3、4、5 h)对多糖(PATM)得率的影响。
1.2.2.4 液固比
固定提取温度80 ℃,提取时间3 h,提取1次,考察不同液固比(10:1、15:1、20:1、30:1、40:1 mL/g)对多糖(PATM)得率的影响。
1.2.3 响应面优化试验
根据单因素实验结果,提取次数固定为1次。选取提取温度(℃)、提取时间(h)、液固比(mL/g)三个因素,以PATM得率为响应值,运用Box-Behnken进行响应面试验优化设计[13],其试验因素与水平设计见表1。
表 1 响应面试验因素与水平Table 1. Response surface test factors and levels因素 水平 −1 0 1 A提取温度(℃) 70 80 90 B提取时间(h) 2 3 4 C液固比(mL/g) 20:1 30:1 40:1 1.2.4 元宝枫种仁多糖的分离纯化
1.2.4.1 元宝枫种仁多糖脱蛋白
采用Sevage试剂[V(三氯甲烷):V(正丁醇)=4:1]脱除蛋白[14],将PATM溶液与Sevage试剂混合搅拌30 min,以5000 r/min离心10 min,收集上清液,重复至蛋白无析出,上清液于旋转蒸发仪去除有机试剂,收集多糖溶液,用3500 Da 透析袋流水透析24 h。将透析后的多糖溶液进行浓缩、冻干,放置干燥器中以进行后续实验。
1.2.4.2 纤维素层析柱分离元宝枫种仁多糖
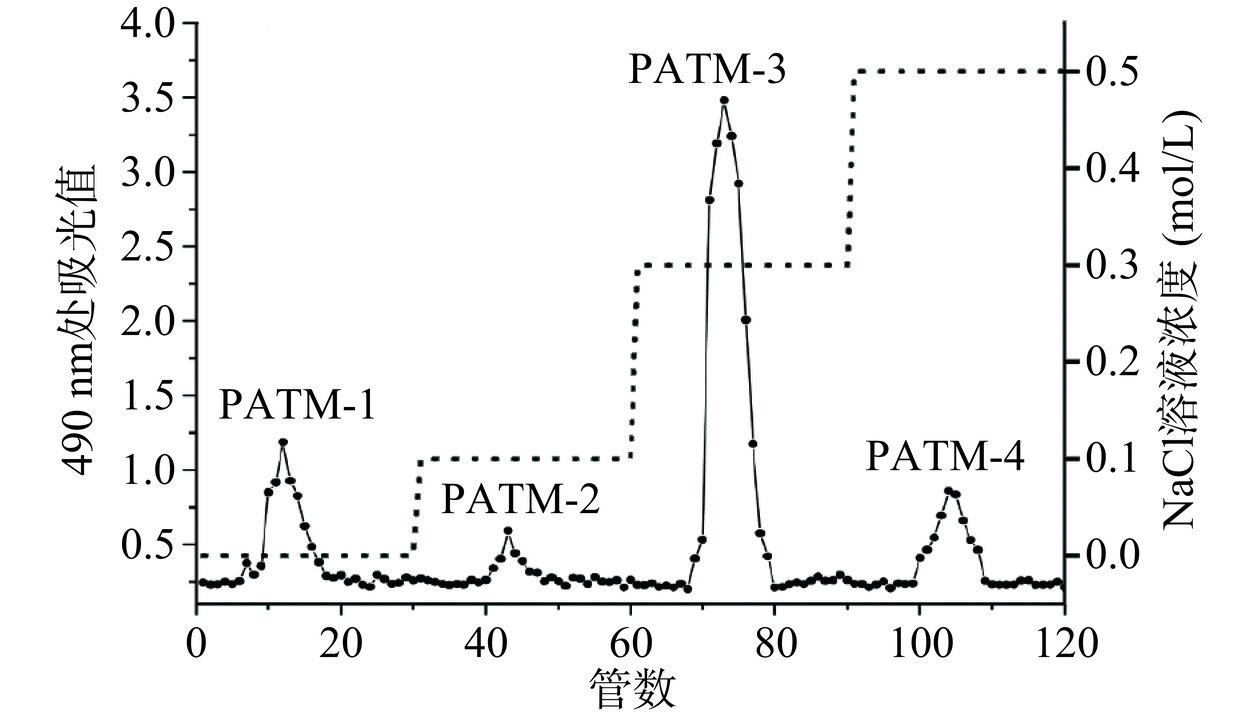
称取500 mg除蛋白的PATM,配置成质量浓度为10 mg/mL的多糖溶液。将多糖溶液缓慢注入DEAE-DE纤维素52层析柱中,依次用超纯水、0.1、0.3、0.5 mol/L的NaCl溶液进行洗脱,流速为1 mL/min,每管4 mL。收集不同洗脱条件的多糖组分,采用苯酚-硫酸法处测定每管中多糖含量,记录OD值。根据峰值段收集洗脱液,减压浓缩,用透析袋流水透析24 h后冻干,得到4个多糖组分:PATM-1、PATM-2、PATM-3和PATM-4。
1.2.4.3 凝胶层析柱纯化元宝枫种仁多糖
采用SephadexG-100凝胶层析柱对主要多糖成分PATM-3进一步分离纯化,上样浓度为5 mg/mL,缓慢注入SephadexG-100凝胶层析柱,0.2 mL/min的流速去离子水进行洗脱,每管4 mL。采用苯酚-硫酸法测定洗脱液在490 nm处吸光值,并绘制洗脱曲线[15]。根据峰值段收集洗脱液,将收集洗脱液浓缩和冷冻干燥,得到纯化组分PATM-3-1。
1.2.5 多糖和蛋白含量测定
以葡萄糖为标准品,采用苯酚-硫酸法测定PATM-3-1多糖含量[16],其回归方程Y=1.0536X+0.0064(R2=0.9932);使用BCA试剂盒检测PATM-3-1多糖中蛋白质含量。
1.2.6 单糖组成测定
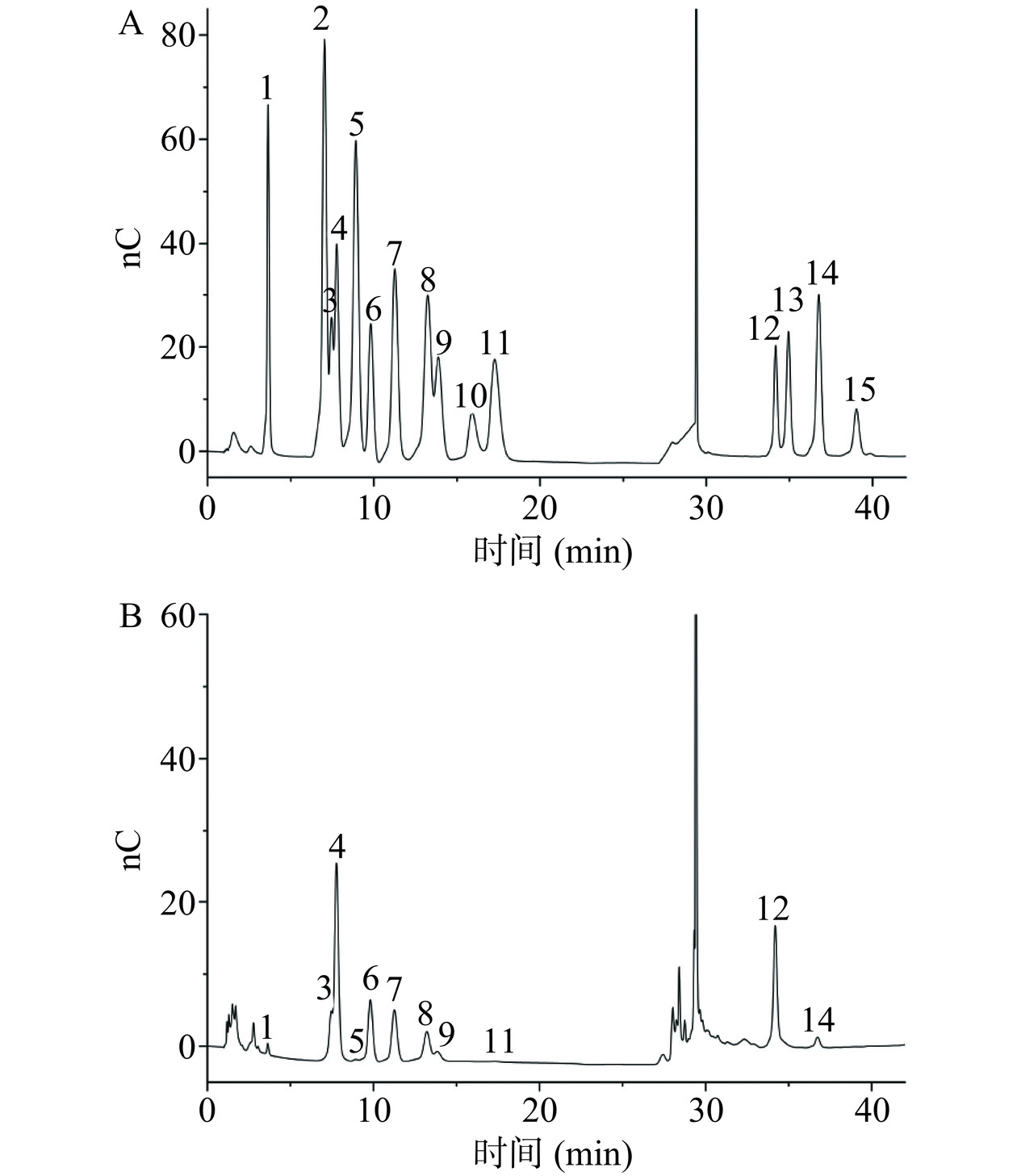
准确称量PATM-3-1多糖样品5 mg,加入2 mol/L 三氟乙酸(TFA)溶液1 mL,105 ℃加热6 h。超纯氮气吹干,加入甲醇清洗,在通过超纯氮气吹干,重复甲醇清洗2~3次。加入超纯水溶解,并通过0.22 μm微孔膜转入色谱瓶中进行测量。HPAEC条件为:Thermo ICS5000离子色谱系统(ICS5000),利用电化学检测器对单糖组分进行分析检测。采用Dionex™ CarboPac™ PA10(250 mm×4.0 mm,10 μm)液相色谱柱;进样量为5 μL。流动相A(0.1 mol/L NaOH),流动相B(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温设置为30 ℃;洗脱梯度:0 min A相/B相(95:5 V/V),30 min A相/B相(80:20 V/V),30.1 min A相/B相(60:40 V/V),45 min A相/B相(60:40 V/V),45.1 min A相/B相(95:5 V/V)。数据在ICS5000离子色谱仪上采集,并使用Chromeleon 7.2 CDS进行处理。
1.2.7 红外光谱分析
称取2 mg多糖样品(PATM-3-1),与200 mg的干燥后的溴化钾在玛瑙研钵中研磨均匀,放入压片机压成薄片。以溴化钾片作为背景去除干扰,在分辨率为4 cm−1在4000~500 cm−1范围内进行红外光谱扫描[17]。
1.2.8 热重分析
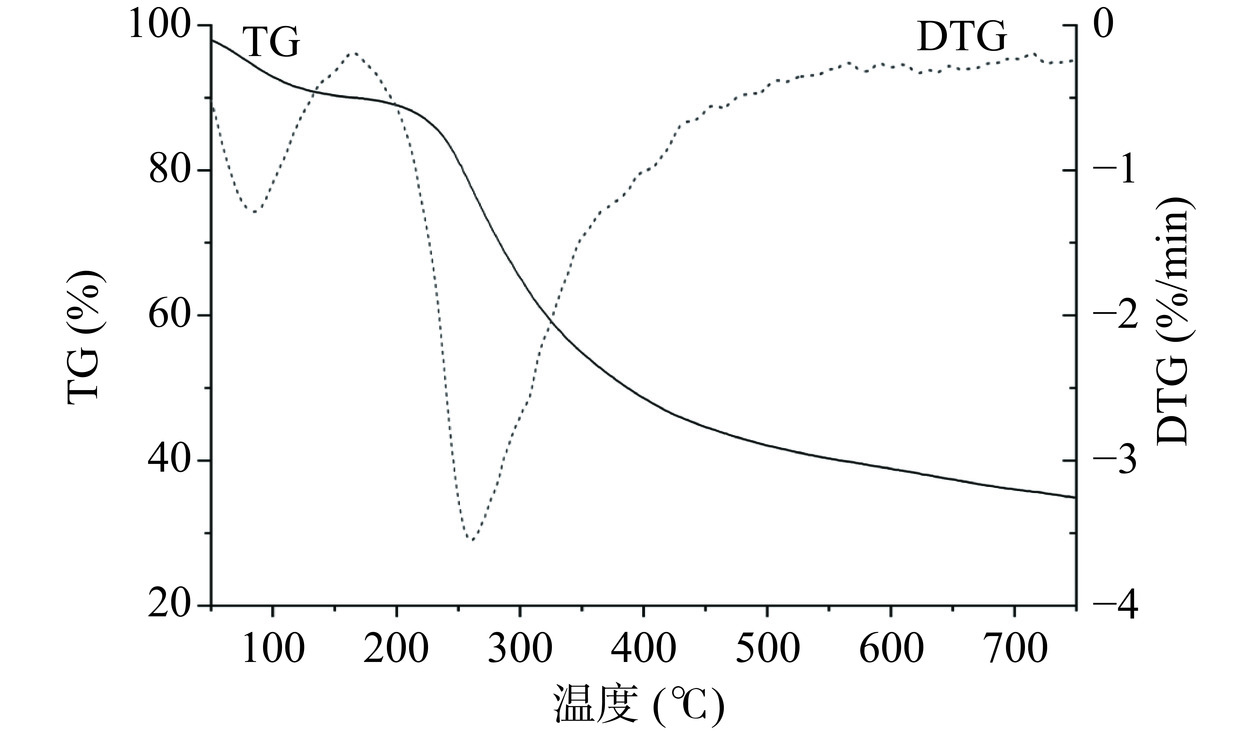
采用同步热分析法分析纯化多糖的热稳定性。称取5 mg多糖样品(PATM-3-1),放于坩埚中,以10 ℃/min加热速率,在20~800 ℃范围进行热重分析[18]。
1.2.9 刚果红实验
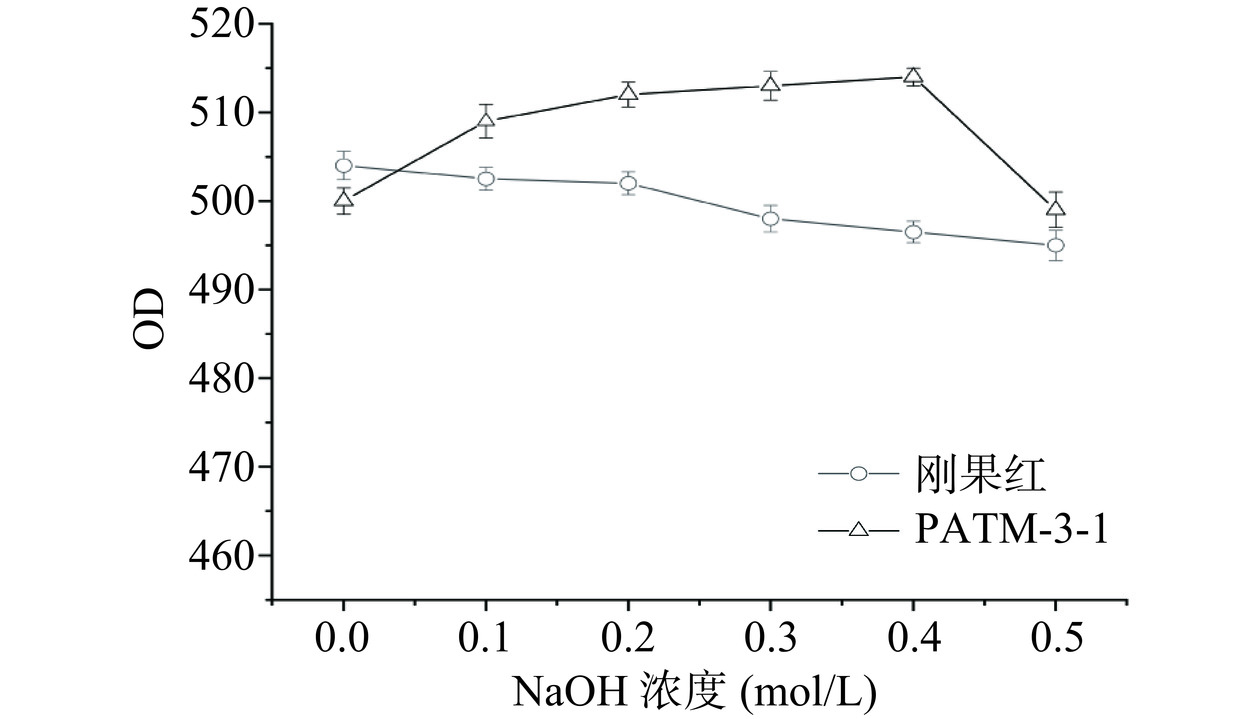
采用刚果红法分析纯化多糖的三螺旋结构。取2 mL(1 mg/mL)纯化多糖溶液与2 mL(160 µmol/L)刚果红溶液混合,依次加入不同浓度(0、0.1、0.3、0.4、0.5 mol/L)的NaOH溶液,室温静置15 min,600~400 nm范围进行全波长扫描,测定溶液最大吸收波长。以NaOH浓度为横坐标,以最大吸收波长为纵坐标,并绘制曲线[19]。
1.2.10 体外降糖活性研究
1.2.10.1 α-淀粉酶抑制率测定
根据文献[20]描述的方法,对多糖PATM-3-1进行α-淀粉酶的抑制率测定。用去离子水将多糖配置成不同质量浓度的溶液。以不同浓度阿卡波糖为阳性对照,取250 µL多糖溶液,与40 µL α-淀粉酶(5 U)充分混合,37 ℃水浴10 min后,加入质量分数为1%可溶性淀粉溶液500 µL,继续37 ℃水浴5 min,取出后加入600 µL DNS试剂终止反应,并在沸水浴加热10 min,冷却至室温,540 nm处检测吸光值,按公式(2)计算α-淀粉酶的抑制率。
(2) 式中:Y表示为α-淀粉酶抑制率,%;A0表示用去离子水代替样品的吸光值;A1表示被测样品反应后的吸光值;A2表示去离子水代替α-淀粉酶溶液混合后的吸光值。
1.2.10.2 胰岛素抵抗细胞模型的建立
取对数生长期的HepG2细胞,用0.25%胰酶进行消化,加入完全培养基调节成1×105个/mL的细胞悬液,接种于96孔板,每孔100 µL,细胞贴壁后,弃去培养基,加入含有不同浓度胰岛素的无血清MEM培养基(10−9、10−8、10−7、10−6、10−5 mol/L)100 µL,培养36 h根据细胞的葡萄糖消耗量来确定最佳的胰岛素浓度。
1.2.10.3 细胞存活率测定
采用MTT法[21]测定多糖PATM-3-1对HepG2细胞存活率的影响。将PATM-3-1用MEM培养基配制成不同质量浓度备用。将1×105个/mL的HepG2细胞悬液加入96孔板,每孔100 µL。放入37 ℃、5% CO2的培养箱中培养24 h后,加入100 µL不同质量浓度(2560、1280、640、320、160、80 µg/mL)的PATM-3-1继续培养24 h,加入5 mg/mL MTT溶液50 µL继续在培养箱中培养3 h,弃去上清液,加入150 µL DMSO溶液,充分振荡10 min,490 nm处检测吸光值[22]。并按照公式(3)计算HepG2细胞存活率。
(3) 式中:Y表示细胞存活率,%;A0表示无细胞孔的吸光值;A1表示含有HepG2细胞和被测样品的吸光值;A2表示含有HepG2细胞的吸光值。
1.2.10.4 细胞培养与分组
在37 ℃、5% CO2的培养条件下,用完全培养基(89% MEM培养基、10%FBS和1%青霉素-链霉素)培养HepG2细胞。当细胞贴壁80%后,用0.25%胰酶进行消化传代,并选取对数生长期细胞进行实验。取对数生长期HepG2细胞,加入完全培养基调节成1×105个/mL的细胞悬液,接种于6孔板中每孔1 mL。将细胞分为六组:空白组、模型组(10−7 mol/L胰岛素)、阳性对照组(1 mg/mL二甲双胍+10−7 mol/L胰岛素)、PATM-3-1低剂量组(320 μg/mL PATM-3-1+10−7 mol/L胰岛素)、PATM-3-1中剂量组(640 μg/mL PATM-3-1+10−7 mol/L胰岛素)、PATM-3-1高剂量组(1280 μg/mL PATM-3-1+10−7 mol/L胰岛素)。
1.2.10.5 葡萄糖消耗量和糖原含量测定
按照1.2.10.4中的细胞分组进行培养,用0.25%胰酶消化,收集细胞离心弃上清液,用PBS清洗细胞1~2次,离心保留沉淀细胞。向沉淀细胞中加入0.1 mol/L pH7.4的磷酸盐缓冲溶液,冰水浴下超声破碎。按照葡萄糖(GLU)、糖原(Glycogen)和蛋白定量(TP)试剂盒说明进行检测。
1.2.10.6 己糖激酶(HK)和丙酮酸激酶(PK)活性测定
实验分组同1.2.10.4,用0.25%胰酶消化后,收集、离心、保留沉淀细胞待用,后续操作按照己糖激酶(HK)、丙酮酸激酶(PK)和蛋白定量(TP)试剂盒说明进行检测。
1.3 数据处理
使用Design-Expert 13.0.1 软件进行响应面试验设计及试验数据处理,并对实验数据进行分析。每组实验3个平行,实验数据以平均值±标准误差表示,利用软件SPSS Statistics26.0进行方差分析,P<0.01表示差异性极显著P<0.05表示差异显著,采用Origin 2021.0 进行数据和图像处理并生成图片。
2. 结果与分析
2.1 单因素结果分析
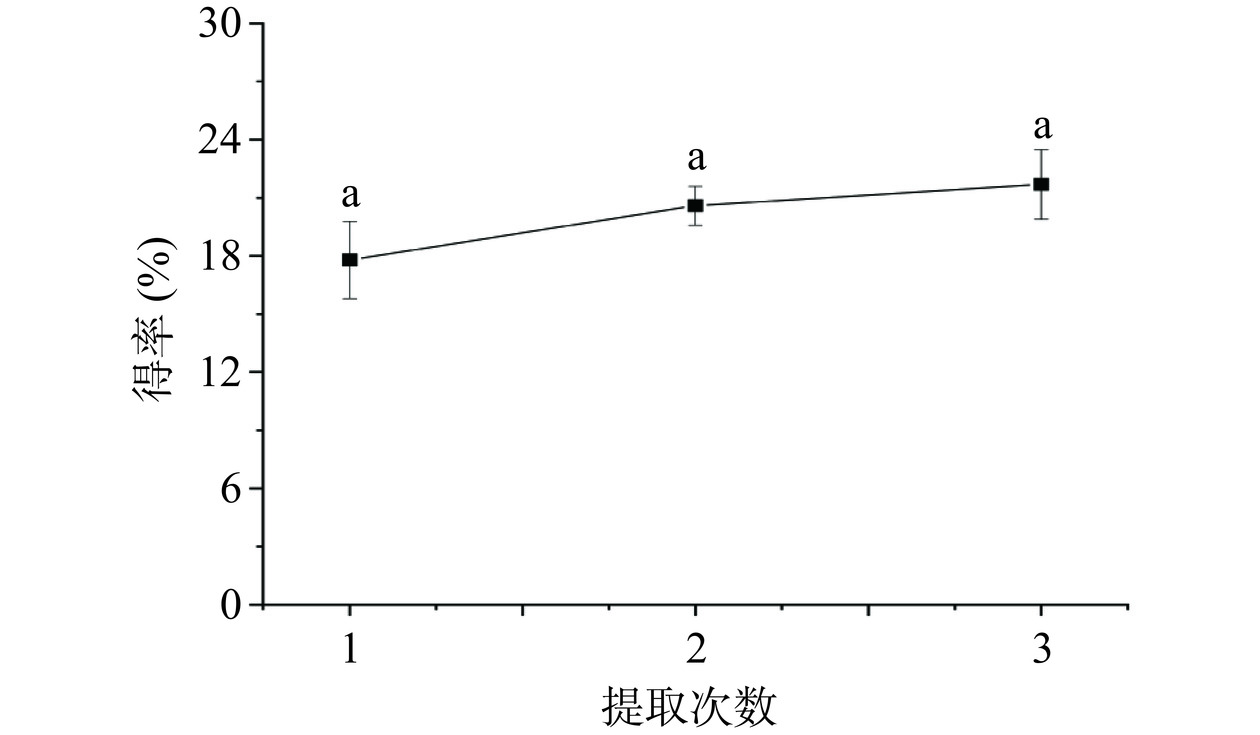
2.1.1 提取次数对元宝枫种仁多糖得率的影响
提取次数对PATM得率的影响如图1所示,提取1次多糖得率为17.79%,提取2次多糖得率为20.60%,提取3次多糖得率为21.72%。提取2次和提取3次多糖得率增加不显著(P>0.05)。这是由于提取1次已经将大部分元宝枫种仁多糖提取出来,增加提取次数,PATM得率增加不明显。考虑到能耗等因素,选择提取1次,进行后续试验。
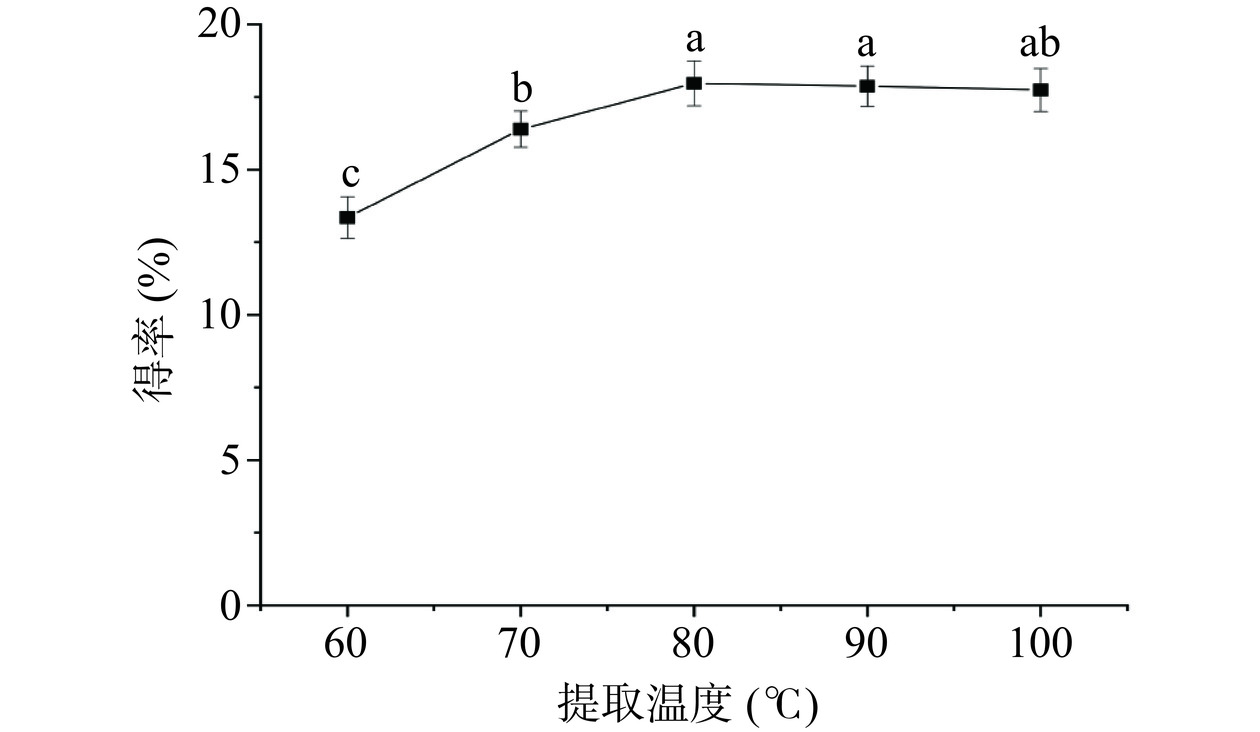
2.1.2 提取温度对多糖得率的影响
如图2所示,随着提取温度的增加,PATM得率呈现先增加后平稳的趋势。在80 ℃时,PATM得率达到最大值,得率为17.97%。之后继续升高提取温度,PATM得率也没有显著变化(P>0.05),趋于稳定。这是由于在80 ℃时能够将元宝枫种仁多糖充分提取出来,达到最大值。提取温度过高不仅能耗增加,而且会对多糖的结构造成破坏,影响后续PATM的表征。因此,最佳提取温度确定为80 ℃。
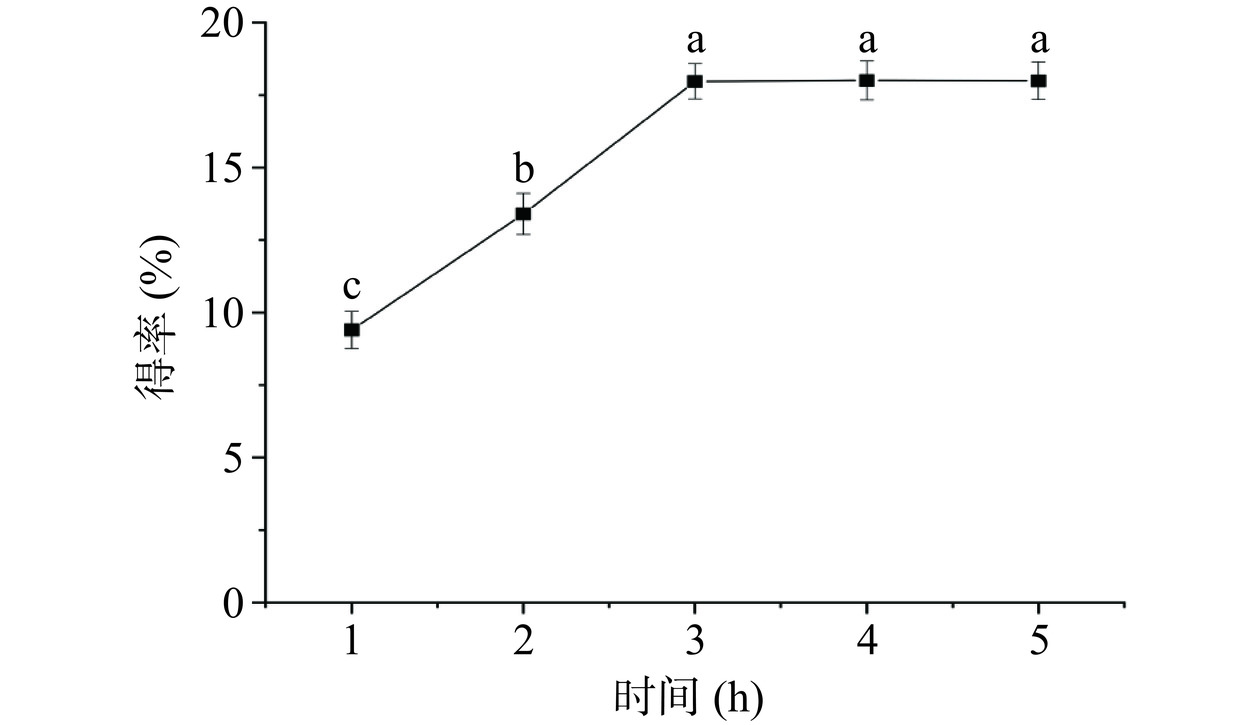
2.1.3 提取时间对多糖得率的影响
提取时间对PATM得率的影响如图3所示,提取时间在1~5 h的范围内,PATM的得率呈现先上升后平稳的趋势。当提取时间为3 h时,多糖得率达到最大,继续延长提取时间,多糖得率没有明显的变化,趋于稳定。这是因为经过3 h的提取,元宝枫种仁多糖被充分提取,再继续延长提取时间也不会增加PATM的得率。因此,最佳提取时间确定为3 h。
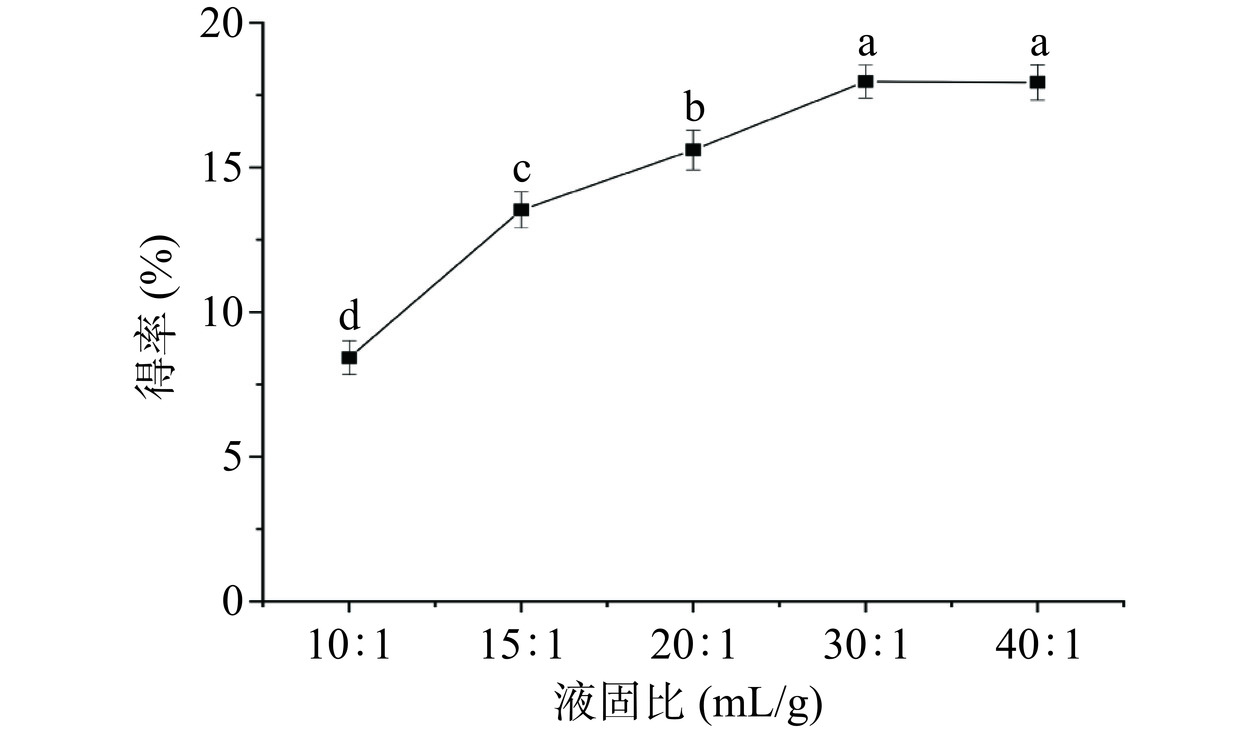
2.1.4 液固比对多糖得率的影响
如图4所示,液固比在10:1~40:1 mL/g的范围内,随着液固比的增加元宝枫种仁多糖得率先上升后下降,以30:1 mL/g的液固比为转折点,PATM得率略微下降。因此,最佳液固比确定为30:1 mL/g。
2.2 响应面优化分析
基于单因素实验结果,考虑到提取次数对PATM得率影响较小,故将提取次数固定为1次。以提取温度、提取时间和液固比三个因素为自变量,PATM得率为响应值,通过响应面分析法对PATM的提取工艺进行三因素三水平优化。响应面试验方案及结果见表2。通过Box-Behnken对比实验数据进行拟合,得到PATM得率的回归方程如下:
表 2 响应面试验设计及试验结果Table 2. Response surface test design and test results实验号 A提取温度(℃) B提取时间(h) C液固比(mL/g) 得率(%) 1 80 3 30:1 18.03 2 80 3 30:1 18.12 3 70 4 30:1 14.61 4 90 3 20:1 13.51 5 70 3 40:1 12.47 6 80 3 30:1 17.56 7 90 2 30:1 11.32 8 90 3 40:1 13.95 9 80 2 40:1 9.93 10 80 3 30:1 17.37 11 90 4 30:1 16.74 12 80 4 40:1 16.32 13 80 2 20:1 10.53 14 80 4 20:1 16.19 15 70 3 20:1 12.21 16 70 2 30:1 9.11 17 80 3 30:1 16.95 Y=+17.61+0.8900A+2.87B+0.0287C−0.0200AB+0.0450AC+0.1828BC−2.43A2−2.23B2−2.12C2
回归模型方差分析结果,见表3,该回归模型极其显著(P<0.0001),失拟项P=0.5120>0.05,说明失拟项差异不显著;决定系数R2=0.9893,校正后R2adj=0.9756,说明该回归方程拟合度良好,实验方法可信度较高[23],可用于PATM得率的分析和预测。
表 3 回归模型及方差分析结果Table 3. Regression model and analysis of variance results方差来源 平方和 自由度 方差 F值 P值 显著性 模型 145.11 9 16.12 72.02 <0.0001 显著 A-提取温度 6.34 1 6.34 28.31 0.0011 ** B-提取时间 65.95 1 65.95 294.61 <0.0001 *** C-液固比 0.0066 1 0.0066 0.0295 0.8684 AB 0.0016 1 0.0016 0.0071 0.9350 AC 0.0081 1 0.0081 0.0362 0.8545 BC 0.1332 1 0.1332 0.5951 0.4657 A² 24.95 1 24.95 111.45 <0.0001 *** B² 20.88 1 20.88 93.26 <0.0001 *** C² 19.22 1 19.22 85.87 <0.0001 *** 残基 1.57 7 0.2239 失拟项 0.6349 3 0.2166 0.9082 0.5120 不显著 纯误差 0.9321 4 0.2330 总误差 146.68 16 R² 0.9893 注:***表示极其显著(P<0.001);**表示高度显著(P<0.01);*表示显著(P<0.05)。 依据回归模型,可预测PATM最佳提取工艺为:提取温度79.879 ℃,提取时间3.341 h,液固比30.259:1 mL/g,此时PATM得率理论值为18.316%。考虑到实际可操作性,将最佳提取工艺参数调整为:提取温度80 ℃,提取时间3.5 h,液固比30:1 mL/g,进行3次平行实验,PATM多糖平均得率为18.17%±0.48%,这也与理论值相近,可见该模型能较好地预测实验结果。
2.3 元宝枫种仁多糖的分离纯化
2.3.1 纤维素层析柱分离纯化
如图5所示,经DEAE-纤维素52阴离子交换柱对PATM进行纯化,PATM经由NaCl溶液洗脱,得到四个多糖组分:PATM-1(16.44%)、PATM-2(3.58%)、PATM-3(79.20%)、PATM-4(0.76%)。在比较样品中每个级别组分的百分比后,PATM-3被认为是PATM的主要组分,收集并用于SephadexG-100凝胶层析柱进一步纯化。
2.3.2 凝胶层析柱分离纯化
SephadexG-100凝胶层析柱是根据分子量大小对多糖样品进行分离纯化,大分子量的多糖分子先流出凝胶柱,而小分子量的多糖分子后流出,从而实现分离。如图6所示,PATM-3经由SephadexG-100凝胶层析柱分离纯化得到PATM-3-1、PATM-3-2、PATM-3-3。将PATM-3-1收集进行浓缩、透析和冻干,测定结果表明,PATM-3-1多糖的纯度为97.17%。
2.4 单糖组成分析
如图7A所示,标准品L-岩藻糖、D-氨基半乳糖、L-鼠李糖、L-阿拉伯糖、D-氨基葡萄糖、D-半乳糖、D-葡萄糖、D-木糖、D-甘露糖、D-果糖、D-核糖、D-半乳糖醛酸、L-古罗糖醛酸、D-葡萄糖醛酸和D-甘露糖醛酸出峰时间依次为3.68、7.05、7.45、7.75、8.91、9.77、11.25、13.19、13.85、15.88、17.27、34.17、34.96、36.68、39.03 min,峰形匀称且分离度较好,无干扰现象,可用于多糖组成分析。通过与标准品对比,PATM-3-1(图7B)是由D-半乳糖醛酸、L-阿拉伯糖、D-半乳糖、L-鼠李糖、D-葡萄糖、D-木糖、D-甘露糖、D-葡萄糖醛酸、L-岩藻糖、D-核糖和D-氨基葡萄糖组成,其摩尔质量之比为12.40:12.81:5.08:3.86:2.69:2.31:1:0.66:0.32:0.06:0.02,说明PTAM-3-1为酸性杂多糖,主要以D-半乳糖醛酸和L-阿拉伯糖两种单糖为主。
2.5 红外光谱分析
FT-IR光谱是阐明多糖特征官能团的重要工具之一,PATM-3-1的红外光谱表现出多糖的典型吸收峰(图8)。在3283 cm−1处出现强而宽的特征峰,归因于O-H拉伸振动;在2928 cm−1处的弱吸收峰归因于C-H拉伸振动[24];1740 cm−1左右的吸收峰归因于-OH羧酸羰基的拉伸振动[25],这表明多糖结构中存在糖醛酸;1643 cm−1处的条带归因于-OH的弯曲振动;1600 cm−1处的条带归因于糖醛酸的CO拉伸振动[26];1411和1240 cm−1处的峰是C-H的可变角度振动,可以判断为多糖;1077和1013 cm−1之间的特征吸收峰归因于吡喃糖环的拉伸振动[27−28];767 cm−1处的吸收峰则表明该多糖为β构型吡喃糖。
2.6 热重分析
PATM-3-1的TG和DTG曲线见图9,其中存在两个显著的热损失:第一个是由于水分蒸发,多糖从40 ℃到126.27 ℃损失了8.80%的质量,这一结果表明多糖具有一定的持水能力;第二个是多糖热分解产生的,从221.25 ℃至443.73 ℃损失了54.90%的质量,在260.70 ℃达到最快的热分解速率。
2.7 刚果红分析
刚果红能与三股螺旋结构的多糖结合在一起形成络合物,从而使其最大吸收波长发生改变。实验结果如图10所示,元宝枫种仁多糖PATM-3-1与刚果红络合物的最大吸收波长在0~0.4 mol/L NaOH浓度下向长波长方向偏移,在0.4~0.5 mol/L NaOH浓度下最大吸收波长明显下降,证明元宝枫种仁多糖PATM-3-1具备三股螺旋结构[29]。
2.8 体外降血糖活性分析
2.8.1 α-淀粉酶抑制活性
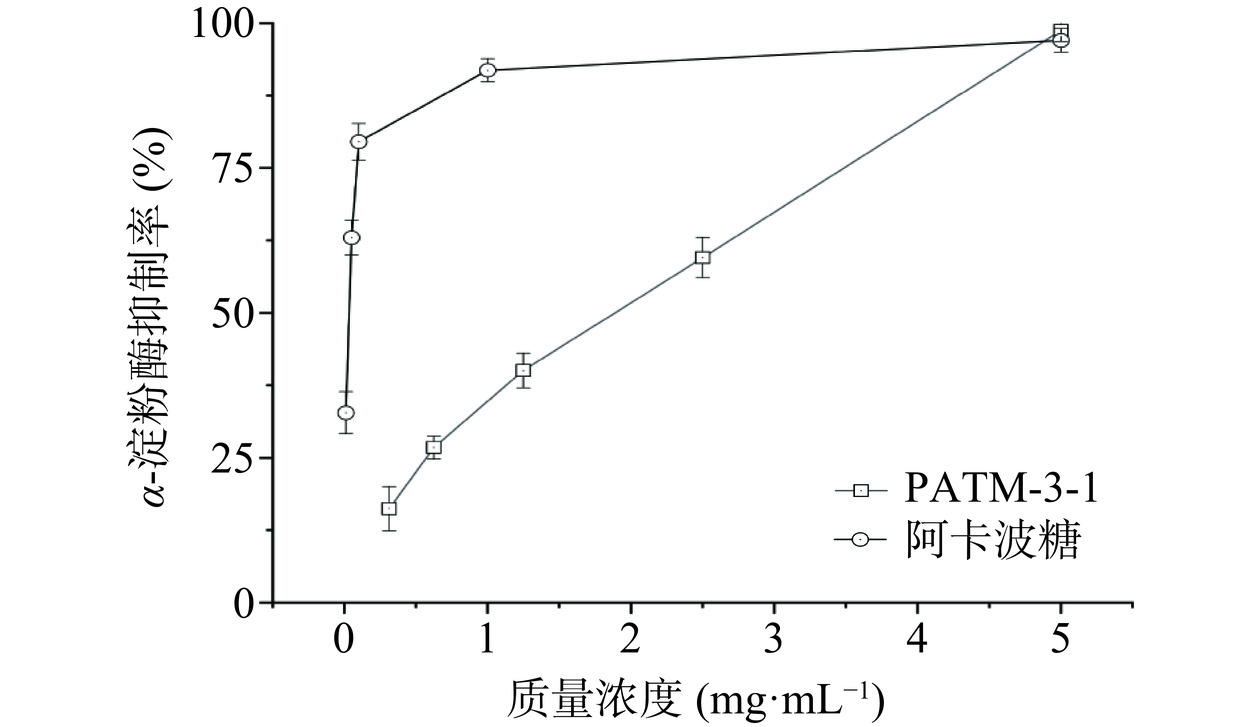
α-淀粉酶抑制剂可以与体内的α-淀粉酶发生作用,阻止淀粉转化为葡萄糖,可以有效控制血糖水平[30]。因此,寻找α-淀粉酶的天然抑制剂是目前国内外降糖的研究热点之一。在本研究中,不同质量浓度的PATM-3-1对α-淀粉酶抑制活性见图11,PATM-3-1在0.3~5 mg/mL浓度范围内表现出对α-淀粉酶的抑制率呈现剂量依赖关系,PATM-3-1和阿卡波糖α-淀粉酶的半抑制质量浓度IC50值分别为2.04和0.032 mg/mL。宋田源等[31]的研究发现,红毛藻多糖对α-淀粉酶抑制随着浓度增加而增强,其IC50值为1.26 mg/mL,PATM-3-1对α-淀粉酶的半数抑制浓度与红毛藻多糖相接近,由此可以看出PATM-3-1展现出良好的α-淀粉酶抑制活性。
2.8.2 胰岛素抵抗模型
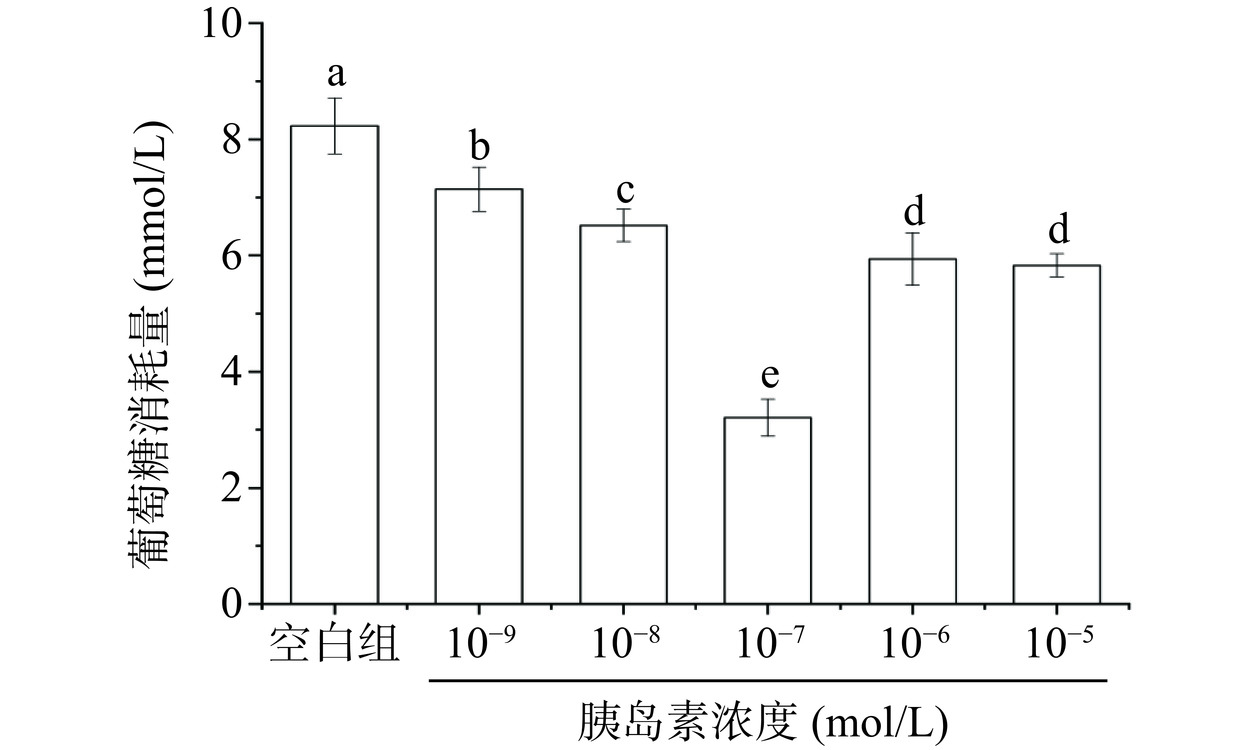
目前认为胰岛素抵抗(insulin resistance,IR)不仅是2型糖尿病的发病基础,也是贯穿多种代谢相关疾病的主线,是心血管疾病、高脂血症、高尿酸血症及代谢综合症的共同病理基础。构建胰岛素抵抗细胞模型是进行IR相关疾病治疗研究及药物研发的有效途径[32]。通过含有不同浓度的胰岛素(10−5~10−9 mol/L)的MEM培养基培养36 h,诱导HepG2细胞产生胰岛素抵抗(图12),模型组与正常组相比,葡萄糖的消耗量明显降低,显著低于正常组(P<0.05),说明胰岛素抵抗模型建立成功。其中胰岛素浓度为10−7 mol/L时,其葡萄糖的消耗量最低,显著低于其他浓度模型组(P<0.05)。因此,选择该浓度的胰岛素来构建胰岛素抵抗的HepG2细胞模型,用于进行后续实验。
2.8.3 细胞毒性
采用MTT法检测PATM-3-1对HepG2细胞毒性,并依据HepG2细胞存活率筛选出后续实验所使用PATM-3-1的安全剂量。不同质量浓度的PATM-3-1对HepG2细胞干预24 h后的细胞存活情况见图13。可以看出在80~2560 μg/mL的浓度范围内,PATM-3-1对HepG2细胞无明显的抗增殖作用,这表明元宝枫种仁多糖PATM-3-1对HepG2细胞无毒性,80~2560 μg/mL可以作为后续实验PATM-3-1的安全浓度范围。
2.8.4 葡萄糖消耗量和糖原含量分析
在正常机体内细胞利用胰岛素将葡萄糖分解为机体提供能量。当机体产生胰岛素抵抗时,细胞对胰岛素敏感性降低,导致细胞对葡萄糖摄取量下降[33]。使用改善胰岛素抵抗的药物会提高细胞对葡萄糖的消耗量[34]。不同质量浓度的PATM-3-1对胰岛素抵抗的HepG2细胞(Insulin Resistance-HepG2,IR-HepG2)葡萄糖消耗量的影响见图14A。空白组、模型组、阳性对照组、高剂量组、中剂量组和低剂量组细胞的葡萄糖消耗量分别为8.63、2.86、8.69、8.55、7.53和7.03 mmol/L。与空白组细胞相比,模型组细胞的葡萄糖消耗量显著降低(P<0.05),降低约为66.86%;与模型组相比,样品组和阳性对照组细胞的葡萄糖消耗量显著提高(P<0.05),并且高剂量组、中剂量组和低剂量组细胞的葡萄糖消耗量与PATM-3-1呈现剂量依赖关系。空白组、高剂量组和阳性对照组细胞的葡萄糖消耗量无明显差异,这说明PATM-3-1能有效调节IR-HepG2细胞对葡萄糖的吸收,高剂量PATM-3-1作用与阳性药相当。
此外,细胞摄取葡萄糖经各种酶作用合成糖原,糖原的合成与分解对维持血糖平衡极为重要。不同质量浓度的PATM-3-1对IR-HepG2细胞合成糖原的影响见图14B,其中空白组、模型组、阳性对照组、高剂量组、中剂量组和低剂量组的糖原含量分别为5.32、1.93、5.02、5.16、4.84和4.03 mg/g。与空白组相比,模型组细胞的糖原含量显著降低(P<0.05),降低约为63.72%。与模型组相比,经由PATM-3-1和阳性药(二甲双胍)处理后的IR-HepG2细胞的糖原含量得到显著提高(P<0.05),这表明PATM-3-1能发挥改善IR-HepG2细胞糖代谢紊乱的作用。
2.8.5 己糖激酶(HK)和丙酮酸激酶(PK)活性分析
己糖激酶(HK)被认为是糖酵解途径中催化己糖磷酸化为磷酸己糖的一种重要的酶。丙酮酸激酶(PK)是糖酵解中的另一种重要酶,胰岛素抵抗会降低己糖激酶和丙酮酸激酶的活性。因此,调节HK和PK活性是促进葡萄糖代谢的关键因素[35]。如图15A和图15B所示,空白组、模型组、阳性对照组、高剂量组、中剂量组和低剂量组细胞的HK活性分别为16.18、7.32、15.17、15.91、13.57和11.93 nmol/min/mg prot;细胞的PK活性分别为74.93、52.31、73.30、72.66、68.73和67.33 U/g prot。与空白组相比,模型组细胞的HK和PK活性显著降低(P<0.05);而阳性对照组细胞的HK和PK活性显著升高。与模型组相比,经PATM-3-1处理后,细胞的HK和PK活性显著提高(P<0.05),呈现与PATM-3-1剂量依赖关系。这说明PATM-3-1具有增强IR-HepG2细胞HK和PK活性,促进糖代谢,发挥降糖作用。
3. 结论
本研究通过单因素和响应面试验优化了元宝枫种仁多糖的提取工艺,在最佳提取工艺条件下,多糖平均得率为18.17%,通过脱蛋白、DEAE-DE纤维素52层析柱和SephadexG-100凝胶层析柱分离纯化得到不具有三螺旋结构的多糖PATM-3-1,其纯度为97.17%,它是由D-半乳糖醛酸、L-阿拉伯糖、D-半乳糖、L-鼠李糖、D-葡萄糖、D-木糖、D-甘露糖、D-葡萄糖醛酸、L-岩藻糖、D-核糖和D-氨基葡萄糖单糖组成。PATM-3-1属于β构型吡喃糖,具有良好的热稳定性和降糖活性,能够有效调节IR-HepG2细胞对葡萄糖吸收和糖原合成,增强HK和PK活性,从而改善IR-HepG2细胞的糖代谢。PATM-3-1展现出良好的降血糖活性,为植物元宝枫种仁多糖在药物和功能性食品中的研发、提取和应用奠定了理论基础。
-
表 1 响应面试验因素与水平
Table 1 Response surface test factors and levels
因素 水平 −1 0 1 A提取温度(℃) 70 80 90 B提取时间(h) 2 3 4 C液固比(mL/g) 20:1 30:1 40:1 表 2 响应面试验设计及试验结果
Table 2 Response surface test design and test results
实验号 A提取温度(℃) B提取时间(h) C液固比(mL/g) 得率(%) 1 80 3 30:1 18.03 2 80 3 30:1 18.12 3 70 4 30:1 14.61 4 90 3 20:1 13.51 5 70 3 40:1 12.47 6 80 3 30:1 17.56 7 90 2 30:1 11.32 8 90 3 40:1 13.95 9 80 2 40:1 9.93 10 80 3 30:1 17.37 11 90 4 30:1 16.74 12 80 4 40:1 16.32 13 80 2 20:1 10.53 14 80 4 20:1 16.19 15 70 3 20:1 12.21 16 70 2 30:1 9.11 17 80 3 30:1 16.95 表 3 回归模型及方差分析结果
Table 3 Regression model and analysis of variance results
方差来源 平方和 自由度 方差 F值 P值 显著性 模型 145.11 9 16.12 72.02 <0.0001 显著 A-提取温度 6.34 1 6.34 28.31 0.0011 ** B-提取时间 65.95 1 65.95 294.61 <0.0001 *** C-液固比 0.0066 1 0.0066 0.0295 0.8684 AB 0.0016 1 0.0016 0.0071 0.9350 AC 0.0081 1 0.0081 0.0362 0.8545 BC 0.1332 1 0.1332 0.5951 0.4657 A² 24.95 1 24.95 111.45 <0.0001 *** B² 20.88 1 20.88 93.26 <0.0001 *** C² 19.22 1 19.22 85.87 <0.0001 *** 残基 1.57 7 0.2239 失拟项 0.6349 3 0.2166 0.9082 0.5120 不显著 纯误差 0.9321 4 0.2330 总误差 146.68 16 R² 0.9893 注:***表示极其显著(P<0.001);**表示高度显著(P<0.01);*表示显著(P<0.05)。 -
[1] ZHU J, HAN J F, LIU L H, et al. Clinical expert consensus on the assessment and protection of pancreatic islet β-cell function in type 2 diabetes mellitus[J]. Diabetes Research and Clinical Practice,2023,197:110568. doi: 10.1016/j.diabres.2023.110568
[2] WANG M J, CHEN M, GUO R, et al. The improvement of sulforaphane in type 2 diabetes mellitus (T2DM) and related complications:A review[J]. Trends in Food Science & Technology,2022,129:397−407.
[3] 张培莲. 胰岛素治疗糖尿病不良反应的药学分析[J]. 北方药学,2021,18(5):179−180. [ZHANG P L. Pharmacologic analysis of adverse reactions to insulin therapy for diabetes mellitus[J]. Journal of North Pharmacy,2021,18(5):179−180.] doi: 10.3969/j.issn.1672-8351.2021.05.091 ZHANG P L. Pharmacologic analysis of adverse reactions to insulin therapy for diabetes mellitus[J]. Journal of North Pharmacy, 2021, 18(5): 179−180. doi: 10.3969/j.issn.1672-8351.2021.05.091
[4] 解娅立, 孙瑞萍, 刘光亮, 等. 植物多糖的生物学功能及其在猪生产中的研究进展[J]. 饲料研究,2023,46(15):153−157. [XIE Y L, SUN R P, LIU G L, et al. Research progress on biological functions of plant polysaccharides and their application in pig production[J]. Feed Research,2023,46(15):153−157.] XIE Y L, SUN R P, LIU G L, et al. Research progress on biological functions of plant polysaccharides and their application in pig production[J]. Feed Research, 2023, 46(15): 153−157.
[5] 黄倩, 梁安健, 朱鹏程, 等. 魏斯氏菌胞外多糖在发酵食品中的应用进展[J]. 食品科学, 2024, 45(4): 352-359. [HUANG Q, LIAN A J, ZHU P C, et al. Progress in the application of extracellular polysaccharide of Weissiella in fermented food[J]. Food Science, 2024, 45(4): 352-359.] HUANG Q, LIAN A J, ZHU P C, et al. Progress in the application of extracellular polysaccharide of Weissiella in fermented food[J]. Food Science, 2024, 45(4): 352-359.
[6] 陈斌. 植物多糖在化妆品中的应用研究进展[J]. 中国野生植物资源,2020,39(4):44−47. [CHEN B. Research progress on the application of plant polysaccharide in cosmetics[J]. Chinese Wild Plant Resources,2020,39(4):44−47.] doi: 10.3969/j.issn.1006-9690.2020.04.0010 CHEN B. Research progress on the application of plant polysaccharide in cosmetics[J]. Chinese Wild Plant Resources, 2020, 39(4): 44−47. doi: 10.3969/j.issn.1006-9690.2020.04.0010
[7] 王亦欣, 陈茜, 匡映, 等. 植物多糖气凝胶材料应用的研究进展[J]. 武汉工程大学学报,2017,39(5):443−449. [WANG Y X, CHEN X, KUANG Y, et al. Progress in application of polysaccharide aerogels[J]. Journal of Wuhan Institute of Technology,2017,39(5):443−449.] doi: 10.3969/j.issn.1674-2869.2017.05.007 WANG Y X, CHEN X, KUANG Y, et al. Progress in application of polysaccharide aerogels[J]. Journal of Wuhan Institute of Technology, 2017, 39(5): 443−449. doi: 10.3969/j.issn.1674-2869.2017.05.007
[8] 马宁珠, 周先泰, 张建国, 等. 虎杖多糖对链脲佐菌素诱导糖尿病模型的降血糖作用研究[J]. 海峡药学,2023,35(7):13−17. [MA N Z, ZHOU X T, ZHANG J G, et al. Extraction of polysaccharide from polygonum cuspidatum and its anti-diabetic effect[J]. Strait Pharmaceutical Journal,2023,35(7):13−17.] MA N Z, ZHOU X T, ZHANG J G, et al. Extraction of polysaccharide from polygonum cuspidatum and its anti-diabetic effect[J]. Strait Pharmaceutical Journal, 2023, 35(7): 13−17.
[9] 赵凯迪, 王秋丹, 林长青. 桔梗多糖抗氧化特性及对2型糖尿病大鼠降血糖作用[J]. 食品与机械,2022,38(7):186−190,198. [ZHAO K D, WANG Q D, LIN C Q, et al. Antioxidant properties of polysaccharides from Platycodon grandiflorum and its hypoglycemic effect on type 2 diabetic rats[J]. Food & Machinery,2022,38(7):186−190,198.] ZHAO K D, WANG Q D, LIN C Q, et al. Antioxidant properties of polysaccharides from Platycodon grandiflorum and its hypoglycemic effect on type 2 diabetic rats[J]. Food & Machinery, 2022, 38(7): 186−190,198.
[10] 佟祎鑫, 许佳敏, 陈芳, 等. 元宝枫化学成分及产品应用现状研究进展[J]. 中国油脂,2022,47(2):118−123. [TONG Y X, XU J M, CHEN F, et al. Advance in chemical components and products application status of Acer truncatum Bunge[J]. China Oils and Fats,2022,47(2):118−123.] TONG Y X, XU J M, CHEN F, et al. Advance in chemical components and products application status of Acer truncatum Bunge[J]. China Oils and Fats, 2022, 47(2): 118−123.
[11] 王琨, 刘少波, 张娜, 等. 元宝枫研究进展[J]. 西北林学院学报,2021,36(3):152−157,280. [WANG K, LIU S B, ZHANG N, et al. Research progress on Acer truncatum[J]. Journal of Northwest Forestry University,2021,36(3):152−157,280.] doi: 10.3969/j.issn.1001-7461.2021.03.23 WANG K, LIU S B, ZHANG N, et al. Research progress on Acer truncatum[J]. Journal of Northwest Forestry University, 2021, 36(3): 152−157,280. doi: 10.3969/j.issn.1001-7461.2021.03.23
[12] 马庆华, 王兴红, 刘慧慧, 等. 不同产地元宝枫种仁主要营养成分及评价[J]. 食品研究与开发,2022,43(22):187−193. [MA Q H, WANG X H, LIU H H, et al. Analysis and evaluation of nutritional ingredients of seed kernels of Acer truncatum cultivated in different production areas[J]. Food Research and Development,2022,43(22):187−193.] doi: 10.12161/j.issn.1005-6521.2022.22.026 MA Q H, WANG X H, LIU H H, et al. Analysis and evaluation of nutritional ingredients of seed kernels of Acer truncatum cultivated in different production areas[J]. Food Research and Development, 2022, 43(22): 187−193. doi: 10.12161/j.issn.1005-6521.2022.22.026
[13] 李倩倩, 李淑芳, 陈贵元. 响应面分析法优化刺梨果多糖的脱色工艺[J]. 农业科技与信息,2022(13):99−105. [LI Q Q, LI S F, CHEN G Y. Optimization of decolorization process of prickly pear fruit polysaccharide by response surface analysis[J]. Agricultural Science-Technology and Information,2022(13):99−105.] LI Q Q, LI S F, CHEN G Y. Optimization of decolorization process of prickly pear fruit polysaccharide by response surface analysis[J]. Agricultural Science-Technology and Information, 2022(13): 99−105.
[14] YANG W J, YANG Z X, ZOU Y, et al. Extraction and deproteinization process of polysaccharide from purple sweet potato[J]. Chemical Biology & Drug Design,2022,99(1):111−117.
[15] MA J S, LIU H, HAN C R, et al. Extraction, characterization and antioxidant activity of polysaccharide from Pouteria campechiana seed[J]. Carbohydrate Polymers,2020,229:115409. doi: 10.1016/j.carbpol.2019.115409
[16] ZENG C B, YE G Y, LI G C, et al. RID serve as a more appropriate measure than phenol sulfuric acid method for natural water-soluble polysaccharides quantification[J]. Carbohydrate Polymers,2022,278:118928. doi: 10.1016/j.carbpol.2021.118928
[17] ZHANG F R, ZHENG J, LI Z Y, et al. Purification, characterization, and self-assembly of the polysaccharide from Allium schoenoprasum[J]. Foods,2021,10(6):1352. doi: 10.3390/foods10061352
[18] WEI L, YANG H Y, LI H, et al. Comparison of chemical composition and activities of essential oils from fresh leaves of Pelargonium graveolens L′ Herit. extracted by hydrodistillation and enzymatic pretreatment combined with a solvent-free microwave extraction method[J]. Industrial Crops and Products,2022,186:115204. doi: 10.1016/j.indcrop.2022.115204
[19] 张玉梅, 邢慧珍, 刘会平, 等. 槐花多糖的提取、纯化和抗氧化活性分析[J]. 食品工业科技,2023,44(24):207−215. [ZHANG Y M, XING H Z, LIU H P, et al. Extraction, purification and antioxidant activity of polysaccharides from Sophora japonica[J]. Science and Technology of Food Industry,2023,44(24):207−215.] ZHANG Y M, XING H Z, LIU H P, et al. Extraction, purification and antioxidant activity of polysaccharides from Sophora japonica[J]. Science and Technology of Food Industry, 2023, 44(24): 207−215.
[20] 高浩天. 牛蒡子多糖的制备、结构鉴定及降糖活性研究[D]. 西安:陕西科技大学, 2021. [GAO H T. Study on preparation, structure identification and hypoglycemic activity of fructus arctii polysaccharide[D]. Xi’an:Shaanxi University of Science and Technology, 2021.] GAO H T. Study on preparation, structure identification and hypoglycemic activity of fructus arctii polysaccharide[D]. Xi’an: Shaanxi University of Science and Technology, 2021.
[21] 孟欣, 刘金锋. 羊肚菌多糖硫酸化衍生物的制备、结构分析及体外抗肿瘤活性[J]. 曲阜师范大学学报(自然科学版),2020,46(2):85−90. [MENG X, LIU J F. Preparation, structure analysis and antitumor activity of sulfonated derivatives of morchella polysaccharides[J]. Journal of Qufu Normal University (Natural Science),2020,46(2):85−90.] MENG X, LIU J F. Preparation, structure analysis and antitumor activity of sulfonated derivatives of morchella polysaccharides[J]. Journal of Qufu Normal University (Natural Science), 2020, 46(2): 85−90.
[22] TAN J Q, LI P C, XUE H K, et al. Cyanidin-3-glucoside prevents hydrogen peroxide (H2O2)-induced oxidative damage in HepG2 cells[J]. Biotechnology Letters,2020,42(11):2453−2466. doi: 10.1007/s10529-020-02982-2
[23] 吴金姗, 黄榕, 刘树英, 等. 玉簪多糖对细胞氧化应激损伤的保护作用机制[J]. 食品科学,2022,43(17):138−146. [WU J S, HUANG R, LIU S Y, et al. Protective mechanism of polysaccharide from hosta ventricosa against oxidative damage in cells[J]. Food Science,2022,43(17):138−146.] doi: 10.7506/spkx1002-6630-20210602-026 WU J S, HUANG R, LIU S Y, et al. Protective mechanism of polysaccharide from hosta ventricosa against oxidative damage in cells[J]. Food Science, 2022, 43(17): 138−146. doi: 10.7506/spkx1002-6630-20210602-026
[24] ZHANG Y, YAO L M, LIU Y F, et al. Acidic polysaccharide from corn silk:Structural & conformational properties and hepatoprotective activity[J]. International Journal of Biological Macromolecules,2023,236:123851. doi: 10.1016/j.ijbiomac.2023.123851
[25] NEP E I, CARNACHAN S M, NGWULUKA N C, et al. Structural characterisation and rheological properties of a polysaccharide from sesame leaves (Sesamum radiatum Schumach. & Thonn.)[J]. Carbohydrate Polymers,2016,152:541−547. doi: 10.1016/j.carbpol.2016.07.036
[26] LIU Z G, DANG J, WANG Q L, et al. Optimization of polysaccharides from Lycium ruthenicum fruit using RSM and its anti-oxidant activity[J]. International Journal of Biological Macromolecules,2013,61:127−134. doi: 10.1016/j.ijbiomac.2013.06.042
[27] KHAN B M, CHEONG K L, LIU Y. Pumpkin polysaccharides:Purification, characterization and hypoglycemic potential[J]. International Journal of Biological Macromolecules,2019,139:842−849. doi: 10.1016/j.ijbiomac.2019.08.053
[28] REN Y P, LIU S X. Effects of separation and purification on structural characteristics of polysaccharide from quinoa (Chenopodium quinoa Willd)[J]. Biochemical and biophysical Research Communications,2019,522(2):286−291.
[29] HU W C, ZHAO Y Q, YANG Y, et al. Microwave-assisted extraction, physicochemical characterization and bioactivity of polysaccharides from Camptotheca acuminata fruits[J]. International Journal of Biological Macromolecules,2019,133:127−136. doi: 10.1016/j.ijbiomac.2019.04.086
[30] 覃亚娟, 王萍, 陈小爱, 等. 3种黄酮类化合物对α-淀粉酶的抑制机制[J]. 食品科学技术学报,2023,41(5):110−122. [QIN Y J, WANG P, CHEN X A, et al. Inhibition mechanism of three flavonoids on α-amylase[J]. Journal of Food Science and Technology,2023,41(5):110−122.] QIN Y J, WANG P, CHEN X A, et al. Inhibition mechanism of three flavonoids on α-amylase[J]. Journal of Food Science and Technology, 2023, 41(5): 110−122.
[31] 宋田源, 韦敬柳乙, 陈艳红, 等. 红毛藻多糖组分纯化及其抑制α-淀粉酶和α-葡萄糖苷酶活性的研究[C]//北京:中国食品科学技术学会第十三届年会, 2016:54−55. [SONG T Y, WEI J L Y, CHEN Y H, et al. Purification of polysaccharide fractions from Trichoderma reesei and their inhibitory activities of α-amylase and α-glucosidase[C]//Beijing:Thirteenth Annual Conference of the Chinese Society for Food Science and Technology, 2016:54−55.] SONG T Y, WEI J L Y, CHEN Y H, et al. Purification of polysaccharide fractions from Trichoderma reesei and their inhibitory activities of α-amylase and α-glucosidase[C]//Beijing: Thirteenth Annual Conference of the Chinese Society for Food Science and Technology, 2016: 54−55.
[32] 吴跃, 陈中, 阳婉容, 等. 基于网络药理学分析消瘅片改善胰岛素抵抗的机制[J]. 临床合理用药,2023,16(30):173−177. [WU Y, CHEN Z, YANG W R, et al. Network pharmacology-based analysis of the mechanism of improving insulin resistance by elimination tablets[J]. Chinese Journal of Clinical Rational Drug Use,2023,16(30):173−177.] WU Y, CHEN Z, YANG W R, et al. Network pharmacology-based analysis of the mechanism of improving insulin resistance by elimination tablets[J]. Chinese Journal of Clinical Rational Drug Use, 2023, 16(30): 173−177.
[33] 吴小杰, 郐滨, 赵海桃, 等. 刺玫果黄酮对胰岛素抵抗HepG2细胞糖代谢功能研究[J]. 林产化学与工业,2023,43(3):41−48. [WU X J, KUAI B, ZHAO H T, et al. Flavonoids from rosa davurica pall. on glucose metabolism function in insulin resistant HepG2 cells[J]. Chemistry and Industry of Forest Products,2023,43(3):41−48.] WU X J, KUAI B, ZHAO H T, et al. Flavonoids from rosa davurica pall. on glucose metabolism function in insulin resistant HepG2 cells[J]. Chemistry and Industry of Forest Products, 2023, 43(3): 41−48.
[34] TANG Y, Y HE X M, LIU G M, et al. Effects of different extraction methods on the structural, antioxidant and hypoglycemic properties of red pitaya stem polysaccharide[J]. Food Chemistry,2022,405:134804.
[35] 刘红雨, 付中平, 周吉燕, 等. 苦瓜降糖多肽PA对四氧嘧啶糖尿病小鼠的口服降血糖作用[J]. 中药药理与临床,2009,25(4):32−35. [LIU H Y, FU Z P, ZHOU J Y, et al. Hypoglycemic effect of oral PA extracted from momordica Charantia Seeds on alloxan-induced diabetic mice[J]. Pharmacology and Clinics of Chinese Materia Medica,2009,25(4):32−35.] LIU H Y, FU Z P, ZHOU J Y, et al. Hypoglycemic effect of oral PA extracted from momordica Charantia Seeds on alloxan-induced diabetic mice[J]. Pharmacology and Clinics of Chinese Materia Medica, 2009, 25(4): 32−35.





 下载:
下载:





 下载:
下载:
