Optimization of Preparation Process of Squid Skin Peptides by Response Surface Methodology and Its Physicochemical Properties
-
摘要: 为实现鱿鱼加工下脚料鱿鱼皮的高值化利用,本研究采用酶法制备鱿鱼皮蛋白肽。以多肽浓度和三氯乙酸可溶性氮指数(Trichloroacetic acid-nitrogen soluble index,TCA-NSI)为评价指标,采用单因素和响应面试验优化酶解工艺参数,并对所制备蛋白肽的氨基酸组成、分子量分布、蛋白肽序列、抗氧化活性及其体外模拟消化特性进行表征。结果表明,最佳酶解工艺条件为酶解温度43.50 ℃、酶解时间100 min、酶解pH7.50、胰蛋白酶与碱性蛋白酶比例2:1、加酶量4000 U/g,在此条件下其TCA-NSI可达89.02%±0.66%。所制备的鱿鱼皮蛋白肽其氨基酸组成均衡,必需氨基酸指数(Essential amino acid index,EAAI)可达0.90。此外,鱿鱼皮蛋白肽含有43个多肽序列,其中38个肽段的分子质量低于1800 Da,其DPPH自由基、ABTS+自由基和羟自由基清除率的IC50分别为0.61、0.28和1.95 mg/mL,且经体外模拟胃肠消化后仍能维持较好的抗氧化活性。本研究结果为鱿鱼加工下脚料的开发利用和精深加工提供了理论依据。Abstract: To achieve the high-value utilization of squid skin obtained from squid processing, this study utilized an enzymatic approach to prepare protein peptides. The enzymatic hydrolysis parameters were optimized using single factor and response surface tests, with the concentration of peptide and trichloroacetic acid-nitrogen soluble index (TCA-NSI) serving as evaluation criteria. The amino acid composition, molecular weight distribution, peptide sequence, antioxidant activity, and in vitro simulated digestive properties of the prepared protein peptides were also thoroughly characterized. The results showed that the optimal conditions for enzymatic hydrolysis were as follows: Enzymatic temperature of 43.50 ℃, enzymatic time of 100 minutes, enzymatic pH of 7.50, trypsin to alkaline protease ratio of 2:1, and enzyme dosage of 4000 U/g. Under these specified conditions, the TCA-NSI achieved a value of 89.02%±0.66%. The prepared protein peptides exhibited a well-balanced amino acid composition, with an essential amino acid index (EAAI) value of 0.90. Furthermore, the prepared protein peptides encompassed a total of 43 polypeptide sequences, with 38 of these segments exhibiting molecular weights below 1800 Da. The IC50 values for scavenging DPPH radical, ABTS+ radical, and hydroxyl radical were determined to be 0.61, 0.28 and 1.95 mg/mL, respectively. Notably, the antioxidant activity remained favorable even after undergoing simulated gastrointestinal digestion in vitro. These findings serve to establish a solid theoretical basis for the advancement and exploitation of byproducts derived from squid processing, as well as their subsequent value-added utilization.
-
鱿鱼(Loligo spp.)属头足类海洋软体动物,体内含有丰富的蛋白质以及矿物质元素,具有生命周期短、生长快的特点[1],是我国重要的远洋渔业捕捞种类之一。据统计,我国每年加工鱿鱼约在40~50万吨[2],鱿鱼加工已成为水产加工业的重要组成部分,其加工主要以胴体加工为主,鱿鱼头、足、内脏及表皮等下脚料一般被加工成鱼粉或被直接掩埋处理,造成资源的浪费和环境污染。鱿鱼皮是鱿鱼加工过程产生的主要下脚料之一,占总重10%左右[3]。鱿鱼皮中含有蛋白质、明胶、抗氧化色素、生物发光素及矿物质元素等物质[4],其中蛋白质约占鱿鱼皮干重的88%,且胶原蛋白含量可高达30%[3],是制备蛋白肽的优质原料。因此,如何高效利用鱿鱼皮制备蛋白肽对提高鱿鱼资源利用率、延伸鱿鱼加工产业链具有重要意义。
目前已有一些关于鱿鱼皮加工利用的报道,主要集中在胶原蛋白制备和活性物质提取等方面。Aleman等[5]通过水解法从鱿鱼皮中提取了具有助消化功能的胶原蛋白。张国玉等[6]通过中性蛋白酶水解鱿鱼皮制备鱿鱼皮胶原蛋白肽粉,优化后的酶解条件为加酶量600 U/g、温度45 ℃、pH6.0、酶解时间4 h,得到的产物呈淡黄色粉末状,是一种低脂、低糖、高蛋白的肽粉。区兑鹏等[7]通过中性蛋白酶酶解鱿鱼皮,再通过热水法制备明胶,得到的最佳制备条件为酶添加量0.6%、酶解时间2 h,酶解温度40 ℃、提胶时间1 h、提胶温度75 ℃,经优化后明胶提取率可达20.807%。Ezquerra-Braue等[8]从鱿鱼皮中提取制备了亲脂性物质,研究发现其具有显著抑制微生物的作用,可显著延长冷冻鳕鱼的保质期。Kao等[9]以鱿鱼皮磷脂为原料制备了功能性鱿鱼皮脂质体,并对其抗炎作用进行了研究,证明了鱿鱼皮脂质体具有明显的抗炎作用。已有研究表明,对于同一酶解对象,采用不同的蛋白酶及酶解条件对其酶解产物的氨基酸组成、分子量分布、蛋白肽序列、抗氧化活性等具有明显影响,而这又决定了酶解产物的潜在应用价值[10]。然而,目前对于鱿鱼皮蛋白肽的研究主要集中在酶解工艺的优化上,鲜有对鱿鱼皮蛋白肽的理化特性进行较为全面的研究。
本研究以鱿鱼皮为原料,首先通过单因素实验考察酶种类、酶解时间、酶解温度、酶解pH、加酶量对多肽浓度和三氯乙酸可溶性氮指数(Trichloroacetic acid soluble nitrogen index,TCA-NSI)的影响。在此基础上,通过响应面分析法优化鱿鱼皮蛋白肽的制备工艺,并对其氨基酸组成、抗氧化活性、肽序列组成、模拟胃肠道消化等进行全面表征,以期为深度开发鱿鱼资源、实现加工下脚料的高值化利用提供一定参考依据。
1. 材料与方法
1.1 材料与仪器
鱿鱼皮 福州海汇生物科技实业有限公司提供;木瓜蛋白酶(800 U/mg)、风味蛋白酶(30 U/mg)、Gly-Gly-Tyr-Arg四肽标准品 上海源叶生物科技有限公司;碱性蛋白酶(200 U/mg) 北京索莱宝科技有限公司;牛血清白蛋白 德国Biofroxx公司;胃蛋白酶(10 U/mg)、胰蛋白酶(50 U/mg)、酒石酸钾钠、五水合硫酸铜、乙腈、甲醇、三羟甲基氨基甲烷、盐酸、无水乙醇、氢氧化钠、三氯乙酸(Trichloroacetic acid, TCA)、邻苯三酚、水杨酸、石油醚、七水硫酸亚铁、抗坏血酸等 国药集团化学试剂有限公司;2, 2-联苯基-1-苦基肼基(2, 2-diphenyl-1-picrylhydrazyl,DPPH) 上海麦克林生化科技有限公司;2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS) 上海阿拉丁生化科技股份有限公司;细胞色素C、抑酞酶、杆菌酶乙氨酸-乙氨酸-酪氨酸-精氨酸、马尿酸 美国Sigma-Aldrich公司。
HMT-15水浴多工位磁力搅拌器 天津市恒奥科技发展有限公司;UV-1700紫外分光光度计、LC-16高效液相色谱仪 日本岛津公司;Sartorius BS 210S电子天平 德国Sartorius公司;TGL-15B高速台式离心机 上海安亭科学仪器厂;Biochrom30+全自动氨基酸分析仪 英国biochrom公司;SHZ-D(III)循环水式多用真空泵 河南予华仪器有限公司;EASY pureⅡ超纯水仪 Barnstead公司;Q-Exactive HF-X质谱仪 美国赛默飞公司。
1.2 实验方法
1.2.1 鱿鱼皮蛋白肽的制备
鱿鱼皮解冻清洗后,将石油醚与鱿鱼皮按4:1混合,常温下搅拌2 h,过滤后清洗沥干得脱脂鱿鱼皮。取5 g脱脂鱿鱼皮,按1:5比例加水,控制不同酶解条件于磁力搅拌水浴锅中酶解,结束后置沸水中灭酶10 min,冷却摇匀后离心(5000 r/min,10 min),取上清液为蛋白肽溶液,冷冻干燥后得鱿鱼皮蛋白肽。
1.2.2 酶解条件优化
1.2.2.1 蛋白酶筛选
选用常见的蛋白酶,通过蛋白酶复配以增加酶切位点,进而提高鱿鱼皮蛋白质的酶解效率。以多肽浓度和TCA-NSI为评价指标,按表1条件筛选酶解效率最高的蛋白酶组合。
表 1 复合蛋白酶实验条件Table 1. Test conditions of compound protease蛋白酶组合 温度(℃) pH 料液比 蛋白酶
比例加酶量
(U/g)酶解时间
(min)木瓜蛋白酶+
碱性蛋白酶50 7.8 1:5 1:1 5000 120 木瓜蛋白酶+
胰蛋白酶50 7.5 1:5 1:1 5000 120 胰蛋白酶+
碱性蛋白酶50 8.3 1:5 1:1 5000 120 风味蛋白酶+
胰蛋白酶50 7.8 1:5 1:1 5000 120 风味蛋白酶+
木瓜蛋白酶50 7.3 1:5 1:1 5000 120 风味蛋白酶+
碱性蛋白酶50 8.0 1:5 1:1 5000 120 1.2.2.2 单因素实验
以酶解温度50 ℃、pH8.3、加酶量5000 U/g、酶解时间120 min、料液比1:5、蛋白酶比例1:1为基本条件。按顺序分别考察酶解时间(20、40、60、80、100、120 min)、酶解温度(35、40、45、50、55、60 ℃)、胰蛋白酶和碱性蛋白酶比例(4:1、3:1、2:1、1:1、1:2、1:3、1:4)、酶解pH(5、6、7、8、9、10)和加酶量(1000、2000、3000、4000、5000、6000 U/g)对多肽浓度和TCA-NSI的影响,同时每个单因素实验结束后选用相应的最适条件进行后续的单因素实验。
1.2.2.3 响应面试验设计
以TCA-NSI(%)为响应值,选取酶解温度、酶解时间、酶解pH三个因素,按表2的响应面试验设计进行酶解工艺优化。
表 2 响应面试验因素水平设计Table 2. Factors and levels for response surface test因素 水平 −1 0 1 A酶解温度(℃) 40 45 50 B酶解时间(min) 60 80 100 C酶解pH 7 8 9 1.2.3 样品多肽浓度测定
样品多肽浓度的测定参照鲁伟等[11]的方法。向酶解得到的蛋白肽溶液中加入等体积5% TCA(Trichloroacetic acid,TCA)溶液,混匀静置10 min后离心(4000 r/min,15 min),取上清液用5% TCA稀释10倍,按3:2的比例加入样品与双缩脲试剂,反应后离心取上清液于540 nm测定吸光值,并参照标准曲线(y=0.1243x+0.0023,R2=0.997,以Gly-Gly-Tyr-Arg四肽为标准试剂制作)计算样品的多肽浓度。
1.2.4 TCA-NSI测定
TCA-NSI测定参照马瑞娟等[12]的方法。先将酶解得到的蛋白肽溶液用等体积的15% TCA溶液沉淀10 min,离心(4000 r/min,10 min)取上清液,按1:4的比例加入样品与双缩脲试剂,反应30 min后于540 nm测定吸光值,参照蛋白标准曲线(y=0.0358x+0.0008,R2=0.999,以牛血清蛋白为标准试剂制作)计算样品中可溶性氮含量,再按下式计算TCA-NSI值。
$$ \text{TCA-NSI}\left(\text{%}\right)=\frac{{\text{m}}_{\text{0}}}{{\text{m}}_{\text{1}}}\times \text{100} $$ 式中:m0为15% TCA沉淀后上清液中的可溶性氮质量(mg);m1为原料中总氮质量(mg),通过凯氏定氮法测定。
1.2.5 蛋白肽氨基酸组成及评价
参照GB/T 5009.124-2016测定鱿鱼皮蛋白肽的氨基酸组成及含量。根据联合国粮农组织/世界卫生组织(United Nations Food Agriculture Organization/World Health Organization,FAO/WHO)的氨基酸评分标准模式和全鸡蛋蛋白质的氨基酸模式,计算氨基酸评分(Amino acid score,AAS)、化学评分(Chemical score,CS)和必需氨基酸指数(Essential amino acid index,EAAI)[12−13]。
$${\text{AAS=}\dfrac{\text{样品中氨基酸含量}\text{(mg/g)}}{\text{FAO/WHO}\text{标准模式中同种氨基酸含量}\text{(mg/g)}} }$$ $$ \text{CS=}\frac{\text{样品中氨基酸含量}\text{(mg/g)}}{\text{全鸡鸡蛋蛋白质中同种氨基酸含量}\text{(mg/g)}} $$ $$ \text{EAAI=}\sqrt[\text{n}]{\frac{{\text{aa}}_{\text{1}}}{{\text{AA}}_{\text{1}}}\times \frac{{\text{aa}}_{\text{2}}}{{\text{AA}}_{\text{2}}}\times \frac{{\text{aa}}_{\text{3}}}{{\text{AA}}_{\text{3}}}\cdots\frac{{\text{aa}}_{\text{n}}}{{\text{AA}}_{\text{n}}}} $$ 式中:aan,样品中必需氨基酸质量占总蛋白质量的比例;AAn,FAO/WHO参考标准中必需氨基酸质量占总蛋白质量的比例。
1.2.6 蛋白肽分子量分布测定
参照GB/T 22729-2008,采用高效液相色谱法测定蛋白肽分子量分布。
1.2.7 蛋白肽抗氧化能力测定
1.2.7.1 DPPH自由基清除率的测定
参考高群等[14]的方法:准确称量3.94 mg DPPH,配成0.1 mmol/L的DPPH溶液,取2 mL不同浓度(0.001、0.3、0.6、0.9、1.2、1.5、1.8 mg/mL)多肽溶液和2 mL DPPH溶液混匀,室温下避光反应30 min,在517 nm波长下测定吸光值,吸光值记为Ai,用无水乙醇和水分别替代DPPH溶液和多肽溶液作为对照组和空白组,测得吸光度分别记为Aj和A0。以VC作为对照,评价其DPPH自由基清除力。DPPH自由基清除率计算公式如下:
$$ \text{DPPH}\text{自由基清除率(}\text{%})=\left(\text{1}-\frac{{\text{A}}_{\text{i}}-{\text{A}}_{\text{j}}}{{\text{A}}_{\text{0}}}\right)\times \text{100} $$ 1.2.7.2 ABTS+自由基清除率的测定
参考葛珍珍等[15]方法:将5 mL 7 mmol/L的ABTS和88 mL 40 mmol/L的K2S2O4混合之后,配制ABTS+母液,室温黑暗条件静置反应12 h后,用纯水稀释溶液至其734 nm吸光度值为0.70±0.02。取1.0 mL多肽溶液(0.01、0.3、0.6、0.9、1.2、1.5、1.8 mg/mL),加入稀释后的ABTS+溶液3.0 mL,室温反应30 min后于734 nm测定吸光值,记为As;以纯水替换ABTS+溶液和多肽溶液,测得吸光度分别记为Ac和A0。以VC作为对照,评价其ABTS+自由基清除力。ABTS+自由基清除率计算公式如下:
$$ {\text{ABTS}}^{\text+}\text{自由基清除率}(\text{%})=\left(\text{1}-\frac{{\text{A}}_{\text{s}}-{\text{A}}_{\text{c}}}{{\text{A}}_{\text{0}}}\right)\times \text{100} $$ 1.2.7.3 羟自由基清除率的测定
参考马瑞娟等[12]方法:取1.0 mL 9.0 mmol/L FeSO4溶液、1.0 mL 9.0 mmol/L水杨酸-乙醇、1 mL 8.8 mmol/L H2O2,分别加入1 mL不同浓度的多肽溶液(0.1、0.5、1.0、2.0、3.0、4.0、5.0、6.0 mg/mL)混合均匀,于37 ℃条件下水浴加热0.5 h,之后测定510 nm处的吸光度,记为A1;以纯水替换H2O2以及多肽溶液,测得吸光度分别记为A2和A0。以VC作为对照,评价其羟自由基清除力。羟自由基清除率计算公式如下:
$$ \text{羟自由基清除率}(\text{%})=\left(\text{1}-\frac{{\text{A}}_{\text{1}}-{\text{A}}_{\text{2}}}{{\text{A}}_{\text{0}}}\right)\times \text{100} $$ 1.2.8 蛋白肽序列测定
蛋白肽按1:10加入去离子水溶解后,加入适量0.25%乙酸,混匀离心取上清液,转10 kDa超滤离心管,12000 r/min离心15 min。之后加入200 µL 0.25%乙酸,离心重复2次,收集滤液,使用C18 StageTip脱盐,真空干燥,肽粉用0.1%甲酸溶液复溶,之后参考李小锋等[16]报道的LC-MS/MS法测定并分析蛋白肽序列。
1.2.9 体外模拟胃肠道消化实验
体外模拟胃肠消化实验参考李小峰等[16]的方法。体外模拟胃消化:取20 g鱿鱼皮按1:5加入去离子水,采用上述优化后的条件进行酶解,灭酶冷却后离心(5000 r/min,10 min),取上清液用HCl将其pH调至2.0,加入2%(E/S)的胃蛋白酶,于37 ℃反应2 h,灭酶冷却后离心(5000 r/min,10 min),取上清液测定自由基清除率。体外模拟肠消化:经胃蛋白酶酶解后,将酶解液的pH调为8.5,加入2%(E/S)的胰蛋白酶,于37 ℃反应2 h,灭酶冷却后离心(5000 r/min,10 min),取上清液测定自由基清除率。
1.3 数据处理
所有实验设置3组平行实验,结果以“平均值±标准差”的形式表示,采用Duncan检验进行显著性统计分析,P<0.05表示差异显著,响应面试验设计、数据统计分析和作图分别采用Design-Expert V 8.0.6、SPSS 22.0和Origin 9.0。
2. 结果与分析
2.1 蛋白酶的筛选和单因素实验结果分析
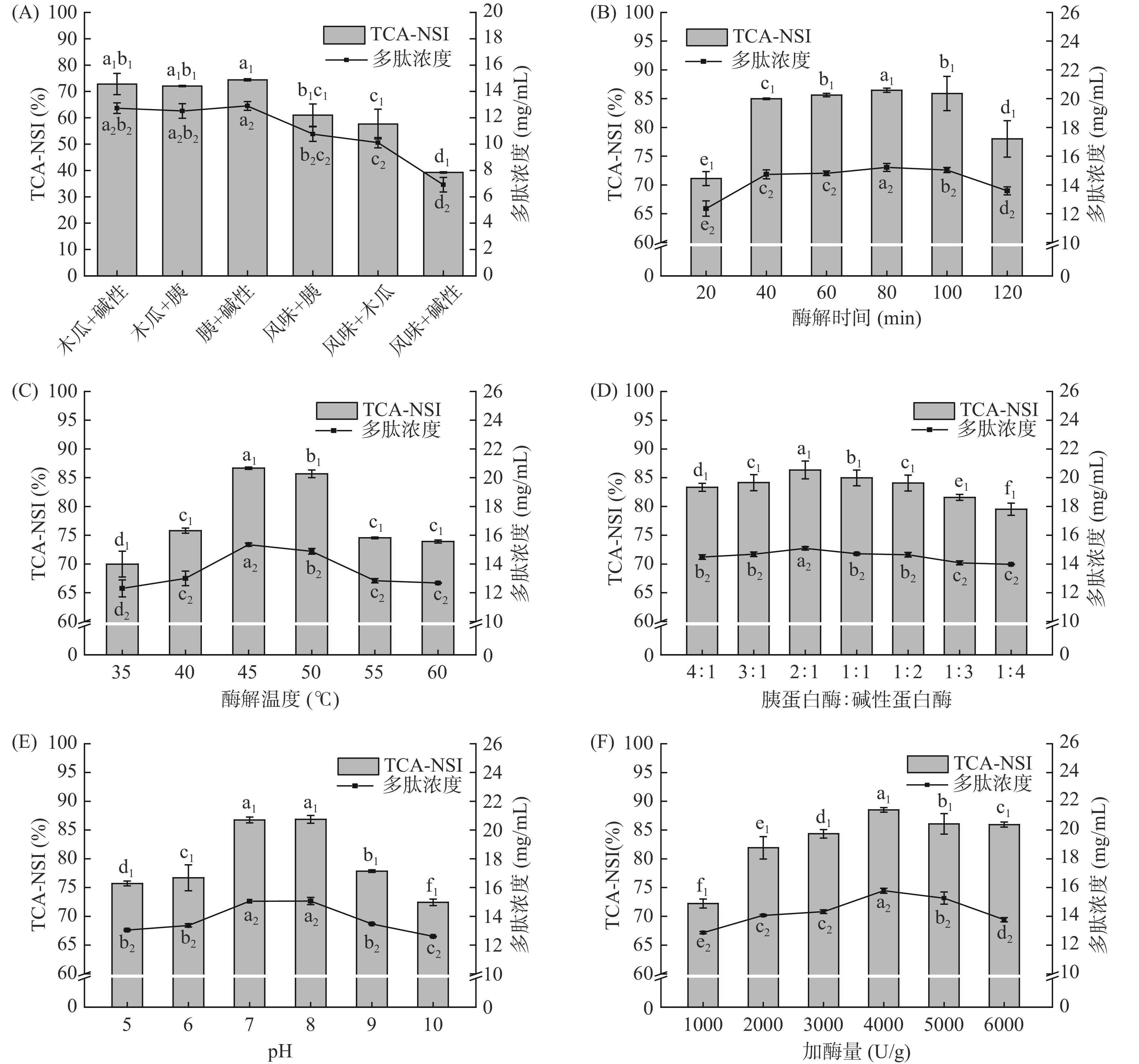
如图1(A)所示,在6种蛋白酶组合中,碱性蛋白酶与胰蛋白酶的组合对鱿鱼皮的酶解效果最佳,而风味蛋白酶与碱性蛋白酶的水解效果最差。这可能是由于胰蛋白酶、碱性蛋白酶、木瓜蛋白酶均为内切酶,且酶切位点各不相同[17],因此通过复合这些蛋白酶可提高鱿鱼皮蛋白质的酶解效果。而风味蛋白酶的酶切位点是内切和外切组合[18],内切酶作用于分子内部肽键,将蛋白质分子断裂为多肽片段,而外切酶主要作用于蛋白质或多肽的分子末端,产生游离氨基酸,因此在相同加酶量的条件下,复合酶中包含外切酶位点的蛋白酶会使得酶解产物中多肽减少而游离氨基酸增多,从而导致酶解效果差于其他酶。因此,选择胰蛋白酶和碱性蛋白酶复合作为酶解用酶。
![]() 图 1 不同酶解条件对多肽浓度和TCA-NSI的影响注:不同字母代表同一指标差异显著(P<0.05),下标数字代表不同的指标;图4同。Figure 1. Effects of different enzymatic conditions on peptide concentration and TCA-NSI
图 1 不同酶解条件对多肽浓度和TCA-NSI的影响注:不同字母代表同一指标差异显著(P<0.05),下标数字代表不同的指标;图4同。Figure 1. Effects of different enzymatic conditions on peptide concentration and TCA-NSI由图1(B)可知,酶解时间对酶解效果的影响呈现先升高后降低的趋势,在酶促反应前80 min内,底物蛋白较为充足,多肽浓度和TCA-NSI均呈现迅速升高趋势,当酶解超过80 min后可能由于底物蛋白所剩无几,蛋白酶可将多肽进一步酶解为游离氨基酸,因此酶解效率大幅度下降[19],这与王熙等[20]的研究结果相似。因此,选择酶解时间为80 min用于后续实验。由图1(C)可知,在35~45 ℃范围内,温度提高有利于激活底物与酶作用活性位点,从而增强酶促反应[21],而当温度超过45 ℃后,会破坏蛋白酶的活性中心,导致酶解效率下降[22]。因此,选择酶解温度为45 ℃用于后续实验。由图1(D)可知,当胰蛋白酶和碱性蛋白酶比例为2:1时其酶解效率最高,主要原因可能是胰蛋白酶的酶切位点较少(Arg-,Lys-),而碱性蛋白酶的酶切位点较多(Ala-、Leu-、Val-、Tyr-、Phe-、Try-)[17],当碱性蛋白酶比例过低时会使得酶解不充分,而当碱性蛋白酶比例过高时,则会导致底物过度酶解,蛋白肽更易被进一步水解为游离氨基酸。因此,选择胰蛋白酶与碱性蛋白酶比例为2:1用于后续实验。由图1(E)可知,多肽浓度和TCA-NSI在pH5~10内呈现先上升后降低的趋势,在pH为8.0时多肽浓度和TCA-NSI均达最大值,原因可能是由于酶的蛋白构象易受H+和OH−浓度变化的影响,并且H+和OH−会对蛋白酶活性位点功能基团的解离产生影响,进而影响酶促反应效率[23]。因此,选择酶解pH为8.0用于后续实验。由图1(F)可知,当底物浓度一定时,蛋白酶浓度的提高有利于增加底物蛋白与酶分子中活性位点的碰撞几率,从而加速酶促反应,但当酶添加过量后,会使得部分多肽被彻底酶解成氨基酸[23−24]。因此,选择酶添加量为4000 U/g用于后续实验。
2.2 响应面试验结果分析
2.2.1 响应面模型建立与分析
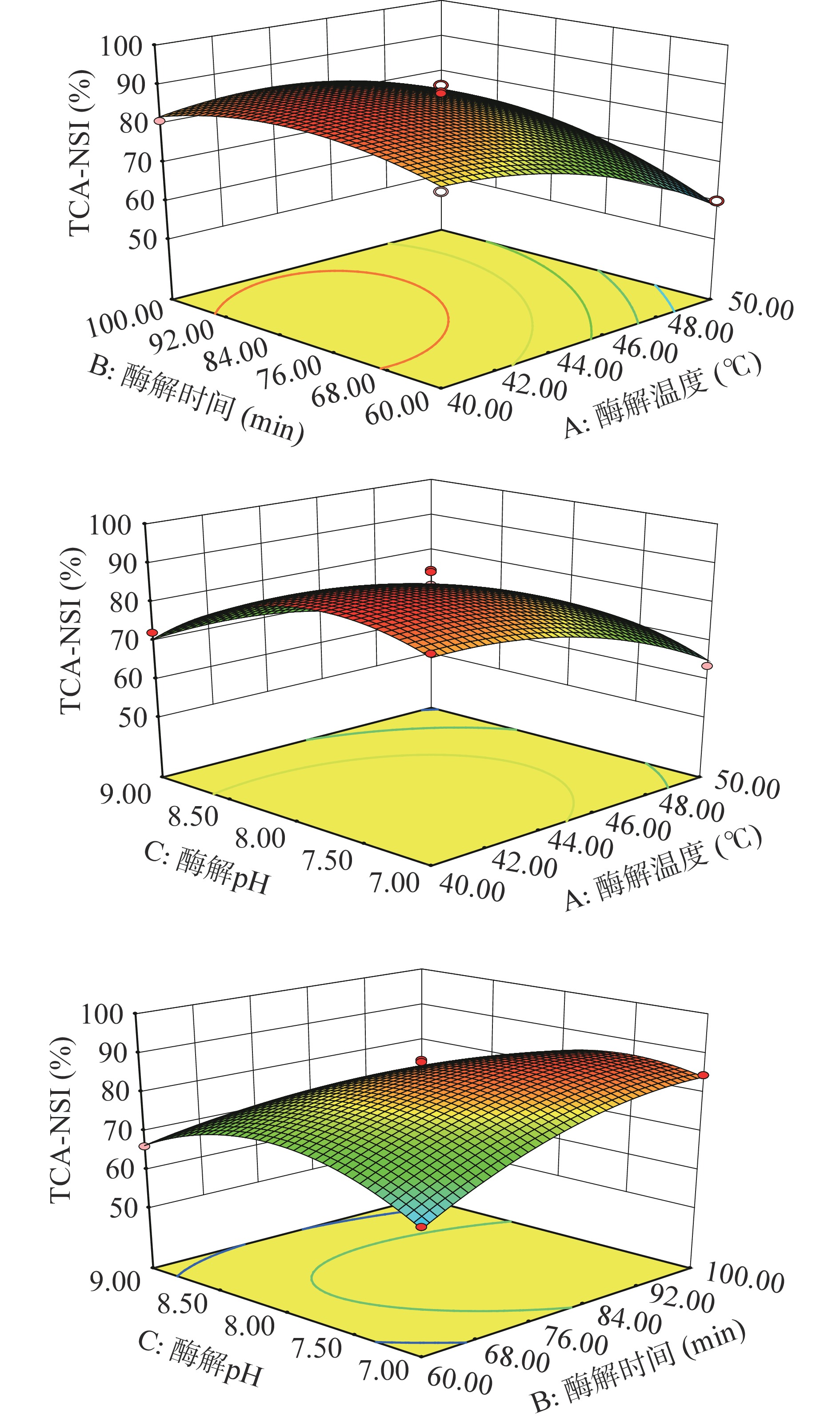
由于采用不同的复合酶比例及加酶量,其最佳的酶解温度、酶解时间、酶解pH也会随之改变,因此本研究在单因素实验确定的最适复合酶比例(2:1)及加酶量(4000 U/g)的基础上,以TCA-NSI(Y)为响应值,选取酶解温度(A)、酶解时间(B)、酶解pH(C)为自变量,进行响应面试验设计,其结果如表3所示。经回归拟合后,得到Y与A、B、C之间关系的回归方程如下:Y=87.49−7.47A+4.13B−4.70C+3.85AB+1.50AC−5.75BC−6.68A2−6.49B2−11.37C2。由表4可知,该拟合模型的P值<0.0001,决定系数R2=0.9879,调整决定系数R2Adj=0.9723,失拟项P=0.3273>0.05不显著,说明该模型拟合程度较好,说明所选的3个因素对鱿鱼皮酶解效果有明显影响,由各因素的均方值可知,各因素对水解度的影响顺序为:酶解温度(A)>酶解pH(C)>酶解时间(B)。由图2可知,所选三个因素在研究范围内都呈现先上升后下降的趋势,且从这3个因素的交互作用中可以看出,酶解时间(B)和酶解pH(C)交互作用最强,其次是酶解温度(A)和酶解时间(B),而酶解温度(A)和酶解pH(C)的交互作用最弱。
表 3 响应面试验方案及结果Table 3. Design and results of response surface test试验号 酶解温度 酶解时间 酶解pH TCA-NSI(%) 1 0 0 0 88.87 2 1 −1 0 60.07 3 −1 1 0 80.89 4 −1 0 −1 83.95 5 0 1 1 62.89 6 1 0 −1 63.57 7 −1 −1 0 80.27 8 1 0 1 57.93 9 0 −1 1 66.20 10 0 −1 −1 64.88 11 1 1 0 76.08 12 0 0 0 88.41 13 0 0 0 87.63 14 0 0 0 87.90 15 −1 0 1 72.31 16 0 0 0 86.64 17 0 1 −1 84.56 表 4 响应面模型的方差分析Table 4. ANOVA of the response surface model变异来源 平方和 自由度 均方 F值 P值 显著性 模型 1965.58 9 218.40 63.36 <0.0001 ** A-酶解温度 446.56 1 446.56 129.54 <0.0001 ** B-酶解时间 136.13 1 136.13 39.49 0.0004 ** C-酶解pH 177.00 1 177.00 51.35 0.0002 ** AB 59.21 1 59.21 17.18 0.0043 ** AC 9.00 1 9.00 2.61 0.1502 BC 132.14 1 132.14 38.33 0.0004 ** A2 187.74 1 187.74 54.46 0.0002 ** B2 177.07 1 177.07 51.37 0.0002 ** C2 544.56 1 544.56 157.97 <0.0001 ** 残差 24.13 7 3.45 失拟项 13.07 3 4.36 1.58 0.3273 纯误差 11.06 4 2.77 总和 1989.71 16 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 2.2.2 验证实验
由Design-Expert软件预测鱿鱼皮蛋白肽的最佳制备条件为:温度43.38 ℃、时间100 min、pH7.52,TCA-NSI的预测值为88.23%。为方便实际操作,选择温度43.50 ℃、时间100 min、pH7.50进行验证,在此条件下,TCA-NSI值为89.02%±0.66%。预测值与实际结果相对误差为0.90%。以上结果说明,通过响应面试验得到的酶解鱿鱼皮工艺条件具有较高的可信度。
2.3 鱿鱼皮蛋白肽氨基酸组成与评分
鱿鱼皮蛋白肽中共包含17种氨基酸(表5),总氨基酸含量为83.05 g/100 g,其中含有7种必需氨基酸,含量为27.70 g/100 g,其必需氨基酸指数EAAI为0.90(表6)。研究表明,当EAAI值为0.86~0.95时可表示蛋白质量良好[25]。因此,以上结果说明所制备鱿鱼皮蛋白肽的必需氨基酸组成相对均衡,且营养价值较高。此外,由CS和AAS可知(表6),Ile和Lys为其限制性氨基酸,因此若将该蛋白肽用作饲料或者食品添加剂时,可根据实际营养需求额外补充Ile和Lys。
表 5 鱿鱼皮蛋白肽的氨基酸组成Table 5. Amino acid composition of squid skin peptides序号 氨基酸名称 氨基酸含量
(g/100 g)1 天冬氨酸Asp 5.03±0.03 2 苏氨酸Thr* 5.01±0.35 3 丝氨酸Ser 4.44±0.09 4 谷氨酸Glu 8.66±0.36 5 脯氨酸Pro 8.17±0.64 6 甘氨酸Gly 11.78±0.85 7 丙氨酸Ala 5.60±0.10 8 胱氨酸Cys 2.42±0.05 9 缬氨酸Val* 3.35±0.20 10 蛋氨酸Met* 2.87±0.05 11 异亮氨酸Ile* 2.12±0.02 12 亮氨酸Leu* 5.70±0.20 13 酪氨酸Tyr 4.36±0.06 14 苯丙氨酸Phe* 5.74±0.14 15 组氨酸His 1.02±0.10 16 赖氨酸Lys* 2.91±0.05 17 精氨酸Arg 3.87±0.16 TAA(g/100 g) 83.05 EAA/TAA(%) 33.35 EAA(Lys、Trp、Phe、Met、Thr、Leu、Ile、Val) 27.70 HAA(Trp、Phe、Val、Leu、Ile、Ala、Pro、Met) 33.55 AAA(Phe、Tyr、Trp) 10.10 注:*必需氨基酸(Essential amino acids,EAA);总氨基酸(Total amino acids,TAA);疏水氨基酸(Hydrophobic amino acids,HAA);芳香族氨基酸(Aromatic amino acids,AAA)。 表 6 鱿鱼皮蛋白肽的必需氨基酸含量及氨基酸评分Table 6. Essential amino acid content and amino acid score of squid skin peptides必需氨基酸 必需氨基酸含量(mg/g) 氨基酸评分 化学评分 必需氨基
酸指数
(EAAI)鱿鱼皮
蛋白肽FAO/WHO
模式全蛋
模式AAS CS 苏氨酸 50.10 40 47 1.25 1.07 0.90 缬氨酸 33.54 50 66 0.67 0.51 异亮氨酸 21.17 40 54 0.53 0.39 亮氨酸 57.00 70 86 0.81 0.66 苯丙氨酸+
酪氨酸101.03 60 93 1.68 1.09 蛋氨酸+
胱氨酸52.86 35 57 1.51 0.93 赖氨酸 29.12 55 70 0.53 0.42 2.4 鱿鱼皮蛋白肽的分子量分布
从表7可以看出,鱿鱼皮蛋白肽的分子量主要分布在180~3000 Da,占比高达99.64%,表明鱿鱼皮经酶解后产物中主要为小分子肽,而小分子肽具有易吸收、吸收过程不需要额外能量、对肠胃亲和性高等特性[26],因此具有较高的潜在应用价值。
表 7 鱿鱼皮蛋白肽的分子量分布Table 7. Molecular weight distribution of squid skin peptides分子量范围(Da) 保留时间(min) 平均分子量(Da) 百分比(%) 5000~10000 15.872 8020 0.007 3000~5000 16.800 4976 0.063 500~3000 21.157 529 49.212 180~500 21.678 405 50.426 <180 24.738 84 0.292 2.5 鱿鱼皮蛋白肽抗氧化性分析
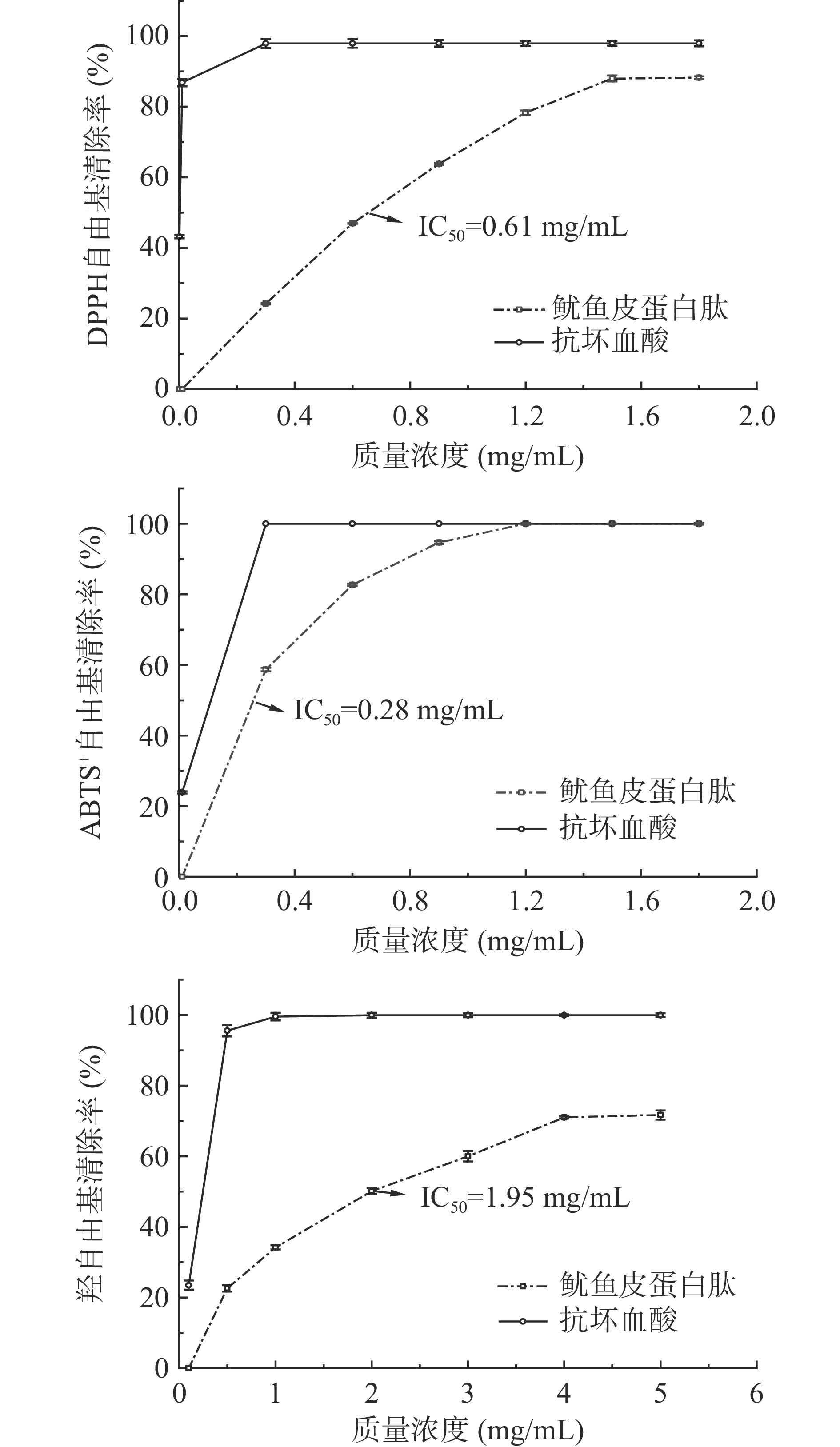
由图3可知,随鱿鱼皮蛋白肽浓度增大,其DPPH自由基清除率、ABTS+自由基清除率、羟自由基清除率均增加,呈明显的正相关性,其半抑制浓度(IC50)分别为0.61、0.28和1.95 mg/mL。相关研究表明,当IC50低于10 mg/mL时,则可说明其具有良好的抗氧化性[27]。因此,以上结果表明所制备的鱿鱼皮蛋白肽具有较强的抗氧化性。
2.6 鱿鱼皮蛋白肽序列分析
从鱿鱼皮蛋白肽中鉴定出43种肽段(表8),其中38个肽段的分子量低于1800 Da。研究表明,分子量介于500~1800 Da的肽段对自由基有更强的清除能力[28],原因是短肽能暴露出更多具有抗氧化能力的氨基酸残基[29]。此外,鱿鱼皮蛋白肽中含有10.10%芳香族氨基酸(表5),且有16个肽段中的疏水氨基酸超过一半,分别有58.14%和48.84%的多肽序列在其N端和C端存在疏水性氨基酸。通常疏水性氨基酸残基能提高肽链在非极性溶剂中的溶解性,增强肽链与脂质自由基亲和力,进而减少自由基对机体细胞的氧化作用[30−31],而芳香族氨基酸是良好的供电子体,使自由基从不稳定状态转变成稳定状态[32]。同时,当疏水性氨基酸位于肽段序列的C端或N端时更有助于提高肽段的抗氧化活性[33−34]。因此,以上结果进一步证实了所制备的鱿鱼皮蛋白肽具有较强的抗氧化活性。
表 8 鱿鱼皮蛋白肽的LC-MS/MS序列鉴定结果Table 8. LC-MS/MS sequence identification results of squid skin peptides序号 肽段序列 长度 分子量(Da) m/z 肽段匹配错误率 肽段分值 蛋白来源 1 VSGTDPEDAL 10 1002.45 1002.45 0.00 163.72 myosin regulatory light chain 2 SDSVIENPF 9 1006.46 1006.46 0.00 158.12 hemocyanin subunit 1 3 QIEPNPF 7 843.41 843.41 0.00 153.88 hemocyanin subunit 2 4 EITDLL 6 702.38 702.38 0.00 149.33 CARB-Par-1, partial 5 VIENPF 6 717.37 717.37 0.00 149.11 hemocyanin subunit 2 6 SVINIS 6 631.35 631.35 0.00 134.12 NADH dehydrogenase subunit 6 7 LDDESRQR 8 1017.48 508.74 0.00 133.55 paramyosin 8 FHSPMEPF 8 990.43 990.43 0.00 132.94 hemocyanin subunit 2 9 LENDFDNA 8 936.38 936.38 0.00 129.77 tropomyosin 10 DDESRQR 7 904.40 452.20 0.00 111.65 paramyosin 11 GGETEMPW 8 905.36 905.36 0.00 106.29 hemocyanin subunit 2 12 IPTFML 6 720.39 720.39 0.00 89.349 NADH dehydrogenase subunit 4 13 RIEMENR 7 946.47 473.23 0.00 87.181 paramyosin 14 STHPHF 6 724.33 362.16 0.00 85.641 myosin heavy chain 15 LEDEAR 6 731.34 365.67 0.01 62.715 myosin heavy chain 16 SFGAPY 6 640.29 640.29 0.01 47.821 hemocyanin subunit 2 17 LPYNEA 6 705.33 352.67 0.01 19.694 hemocyanin subunit 2 18 EVPEDK 6 715.34 357.67 0.01 18.805 heat shock 70 kDa protein 4L isoform 4 19 VEDERR 6 802.39 401.20 0.01 17.084 paramyosin 20 VVEDER 6 745.36 372.68 0.01 12.431 paramyosin 21 VITFHK 6 743.43 371.72 0.01 10.919 heat shock 70 kDa protein 4L isoform 4 22 ISTQHGGIMNYMNSNF 16 1812.79 453.20 0.00 9.9211 NADH dehydrogenase subunit 4 23 LDEKPR 6 756.41 378.21 0.01 8.683 heat shock 70 kDa protein 4L isoform 4 24 MNSNIMTIMIISMMTTL 17 1943.93 485.98 0.00 4.9019 NADH dehydrogenase subunit 2 25 TDAERR 6 746.37 373.18 0.01 4.6725 heat shock 70 kDa protein 4L isoform 4 26 LSGDYY 6 716.30 358.15 0.01 4.4158 hemocyanin subunit 1 27 TADIYR 6 737.37 368.69 0.01 4.4158 tyrosinase precursor 2 28 KDNFHY 6 822.37 411.18 0.01 4.1196 hemocyanin subunit 2 29 EIIHERMENICNMGNF 16 1948.86 487.21 0.00 1.0321 tyrosinase precursor 2 30 CCQHGMITFPHWHR 14 1751.76 583.92 0.01 0.12211 hemocyanin subunit 2 31 RVGIPY 6 703.40 351.70 0.01 0 hemocyanin subunit 1 32 PIGRFL 6 701.42 350.71 0.01 0 tyrosinase precursor 2 33 NQHQQQQQHHHHQQHQHTL 19 2458.12 614.53 0.00 0 RNA-binding protein squid 34 MDTSHGPHIPPGAL 14 1428.68 476.23 0.01 0 zinc finger protein Lb-Zic 35 LLIIGW 6 713.45 356.72 0.01 0 NADH dehydrogenase subunit 4 36 TGGITTTTTTSSQERR 16 1695.84 423.96 0.01 0 a neurofilament protein 37 IRDIQQEY 8 1063.53 354.51 0.00 0 a neurofilament protein 38 VESDIMEMDEGSMY 14 1634.62 544.87 0.01 0 voltage-dependent potassium channel SqKv1A 39 IPDPDTIQWSPCTDPY 16 1846.81 461.70 0.00 0 symplectin/biotinidase-like protein 2 40 FHNQNIITMIIGIF 14 1659.88 553.29 0.01 0 cytochrome c oxidase subunit III 41 VLQNQY 6 763.39 381.69 0.01 0 tyrosinase precursor 2 42 EEAMME 6 738.26 369.13 0.01 0 myosin heavy chain 43 MDDCNTCSCSSGNV 14 1434.45 478.15 0.01 0 Paci-Abd-2 注:G甘氨酸;A丙氨酸;V缬氨酸;L亮氨酸;I异亮氨酸;P脯氨酸;F苯丙氨酸;Y酪氨酸;S丝氨酸;T苏氨酸;M甲硫氨酸;N天冬酰胺;Q谷氨酰胺;D天冬氨酸;E谷氨酸;R精氨酸;H组氨酸;C半胱氨酸;K赖氨酸。 2.7 体外消化实验结果分析
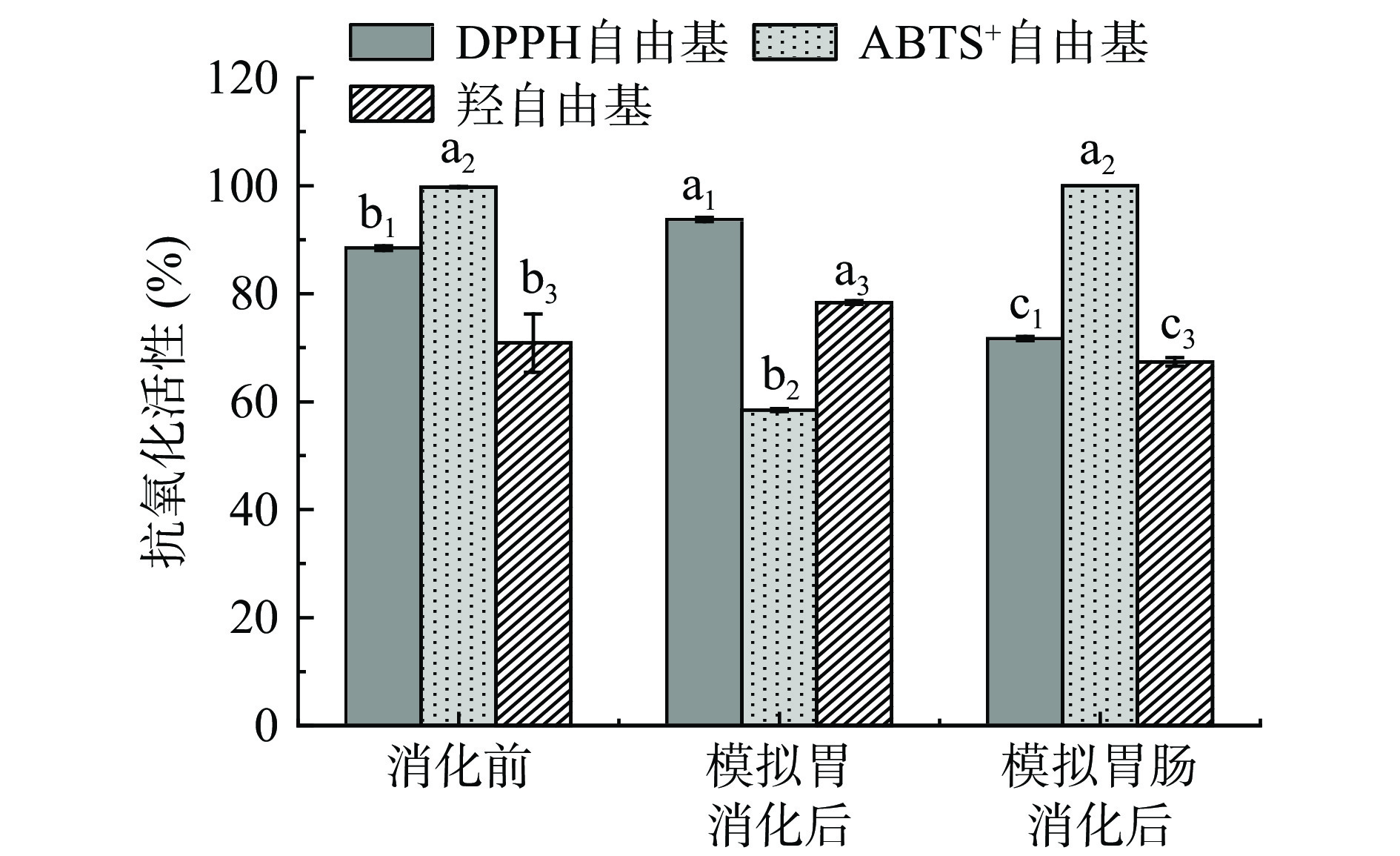
由表9可知,在胃消化阶段,鱿鱼皮蛋白肽中分子量大于3000 Da的部分被完全酶解,因此该阶段主要是将较大肽段进一步分解;而在肠消化阶段,分子量在500~3000 Da的肽段则被完全酶解成更易吸收的小肽以及氨基酸。如图4所示,经模拟胃肠消化后,鱿鱼皮蛋白肽对DPPH自由基和羟自由基的清除活性呈先升高后降低的变化趋势,原因可能是模拟胃消化过程使得蛋白肽暴露出更多的疏水性氨基酸侧链,从而有利于提高蛋白肽对DPPH自由基和羟自由基的清除活性[35];而模拟肠消化过程可将多肽进一步酶解,导致多肽内部空间结构发生变化,进而使得相应的抗氧化活性位点减少[36]。相反地,ABTS+自由基清除率则呈现先降低后上升的趋势,原因可能是不同pH条件会引起蛋白肽结构变化,导致蛋白肽与ABTS+自由基的相互作用方式发生改变,从而影响其抗氧化能力;同时在酸性条件下,蛋白肽可能更容易发生氧化反应,如生成二硫键或氧化脱氨酸等,这些氧化反应可能会降低蛋白肽的抗氧化能力,导致其对抗ABTS+自由基的能力下降[37]。
表 9 模拟胃肠消化对鱿鱼皮蛋白肽分子量分布的影响(%)Table 9. Effect of simulated gastrointestinal digestion on the molecular weight distribution of squid skin peptides (%)消化阶段 5000~10000(Da) 3000~5000(Da) 500~3000(Da) 180~500(Da) <180(Da) 消化前 0.007±0.00a 0.063±0.00a 49.212±0.33a 50.426±0.28b 0.292±0.05c 模拟胃消化 0.000±0.00b 0.000±0.00b 50.750±0.78a 48.290±0.71b 0.960±0.07b 模拟肠消化 0.000±0.00b 0.000±0.00b 0.000±0.00b 98.610±0.09a 1.390±0.09a 注:同列不同字母表示数据间具有显著性(P<0.05)。 3. 结论
本文以鱿鱼皮为原料,通过单因素和响应面试验优化了鱿鱼皮蛋白肽的酶解制备工艺,得到的最佳条件为:酶解温度43.50 ℃、酶解时间100 min、酶解pH7.50、胰蛋白酶与碱性蛋白酶比例为2:1、加酶量4000 U/g,在此条件下TCA-NSI可达89.02%±0.66%,所制备的鱿鱼皮蛋白肽氨基酸组成均衡,EAAI值为0.90。LC-MS/MS测序结果表明鱿鱼皮蛋白肽中含有43个多肽序列,其中38个肽段的分子量低于1800 Da,且有16个肽段中的疏水氨基酸超过一半,分别有58.14%和48.84%的多肽序列在其N端和C端存在疏水性氨基酸,使得鱿鱼皮蛋白肽对DPPH自由基、ABTS+自由基和羟自由基清除率的IC50可分别达0.61、0.28和1.95 mg/mL。经体外模拟胃肠消化后,鱿鱼皮蛋白肽可被降解为分子量更小的肽段,同时仍能维持较好的抗氧化活性。本实验为鱿鱼皮蛋白肽的制备及应用提供了实验依据。
-
图 1 不同酶解条件对多肽浓度和TCA-NSI的影响
注:不同字母代表同一指标差异显著(P<0.05),下标数字代表不同的指标;图4同。
Figure 1. Effects of different enzymatic conditions on peptide concentration and TCA-NSI
表 1 复合蛋白酶实验条件
Table 1 Test conditions of compound protease
蛋白酶组合 温度(℃) pH 料液比 蛋白酶
比例加酶量
(U/g)酶解时间
(min)木瓜蛋白酶+
碱性蛋白酶50 7.8 1:5 1:1 5000 120 木瓜蛋白酶+
胰蛋白酶50 7.5 1:5 1:1 5000 120 胰蛋白酶+
碱性蛋白酶50 8.3 1:5 1:1 5000 120 风味蛋白酶+
胰蛋白酶50 7.8 1:5 1:1 5000 120 风味蛋白酶+
木瓜蛋白酶50 7.3 1:5 1:1 5000 120 风味蛋白酶+
碱性蛋白酶50 8.0 1:5 1:1 5000 120 表 2 响应面试验因素水平设计
Table 2 Factors and levels for response surface test
因素 水平 −1 0 1 A酶解温度(℃) 40 45 50 B酶解时间(min) 60 80 100 C酶解pH 7 8 9 表 3 响应面试验方案及结果
Table 3 Design and results of response surface test
试验号 酶解温度 酶解时间 酶解pH TCA-NSI(%) 1 0 0 0 88.87 2 1 −1 0 60.07 3 −1 1 0 80.89 4 −1 0 −1 83.95 5 0 1 1 62.89 6 1 0 −1 63.57 7 −1 −1 0 80.27 8 1 0 1 57.93 9 0 −1 1 66.20 10 0 −1 −1 64.88 11 1 1 0 76.08 12 0 0 0 88.41 13 0 0 0 87.63 14 0 0 0 87.90 15 −1 0 1 72.31 16 0 0 0 86.64 17 0 1 −1 84.56 表 4 响应面模型的方差分析
Table 4 ANOVA of the response surface model
变异来源 平方和 自由度 均方 F值 P值 显著性 模型 1965.58 9 218.40 63.36 <0.0001 ** A-酶解温度 446.56 1 446.56 129.54 <0.0001 ** B-酶解时间 136.13 1 136.13 39.49 0.0004 ** C-酶解pH 177.00 1 177.00 51.35 0.0002 ** AB 59.21 1 59.21 17.18 0.0043 ** AC 9.00 1 9.00 2.61 0.1502 BC 132.14 1 132.14 38.33 0.0004 ** A2 187.74 1 187.74 54.46 0.0002 ** B2 177.07 1 177.07 51.37 0.0002 ** C2 544.56 1 544.56 157.97 <0.0001 ** 残差 24.13 7 3.45 失拟项 13.07 3 4.36 1.58 0.3273 纯误差 11.06 4 2.77 总和 1989.71 16 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 5 鱿鱼皮蛋白肽的氨基酸组成
Table 5 Amino acid composition of squid skin peptides
序号 氨基酸名称 氨基酸含量
(g/100 g)1 天冬氨酸Asp 5.03±0.03 2 苏氨酸Thr* 5.01±0.35 3 丝氨酸Ser 4.44±0.09 4 谷氨酸Glu 8.66±0.36 5 脯氨酸Pro 8.17±0.64 6 甘氨酸Gly 11.78±0.85 7 丙氨酸Ala 5.60±0.10 8 胱氨酸Cys 2.42±0.05 9 缬氨酸Val* 3.35±0.20 10 蛋氨酸Met* 2.87±0.05 11 异亮氨酸Ile* 2.12±0.02 12 亮氨酸Leu* 5.70±0.20 13 酪氨酸Tyr 4.36±0.06 14 苯丙氨酸Phe* 5.74±0.14 15 组氨酸His 1.02±0.10 16 赖氨酸Lys* 2.91±0.05 17 精氨酸Arg 3.87±0.16 TAA(g/100 g) 83.05 EAA/TAA(%) 33.35 EAA(Lys、Trp、Phe、Met、Thr、Leu、Ile、Val) 27.70 HAA(Trp、Phe、Val、Leu、Ile、Ala、Pro、Met) 33.55 AAA(Phe、Tyr、Trp) 10.10 注:*必需氨基酸(Essential amino acids,EAA);总氨基酸(Total amino acids,TAA);疏水氨基酸(Hydrophobic amino acids,HAA);芳香族氨基酸(Aromatic amino acids,AAA)。 表 6 鱿鱼皮蛋白肽的必需氨基酸含量及氨基酸评分
Table 6 Essential amino acid content and amino acid score of squid skin peptides
必需氨基酸 必需氨基酸含量(mg/g) 氨基酸评分 化学评分 必需氨基
酸指数
(EAAI)鱿鱼皮
蛋白肽FAO/WHO
模式全蛋
模式AAS CS 苏氨酸 50.10 40 47 1.25 1.07 0.90 缬氨酸 33.54 50 66 0.67 0.51 异亮氨酸 21.17 40 54 0.53 0.39 亮氨酸 57.00 70 86 0.81 0.66 苯丙氨酸+
酪氨酸101.03 60 93 1.68 1.09 蛋氨酸+
胱氨酸52.86 35 57 1.51 0.93 赖氨酸 29.12 55 70 0.53 0.42 表 7 鱿鱼皮蛋白肽的分子量分布
Table 7 Molecular weight distribution of squid skin peptides
分子量范围(Da) 保留时间(min) 平均分子量(Da) 百分比(%) 5000~10000 15.872 8020 0.007 3000~5000 16.800 4976 0.063 500~3000 21.157 529 49.212 180~500 21.678 405 50.426 <180 24.738 84 0.292 表 8 鱿鱼皮蛋白肽的LC-MS/MS序列鉴定结果
Table 8 LC-MS/MS sequence identification results of squid skin peptides
序号 肽段序列 长度 分子量(Da) m/z 肽段匹配错误率 肽段分值 蛋白来源 1 VSGTDPEDAL 10 1002.45 1002.45 0.00 163.72 myosin regulatory light chain 2 SDSVIENPF 9 1006.46 1006.46 0.00 158.12 hemocyanin subunit 1 3 QIEPNPF 7 843.41 843.41 0.00 153.88 hemocyanin subunit 2 4 EITDLL 6 702.38 702.38 0.00 149.33 CARB-Par-1, partial 5 VIENPF 6 717.37 717.37 0.00 149.11 hemocyanin subunit 2 6 SVINIS 6 631.35 631.35 0.00 134.12 NADH dehydrogenase subunit 6 7 LDDESRQR 8 1017.48 508.74 0.00 133.55 paramyosin 8 FHSPMEPF 8 990.43 990.43 0.00 132.94 hemocyanin subunit 2 9 LENDFDNA 8 936.38 936.38 0.00 129.77 tropomyosin 10 DDESRQR 7 904.40 452.20 0.00 111.65 paramyosin 11 GGETEMPW 8 905.36 905.36 0.00 106.29 hemocyanin subunit 2 12 IPTFML 6 720.39 720.39 0.00 89.349 NADH dehydrogenase subunit 4 13 RIEMENR 7 946.47 473.23 0.00 87.181 paramyosin 14 STHPHF 6 724.33 362.16 0.00 85.641 myosin heavy chain 15 LEDEAR 6 731.34 365.67 0.01 62.715 myosin heavy chain 16 SFGAPY 6 640.29 640.29 0.01 47.821 hemocyanin subunit 2 17 LPYNEA 6 705.33 352.67 0.01 19.694 hemocyanin subunit 2 18 EVPEDK 6 715.34 357.67 0.01 18.805 heat shock 70 kDa protein 4L isoform 4 19 VEDERR 6 802.39 401.20 0.01 17.084 paramyosin 20 VVEDER 6 745.36 372.68 0.01 12.431 paramyosin 21 VITFHK 6 743.43 371.72 0.01 10.919 heat shock 70 kDa protein 4L isoform 4 22 ISTQHGGIMNYMNSNF 16 1812.79 453.20 0.00 9.9211 NADH dehydrogenase subunit 4 23 LDEKPR 6 756.41 378.21 0.01 8.683 heat shock 70 kDa protein 4L isoform 4 24 MNSNIMTIMIISMMTTL 17 1943.93 485.98 0.00 4.9019 NADH dehydrogenase subunit 2 25 TDAERR 6 746.37 373.18 0.01 4.6725 heat shock 70 kDa protein 4L isoform 4 26 LSGDYY 6 716.30 358.15 0.01 4.4158 hemocyanin subunit 1 27 TADIYR 6 737.37 368.69 0.01 4.4158 tyrosinase precursor 2 28 KDNFHY 6 822.37 411.18 0.01 4.1196 hemocyanin subunit 2 29 EIIHERMENICNMGNF 16 1948.86 487.21 0.00 1.0321 tyrosinase precursor 2 30 CCQHGMITFPHWHR 14 1751.76 583.92 0.01 0.12211 hemocyanin subunit 2 31 RVGIPY 6 703.40 351.70 0.01 0 hemocyanin subunit 1 32 PIGRFL 6 701.42 350.71 0.01 0 tyrosinase precursor 2 33 NQHQQQQQHHHHQQHQHTL 19 2458.12 614.53 0.00 0 RNA-binding protein squid 34 MDTSHGPHIPPGAL 14 1428.68 476.23 0.01 0 zinc finger protein Lb-Zic 35 LLIIGW 6 713.45 356.72 0.01 0 NADH dehydrogenase subunit 4 36 TGGITTTTTTSSQERR 16 1695.84 423.96 0.01 0 a neurofilament protein 37 IRDIQQEY 8 1063.53 354.51 0.00 0 a neurofilament protein 38 VESDIMEMDEGSMY 14 1634.62 544.87 0.01 0 voltage-dependent potassium channel SqKv1A 39 IPDPDTIQWSPCTDPY 16 1846.81 461.70 0.00 0 symplectin/biotinidase-like protein 2 40 FHNQNIITMIIGIF 14 1659.88 553.29 0.01 0 cytochrome c oxidase subunit III 41 VLQNQY 6 763.39 381.69 0.01 0 tyrosinase precursor 2 42 EEAMME 6 738.26 369.13 0.01 0 myosin heavy chain 43 MDDCNTCSCSSGNV 14 1434.45 478.15 0.01 0 Paci-Abd-2 注:G甘氨酸;A丙氨酸;V缬氨酸;L亮氨酸;I异亮氨酸;P脯氨酸;F苯丙氨酸;Y酪氨酸;S丝氨酸;T苏氨酸;M甲硫氨酸;N天冬酰胺;Q谷氨酰胺;D天冬氨酸;E谷氨酸;R精氨酸;H组氨酸;C半胱氨酸;K赖氨酸。 表 9 模拟胃肠消化对鱿鱼皮蛋白肽分子量分布的影响(%)
Table 9 Effect of simulated gastrointestinal digestion on the molecular weight distribution of squid skin peptides (%)
消化阶段 5000~10000(Da) 3000~5000(Da) 500~3000(Da) 180~500(Da) <180(Da) 消化前 0.007±0.00a 0.063±0.00a 49.212±0.33a 50.426±0.28b 0.292±0.05c 模拟胃消化 0.000±0.00b 0.000±0.00b 50.750±0.78a 48.290±0.71b 0.960±0.07b 模拟肠消化 0.000±0.00b 0.000±0.00b 0.000±0.00b 98.610±0.09a 1.390±0.09a 注:同列不同字母表示数据间具有显著性(P<0.05)。 -
[1] 刘金立, 陈新军. 世界大洋性鱿钓渔业研究评述[J]. 上海海洋大学学报,2019,28(3):331−343. [LIU J L, CHEN X J. Bibliometrics research of document on the theme of oceanic squid jigging fishery in the world[J]. Journal of Shanghai Ocean University,2019,28(3):331−343.] LIU J L, CHEN X J . Bibliometrics research of document on the theme of oceanic squid jigging fishery in the world[J]. Journal of Shanghai Ocean University,2019 ,28 (3 ):331 −343 .[2] 曲映红, 陈新军, 陈舜胜. 我国鱿鱼加工利用技术研究进展[J]. 上海海洋大学学报,2019,28(3):357−364. [QU Y H, CHEN X J, CHEN S S. Research progress of squid processing and utilization technology in China[J]. Journal of Shanghai Ocean University,2019,28(3):357−364.] doi: 10.12024/jsou.20190102498 QU Y H, CHEN X J, CHEN S S . Research progress of squid processing and utilization technology in China[J]. Journal of Shanghai Ocean University,2019 ,28 (3 ):357 −364 . doi: 10.12024/jsou.20190102498[3] 王华军. 鱿鱼内脏团的高值化产品研发及其性能表征[D]. 福州:福州大学, 2018. [WANG H J. The development and characterization of high-value products from squid viscera[D]. Fuzhou:Fuzhou University, 2018.] WANG H J. The development and characterization of high-value products from squid viscera[D]. Fuzhou: Fuzhou University, 2018.
[4] 黄玲, 余梦海, 刘晗慧, 等. 鱿鱼主要组分与酸味研究进展[J]. 食品安全质量检测学报,2022,13(24):7859−7866. [HUANG L, YU M H, LIU H H, et al. Progress in the study of calamary main components and acidity[J]. Journal of Food Safety and Quality,2022,13(24):7859−7866.] doi: 10.3969/j.issn.2095-0381.2022.24.spaqzljcjs202224004 HUANG L, YU M H, LIU H H, et al . Progress in the study of calamary main components and acidity[J]. Journal of Food Safety and Quality,2022 ,13 (24 ):7859 −7866 . doi: 10.3969/j.issn.2095-0381.2022.24.spaqzljcjs202224004[5] ALEMAN A, GOMEZ-GUILLEN M C, MONTERO P. Identification of ACE-inhibitory peptides from squid skin collagen after in vitro gastrointestinal digestion[J]. Food Research International,2013,54(1):790−795. doi: 10.1016/j.foodres.2013.08.027
[6] 张国玉, 俞存兵, 余奕珂, 等. 酶法制备鱿鱼皮胶原蛋白肽工艺[J]. 食品工业,2022,43(11):12−14. [ZHANG G Y, YU C B, YU Y K, et al. Enzymatic preparation of collogen peptide from squid skin[J]. Food Industry,2022,43(11):12−14.] ZHANG G Y, YU C B, YU Y K, et al . Enzymatic preparation of collogen peptide from squid skin[J]. Food Industry,2022 ,43 (11 ):12 −14 .[7] 区兑鹏, 张小军, 严忠雍, 等. 鮟鱇鱼、鱿鱼、马面鱼明胶提取工艺优化[J]. 渔业现代化,2022,49(2):76−84. [OU D P, ZHANG X J, YAN Z Y, et al. Optimization of Lophiiformes, squid, Thamnaconus septentrionalis fish skin gelatin extraction process[J]. Fishery Modernization,2022,49(2):76−84.] doi: 10.3969/j.issn.1007-9580.2022.02.010 OU D P, ZHANG X J, YAN Z Y, et al . Optimization of Lophiiformes, squid, Thamnaconus septentrionalis fish skin gelatin extraction process[J]. Fishery Modernization,2022 ,49 (2 ):76 −84 . doi: 10.3969/j.issn.1007-9580.2022.02.010[8] EZQUERRA-BRAUER J M, MIRANDA J M, CHAN-HIGUERA J E, et al. New icing media for quality enhancement of chilled hake ( Merluccius merluccius) using a jumbo squid ( Dosidicus gigas) skin extract[J]. Journal of the Science of Food and Agriculture,2017,97(10):3412−3419. doi: 10.1002/jsfa.8192
[9] KAO Y F, WU Y H S, CHOU C H, et al. Manufacture and characterization of anti-inflammatory liposomes from jumbo flying squid ( Dosidicus gigas) skin phospholipid extraction[J]. Food & Function,2018,9(7):3986−3996.
[10] CUI Q, SUN Y X, CHENG J J, et al. Effect of two-step enzymatic hydrolysis on the antioxidant properties and proteomics of hydrolysates of milk protein concentrate[J]. Food Chemistry,2022,366:130711. doi: 10.1016/j.foodchem.2021.130711
[11] 鲁伟, 任国谱, 宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005,26(7):169−171. [LU W, REN G P, SONG J M. Determination of contentof peptidesin proteinhydrolysates[J]. Food Science,2005,26(7):169−171.] doi: 10.3321/j.issn:1002-6630.2005.07.039 LU W, REN G P, SONG J M . Determination of contentof peptidesin proteinhydrolysates[J]. Food Science,2005 ,26 (7 ):169 −171 . doi: 10.3321/j.issn:1002-6630.2005.07.039[12] 马瑞娟, 林煌华, 谢友坪, 等. 固定化酶制备鳀鱼蒸煮液蛋白肽及其性能表征[J]. 食品与发酵工业,2020,46(9):122−127. [MA R J, LIN H H, XIE Y P, et al. Preparation and characterization of peptides from anchovy cooking liquid using immobilized protease[J]. Food and Fermentation Industries,2020,46(9):122−127.] MA R J, LIN H H, XIE Y P, et al . Preparation and characterization of peptides from anchovy cooking liquid using immobilized protease[J]. Food and Fermentation Industries,2020 ,46 (9 ):122 −127 .[13] 徐永江, 王开杰, 姜燕, 等. 三种鰤属鱼类肌肉质构特性及营养成分比较分析[J]. 中国水产科学,2022,29(7):1022−1032. [XU Y J, WANG K J, JIANG Y, et al. Comparative analysis of the muscle texture characteristics and nutrient compositions among three Seriola fishes[J]. Journal of Fishery Sciences of China,2022,29(7):1022−1032.] doi: 10.12264/JFSC2021-0492 XU Y J, WANG K J, JIANG Y, et al . Comparative analysis of the muscle texture characteristics and nutrient compositions among three Seriola fishes[J]. Journal of Fishery Sciences of China,2022 ,29 (7 ):1022 −1032 . doi: 10.12264/JFSC2021-0492[14] 高群, 黄渊楠, 蔡茜茜, 等. 鲈鱼抗氧化肽的稳定性分析及其对细胞氧化损伤的保护作用[J]. 食品工业科技,2023,44(4):410−418. [GAO Q, HUANG Y N, CAI X X et al. Stability analysis of antioxidant peptides from Lateolabrax maculatus and their protective effect against cellular oxidative damage[J]. Science and Technology of Food Industry,2023,44(4):410−418.] GAO Q, HUANG Y N, CAI X X et al . Stability analysis of antioxidant peptides from Lateolabrax maculatus and their protective effect against cellular oxidative damage[J]. Science and Technology of Food Industry,2023 ,44 (4 ):410 −418 .[15] 葛珍珍, 许明月, 赵玉翔, 等. 杜仲籽粕水解肽的制备及其抗氧化活性分析[J]. 食品工业科技,2022,43(21):218−224. [GE Z Z, XU M Y, ZHAO Y X, et al. Preparation and antioxidant activity analysis of hydrolyzed peptides from Eucommia ulmoides seed meal[J]. Science and Technology of Food Industry,2022,43(21):218−224.] GE Z Z, XU M Y, ZHAO Y X, et al . Preparation and antioxidant activity analysis of hydrolyzed peptides from Eucommia ulmoides seed meal[J]. Science and Technology of Food Industry,2022 ,43 (21 ):218 −224 .[16] 李小锋, 张露, 马天新, 等. 多宝鱼不同水解物肽段组成及体外抗氧化活性比较[J]. 食品工业科技,2023,44(3):95−101. [LI X F, ZHANG L, MA T X, et al. Comparison of peptide composition and in vitro antioxidant activity of different hydrolysates of turbot meat[J]. Science and Technology of Food Industry,2023,44(3):95−101.] LI X F, ZHANG L, MA T X, et al . Comparison of peptide composition and in vitro antioxidant activity of different hydrolysates of turbot meat[J]. Science and Technology of Food Industry,2023 ,44 (3 ):95 −101 .[17] 王金玲, 王雨淅, 王梓同, 等. 大豆多肽的制备及功能性研究进展[J]. 中国酿造,2022,41(1):25−31. [WANG J L, WANG Y X, WANG Z T. Progress on preparation and functionality of soybean polypeptides[J]. China Brewing,2022,41(1):25−31.] doi: 10.11882/j.issn.0254-5071.2022.01.005 WANG J L, WANG Y X, WANG Z T . Progress on preparation and functionality of soybean polypeptides[J]. China Brewing,2022 ,41 (1 ):25 −31 . doi: 10.11882/j.issn.0254-5071.2022.01.005[18] 徐刘贝, 马佳雯, 蔡金秀, 等. 酶解-发酵法制备鱼鲜汁的工艺优化[J]. 食品工业科技,2021,42(22):185−192. [XU L B, MA J W, CAI J X, et al. Optimization of enzymatic hydrolysis-fermentation process for preparing fish juice[J]. Science and Technology of Food Industry,2021,42(22):185−192.] XU L B, MA J W, CAI J X, et al . Optimization of enzymatic hydrolysis-fermentation process for preparing fish juice[J]. Science and Technology of Food Industry,2021 ,42 (22 ):185 −192 .[19] MULLALLY M M, OCALLAGHAN D M, FITZGERALD R J, et al. Zymogen activation in pancreatic endoproteolytic preparations and influence on some whey-protein hydrolysate characteristics[J]. Journal of Food Science,1995,60(2):227−233. doi: 10.1111/j.1365-2621.1995.tb05643.x
[20] 王熙, 刘晓攀, 刘冰, 等. 酶解法制备条浒苔抗氧化肽工艺优化及其消化稳定性研究[J]. 食品工业科技,2020,41(16):176−181,219. [WANG X, LIU X P, LIU B, et al. Optimization of the preparation of antioxidant peptides from Enteromorpha clathrata by enzymolysis and its digestive stability[J]. Science and Technology of Food Industry,2020,41(16):176−181,219.] WANG X, LIU X P, LIU B, et al . Optimization of the preparation of antioxidant peptides from Enteromorpha clathrata by enzymolysis and its digestive stability[J]. Science and Technology of Food Industry,2020 ,41 (16 ):176 −181,219 .[21] JOOYANDEH H, NOSHAD M, KHAMIRIAN R A. Modeling of ultrasound-assisted extraction, characterization and in vitro pharmacological potential of polysaccharides from Vaccinium arctostaphylos L[J]. International Journal of Biological Macromolecules,2018,107:938−948. doi: 10.1016/j.ijbiomac.2017.09.077
[22] RESA P, ELVIRA L, SIERRA C, et al. Ultrasonic velocity assay of extracellular invertase in living yeasts[J]. Analytical Biochemistry,2009,384(1):68−73. doi: 10.1016/j.ab.2008.09.025
[23] 尹家琪, 康明丽, 韩敏义, 等. 酶法制备鸡肺抗氧化肽及其序列分析[J]. 食品工业科技,2022,43(10):112−123. [YIN J Q, KANG M L, HAN M Y, et al. Enzymatic preparation and sequence analysis of antioxidant peptides from chicken lung[J]. Science and Technology of Food Industry,2022,43(10):112−123.] YIN J Q, KANG M L, HAN M Y, et al . Enzymatic preparation and sequence analysis of antioxidant peptides from chicken lung[J]. Science and Technology of Food Industry,2022 ,43 (10 ):112 −123 .[24] 王耀冉, 陈明杰, 查磊, 等. 响应面法优化草菇抗氧化肽的酶法制备工艺[J]. 食品工业科技,2022,43(15):227−233. [WANG Y R, CHEN M J, ZHA L, et al. Optimization of enzymatic preparation technology of antioxidant peptide from Volvariella volvacea by response surface methodology[J]. Science and Technology of Food Industry,2022,43(15):227−233.] WANG Y R, CHEN M J, ZHA L, et al . Optimization of enzymatic preparation technology of antioxidant peptide from Volvariella volvacea by response surface methodology[J]. Science and Technology of Food Industry,2022 ,43 (15 ):227 −233 .[25] KENT M, WELLADSEN H M, MANGOTT A, et al. Nutritional evaluation of australian microalgae as potential human health supplements[J]. PLos One,2015,10(2):e0118985. doi: 10.1371/journal.pone.0118985
[26] WANG C, WANG B, LI B. Bioavailability of peptides from casein hydrolysate in vitro:Amino acid compositions of peptides affect the antioxidant efficacy and resistance to intestinal peptidases[J]. Food Research International,2016,81(3):188−196.
[27] 郑义, 邵颖, 陈安徽, 等. 益智仁总黄酮超声辅助提取工艺优化及其抗氧化活性[J]. 食品科学,2014,35(6):44−49. [ZHENG Y, SHAO Y, CHEN A H, et al. Optimization of ultrasonic-assisted extraction and antioxidant activities of total flavonoids from Alpinia oxyphylla fruits[J]. Food Science,2014,35(6):44−49.] doi: 10.7506/spkx1002-6630-201406009 ZHENG Y, SHAO Y, CHEN A H, et al . Optimization of ultrasonic-assisted extraction and antioxidant activities of total flavonoids from Alpinia oxyphylla fruits[J]. Food Science,2014 ,35 (6 ):44 −49 . doi: 10.7506/spkx1002-6630-201406009[28] SARBON N M, BADII F, HOWELL N K. Purification and characterization of antioxidative peptides derived from chicken skin gelatin hydrolysate[J]. Food Hydrocolloids,2018,85:311−320. doi: 10.1016/j.foodhyd.2018.06.048
[29] WONG F C, XIAO J, WANG S, et al. Advances on the antioxidant peptides from edible plant sources[J]. Trends in Food Science & Technology,2020,99:44−57.
[30] ESTEVE C, MARINA M L, GARCIA M C. Novel strategy for the revalorization of olive ( Olea europaea) residues based on the extraction of bioactive peptides[J]. Food Chemistry,2015,167(15):272−280.
[31] NGOH Y Y, GAN C Y. Enzyme-assisted extraction and identification of antioxidative and α-amylase inhibitory peptides from pinto beans ( Phaseolus vulgaris cv. Pinto)[J]. Food Chemistry,2016,190:331−337. doi: 10.1016/j.foodchem.2015.05.120
[32] LIAO B Q, HUANG C L, FENG J, et al. Overview of antioxidant peptides derived from marine resources:The sources, characteristic, purification, and evaluation methods[J]. Applied Biochemistry and Biotechnology,2015,179(7):1885−1833.
[33] TANZADEHPANAH H, ASOODEH A, CHAMANI J. An antioxidant peptide derived from ostrich ( Struthio camelus) egg white protein hydrolysates[J]. Food Research International,2012,49(1):105−111. doi: 10.1016/j.foodres.2012.08.022
[34] YANG J, HUANG J, DONG X, et al. Purification and identification of antioxidant peptides from duck plasma proteins[J]. Food Chemistry,2020,319:126534. doi: 10.1016/j.foodchem.2020.126534
[35] RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International,2005,38(2):175−182. doi: 10.1016/j.foodres.2004.10.002
[36] 朱婷婷, 郑炜, 尚子寒, 等. 星鳗抗氧化肽的稳定性研究[J]. 食品安全质量检测学报,2022,13(20):6488−6494. [ZHU T T, ZHENG W, SHANG Z H, et al. Stability study of antioxidant peptidesin Astroconger myriaster[J]. Journal of Food Safety and Quality,2022,13(20):6488−6494.] ZHU T T, ZHENG W, SHANG Z H, et al . Stability study of antioxidant peptidesin Astroconger myriaster[J]. Journal of Food Safety and Quality,2022 ,13 (20 ):6488 −6494 .[37] 郑昌亮, 陈梦婷, 汪兰, 等. 鳙鱼肌原纤维蛋白源抗氧化肽的稳定性研究[J]. 食品与发酵工业,2023,49(8):43−50. [ZHENG C L, CHEN M T, WANG L, et al. Stability of antioxidant peptides from bighead carp ( Aristichthys nobilis) myofibrillar protein[J]. Food and Fermentation Industries,2023,49(8):43−50.] ZHENG C L, CHEN M T, WANG L, et al . Stability of antioxidant peptides from bighead carp (Aristichthys nobilis) myofibrillar protein[J]. Food and Fermentation Industries,2023 ,49 (8 ):43 −50 . -
期刊类型引用(4)
1. 李敏晶,李丹阳,范梓伊. 响应面优化海星肽-锌螯合物的制备. 农产品加工. 2025(04): 11-14+19 .  百度学术
百度学术
2. 高思惠,马玉芯,刘秀军,夏广清,郭鑫. 鱼鳔氨基酸组成分析及抗氧化活性研究. 粮食与食品工业. 2024(02): 28-32 .  百度学术
百度学术
3. 秦巾凡,李婷,苗钧魁,冷凯良,张雅婷,唐文婷,蒲传奋. 鱿鱼皮综合利用研究进展. 食品与发酵工业. 2024(22): 409-416 .  百度学术
百度学术
4. 赵艺科,吴桐,孙孟琪,万茜淋,张哲,杨洪梅. 高分辨液相色谱-串联质谱法分析冻干西洋参抗氧化多肽. 质谱学报. 2024(06): 851-860 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



