Comparative Study on the Structural Characterization and Cosmetic-related Activities of Three Rose Polysaccharides
-
摘要: 分别提取获得和田玫瑰多糖、苦水玫瑰多糖和平阴玫瑰多糖。测定粗多糖得率及多糖含量,利用离子色谱仪、傅里叶红外光谱仪、高效液相色谱联用多角度激光散射法、刚果红实验和碘-碘化钾实验表征多糖结构。利用体外抗氧化实验、益生元实验和酪氨酸酶抑制实验分析玫瑰多糖美容相关活性。结果表明,和田玫瑰的粗多糖得率高于苦水玫瑰和平阴玫瑰(P<0.05),平阴玫瑰粗多糖中的多糖含量较低(P<0.05)。3种玫瑰多糖均包含Glc、Ara、Gal和Fru等11种单糖残基(摩尔比例不同);重均分子量在4.376×105~5.841×105 Da之间(分散系数:1.35~1.72);均为含有α和β构型的吡喃糖;均不含有三螺旋结构,具有较多侧链。活性评价实验表明,3种玫瑰多糖均具有良好的抗氧化能力、益生元作用及酪氨酸酶抑制能力。在3种玫瑰多糖中,平阴玫瑰多糖具有较强的ABTS+及DPPH自由基清除能力(P<0.05),而和田玫瑰多糖具有较强的酪氨酸酶抑制能力(P<0.05)。因此,3种玫瑰多糖结构具有相似性,其结构的差异导致生物学活性略有差异。3种玫瑰多糖在美容功能食品领域具有良好的开发应用前景。Abstract: Hetian rose polysaccharides, Kushui rose polysaccharides and Pingyin rose polysaccharides were extracted and obtained respectively, and the crude polysaccharide yield and polysaccharide content were determined. The polysaccharide structure was characterized using ion chromatograph, Fourier transform infrared spectroscopy and high performance liquid chromatography coupled with multi-angle laser scattering method. Cosmetic-related activities were analyzed using in vitro antioxidant, prebiotic and tyrosinase inhibition assays. The results showed that the crude polysaccharide yield of Hetian rose was higher than that of Kushui rose and Pingyin rose (P<0.05), and the polysaccharide content in the crude polysaccharide of Pingyin rose was lower (P<0.05). All three rose polysaccharides contained 11 types of monosaccharide residues (with different molar ratios), including Glc, Ara, Gal and Fru. Their weight-averaged molecular weights ranged from 4.376×105 to 5.841×105 Da (dispersity index: 1.35~1.72). They were all pyranose containing α and β configurations. They all had non-triple helical spiral structures and multi-branched. The activity evaluation experiments showed that all three rose polysaccharides had good antioxidant activity, prebiotic effect and tyrosinase inhibition activity. Among the three rose polysaccharides, Pingyin rose polysaccharide had strong ABTS+ and DPPH free radical scavenging activities (P<0.05), while Hetian rose polysaccharide had strong tyrosinase inhibition activity (P<0.05). Therefore, the three rose polysaccharides were similar in structure, and their structural differences led to slight differences in biological activities. The three types of rose polysaccharides had good development and application prospects in the field of cosmetic functional foods.
-
玫瑰(Rosa rugosa Thunb.)为蔷薇科蔷薇属的多年生常绿或落叶灌木[1]。新疆和田、甘肃苦水和山东平阴玫瑰种植历史悠久,玫瑰花质量上乘,是享誉全国的“玫瑰之乡”。玫瑰产业是山东平阴、甘肃苦水和新疆和田地区的特色产业,由于相关政策支持,玫瑰产业正在以上地区蓬勃发展[2]。和田玫瑰、苦水玫瑰和平阴玫瑰是各具特色的不同玫瑰品种(图1)。平阴玫瑰,又称重瓣红玫瑰,为历史悠久的我国本土优良玫瑰品种[3];苦水玫瑰是顿齿蔷薇和中国传统玫瑰的自然杂交种[4];和田玫瑰来源于古丝绸之路,可能属于独特的突厥玫瑰品系[5]。如何高质量地发展平阴、苦水和和田地区的特色玫瑰花产业是亟需解决的重要问题。
玫瑰花作为药食同源植物,自古以来就是深受女性喜爱的美容养颜佳品,具有行气解郁、活血化瘀、美容养颜的功效[6]。美容功能食品是近年来受到广泛关注的功能食品研究方向。美容功能食品可以由内向外调理机体机能,通过机体生理状态整体的改善,达到容光焕发、美容养颜的效果[7]。衰老的自由基学说认为抗氧化是预防衰老的关键[8];肠道微生态环境与肌肤暗沉、机体衰老密切相关[9];抑制皮肤黑色素形成是美容产品研发最关注的功效之一。因此,研发具有抗氧化作用、益生元作用和抑制黑色素形成作用的玫瑰美容功能产品可以作为玫瑰产业新的发展方向。
天然植物多糖是一类由单糖分子通过糖苷键结合而成的大分子化合物,具有抗氧化、调节免疫、降血糖和调节肠道菌群等广泛的生物学活性[10]。天然植物多糖是一类极具开发潜力的天然活性物质,具有功效明确和无毒副作用的优点。多糖结构是多糖呈现不同生物学活性的基础,多糖构效关系的阐明对多糖研发具有重要意义。目前,不同品种玫瑰多糖的比较研究未见报道。玫瑰多糖相关研究主要集中于玫瑰多糖提取工艺的优化,结构的初步表征以及降血糖[11]、抗肿瘤[12]等生物学活性的研究。但是,关于玫瑰多糖结构的研究较为浅显,缺乏玫瑰多糖结构特征的系统研究。玫瑰多糖美容相关生物学活性的研究还未见报道。
本研究选取平阴玫瑰、苦水玫瑰和田玫瑰作为研究对象,采用“水提醇沉法”分别提取3种玫瑰多糖。分析玫瑰多糖单糖组成、分子量、官能团、分支程度等结构特征,对比研究其抗氧化、益生元作用和抑制酪氨酸酶活性。本研究以期为玫瑰多糖开发为美容类功能产品提供理论依据,为我国主要产区不同品种玫瑰的产业化发展提供新的思路。
1. 材料与方法
1.1 材料与仪器
和田玫瑰干花蕾 新疆阿克苏市实验林场六队;苦水玫瑰干花蕾 兰州永登苦水镇玫瑰产业基地;平阴玫瑰干花蕾 平阴县玫瑰镇夏沟村东(3种玫瑰干花蕾均为烘干品);Lactobacillu casei(菌株编号:23184)、Lactobacillus plantarum(菌株编号:21825) 购买自中国工业微生物菌种保藏管理中心;D-岩藻糖(Fucose,Fuc)、L-阿拉伯糖(Arabinose,Ara)、L-鼠李糖(Rhamnose,Rha)、L-半乳糖(Galactose,Gal)、D-葡萄糖(Glucose,Glu)、D-木糖(Xylose,Xyl)、D-甘露糖(Mannose,Man)、D-果糖(Fructose,Fru)、D-核糖(Ribose,Rib)、D-半乳糖醛酸(Galacturonic acid,Gal-UA)、D-古罗糖醛酸(Guluronic acid,Gul-UA)、D-葡萄糖醛酸(Glucuronic acid,Glu-UA)、D-甘露糖醛酸(Mannuronic acid,Man-UA)、右旋糖酐(纯度99%)、1,1-二苯基-2-苦基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 阿拉丁化学试剂公司;其它化学试剂均为分析纯。
SBA-40E生物传感分析仪 山东省科学院生物研究所;JY92-II超声波细胞破碎机 宁波新芝生物科技股份有限公司;LE204E电子天平 梅特勒-托利多(Mettler Toledo)仪器(上海)有限公司;5804R离心机 德国Eppendorf公司;HH-2数显恒温水浴锅 常州国华电器有限公司;101A-2电热鼓风干燥箱 南通宏大实验仪器有限公司;Dynex Spectra MR酶标仪 美国Dynex Technologies公司;ICS5000离子色谱仪(Ion chromatography,IC)、Dionex™CarboPac™PA20液相色谱柱(150 mm×3.0 mm,10 μm)、ICS5000电导率检测器、Nicolet 6700 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪 美国Thermo公司;1260 Infinity Ⅱ MDS高效液相色谱仪、1260 Infinity II 等度泵、1260 Infinity II 示差检测器、1260 Infinity II 双角度激光散射检测器、1260 Infinity II 黏度检测器、PL aquagel-OH Mixed-H色谱柱(8 μm,7.5×300 mm) 美国Agilent公司; Multimode 8 原子力显微镜(Atomic force microscope,AFM) 德国布鲁克公司。
1.2 实验方法
1.2.1 粗多糖的制备
采用“水提醇沉法”提取玫瑰粗多糖[13]。使用粉碎机分别粉碎和田玫瑰、苦水玫瑰和平阴玫瑰干花蕾,获得玫瑰干花蕾粉末。按照粉末:去离子水为1:20(m/v)的比例将玫瑰干花蕾粉末与去离子水混合。超声波破碎(超声功率300 W,10 min),置于90 ℃水浴锅中水浴2 h,离心(10000 r/min,10 min,4 ℃)取上清液,上述步骤重复3次,合并上清液。使用旋转蒸发仪将上清液浓缩至1/2体积,加入3倍体积的95%乙醇,静置过夜。10000 r/min离心10 min收集沉淀,沉淀于55 ℃烘干得和田玫瑰粗多糖、苦水玫瑰粗多糖以及平阴玫瑰粗多糖,分别命名为HRP、KRP和PRP。称量,计算玫瑰粗多糖得率。
玫瑰粗多糖得率(%)=粗多糖质量(g)玫瑰干花蕾粉末质量(g)×100 1.2.2 多糖含量的测定
采用苯酚-硫酸法[14]测定多糖含量,精确量取400 μL浓度为0、0.0125、0.025、0.0375、0.05、0.0625、0.075、0.0875、0.1 mg/mL的葡萄糖标准液,加入200 μL苯酚溶液(60 mg/mL)和1 mL浓硫酸,摇匀后反应20 min,使用酶标仪于490 nm波长下测定吸光度,绘制标准曲线并求出回归方程。取400 μL HRP、KRP、PRP 3种玫瑰粗多糖样品溶液(0.1 mg/mL),同法测定,经标准曲线计算多糖浓度。
多糖含量(mg/g)=多糖浓度(mg/mL)×溶液体积(mL)粗多糖质量(g) 1.2.3 多糖的结构表征
1.2.3.1 单糖组成测定
多糖的水解:a. 常规多糖水解法。各取5 mg多糖样品于安瓿中,用1 mL 2 mol/L三氟乙酸在121 ℃水解2 h。b. 低强度多糖水解法。各取5 mg多糖样品于安瓿中,用1 mL 2.5 mol/L三氟乙酸在60 ℃水解1 h。两种水解方法得到的溶液在N2下干燥,加入甲醇,然后再次干燥,重复干燥3次,然后溶解在超纯水中待测。
采用配置有Dionex™CarboPac™PA20色谱柱(150 mm×3.0 mm,10 μm)、ICS5000电导率检测器的ICS5000离子色谱仪进行测定。流动相由溶液A(0.1 mol/L NaOH溶液)和溶液B(0.1 mol/L NaOH溶液和0.2 mol/L NaAc溶液)组成。线性梯度洗脱:0~30 min,95%~80% A;30.1~45 min,60% A;45.1~60 min,95% A。进样量为5 μL;流速0.5 mL/min;柱温30 ℃[15]。
1.2.3.2 分子量测定
采用高效液相色谱联用多角度激光散射(High performance size exclusion chromatography-Multi angle laser light scattering,HPSEC-MALLS)法测定HRP、KRP和PRP的分子量[16]。设备条件:1260 Infinity Ⅱ MDS高效液相色谱仪、1260 Infinity II 等度泵、1260 Infinity II 示差检测器、1260 Infinity II 双角度激光散射检测器、1260 Infinity II 黏度检测器以及PL aquagel-OH Mixed-H色谱柱(8 μm,7.5×300 mm)。流动相:超纯水(含有0.02%叠氮化钠),pH6;柱温:40 ℃;流速:1.0 mL/min;进样量500 µL。以右旋糖酐作为标准品,用ATRA软件分析HRP、KRP、PRP的重均分子量(Weight-average molecular weight,Mw);数均分子量(Number average molecular weight,Mn);峰值分子量(Molecular weight of the highest peak,Mp)和Z均分子量(Z-average molecular weight,Mz)。
1.2.3.3 FT-IR分析
利用FT-IR和OMNIC软件获得3种玫瑰多糖的FT-IR光谱。干燥的HRP、KRP、PRP组分(1 mg)与干燥的KBr粉末(100 mg)充分混合并压成圆片状,在4000~500 cm−1范围内进行扫描[17]。
1.2.3.4 碘-碘化钾实验
各取1 mL 0.5 mg/mL HRP、KRP、PRP 3种样品溶液,加入1.2 mL碘-碘化钾试剂(含0.2 g/L I2 和2 g/L KI),混匀后,使用酶标仪测定混合溶液在250~600 nm范围内的吸光度[18]。以波长作为横坐标,吸光度作为纵坐标,绘制曲线。
1.2.3.5 刚果红实验
将HRP、KRP或PRP样品溶液(1 mL,0.5 mg/mL)与1 mL 80 μmol/L的刚果红溶液混合均匀。分别加入1.0 mol/L的NaOH,使混合液中NaOH的浓度由0 mol/L逐渐升至3 mol/L。使用酶标仪测定样品485~520 nm范围内的最大吸收波长[19]。以NaOH浓度作为横坐标,最大吸收波长作为纵坐标,绘制曲线。
1.2.3.6 AFM分析
将5 μL HRP、KRP和PRP溶液(50 μL/mL)分别滴加到干净的云母片上,并在环境气压下干燥。用AFM在非接触模式下扫描观察,扫描模式是scanasyst,扫描频为1 Hz[20]。
1.2.4 抗氧化实验
1.2.4.1 总抗氧化能力
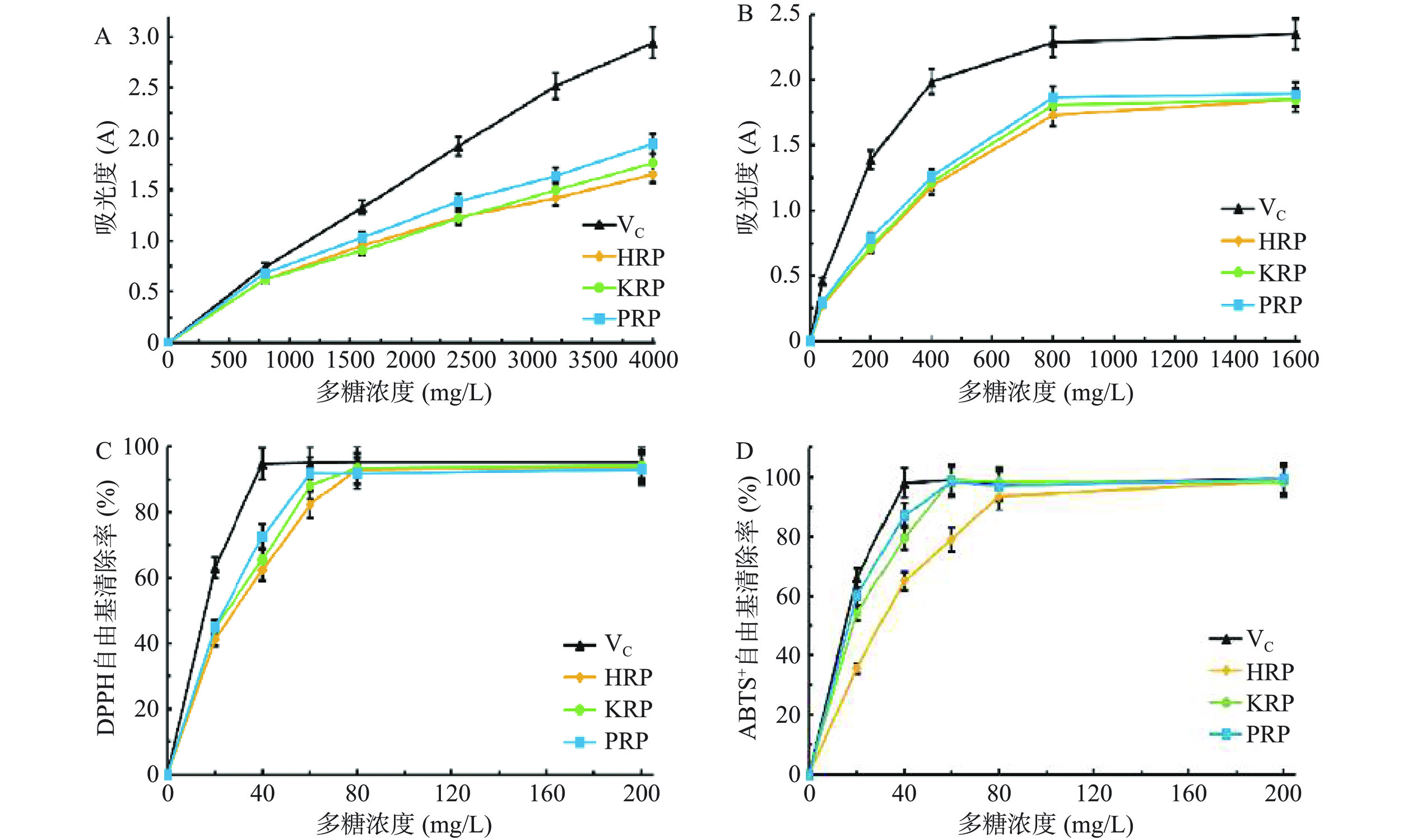
配制3种多糖样品溶液,分别稀释为不同浓度梯度(0~4000 mg/L),同时配制等浓度的维生素C(Vitamin C,VC)溶液。取0.2 mL样品或维生素C溶液于试管中,加入2 mL P溶液(含有0.6 mol/L硫酸,28 mmol/L磷酸三钠和4 mmol/L钼酸铵),95 ℃水浴90 min,冷却后用酶标仪于695 nm下测定吸光度[21]。
1.2.4.2 还原力测定
采用普鲁士蓝法测定HRP、KRP、PRP的还原力[22]。配制3种多糖样品溶液,分别稀释为不同浓度梯度(0~1600 mg/L),同时配制等浓度的VC溶液。依次加入1 mL样品、2.5 mL磷酸盐缓冲液(0.2 mol/L,pH6.6)和1 mL铁氰化钾溶液(10 g/L),混合均匀,置于50 ℃水浴 20 min,加入2 mL三氯乙酸(100 g/L)和1.2 mL三氯化铁溶液(1 g/L)。混匀后使用酶标仪在700 nm处测定吸光度,用VC作阳性对照。
1.2.4.3 DPPH自由基清除能力
配制3种多糖样品溶液,分别稀释为不同浓度梯度(0~200 mg/L)。分别吸取1 mL多糖溶液加入到1 mL浓度为200 μmol/L的DPPH-乙醇溶液中。混合均匀后避光反应30 min。在517 nm处测定吸光度[23]。样品多糖溶液加DPPH-乙醇溶液吸光度为A,以无水乙醇代替DPPH的吸光度为A0,以蒸馏水代替样品多糖溶液的吸光度为A1。
DPPH自由基清除率(%)=(1−A−A0A1)×100 1.2.4.4 ABTS+自由基清除能力
ABTS储液的制备:将ABTS溶液(7 mmol/L)和过硫酸钾溶液(4.9 mmol/L)等体积混合,避光静置20 h。ABTS工作液的制备:用磷酸盐缓冲液(0.1 mol/L,pH7.4)稀释ABTS储液,使其在734 nm处吸光度为0.70±0.02。配制3种多糖样品溶液,稀释为不同浓度梯度(0~200 mg/L)。取ABTS工作液3 mL,加入多糖溶液1 mL,室温避光6 min,于734 nm下测吸光度[24]。样品多糖溶液加ABTS工作液的吸光度为A,磷酸盐缓冲液代替ABTS工作液为空白组A0,蒸馏水代替样品为对照组A1。
ABTS+自由基清除率(%)=(1−A−A0A1)×100 1.2.5 益生元实验
将L. plantarum和L. casei分别接种于MRS平板中,置于37 ℃恒温培养箱中培养48 h后,分别接种到MRS肉汤培养基中,摇床培养(37 ℃,150 r/min,12 h),获得2种菌种的种子液。设置阴性对照组:去除碳源的MRS培养基;阳性对照组:菊粉加去除碳源的MRS培养基;HRP、KRP或PRP实验组:多糖样品(HRP、KRP或PRP)加去除碳源的MRS培养基。其中,多糖样品和菊粉添加量皆为50 g/L,接种量为1%(v/v)。通过检测发酵过程中的pH、OD600值和乳酸含量来衡量HRP、KRP和PRP的益生元作用[25]。
1.2.6 酪氨酸酶抑制实验
构建酪氨酸酶催化反应体系,在该体系中,L-酪氨酸被酪氨酸酶催化产生黑色素,在475 nm处有最大吸收峰,加入酪氨酸酶抑制剂,可以减少黑色素生成。通过HRP、KRP、PRP 3种玫瑰多糖对酪氨酸酶的抑制效果,评价其美白功效。将HRP、KRP、PRP用磷酸盐缓冲液(25 mmol/L,pH6.8)稀释成不同浓度的样品溶液。取120 μL样品溶液,分别加入360 μL酪氨酸溶液(0.5 mg/L)、120 μL磷酸盐缓冲液(25 mmol/L,pH6.8)和120 μL酪氨酸酶溶液(50 U/mL),以熊果苷作为阳性对照,根据公式计算酪氨酸酶抑制率(IR)[26]。
IR(%)=(1−C−DA−B)×100 式中:A为等量磷酸盐缓冲液代替样品溶液的吸光度;B为等量磷酸盐缓冲液代替样品溶液和酪氨酸酶溶液的吸光度;C为样品溶液吸光度;D为等量磷酸盐缓冲液代替酪氨酸酶溶液的吸光度。
1.3 数据处理
实验数据表示为至少3个独立实验的平均值±标准差(SD)。通过单因素方差分析(One Way ANOVA)检查测试组之间的显著差异,P<0.05被认为具有统计学意义。统计分析使用Excel软件完成。
2. 结果与分析
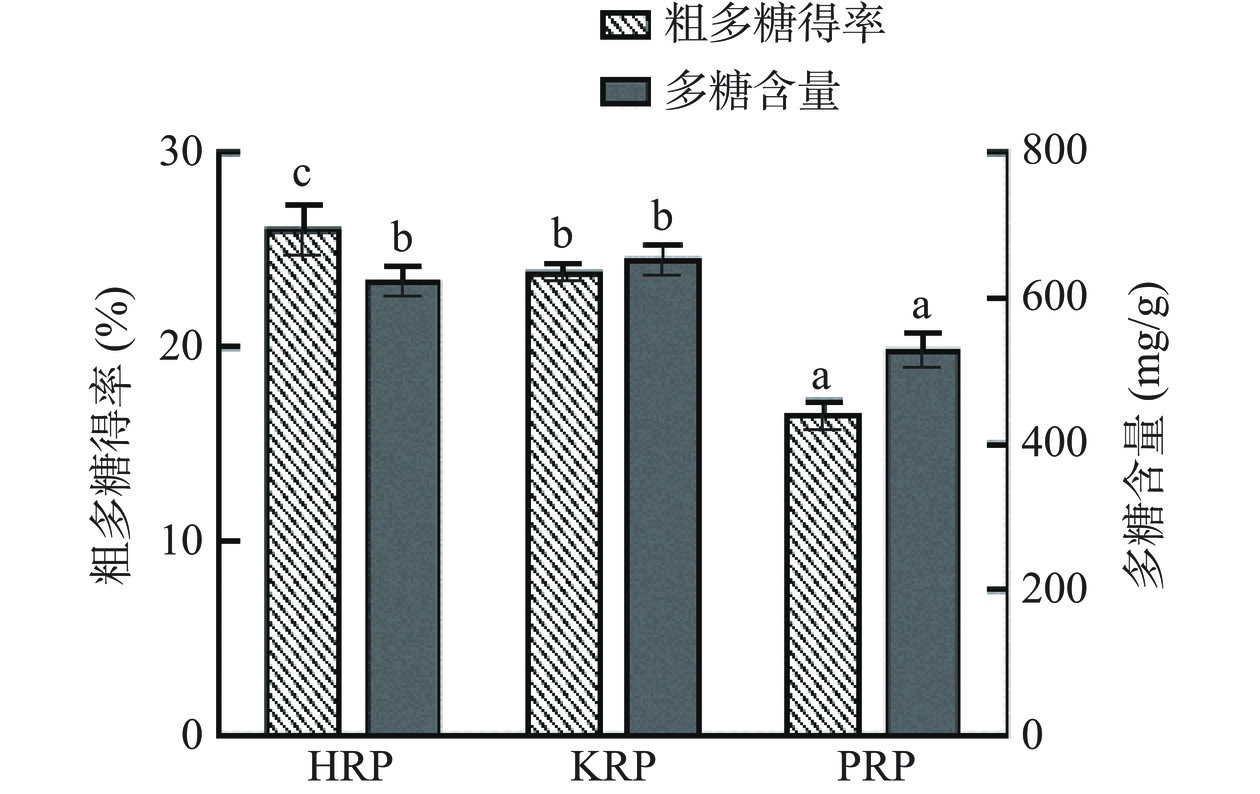
2.1 HRP、KRP和PRP得率及多糖含量的测定结果
HRP、KRP和PRP得率及多糖含量的测定结果见图2。
由图2可知,HRP、KRP和PRP的得率分别为26.18%、23.95%和16.60%(HRP>KRP>PRP)。HRP的得率显著高于KRP和PRP的得率(P<0.05),KRP和PRP的得率分别为HRP得率的91.49%和63.40%。HRP、KRP和PRP中的多糖含量分别为627.040、657.033和532.648 mg/g(KRP≈HRP>PRP)。HRP和KRP的多糖含量没有显著性差异(P>0.05),并且显著高于PRP的多糖含量(P<0.05)。
2.2 HRP、KRP和PRP的单糖组成
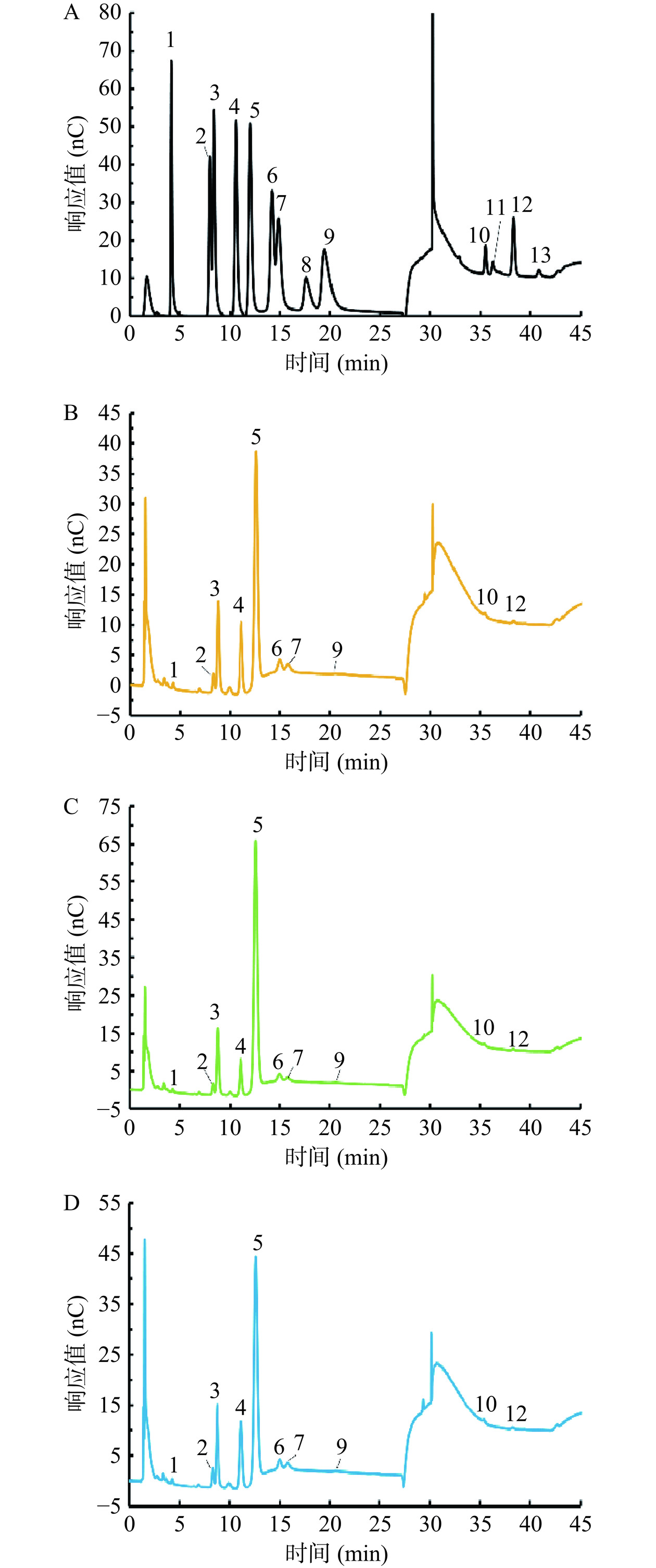
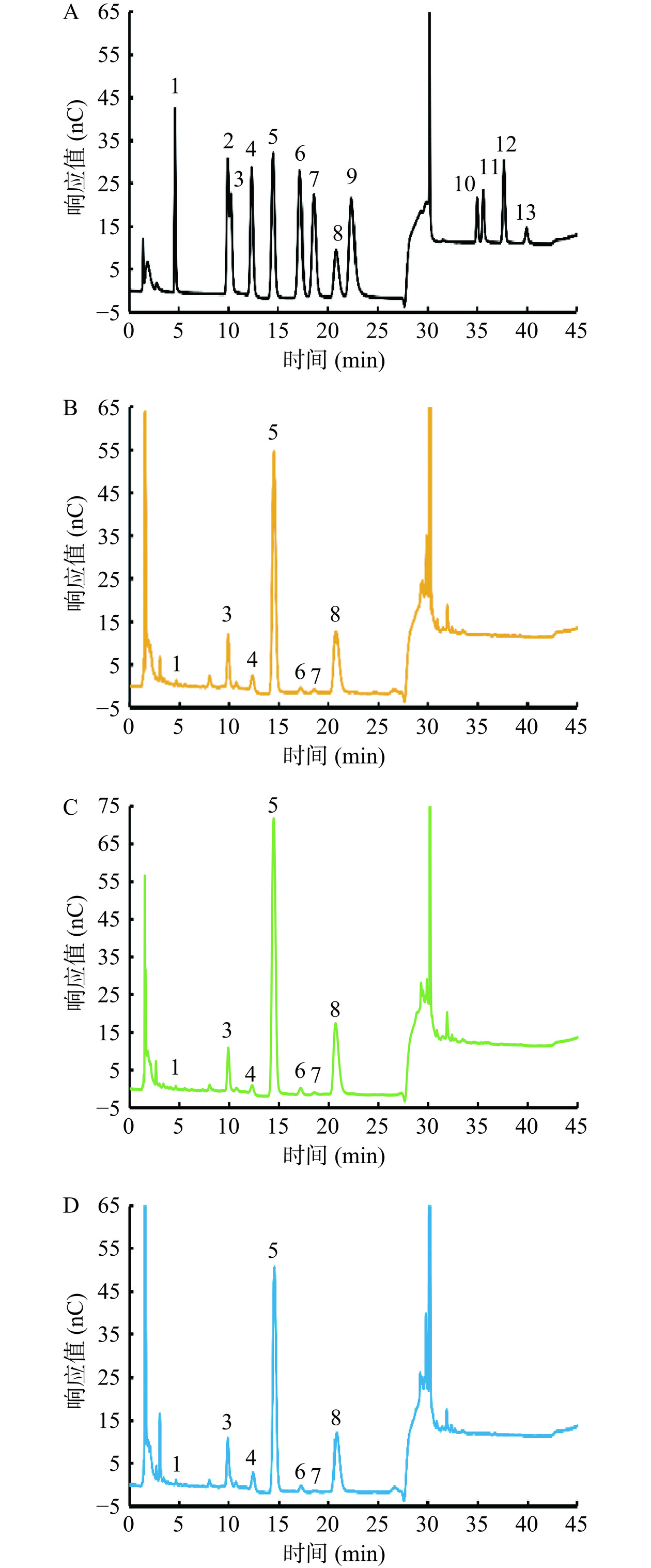
HRP、KRP和PRP的IC图谱及其单糖组成见图3、图4和表1。
表 1 HRP、KRP和PRP的单糖组成(mol%)Table 1. Monosaccharide composition of HRP, KRP and PRP (mol%)Fuc Rha Ara Gal Glc Xyl Man Fru Rib Gal-UA Gul-UA Glc-UA Man-UA 常规多糖水解法 HRP 0.77 4.9 17.65 12.78 47.25 5.4 4.81 / 0.54 3.9 / 2.03 / KRP 0.49 3.37 15.33 7.67 62.59 3.49 2.45 / 0.54 2.85 / 1.2 / PRP 0.73 5.35 17.07 12.57 50.27 4.37 4.1 / 0.63 3.45 / 1.46 / 低强度多糖水解法 HRP 0.61 / 10.7 2.85 39.87 0.99 0.82 44.15 / / / / / KRP 0.36 / 7.72 1.36 42.23 1.11 0.47 46.75 / / / / / PRP 0.59 / 11.23 3.38 37.94 1.26 0.48 45.13 / / / / / 采用了“常规多糖水解法”和“低强度多糖水解法”2种多糖水解方法同时对玫瑰多糖进行单糖组成分析。其原因为Fru具有不稳定性,“常规多糖水解法”的水解条件会破坏Fru,导致多糖中的Fru残基测定结果偏低或不能检出。而“低强度多糖水解法”将导致多糖水解不充分,该实验条件仅能定性分析3种玫瑰多糖是否含有Fru残基(作为“常规多糖水解法”实验结果的补充)。由图3及表1可知,在常规多糖水解条件下,HRP、KRP和PRP玫瑰多糖的单糖组成具有一定的相似性,其单糖残基均由10种单糖残基组成(Glc、Ara、Gal、Xyl、Rha、Man、Rib、Gal-UA、Glc-UA和Fuc)。由图4和表1可知,降低3种玫瑰多糖的水解强度后,3种玫瑰多糖的水解液中均可以检出Fru,并且3种玫瑰多糖中的Fru残基比例较高。因此,HRP、KRP和PRP玫瑰多糖为主要包含Glc、Ara、Gal和Fru残基的,由11种单糖残基构成的杂多糖。其中Glc、Ara、Gal、Fru是3种玫瑰多糖含量最高的单糖残基。HRP和PRP玫瑰多糖的单糖组成摩尔比例关系较为接近。相较于HRP和PRP,KRP含有的Glc残基比例略高,Gal和Ara残基的比例略低。
关于玫瑰多糖结构特征的相关研究较少。张曰辉等[27]利用柱前衍生HPLC法测定了平阴玫瑰多糖的单糖组成,结果表明平阴玫瑰多糖由Man、Rha、Glc-UA、Glc、Gal、Ara 6种单糖残基组成,其摩尔比为0.93:0.98:1.15:0.97:0.97:0.97。Tang等[28]报道玫瑰多糖由Ara、Xyl、Glc、Gal、Gal-UA和Glu-UA 6种单糖残基组成,其摩尔比为4.6:1.4:5.22:4.81:1:1.86。之前研究由于测定方法的局限性及未能考虑到Fru的不稳定性,未能检测出玫瑰多糖中较高含量的Fru残基。本研究发现玫瑰多糖中含有较高含量的Fru残基,并且将组成玫瑰多糖的单糖残基种类由6种提高到了11种。
2.3 HRP、KRP和PRP的分子量测定
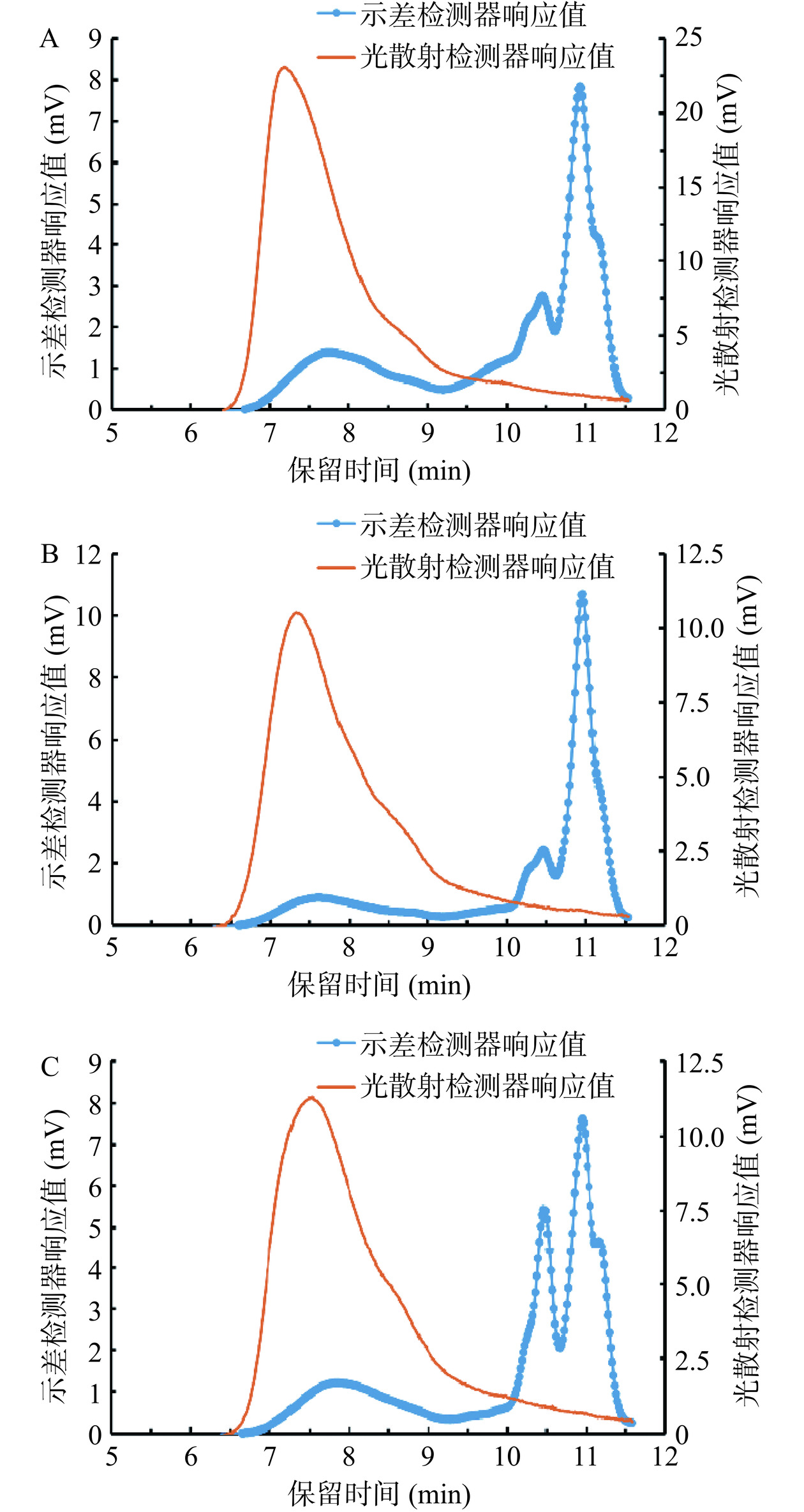
HRP、KRP和PRP的HPSEC-MALLS图谱及其分子量见图5和表2。
表 2 HRP、KRP和PRP的分子量及分散系数Table 2. Molecular weight and dispersion coefficient of HRP, KRP and PRPMw(Da) Mn(Da) Mp(Da) Mz(Da) Mw/Mn HRP 5.841×105 3.391×105 6.418×105 8.784×105 1.72 KRP 5.634×105 4.169×105 6.530×105 7.146×105 1.35 PRP 4.376×105 3.141×105 4.800×105 5.774×105 1.39 由图5和表2可知,HRP、KRP和PRP玫瑰多糖的分子量差异较小,3种玫瑰多糖的Mw在4.376×105~5.841×105 Da之间。3种玫瑰多糖的分散系数(Mw/Mn)在1.35~1.72之间,说明3种玫瑰多糖均具有一定的均一性。比较可知,3种玫瑰多糖的Mw从大到小依次为HRP>KRP>PRP。HRP的Mw较高,并且分散性较大;PRP的Mw较小,并且分散性较小。
2.4 HRP、KRP和PRP的FT-IR分析
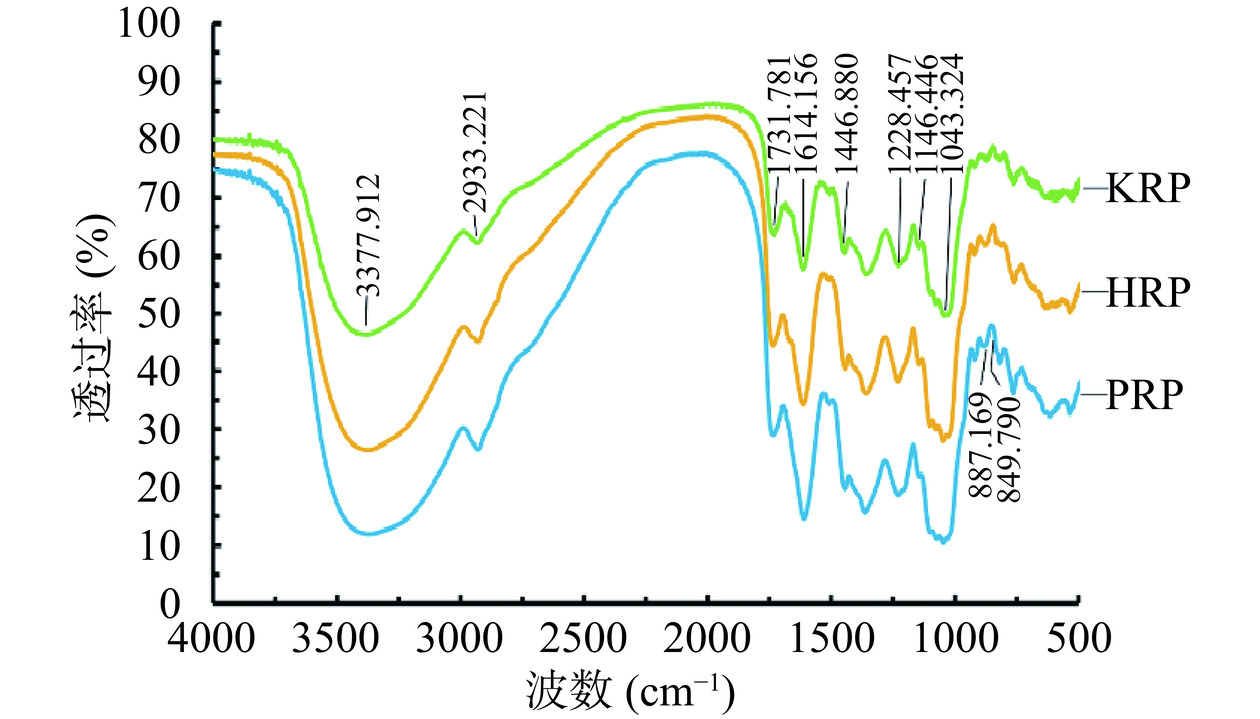
HRP、KRP和PRP的FT-IR图谱见图6。
由图6可知,HRP、KRP和PRP的FT-IR光谱图具有极高的相似性。在3200~3600 cm−1处的宽而强的吸收峰是羟基的伸缩振动。2935 cm−1区域的吸收峰是由C-H键拉伸振动引起的[29]。在1600~1650 cm−1处较强的吸收峰,符合C=O引起的吸收峰特征[30]。在1740 cm−1附近的吸收峰表明多糖中存在糖醛酸。在1000~1200 cm−1处的吸收峰由C-OH的伸缩振动和C-O-C糖苷键振动叠加产生。在840 cm−1和890 cm−1左右的吸收峰表明多糖具有α和β构型[31]。因此,HRP、KRP、PRP具有多糖的典型特征吸收峰,均为含有α和β构型的吡喃糖[32]。并且,3种玫瑰多糖均含有糖醛酸,该结果与单糖组成的测定结果一致。
2.5 HRP、KRP和PRP的碘-碘化钾实验结果
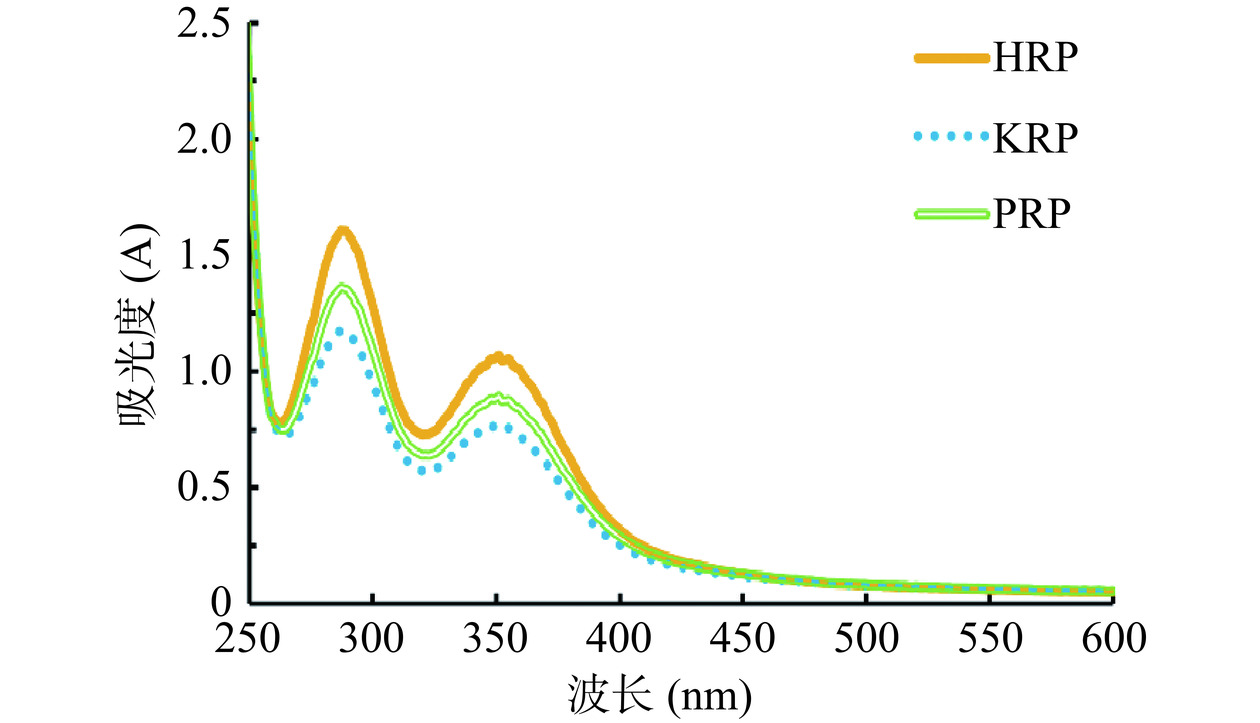
HRP、KRP和PRP的碘-碘化钾实验结果见图7。
碘-碘化钾实验用于分析多糖的侧链情况,若在565 nm处有最大吸收峰则说明多糖含有较少的分支和较短的侧链[33]。如图7所示,3种玫瑰多糖与碘-碘化钾的反应物最大吸收峰均在288 nm和350 nm附近,在565 nm处没有最大吸收峰,说明HRP、KRP和PRP可能存在较长的侧链和较多的分支。
2.6 HRP、KRP和PRP的刚果红实验结果
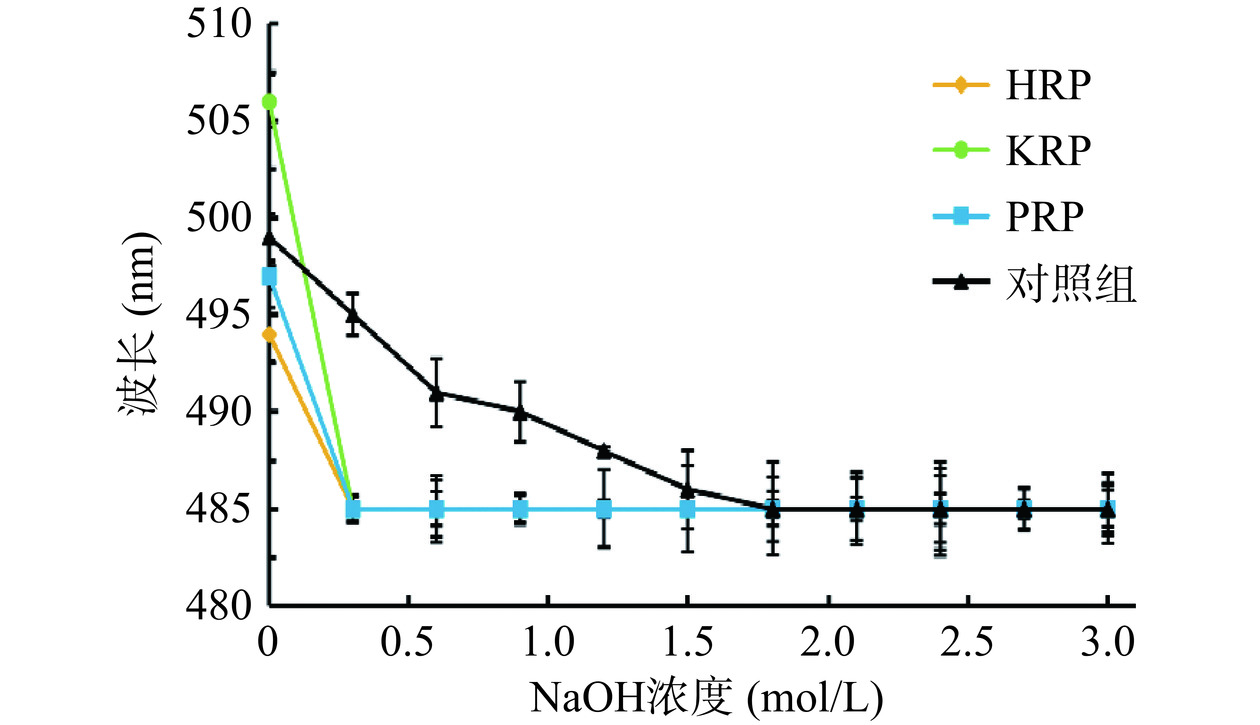
HRP、KRP和PRP的刚果红实验结果见图8。
刚果红溶液是一种弱碱性的溶液,具有三螺旋构象的多糖在稀NaOH溶液中与刚果红溶液形成络合物,最大波长会出现红移现象(多糖溶液的最大吸收波长随NaOH溶液浓度的增加而增加)[34]。随着NaOH溶液浓度逐渐增高,多糖螺旋结构发生解体,变成无规则的线团形式,最大吸收波长又会发生蓝移现象[35]。HRP、KRP和PRP与刚果红溶液混合物在NaOH溶液中最大波长吸收的变化如图8所示,HRP、KRP和PRP未出现红移现象,因此3种玫瑰多糖均不含有三螺旋结构[36]。
2.7 AFM实验结果
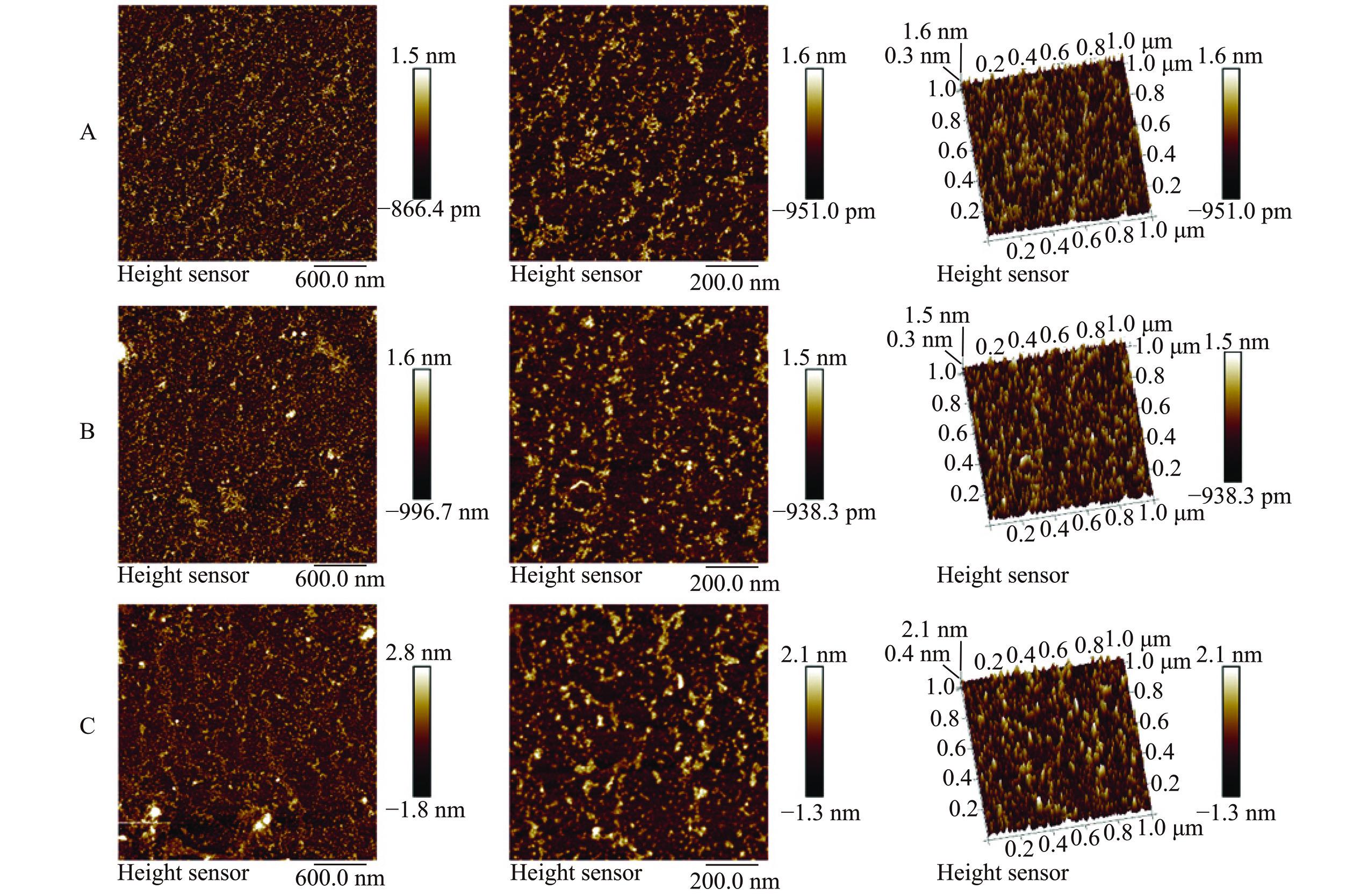
HRP、KRP和PRP的AFM实验结果见图9。
HRP、KRP和PRP的AFM平面及立体图如图9所示,HRP、KRP和PRP的AFM原子力显微图差异性不大。由平面图可知,HRP、KRP和PRP均呈现有一定线状聚集形态的突起状结构;三维立体图像中3种玫瑰多糖呈较圆滑、高低不等的密集突起状结构。聚集突起结构可能与多糖的分子内及分子间作用力导致的多糖分子聚集有关。
2.8 抗氧化实验结果
HRP、KRP和PRP的总抗氧化能力、还原力、DPPH自由基清除能力和ABTS+自由基清除能力见图10及表3。
表 3 HRP、KRP和PRP的抗氧化能力Table 3. Antioxidant capacities of HRP, KRP and PRP指标 HRP KRP PRP VC 总抗氧化能力 1.65±0.09a 1.76±0.08a 1.95±0.08a 2.94±0.05b 还原力 1.84±0.04a 1.84±0.05a 1.89±0.06a 2.35±0.07b DPPH自由基清除能力(mg/L) 28.28±1.40c 25.09±1.12b 23.69±0.49b 15.86±0.65a ABTS+自由基清除能力(mg/L) 30.78±1.29d 18.45±0.44c 16.63±0.51b 15.11±0.36a 注:总抗氧化能力为多糖在4000 mg/L处的吸光度值;还原力为多糖在1600 mg/L处的吸光度值;DPPH和ABTS+自由基清除能力为多糖自由基清除率的EC50值。同行中不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。 由图10和表3可知,HRP、KRP和PRP的体外抗氧化能力随着多糖样品浓度的增加而逐渐增加,表现出明显的量效关系。因此,3种玫瑰多糖均具有抗氧化能力。3种玫瑰多糖的总抗氧化能力和还原力无显著差异(P>0.05)。而3种玫瑰多糖的ABTS+自由基清除能力(PRP>KRP>HRP)及DPPH自由基清除能力(PRP≈KRP>HRP)具有显著差异(P<0.05)。据报道,抗氧化能力较高的多糖通常具有较低的分子量[37],PRP较强的ABTS+自由基及DPPH自由基清除能力可能与其较低的Mw有关。黄琼等[38]报道玫瑰茄多糖DPPH自由基清除能力的EC50值为119.50 mg/L。Nuerxiati等[39]报道兰花多糖ABTS+自由基清除能力的EC50值为495.90 mg/L。金友权等[40]报道粉花重瓣木槿花多糖在1600 mg/L浓度下的还原力约为0.61,ABTS+自由基清除能力的EC50值为908 mg/L。任晓莉等[41]报道槐花多糖DPPH自由基清除能力EC50值约为110 mg/L,在1600 mg/L浓度下的还原力约为0.59。本文所研究的3种玫瑰多糖的抗氧化能力皆显著高于上述报道的花朵类多糖,这为玫瑰多糖研发为口服美容功能食品提供了理论支撑。
2.9 益生元实验
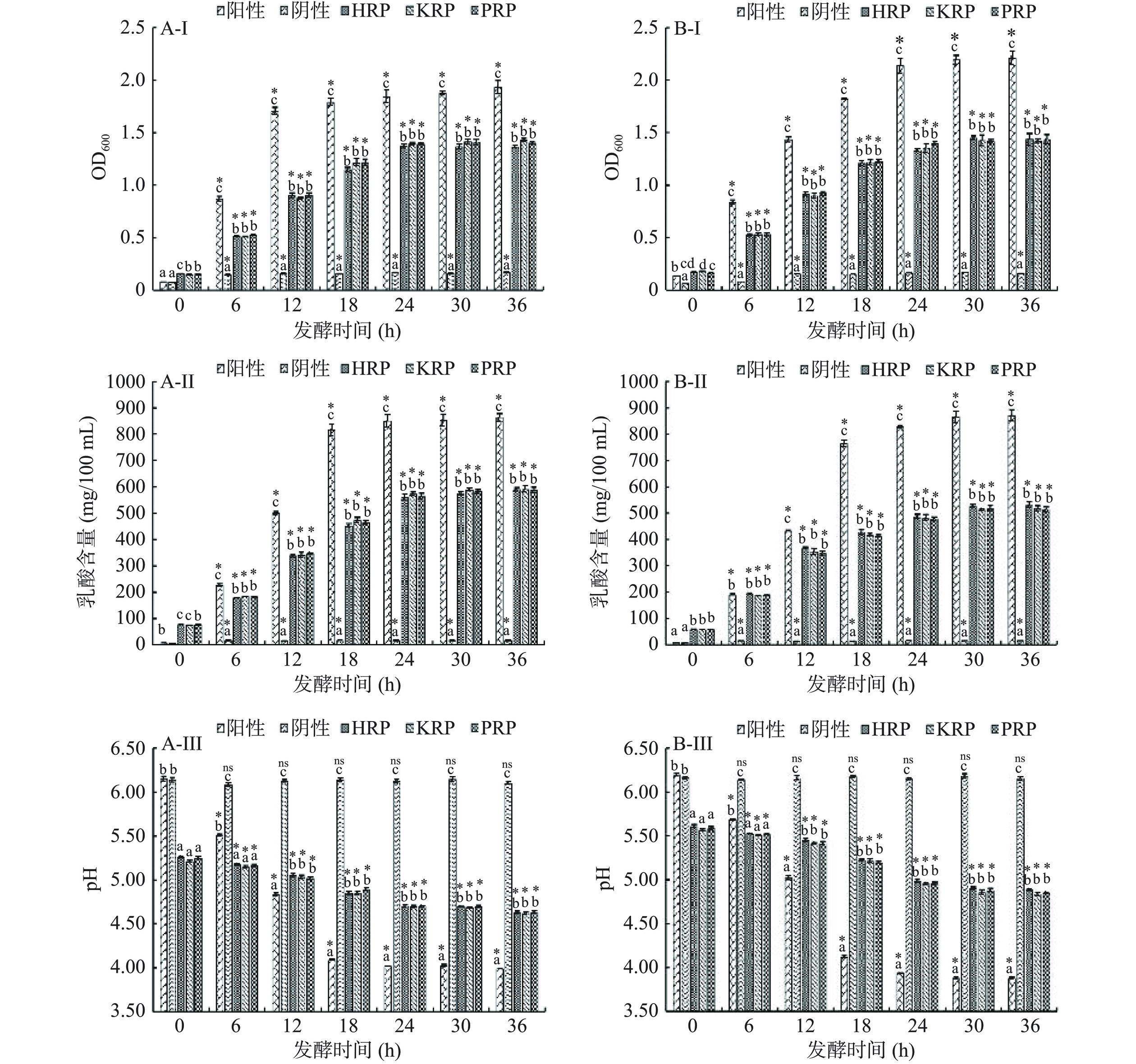
HRP、KRP和PRP对L. plantarum和L. casei的生长促进作用见图11。
![]() 图 11 HRP、KRP和PRP对L. plantarum(A)和L. casei(B)的生长促进作用注:(I)L. plantarum或L. casei发酵过程中OD600值的变化;(II)L. plantarum或L. casei发酵过程中乳酸含量的变化;(III)L. plantarum或L. casei发酵过程中pH的变化。阴性:去除碳源的MRS培养基;阳性:菊粉+去除碳源的MRS培养基;HRP、KRP或PRP实验组:HRP、KRP或PRP+去除碳源的MRS培养基。“ns”与对应组发酵前(0 h)相比不具有显著性差异(P>0.05);“*”与对应组发酵前(0 h)相比具有极显著性差异(P<0.01);同一发酵时间不同字母代表具有显著性差异(P<0.05),相同字母代表无显著性差异(P>0.05)。Figure 11. Growth promotion effects of HRP, KRP and PRP on L. plantarum (A) and L. casei (B)
图 11 HRP、KRP和PRP对L. plantarum(A)和L. casei(B)的生长促进作用注:(I)L. plantarum或L. casei发酵过程中OD600值的变化;(II)L. plantarum或L. casei发酵过程中乳酸含量的变化;(III)L. plantarum或L. casei发酵过程中pH的变化。阴性:去除碳源的MRS培养基;阳性:菊粉+去除碳源的MRS培养基;HRP、KRP或PRP实验组:HRP、KRP或PRP+去除碳源的MRS培养基。“ns”与对应组发酵前(0 h)相比不具有显著性差异(P>0.05);“*”与对应组发酵前(0 h)相比具有极显著性差异(P<0.01);同一发酵时间不同字母代表具有显著性差异(P<0.05),相同字母代表无显著性差异(P>0.05)。Figure 11. Growth promotion effects of HRP, KRP and PRP on L. plantarum (A) and L. casei (B)由图11可知,随着培养时间的增加,HRP、KRP或PRP实验组(HRP、KRP或PRP+去除碳源的MRS培养基)的OD600值和乳酸含量逐渐增加,pH逐渐降低。并且,HRP、KRP或PRP实验组中,OD600值、乳酸含量的增加程度,pH的降低程度均显著高于阴性对照组(缺碳培养基)(P<0.05)。因此,3种玫瑰多糖(HRP、KRP和PRP)对L. plantarum和L. casei的生长均具有促进作用,即3种玫瑰多糖(HRP、KRP和PRP)均具有益生元作用。进一步分析可知,L. plantarum和L. casei培养过程中,HRP、KRP或PRP实验组之间OD600值、乳酸含量、pH的变化基本一致(P>0.05)。因此,HRP、KRP和PRP的益生元作用能力无显著差异。
由于低聚果糖不易被人体消化酶水解并且可以选择性地促进肠道益生菌生长,低聚果糖是被认可的益生元[42]。由之前测定结果可知(2.2),3种玫瑰多糖均含有较高含量的Fru残基。因此,玫瑰多糖的益生元作用可能与其含有的Fru残基有关。玫瑰多糖等天然植物多糖通常具有良好的抗氧化、调节免疫力等生物学功效。因此,玫瑰多糖是具有多种生物学功效的更理想的益生元。
2.10 酪氨酸酶抑制实验
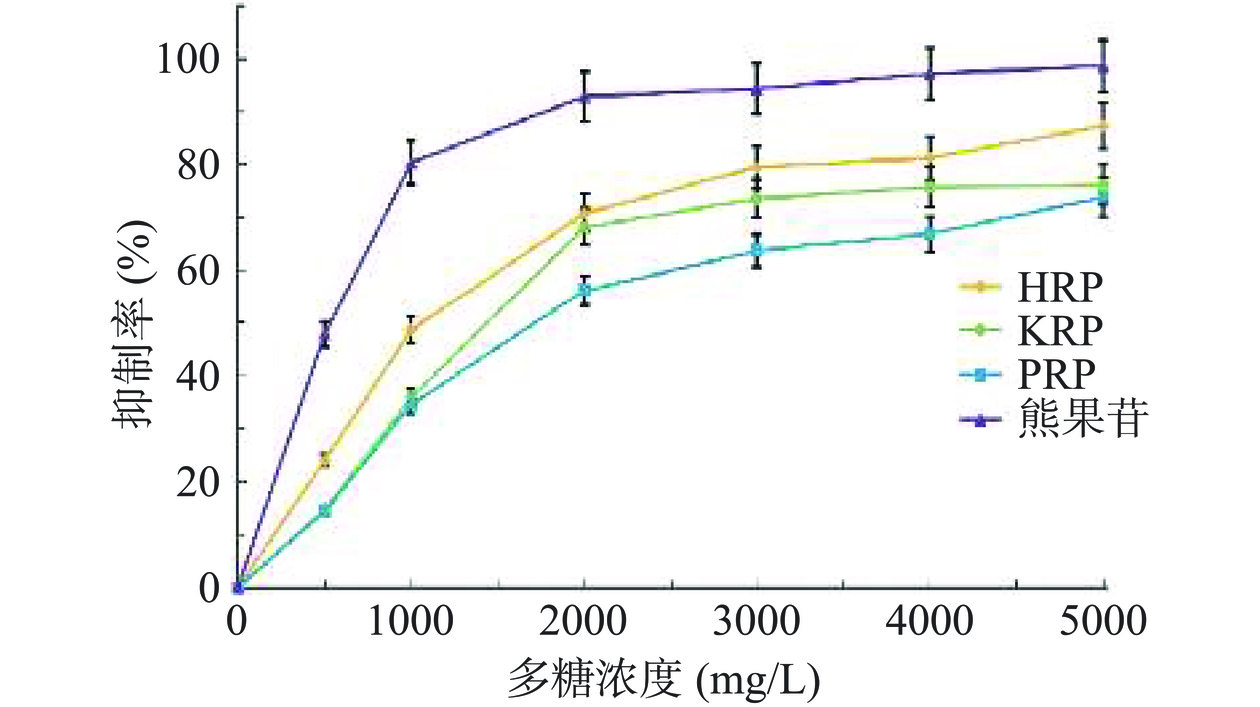
HRP、KRP和PRP对酪氨酸酶的抑制能力见图12。
酪氨酸酶为黑色素合成关键酶,抑制酪氨酸酶活性,在一定程度上可以减少黑色素的生成[43]。由图12可知,HRP、KRP和PRP在一定多糖浓度范围内,随着多糖浓度上升,对酪氨酸酶抑制率逐渐增强,表现出明显的量效关系。HRP、KRP和PRP对酪氨酸酶的抑制能力的EC50值分别为1062.5、1438.6和1716.67 mg/L。其对酪氨酸酶的抑制能力的强弱顺序为HRP>KRP>PRP。3种玫瑰多糖对酪氨酸酶的抑制能力具有显著差异性(P<0.05),因此,HRP、KRP和PRP均具有酪氨酸酶抑制能力,其中HPR的酪氨酸酶抑制能力最强。
Liang等[15]报道糖醛酸含量较高的多糖可能具有较好酪氨酸酶抑制能力。本研究证明,玫瑰多糖为酸性多糖,含有Gal-UA和Glc-UA,并且HRP的糖醛酸含量最高。因此,3种玫瑰多糖对酪氨酸酶的抑制能力可能与其含有的糖醛酸有关。
3. 结论
利用“水提醇沉法”分别从和田玫瑰、苦水玫瑰和平阴玫瑰干花蕾中获得3种玫瑰多糖(HRP、KRP和PRP)。结构表征结果表明,3种玫瑰多糖结构具有相似性。3种玫瑰多糖的单糖组成均包括Glc、Ara、Gal和Fru等11种单糖残基;分子量较大(Mw:4.376×105~5.841×105 Da),且较为均一(分散系数:1.35~1.72);含有α和β构型的吡喃糖;不含三螺旋结构;含有较多的长侧链。但是,3种玫瑰多糖在结构上仍有差异。HRP和PRP的单糖残基摩尔比例较为接近。相较于HRP和PRP,KRP的Glc残基比例略高,Gal和Ara残基比例略低。HRP和KRP的Mw较为接近,相较于HRP和KRP,PRP的Mw略低。体外活性评价实验表明,3种玫瑰多糖均具有良好的抗氧化能力、益生元作用及酪氨酸酶抑制能力。PRP具有较强的ABTS+及DPPH自由清除能力,HRP具有较强的酪氨酸酶抑制能力。因此,品种和产地对玫瑰多糖的结构略有影响,3种玫瑰多糖的生物学活性因此略有不同。玫瑰多糖可以研发为具有抗氧化、益生元及美白作用的美容类功能食品。
-
图 11 HRP、KRP和PRP对L. plantarum(A)和L. casei(B)的生长促进作用
注:(I)L. plantarum或L. casei发酵过程中OD600值的变化;(II)L. plantarum或L. casei发酵过程中乳酸含量的变化;(III)L. plantarum或L. casei发酵过程中pH的变化。阴性:去除碳源的MRS培养基;阳性:菊粉+去除碳源的MRS培养基;HRP、KRP或PRP实验组:HRP、KRP或PRP+去除碳源的MRS培养基。“ns”与对应组发酵前(0 h)相比不具有显著性差异(P>0.05);“*”与对应组发酵前(0 h)相比具有极显著性差异(P<0.01);同一发酵时间不同字母代表具有显著性差异(P<0.05),相同字母代表无显著性差异(P>0.05)。
Figure 11. Growth promotion effects of HRP, KRP and PRP on L. plantarum (A) and L. casei (B)
表 1 HRP、KRP和PRP的单糖组成(mol%)
Table 1 Monosaccharide composition of HRP, KRP and PRP (mol%)
Fuc Rha Ara Gal Glc Xyl Man Fru Rib Gal-UA Gul-UA Glc-UA Man-UA 常规多糖水解法 HRP 0.77 4.9 17.65 12.78 47.25 5.4 4.81 / 0.54 3.9 / 2.03 / KRP 0.49 3.37 15.33 7.67 62.59 3.49 2.45 / 0.54 2.85 / 1.2 / PRP 0.73 5.35 17.07 12.57 50.27 4.37 4.1 / 0.63 3.45 / 1.46 / 低强度多糖水解法 HRP 0.61 / 10.7 2.85 39.87 0.99 0.82 44.15 / / / / / KRP 0.36 / 7.72 1.36 42.23 1.11 0.47 46.75 / / / / / PRP 0.59 / 11.23 3.38 37.94 1.26 0.48 45.13 / / / / / 表 2 HRP、KRP和PRP的分子量及分散系数
Table 2 Molecular weight and dispersion coefficient of HRP, KRP and PRP
Mw(Da) Mn(Da) Mp(Da) Mz(Da) Mw/Mn HRP 5.841×105 3.391×105 6.418×105 8.784×105 1.72 KRP 5.634×105 4.169×105 6.530×105 7.146×105 1.35 PRP 4.376×105 3.141×105 4.800×105 5.774×105 1.39 表 3 HRP、KRP和PRP的抗氧化能力
Table 3 Antioxidant capacities of HRP, KRP and PRP
指标 HRP KRP PRP VC 总抗氧化能力 1.65±0.09a 1.76±0.08a 1.95±0.08a 2.94±0.05b 还原力 1.84±0.04a 1.84±0.05a 1.89±0.06a 2.35±0.07b DPPH自由基清除能力(mg/L) 28.28±1.40c 25.09±1.12b 23.69±0.49b 15.86±0.65a ABTS+自由基清除能力(mg/L) 30.78±1.29d 18.45±0.44c 16.63±0.51b 15.11±0.36a 注:总抗氧化能力为多糖在4000 mg/L处的吸光度值;还原力为多糖在1600 mg/L处的吸光度值;DPPH和ABTS+自由基清除能力为多糖自由基清除率的EC50值。同行中不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。 -
[1] 王丽君, 曹炎生, 苗保河, 等. 两种玫瑰健康食品的开发及其检测与分析[J]. 现代食品,2022,28(19):42−45. [WANG L J, CAO Y S, MIAO B H, et al. Development and detection of two kinds of rose health food[J]. Modern Food,2022,28(19):42−45.] WANG L J, CAO Y S, MIAO B H, et al. Development and detection of two kinds of rose health food[J]. Modern Food, 2022, 28(19): 42−45.
[2] 朱峰, 赵诗强. “一带一路”视野下平阴玫瑰产业发展思考[J]. 中共济南市委党校学报,2019(1):119−123. [ZHU F, ZHAO S Q. Thinking on the development of Pingyin rose industry under the vision of "One Belt and One Road"[J]. Journal of the Party School of CPC Jinan Municipal Committee,2019(1):119−123.] doi: 10.3969/j.issn.1672-6359.2019.01.024 ZHU F, ZHAO S Q. Thinking on the development of Pingyin rose industry under the vision of "One Belt and One Road"[J]. Journal of the Party School of CPC Jinan Municipal Committee, 2019(1): 119−123. doi: 10.3969/j.issn.1672-6359.2019.01.024
[3] 曾荣妹, 韩琳, 葛平珍, 等. 玫瑰酒生产及玫瑰花品种选择研究进展[J]. 酿酒科技,2015(11):110−114. [ZENG R M, HAN L, GE P Z, et al. Research progress in rose wine production and rose species selection[J]. Liquor-Making Science & Technology,2015(11):110−114.] ZENG R M, HAN L, GE P Z, et al. Research progress in rose wine production and rose species selection[J]. Liquor-Making Science & Technology, 2015(11): 110−114.
[4] 颜子曦, 李永慧, 孟德豪, 等. 苦水玫瑰中49项营养及活性成分指标分析与评价[J]. 北京林业大学学报,2023,45(2):120−128. [YAN Z X, LI Y H, MENG D H, et al. Analysis and evaluation of 49 nutritional and active component indexes of Kushui rose[J]. Journal of Beijing Forestry University,2023,45(2):120−128.] doi: 10.12171/j.1000-1522.20220444 YAN Z X, LI Y H, MENG D H, et al. Analysis and evaluation of 49 nutritional and active component indexes of Kushui rose[J]. Journal of Beijing Forestry University, 2023, 45(2): 120−128. doi: 10.12171/j.1000-1522.20220444
[5] 宋垚, 王辉. 基于DNA序列的‘和田’玫瑰遗传背景分析研究[J]. 中国农学通报,2022,38(28):36−40. [SONG Y, WANG H. Genetic background analysis of 'Hetian' rose based on DNA sequence[J]. Chinese Agricultural Science Bulletin,2022,38(28):36−40.] doi: 10.11924/j.issn.1000-6850.casb2022-0439 SONG Y, WANG H. Genetic background analysis of 'Hetian' rose based on DNA sequence[J]. Chinese Agricultural Science Bulletin, 2022, 38(28): 36−40. doi: 10.11924/j.issn.1000-6850.casb2022-0439
[6] 田谊红, 冯雅玲, 王馨怡, 等. 玫瑰花化学成分质量评价及食用药用的研究进展[J]. 质量安全与检验检测,2022,32(2):43−46. [TIAN Y H, FENG Y L, WANG X Y, et al. Research progress on quality evaluation of chemical components and edible and medicinal use of Rosa rugosa[J]. Quality Safety Inspection and Testing,2022,32(2):43−46.] TIAN Y H, FENG Y L, WANG X Y, et al. Research progress on quality evaluation of chemical components and edible and medicinal use of Rosa rugosa[J]. Quality Safety Inspection and Testing, 2022, 32(2): 43−46.
[7] GRACIELA C Q, JOSÉ JUAN E C, GIERALDIN C L, et al. Hyaluronic acid-extraction methods, sources and applications[J]. Polymers,2023,15(16):3473. doi: 10.3390/polym15163473
[8] BEHOF W J, WHITMORE C A, HAYNES J R, et al. A novel antioxidant ergothioneine PET radioligand for in vivo imaging applications[J]. Scientific Reports,2021,11:18450. doi: 10.1038/s41598-021-97925-w
[9] WU Y, ZHUANG J, ZHANG Q, et al. Aging characteristics of colorectal cancer based on gut microbiota[J]. Cancer Medicine,2023,12(17):17822−17834. doi: 10.1002/cam4.6414
[10] 朱赤云, 肖平, 方悦悦, 等. 多糖体内过程与免疫调节机制研究方法和技术进展[J]. 药学学报,2024,59(2):322−335. [ZHU C Y, XIAO P, FANG Y Y, et al. Advances in methods and techniques for the study of polysaccharide in vivo processes and immunomodulatory mechanisms[J]. Acta Pharmaceutica Sinica,2024,59(2):322−335.] ZHU C Y, XIAO P, FANG Y Y, et al. Advances in methods and techniques for the study of polysaccharide in vivo processes and immunomodulatory mechanisms[J]. Acta Pharmaceutica Sinica, 2024, 59(2): 322−335.
[11] 陈容容, 王常荣, 江筠, 等. 玫瑰花和鲍鱼菇中抗氧化成分的降血糖作用研究[J]. 南开大学学报(自然科学版),2009,42(2):87−91. [CHEN R R, WANG C R, JIANG Y, et al. Study on the hypoglycemic effect of antioxidant components in rosehips and abalone mushrooms[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis,2009,42(2):87−91.] CHEN R R, WANG C R, JIANG Y, et al. Study on the hypoglycemic effect of antioxidant components in rosehips and abalone mushrooms[J]. Acta Scientiarum Naturalium Universitatis Nankaiensis, 2009, 42(2): 87−91.
[12] 白伟芳. 玫瑰花多糖的提取及其功效研究[D]. 济南:山东轻工业学院, 2010. [BAI W F. Extraction of polysaccharides from roses and their efficacy[D]. Jinan:Shandong Light Industry Institute, 2010.] BAI W F. Extraction of polysaccharides from roses and their efficacy[D]. Jinan: Shandong Light Industry Institute, 2010.
[13] 孙艺, 乔旭光, 郑振佳, 等. 大蒜多糖脂质体制备及结构表征[J]. 食品工业科技,2023,44(14):9−15. [SUN Y, QIAO X G, ZHENG Z J, et al. Preparation and structural characterization of garlic polysaccharide liposomes[J]. Science and Technology of Food Industry,2023,44(14):9−15.] SUN Y, QIAO X G, ZHENG Z J, et al. Preparation and structural characterization of garlic polysaccharide liposomes[J]. Science and Technology of Food Industry, 2023, 44(14): 9−15.
[14] 朱艳, 李先芝, 严玲, 等. 苯酚-硫酸法测定保健酒中多糖含量的分析研究[J]. 酿酒科技,2023(2):118−121. [ZHU Y, LI X Z, YAN L, et al. Determination of polysaccharides in healthcare liqueur by phenol-sulfuric acid method[J]. Liquor-Making Science & Technology,2023(2):118−121.] ZHU Y, LI X Z, YAN L, et al. Determination of polysaccharides in healthcare liqueur by phenol-sulfuric acid method[J]. Liquor-Making Science & Technology, 2023(2): 118−121.
[15] LIANG J, ZHAO Y L, YANG F R, et al. Preparation and structure-activity relationship of highly active black garlic polysaccharides[J]. International Journal of Biological Macromolecules,2022,220:601−612. doi: 10.1016/j.ijbiomac.2022.08.115
[16] 赵婷婷, 商洛华, 姚肖翰, 等. 香菇菌柄营养成分、多糖结构表征及其体外抗氧化活性[J/OL]. 菌物研究, 1−10[2024-08-12]. https://doi.org/10.13341/j.jfr.2022.1522. [ZHAO T T, SHANG L H, YAO X H, et al. Lentinula edodes stalks nutrent composition, characterization of polysaccharide structure and its antioxidant activity in vitro[J/OL]. Journal of Fungal Research, 1−10[2024-08-12]. https://doi.org/10.13341/j.jfr.2022.1522.] ZHAO T T, SHANG L H, YAO X H, et al. Lentinula edodes stalks nutrent composition, characterization of polysaccharide structure and its antioxidant activity in vitro[J/OL]. Journal of Fungal Research, 1−10[2024-08-12]. https://doi.org/10.13341/j.jfr.2022.1522.
[17] 李雪超, 赵建伟, 周星, 等. 红米米糠非淀粉多糖的提取纯化与结构表征[J]. 食品与发酵工业,2024,50(9):157−163. [LI X C, ZHAO J W, ZHOU X, et al. Extraction, purification, and structure characterization of non-starch polysaccharides from red rice bran[J]. Food and Fermentation Industries,2024,50(9):157−163.] LI X C, ZHAO J W, ZHOU X, et al. Extraction, purification, and structure characterization of non-starch polysaccharides from red rice bran[J]. Food and Fermentation Industries, 2024, 50(9): 157−163.
[18] 张亚男, 王昌禄, 李贞景, 等. 金针菇根部多糖的结构特征[J]. 食品科技,2015,40(3):283−286. [ZHANG Y N, WANG C L, LI Z J, et al. Structural characterization of polysaccharides from root of Flammulina velutipes[J]. Food Science and Technology,2015,40(3):283−286.] ZHANG Y N, WANG C L, LI Z J, et al. Structural characterization of polysaccharides from root of Flammulina velutipes[J]. Food Science and Technology, 2015, 40(3): 283−286.
[19] 陈庆庆, 陈帅, 李峰, 等. 阿魏菇子实体多糖的结构及其抗氧化活性研究[J]. 食品工业科技,2016,37(2):108−112. [CHEN Q Q, CHEN S, LI F, et al. Structural analysis and antioxidant activities of polysaccharides from the fruiting bodies of Pleurotus ferulae Lenzi[J]. Science and Technology of Food Industry,2016,37(2):108−112.] CHEN Q Q, CHEN S, LI F, et al. Structural analysis and antioxidant activities of polysaccharides from the fruiting bodies of Pleurotus ferulae Lenzi[J]. Science and Technology of Food Industry, 2016, 37(2): 108−112.
[20] 刘哲, 叶兴旺, 王吉平, 等. 生物结皮胞外多糖理化特性及菌群结构的季节动态[J]. 应用生态学报,2022,33(7):1801−1809. [LIU Z, YE X W, WANG J P, et al. Seasonal dynamics the physicochemical properties of biological crusts exopolysaccharides and the microbial community structure[J]. Chinese Journal of Applied Ecology,2022,33(7):1801−1809.] LIU Z, YE X W, WANG J P, et al. Seasonal dynamics the physicochemical properties of biological crusts exopolysaccharides and the microbial community structure[J]. Chinese Journal of Applied Ecology, 2022, 33(7): 1801−1809.
[21] 郑岚, 梁洁, 赵永雷, 等. 独瓣, 多瓣黑蒜发酵前后成分及抗氧化活性的分析[J]. 食品与发酵工业,2022,48(16):95−102. [ZHENG L, LIANG J, ZHAO Y L, et al. Compositions and antioxidant activities of single-clove and multiple-clove black garlic before and after fermentation[J]. Food and Fermentation Industries,2022,48(16):95−102.] ZHENG L, LIANG J, ZHAO Y L, et al. Compositions and antioxidant activities of single-clove and multiple-clove black garlic before and after fermentation[J]. Food and Fermentation Industries, 2022, 48(16): 95−102.
[22] 姜冬洋, 苏林贺, 陈亚东, 等. 富硒黑木耳菌丝体硒多糖的提取优化与抗氧化活性研究[J]. 菌物学报,2024,43(2):115−128. [JIANG D Y, SU L H, CHEN Y D, et al. Extraction and antioxidant activities of selenium polysaccharides from selenium enriched Auricularia heimuer mycelia[J]. Mycosystema,2024,43(2):115−128.] JIANG D Y, SU L H, CHEN Y D, et al. Extraction and antioxidant activities of selenium polysaccharides from selenium enriched Auricularia heimuer mycelia[J]. Mycosystema, 2024, 43(2): 115−128.
[23] WEI Q, ZHANG Y. Ultrasound-assisted polysaccharide extraction from Cercis chinensis and properites, antioxidant activity of polysaccharide[J]. Ultrasonics Sonochemistry,2023,96:106422. doi: 10.1016/j.ultsonch.2023.106422
[24] CHENG S, HE F, FU L, et al. Polysaccharide from rubescens:Extraction, optimization, characterization and antioxidant activities[J]. RSC Advances,2021,11(31):18974−18983. doi: 10.1039/D1RA01365C
[25] XIAO M, REN X, CHENG J, et al. Structural characterization of a novel fucosylated trisaccharide prepared from bacterial exopolysaccharides and evaluation of its prebiotic activity[J]. Food Chemistry,2023,420:136144. doi: 10.1016/j.foodchem.2023.136144
[26] 刘晓英, 马诗经, 韩萍, 等. 不同分子量茯苓多糖抑制酪氨酸酶活性及抗炎功效的研究[J]. 中国食用菌,2021,40(9):47−53. [LIU X Y, MA S J, HAN P, et al. Study on inhibitory of tyrosinase activity and anti-inflammatory effect of Poria cocos polysaccharides with different molecular weight[J]. Edible Fungi of China,2021,40(9):47−53.] LIU X Y, MA S J, HAN P, et al. Study on inhibitory of tyrosinase activity and anti-inflammatory effect of Poria cocos polysaccharides with different molecular weight[J]. Edible Fungi of China, 2021, 40(9): 47−53.
[27] 张曰辉, 韩立文, 郑岚, 等. 玫瑰多糖的酶法提取及柱前衍生HPLC分析[J]. 湖北农业科学,2013,52(20):5031−5033. [ZHANG Y H, HAN L W, ZHENG L, et al. Enzymatic extraction and pre-column derivatization HPLC analysis of rose polysaccharides[J]. Hubei Agricultural Science,2013,52(20):5031−5033.] ZHANG Y H, HAN L W, ZHENG L, et al. Enzymatic extraction and pre-column derivatization HPLC analysis of rose polysaccharides[J]. Hubei Agricultural Science, 2013, 52(20): 5031−5033.
[28] TANG Y, ZHU Z Y, LIU Y, et al. The chemical structure and anti-aging bioactivity of an acid polysaccharide obtained from rose buds[J]. Food & Function,2018,9(4):2300−2312.
[29] ZHU H, NI L, REN S, et al. A composite carbon-based solid acid-supported palladium catalyst (Pd/C-SO 3 H) for hydrogenolysis of plant-derived polymeric proanthocyanidins[J]. RSC Advances,2020,10(35):20665−20675. doi: 10.1039/D0RA03518A
[30] 石硕, 孙康婷, 李继伟, 等. 琼枝麒麟菜多糖的分离纯化、结构表征及降血糖活性[J]. 大连海洋大学学报,2023,38(5):866−873. [SHI S, SUN K T, LI J W, et al. Isolation, purification and hypoglycemic activity of polysaccharides derived from Eucheuma gelatinae[J]. Journal of Dalian Ocean University,2023,38(5):866−873.] SHI S, SUN K T, LI J W, et al. Isolation, purification and hypoglycemic activity of polysaccharides derived from Eucheuma gelatinae[J]. Journal of Dalian Ocean University, 2023, 38(5): 866−873.
[31] HONG T, YIN J Y, NIE S P, et al. Applications of infrared spectroscopy in polysaccharide structural analysis:Progress, challenge and perspective[J]. Food Chemistry:X,2021,12:100168.
[32] 宋照风, 谭杰安, 周子凡, 等. 黄芪多糖衍生物的制备及乳化性能研究[J]. 轻工科技,2023,39(5):8−15. [SONG Z F, TAN J A, ZHOU Z F, et al. Preparation and emulsification of astragalus polysaccharide derivatives[J]. Light Industry Science and Technology,2023,39(5):8−15.] SONG Z F, TAN J A, ZHOU Z F, et al. Preparation and emulsification of astragalus polysaccharide derivatives[J]. Light Industry Science and Technology, 2023, 39(5): 8−15.
[33] DAI Y, WANG L, CHEN X, et al. Lentinula edodes Sing polysaccharide:Extraction, characterization, bioactivities, and emulsifying applications[J]. Foods,2023,12(17):3289. doi: 10.3390/foods12173289
[34] TANG Y, SHENG J, HE X, et al. Novel antioxidant and hypoglycemic water-soluble polysaccharides from jasmine tea[J]. Foods,2021,10(10):2375. doi: 10.3390/foods10102375
[35] 杭书扬, 杨留枝, 史苗苗, 等. 山药皮残渣多糖结构表征及抗氧化活性测定[J]. 食品与机械,2023,39(2):153−158. [HANG S Y, YANG L Z, SHI M M, et al. Characterization and antioxidant activity determination of polysaccharide from yam peel residue[J]. Food & Machinery,2023,39(2):153−158.] HANG S Y, YANG L Z, SHI M M, et al. Characterization and antioxidant activity determination of polysaccharide from yam peel residue[J]. Food & Machinery, 2023, 39(2): 153−158.
[36] LIU Y, RAN L, WANG Y, et al. Basic characterization, antioxidant and immunomodulatory activities of polysaccharides from sea buckthorn leaves[J]. Fitoterapia,2023,169:105592. doi: 10.1016/j.fitote.2023.105592
[37] ZOU L. Deep eutectic solvent-assisted extraction, partially structural characterization, and bioactivities of acidic polysaccharides from lotus leaves[J]. Foods,2021,10(10):2330. doi: 10.3390/foods10102330
[38] 黄琼, 何燕萍. 玫瑰茄多糖含量测定及抗氧化活性研究[J]. 食品工业,2018,39(10):49−53. [HUANG Q, HE Y P. Determination of polysaccharide content and antioxidant activity of rosehips[J]. The Food Industry,2018,39(10):49−53.] HUANG Q, HE Y P. Determination of polysaccharide content and antioxidant activity of rosehips[J]. The Food Industry, 2018, 39(10): 49−53.
[39] NUERXIATI R, MUTAILIPU P, ABUDUWAILI A, et al. Effects of different chemical modifications on the structure and biological activities of polysaccharides from Orchis chusua D. Don[J]. Journal of Food Science,2021,86(6):2434−2444. doi: 10.1111/1750-3841.15734
[40] 金友权, 张四杰, 钱正, 等. 木槿花多糖的组成分析及抗氧化活性研究[J]. 中国中药杂志,2019,44(9):1822−1828. [JIN Y Q, ZHANG S J, QIAN Z, et al. Composition analysis and antioxidant activity of polysaccharide from Hibiscus syriacus[J]. China Journal of Chinese Materia Medica,2019,44(9):1822−1828.] JIN Y Q, ZHANG S J, QIAN Z, et al. Composition analysis and antioxidant activity of polysaccharide from Hibiscus syriacus[J]. China Journal of Chinese Materia Medica, 2019, 44(9): 1822−1828.
[41] 任晓莉, 杨璐, 乔鹏, 等. 复合酶法提取槐花多糖的工艺优化及其抗氧化活性[J]. 食品工业科技,2024,45(7):8−14. [REN X L, YANG L, QIAO P, et al. Process optimization of complex enzyme extraction of polysaccharides from Sophora japonica flowers and its antioxidant activity[J]. Science and Technology of Food Industry,2024,45(7):8−14.] REN X L, YANG L, QIAO P, et al. Process optimization of complex enzyme extraction of polysaccharides from Sophora japonica flowers and its antioxidant activity[J]. Science and Technology of Food Industry, 2024, 45(7): 8−14.
[42] AZIZ R H, LEILI M A, HOSSEIN K S, et al. Postbiotics as novel health-promoting ingredients in functional foods[J]. Health Promotion Perspectives,2020,10(1):3−4. doi: 10.15171/hpp.2020.02
[43] 杜孝元, 刘玮, 史飞, 等. 酪氨酸酶活性抑制实验及其在祛斑美白化妆品功效评价中的应用[J]. 中国美容医学,2005,14(6):740−742. [DU X Y, LIU W, SHI F, et al. Tyrosinase inhibition test and its application in efficacy evaluation of whitening cosmetics[J]. Chinese Journal of Aesthetic Medicine,2005,14(6):740−742.] doi: 10.3969/j.issn.1008-6455.2005.06.041 DU X Y, LIU W, SHI F, et al. Tyrosinase inhibition test and its application in efficacy evaluation of whitening cosmetics[J]. Chinese Journal of Aesthetic Medicine, 2005, 14(6): 740−742. doi: 10.3969/j.issn.1008-6455.2005.06.041






 下载:
下载:
 下载:
下载:



