Characterisation and Bioactivity Evaluation of Lycium barbarum Leaf Protein Extract
-
摘要: 为了探究枸杞叶蛋白提取物的特性表征与生物活性,采用碱提酸沉法提取枸杞叶蛋白提取物,通过持水性(water holding capacity,WA)、持油性(oil-holding property,FA)、热稳定性(thermal stability,TM)、溶解性(solubility,PS)、起泡性(froth capability,FC)、乳化性(emulsification capability,EC)等指标和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、扫描电镜(scanning electron microscopy,SEM)、紫外可见光谱(ultraviolet-visible spectra,UV)、傅里叶变换红外光谱(Fourier Transform infrared spectroscopy,FT-IR)、X射线衍射(X-ray Diffraction,XRD)的方法及体外自由基清除试验和酶抑制试验对枸杞叶蛋白提取物的理化性质、功能特性、结构表征及生物活性进行分析。结果表明,枸杞叶蛋白提取物总氨基酸含量达344.00±10.49 mg/100 g,分子量在40~55 kDa,WA和FA分别为2.70、3.43 g/g,变性温度为85.73 ℃,随pH的升高,枸杞叶蛋白提取物溶液的PS、FC、EC、起泡稳定性(froth stability,FS)均呈现先下降后上升的趋势,而乳化稳定性(emulsion stability,ES)正好相反。枸杞叶蛋白提取物表面有紧密连接的小孔且呈大小不均一的块状,在270 nm附近有特征吸收峰,出现酰胺A、B、Ⅰ、Ⅱ、Ⅲ带,具有完整的三螺旋结构。枸杞叶蛋白提取物浓度为10 mg/mL时对超氧阴离子、羟基自由基的清除率分别为37.73%、35.38%,对α-葡萄糖苷酶、α-淀粉酶的IC50分别为9.88、21.09 mg/mL。综上所述,枸杞叶蛋白提取物的特性和结构稳定,有一定的体外抗氧化能力并能抑制与血糖代谢相关酶的活性。本试验为枸杞叶蛋白提取物的开发利用和深加工提供理论依据。Abstract: In order to investigate the characterisation and biological activity of the leaf protein extract of Lycium barbarum, alkaline extraction and acid precipitation method was used to extract Lycium barbarum leaf protein extract. And the physicochemical properties, functional properties, structural characterisation and bioactivities of Lycium barbarum leaf protein extract were analysed by the methods of water holding capacity (WA), oil-holding property (FA), thermal stability (TM), solubility (PS), froth capability (FC), emulsification capability (EC), and other indexes as well as by the sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE), scanning electron microscopy (SEM), ultraviolet-visible spectroscopy (UV), Fourier infraredspectroscopy (FT-IR), and X-ray Diffraction (XRD), and the in vitro radical scavenging assays and enzyme inhibition assays. The results showed that the total amino acid content of Lycium barbarum leaf protein extract reached 344.00±10.49 mg/100 g, the molecular weight ranged in 40 to 55 kDa, the water WA and FA property were 2.70 and 3.43 g/g, and the denaturation temperature was 85.73 ℃. With the increase of pH, the PS, FC, EC and froth stability (FS) of Lycium barbarum leaf protein extract showed a tendency of first decreasing and then increasing, while emulsion stability (ES) was exactly the opposite. The surface of Lycium barbarum leaf protein extract had tightly connected pores and was in the form of lumps of uneven sizes, with characteristicabsorption peaks near 270 nm, appearing amide A, B, Ⅰ, Ⅱ, Ⅲ bands, and a complete triplehelix structure. The scavenging rate of superoxide anion and hydroxyl radical was 37.73% and 35.38% at the concentration of 10 mg/mL of Lycium barbarum leaf protein extract, respectively. The IC50 of α-glucosidase and α-amylase was 9.88 and 21.09 mg/mL, respectively. In conclusion, the Lycium barbarum leaf protein extract was characterised and structurally stable, had certain in vitro antioxidant capacity and could inhibit the activity of enzymes related to blood glucose metabolism. This experiment provides theoretical basis for the development, utilisation and deep processing of Lycium barbarum leaf protein extract.
-
Keywords:
- Lycium barbarum leaf /
- protein /
- functional characteristics /
- antioxidant /
- enzyme inhibition
-
枸杞叶是茄科枸杞属植物枸杞子(Lycium barbarum L.)的干燥嫩叶,有悠久的药用历史[1]。枸杞叶与枸杞子同根同源,富含多种营养物质,主要包括黄酮类化合物、甾类化合物、生物碱等活性成分以及蛋白质、氨基酸、矿物质等营养成分[2]。《本草纲目》称枸杞叶为天精草[3],具有消除疲惫、补充体力、清热解毒、消肿止痛、益精明目等功效[4]。有研究发现枸杞叶中的氨基酸含量高于枸杞果实[5],且富含24%可被人体直接吸收的游离氨基酸[6]。过去枸杞叶被用作廉价的饲料原料和土壤肥料,未能挖掘出其营养价值,而现在对于枸杞的加工利用也主要集中在果实,对于枸杞叶的研究利用较少,一般被用作烹饪食材,造成资源浪费,极大地降低了枸杞叶的附加值[7]。因此,对于枸杞叶蛋白的开发利用是研究其中活性物质一个潜在的研究方向。
近年来国内外对植物蛋白的研究热度持续上升,在全球范围内植物蛋白能广泛的应用在食品中。目前对枸杞叶蛋白的研究主要集中在分离提取以及粗蛋白中活性多肽含量的测定[8−9],关于枸杞叶蛋白的理化性质、结构表征、功能性质及生物活性的研究报道很少。因此,本文采用碱提酸沉法提取枸杞叶蛋白组分,探究枸杞叶蛋白的理化性质、结构表征、功能性质及生物活性,作为其在食品工业发展过程中的理论指标。
1. 材料与方法
1.1 材料与仪器
枸杞叶(Lycium barbarum L. leaves)(以鲜叶为原料:含有生物碱、黄酮类化合物、萜类化合物、甾类化合物等活性成分,蛋白质、氨基酸、矿物质等营养成分) 宁夏童子茶科技有限公司;无水乙醇、氢氧化钠、盐酸、牛血清蛋白、磷酸、过硫酸钾 均为分析纯,天津大茂试剂厂;抗坏血酸 天津市北联精细化学品开发有限公司;奥利司他(Orlistat)、α-葡萄糖苷酶(50 units/mg protein 酵母%)、阿卡波糖 阿拉丁试剂有限公司;考马斯亮蓝G-250、溴化钾 均为分析纯,上海市麦克林生化科技有限公司;α-淀粉酶 (≥5 u/mg solid),北京索莱宝科技有限公司。
TDL-5-A离心机 上海安亭科学仪器厂;FD-1A-5D真空冷冻干燥机 上海继谱公司;A300自动氨基酸分析仪 德国曼默博尔公司;Spectrum Two 傅里叶变换-红外光谱仪 美国PerkinElmer公司;UV-1800紫外光谱仪器 日本岛津公司;JSM-7500F扫描电镜 日本电子株式会社;V-5100紫外分光光度计 上海元析仪器有限公司;Multiskan Mk3 酶标仪 美国赛默飞世尔科技公司;D8-ADVANCE-A25 X射线衍射仪器 德国布鲁克AXS有限公司。
1.2 实验方法
1.2.1 原料预处理
挑选干净、无腐烂的新鲜枸杞叶,置于真空冷冻干燥箱60 ℃下干燥12 h后粉碎,过40目筛备用。
1.2.2 枸杞叶蛋白的提取
备用的枸杞叶粉末通过醇提法去除多酚后按照料液比1:30 g/mL加入1%的氢氧化钠溶液,在45 ℃下磁力搅拌提取枸杞叶蛋白,提取液在4000 r/min下离心15 min,取上清液调pH为3.0后在冰箱(4 ℃)放置过夜,生成的沉淀在4000 r/min下离心15 min,收集沉淀pH调节至7后进行真空冷冻干燥得枸杞叶蛋白提取物[10],重复提取3次。
1.2.3 枸杞叶蛋白提取物蛋白含量测定
1.2.3.1 标准曲线回归方程的建立
采用考马斯亮蓝法测定枸杞叶蛋白提取物的含量,牛血清白蛋白(BSA)标准品配制成浓度为0.1 mg/mL的标准溶液,向具塞试管中加入不同体积(0.0、0.1、0.2、0.4、0.6、0.8、1.0 mL)的BSA标准溶液,补加蒸馏水至1 mL,再加配制好的考马斯亮蓝G-250溶液5 mL,静置5 min后在595 nm处测定相应吸光度值,蒸馏水为空白对照。以标准牛血清蛋白浓度为横坐标,以595 nm处的吸光度为纵坐标,绘制标准曲线[11]。
1.2.3.2 枸杞叶蛋白提取物的蛋白含量及得率的计算
取0.1 mL 浓度为0.1 mg/mL的待测样液,加5 mL考马斯亮蓝G-250溶液,振荡混匀,静置5 min,按照标曲的制作步骤测定吸光值,以蒸馏水作空白对照,按照标准曲线查得蛋白浓度,根据以下公式计算枸杞叶蛋白含量及得率:
样品中蛋白的含量(g/100g)=(C−C0)×Vm×1000×100 (1) 式中:C为标准曲线查得蛋白质浓度(mg/mL);C0为空白试验蛋白质浓度(mg/mL);V为样品溶液定容体积;m为样品质量(g)。
得率(%)=M1M2×100 (2) 式中:M1为枸杞叶蛋白提取物的质量(g);M2为枸杞叶粉的质量(g)。
1.2.4 枸杞叶蛋白提取物的理化性质测定
1.2.4.1 枸杞叶蛋白提取物的氨基酸测定
使用自动氨基酸分析仪测定氨基酸谱(色氨酸未检测)。将20 mg枸杞叶蛋白置于真空水解管中,加入6 mol/L盐酸10 mL,管中充入氮气30 s并密封,置于油锅中110±1 ℃下水解24 h,水解液加水定容至50 mL,吸取水解液2 mL,在50 ℃下干燥,加入2 mL pH2.2的磷酸缓冲液充分溶解,过滤后放入氨基酸分析仪进行分析[12]。
1.2.4.2 枸杞叶蛋白提取物的SDS-PAGE测定
参考李琳等[13]的方法并略微修改。采用垂直电泳系统,浓缩胶5%,分离胶12.5%。样品前准备:按4:1的比例将10 mg/mL的枸杞叶蛋白溶液与上样缓冲液混合,在沸水中变性10 min。Maker的上样量为8 μL,枸杞叶蛋白溶液的上样量为15 μL,凝胶电泳条件为80 V、3 h。考马斯亮蓝溶液染色1 h,用脱色液脱色12 h,对蛋白质条带拍照观察。
1.2.5 枸杞叶蛋白提取物的功能特性测定
1.2.5.1 枸杞叶蛋白提取物持水性及持油性的测定
a. 持水性 利用1 mL蒸馏水溶解0.1 g枸杞叶蛋白粉末,混匀。静置20 min后,4000 r/min离心15 min,称量离心管和沉淀的总质量[13],实验重复3次。根据公式(3)计算蛋白的持水性。
持水性(g/g)=W2−W1W0 (3) 式中:W0:样品的质量(g);W1:离心管和样品的总质量(g);W2:离心后离心管加沉淀的总质量(g)。
b. 持油性 吸取5 mL大豆油与0.1 g枸杞叶蛋白粉末充分混匀,放置20 min,离心15 min,弃除上油层,然后称量。实验重复3次。按公式(4)计算蛋白的持油性[13]。
持油性(g/g)=W2−W1W0 (4) 式中:W0:样品的质量(g);W1:离心管和样品的总质量(g);W2:离心后离心管加沉淀的总质量(g)。
1.2.5.2 枸杞叶蛋白提取物的热稳定性测定
参考刘海鹏等[14]的方法,取适量的枸杞叶蛋白放入样品池,用差示扫描量热仪(DSC)进行检测扫描,扫描升温范围:20~200 ℃,升温速率:5 ℃/min。
1.2.5.3 枸杞叶蛋白提取物的溶解度测定
称取0.1 g枸杞叶蛋白粉末溶于10 mL蒸馏水中,分别用1.0 mol/L HCl和NaOH溶液调节pH至3.0~9.0均质2 min后,在4000 r/min下离心5 min[13]。利用1.3.4的方法计算样品蛋白质含量,重复3次,根据公式(5)计算溶解度。
溶解度(%)=W0W1×100 (5) 式中:W1:样品中的蛋白质含量(%);W0:上清液中的蛋白质含量(%)。
1.2.5.4 枸杞叶蛋白提取物起泡性及起泡稳定性的测定
参考王喜波等[15]的方法并略加改动,配制10 mg/mL的枸杞叶蛋白溶液,涡旋混匀,利用1.0 mol/L的HCl和NaOH溶液调节pH至3.0~9.0,最后以15000 r/min的转速搅拌2 min,分别测定搅拌停止时刻的起泡体积量;与放置30 min后的枸杞叶蛋白体积量。按公式(6)、(7)计算:
起泡性(%)=V1−V0V0×100 (6) 起泡稳定性(%)=V2V0×100 (7) 式中:V0:样品水溶液的体积(mL);V1:样品均质后的总体积(mL);V2:静置30 min后的体积(mL)。
1.2.5.5 枸杞叶蛋白提取物乳化性及乳化稳定性的测定
称取1 g枸杞叶蛋白,加入100 mL蒸馏水中,涡旋混匀,用1.0 mol/L HCl和1.0 mol/L NaOH溶液各调节pH至2.0~10.0。量取15 mL各溶液转移到离心管中,分别加入5 mL大豆油,在15000 r/min条件下高速搅拌2 min。搅拌完成后,立即从管底部吸取50 μL溶液,转移到含有5 mL 0.1% SDS溶液的离心管中,混匀,使用分光光度计在500 nm处测定吸光度。溶液室温放置30 min后,吸取50 μL转移到含有5 mL 0.1% SDS溶液的离心管中,混匀,测定吸光度[15]。按式(8)~式(9)计算。
乳化性(g/m2)=2×2.303×A0×nL×ρ×φ×100 (8) 乳化稳定性(min)=A0×ΔtA0−A10 (9) 式中:A0:0 min时枸杞叶蛋白乳化液的吸光度;A10:10 min时枸杞叶蛋白乳化液的吸光度;L:比色皿光程(1 cm);n:溶液稀释倍数;ρ:蛋白质浓度(g/100 mL);φ:油相体积分数(25%);Δt:10 min。
1.2.6 枸杞叶蛋白提取物的结构表征
1.2.6.1 枸杞叶蛋白提取物的扫描电镜观察
参考刘艳香等[16]方法并略微修改,将少量经冻干后的枸杞叶蛋白粉末用双面胶粘在样品座上,洗耳球吹去浮洋,喷完金粉后,置于扫描电镜的样品室中扫描、观察并分析。
1.2.6.2 枸杞叶蛋白提取物的紫外光谱测定
参考FANG等[17]方法并略微修改,称取0.01 g枸杞叶蛋白,加入超纯水,配成浓度为0.1 mg/mL的枸杞叶蛋白溶液同时以超纯水作为空白对照,在室温下置于紫外光谱仪中扫描,扫描范围为200~450 nm,扫描速度为1 nm/s。
1.2.6.3 枸杞叶蛋白提取物的傅里叶红外光谱测定
参考ZHANG等[18]方法并略微修改,制备KBr片时以1:10的比例将叶蛋白样品与KBr粉末充分混合。将不添加蛋白样品的KBr片为参考,空白KBr扫描后将制备好的KBr片通过傅里叶变换红外光谱仪在400~4000 cm−1范围内扫描32次,分辨率4.0 cm−1,绘制样品的红外光谱图。
1.2.6.4 枸杞叶蛋白提取物的X-射线衍射测定
参考赵立铸等[19]方法,称取2 g枸杞叶蛋白提取物置于X-射线衍射分析仪中,在40 kV管压,40 mA电流下,扫描的衍射角范围为5°~90°,扫描速度为2°/min的条件下分析。
1.2.7 枸杞叶蛋白提取物的自由基清除试验
1.2.7.1 超氧阴离子自由基的清除活性测定
参考冯书珍等[20]方法并略加修改,取25 ℃水浴20 min过的5 mL Tris-HCl缓冲溶液(0.5 mol/L、pH=8.2),1 mL不同浓度的样品溶液(2、4、6、8和10 mg/mL),0.5 mL浓度为3 mmol/L的邻苯三酚,混匀置于25 ℃水浴,5 min后加入1 mL盐酸(8 mmol/L)结束反应,于299 nm处测定吸光度。以VC作阳性对照,公式(10)为超氧阴离子自由基清除率的计算公式。
超氧阴离子自由基清除率(%)=A0−(A1−A2)A0×100 (10) 式中:A0为以同体积蒸馏水代替样品的吸光度;A1为样品组的吸光度;A2为以0.5 mL蒸馏水代替样品中的邻苯三酚的吸光度。
1.2.7.2 羟自由基的清除活性测定
参考范艳丽等[21]方法并略加修改,取0.2 mL不同浓度的样品溶液(2、4、6、8和10 mg/mL),1 mL 0.15 mg/mL的邻二氮菲溶液、2 mL pH7.4 PBS缓冲溶液、1 mL 0.2 mg/mL FeSO4溶液加入试管摇匀,于波长536 nm处测定吸光度值。以VC为阳性对照。公式(11)为羟自由基清除率的计算公式。
羟自由基清除率(%)=1−(A2−A0)(A1−A0)×100 (11) 式中:A0为不加样品溶液和H2O2的吸光度;A1为不加样品溶液而加H2O2的吸光度;A2为加入H2O2和样品溶液的吸光度。
1.2.8 枸杞叶蛋白提取物体外酶活性抑制试验
1.2.8.1 α-葡萄糖苷酶活性抑制试验
参考MPHAHLELE等[22]方法略微改进。将50 μL枸杞叶蛋白溶液(2、4、6、8、10 mg/mL)、150 μL PBS、20 μL的α-葡萄糖苷酶溶液,置于96孔板混匀,然后37 ℃水浴10 min,再加入 50 μL 4-硝基苯基α-D-吡喃葡萄糖苷,反应10 min,50 μL的Na2CO3的溶液停止反应,在于波长405 nm处测定吸光度,以阿卡波糖作为阳性对照。公式(12)为α-葡萄糖苷酶抑制率计算公式。
α-葡萄糖苷酶抑制率(%)=1−(A1−A2)(A3−A4)×100 (12) 式中:A1为样品组吸光度;A2为缓冲液代替酶液的吸光度;A3为缓冲液代替抑制剂的吸光度;A4为缓冲液代替酶液和抑制剂的吸光度。
1.2.8.2 α-淀粉酶活性抑制试验
参考沈荷玉等[23]方法并略微改进,取0.5 mL不同浓度样品(5、10、15、20、25 mg/mL),0.5 mL的α-淀粉酶,0.5 mL缓冲溶液混合均匀,37 ℃恒温水浴10 min后加1%的可溶性淀粉溶液0.5 mL再水浴10 min,加0.5 mL DNS(3,5-二硝基水杨酸)显色剂在沸水浴中加热10 min,于540 nm处测定吸光度值。以阿卡波糖为阳性对照。公式(13)为α-淀粉酶抑制率计算公式。
α-淀粉酶抑制率(%)=1−(A1−A2)(A3−A4)×100 (13) 式中:A1为样品组吸光度;A2为缓冲液代替抑制剂吸光度;A3为缓冲液代替酶液和抑制剂的吸光度;A4为缓冲液代替酶液的吸光度。
1.3 数据处理
所有试验均采用不同样品,并且做三次独立重复检测试验。所有试验所得数据采用Origin 2023.0作图,采用IBM SPSS Statistics 25.0版本分析数据显著性水平P<0.05,P<0.01表示不同水平的显著性差异,并用“平均数±标准差”表示。
2. 结果与分析
2.1 枸杞叶蛋白提取物的蛋白含量
标准曲线为y=0.6511x+0.0069(R2=0.9936)。计算得枸杞叶蛋白提取物中蛋白的含量为52.39%±0.45%,得率为3.52%±0.62%。
2.2 枸杞叶蛋白提取物的理化性质
2.2.1 枸杞叶蛋白提取物的氨基酸组成与含量
氨基酸是蛋白质组成的基本物质,蛋白质的营养价值主要取决于氨基酸的组成。枸杞叶蛋白提取物中的氨基酸组成如表1所示,枸杞叶蛋白提取物共检测出17种氨基酸,含量丰富,种类齐全,其中人体必需氨基酸占总氨基酸含量的46.85%,且根据氨基酸评分可知,蛋氨酸是枸杞叶蛋白提取物的第一限制性氨基酸,在实际生产应用中可与其他氨基酸互补使用,增加其营养价值;支链氨基酸亮氨酸、缬氨酸和异亮氨酸含量达23.65%,其具有修复肌肉、给身体组织提供能量的作用,是最有效的营养补剂[24];芳香族氨基酸酪氨酸和苯丙氨酸含量达20.92%,能够促进多肽链中蛋白质分子间的相互作用[25]。因此,枸杞叶蛋白提取物在食品工业中有广阔的市场前景。
表 1 枸杞叶蛋白提取物中氨基酸组成与含量Table 1. Composition and content of amino acids in leaf protein extract of Lycium barbarum氨基酸种类 含量(mg/100 g) 必需氨基酸 苏氨酸(Thr) 13.32±0.03 异亮氨酸(Ile) 60.41±3.19 亮氨酸(Leu) 14.39±0.12 苯丙氨酸(Phe) 22.43±0.27 赖氨酸(Lys) 11.97±0.59 蛋氨酸(Met) 32.08±0.61 缬氨酸(Val) 6.56±0.02 半必需氨基酸 精氨酸(Arg) 9.94±1.62 组氨酸(His) 3.77±0.26 非必需氨基酸 天冬氨酸(Asp) 34.68±1.61 半胱氨酸(Cys) 12.26±0.80 酪氨酸(Tyr) 49.53±2.70 丝氨酸(Ser) 29.84±0.83 谷氨酸(Glu) 21.44±4.06 甘氨酸(Gly) 11.91±0.71 丙氨酸(Ala) 9.45±1.42 脯氨酸(Pro) 16.12±2.72 氨基酸总量 344.00±10.49 2.2.2 枸杞叶蛋白提取物的分子量分布
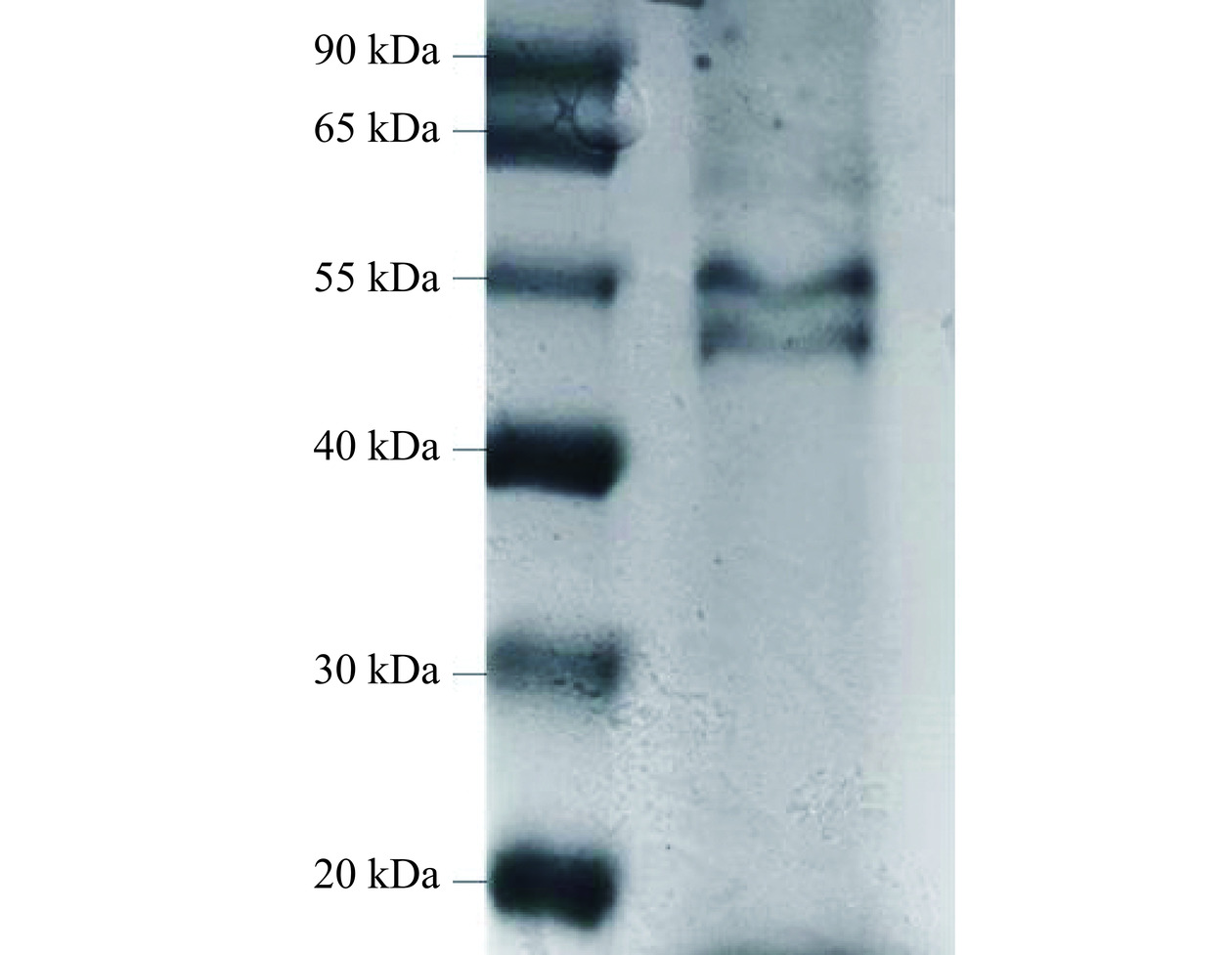
SDS-PAGE电泳通常用于蛋白质分子量和亚基组成分析。枸杞叶蛋白的电泳模式图如图1所示(标准分子量蛋白Marker在左泳道,枸杞叶蛋白样品右泳道),枸杞叶蛋白主要条带分布在40~65 kDa的范围内,55 kDa条带的颜色较深说明其中的亚基种类较多,有较为浅的条带说明含有其它低分子肽,由此可知枸杞叶蛋白的分子量在40~55 kDa之间[26]。
2.3 枸杞叶蛋白提取物的功能特性
2.3.1 枸杞叶蛋白提取物的持水性及持油性
持水性是蛋白质结合水能力的重要指标,用于评估蛋白质和水之间相互作用的强度;持油性通常反映蛋白质的非极性侧链与脂类结合的能力,会影响蛋白质产品的味道、质地和风味[27]。图2为枸杞叶蛋白提取物持水力及持油力测定的结果,其持水力为2.70 g/g,持油力为3.43 g/g,有研究表明,持水性在1.49~4.72 g/g之间的蛋白质适合加工粘性食品,高持油力的蛋白质可用于食品工业中的肉类配方或填充剂[28],因此,枸杞叶蛋白提取物可作为粘性食品的添加成分或者用在肉类配方中。
2.3.2 枸杞叶蛋白提取物的热稳定性
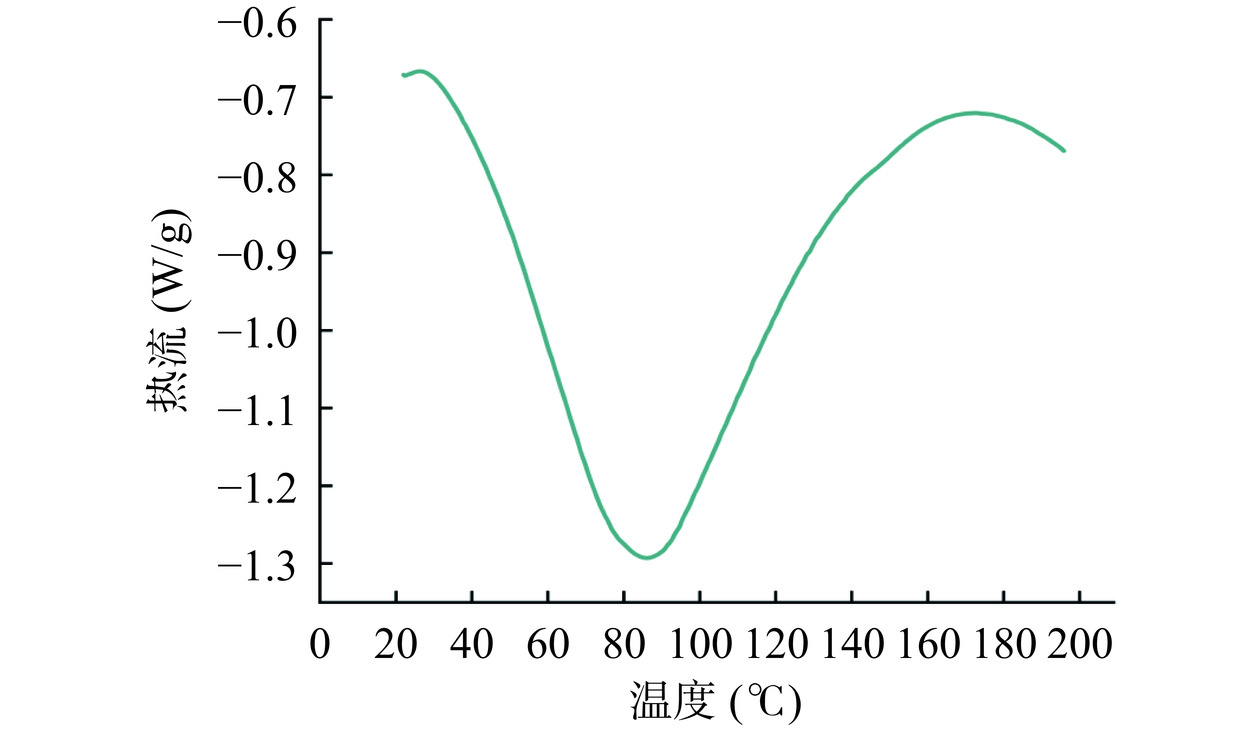
通过加热破坏蛋白质的二级、三级和四级结构,可以测量其在变性过程中的能量变化情况,所以从DSC的结果图中可以看出蛋白结构的稳定性。如图3所示,随着温度的升高,枸杞叶蛋白呈现单一的吸收峰,变形温度为85.73 ℃,与植物蛋白燕麦谷蛋白(61.49 ℃)相比枸杞叶蛋白的变性温度较高[29],可能由于蛋白质的变性使其内部共价键遭到破坏,而糖类与蛋白质发生糖基化反应后形成更为稳定的共价键[30]。
2.3.3 pH对枸杞叶蛋白提取物溶解度的影响
pH对溶解度的影响较大,能够影响产品的颜色、质地和口感。pH对枸杞叶蛋白提取物溶解度的影响如图4a所示,溶解度随pH的变化,呈典型的“U”型变化,在pH=5.0等电点处有明显的转折现象,此时,溶液中正负电荷平衡,削弱了水分子和蛋白质分子之间的相互作用,增强了蛋白质分子之间的相互作用,蛋白质聚集沉淀致使溶解度降低;pH大于等电点时,溶液中的正负电荷含量发生变化,增强了蛋白质分子与水分子之间的相互作用,随着pH的增加溶解度快速增大[31]。
2.3.4 pH对枸杞叶蛋白提取物起泡性及起泡稳定性的影响
蛋白质的起泡能力是指蛋白质能降低气-液界面的表面张力而帮助形成起泡的能力,起泡稳定性是指蛋白质维持泡沫稳定保持泡沫体积的能力。如图4b所示,枸杞叶蛋白提取物的起泡能力从pH=5时开始逐渐升高,较高的蛋白质溶解度增加蛋白质分子与水分子之间的相互作用,使其在搅拌过程中与空气充分接触,致使更多的泡沫生成[32]。
泡沫稳定性是指在泡沫形成后的一段时间内保持并防止泡沫破裂和聚结的能力。当pH从5.0逐渐到9.0时,起泡稳定性从71.77%上升到84.75%后又下降,在pH为7.0时达到最大值为84.75%,可能由于搅拌过程中沉淀的蛋白颗粒通过静电作用与泡沫结合,形成的泡沫绵密稳定,且在等电点附近枸杞叶蛋白之间静电作用力小,利于界面上蛋白之间相互作用及形成黏稠的膜,所以泡沫稳定性好,远离等电点且pH上升时泡沫稳定性又会下降[33]。枸杞叶蛋白提取物具有形成高稳定泡沫的能力,可提高其在食品工业中的应用潜力。
2.3.5 pH对枸杞叶蛋白提取物乳化性及乳化稳定性的影响
如图4c所示,枸杞叶蛋白提取物乳化性在pH为5.0时最小,可能与枸杞叶蛋白的溶解度有关,等电点处溶解度小,蛋白质相互聚集,产生沉淀,溶液中能够与油结合成乳状液的蛋白质较少;反之,当pH大于或小于等电点时,正负离子越多乳化性越强。
蛋白质是一种两性电解质,溶液的稳定性主要取决于电荷的变化。当溶液的pH高于枸杞叶蛋白的等电点时,蛋白质分子携带更多的负电荷,分子间的静电斥力增加,枸杞叶蛋白提取物的折叠结构扩展,如α-螺旋、氢键、离子键等,蛋白质结构内部的疏水基团暴露于表面,促进了油脂与蛋白质的结合[34]。在pH为7.0时,枸杞叶蛋白的乳化稳定性达到最大值(96.19%),但pH>7时,乳化稳定性缓慢下降,推测可能因为在强碱环境对蛋白的结构造成了影响,从而改变了蛋白分子之间的结构而引起的。枸杞叶蛋白提取物可以作为食品工业中新型的植物乳化剂。
2.4 枸杞叶蛋白提取物的结构特征
2.4.1 枸杞叶蛋白提取物扫描电镜分析
扫描电镜能更直观地观察物质结构,被广泛应用于蛋白表面结构形貌分析。图5为枸杞叶蛋白的电镜图。从图5中可以看出,在200×下枸杞叶蛋白提取物呈现出大小不均一的块状且块状的表面有各种孔洞;在5000×下枸杞叶蛋白有切面、结构紧密且表面有较多的小孔。
2.4.2 枸杞叶蛋白提取物紫外光谱分析
图6为枸杞叶蛋白提取物在200~450 nm波长范围内测定的紫外光谱图。由图6可知,枸杞叶蛋白在240~300 nm处有吸收峰表明枸杞叶蛋白中含有酪氨酸、苯丙氨酸等芳香族氨基酸,在270 nm处出现特征吸收峰主要原因是由于氨基酸残基的振动[35]。
2.4.3 枸杞叶蛋白提取物傅里叶红外光谱分析
枸杞叶蛋白提取物傅里叶红外光谱的结果如图7所示,在3332 cm−1附近出现吸收峰,是酰胺A带,由氨基中的N-H伸缩振动和羧基中的O-H伸缩振动所引起的,证明枸杞叶蛋白提取物中有氢键的存在;在2960 cm−1处出现的短而窄的吸收峰为酰胺B带,是C-H伸缩振动、CH2不对称/对称伸缩的特征吸收峰;在1605 cm−1附近出现较强的吸收峰由酰胺Ⅰ带的C=O伸缩振动引起,两个强吸收峰1528 cm−1、1445 cm−1出现是由酰胺Ⅱ带的N-H弯曲和C-N拉伸引起的,这是叶蛋白的特征峰[36]。在酰胺Ⅲ带1241 cm−1附近有强吸收峰,表明枸杞叶蛋白由于N-H弯曲而具有三螺旋结构[37]。酰胺Ⅰ带含有丰富的二级结构信息,通过对酰胺Ⅰ带进行峰形拟合和面积计算后可知α-螺旋、β-折叠、β-转角以及无规卷曲的相对百分比分别为11.31%、34.56%、30.00%和24.13%,其中β-折叠、β-转角和无规则卷曲含量较高,说明蛋白的自由度大,变性的程度越大,同时β-折叠结构也是蛋白聚集和形成凝胶的基础[38]。傅里叶红外光谱证明了枸杞叶蛋白提取物具有三螺旋完整结构。另外,枸杞叶蛋白提取物在1015 cm−1处出现较强的吸收峰,是糖苷键拉伸振动,表明其可能含有糖蛋白成分[39]。
2.4.4 枸杞叶蛋白提取物X射线衍射分析
X射线衍射已普遍应用在蛋白质构象分析中。如图8所示,2θ=8.50°和2θ=20.80°有两个明显的吸收峰且峰形基本相似,在2θ=8.50°时的峰稍为尖锐,是枸杞叶蛋白提取物内部排列较为规律的一部分结构所产生的衍射峰,与枸杞叶蛋白提取物的三螺旋结构有关,反映了其分子链间的距离,此研究结果与吴绍珍[40]的研究结果具有一致性;在2θ=20.80°时的峰形稍宽、强度较大,与枸杞叶蛋白提取物内部复杂结构所引起的漫射有关,此现象不仅反映出枸杞叶蛋白分子链间的距离且展现出枸杞叶蛋白提取物内部非结晶成分的含量占比[41]。
2.5 枸杞叶蛋白提取物的体外自由基清除作用
超氧阴离子自由基与羟基结合后会产生脂质过氧化,造成线粒体的作用改变和细胞损伤[42],破坏人体机能对人造成危害。如图9a所示,浓度为10 mg/mL时,枸杞叶蛋白对超氧阴离子自由基的清除率为37.73%。
羟自由基由过氧化物负离子和过氧化氢反应生成的,能够降解DNA、蛋白质及脂质等化合物,导致机体由于氧化而产生损伤[43]。如图9b所示,枸杞叶蛋白提取物在2~10 mg/mL的浓度范围内清除能力缓慢增大,在10 mg/mL时的清除率仅达到35.38%,同浓度下,鲁梅克斯叶蛋白酶解物对超氧阴离子和羟自由基的清除率均<30.0%[44],低于枸杞叶蛋白提取物的清除作用。
2.6 枸杞叶蛋白提取物的体外酶活性抑制作用
α-葡萄糖苷酶位于人小肠刷状边缘,能将寡糖末端非还原型的α(1→4)键水解成可被肠道上皮细胞易吸收的单糖[45]。因此,抑制α-葡萄糖苷酶活性能够控制小肠对葡萄糖的消化吸收,从而有效降低了人体血糖浓度。如图10a所示,当枸杞叶蛋白提取物浓度为10 mg/mL时,对α-葡萄糖苷酶的抑制率达到50.75%,枸杞叶蛋白对α-葡萄糖苷酶的IC50值为9.88 mg/mL,且质量浓度与抑制率的拟合方程的R2在0.9886~0.9986之间,表明样品浓度与α-葡萄糖苷酶抑制率之间呈良好的量效关系。在20 mg/mL浓度下,扁豆蛋白对α-葡萄糖苷酶的抑制率为21.32%[46],低于枸杞叶蛋白提取物。
枸杞叶蛋白提取物可以通过疏水相互作用与活性位点/酶分子结合抑制α-淀粉酶活性[47]。如图10b所示,随质量浓度的增大,枸杞叶蛋白对α-淀粉酶的抑制率也显著增大,其IC50为21.09 mg/mL,但低于同质量浓度下阿卡波糖对α-淀粉酶的抑制率。在20 mg/mL浓度下,枸杞叶蛋白提取物对α-淀粉酶的抑制率达43.09%,高于黑豆蛋白对其抑制率23.24%[47]。
3. 结论
枸杞叶蛋白的含量为52.39%±0.45%,得率为3.52%±0.62%,由17种氨基酸组成,持水力为2.70 g/g、持油力为3.43 g/g、变性温度为85.73 ℃;随pH的升高,枸杞叶蛋白溶液的溶解性、起泡性、起泡稳定性、乳化性均呈现先下降后上升的趋势,而乳化稳定性正好相反;通过电镜扫描观察得出枸杞叶蛋白为块状且有各种紧密连接的小孔洞;紫外光谱分析发现在枸杞叶蛋白240~300 nm处有吸收峰且在270 nm附近出现最大吸收峰;傅里叶红外光谱得出枸杞叶蛋白的二级结构为完整的三螺旋结构,且红外图谱显示振动组成复杂;X射线衍射分析得出在2θ=8.50°和2θ=20.80°有两个明显的吸收峰且峰形基本相似,分别代表蛋白α-螺旋和β-折叠结构。体外自由基清除试验发现枸杞叶蛋白提取物浓度为10 mg/mL时对超氧阴离子、羟基自由基的清除率分别为37.73%、35.38%;体外酶活性抑制试验发现枸杞叶蛋白对α-葡萄糖苷酶、α-淀粉酶的IC50分别为9.88、21.09 mg/mL。
此外,本研究仅对枸杞叶蛋白特性表征与生物活性进行简单的考察,后续可以结合体内实验进行深入研究,为进一步发掘和应用枸杞叶蛋白提供数据支撑,使枸杞叶的综合利用得到更快发展,大幅度提升枸杞叶的经济与营养价值。
-
表 1 枸杞叶蛋白提取物中氨基酸组成与含量
Table 1 Composition and content of amino acids in leaf protein extract of Lycium barbarum
氨基酸种类 含量(mg/100 g) 必需氨基酸 苏氨酸(Thr) 13.32±0.03 异亮氨酸(Ile) 60.41±3.19 亮氨酸(Leu) 14.39±0.12 苯丙氨酸(Phe) 22.43±0.27 赖氨酸(Lys) 11.97±0.59 蛋氨酸(Met) 32.08±0.61 缬氨酸(Val) 6.56±0.02 半必需氨基酸 精氨酸(Arg) 9.94±1.62 组氨酸(His) 3.77±0.26 非必需氨基酸 天冬氨酸(Asp) 34.68±1.61 半胱氨酸(Cys) 12.26±0.80 酪氨酸(Tyr) 49.53±2.70 丝氨酸(Ser) 29.84±0.83 谷氨酸(Glu) 21.44±4.06 甘氨酸(Gly) 11.91±0.71 丙氨酸(Ala) 9.45±1.42 脯氨酸(Pro) 16.12±2.72 氨基酸总量 344.00±10.49 -
[1] YAO X, MENG L F, ZHAO W L, et al. Changes the morphology traits, anatomical structure of the leaves andtranscriptome analysis in Lycium barbarum L. response to salt stress[J]. Frontiers in Plant Science,2023,14:399.
[2] XIA H, TANG H L, WANG F, et al. Metabolic effects of dietary supplementation of Lycium barbarum polysaccharides on serum and urine metabolomics in a young healthy male population[J]. Journal of Functional Foods,2018,46:440−448. doi: 10.1016/j.jff.2018.04.060
[3] 宿树兰, 郭盛, 朱悦, 等. 枸杞叶现代研究进展与资源化利用展望[J]. 中国现代中药,2022,24(1):10−19. [SU Shulan, GUO Sheng, ZHU Yue, et al. Progress in modern research and prospect of resource utilization of Lycium barbarum leaves[J]. Modern Chinese medicine,2022,24(1):10−19.] SU Shulan, GUO Sheng, ZHU Yue, et al. Progress in modern research and prospect of resource utilization of Lycium barbarum leaves[J]. Modern Chinese medicine, 2022, 24(1): 10−19.
[4] 闫亚美, 米佳, 禄璐, 等. 不同枸杞叶茶中黄酮、多酚及氨基酸组成分析[J]. 食品研究与开发,2020,41(23):27−31. [YAN Yamei, MI Jia, LU Lu, et al. Analysis of flavonoids, polyphenols and amino Acids in different Lycium barbarum leaf tea[J]. Food Research and Development,2020,41(23):27−31.] doi: 10.12161/j.issn.1005-6521.2020.23.005 YAN Yamei, MI Jia, LU Lu, et al. Analysis of flavonoids, polyphenols and amino Acids in different Lycium barbarum leaf tea[J]. Food Research and Development, 2020, 41(23): 27−31. doi: 10.12161/j.issn.1005-6521.2020.23.005
[5] 栾倩, 樊毅, 张淼, 等. 枸杞芽叶高纯度有效成分的制备及抗氧化活性研究[J]. 中国现代中药,2019,23(2):332−339. [LUAN Qian, FAN Yi, ZHANG Miao, et al. Study on the preparation and antioxidant activity ofhigh-purityactive components of Lycium barbarum buds and leaves[J]. Chinese Journal of Modern ChineseMedicine,2019,23(2):332−339.] LUAN Qian, FAN Yi, ZHANG Miao, et al. Study on the preparation and antioxidant activity ofhigh-purityactive components of Lycium barbarum buds and leaves[J]. Chinese Journal of Modern ChineseMedicine, 2019, 23(2): 332−339.
[6] YU Z L, XIA M Q, LAN J P, et al. A comprehensive review on the ethnobotany, phytochemistry, pharmacology andquality control of the genus Lycium in China[J]. Food & Function,2023,14(7):2998−3025.
[7] LIU H H, FAN Y L, WANG W H, et al. Polysaccharides from Lycium barbarum leaves:Isolation, characterization and splenocyte proliferation activity[J]. International Journal of Biological Macromolecules,2012,51(4):417−422. doi: 10.1016/j.ijbiomac.2012.05.025
[8] 侯明, 赵军平, 熊玲, 等. 钒胁迫下枸杞和芥菜叶蛋白含量的变化[J]. 桂林理工大学学报,2016,36(2):344−348. [HOU Ming, ZHAO Junping, XIONG Ling, et al. Changes in leaf protein content of Lycium barbarum and Brassica napus under vanadium stress[J]. Journal of Guilin University of Technology,2016,36(2):344−348.] doi: 10.3969/j.issn.1674-9057.2016.02.026 HOU Ming, ZHAO Junping, XIONG Ling, et al. Changes in leaf protein content of Lycium barbarum and Brassica napus under vanadium stress[J]. Journal of Guilin University of Technology, 2016, 36(2): 344−348. doi: 10.3969/j.issn.1674-9057.2016.02.026
[9] 江磊, 毕洪涛, 梅丽娟, 等. 高效液相色谱法测定枸杞叶粗蛋白中的活性多肽IN-5[J]. 光谱实验室,2012,29(5):2857−2860. [JIANG Lei, BI Hongtao, MEI Lijuan, et al. Determination of active peptide IN-5 in crude protein of Lycium barbarum leaves by high performance liquid chromatography[J]. Spectroscopy Laboratory,2012,29(5):2857−2860.] doi: 10.3969/j.issn.1004-8138.2012.05.054 JIANG Lei, BI Hongtao, MEI Lijuan, et al. Determination of active peptide IN-5 in crude protein of Lycium barbarum leaves by high performance liquid chromatography[J]. Spectroscopy Laboratory, 2012, 29(5): 2857−2860. doi: 10.3969/j.issn.1004-8138.2012.05.054
[10] 侯明, 陈国勇, 梁福晓, 等. 碱法提取枸杞植物叶中的蛋白质[J]. 桂林理工大学学报,2014,34(3):515−518. [HOU Ming, CHEN Guoyong, LIANG Fuxiao, et al. Extraction of proteins from leaves of Lycium barbarum plant by alkaline method[J]. Journal of Guilin University of Technology,2014,34(3):515−518.] doi: 10.3969/j.issn.1674-9057.2014.03.018 HOU Ming, CHEN Guoyong, LIANG Fuxiao, et al. Extraction of proteins from leaves of Lycium barbarum plant by alkaline method[J]. Journal of Guilin University of Technology, 2014, 34(3): 515−518. doi: 10.3969/j.issn.1674-9057.2014.03.018
[11] 徐亚, 范会芬, 赵玎玲, 等. 考马斯亮蓝法测定大豆水溶性蛋白提取方法的优化[J]. 大豆科学,2022,41(2):196−202. [XU Ya, FAN Huifen, ZHAO Dingling, et al. Optimization of extraction method of water-soluble protein from soybean by Coomasil brilliant blue method[J]. Soybean Science,2022,41(2):196−202.] doi: 10.11861/j.issn.1000-9841.2022.02.0196 XU Ya, FAN Huifen, ZHAO Dingling, et al. Optimization of extraction method of water-soluble protein from soybean by Coomasil brilliant blue method[J]. Soybean Science, 2022, 41(2): 196−202. doi: 10.11861/j.issn.1000-9841.2022.02.0196
[12] TERUYOSHI T, KENJI T, KAZUFUMI T, et al. Isolation and characterization of acid-soluble bluefin tuna(Thunnus orientalis) skin collagen[J]. Fisheries and Aquatic Sciences,2018,21(1):53−57.
[13] 李琳, 金丽娜, 郭佩佩, 等. 富硒小米蛋白的理化性质、功能特性及结构研究[J]. 食品与发酵工业,2024,50(3):259−267. [LI Lin, JIN Lina, GUO Peipei, et al. Physicochemical properties, functional properties and structural stu ies of selenium-enriched millet protein[J]. Food and Fermentation Industry,2024,50(3):259−267.] LI Lin, JIN Lina, GUO Peipei, et al. Physicochemical properties, functional properties and structural stu ies of selenium-enriched millet protein[J]. Food and Fermentation Industry, 2024, 50(3): 259−267.
[14] 刘海鹏, 李玲, 韩佳利, 等. 改性瓜尔胶/乳清蛋白/芦丁复合膜的制备、表征及其对双孢菇贮藏品质的影响[J]. 食品科学,2024,45(5):233−242. [LIU Haipeng, LI Ling, HAN jiali, et al. Preparation and characterisation of modified guargum/whey protein/rutin composite film and its effect on storage quality of Agaricus bisporus[J]. Food Science,2024,45(5):233−242.] doi: 10.7506/spkx1002-6630-20230425-239 LIU Haipeng, LI Ling, HAN jiali, et al. Preparation and characterisation of modified guargum/whey protein/rutin composite film and its effect on storage quality of Agaricus bisporus[J]. Food Science, 2024, 45(5): 233−242. doi: 10.7506/spkx1002-6630-20230425-239
[15] 王喜波, 崔强, 张安琪, 等. 超声处理改善不同比例大豆-乳清混合蛋白理化性质[J]. 农业工程学报,2018,34(22):299−305. [WANG Xibo, CUI Qiang, ZAHNG Anqi, et al. Ultrasonic treatment improves physicochemical properties of different proportions of soy-whey mixed protein[J]. Transactions of the Chinese Societyof AgriculturalEngineering (Transactions of the CSAE),2018,34(22):299−305.] doi: 10.11975/j.issn.1002-6819.2018.22.037 WANG Xibo, CUI Qiang, ZAHNG Anqi, et al. Ultrasonic treatment improves physicochemical properties of different proportions of soy-whey mixed protein[J]. Transactions of the Chinese Societyof AgriculturalEngineering (Transactions of the CSAE), 2018, 34(22): 299−305. doi: 10.11975/j.issn.1002-6819.2018.22.037
[16] 刘艳香, 谭斌, 刘明, 等. 添加剂对高水分挤压组织化复合蛋白理化性质的影响[J]. 农业工程学报,2019,35(1):294−302. [LIU Yanxaing, TAN Bin, LIU Ming, et al. Effects of additives on physicochemical properties of high moisture extruded complex protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE),2019,35(1):294−302.] doi: 10.11975/j.issn.1002-6819.2019.01.036 LIU Yanxaing, TAN Bin, LIU Ming, et al. Effects of additives on physicochemical properties of high moisture extruded complex protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(1): 294−302. doi: 10.11975/j.issn.1002-6819.2019.01.036
[17] FANG S X, RUAN G R, HAO J, et al. Characterization and antioxidant properties of Manchurian walnutmeal hydrolysates after calcium chelation[J]. LWT-Food Science and Technology,2020,130:109632. doi: 10.1016/j.lwt.2020.109632
[18] ZHANG Fengrui, ZHENG jun, LI Zeyu, et al. Purification, characterization, and self-assembly of the polysaccharide from Allium schoenoprasum[J]. Foods,2021,10(6):1352. doi: 10.3390/foods10061352
[19] 赵立铸, 裴志胜, 王会博, 等. 热处理肌原纤维蛋白复凝聚法制备微胶囊及性能表征[J]. 食品工业科技,2023,44(11):1−12. [ZHAO Lizhu, PEI Zhisheng, WANG Huibo, et al. Preparation of microcapsules by heat-treated myofibrillar protein complex coagulation and property characterisation[J]. Food Industry Science and Technology,2023,44(11):1−12.] ZHAO Lizhu, PEI Zhisheng, WANG Huibo, et al. Preparation of microcapsules by heat-treated myofibrillar protein complex coagulation and property characterisation[J]. Food Industry Science and Technology, 2023, 44(11): 1−12.
[20] 冯书珍, 谢广燕, 刘南英, 等. 两种海藻内生菌的分离及其抗氧化活性研究[J]. 食品与生物技术学报,2020,39(6):99−105. [FENG Shuzhen, XIE Guangyan, LIU Nanying, et al. Study on the isolation and antioxidant activity of two endophytic algae bacteria[J]. Journal of Food and Biotechnology,2020,39(6):99−105.] doi: 10.3969/j.issn.1673-1689.2020.06.014 FENG Shuzhen, XIE Guangyan, LIU Nanying, et al. Study on the isolation and antioxidant activity of two endophytic algae bacteria[J]. Journal of Food and Biotechnology, 2020, 39(6): 99−105. doi: 10.3969/j.issn.1673-1689.2020.06.014
[21] 范艳丽, 韩丽娜, 付丽霞, 等. 枸杞叶黄酮类化合物体外清除自由基作用研究[J]. 中国调味品,2017,42(12):32−37. [FAN Y L, HAN L N, FU L X, et al. Study on free radical scavenging effect of flavonoids from Lycium barbarum leaves[J]. Chinese Condiment,2017,42(12):32−37.] doi: 10.3969/j.issn.1000-9973.2017.12.007 FAN Y L, HAN L N, FU L X, et al. Study on free radical scavenging effect of flavonoids from Lycium barbarum leaves[J]. Chinese Condiment, 2017, 42(12): 32−37. doi: 10.3969/j.issn.1000-9973.2017.12.007
[22] MPHAHLELE M J, MAGWAZA N M, MALINDISA S T, et al. Biological evaluation the 2-aryl-2, 3-dihydrobenzodiazaborinin-4 (1H)-ones as potential dual α-glucosidase and α-amylase inhibitors with antioxidantproperties[J]. Chemical Biology & Drug Design,2021,98(2):234−247.
[23] 沈荷玉, 李梦阳, 敖婧芳, 等. 没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制作用及机理[J]. 食品科学,2023,44(22):31−38. [SHEN Heyu, LI Mengyang, AO Jingfang, et al. Inhibition of α-amylase and α-glucosidase by gallic acid and its mechanism[J]. Food Science,2023,44(22):31−38.] doi: 10.7506/spkx1002-6630-20230116-132 SHEN Heyu, LI Mengyang, AO Jingfang, et al. Inhibition of α-amylase and α-glucosidase by gallic acid and its mechanism[J]. Food Science, 2023, 44(22): 31−38. doi: 10.7506/spkx1002-6630-20230116-132
[24] 温青玉, 张康逸, 屈凌波, 等. 青麦仁分离蛋白理化性质及功能特性的研究[J]. 食品工业科技,2020,41(9):26−33. [WEN Qingyu, ZHANG Kangyi, QU lingbo, et al. Research on physicochemical properties and functional properties of green wheat kernel isolate protein[J]. Food Industry Science and Technology,2020,41(9):26−33.] WEN Qingyu, ZHANG Kangyi, QU lingbo, et al. Research on physicochemical properties and functional properties of green wheat kernel isolate protein[J]. Food Industry Science and Technology, 2020, 41(9): 26−33.
[25] 耿正玮, 樊林娟, 张咏梅, 等. 杏鲍菇谷蛋白理化性质及功能特性研究[J]. 食品研究与开发,2020,41(14):55−62. [GENG Zhengwei, FAN Linjuan, ZHANG Yongmei, et al. Studies on physicochemical properties and functional characteristics of apricot mushroom glutenin[J]. Food Research and Development,2020,41(14):55−62.] doi: 10.12161/j.issn.1005-6521.2020.14.009 GENG Zhengwei, FAN Linjuan, ZHANG Yongmei, et al. Studies on physicochemical properties and functional characteristics of apricot mushroom glutenin[J]. Food Research and Development, 2020, 41(14): 55−62. doi: 10.12161/j.issn.1005-6521.2020.14.009
[26] 李娜, 黄霁雯, 雷敏, 等. 银耳多糖对麦醇溶蛋白纳米体系的影响及复合物的特性研究[J/OL]. 食品与发酵工业, 2023:1−10. https://doi.org/10.13995/j.cnki.11-1802/ts.035712. [LI Na, HUANG Jiwen, LEI Min, et al. Effect of ginkgo polysaccharides on maltolysin nanosystems and characterisation of the complexes[J/OL]. Food and Fermentation Industry, 2023:1−10. https://doi.org/10.13995/j.cnki.11-1802/ts.035712.] LI Na, HUANG Jiwen, LEI Min, et al. Effect of ginkgo polysaccharides on maltolysin nanosystems and characterisation of the complexes[J/OL]. Food and Fermentation Industry, 2023: 1−10. https://doi.org/10.13995/j.cnki.11-1802/ts.035712.
[27] SHEN Y T, HONG S, SINGH G, et al. Improving functional properties of pea protein through “green” modifications using enzymes and polysaccharides[J]. Food Chemistry,2022,385:132687. doi: 10.1016/j.foodchem.2022.132687
[28] 王海东, 张红印, 曹珺, 等. 五味子四种组分蛋白结构、理化性质和功能特性比较[J]. 食品与发酵工业,2024,50(2):67−77. [WANG Haidong, ZHANG Hongyin, CAO Jun, et al. Comparison of the structure, physicochemical properties and functional properties of four fractions of Schisandra chinensis[J]. Food and Fermentation Industry,2024,50(2):67−77.] WANG Haidong, ZHANG Hongyin, CAO Jun, et al. Comparison of the structure, physicochemical properties and functional properties of four fractions of Schisandra chinensis[J]. Food and Fermentation Industry, 2024, 50(2): 67−77.
[29] 王婵. 燕麦麸皮蛋白的提取条件及其理化性质研究[D]. 天津:天津科技大学, 2013. [WANG Chan. Study onextraction conditions and Physicochemical properties of oat bran protein[D]. Tianjin:Tianjin University of Science and Technology, 2013.] WANG Chan. Study onextraction conditions and Physicochemical properties of oat bran protein[D]. Tianjin: Tianjin University of Science and Technology, 2013.
[30] 王丹, 李河, 张志军, 等. 紫苏籽粕蛋白糖基化产物结构及功能特性[J]. 浙江大学学报(农业与生命科学版),2023,49(4):557−565. [WANG Dan, LI He, ZHANG Zhijun, et al. Structural and functional properties of protein glycosylation products from perilla seed meal[J]. Journal of Zhejiang University (Agricultural and Life Sciences),2023,49(4):557−565.] doi: 10.3785/j.issn.1008-9209.2023.03.101 WANG Dan, LI He, ZHANG Zhijun, et al. Structural and functional properties of protein glycosylation products from perilla seed meal[J]. Journal of Zhejiang University (Agricultural and Life Sciences), 2023, 49(4): 557−565. doi: 10.3785/j.issn.1008-9209.2023.03.101
[31] 付丽霄, 冯潇, 汤晓智. 藜麦蛋白的提取、功能特性及改性方式研究进展[J]. 食品工业科技,2023,44(23):346−353. [FU Lixiao, FENG Xiao, TANG Xiaozhi, et al. Research progress on the extraction, functional propertiesand modification of quinoa protein[J]. Food Industry Science and Technology,2023,44(23):346−353.] FU Lixiao, FENG Xiao, TANG Xiaozhi, et al. Research progress on the extraction, functional propertiesand modification of quinoa protein[J]. Food Industry Science and Technology, 2023, 44(23): 346−353.
[32] LECH F J, DELAHAIJE R J B M, MEINDERS M B J, et al. Identification of critical concentrations determining foam ability and stability of β-lactoglobulin[J]. Food Hydrocolloids,2016,57:46−54. doi: 10.1016/j.foodhyd.2016.01.005
[33] 张艺玮, 任静, 张舒, 等. pH对微波改性薏米蛋白功能特性的影响[J]. 中国调味品,2021,46(9):48−52. [ZHANG Yiwei, REN Jing, ZHANG Shu, et al. Effect of pH on the functional properties of microwave-modified barley protein[J]. China Seasoning,2021,46(9):48−52.] doi: 10.3969/j.issn.1000-9973.2021.09.009 ZHANG Yiwei, REN Jing, ZHANG Shu, et al. Effect of pH on the functional properties of microwave-modified barley protein[J]. China Seasoning, 2021, 46(9): 48−52. doi: 10.3969/j.issn.1000-9973.2021.09.009
[34] 王江涛, 赵晓瑜, 郭彩霞. 花青素协同酶水解法对翅果油粕蛋白功能性质和结构特性的影响[J]. 食品工业科技,2023,44(20):18−26. [WANG Jiangtao, ZHAO Xiaoyu, GUO Caixia. Effects of anthocyanin synergistic enzymatic hydrolysis on functional properties and structural properties of protein from samara oil meal[J]. Food Industry Science and Technology,2023,44(20):18−26.] WANG Jiangtao, ZHAO Xiaoyu, GUO Caixia. Effects of anthocyanin synergistic enzymatic hydrolysis on functional properties and structural properties of protein from samara oil meal[J]. Food Industry Science and Technology, 2023, 44(20): 18−26.
[35] 李春翼, 王启明, 张驰, 等. 热诱导对麦醇溶蛋白-芦丁相互作用及其乳化特性的影响[J]. 中国食品学报,2022,22(12):63−71. [LI Chunyi, WANG Qiming, ZHANG Chi, et al. Effect of thermal induction on the interaction ofmaltolysin-rutin and its emulsification properties[J]. Chinese Journal of Food Science,2022,22(12):63−71.] LI Chunyi, WANG Qiming, ZHANG Chi, et al. Effect of thermal induction on the interaction ofmaltolysin-rutin and its emulsification properties[J]. Chinese Journal of Food Science, 2022, 22(12): 63−71.
[36] 秦庆雨, 李宇宇, 李文虎, 等. 不同干燥方式下叶蛋白-辣椒素微胶囊理化特性研究[J]. 农业机械学报,2022,53(2):378−385. [QIN Qingyu, LI Yuyu, LI Wenhu, et al. Physicochemical properties of leaf protein-capsaicin microcapsules under different drying methods[J]. Transactions of the Chinese Society for Agricultural Machinery,2022,53(2):378−385.] doi: 10.6041/j.issn.1000-1298.2022.02.040 QIN Qingyu, LI Yuyu, LI Wenhu, et al. Physicochemical properties of leaf protein-capsaicin microcapsules under different drying methods[J]. Transactions of the Chinese Society for Agricultural Machinery, 2022, 53(2): 378−385. doi: 10.6041/j.issn.1000-1298.2022.02.040
[37] WU Wenmin, HE Lichao, LIANG Yanhui, et al. Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J]. Food Chemistry,2019,284:80−89. doi: 10.1016/j.foodchem.2019.01.103
[38] 计红芳, 李莎莎, 王雪菲, 等. 豌豆蛋白对牛肉盐溶蛋白理化性质及二级结构的影响[J]. 食品与发酵工业,2019,45(7):109−115. [JI Hongfang, LI Shasha, WANG Xuefei, et al. Effect of pea protein on physicochemical properties and secondary structure of beef salt soluble protein[J]. Food and Fermentation Industry,2019,45(7):109−115.] JI Hongfang, LI Shasha, WANG Xuefei, et al. Effect of pea protein on physicochemical properties and secondary structure of beef salt soluble protein[J]. Food and Fermentation Industry, 2019, 45(7): 109−115.
[39] HUANG G Q, SUN Y T, et al. Complex coacervation of soybean protein isolate and chitosan[J]. Food Chemistry,2012,135(2):534−539. doi: 10.1016/j.foodchem.2012.04.140
[40] 吴绍珍. 山核桃饼粕生物活性肽的制备与活性研究[D]. 杭州:浙江农林大学, 2022. [WU Shaozhen. Preparation andactivity of bioactive peptides from Pecan cake meal[D]. Hangzhou:Zhejiang A&F University, 2022.] WU Shaozhen. Preparation andactivity of bioactive peptides from Pecan cake meal[D]. Hangzhou: Zhejiang A&F University, 2022.
[41] LI Q P, XU B, XU X Q, et al. Dissolution and interaction of white hide powder in [Etmim][C12H25SO4][J]. Journal of Molecular Liquids,2017,241:974−983. doi: 10.1016/j.molliq.2017.06.108
[42] 马洪鑫. 藜麦蛋白抗氧化肽的制备及其作用机制研究[D]. 兰州:西北民族大学, 2021. [MA Hongxin. Preparation and mechanism of antioxidant peptides from quinoa protein[D]. Lanzhou:Northwest University for Nationalities, 2021.] MA Hongxin. Preparation and mechanism of antioxidant peptides from quinoa protein[D]. Lanzhou: Northwest University for Nationalities, 2021.
[43] HAYTAA M, BENLI B, İŞÇIMEN E M, et al. Optimization of antihypertensive and antioxidant hydrolysate extraction from rice bran proteins using ultrasound assisted enzymatic hydrolysis[J]. Journal of Food Measurement and Characterization,2020,14(5):2578−2589. doi: 10.1007/s11694-020-00504-2
[44] 李延琪, 徐永清, 苗宇, 等. 鲁梅克斯叶蛋白的抗氧化肽活性及功能性质研究[J]. 食品工业科技,2017,38(2):104−110. [LI Yanqi, XU Yongqing, MIAO Yu, et al. Study on antioxidant peptide activity and functional properties of Rumex leaf protein[J]. Food Industry Science and Technology,2017,38(2):104−110.] LI Yanqi, XU Yongqing, MIAO Yu, et al. Study on antioxidant peptide activity and functional properties of Rumex leaf protein[J]. Food Industry Science and Technology, 2017, 38(2): 104−110.
[45] DENG Y T, LIN-SHIOU S Y, SHYUR L F, et al. Pu-erh tea polysaccharides decrease blood sugar by inhibitionof α-glucosidase activity in vitro and in mice[J]. Food & Function,2015,6(5):1539−1546.
[46] WANG M T, CHEN J C, YE X Q, et al. In vitro inhibitory effects of Chinese bayberry (Myrica rubra Sieb. et Zucc.) leaves proanthocyanidins on pancreatic α-amylase and their interaction[J]. Bioorganic Chemistry,2020,101:104029. doi: 10.1016/j.bioorg.2020.104029
[47] 任顺成, 张丹丹, 刘泽龙. 4种外源植物蛋白对小麦淀粉消化性的影响[J]. 中国食品学报,2023,23(2):91−99. [REN Shuncheng, ZHANG Dandan, LIU Zelong, et al. Effects of four exogenous plant proteins on the digestibility of wheat starch[J]. Chinese Journal of Food Science,2023,23(2):91−99.] REN Shuncheng, ZHANG Dandan, LIU Zelong, et al. Effects of four exogenous plant proteins on the digestibility of wheat starch[J]. Chinese Journal of Food Science, 2023, 23(2): 91−99.
-
期刊类型引用(2)
1. 高玮,李若兰,曾婧辉,力娜,宋凯,韩世范,朱瑞芳. 药食同源物质及其非营养素在肺癌防治中的研究进展. 护理研究. 2024(10): 1741-1746 .  百度学术
百度学术
2. 孙佳慧,周援,孙月娥,李春阳,王卫东,张军. 黄芪生物活性成分及在食品中的应用研究进展. 中国食品添加剂. 2023(12): 272-276 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:








 下载:
下载:



