Purification Technology by Macroporous Resin and Immunomodulatory Activity of Abalone Polysaccharide
-
摘要: 目的:为提高鲍鱼多糖品质,对鲍鱼多糖的大孔树脂纯化工艺进行优化,并对纯化前后多糖的免疫调节活性分析评价。方法:以多糖保留率、蛋白质脱除率和色素脱除率的加权综合得分为指标,考察6种不同型号的大孔树脂对鲍鱼多糖的纯化效果,利用单因素实验和响应面分析法优化大孔树脂的纯化工艺条件,并通过体外细胞实验对纯化前后鲍鱼多糖的免疫调节活性进行研究。结果:HPD100的加权综合得分最高,对鲍鱼多糖的纯化效果最佳;HPD100纯化多糖的最佳工艺参数为多糖与树脂质量比1:42、吸附时间3.10 h,吸附温度35 ℃,在此条件下多糖保留率为97.58%±1.58%,蛋白质脱除率为30.20%±0.66%,色素脱除率为45.78%±1.01%,加权综合平均得分61.83%;体外细胞实验结果表明,纯化后鲍鱼多糖的免疫调节活性显著增强,RAW264.7巨噬细胞的增殖活力提高,NO、TNF-α和IL-6细胞因子分泌水平大幅增加。结论:本研究获得鲍鱼多糖的最佳大孔树脂纯化工艺条件,纯化后鲍鱼多糖的生物活性显著增强,可为高活性鲍鱼多糖的制备提供理论依据。Abstract: Objective: To improve the quality of abalone polysaccharide, the purification process by macroporous resins was optimized, and the immunomodulatory activities of polysaccharides before and after purification were evaluated. Methods: The purification effects of six kinds of macroporous resins on abalone polysaccharide were investigated with the comprehensive score of polysaccharide recovery rate, deproteinization rate and decolorization rate as the index. Single-factor experiment and response surface analysis were employed to optimize the purification process parameters. The immunomodulatory activities of abalone polysaccharide before and after purification were studied by cell experiment in vitro. Results: HPD100 had the best purification effect on abalone polysaccharide with the highest comprehensive score. The optimal purification process parameters were as follows: Polysaccharide to resin mass ratio 1:42, adsorption time 3.10 h, adsorption temperature 35 ℃. Under these conditions, the polysaccharide recovery rate, deproteinization rate and decolorization rate were 97.58%±1.58%, 30.20%±0.66% and 45.78%±1.01%, respectively, and the resulting average comprehensive score was 61.83%. Furthermore, the in vitro cell experiment results showed that the immunomodulatory activity of abalone polysaccharide was markedly enhanced after purification by HPD100, with stronger viability of RAW264.7 macrophages and higher secretion of cytokines including NO, TNF-α and IL-6. Conclusions: An optimal purification process of abalone polysaccharide by macroporous resins was obtained, and the purified polysaccharide exhibited significantly improved biological activity. This research would provide a theoretical basis for preparation of highly bioactive abalone polysaccharide.
-
Keywords:
- abalone /
- polysaccharide /
- purification /
- macroporous resin /
- immunomodulatory activity
-
鲍鱼,鲍科鲍属软体动物,被誉为“海洋软黄金”,是一种具有重要经济价值的海洋贝类。随着人们生活水平日益提高,鲍鱼需求量不断增加,我国鲍鱼养殖产量也逐年增长。根据中国渔业统计年鉴数据显示,截至2021年我国鲍鱼产量已达21.78万吨,同比增长7.1%[1]。鲍鱼市场需求与产业规模扩大的同时,在加工过程中也随之产生了大量的鲍鱼内脏废弃物(占体重的15%~25%),这些物质极易腐烂发臭,造成环境污染[2]。近年来,大量研究表明鲍鱼内脏中含有多种生物活性成分,如多糖、蛋白质和氨基酸等,是海洋活性物质的良好来源[3−4]。因此,加深对鲍鱼内脏废弃资源的开发利用不仅可促进鲍鱼产业的快速发展,也有利于海洋资源的全面利用。
鲍鱼多糖是鲍鱼内脏中最主要的生物活性物质之一,具有抗氧化、抗肿瘤、抗病毒、抗凝血和抗炎等多种功效[2−6]。魏好程等[7]和SUN等[8]通过实验证实,鲍鱼多糖在免疫器官指数、细胞免疫、体液免疫以及非特异性免疫方面均表现出增强免疫活性的效果,是一种良好的具有免疫调节功能的活性物质。鲍鱼多糖大多采用水提醇沉法、酶解法、超声波辅助、高压脉冲电场辅助等方法提取[9−10],但所得粗多糖中仍含有蛋白质、色素等杂质,影响了多糖品质。Sevag法、酶法和双氧水法是目前常用的鲍鱼多糖除蛋白质、色素的手段[5,11],这些方法操作复杂,试剂耗费量大,且易造成多糖损失,甚至发生降解[12]。相比之下,采用大孔树脂对多糖进行纯化,既可以同时脱除蛋白质和色素,也具有多糖损失量小、成本低、可重复利用等优点[13]。大孔树脂主要是以苯乙烯等化合物作为基本骨架,其所带的功能基不同,表面极性不同,对目标物质的吸附效果也存在差异[14]。大孔树脂按极性一般可分为非极性(如D101、HPD100等)、弱极性(如AB-8、X-5等)和极性树脂(如NKA-9、S-8等)[15],如何筛选合适的大孔树脂纯化鲍鱼多糖尚需深入探究。
在前期研究中,已采用天然低共熔溶剂法从鲍鱼内脏中提取多糖,为提高鲍鱼多糖品质,本研究采用大孔树脂纯化鲍鱼多糖。通过比较6种不同极性的大孔树脂对鲍鱼多糖的纯化效果,筛选适宜的树脂类型;根据单因素实验和响应面分析法对大孔树脂纯化工艺参数进行优化;并利用体外巨噬细胞实验对纯化前后鲍鱼多糖的免疫调节活性进行分析评价,以期为高活性鲍鱼多糖的制备提供理论基础。
1. 材料与方法
1.1 材料与仪器
鲍鱼(Haliotis discus Hannai Ino)内脏 浙江百珍堂食品有限公司提供;牛白蛋白 国药集团化学试剂有限公司;葡萄糖、无水乙醇、苯酚 分析纯,西陇科学股份有限公司;浓硫酸 浙江中星化工试剂有限公司;D101、AB-8大孔树脂 上海源叶生物科技有限公司;S-8、X-5、NKA-9、HPD100大孔树脂 北京瑞达恒辉科技发展有限公司;小鼠单核巨噬细胞白血病细胞(RAW264.7巨噬细胞) 武汉普诺赛生命科技有限公司;RPMI1640培养基、噻唑蓝(3-(4,5-dimethyl- 2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT)、脂多糖(lipopolysaccharide,LPS)、小鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA检测试剂盒、小鼠白介素6(interleukin 6,IL-6)ELISA检测试剂盒 北京索莱宝科技有限公司;胎牛血清 美国Gibco公司;一氧化氮(nitric oxide,NO)检测试剂盒 上海碧云天生物技术有限公司。
BSA124S分析电子天平 德国Sartorius公司;RE-2000B旋转蒸发器 上海亚荣生化仪器厂;HWCL磁力搅拌器 郑州长城科工贸有限公司;HWS-12电热恒温水浴锅 上海一恒科学仪器有限公司;ZWY-2102C恒温培养振荡器 上海智城分析仪器制造有限公司;TU-1950紫外可见光分光光度计 北京普析通用仪器有限责任公司;TD5G台式低速离心机 湖南湘立科学仪器有限公司;KQ-300GVDV恒温数控超声波清洗器 昆山市超声波仪器有限公司;二氧化碳培养箱 普和希健康医疗器械(上海)有限公司;SpectraMax 190全波长酶标仪 美谷分子仪器(上海)有限公司。
1.2 实验方法
1.2.1 鲍鱼多糖提取
本研究采用天然低共熔溶剂提取鲍鱼多糖,具体方法参照前期研究[16]。鲍鱼内脏干燥后经粉碎机粉碎,过60目筛,备用。以氯化胆碱作为氢键受体,以乙二醇作为氢键供体,二者摩尔比为1:3,水含量25%(w/w),利用加热搅拌法在85 ℃下磁力搅拌4 h合成低共熔溶剂。准确称取10 g鲍鱼内脏干燥粉末溶于400 mL低共熔溶剂,混合均匀后,在70 ℃下超声辅助提取40 min。提取结束后,4000×g离心20 min,收集上清液,减压浓缩至合适体积后加入4倍体积的无水乙醇,4 ℃静置过夜后,离心收集沉淀,冻干即得鲍鱼多糖(abalone polysaccharide,AP)。
1.2.2 大孔树脂预处理
将大孔树脂浸泡于95%乙醇溶液中,充分溶胀24 h后,以无水乙醇洗涤至无白色混浊,再以去离子水冲至无乙醇味。然后将树脂浸泡于5% HCl溶液中,3 h后用去离子水冲洗至中性;再将树脂浸泡于5% NaOH溶液中,3 h后以去离子水冲洗至中性,干燥备用[13]。
1.2.3 大孔树脂筛选
本研究共选取6种不同极性的骨架结构为苯乙烯型共聚体的大孔树脂进行静态吸附实验,各树脂型号及其理化性质见表1。
表 1 大孔树脂型号及其理化性质Table 1. Types and physical and chemical properties of macroporous resins型号 粒径范围(mm) 比表面(m2/g) 平均孔径(nm) 极性 外观 D101 0.30~1.25 500~550 9.0~10.0 非极性 乳白色不透明球状颗粒 HPD100 0.30~1.20 650~700 8.5~9.0 非极性 乳白色不透明球状颗粒 AB-8 0.30~1.25 450~530 13.0~14.0 弱极性 乳白色不透明球状颗粒 X-5 0.30~1.25 500~600 29.0~30.0 弱极性 乳白色不透明球状颗粒 NKA-9 0.30~1.25 250~290 15.5~16.5 极性 乳白色至微黄色不透明球状颗粒 S-8 0.32~1.25 100~120 28.0~30.0 极性 乳白色不透明球状颗粒 准确称取各型号预处理后的干燥树脂12 g,置于250 mL三角瓶中,分别加入3 mg/mL AP溶液100 mL,置于恒温培养振荡器中,在35 ℃下150 r/min振荡吸附3 h,每种树脂设置3组平行对照。振荡结束后,室温静置,抽滤并收集滤液[17]。测定吸附后各组滤液中多糖、蛋白含量等,并计算多糖保留率(polysaccharide recovery rate,PRR)、蛋白脱除率(deproteinization rate,DPR)和色素脱除率(decolorization rate,DCR)。采用Abuduwaili等[18]报道的方法,以PRR、DPR和DCR的加权综合得分(comprehensive score,CS)评价树脂对鲍鱼多糖的纯化效果,CS值越高代表树脂纯化效果越好。按照公式(1)计算CS值。
CS(%)=PRR×0.4+DPR×0.3+DCR×0.3 (1) 式中,CS为综合评分,%;PRR为多糖保留率,%;DPR为蛋白脱除率,%;DCR为色素脱除率,%。
1.2.4 多糖含量测定及多糖保留率计算
以葡萄糖为标品,采用苯酚硫酸法测定大孔树脂吸附前与吸附后的多糖溶液在490 nm波长处的吸光度值[19]。根据标准曲线y=8.40x+0.0743(R2=0.9995)计算溶液中多糖质量浓度,并按照公式(2)计算PRR。
PRR(%)=C1×V1C0×V0×100 (2) 式中:PRR为多糖保留率,%;C0表示吸附前溶液中多糖质量浓度,mg/mL;C1表示树脂吸附后滤液中多糖质量浓度,mg/mL;V0表示吸附前溶液体积,mL;V1表示树脂吸附后的滤液体积,mL。
1.2.5 蛋白含量测定及蛋白脱除率计算
以牛白蛋白为标品,采用考马斯亮蓝G-250法测定大孔树脂吸附前与吸附后的多糖溶液在595 nm波长处的吸光度值[20]。根据标准曲线y=3.57x+0.53(R2=0.9931)计算溶液中蛋白质量浓度,并按照公式(3)计算DPR。
DPR(%)=C0×V0−C1×V1C0×V0×100 (3) 式中:DPR为蛋白脱除率,%;C0表示吸附前溶液中蛋白质量浓度,mg/mL;C1表示树脂吸附后滤液中蛋白质浓度,mg/mL;V0表示吸附前溶液体积,mg/mL;V1表示树脂吸附后的滤液体积,mg/mL。
1.2.6 色素脱除率测定及计算
DCR的测定方法参照文献[21]。将吸附前与吸附后的多糖溶液以去离子水稀释到合适浓度后,利用分光光度计分别测定其在420 nm波长下的吸光度值,并按照公式(4)计算DCR。
DCR(%)=A0−A1A0×100 (4) 式中:DCR为色素脱除率,%;A0表示吸附前溶液在420 nm波长下的吸光度值;A1表示树脂吸附后的滤液在420 nm波长下的吸光度值。
1.2.7 大孔树脂纯化工艺的单因素实验
在筛选出适合的大孔树脂型号后,对其多糖纯化工艺进行单因素实验,分别考察多糖与树脂质量比、吸附时间和吸附温度对多糖纯化效果的影响。
1.2.7.1 多糖与树脂质量比对纯化效果的影响
取筛选的大孔树脂12 g置于三角瓶中,分别加入100 mL浓度为12、6、4、3、2.4 mg/mL AP溶液,即多糖与树脂质量比(w/w)分别为1:10、1:20、1:30、1:40、1:50,在35 ℃条件下振荡3 h后,静置、抽滤并收集滤液。测定滤液中多糖质量浓度和蛋白质量浓度,并计算PRR、DPR、DCR和CS,确定合适的多糖与树脂质量比。
1.2.7.2 吸附时间对纯化效果的影响
取筛选的大孔树脂12 g置于三角瓶中,加入100 mL浓度为3 mg/mL AP溶液,在35 ℃条件下分别振荡1、2、3、4、5 h后,静置,抽滤并收集各滤液。测定滤液中多糖质量浓度和蛋白质量浓度,并计算PRR、DPR、DCR和CS,确定合适的大孔树脂吸附时间。
1.2.7.3 吸附温度对多糖纯化效果的影响
取筛选的大孔树脂12 g置于三角瓶中,加入100 mL浓度为3 mg/mL AP溶液(提前预热至吸附温度),分别在25、30、35、40、45 ℃下振荡3 h后,静置、抽滤并收集各滤液。测定滤液中多糖质量浓度和蛋白质量浓度,并计算PRR、DPR、DCR和CS,确定合适的大孔树脂吸附温度。
1.2.8 响应面法优化设计
根据Box-Behnken试验设计原理,在单因素实验的基础上,采用Design Expert 11.0软件对影响大孔树脂纯化效果的因素进行三因素三水平的响应面优化设计,试验因素与水平设计见表2。
表 2 响应面试验因素水平Table 2. Factors and levels of response surface experiment水平 因素 A多糖与树脂质量比(w/w) B吸附时间(h) C吸附温度(℃) −1 1:30 2 30 0 1:40 3 35 1 1:50 4 40 1.2.9 鲍鱼多糖的免疫调节活性评价
1.2.9.1 细胞培养
将RAW264.7巨噬细胞接种于RPMI 1640培养基(含10%胎牛血清、1%青霉素-链霉素)中,在37 ℃、5%(v/v)CO2培养箱中进行培养。每天观察细胞生长状况,并定期更换培养基,至对数生长期可用于实验。
1.2.9.2 细胞增殖活力
根据SLERIA等[22]报道,取对数生长期RAW264.7巨噬细胞,接种于96孔板中,待细胞完全贴壁后,弃去旧培养基,分别加入含不同浓度(50、100、200 μg/mL)AP的新鲜培养基,空白组(Control,Con)中加入未含AP的培养基,每组8个复孔。采用MTT法测定RAW264.7巨噬细胞的增殖活力[23]。细胞在37 ℃、5%(v/v)CO2条件下培养24 h后,向每孔加入10 μL 5 mg/mL MTT溶液。继续孵育4 h后,弃去上清液,以磷酸盐缓冲液冲洗后向每孔中加入200 μL二甲基亚砜(DMSO)充分溶解紫色结晶,并测定各孔在570 nm波长处吸光度值,按照公式(5)计算细胞相对增殖率,以细胞相对增殖率表征细胞增殖活力。
细胞相对增殖率(%)=A1A0×100 (5) 式中:A0表示空白组在570 nm波长处吸光度值;A1表示给药组在570 nm波长处吸光度值。
1.2.9.3 细胞因子分泌水平
取对数生长期RAW264.7巨噬细胞接种于96孔板中,待细胞完全贴壁后,加入不同浓度(0、50、100、200 μg/mL)的以新鲜培养基作为溶剂配制的AP溶液,以1 μg/mL LPS作为阳性对照,在37 ℃、5%(v/v)CO2条件下孵育24 h,每组8个复孔。孵育结束后,根据NO检测试剂盒的操作说明测定各组上清液中NO含量。取对数生长期RAW264.7巨噬细胞接种于24孔板中,待细胞完全贴壁后,采用不同浓度(0、50、100、200 μg/mL)AP溶液在37 ℃、5%(v/v)CO2条件下孵育24 h,每组6个复孔。根据各酶联免疫试剂盒的操作说明分别测定上清液中TNF-α和IL-6的含量。
1.3 数据处理
所有实验均重复3次,数据结果以平均值±标准差表示。试验数据通过SPSS 24.0统计软件进行分析,单因素方差分析(ANOVA),采用Duncan检验进行显著性分析,P<0.05表示差异显著,采用Origin Pro软件制图。
2. 结果与分析
2.1 大孔树脂筛选
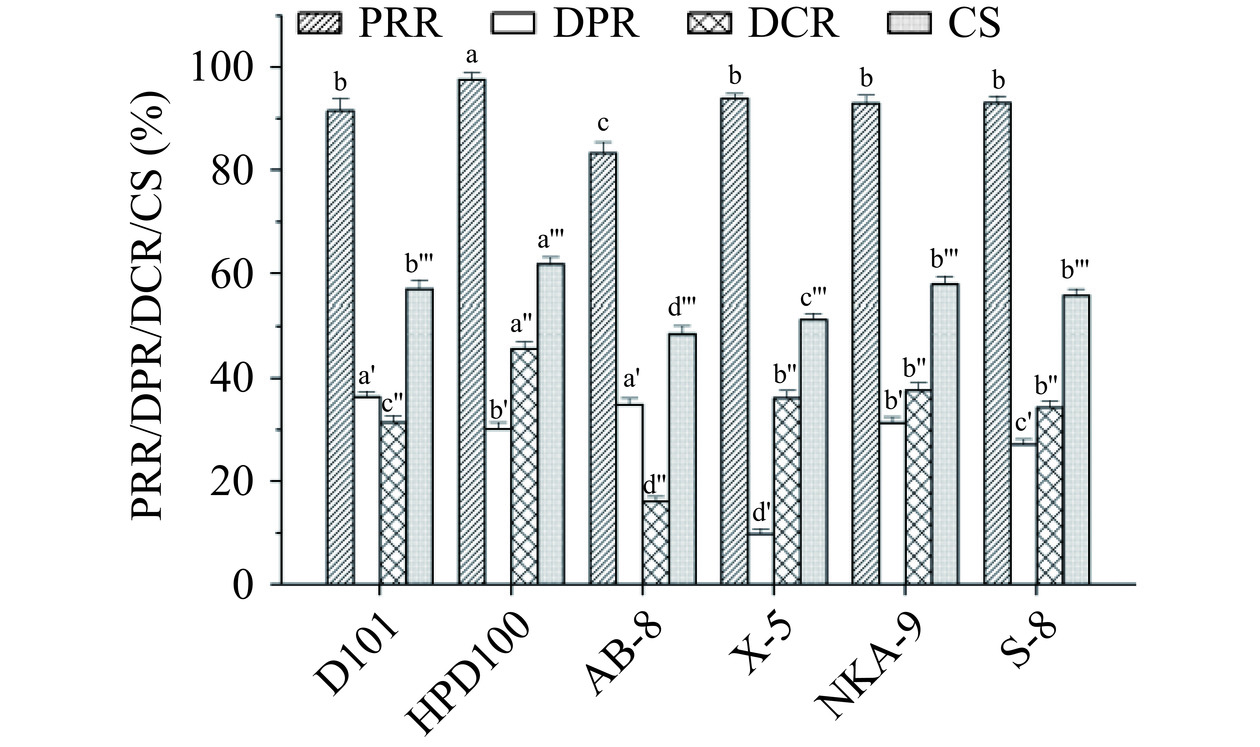
大孔树脂作为有机高聚物吸附剂,具有同时除蛋白和脱色的双重功能,已成为目前多糖纯化的一种重要方法[13,18]。本研究共考察了6种不同型号的大孔树脂对鲍鱼多糖的纯化效果,结果如图1所示。各大孔树脂的PRR由高到低依次为HPD100>X-5>S-8>NKA-9>D101>AB-8,其中HPD100的多糖保留效果显著优于其他型号树脂(P<0.05),PRR高达97.60%±1.38%。HPD100作为一种孔径较小的非极性大孔树脂,其较好的多糖保留效果提示所提取的鲍鱼多糖主要为分子量较大的极性分子,这与前期的文献报道相一致[9]。此外,6种大孔树脂均具有一定的蛋白质和色素脱除能力。D101和AB-8的蛋白清除效果较好,它们的DPR分别为36.43%±1.02%和34.92%±1.25%,二者之间并无显著差异(P>0.05)。相比之下,X-5的蛋白脱除效果最差,DPR仅为9.79%±0.98%。在色素脱除效果方面,HPD100的脱色效果最佳,DCR为45.71%±1.44%,其次是NKA-9、X-5和S-8。采用加权求和法对各大孔树脂的多糖纯化效果进行综合比较,由图1可知,HPD100的综合得分最高,因此选择HPD100对鲍鱼多糖进行纯化工艺优化。
2.2 多糖纯化工艺的单因素实验
2.2.1 多糖与树脂质量比对多糖纯化效果的影响
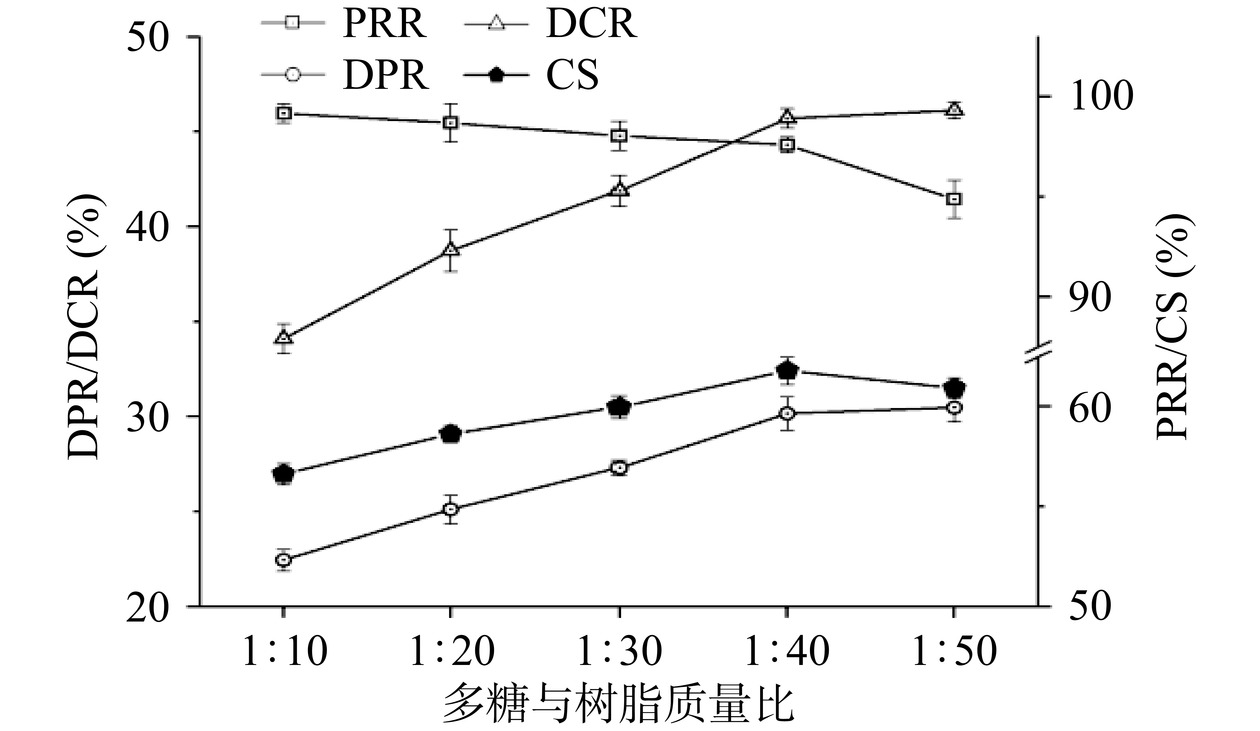
吸附介质对目标化合物的吸附处于动态平衡过程,这种平衡既受到吸附介质用量的影响,也会受到化合物浓度的影响[24]。在样品浓度一定时,随着树脂用量的增加,蛋白质和色素的脱除效果会有所提高,然而大孔树脂在吸附蛋白质和色素的同时,也会吸附多糖,因而过量的树脂可能会导致多糖保留率的下降[25]。另一方面,当吸附介质量不变时,适当增加待吸附物质的浓度有利于吸附作用,但过高的浓度会影响目标化合物与树脂的充分接触,甚至可能造成树脂过载、堵塞等现象,导致吸附效率降低[26]。在本研究中,以多糖与树脂质量比为指标评价树脂吸附平衡对纯化效果的影响。如图2所示,多糖与树脂质量比由1:10增加至1:40时,DPR和DCR呈上升趋势,PRR呈下降趋势,CS不断增加;然而当多糖与树脂质量比继续增加至1:50时,蛋白质和色素的清除效果未见明显提高,但PRR大幅降低,CS随之下降。因此,选择1:40作为最适的多糖与树脂质量比。
2.2.2 吸附时间对纯化效果的影响
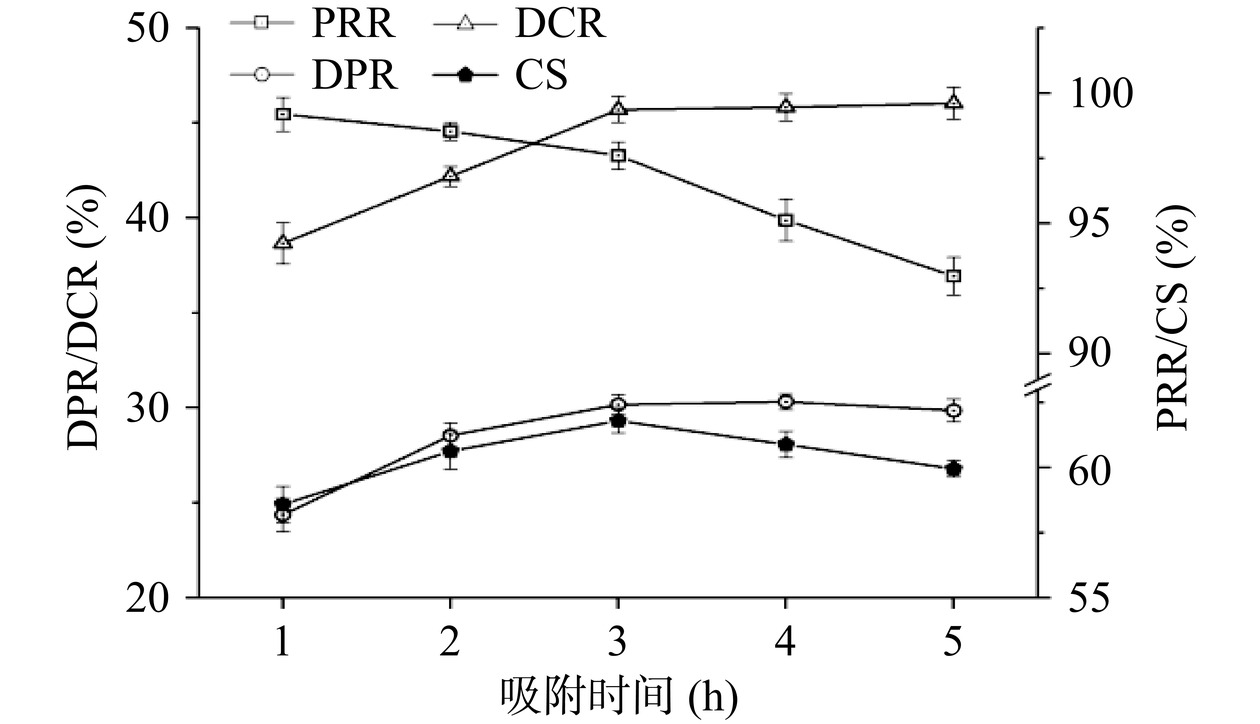
吸附时间的合理增加有利于目标化合物与树脂的充分接触,继而增强吸附效果[27]。如图3所示,当吸附时间仅为1 h时,蛋白质和色素的吸附效果较差,DPR和DCR分别仅为24.37%±0.87%和38.66%±1.09%;随吸附时间延长至 3 h,DPR 和 DCR分别提高 23.80% 和 18.21%;但当树脂对目标物质的吸附达到平衡后,DPR 和 DCR 不再随吸附时间的增加而发生变化,该变化趋势与郭静等[14]的报道一致。由图3可知,在实验时间范围内,吸附时间与PRR呈反比,即随吸附时间的延长,多糖保留率不断下降;CS呈现出先上升后下降的趋势,在吸附时间3 h时达到峰值。因此,选择3 h作为最适的吸附时间。
2.2.3 吸附温度对纯化效果的影响
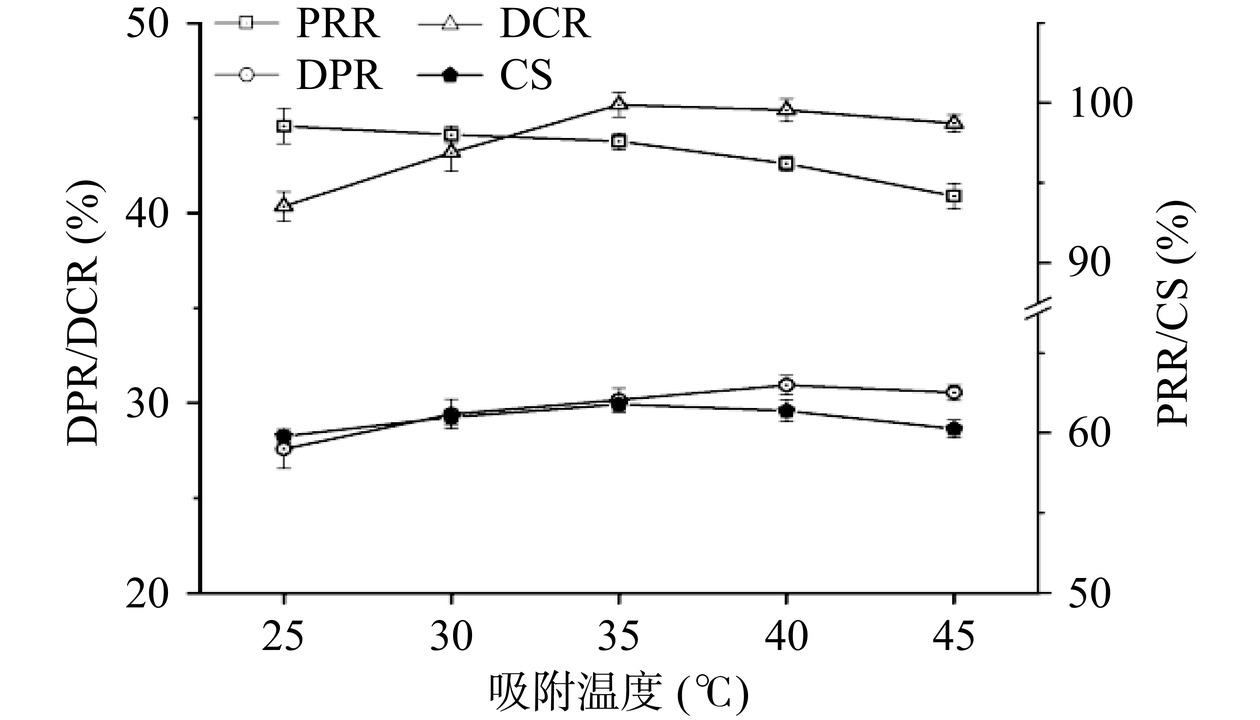
吸附温度在一定范围内的升高可以增强树脂对化合物的吸附速度,继而提升吸附效率[28]。谢三都等[29]提出升温有利于树脂对色素的吸附作用,但过高的温度可能会导致色素分子热运动激烈,不易形成分子键与目标物质键合,进而影响吸附稳定性。如图4所示,吸附温度对PRR和DCR的影响相对较大,对DPR的影响则相对较小。随吸附温度的不断升高,PRR持续下降,且呈现出温度越高,下降速率越快的趋势。在25 ℃条件下,DCR相对较低,仅为40.36%±0.78%;随吸附温度的升高,DCR明显增加,在35 ℃时达到最大值;继续升高温度,DCR呈下降趋势,这可能与吸附稳定性的下降有关。在实验温度范围内,CS先上升后下降,在35 ℃时达到峰值。因此,选择35 ℃作为最适的吸附温度。
2.3 多糖纯化工艺响应面分析
2.3.1 响应面试验结果
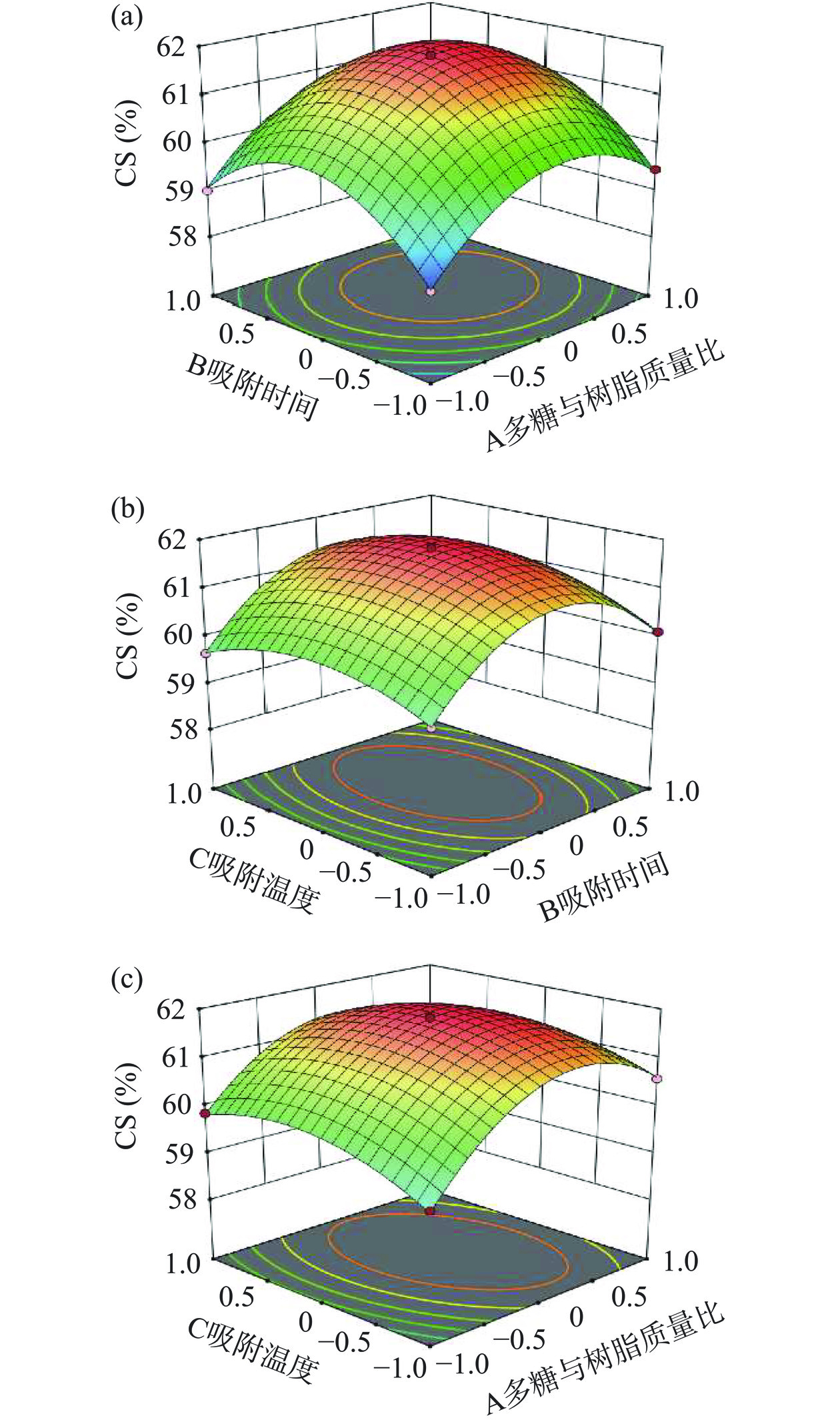
在单因素实验的基础上,进行三因素三水平响应面设计,结果见表3。采用Design Expert 11.0软件对实验数据进行二次多项回归拟合,得模型方程为:CS=61.80+0.4837A+0.3030B+0.0882C+0.0377AB−0.1698AC+0.0507BC−1.21A2−1.32B2−0.5490C2。对该模型回归方程进行方差分析及显著性检验,结果如表4所示。回归模型P<0.01,说明模型具有较好的稳定性;模型失拟项P>0.05,不具有显著性差异,且预测R2=0.9894,表明该模型可靠;此外,变异系数CV=0.077%,说明模型外因素对模型响应值的影响较小,上述数据均表明该模型可用于对实际实验结果的预测。由表4可知,多糖与树脂质量比(A)、吸附时间(B)和吸附温度(C)三个因素对鲍鱼多糖纯化效果的综合得分CS都具有极显著性影响(P<0.01),其中F(A)=874.74,F(B)=343.18,F(C)=29.11,根据F值可知多糖与树脂质量比(A)对CS的影响最大,其次是吸附时间(B),最后是吸附温度(C)。
表 3 响应面试验设计与结果Table 3. Design and results of response surface experiment试验号 A多糖与树脂质量比(w/w) B吸附时间(h) C吸附温度(℃) PRR(%) DPR(%) DCR(%) CS(%) 1 1:50 3 40 94.34 29.75 45.82 60.41 2 1:40 3 35 97.6 30.17 45.69 61.80 3 1:40 3 35 97.68 30.21 45.59 61.81 4 1:30 3 40 97.05 28.15 41.96 59.85 5 1:40 2 40 97.94 27.69 40.57 59.65 6 1:50 4 35 93.72 30.14 45.29 60.12 7 1:50 3 30 97.74 29.26 42.33 60.57 8 1:30 2 35 97.61 25.08 39.76 58.50 9 1:40 3 35 97.67 30.15 45.74 61.84 10 1:40 2 30 98.54 27.43 39.77 59.58 11 1:40 3 35 97.71 30.19 45.56 61.81 12 1:40 4 30 95.3 28.97 44.32 60.11 13 1:50 2 35 96.23 28.09 41.81 59.46 14 1:40 4 40 94.27 31.08 44.52 60.39 15 1:30 3 30 98.22 26.99 39.85 59.34 16 1:30 4 35 95.84 28.25 40.63 59.00 17 1:40 3 35 97.75 30.03 45.52 61.77 表 4 回归模型的方差分析及显著性检验Table 4. Variance analysis and significance test of regression model方差来源 平方和 自由度 均值 F值 P值 显著性 模型 19.12 9 2.12 992.74 <0.0001 ** A 1.87 1 1.87 874.74 <0.0001 ** B 0.7345 1 0.7345 343.18 <0.0001 ** C 0.0623 1 0.0623 29.11 0.001 ** AB 0.0057 1 0.0057 2.66 0.1467 AC 0.1153 1 0.1153 53.86 0.0002 ** BC 0.0103 1 0.0103 4.81 0.0643 A2 6.18 1 6.18 2887.68 <0.0001 ** B2 7.38 1 7.38 3446.27 <0.0001 ** C2 1.27 1 1.27 593.02 <0.0001 ** 残差 0.0150 7 0.0021 失拟项 0.0124 3 0.0041 6.33 0.0534 纯误差 0.0026 4 0.0007 总和 19.14 16 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 2.3.2 各因素响应面分析
响应面图可直观反映出各因素之间交互作用的显著性。通常,响应面图中的等高线形状呈椭圆形表明因素之间交互作用影响显著,若等高线趋近于圆形则说明各因素交互作用不显著[30]。图5为本实验中各因素交互作用对鲍鱼多糖纯化效果影响的响应面图。如图5(a)所示,多糖与树脂质量比(A)与吸附时间(B)的等高线接近于圆形,说明二者交互作用并不显著,这与表4中AB的P值(P=0.1467)相一致。类似地,如图5(b)所示,吸附时间(B)与吸附温度(C)之间交互作用对多糖纯化效果的影响也不显著(P=0.0643)。而如图5(c)所示,多糖与树脂质量比(A)与吸附温度(C)的等高线呈椭圆形,表明多糖与树脂质量比与吸附温度之间的交互作用对纯化效果具有显著影响,这与方差分析中AC较小的P值(P=0.0002)相一致。
2.3.3 最佳纯化工艺验证
以纯化效果综合得分CS为响应值,根据Design expert 11.0软件对所得回归方程进行预测,得最佳工艺参数为:多糖与树脂质量比1:42.40、吸附时间3.10 h、吸附温度35.39 ℃,在该条件下预测CS值为61.86%。根据实际操作可行性,将工艺参数修订为:多糖与树脂质量比1:42、吸附时间3.10 h、吸附温度35 ℃,在此条件下重复实验,测得PRR为97.58%±1.58%,DPR为30.20%±0.66%,DCR为45.78%±1.01%,经过计算得CS平均值为61.83%,与预测值差距较小,说明该模型可用于预测实际实验数据。鲍鱼多糖经HPD100大孔树脂纯化后,多糖颜色明显变浅,且多糖纯度由58.74%提升至63.03%,类似膜法纯化的鲍鱼多糖纯度(62.75%)[9],明显优于酶法纯化的鲍鱼多糖纯度(40.64%)[8]。
2.4 鲍鱼多糖的免疫调节活性
2.4.1 细胞增殖活力
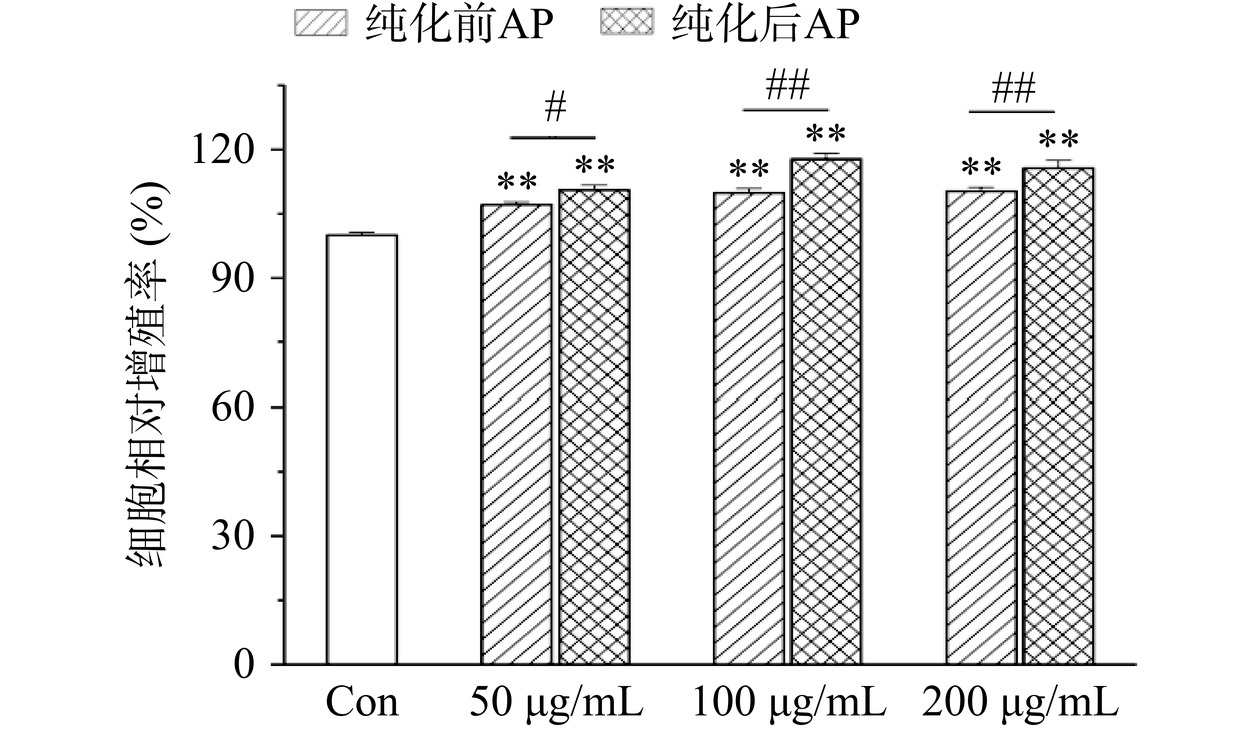
巨噬细胞是机体重要的免疫细胞,能够吞噬并杀伤多种入侵的病毒微生物,同时激活淋巴细胞或其他免疫细胞,诱发机体免疫响应[31]。RAW264.7巨噬细胞是小鼠单核巨噬细胞白血病细胞,目前已广泛应用于活性物质的体内外免疫调节活性研究[32−33]。AP经大孔树脂纯化前后对RAW264.7巨噬细胞增殖活力的影响如图6所示。由图可知,与对空白组Con相比,AP在大孔树脂纯化前后均可极显著促进RAW264.7巨噬细胞的增殖活力(P<0.01),表明鲍鱼多糖对细胞无毒性作用。纯化前的AP对RAW264.7巨噬细胞细胞增殖活力的影响在50~200 μg/mL范围内呈现出剂量依赖关系,在200 μg/mL达到最大细胞相对增殖率110.27%;而经过HPD100纯化后,细胞相对增殖率呈先上升后下降的趋势,在100 μg/mL浓度下达到最大细胞相对增殖率117.81%,极显著高于纯化前相应结果(P<0.01),这可能与树脂纯化后多糖纯度提升、杂质种类及含量下降等有关。
![]() 图 6 大孔树脂纯化前后的鲍鱼多糖对RAW264.7巨噬细胞相对增殖率的影响注:与空白组Con相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与同浓度多糖纯化前相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);图7同。Figure 6. Effects of abalone polysaccharides before and after purification by microporous resin on the cell viability of RAW264.7 macrophages
图 6 大孔树脂纯化前后的鲍鱼多糖对RAW264.7巨噬细胞相对增殖率的影响注:与空白组Con相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与同浓度多糖纯化前相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);图7同。Figure 6. Effects of abalone polysaccharides before and after purification by microporous resin on the cell viability of RAW264.7 macrophages2.4.2 细胞因子分泌水平
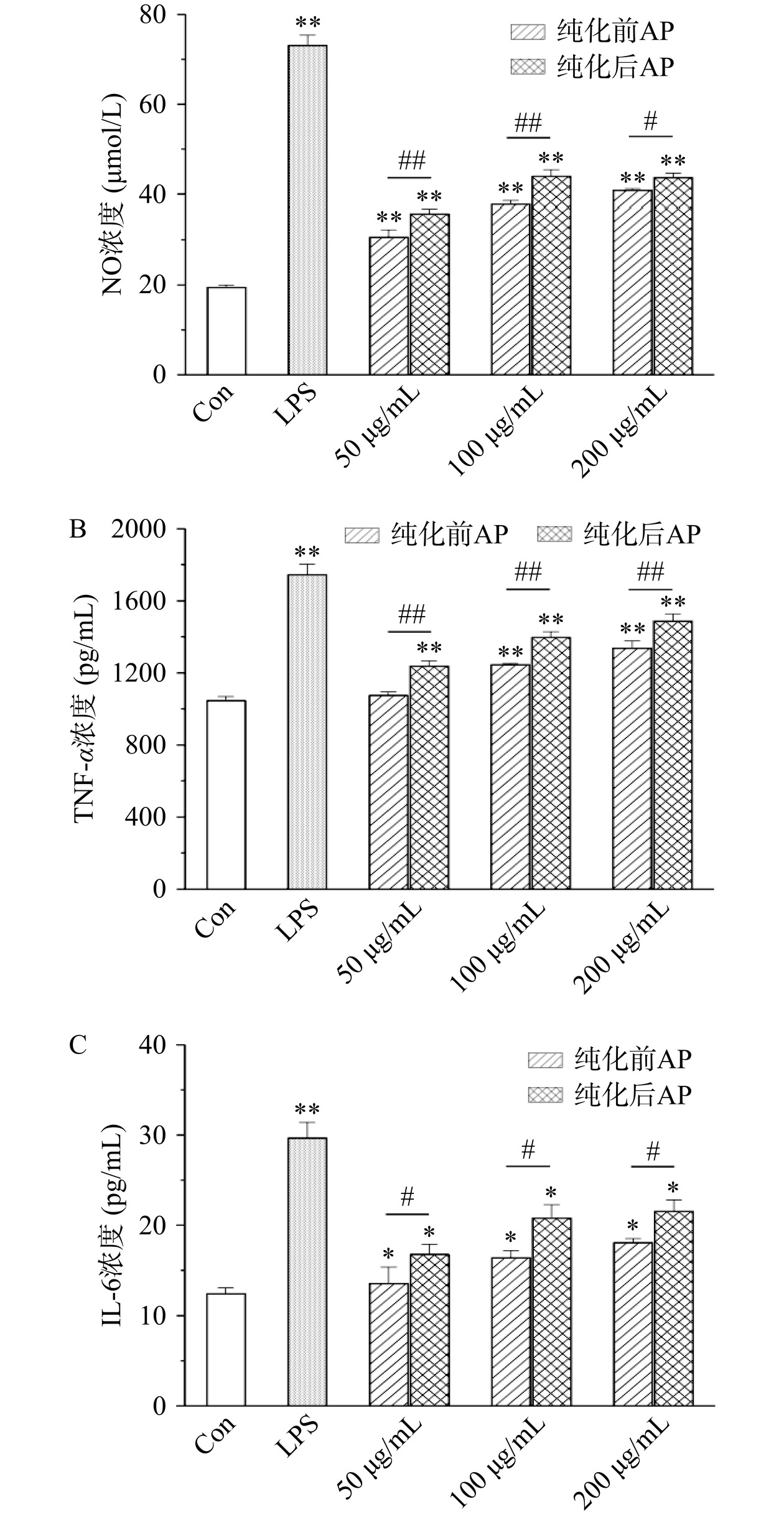
近年来多项研究已发现,生物活性多糖能够通过巨噬细胞表面多种受体诱导信号转导,调控细胞功能与相关细胞免疫调节因子的表达,而起到免疫调节功效[34−35]。NO是由激活的巨噬细胞所产生的免疫调节关键因子,其作为生物信息传递分子,能够有效发挥免疫调节作用[36]。因此,NO的释放量常用于作为评价巨噬细胞活力的重要指标之一。如图7A所示,大孔树脂纯化前后的AP在50~200 μg/mL浓度范围内都可以极显著促进NO产生(P<0.01),且纯化后的多糖处理组在各浓度下NO的浓度均显著高于纯化前多糖处理组(P<0.05),这表明纯化后的多糖更有利于刺激RAW264.7巨噬细胞释放NO参与免疫应答。TNF-α是主要由巨噬细胞所分泌的一种特殊细胞因子,其能够直接杀伤肿瘤细胞但对正常细胞无明显毒性,因而具有免疫调节功能[37]。大孔树脂纯化前后AP对RAW264.7巨噬细胞分泌TNF-α的影响如图7B所示。与对照组相比,采用100和200 μg/mL的纯化前AP以及各浓度的纯化后AP处理都可以有效刺激RAW264.7巨噬细胞分泌TNF-α(P<0.01),且纯化后多糖的作用效果极显著优于纯化前(P<0.01)。此外,IL-6作为一种多效细胞因子,可以通过诱导B细胞分化产生免疫球蛋白,促进T细胞增殖生长,增强血细胞分化等在宿主防御中发挥重要作用[38]。由图7C可知,50~200 μg/mL浓度范围的纯化前和纯化后的AP均可以显著提高RAW264.7巨噬细胞释放IL-6(P<0.05),且纯化后的多糖处理组的IL-6水平与纯化前多糖处理组相比有显著提高(P<0.05)。综合上述实验结果可知,AP具有一定的体外免疫调节活性,且AP在经过HPD100大孔树脂纯化后,其免疫调节活性得到显著提升。
3. 结论
本研究考察了6种不同型号的大孔树脂对鲍鱼多糖的纯化效果,筛选出静态吸附纯化效果最佳的大孔树脂为HPD100,并利用单因素实验及响应面分析法优化出了鲍鱼多糖的最佳纯化工艺条件。研究结果表明,鲍鱼多糖的纯度经HPD100纯化后提升至63.03%,纯化效果优于酶法,且纯化成本更低;同时,纯化后的鲍鱼多糖生物活性有所提高,其体外免疫调节能力显著增强,这为高品质鲍鱼活性多糖的制备提供理论基础。
-
图 6 大孔树脂纯化前后的鲍鱼多糖对RAW264.7巨噬细胞相对增殖率的影响
注:与空白组Con相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与同浓度多糖纯化前相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);图7同。
Figure 6. Effects of abalone polysaccharides before and after purification by microporous resin on the cell viability of RAW264.7 macrophages
表 1 大孔树脂型号及其理化性质
Table 1 Types and physical and chemical properties of macroporous resins
型号 粒径范围(mm) 比表面(m2/g) 平均孔径(nm) 极性 外观 D101 0.30~1.25 500~550 9.0~10.0 非极性 乳白色不透明球状颗粒 HPD100 0.30~1.20 650~700 8.5~9.0 非极性 乳白色不透明球状颗粒 AB-8 0.30~1.25 450~530 13.0~14.0 弱极性 乳白色不透明球状颗粒 X-5 0.30~1.25 500~600 29.0~30.0 弱极性 乳白色不透明球状颗粒 NKA-9 0.30~1.25 250~290 15.5~16.5 极性 乳白色至微黄色不透明球状颗粒 S-8 0.32~1.25 100~120 28.0~30.0 极性 乳白色不透明球状颗粒 表 2 响应面试验因素水平
Table 2 Factors and levels of response surface experiment
水平 因素 A多糖与树脂质量比(w/w) B吸附时间(h) C吸附温度(℃) −1 1:30 2 30 0 1:40 3 35 1 1:50 4 40 表 3 响应面试验设计与结果
Table 3 Design and results of response surface experiment
试验号 A多糖与树脂质量比(w/w) B吸附时间(h) C吸附温度(℃) PRR(%) DPR(%) DCR(%) CS(%) 1 1:50 3 40 94.34 29.75 45.82 60.41 2 1:40 3 35 97.6 30.17 45.69 61.80 3 1:40 3 35 97.68 30.21 45.59 61.81 4 1:30 3 40 97.05 28.15 41.96 59.85 5 1:40 2 40 97.94 27.69 40.57 59.65 6 1:50 4 35 93.72 30.14 45.29 60.12 7 1:50 3 30 97.74 29.26 42.33 60.57 8 1:30 2 35 97.61 25.08 39.76 58.50 9 1:40 3 35 97.67 30.15 45.74 61.84 10 1:40 2 30 98.54 27.43 39.77 59.58 11 1:40 3 35 97.71 30.19 45.56 61.81 12 1:40 4 30 95.3 28.97 44.32 60.11 13 1:50 2 35 96.23 28.09 41.81 59.46 14 1:40 4 40 94.27 31.08 44.52 60.39 15 1:30 3 30 98.22 26.99 39.85 59.34 16 1:30 4 35 95.84 28.25 40.63 59.00 17 1:40 3 35 97.75 30.03 45.52 61.77 表 4 回归模型的方差分析及显著性检验
Table 4 Variance analysis and significance test of regression model
方差来源 平方和 自由度 均值 F值 P值 显著性 模型 19.12 9 2.12 992.74 <0.0001 ** A 1.87 1 1.87 874.74 <0.0001 ** B 0.7345 1 0.7345 343.18 <0.0001 ** C 0.0623 1 0.0623 29.11 0.001 ** AB 0.0057 1 0.0057 2.66 0.1467 AC 0.1153 1 0.1153 53.86 0.0002 ** BC 0.0103 1 0.0103 4.81 0.0643 A2 6.18 1 6.18 2887.68 <0.0001 ** B2 7.38 1 7.38 3446.27 <0.0001 ** C2 1.27 1 1.27 593.02 <0.0001 ** 残差 0.0150 7 0.0021 失拟项 0.0124 3 0.0041 6.33 0.0534 纯误差 0.0026 4 0.0007 总和 19.14 16 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 -
[1] 农业农村部渔业渔政管理局. 2022中国渔业统计年鉴[M]. 北京:中国农业出版社, 2022. [Ministry of Agriculture and Administration of Fisheries and Fishery Administration. 2022 China fisheries statistical yearbook[M]. Beijing:China Agricultural Press, 2022.] Ministry of Agriculture and Administration of Fisheries and Fishery Administration. 2022 China fisheries statistical yearbook[M]. Beijing: China Agricultural Press, 2022.
[2] SULERIA H A R, MASCI P P, ADDEPALLI R, et al. In vitro anti-thrombotic and anti-coagulant properties of blacklip abalone (Haliotis rubra) viscera hydrolysate[J]. Analytical and Bioanalytical Chemistry,2017,409(17):4195−4205. doi: 10.1007/s00216-017-0367-x
[3] 陈胜军, 杨少玲, 刘先进, 等. 鲍鱼及其副产物组合加工利用研究进展[J]. 肉类研究,2019,33(10):76−81. [CHEN S J, YANG S L, LIU X J, et al. Recent progress in comprehensive processing and utilization of abalone and its byproducts[J]. Meat Research,2019,33(10):76−81.] CHEN S J, YANG S L, LIU X J, et al. Recent progress in comprehensive processing and utilization of abalone and its byproducts[J]. Meat Research, 2019, 33(10): 76−81.
[4] 路海霞, 刘智禹, 吴靖娜, 等. 鲍内脏功能成分及其活性研究进展[J]. 福建水产,2015,37(5):426−432. [LU H X, LIU Z Y, WU J N, et al. Research progress in functional components and their activities of abalone viscera[J]. Journal of Fujian Fisheries,2015,37(5):426−432.] LU H X, LIU Z Y, WU J N, et al. Research progress in functional components and their activities of abalone viscera[J]. Journal of Fujian Fisheries, 2015, 37(5): 426−432.
[5] ZHANG R J, SHI Y, ZHENG J, et al. Effects of polysaccharides from abalone viscera (Haliotis discus hannai Ino) on MGC 803 cells proliferation[J]. International Journal of Biological Macromolecules,2018,106:587−595. doi: 10.1016/j.ijbiomac.2017.08.055
[6] YIM S K, KIM K, KIM I H, et al. Inhibition of SARS-CoV-2 virus entry by the crude polysaccharides of seaweeds and abalone viscera in vitro[J]. Marine Drugs,2021,19(4):219. doi: 10.3390/md19040219
[7] 魏好程, 邵杰, 何传波, 等. 鲍内脏多糖体内抗氧化及增强小鼠免疫活性[J]. 食品科学,2018,39(9):140−144. [WEI H C, SHAO J, HE C B, et al. In vivo antioxidant capacity and immunoenhancing activity in mice of polysaccharides from abalone viscera[J]. Food Science,2018,39(9):140−144.] doi: 10.7506/spkx1002-6630-201809022 WEI H C, SHAO J, HE C B, et al. In vivo antioxidant capacity and immunoenhancing activity in mice of polysaccharides from abalone viscera[J]. Food Science, 2018, 39(9): 140−144. doi: 10.7506/spkx1002-6630-201809022
[8] SUN L M, ZHU B W, LI D M, et al. Purification and bioactivity of a sulphated polysaccharide conjugate from viscera of abalone Haliotis discus hannai Ino[J]. Food and Agricultural Immunology,2010,21(1):15−26. doi: 10.1080/09540100903418859
[9] GUO S, WANG J, HE C B, et al. Preparation and antioxidant activities of polysaccharides obtained from abalone viscera by combination of enzymolysis and multiple separation methods[J]. Journal of Food Science,2020,85:4260−4270. doi: 10.1111/1750-3841.15520
[10] LIU B X, JIA Z, LI C C, et al. Hypolipidemic and anti-atherogenic activities of crude polysaccharides from abalone viscera[J]. Food Science & Nutrition,2020,8:2524−2534.
[11] 陈胜军, 刘先进, 杨贤庆, 等. 鲍鱼内脏多糖分离纯化与抗氧化活性评价[J]. 南方农业学报,2019,50(2):372−377. [CHEN S J, LIU X J, YANG X Q, et al. Isolation and purification of visceral polysaccharides from abalone and its antioxidant activity[J]. Journal of Southern Agriculture,2019,50(2):372−377.] doi: 10.3969/j.issn.2095-1191.2019.02.22 CHEN S J, LIU X J, YANG X Q, et al. Isolation and purification of visceral polysaccharides from abalone and its antioxidant activity[J]. Journal of Southern Agriculture, 2019, 50(2): 372−377. doi: 10.3969/j.issn.2095-1191.2019.02.22
[12] 信传鑫, 杨金涛, 戴晓婧, 等. 大孔树脂吸附桦褐孔菌多糖色素的机理及工艺优化[J]. 食品工业科技,2021,42(22):193−201. [XIN C X, YANG J T, DAI X J, et al. Adsorption mechanism and process optimization of Inonotus obliquus polysaccharide pigment by macroporous resin[J]. Journal of Southern Agriculture,2021,42(22):193−201.] XIN C X, YANG J T, DAI X J, et al. Adsorption mechanism and process optimization of Inonotus obliquus polysaccharide pigment by macroporous resin[J]. Journal of Southern Agriculture, 2021, 42(22): 193−201.
[13] LIANG L, LIU G M, YU G Y, et al. Simultaneous decoloration and purification of crude oligosaccharides from pumpkin (Cucurbita moschata Duch) by macroporous adsorbent resin[J]. Food Chemistry,2019,277:744−752. doi: 10.1016/j.foodchem.2018.10.138
[14] 郭静, 赵鸿燕, 李莉, 等. 油樟叶多糖的大孔树脂纯化工艺研究[J]. 离子交换与吸附,2023,39(2):147−156. [GUO J, ZHAO H Y, LI L, et al. Purification technology of polysaccharide from Cinnamomum longepaniculatum leaves by macroporous resin[J]. Ion Exchange and Adsorption,2023,39(2):147−156.] GUO J, ZHAO H Y, LI L, et al. Purification technology of polysaccharide from Cinnamomum longepaniculatum leaves by macroporous resin[J]. Ion Exchange and Adsorption, 2023, 39(2): 147−156.
[15] 王丹丹, 刘芫汐, 左甜甜, 等. 大孔吸附树脂及其在中药领域应用研究进展[J]. 中国药事,2022,36(7):826−835. [WANG D D, LIU Y X, ZUO T T, et al. Research progress of macroporous adsorption resin and its application in traditional Chinese medicines[J]. Chinese Pharmaceutical Affairs,2022,36(7):826−835.] WANG D D, LIU Y X, ZUO T T, et al. Research progress of macroporous adsorption resin and its application in traditional Chinese medicines[J]. Chinese Pharmaceutical Affairs, 2022, 36(7): 826−835.
[16] QU H, WU Y, LUO Z S, et al. An efficient approach for extraction of polysaccharide from abalone (Haliotis discus hannai Ino) viscera by natural deep eutectic solvent[J]. International Journal of Biological Macromolecules,2023,244:125336. doi: 10.1016/j.ijbiomac.2023.125336
[17] LU F, ZHAI R R, RUAN S Y, et al. Enhancement of ultrasound on the dynamic decolorization of wolfberry (Lycium barbarum) polysaccharides[J]. LWT-Food Science and Technology,2021,145:111384. doi: 10.1016/j.lwt.2021.111384
[18] ABUDUWAILI A, NUERXIATI R, MUTAILIFU P, et al. Isolation, structural modification, characterization, and bioactivity of polysaccharides from Folium isatidis[J]. Industrial Crops & Products,2022,176:114319.
[19] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Biochemistry,1956,28(3):350−356.
[20] 赵丹洁, 唐鹏, 田冬梅, 等. 金线莲多糖纯化工艺及其抗氧化活性研究[J]. 食品研究与开发,2021,42(20):116−123. [ZHAO D J, TANG P, TIAN D M, et al. Study on purification technology and antioxidant activity of polysaccharides from Anoectochilus roxburghii[J]. Food Research and Development,2021,42(20):116−123.] doi: 10.12161/j.issn.1005-6521.2021.20.017 ZHAO D J, TANG P, TIAN D M, et al. Study on purification technology and antioxidant activity of polysaccharides from Anoectochilus roxburghii[J]. Food Research and Development, 2021, 42(20): 116−123. doi: 10.12161/j.issn.1005-6521.2021.20.017
[21] WANG Q, YING T, JAHANGIR M M, et al. Study on removal of coloured impurity in soybean oligosaccharides extracted from sweet slurry by adsorption resins[J]. Journal of Food Engineering,2012,111(2):386−393. doi: 10.1016/j.jfoodeng.2012.02.005
[22] SULERIA H A R, ADDEPALLI R, MASCI P, et al. In vitro anti-inflammatory activities of blacklip abalone (Haliotis rubra) in RAW264.7 macrophages[J]. Food and Agricultural Immunology, 2017, 28(4):711−724. ].
[23] GU J Y, ZHANG H H, WEN C T, et al. Purification, characterization, antioxidant and immunological activity of polysaccharide from Sagittaria sagittifolia L.[J]. Food Research International,2020,136:109345. doi: 10.1016/j.foodres.2020.109345
[24] PAN F, LI S H, ZHU X T, et al. Purification and the effects on structure and bioactivity for polysaccharide from Actinidia valvata Dunn. using macroporous adsorption resin[J]. Food Science and Technology,2022,42:e99721. doi: 10.1590/fst.99721
[25] 邱晓月, 景永帅, 李朋月, 等. 祁白芷多糖脱色工艺优化及抗氧化活性研究[J]. 食品安全质量检测学报,2022,13(18):6074−6081. [QIU X Y, JING Y S, LI P Y, et al. Study on optimization of decolorization process and antioxidant activity of polysaccharide from Angelicae dahurica[J]. Journal of Food Safety and Quality,2022,13(18):6074−6081.] doi: 10.3969/j.issn.2095-0381.2022.18.spaqzljcjs202218037 QIU X Y, JING Y S, LI P Y, et al. Study on optimization of decolorization process and antioxidant activity of polysaccharide from Angelicae dahurica[J]. Journal of Food Safety and Quality, 2022, 13(18): 6074−6081. doi: 10.3969/j.issn.2095-0381.2022.18.spaqzljcjs202218037
[26] 张玉, 李进, 吕海英, 等. 响应面试验优化新疆野生准噶尔山楂残渣中多糖纯化工艺[J]. 食品科学,2015,36(12):22−28. [ZHANG Y, LI J, LÜ H Y, et al. Optimization of purification process for crude polysaccharides from the pomace of wild Crataegus songorica in Xinjiang by response surface methodology[J]. Journal of Food Science,2015,36(12):22−28.] doi: 10.7506/spkx1002-6630-201512005 ZHANG Y, LI J, LÜ H Y, et al. Optimization of purification process for crude polysaccharides from the pomace of wild Crataegus songorica in Xinjiang by response surface methodology[J]. Journal of Food Science, 2015, 36(12): 22−28. doi: 10.7506/spkx1002-6630-201512005
[27] 孙伟, 叶润, 蔡静, 等. 大孔树脂纯化桑白多糖的工艺研究[J]. 食品工业科技,2020,41(14):129−133. [SUN W, YE R, CAI J, et al. Purification of polysaccharide from Mori cortex by microporous resin[J]. Science and Technology of Food Industy,2020,41(14):129−133.] SUN W, YE R, CAI J, et al. Purification of polysaccharide from Mori cortex by microporous resin[J]. Science and Technology of Food Industy, 2020, 41(14): 129−133.
[28] 王晓婷, 康明丽, 宋丽君, 等. 大孔吸附树脂法纯化黑玉米花青素工艺[J]. 食品工业,2022,43(5):19−24. [WANG X T, KANG M L, SONG L J, et al. Purification of anthocyanin from black corn by macroporous adsorption resin[J]. The Food Industy,2022,43(5):19−24.] WANG X T, KANG M L, SONG L J, et al. Purification of anthocyanin from black corn by macroporous adsorption resin[J]. The Food Industy, 2022, 43(5): 19−24.
[29] 谢三都, 方豪, 黄东东. 大孔树脂纯化柿子黄色素工艺优化[J]. 中国调味品,2021,46(12):167−171. [XIE S D, FANG H, HUANG D D. Optimization of purification process of persimmon yellow pigment by microporous resin[J]. China Condiment,2021,46(12):167−171.] XIE S D, FANG H, HUANG D D. Optimization of purification process of persimmon yellow pigment by microporous resin[J]. China Condiment, 2021, 46(12): 167−171.
[30] 刘冲英, 周宁, 崔涛, 等. 响应面法优化大孔树脂纯化地黄多糖工艺[J]. 食品工业科技,2021,42(6):202−207,232. [LIU C Y, ZHOU N, CUI T. Optimization of purification process of polysaccharides from Rehmannia glutinosa Libosch. with microporous adsorption resins by response surface methodology[J]. Science and Technology of Food Industy,2021,42(6):202−207,232.] LIU C Y, ZHOU N, CUI T. Optimization of purification process of polysaccharides from Rehmannia glutinosa Libosch. with microporous adsorption resins by response surface methodology[J]. Science and Technology of Food Industy, 2021, 42(6): 202−207,232.
[31] QIN L, XU H, HE Y Y, et al. Purification, chemical characterization and immunomodulatory activity of a sulfated polysaccharide from marine brown algae Durvillaea antarctica[J]. Marine Drugs,2022,20(4):223. doi: 10.3390/md20040223
[32] XIA X W, HAO H L, ZHANG X Y, et al. Immunomodulatory sulfated polysaccharides from Caulerpa racemosa var. peltata induces metabolic shifts in NF-κB signaling pathway in RAW264.7 macrophages[J]. International Journal of Biological Macromolecules,2021,182:321−332. doi: 10.1016/j.ijbiomac.2021.04.025
[33] WU Z, WANG D, LIU C X, et al. Macrophage immunity promotion effect of polysaccharide LGP-1 from Guapian tea via PI3K/AKT and NF-κB signaling pathway[J]. Journal of Functional Foods,2022,89:104946. doi: 10.1016/j.jff.2022.104946
[34] 易阳, 曹银, 张名位. 多糖调控巨噬细胞免疫应答机制的研究进展[J]. 中国细胞生物学学报,2011,33(11):1267−1277. [YI Y, CAO Y, ZHANG M W. Research progress on the mechanism of polysaccharides regulating macrophage immune response[J]. Chinese Journal of Cell Biology,2011,33(11):1267−1277.] YI Y, CAO Y, ZHANG M W. Research progress on the mechanism of polysaccharides regulating macrophage immune response[J]. Chinese Journal of Cell Biology, 2011, 33(11): 1267−1277.
[35] SHIN K S, SEO H, LEE S J, et al. Polysaccharide isolated from Korean-style soy sauce activates macrophages via the MAPK and NK-κB pathways[J]. Food Science and Technology,2021,41(4):817−824. doi: 10.1590/fst.06121
[36] LI H H, MI Y, DUAN Z G, et al. Structural characterization and immunomodulatory activity of a polysaccharide from Eurotium cristatum[J]. International Journal of Biological Macromolecules,2020,162:609−617. doi: 10.1016/j.ijbiomac.2020.06.099
[37] 赵文俊, 陈思名, 彭东, 等. 美藤果粕可溶性膳食纤维的抗氧化及免疫活性评价[J]. 食品科学,2022,43(13):131−139. [ZHAO W J, CHEN S M, PENG D, et al. Antioxidant and immunological activities of sacha inchi soluble dietary fiber[J]. Food Science,2022,43(13):131−139.] doi: 10.7506/spkx1002-6630-20210713-143 ZHAO W J, CHEN S M, PENG D, et al. Antioxidant and immunological activities of sacha inchi soluble dietary fiber[J]. Food Science, 2022, 43(13): 131−139. doi: 10.7506/spkx1002-6630-20210713-143
[38] HIRANO T. IL-6 in inflammation, autoimmunity and cancer[J]. International Immunology,2021,33(3):127−148. doi: 10.1093/intimm/dxaa078
-
期刊类型引用(12)
1. 于梓芃,李宁阳,弓志青,王文亮,贾凤娟,崔文甲,徐宗海,宋莎莎,李永生. 食用菌呈味物质及其检测技术、应用的研究进展. 食品工业科技. 2024(02): 373-379 .  本站查看
本站查看
2. 陈梦,胡浩,管征,蒋伊琪,钟晴,陈运娇,曹庸,李晓青. 余甘子提取物与四种中药提取物复配的促消化效果的研究. 中国食品添加剂. 2024(02): 9-15 .  百度学术
百度学术
3. 王熙,姜文,代朋,徐舒愉,胡颖,勾瑶. 功能性饼干的有效成分及保健功能. 安徽农学通报. 2024(05): 84-86 .  百度学术
百度学术
4. 南新梅,冯昊天,李亚兰,贾秀珍,杜进睿,刘艳,尹小静,马国文,李昊虬,吴珺. 茯苓山药联合豆乳对斑马鱼酒精性肝病的防护作用. 现代中医药. 2024(03): 111-115 .  百度学术
百度学术
5. 谭岸,王智诚,袁铭,胡浩,曹庸,温林凤. 余甘子提取物及其复配物改善大鼠的功能性消化不良症状. 现代食品科技. 2024(04): 1-7 .  百度学术
百度学术
6. 陈絮蒙,田星,郭亦杰,尹珑桦,唐志平,曾嵘. 不同比例酸枣仁-茯苓水提物对大鼠焦虑样行为的影响. 食品工业科技. 2023(02): 408-416 .  本站查看
本站查看
7. 李尽哲,张弛,盛思佳,柳凤凤,祝浩杰,黄雅琴. 花脸香蘑山药菌质饮料的配方优化及其抗氧化活性. 食品工业科技. 2023(05): 195-203 .  本站查看
本站查看
8. 夏楠,杨丽军,徐迪,张冬冬. 茯苓饼干配方对其品质的影响研究. 农产品加工. 2023(04): 23-26 .  百度学术
百度学术
9. 孙庆,李娟,赵伟,姚血明. 基于数据挖掘龙运光治疗绝经前后诸证的用药规律及学术思想. 贵州中医药大学学报. 2023(03): 59-63+87 .  百度学术
百度学术
10. 邓晰文,彭新安,林倩如,候韬,徐璐,曹庸,贺丽苹. 余甘子提取物及其复配物对功能性消化不良小鼠的改善作用. 现代食品科技. 2023(05): 8-13 .  百度学术
百度学术
11. 马征,李娜,吴黎明. 猴头菇多糖活性物质对疲劳恢复和抗氧化能力的影响. 分子植物育种. 2023(16): 5510-5516 .  百度学术
百度学术
12. 王小建,李果,孙秋枝,曾晓. 茯苓多糖对仔猪生长性能、养分表观消化率及免疫功能的影响. 中国饲料. 2023(18): 37-40 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



