Optimization of Preparation Process of Sorghum Resistant Dextrin and Its Structure and in Vitro Digestion Properties
-
摘要: 为探究酸热法制备高粱抗性糊精的最佳工艺,以高粱淀粉为原料,采用单因素及响应面试验优化制备工艺,并对其进行结构表征。结果表明:高粱抗性糊精的最佳制备工艺为盐酸添加量21%,热解温度188 ℃,热解时间84 min,在此条件下的抗性糊精含量为86.71%,色度为50.58;制得的抗性糊精呈现起伏不平、片层状的不规则结构,原有衍射峰完全被破坏,形成了重结晶峰,化学基团无明显变化且各官能团峰位与高粱淀粉特征峰相似,分子降解后抗性糊精的Mw为6.1×103 g/mol,经糖苷键断裂及小分子重聚合反应后,抗性糊精同时拥有α和β两种首旋异构体,使得高粱抗性糊精具有良好的分子特性。此外,通过模拟体外消化实验结果显示其抗消化淀粉含量可达93.61%,表明其具有良好的抗消化特性。综上,利用酸热法制备的抗性糊精可以使高粱抗性糊精的分子量减小且抗消化能力更强,同时也为高粱抗性糊精的高效制备提供新的理论指导。Abstract: In order to explore the best process of acid-heat preparation on sorghum resistant dextrin, the preparation process of sorghum starch was optimized by single factor and response surface experiment as well as its structural characterization was studied. The results showed that the optimum preparation process of sorghum resistant dextrin was hydrochloric acid addition of 21%, pyrolysis temperature of 188 ℃ and pyrolysis time of 84 min. Under this condition, the content of resistant dextrin was 86.71% and the chroma was 50.58. The prepared resistant dextrin showed an undulating and lamellar irregular structure. The original diffraction peaks were completely destroyed and a recrystallization peak was formed. The chemical groups did not change significantly and the peaks of each functional group were similar to the characteristic peaks of sorghum starch. The Mw of resistant dextrin after molecular degradation was 6.1×103 g/mol. After the glycosidic bond cleavage and small molecule repolymerization reaction, the resistant dextrins have both α and β isomers, which indicated that the molecular properties was good. In addition, the results of simulated in vitro digestion experiment showed that the content of resistant starch could reach 93.61%, which indicated that it had good anti-digestion characteristics. In conclusion, the resistant dextrin prepared by acid-heat method could reduce the molecular weight of sorghum resistant dextrin and improve the digestibility. It also provides a new theoretical guidance for the efficient preparation of sorghum resistant dextrin.
-
高粱又名蜀黍,在我国作为酿酒、饲料及淀粉生产等工业的主要原料[1]。高粱具有独特的营养特性,高粱中富含淀粉、膳食纤维、蛋白质、维生素、矿物质等营养成分,其中淀粉含量可达60%~80%,可作为丰富的碳水化合物来源[2-3]。抗性糊精又可称为难消化糊精,是由淀粉为原料制备而成的一种低分子水溶性膳食纤维[4]。抗性糊精具有良好的加工特性[5],如耐酸热、黏度低、易溶于水等,在面制品[6]、饮料[7]、肉制品[8]等食品加工中得到广泛应用。此外,抗性糊精能抑制体内消化酶利用,可使体内胆汁酸和脂肪的吸收率下降,阻止机体内糖类扩散,调控体内胰岛素抵抗水平,达到控制体重、调节血糖及血脂等生理功能[9-10]。随着日常生活水平的提高,人们的饮食结构发生了改变,其中膳食纤维摄入量减少,造成机体营养不均衡,而抗性糊精可作为一种膳食纤维补充剂应用于食品中[11-12]。目前,国内外对于抗性糊精的研究主要聚焦于玉米淀粉。近年来有研究通过使用高粱麦芽淀粉酶水解玉米和小麦淀粉制备抗性糊精并分析其理化性质[13];张婷等[14]通过酸热法制备高粱抗性糊精,所得高粱抗性糊精样品符合国家质量标准。然而,高粱抗性糊精的结构表征与其淀粉的相关性有待进一步探讨,对于高粱抗性糊精的抗消化特性也鲜有报道。
对于糊精的制备工艺,酸热法是最简便且常用的一种。微波辅助处理虽然可以减少反应时间,但所得样品的感官指标会被影响,易造成碳化;酶法的可控性较强,但抗性含量低且得率不理想[15-16]。本实验以高粱淀粉为原料,采用传统酸热法制备高粱抗性糊精,通过响应面优化抗性糊精的制备工艺,对高粱淀粉及高粱抗性糊精的结构进行表征,并通过体外模拟消化实验探究高粱抗性糊精的消化特性,为高粱抗性糊精在食品工业的应用提供数据支持及理论基础。
1. 材料与方法
1.1 材料与仪器
高粱(晋杂22号) 山西农业科学院提供;α-淀粉酶(2×104 U/g)、淀粉葡萄糖苷酶(1×105 U/mL) 美国Sigma公司;溴化钾(光谱级)、盐酸、氢氧化钠、3,5-二硝基水杨酸、苯酚、亚硫酸氢钠、酒石酸钾钠等均为分析纯 天津市大茂化学试剂厂。
DK-S24恒温水浴锅、DGA-9080A电热恒温鼓风干燥箱 上海森信实验仪器有限公司;WSC-S色差仪 上海京阁仪器设备有限公司;GPhenomG2扫描电子显微镜 Phenom World公司;TSK G5000 PW高效尺寸排阻色谱(HPSEC) 美国TOSO Biosep公司;2414折射率检测器(RI)、HELEOS多角度激光散射仪(MALLS) 美国Waters公司;iS10傅里叶变换红外光谱仪 美国Thermo Fisher公司;AVANCE 400核磁共振仪 德国布鲁克公司;Aldpha1-2LD plus真空冷冻干燥机 德国 Christ 公司。
1.2 实验方法
1.2.1 高粱淀粉的提取
高粱淀粉的提取参照张吉军等[17]的方法,稍加修改,挑选颗粒完整的高粱籽粒,粉碎后过80目筛,按料液比1:15(质量体积比)的条件添加质量分数为0.3%的NaOH溶液浸润高粱粉末,混合均匀后将其放入40 ℃恒温水浴锅中搅拌浸提3 h,取出浸提液,冷却至室温,4000 r/min条件下离心10 min,倒出上清液后剥离掉上层非淀粉物质,多次水洗、重复离心,直至淀粉乳呈浅白色;用1 mol/L盐酸将淀粉乳pH调至中性,置于40 ℃烘箱中干燥24 h,取出粉碎过筛后得到高粱淀粉(纯度85.9%)。
1.2.2 高粱抗性糊精制备工艺
高粱抗性糊精参照朱洁[18]的方法进行制备,称取一定量的高粱淀粉(水分含量<5%),用质量分数为1%的盐酸喷洒均匀,放入50 ℃鼓风干燥箱中预干燥至水分<5%,将预烘干的酸解淀粉在一定的温度下热解一段时间,冷却至室温后即得焦糊精。将焦糊精加0.05 mol/L的磷酸盐缓冲溶液(pH6)制成50%溶液,加入体积比为0.5%的耐高温α-淀粉酶,95 ℃下酶解30 min;溶液冷却后将pH调节至4.5,加入体积比为0.2%淀粉葡萄糖苷酶,60 ℃下酶解30 min,随即沸水浴灭酶(100 ℃、10 min),离心分离(5000 r/min、15 min)去沉淀留上清液[19]。将酶解液加入树脂充分振荡脱色(150 r/min、24 h),透析脱盐,用旋转蒸发仪按原液与浓缩液为3:1比例进行浓缩,然后将浓缩液过钠型凝胶树脂。色谱柱直径10 mm,长度1000 mm,带夹套,用去离子水冲洗色谱柱,采用连续制备色谱在进料9 mL、流速 1.6 mL/min、柱温60 ℃、进料浓度60%的条件下,收集抗性糊精组分[20],经冷冻干燥后即得纯化后的高粱抗性糊精样品(纯度92.7%)。
1.2.3 3,5-二硝基水杨酸(DNS)比色法测定抗性糊精含量
1.2.3.1 绘制葡萄糖标准曲线
称取烘至恒重的葡萄糖100 mg,溶解定容至100 mL容量瓶中,制得1 mg/mL葡萄糖标准液。吸取0、0.2、0.4、0.6、0.8、1 mL葡萄糖标准液于10 mL容量瓶中,分别加入蒸馏水补足1 mL,再各自加入2 mL DNS试剂,混匀后沸水浴5 min,流水迅速冷却后定容,用分光光度计于540 nm处测定吸光度[21-22],测得葡萄糖标准曲线方程为y=1.3371x−0.0231,R2=0.9993,其中y表示吸光度,x表示葡萄糖含量(mg)。
1.2.3.2 高粱抗性糊精含量的测定
样品经稀释后,使其浓度为0.4 mg/mL,取1 mL稀释液于10 mL容量瓶中,加入2 mL DNS试剂后沸水浴5 min,流水迅速冷却后定容,用分光光度计在540 nm处测定样品吸光度,计算样品中还原糖含量[23]。
抗性糊精含量(%)=100%−还原糖含量(%)×0.9 1.2.4 高粱抗性糊精色度
根据Hidalgo等[24]的方法,使用WSC-S色差仪对抗性糊精样品的色度进行测定。通过色度系统的L*、a*、b* 进行计算,L*表示白(亮)度,a*表示红色-绿色,b*表示黄色-蓝色。
色度=√(100−L∗)2+a∗2+b∗2 1.2.5 单因素实验
1.2.5.1 盐酸添加量对高粱抗性糊精含量及色度的影响
称取5 g高粱淀粉,均匀喷洒质量分数为1%的盐酸,加酸量(质量体积比)分别为16%、18%、20%、22%、24%,热解温度为180 ℃、热解时间为80 min,考察加酸量对高粱抗性糊精含量及色度的影响。
1.2.5.2 热解温度对高粱抗性糊精含量及色度的影响
称取5 g高粱淀粉,均匀喷洒1%的盐酸,加酸量为18%,热解温度分别为160、170、180、190、200 ℃,热解时间为80 min,考察热解温度对高粱抗性糊精含量及色度的影响。
1.2.5.3 热解时间对高粱抗性糊精含量及色度的影响
称取5 g高粱淀粉,均匀喷洒1%的盐酸,加酸量为18%,热解温度为180 ℃、热解时间分别为40、60、80、100、120 min,考察热解时间对高粱抗性糊精含量及色度的影响。
1.2.6 响应面优化试验
在单因素实验基础上,选取盐酸添加量、热解温度、热解时间为考察因素,以高粱抗性糊精含量及色度为响应值(Y),通过响应面试验对高粱抗性糊精的制备工艺进行优化,试验因素及水平见表1。
表 1 响应面试验设计因素与水平Table 1. Design factors and levels of response surface experiment编码值 因素 A盐酸添加量(%) B热解温度(℃) C热解时间(min) −1 18 170 60 0 20 180 80 1 22 190 100 1.2.7 高粱淀粉及高粱抗性糊精的结构表征
1.2.7.1 扫描电镜测定
取适量干燥样品分散于导电样品台,通过导电胶固定样品,对样品表面喷金处理,保持在20 kV加速电压下分别放大500和5000倍后观察样品的微观形貌。
1.2.7.2 X-射线衍射(XRD)测定
将样品干燥粉碎后置于检测板上,在30 kV、3 mA条件下,利用广角衍射仪测定,设定条件参数为:扫描速度2°/min,扫描区域5~60°(2θ),辐射线Cu Kα,DS-SS-RS为1~0.1 mm,测定结束后导出衍射曲线并计算样品结晶度[25]。
1.2.7.3 傅立叶红外光谱测定
称取1 mg样品与100 mg干燥的溴化钾粉末于玛瑙研钵中充分研磨混匀,在红外快速干燥器中干燥完全后,将粉末压片成0.4 mm的薄片,然后将薄片转移到傅里叶红外光谱仪中,扫描500~4000 cm−1区间的红外光谱图[25]。
1.2.7.4 分子量测定
将质量浓度为2 mg/mL的抗性糊精样品水溶液经膜过滤(3 μm醋酸纤维素膜)后存储于进样瓶中,选用0.15 mol/L NaNO3与0.02% NaN3为流动相(50 mL 3 mol/L NaNO3+0.4% NaN3定容到1 L),流速为0.4 mL/min,使用高效尺寸排阻色谱-多角度激光散射仪-示差折光检测器(HPSEC-MALLS-RI)联用系统,待基线稳定后将待测溶液注入后进行检测[26]。测定结果给出SVg和Rg值,收集的数据通过ASTRA 6.1软件进行分析计算,计算公式为:
MW=SVg2.522R3g 式中,Mw 表示重均分子量,g/mol;SVg表示旋转比体积,cm3/g;Rg表示回转半径,nm。
1.2.7.5 核磁氢谱测定
参照Bai等[27]的方法并稍作修改。称取20 mg样品溶解于1 mL D2O并置换两次,每次都进行冷冻干燥,采用400 MHz核磁共振仪,置于5 mm样品管中进行测试,选定温度为25 ℃,在32次扫描中采集1HNMR图谱,扫描宽度为16 ppm,延迟时间为1 s。
1.2.8 模拟体外消化特性
根据Englyst等[28]和陆勇等[29]的方法稍加修改进行模拟体外消化特性测定。准确称取0.2 g高粱抗性糊精和高粱淀粉样品置于三角锥形瓶中,然后加入20 mL醋酸钠缓冲溶液(pH5.2,0.2 mol/L)于沸水中糊化30 min。待糊化后的样品冷却至室温后加入含有猪胰 α-淀粉酶(290 U/mL)和淀粉葡萄糖苷酶(20 U/mL)的混合酶液5 mL,随后置于恒温摇床中振荡培养(37 ℃、180 r/min),分别在0、20、60、90、120、180 min时取样0.5 mL,迅速加入4.5 mL的无水乙醇进行灭酶处理,采用DNS法测定样品中葡萄糖含量,并计算样品水解率及快消化淀粉(RDS)、慢消化淀粉(SDS) 、抗性淀粉(RS)的含量。
水解率(%)=Gt×0.9M×100 RDS(%)=(G1−G0)×0.9×100 SDS(%)=(G2−G1)×0.9×100 RS(%)=1−(RDS+SDS) 式中:Gt表示不同时间产生的葡萄糖含量,mg;M表示样品质量,mg;0.9表示葡萄糖换算系数,G0表示未被酶作用的样品中葡萄糖含量,mg/g;G1表示酶作用于样品20 min后产生的葡萄糖量,mg/g;G2表示酶作用于样品120 min后产生的葡萄糖量,mg/g。
1.3 数据处理
所有实验均取用3次平行实验的平均值,采用SPSS 26.0、ASTRA 6.1、Origin 2019、JADE 6.0和Design-Expert 11.0处理分析数据及绘制相关图表。
2. 结果与分析
2.1 高粱抗性糊精制备工艺优化
2.1.1 单因素实验结果
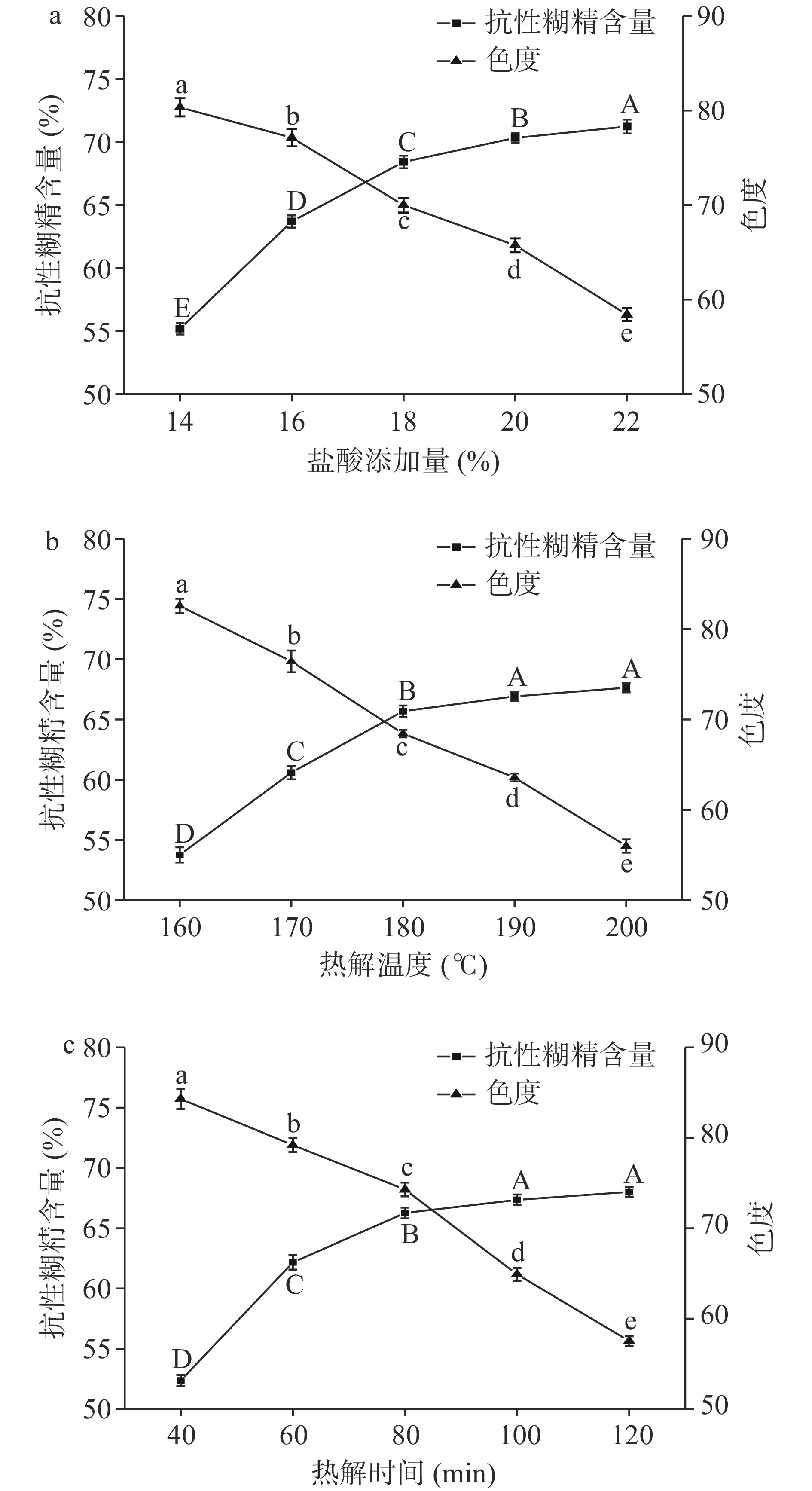
由图1a可知,高粱抗性糊精的含量及色度因不同的盐酸添加量而产生显著(P<0.05)变化。随着盐酸添加量的增加,高粱抗性糊精含量逐步增加,在添加量为20%时高粱抗性糊精含量增加趋缓。可能是由于随着盐酸添加量的增多,淀粉大分子被降解成小分子物质,降解出的小分子物质在高温的作用下发生重聚合反应,生成了新的不能被α-淀粉酶和糖化酶酶解的物质[30]。同时热解反应会随着盐酸添加量的增多而逐渐加剧,但过量的盐酸会使淀粉与盐酸分子在反应时形成焦化层,阻碍糊精化反应的进行[20]。并且抗性糊精的颜色会随着盐酸用量的增多而发生变化,逐渐由白色变为黄色甚至是黄褐色。颜色过深会不利于后续进行脱色实验,因此综合考虑抗性糊精含量和色度两个因素,选取盐酸添加量18%、20%、22%进行后续响应面试验。
由图1b可知,热解温度对抗性糊精含量及色度有显著(P<0.05)影响。随着温度的升高高粱抗性糊精含量增加、色度降低,但在180~200 ℃之间趋势缓慢,可能是由于淀粉在高温酸解过程中,其所含有的还原性葡萄糖端基发生分子内脱水,或者被解离的葡萄糖残基转移到任意羟基上,在分子发生断裂的同时提高了抗性糊精含量[9]。但是淀粉在过高的温度下进行热解反应会发生碳化,同时导致样品颜色过深,在200 ℃时抗性糊精变为焦黄色并有焦苦味产生,使其在食品加工中无法得到有效利用,因此综合考虑抗性糊精含量和色度两个因素,选取热解温度170、180、190 ℃进行后续响应面试验。
由图1c可知,抗性糊精的含量随着反应时间的延长而增加,在80~120 min之间增加趋势逐渐平缓。这是因为在热解反应的初始阶段,淀粉大分子逐步被降解成小分子物质,而随着反应时间的增加,小分子成分增多并且发生重聚合反应[31-32],进而影响抗性糊精的含量。而且随着热解时间的增加,色度值逐渐变小,时间过久不利于抗性糊精的颜色及口感,在实际应用中生产效率较低,因此综合考虑抗性糊精含量和色度两个因素,选取热解时间60、80、100 min进行后续响应面试验。
2.2 响应面试验结果
2.2.1 回归模型建立及方差分析
响应面试验设计及结果见表 2。利用Design-Expert 11分析试验数据,得到多元回归方程为:含量(%)=72.23+7.25A+6.75B+3.21C+0.8750AB+1.98AC+1.44BC+0.7845A2−2.24B2−1.31C2
表 2 响应面试验设计与结果Table 2. Response surface experimental design and results实验号 盐酸添加量 热解温度 热解时间 抗性糊精含量(%) 色度 1 −1 −1 0 57.22 85.06 2 1 −1 0 70.68 68.03 3 −1 1 0 69.11 72.8 4 1 1 0 86.07 50.21 5 −1 0 −1 63.69 77.63 6 1 0 −1 73.5 62.95 7 −1 0 1 65.94 78.07 8 1 0 1 83.67 53.3 9 0 −1 −1 60.11 78.11 10 0 1 −1 70.61 64.23 11 0 −1 1 63.87 70.12 12 0 1 1 80.11 61.12 13 0 0 0 72.87 64.76 14 0 0 0 72.24 65.62 15 0 0 0 72.34 65.02 16 0 0 0 72.12 65.57 17 0 0 0 71.56 66.54 色度=65.50−9.88A−6.62B−2.54C−1.39AB−2.52AC+1.22BC+1.56A2+1.97B2+0.9278C2
表3是回归方程的方差分析结果。其中,用F值检验各变量对响应值影响显著性的高低,变量的显著性越高其F值越大。当模型中P<0.05时,证明该模型具有统计学意义[33]。由表3可知,含量和色度回归模型的P值都小于0.01,证明两个模型是极显著的,且两个模型失拟项的P值都大于0.05(不显著),表明两个模型均高度拟合,且实验误差较小,可以对各因素和响应值之间进行准确的描述,即可用这两个模型对抗性糊精的含量和色度进行分析。由各因素F值可知,三个因素对含量和色度的影响顺序为A>B>C,即盐酸添加量>热解温度>热解时间。此外,含量模型中的交互项AB和二次项A2显著(P<0.05);一次项A、B、C,交互项AC、BC及二次项B2、C2极显著(P<0.01)。色度模型中的交互项AB和二次项A2显著(P<0.05);一次项A、B、C,交互项AC及二次项B2极显著(P<0.05)。本实验中含量和色度两个模型的R2(决定系数)分别为0.9978和0.9930,信噪比分别为67.5453、38.3639,证明两个模型的准确性和可信度高[34-35]。
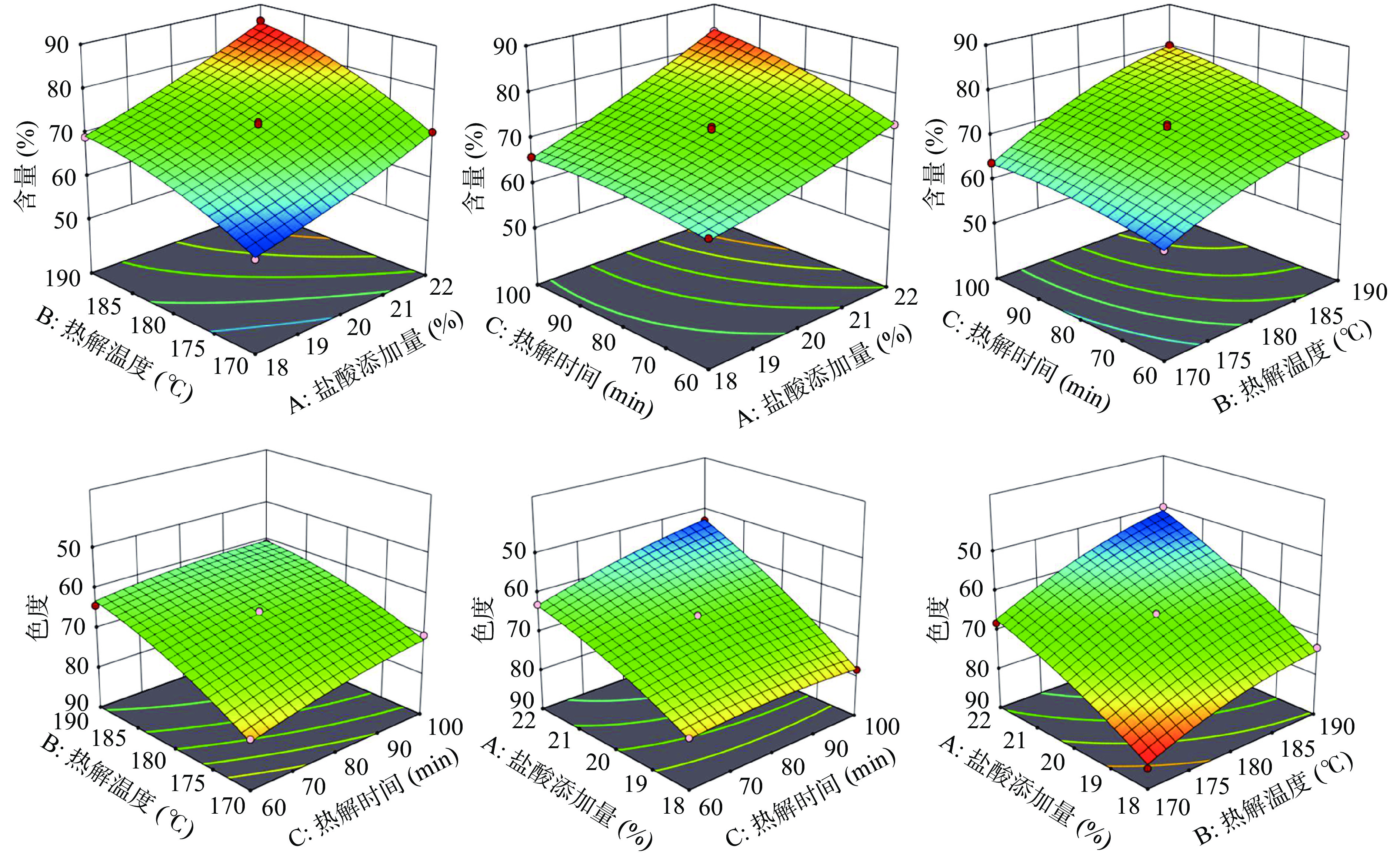
表 3 响应值含量及色度拟合回归方程的方差分析结果Table 3. Variance analysis results of regression equation fitting response value content and chromaticity方差来源 含量拟合 色度拟合 F值 P值 显著性 F值 P值 显著性 回归模型 352.07 <0.0001 ** 110.90 <0.0001 ** A 1437.96 <0.0001 ** 621.02 <0.0001 ** B 1249.11 <0.0001 ** 278.60 <0.0001 ** C 282.28 <0.0001 ** 40.97 0.0004 ** AB 10.49 0.0143 * 6.14 0.0423 * AC 53.70 0.0002 ** 20.23 0.0028 ** BC 28.21 0.0011 ** 4.73 0.0661 A2 8.87 0.0205 * 8.12 0.0247 * B2 72.38 <0.0001 ** 12.92 0.0088 ** C2 24.76 0.0016 ** 2.88 0.1335 失拟项 1.75 0.2943 4.92 0.1153 R2 0.9978 0.9930 R2Adj 0.9950 0.9841 信噪比 67.5453 38.3639 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 2.2.2 模型响应面分析及验证实验
利用 Design-Expert 11分析得出的各因素交互作用的响应面图见图2。因素之间的交互作用越显著,则响应面的曲面坡度越陡;反之,响应面的曲面坡度越平,则因素之间的交互作用越小。从图2中可以看出,在含量回归模型中,交互项AC、BC的曲面坡度陡峭,而AB的曲面坡度稍显陡峭,证明交互项AC、BC极显著,AB显著;在色度回归模型中,交互项AC的曲面坡度陡峭、AB的曲面坡度稍显陡峭,而BC的曲面坡度较为平缓,证明交互项AC极显著,AB显著,BC不显著。其结果与方差分析中的一致,证明两个回归模型的可行性高。
根据响应面建立的模型进行优化,利用软件进行结果分析时以含量最大化为目标,确定最优工艺参数为:盐酸添加量21.09%,热解温度188.62 ℃,热解时间84.01 min,高粱抗性糊精含量和色度的预测值分别为86.37%、50.99。为验证响应面最优工艺的可靠性,根据预测参数进行验证实验,为适应实际生产需求将高粱抗性糊精制备工艺的盐酸添加量设置为21%,热解温度设置为188 ℃,热解时间设置为84 min,经3次重复实验得到抗性糊精含量为86.71%,色度为50.58,其结果与模型预测结果相近,证明该实验具有可行性。
2.3 高粱淀粉及高粱抗性糊精的结构表征
2.3.1 扫描电镜分析
通过扫描电镜对高粱淀粉与高粱抗性糊精颗粒的表观形态进行比较。由图3可知,高粱淀粉颗粒形态呈椭圆形或多角形,表面光滑且结构完整,颗粒差异不大;相反,高粱抗性糊精的颗粒形态与其完全不同,糊精分子表面结构致密,呈现起伏不平、片层状的不规则结构。这表明在高温酸解作用下,原淀粉的颗粒受到了一定程度的破坏,淀粉分子因糊精化反应而发生降解,产生小分子物质,而剧烈的酸热反应会促进小分子物质发生糖基的转移,致使这些小分子进行重聚合反应,从而形成大小不一、更为复杂的不规则结构 [9,14,36]。
2.3.2 XRD分析
图4为高粱淀粉及高粱抗性糊精的X-衍射图谱。由图4可以观察出高粱淀粉为A型结晶,其在2θ为15.18°、17.09°、18.12°、23.08°处出现较强的衍射吸收峰,经拟合分析后其结晶度为20.68%。与高粱淀粉相比,高粱抗性糊精的晶型结构发生显著变化,淀粉原有的衍射峰完全消失,只在2θ为20°左右出现一个较宽的衍射峰。结合扫描电镜结果分析,表明抗性糊精的结构与淀粉显著不同,其为以葡萄糖为主体的葡聚糖[37]。这是由于高粱淀粉经剧烈的酸热反应后晶体结构被破坏,由有序晶体转变为无序,而热解后的小分子物质会进一步发生重聚合反应,形成重结晶峰,使得抗性糊精具有高度分支结构。
2.3.3 傅立叶红外光谱分析
通过红外光谱分析抗性糊精中的官能团及相关化学键,结果如图5所示,高粱抗性糊精在形成过程中并未产生新的官能团,结构与高粱淀粉相似。抗性糊精分子的红外光谱中具有多糖的特征吸收峰,在3421 cm−1处有较宽的-OH伸缩振动吸收峰,致使抗性糊精具有较强的水溶性,在2931 cm−1处有较弱的C-H3,C-H2,C-H等官能团所产生的C-H伸缩振动吸收峰,在1647 cm−1处有颇大的C=O伸缩振动吸收峰,在1370 cm−1处有间断的C-H弯曲振动小吸收峰,1157 cm−1和1003 cm−1处分别为C-O-C的非伸缩振动峰和C-O的对称振动吸收峰,在800~1000 cm−1间存在的特征吸收带是因α和β-糖苷键发生了一定强度的伸缩振动[38]。在红外图谱中可以明显看到929 cm−1处两者的吸收峰有所不同,这由于糊精化反应导致淀粉分子中的α-1,4糖苷键遭到破坏,而淀粉分子在降解时会发生诱导解聚,周围分子被攻击后导致羟基和短链产生交联聚合,诱导形成新的分子内耐消化糖苷键,致使糊精相对于淀粉具有更强的耐消化特性[39]。
2.3.4 分子量分析
由图6可知,高粱抗性糊精和高粱淀粉的示差折光检测曲线均为单一峰,证明两者的分子量较为集中,利用系统软件计算得出高粱淀粉的MW为6.31×106 g/mol,高粱抗性糊精的MW为6.1×103 g/mol,高粱淀粉与高粱抗性糊精的Rg分别为143.8 nm和71.2 nm,由此可知高粱抗性糊精的分子量要远小于高粱淀粉,所以将其归类为低分子聚合物。结合扫描电镜分析,进一步证实高粱抗性糊精与高粱淀粉相比结构发生了改变,淀粉经剧烈酸解反应后链状结构明显被破坏,生成大量小分子糖类物质,但糊精化过程使小分子物质进行了较为复杂的结构重排和重聚合反应,最终生成低分子量的抗性糊精[40]。
2.3.5 核磁氢谱分析
在1H NMR图谱中,葡萄糖单元上多数质子的化学位移发生在3.0~4.0 ppm的光谱高场区,氢信号在共振拥挤区严重重叠,使其解析困难,但糖环上异头氢质子在4.5~5.5 ppm 的光谱低场区产生化学位移,其共振信号不在共振拥挤区,可以被较好地分离和分辨[27]。通常可以通过异头氢质子产生的化学位移判断分子的糖环构型,α-型吡喃糖H-1质子的化学位移大于4.95 ppm,β-型吡喃糖H-1质子的化学位移小于4.95 ppm[41]。图7为高粱抗性糊精1H NMR谱图,溶剂为重水,重水的质子峰为4.74 ppm,在δ 4.5~5.5×10−6区域内产生5.15~5.14、4.74、4.57~4.55的异头氢信号,由此可知抗性糊精的糖环中含有α和β两种首旋异构体,且存在吡喃环非对称伸缩振动峰和呋喃环CH变角振动峰,与红外光谱对应分析,证实了糊精化反应会导致糖苷键断裂且发生转苷反应,引起高粱抗性糊精糖环的振动[42]。
2.4 模拟体外消化特性
高粱淀粉及高粱抗性糊精的体外模拟消化特性如图8所示,在模拟体外消化反应的0~120 min内,高粱淀粉的水解率随着反应时间的延长明显增加,而高粱抗性糊精的水解率呈现小幅增加,表明高粱抗性糊精相较于高粱淀粉拥有更强的抗酶解消化能力。根据模拟体外消化率的结果可知,高粱淀粉的RDS为45.73%、SDS为16.33%、RS为37.94%,高粱抗性糊精的RDS为4.14%、SDS为2.25%、RS为93.61%。高粱抗性糊精的RDS和SDS含量显著(P<0.05)低于高粱淀粉,而高粱抗性糊精的RS含量显著(P<0.05)高于高粱淀粉,进一步证实高粱抗性糊精具有良好的抗消化特性。RDS的含量在一定程度上决定人体餐后血糖应答情况,根据高粱淀粉和高粱抗性糊精RDS含量的情况可知高粱抗性糊精有利于调节人体餐后血糖水平[43]。结合高粱抗性糊精结构表征的变化分析其消化特性,由于在糊精化反应过程中,高粱淀粉颗粒发生裂解,原有的α-1,4-糖苷键遭到破坏,解聚后的小分子物质发生重聚合反应形成新的糖苷键,但人体消化酶(主要是α-淀粉酶)大多以α-1,4-糖苷键为水解靶点,因此高粱抗性糊精对体内消化酶有强烈的抵抗作用。综合来看高粱抗性糊精具有的抗消化性要强于高粱淀粉,基本符合膳食纤维的功能特性。
3. 结论
本研究通过单因素和响应面优化试验,确定了酸热法制备高粱抗性糊精最佳工艺条件:盐酸添加量21%,热解温度188 ℃,热解时间84 min;在此条件下,高粱抗性糊精的含量为86.71%,色度为50.58。经糊精化反应后制得的高粱抗性糊精结构呈现起伏不平、大小不一的不规则形状,并且淀粉原有的衍射峰完全消失,高粱淀粉的A型结晶结构被破坏形成重结晶峰,使得高粱抗性糊精形成一个宽衍射峰;高粱抗性糊精的官能团与高粱淀粉相比无明显变化,且各官能团峰位与高粱淀粉特征峰相似,经分子降解后高粱抗性糊精的Mw为6.1×103 g/mol,表明高粱抗性糊精属于低分子聚合物;因糖苷键断裂及小分子的重聚合反应,使得抗性糊精同时拥有α和β两种首旋异构体。通过模拟体外消化实验结果可知抗性糊精的抗消化淀粉含量高达93.61%,证实高粱抗性糊精具有良好的抗消化特性,这使得其在食品开发中拥有更广阔的前景。综上所述,通过对高粱抗性糊精结构和消化特性的研究,确定高粱抗性糊精的优良特性,为高粱深加工研究提供部分数据支持及理论基础。
-
表 1 响应面试验设计因素与水平
Table 1 Design factors and levels of response surface experiment
编码值 因素 A盐酸添加量(%) B热解温度(℃) C热解时间(min) −1 18 170 60 0 20 180 80 1 22 190 100 表 2 响应面试验设计与结果
Table 2 Response surface experimental design and results
实验号 盐酸添加量 热解温度 热解时间 抗性糊精含量(%) 色度 1 −1 −1 0 57.22 85.06 2 1 −1 0 70.68 68.03 3 −1 1 0 69.11 72.8 4 1 1 0 86.07 50.21 5 −1 0 −1 63.69 77.63 6 1 0 −1 73.5 62.95 7 −1 0 1 65.94 78.07 8 1 0 1 83.67 53.3 9 0 −1 −1 60.11 78.11 10 0 1 −1 70.61 64.23 11 0 −1 1 63.87 70.12 12 0 1 1 80.11 61.12 13 0 0 0 72.87 64.76 14 0 0 0 72.24 65.62 15 0 0 0 72.34 65.02 16 0 0 0 72.12 65.57 17 0 0 0 71.56 66.54 表 3 响应值含量及色度拟合回归方程的方差分析结果
Table 3 Variance analysis results of regression equation fitting response value content and chromaticity
方差来源 含量拟合 色度拟合 F值 P值 显著性 F值 P值 显著性 回归模型 352.07 <0.0001 ** 110.90 <0.0001 ** A 1437.96 <0.0001 ** 621.02 <0.0001 ** B 1249.11 <0.0001 ** 278.60 <0.0001 ** C 282.28 <0.0001 ** 40.97 0.0004 ** AB 10.49 0.0143 * 6.14 0.0423 * AC 53.70 0.0002 ** 20.23 0.0028 ** BC 28.21 0.0011 ** 4.73 0.0661 A2 8.87 0.0205 * 8.12 0.0247 * B2 72.38 <0.0001 ** 12.92 0.0088 ** C2 24.76 0.0016 ** 2.88 0.1335 失拟项 1.75 0.2943 4.92 0.1153 R2 0.9978 0.9930 R2Adj 0.9950 0.9841 信噪比 67.5453 38.3639 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 -
[1] ZHU F. Structure, physicochemical properties, modifications, and uses of sorghum starch[J]. Comprehensive Reviews in Food Science and Food Safety,2014,13(4):597−610. doi: 10.1111/1541-4337.12070
[2] 申瑞玲, 陈明, 任贵兴. 高粱淀粉的研究进展[J]. 中国粮油学报,2012,27(7):123−128. [SHEN R L, CHEN M, REN G X. Research progress of the sorghum starch[J]. Journal of the Chinese Cereals and Oils Association,2012,27(7):123−128. SHEN R L, CHEN M, REN G X. Research progress of the sorghum starch[J]. Journal of the Chinese Cereals and Oils Association, 2012, 27(7): 123-128.
[3] 刘庆芳, 祁瑜婷, 杜方岭. 高粱淀粉的研究与发展[J]. 农产品加工,2016(18):54−56. [LIU Q F, QI Y T, DU F L. Research and development of sorghum starch[J]. Farm Products Processing,2016(18):54−56. LIU Q F, QI Y T, DU F L. Research and development of sorghum starch[J]. Farm Products Processing, 2016(18): 54-56.
[4] 苏会波, 林海龙. 难消化糊精的研究进展[J]. 食品与生物技术学报,2014,33(1):1−7. [SU H B, LIN H L. Research progress and market status of health food-indigestible dextrin[J]. Journal of Food Science and Biotechnology,2014,33(1):1−7. SU H B, LIN H L. Research progress and market status of health food-indigestible dextrin[J]. Journal of Food Science and Biotechnology, 2014, 33(1): 1-7.
[5] 王六强, 张新武, 马飞飞, 等. 抗性糊精的生产应用现状研究与展望[J]. 农产品加工,2020(6):76−80. [WANG L Q, ZHANG X W, MA F F, et al. Research and prospect of production and application of resistant dextrin[J]. Farm Products Processing,2020(6):76−80. WANG L Q, ZHANG X W, MA F F, et al. Research and prospect of production and application of resistant dextrin[J]. Farm Products Processing, 2020(6): 76-80.
[6] 任国宝, 任晨刚, 郇美丽, 等. 膳食纤维对小麦粉品质的影响[J]. 中国粮油学报,2020,35(2):6−11. [REN G B, REN C G, HUAN M L, et al. Effect of dietary fiber on flour quality[J]. Journal of the Chinese Cereals and Oils Association,2020,35(2):6−11. REN G B, REN C G, HUAN M L, et al. Effect of dietary fiber on flour quality[J]. Journal of the Chinese Cereals and Oils Association, 2020, 35(2): 6-11.
[7] KAMILA K, EWA N. Enzyme-resistant dextrins from potato starch for potential application in the beverage industry[J]. Carbohydrate Polymers,2017,172(5):152−158.
[8] MARCIO S, MARIA C C N M, ANDREA C D S B, et al. Dietary fiber as fat substitute in emulsified and cooked meat model system[J]. LWT-Food Science and Technology,2015,61(1):105−111. doi: 10.1016/j.lwt.2014.11.037
[9] TRITHAVISUP K, KRUSONG K. In-depth study of the changes in properties and molecular structure of cassava starch during resistant dextrin preparation[J]. Food Chemistry,2019(12):49−53.
[10] HOBDEN M R, AETITIAL G D, IAN R, et al. Potential anti-obesogenic properties of non-digestible carbohydrates: Specific focus on resistant dextrin[J]. Proceedings of the Nutrition Society,2015,74:1−10. doi: 10.1017/S0029665114001566
[11] 张松, 苏永平, 李涛, 等. 膳食纤维的功能特性及其在食品领域的研究进展[J]. 食品研究与开发,2018,39(17):214−218. [ZHANG S, SU Y P, LI T, et al. Functional characteristics of dietary fiber and research progress in food field[J]. Food Research and Development,2018,39(17):214−218. ZHANG S, SU Y P, LI T, et al. Functional characteristics of dietary fiber and research progress in food field[J]. Food Research andDevelopment, 2018, 39(17): 214-218.
[12] 黄政, 孙江文, 徐勇, 等. 抗性糊精的研究与应用进展[J]. 海南师范大学学报(自然科学版),2018,31(4):418−428. [HUANG Z, SUN J W, XU Y, et al. Advance on research and application of resistant dextrin[J]. Journal of Hainan Normal University (Natural Science Edition),2018,31(4):418−428. HUANG Z, SUN J W, XU Y, et al. Advance on research and application of resistant dextrin[J]. Journal of Hainan Normal University(Natural Science Edition), 2018, 31(4): 418-428.
[13] BA K, BLECKER C, DANTHINE S, et al. Physicochemical characterization of dextrins prepared with amylases from sorghum malt[J]. Starch-Stärke,2013,65(11-12):962−968.
[14] 张婷, 李佳瑶, 安双双, 等. 高粱抗性糊精的制备工艺优化及结构表征[J]. 食品科技,2020,342(4):238−243. [ZHANG T, LI J Y, AN S S, et al. Preparation process optimization and structure characterization of sorghum resistant dextrin[J]. Food Science and Technology,2020,342(4):238−243. ZHANG T, LI J Y, AN S S, et al. Preparation process optimization and structure characterization of sorghum resistant dextrin[J]. Food Science and Technology, 2020, 342(4): 238-243.
[15] 常江涛, 刘洁, 刘亚伟. 糯性低葡萄糖当量麦芽糊精的制备及结构表征[J]. 河南工业大学学报(自然科学版),2022,43(4):70−76. [CHANG J T, LIU J, LIU Y W. Preparation and structure characterization of low dextrose equivalent maltodextrin from waxy rice starch[J]. Journal of Henan University of Technology (Natural Science Edition),2022,43(4):70−76. CHANG J T, LIU J, LIU Y W. Preparation and structure characterization of low dextrose equivalent maltodextrin from waxy rice starch[J]. Journal of Henan University of Technology(Natural Science Edition), 2022, 43(4): 70-76.
[16] 李泽润, 田延军, 黄艳红, 等. 不同制备工艺对抗性糊精构效的影响[J/OL]. 食品科学: 1−11[2022−12−27]. http://kns.cnki.net/kcms/detail/11.2206.TS.20220701.1224.003.html LI Z R, TIAN Y J, HUANG Y H, et al. Study on structure-activity relationship of resistant dextrin based on different preparation techniques[J/OL]. Food Science: 1−11[2022−12−27]. http://kns.cnki.net/kcms/detail/11.2206.TS.20220701.1224.003.html.
[17] 张吉军, 曹龙奎, 衣淑娟, 等. 微波间歇干燥对北方粳高粱蛋白质及淀粉品质的影响[J]. 食品科学,2022,43(7):52−60. [ZHANG J J, CAO L K, YI S J, et al. Effect of intermittent microwave drying on protein and starch quality of non-glutinous sorghum[J]. Food Science,2022,43(7):52−60. ZHANG J J, CAO L K, YI S J, et al. Effect of intermittent microwave drying on protein and starch quality of non-glutinous sorghum[J]. Food Science, 2022, 43(7): 52-60.
[18] 朱洁. 抗性糊精的工艺及特性研究[D]. 天津: 天津科技大学, 2010 ZHU J. Study on technology and properties of indigestible dextrin[D]. Tianjing: Tianjin University of Science and Technology, 2010.
[19] 甄远航. 抗性糊精的分离纯化及其在面制品中的应用研究[D]. 无锡: 江南大学, 2021 ZHEN Y H. Isolation and purification of resistant dextrin and its application in flour product[D]. Wuxi: Jiangnan University, 2021.
[20] 刘晚霞. 绿豆渣抗性糊精的模拟移动床色谱纯化及其特性研究[D]. 大庆: 黑龙江八一农垦大学, 2021 LIU W X. Study on high efficiency purification technology and molecular characteristics of mung bean resistant dextrin[D]. Daqing: Heilongjiang Bayi Agricultural University, 2021.
[21] 张新武, 朱博博, 黄继红, 等. 抗性糊精的焙烤制备工艺技术研究[J]. 农产品加工,2018(22):33−36. [ZHANG X W, ZHU B B, HUANG J H, et al. Study on baking preparation technology of resistant dextrin[J]. Farm Products Processing,2018(22):33−36. ZHANG X W, ZHU B B, HUANG J H, et al. Study on baking preparation technology of resistant dextrin[J]. Farm Products Processing, 2018(22): 33-36.
[22] BARCZYNSKA R, SLIZEWSKAB K, JOCHYMA K. The tartaric acid-modified enzyme-resistant dextrin from potato starch as potential prebiotic[J]. Journal of Functional Food,2012(4):954−962.
[23] 吕行, 黄继红, 纪小国, 等. “干热三步法”制备抗性糊精的工艺及其表征[J]. 食品工业,2019,40(2):95−99. [LÜ X, HUANG J H, JI X G, et al. Technology and characterization of preparation of resistant dextrin by “dry heat three-step method”[J]. The Food Industry,2019,40(2):95−99. LV X, HUANG J H, JI X G, et al. Technology and Characterization of Preparation of Resistant Dextrin by“Dry Heat Three-step Method”[J]. The Food Industry, 2019, 40(2): 95-99.
[24] HIDALGO A, FONGARO L, BRANDOLINI A. Colour screening of whole meal flours and discrimination of seven Triticum subspecies[J]. Journal of Cereal Science,2017,77:9−16. doi: 10.1016/j.jcs.2017.07.006
[25] 刘德志, 王维浩, 全志刚, 等. 绿豆抗性糊精的结构表征及抗消化特性研究[J]. 食品工业科技,2022,43(11):119−125. [LIU D Z, WANG W H, QUAN Z G, et al. Study on structure characterization and anti digestion properties of mung bean resistant dextrin[J]. Science and Technology of Food Industry,2022,43(11):119−125. LIU D Z, WANG W H, QUAN Z G, et al. Study on structure characterization and anti digestion properties of mung bean resistant dextrin[J]. Science and Technology of Food Industry, 2022, 43(11): 119-125.
[26] 季瑞雪. 知母多糖理化性质及生物活性研究[D]. 大庆: 黑龙江八一农垦大学, 2021 JI R X. Research on physicochemical properties and biological activities of polysaccharides from Anemarrhena asphodeloides rhizomes[D]. Daqing: Heilongjiang Bayi Agricultural University, 2021.
[27] BAI Y J, SHI Y C. Chemical structures in pyrodextrin determined by nuclear magnetic resonance spectroscopy[J]. Carbohydrate Polymers,2016:426−433.
[28] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition,1992,46(2):33−50.
[29] 陆勇, 郭丽慧, 李学红, 等. 高粱淀粉的理化特性及其水解率的研究[J]. 食品工业,2015,36(9):29−33. [LU Y, GUO L H, LI X H. The physical and chemical properties and hydrolysis rate of sorghum starch research[J]. The Food Industry,2015,36(9):29−33. LU Y, GUO L H, LI X H. The physical and chemical properties and hydrolysis rate of sorghum starch research[J]. The Food Industry, 2015, 36(9): 29-33.
[30] 大隈一裕, 西端丰秀. 水溶性膳食纤维Fibersol-2[J]. 中国食品添加剂,2003(5):11−16. [OKUMA Y Y, XIDUAN C X. Watersoluble dietary fiber Fibersol-2[J]. China Food Additives,2003(5):11−16. OKUMA Y Y, XIDUAN C X. Watersoluble dietary fiber fibersol-2[J]. China Food Additives, 2003(5): 11-16.
[31] HAN X, KANG J, BAI Y, et al. Structure of pyrodextrin in relation to its retrogradation properties[J]. Food Chemistry,2018,242(MAR.1):169−173.
[32] 张颖. 抗性糊精的纯化及应用特性研究[D]. 无锡: 江南大学, 2015 ZHANG Y. Study on purification and application of resistant dextrin[D]. Wuxi: Jiangnan University, 2015.
[33] 赵姝婷, 全志刚, 王娟, 等. 硒化绿豆抗性淀粉制备工艺优化及抗氧化活性分析[J]. 中国粮油学报,2022,37(9):246−255. [ZHAO S T, QUAN Z G, WANG J, et al. Preparation process of resistant starch of selenized mung bean-resistant starch and analysis of antioxidant activity[J]. Journal of the Chinese Cereals and Oils Association,2022,37(9):246−255. ZHAO S T, QUAN Z G, WANG J, et al. Preparation process of resistant starch of selenized mung bean-resistant starch and analysis of antioxidant activity[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(9): 246-255.
[34] 竺鉴博, 李朝阳, 贾鹏禹, 等. 响应面法优化豌豆渣抗性糊精的制备工艺[J]. 食品工业,2019,40(12):65−69. [ZHU J B, LI Z Y, JIA P Y, et al. Response surface methodology optimization for resistant dextrin preparation from pea residue[J]. The Food Industry,2019,40(12):65−69. ZHU J B, LI Z Y, JIA P Y, et al. Response surface methodology optimization for resistant dextrin preparation from pea residue[J]. The Food Industry, 2019, 40(12): 65-69.
[35] FAKOOR M, BA K M, SOLEYMANI M. Optimal design of the satellite constellation arrangement reconfiguration process[J]. Advances in Space Research,2016:372−386.
[36] 黄政. 水溶性抗性糊精的性质及其对面粉加工品质的影响[D]. 广州: 华南理工大学, 2019 HUANG Z. Properties of water-soluble resistant dextrin and its effects on the processing quality of flour products[D]. Guangzhou: South China University of Technology, 2019.
[37] 李良玉, 刘晚霞, 李朝阳, 等. 绿豆抗性糊精的高效纯化技术及分子特性研究[J]. 中国食品学报,2020,20(10):134−141. [LI L Y, LIU W X, LI C Y, et al. High efficiency purification technology and molecular characteristics of mung bean resistant dextrin[J]. Chinese Journal of Food,2020,20(10):134−141. LI L Y, LIU W X, LI C Y, et al. High efficiency purification technology and molecular characteristics of mung bean resistant dextrin[J]. Chinese Journal of Food, 2020, 20(10): 134-141.
[38] WANG H S, ZAINABU M, ZHENG R N. Characterization of microwave-synthesized polydextrose and its radical-scavenging activity[J]. Taylor and Francis,2018,37(1):44−56.
[39] JOANNA T B, WIOLETTA B, ARTUR S, et al. Molecular and supermolecular structure of commercial pyrodextrins[J]. Journal of Food Science,2016,81(7−9):C2135.
[40] 徐佩琳. 酸热法和微波预处理—酶法制备山药抗性糊精及其特性研究[D]. 合肥: 合肥工业大学, 2018 XU P L. Preparation and characterization of yam resistant dextrin by acid heating method and microwave pretreatment-enzymolysis method[D]. Hefei: Hefei University of Technology, 2018.
[41] 武小辉. 麦芽糊精的交联聚合技术及其特性研究[D]. 郑州: 河南工业大学, 2016 WU X H. Study on cross-linking polymerization technology and characteristics of maltodextrin[D]. Zhengzhou: Henan University of Technology, 2016.
[42] WEIL W, WEIL R C, KEAWSOMPONG S, et al. Pyrodextrins from waxy and normal tapioca starches: Molecular structure and in vitro digestibility[J]. Carbohydrate Polymers,2021,252(11):117140.
[43] 李梦楠, 张黎明, 郝利民, 等. 茶多酚-高直链玉米淀粉共研磨混合物的制备与结构表征[J]. 食品工业科技,2019,40(7):1−4. [LI M N, ZHANG L M, HAO L M, et al. Preparation and structure characterization of tea polyphenols-high-amylose maize starch co-grinding mixtures[J]. Science and Technology of Food Industry,2019,40(7):1−4. Preparation and structure characterization of tea polyphenols-high-amylose maize starch co-grinding mixtures[J]. Science and Technology of Food Industry, 2019, 40(7): 1−4, 10.
-
期刊类型引用(1)
1. 曾佳,林江涛,岳清华,李淑月,李心灵,郑雁. 超声协同微波法制备抗性糊精及其结构和体外消化特性. 食品研究与开发. 2024(12): 85-94 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:






 下载:
下载:



